Revisión de las Ideas Principales de la Unidad “materia y energía”
La química estudia la composición, estructura y el comportamiento de la materia.
Las observaciones macroscópicas
submicroscópica.
de
la
materia
reflejan
su
estructura
La cantidad de materia que contiene una muestra se puede medir al determinar
sus masa.
A las descripciones de la materia y su comportamiento se les llaman propiedades.
Las cuales pueden ser: Generales y Específicas. Las propiedades generales se
llaman así porque toda la materia lo posee, ejemplos: masa, peso, inercia,
volumen. Mientras que las propiedades específicas nos sirven para identificar una
materia de otra, por ejemplo: color, sabor, textura, tamaño, estado de agregación,
etc.
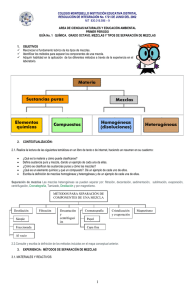
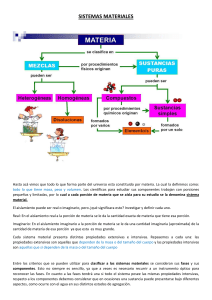
La composición de una muestra de materia determina si ésta es una sustancia o
una mezcla.
Las mezclas pueden ser homogéneas (soluciones) si se observan las mismas
propiedades en toda su extensión, es decir, se observa uniformidad y no se
distinguen sus componentes; ejemplos: aire, refresco, agua de mar, oro comercial,
plata comercial, concreto, aleación (mezcla de metales), medicamentos, etc. Las
mezclas heterogéneas son aquellas en las cuales se distinguen sus componentes.
Las mezclas se pueden separar por medio de cambios físicos que utilizan
propiedades físicas de las sustancias individuales de las mezclas.
Las sustancias se clasifican en elementos y compuestos. Los elementos son
sustancias puras que ya no pueden descomponerse en otras más simples o
sencillas por métodos químicos ordinarios. Los compuestos están formados por
las combinaciones o uniones de dos o más elementos químicos.
Los elementos son los bloques de construcción de toda la materia.
La composición de un compuesto está representada pos su fórmula química.
Propiedades y cambios de la materia
Cada sustancia tiene un conjunto de propiedades físicas y químicas particulares.
Los estados de agregación de la materia son sólido, líquido y gaseoso. El estado
de una sustancia, a temperatura ambiente, es una propiedad física.
Las temperaturas a las cuales cambia el estado de una sustancia son propiedades
físicas de la sustancia. Por ejemplo: La temperatura de fusión es aquella en la cual
un sólido pasa al estado líquido. La temperatura de condensación o licuefacción
es aquella temperatura en la cual un gas pasa al estado líquido.
La densidad de una muestra de materia es la cantidad de materia (masa en
gramos) por unidad de volumen, normalmente medida en mililitros (ml). Por
ejemplos: la densidad del agua es 1.0gr/ml, el aluminio de 2.70 gr/ml, el plomo es
de 11.34 gr/ml y la del oro es de 19.31 gr/ml, es decir de todas estas cuatro
sustancias el oro es el más pesado.
Las propiedades químicas de una sustancia describen los cambios químicos que
experimenta las mismas, en donde se altera la naturaleza interna de las
sustancias, es decir, se transforman en nuevas sustancias.
Los cambios químicos implican que los átomos de las sustancias se reacomodan
para formar otras sustancias.
Una reacción química es otro nombre que se le da a un cambio químico.
En una reacción química, los átomos nunca se crean o se destruyen.
TRABAJO DE INVESTIGACIÓN PARA ENTREGAR
Comprensión de conceptos.
1. Menciona dos diferencias entre una mezcla y una sustancia pura.
2. ¿Por qué un compuesto es distinto de una mezcla?
Razonamiento crítico.
3. El elemento oxígeno es un gas que constituye cerca del 20% de la
atmósfera de la tierra. También es el elemento más abundante de la
corteza terrestre, y sin embargo, ésta no es un gas. Explica esta aparente
contradicción.
4. Aplicaciones de la química. Materiales de todos los días. La materia se
puede subdividir en elementos, compuestos y mezclas homogéneas y
heterogéneas. Describe un material que se halle en la alacena de tu casa
que corresponda a cada una de estas categorías.
Comprensión de conceptos:
5. Para cada uno de los siguientes incisos, señala cuál es una propiedad física
y cuál es una propiedad química de la sustancia.
a. El oro se puede laminar con gran facilidad.
b. El sulfato de cobre se disuelve en el agua.
c. El magnesio arde en el aire.
d. El bióxido de manganeso es un polvo gris.
e. El flúor es un elemento muy reactivo-
6. Diferencia entre cada uno de los cambios entre químicos y físicos:
a. Un cerillo se enciende cuando se raspa.
b. El aire se presiona con una bomba para forzarlo a entrar a la llanta de un
auto.
c. Cuando el polvo de hornear se humedece, burbujea y libera CO 2.
d. Un tazón de agua hierve en la estufa.
e. La formación del arco iris.
f. Una fruta se fermenta y produce alcohol.
g. Una termita que come madera y produce gas metano.
h. El vinagre y el aceite no se mezclan.
i. La densidad del agua se incrementa cuando se le añade sal.
Razonamiento crítico:
7. Aplica los conceptos. Un amigo te cuenta que un diario desapareció al
quemarse en un incendio. Utiliza la ley de la conservación de la masa para
escribirle a tu amigo y explicarle lo que en realidad le sucedió al periódico.
Aplicaciones de la química
8. Fogatas. En las noches heladas, una fogata calienta el cuerpo y el espíritu.
¿la combustión de los leños es una reacción endotérmica o exotérmica?
Comprensión de conceptos
9. Escribe los símbolos de los siguientes elementos: hierro, sodio, antimonio y
tungsteno. Explica por qué estos símbolos no corresponden a los nombres
de los elementos en español.
10. ¿Dos objetos con el mismo volumen podrían tener distintas masas? ¿Cuál
de los dos tendría más materia?
11. ¿Qué significa materia pura?
12. ¿Qué papel juega la energía en la química?
13. Haz una distinción entre reacción endotérmica y reacción exotérmica y da
un ejemplo de cada una.
14. ¿Qué significa densidad? ¿Habría alguna manera de que una bolsa de
pelotas de esponja de estireno (el que se usa como aislante para techos y
paredes) fuera más pesada que una bolsa de piedras?
15. El oro se congela a 1064°C. ¿Cuál es el punto de fusión del oro?
Aplicación de conceptos
16. El proceso completo de digestión de la comida en tu cuerpo, ¿es un
proceso endotérmico o exotérmico? Explica tu respuesta.
17. Un cubo de hielo flota en tu vaso de agua, igual que un iceberg flota en el
océano. ¿Qué conclusión puedes sacar acerca de la densidad del agua
líquida y la del agua sólida?
18. Un medicamento con un nombre comercial muy conocido también lo puede
fabricar otra compañía y venderlo a precio más bajo. En ambos
medicamentos se especifica que tiene la misma fórmula química y los dos
son aprobados por la secretaría de salud. ¿Será mejor usar el medicamento
de la marca conocida? Explica tu respuesta.
19. Una perilla de una puerta está recubierta con una aleación de latón. ¿Qué
es una aleación? Cita tres ejemplos de ellas y de qué están compuestos.
20. Cuando mezclas vinagre y bicarbonato de sodio, la mezcla hace espuma y
burbujea. Suponiendo que pesas el vinagre y el bicarbonato antes de
mezclar y después de que han reaccionado, ¿cómo se comparan las
masas? Explica tu respuesta.
21. Cuando se advierte que el jugo de naranja está puro, ¿quiere decir que el
jugo es una sustancia pura? Explica tu respuesta.