Guia preparatoria Prueba Departamental 1 Semestre II
Anuncio

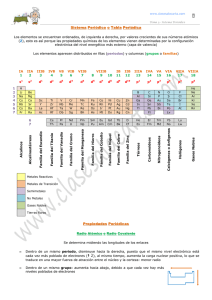
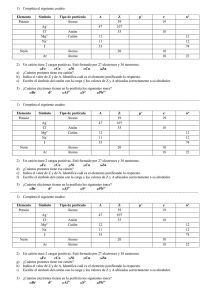
Centro educacional Santa Rosa Departamento de ciencias Profesora Roxana Espinosa B. Guía departamental de química 2º Instrucciones: Lee esta guía y respóndela en grupos (máx. 4 personas). Puedes imprimirla o copiarla. Una vez terminada, entrega la resolución de esta a tu profesor. I.- Propiedades periódicas. La periodicidad implica la repetición de una tendencia entre periodos o elementos de un grupo. De este modo una propiedad puede disminuir o crecer a lo largo de estos. Las propiedades que se presentan a continuación son propiedades microscópicas de los distintos elementos químicos. 1.- Radio atómico: Es la distancia entre el núcleo del átomo y el o los electrones mas externos (de valencia. Esta propiedad disminuye de izquierda a derecha en periodos y aumenta de arriba a bajo en grupos. 2.-Energía o potencial de ionizaron (PI): Es la energía necesaria para sacar un electrón de un átomo gaseoso en estado fundamental, de manera que dicho átomo se transforme en un catión. Esta propiedad aumenta de izquierda a derecha en periodos y disminuye de arriba a bajo en grupos. A (g) → A + + e 3.- Electroafinidad (EA): Es la energía necesaria para que un átomo gaseoso capte un electrón y así se transforme en un anión. Esta propiedad disminuye de izquierda a derecha en periodos y disminuye de arriba a bajo en grupos. A + (g) + e → A 4.- Electronegatividad (EN): Nos informa sobre la tendencia que tienen los distintos átomos de captar o atraer electrones: Un elemento altamente electronegativo posee muy baja electroafinidad y viceversa. Esta tendencia aumenta de izquierda a derecha en periodos y disminuye de arriba a bajo en grupos. 5.- Estado de oxidación (EO): Es la carga eléctrica que adquiere un átomo cuando de transforma en Ion monoatómico. Cuando un átomo es neutro de dice que su estado de oxidación es cero. Ca → F- + Ca 2+ e → + F 2e Actividades I.-Utilizando una tabla periódica contesta las siguientes preguntas: a) Al comparar los elementos Mg y Br, ¿cual de ellos se puede transformar en catión (+)? Por que? b) Entre los elementos Na y Po, ¿cual tiene mayor radio atómico? c) El F es el elemento más electronegativo. ¿Que significa eso? ¿Como es su electroafinidad? II.- Estructura de Lewis Completa el siguiente cuadro con la información que falta. ELEMENTO Cd Z= 48 Ac Z= 89 As Z=33 Au Z= 79 Sr Z= 38 I Z= 53 Ga Z= 31 Mo Z= 42 Ta Z=81 Ar Z= 18 Se Z= 34 Ho Z= 67 He Z= 2 ULTIMO NIVEL ENERGIA ELECTRONES DE VALENCIA ESTRUCTURA DE LEWIS III.- Enlace químico y regla del octeto. Realiza la estructura de Lewis que explica el enlace para la formación de las siguientes moléculas, según su reacción: a) Na + + b) N + F- N c) Ca 2+ + d) I + 2F _ I enlace iónico Na F N N Ca F 2 I I enlace covalente puro enlace iónico enlace covalente puro