Quimica II - TP 1 2005
Anuncio

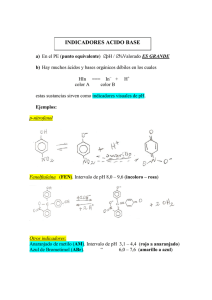
Presentación Trabajo Práctico N° 1 ............……….. Contenido TITULACIÓN ÁCIDO - BASE ......….………… CALIFICACIÓN …..............…… Universidad AUSTRAL Facultad de Ingeniería Materia: QUÍMICA II Grupo N° … Integrantes: ... Fechas Realización Entrega Devolución Entrega Devolución Aprobación Química II - T P N° 1 Titulación Ácido-base OBJETIVOS: ……………………………….. ……………………………….. ……………………………….. 1era Parte 1) Materiales necesarios Probeta 10,0 ml Bureta 25 ml Erlenmeyer 125 ml Pipeta 5 ml Vaso de precipitados Electrodo para medición de pH Agitador magnético Computadora 2) Sustancias necesarias Solución HCl 0,1N Solución NaOH 0,1N Solución NaOH preparada en Química I Vinagre blanco Solución alcohólica de fenoftaleína al 1% Muestra incógnita Papel indicador de pH 3) Esquema del equipo empleado 2/7 Química II - T P N° 1 Titulación Ácido-base 4) Procedimiento 4 - A - Valoración de base fuerte con ácido fuerte En un erlenmeyer de 125 ml, coloca 10 ml de solución de NaOH preparada en Química I (indicar autores). Agrega aproximadamente 50 ml de agua destilada y 2 ó 3 gotas de fenolftaleína. En la bureta cargada con HCl 0.1 N, lee el volumen inicial. Agrega gota a gota HCl sobre NaOH, agitando hasta casi la desaparición del color (apenas rosado). Lee el volumen final. Consigna los resultados en el cuadro del informe. Efectúa los cálculos y completa el cuadro. 4 - B - Valoración del contenido de ácido acético del vinagre. En un erlenmeyer de 125 ml, coloca 2 ml de vinagre. Agrega 50 ml de agua destilada y 2 ó 3 gotas de fenolftaleína. Lee el volumen inicial de la bureta cargada con la solución de NaOH 0,1N. Añade gota a gota en agitación, hasta que la solución tome color rosado persistente. Mide el volumen de la solución de NaOH gastado, por diferencia de volúmenes. Consigna los resultados en el cuadro y efectúa los cálculos. 4 - C - Valoración de una muestra incógnita Toma el pH de la muestra. De acuerdo con valor obtenido, elige la solución patrón adecuada para titular. Agrega 2 ó 3 gotas de fenolftaleína. Titula por duplicado, siguiendo el procedimiento antes descripto. 4 - D - Valoración de una muestra con electrodo para medición de pH (demostrativa) En un vaso de precipitados de 125 ml, se coloca un volumen conocido de solución a titular. Se agregan aproximadamente 50 ml de agua destilada y 2 ó 3 gotas de fenolftaleína. De acuerdo con la muestra elegida, se selecciona la solución patron a utilizar en la titulación. Se arma el dispositivo con el sensor, la interfase y la computadora, seleccionando el software adecuado. Se realiza la calibración del sensor. Se coloca el erlenmeyer con la solución a titular sobre el agitador magnético y se agrega el agitador metálico. 3/7 Química II - T P N° 1 Titulación Ácido-base Se gradúa la velocidad de agitación para generar el movimiento adecuado de la solución. Se introduce el sensor en la solución, cuidando de que no lo golpee el agitador, y se procede a realizar la medición del pH mientras se gotea el volumen adecuado de solución patrón de forma de obtener datos para graficar la curva de titulación en un entorno amplio y simétrico del punto de equivalencia. Registrar el valor de pH para el cual ocurre el viraje del indicador. 4/7 Química II - T P N° 1 Titulación Ácido-base 2da Parte Informe 1 - Valoración de NaOH 1era determinación 2da determinación Volumen de muestra de NaOH HCl: enrase inicial HCl: enrase final Volumen de HCl 0,1 N gastado pH punto final Cálculos: N de la solución de NaOH M de la solución de NaOH %P/V de la solución de NaOH Evalúa la etiqueta elaborada en Química I (incorporála al presente informe) . ¿Estás de acuerdo con los pictogramas y frases utilizadas? Justifica. 2 - Valoración del ácido acético del vinagre 1era determinación 2da determinación Volumen de muestra de vinagre NaOH: enrase inicial NaOH: enrase final Volumen de NaOH 0,1 N gastado pH punto final Cálculos: N de la solución de CH3COOH M de la solución de CH3COOH %P/V de la solución de CH3COOH 5/7 Química II - T P N° 1 Titulación Ácido-base 3 - Valoración de la muestra incógnita N° ..... 1era determinación 2da determinación pH inicial de la solución incógnita Volumen de solución a titular Volumen inicial de solución patrón Volumen final de solución patrón Volumen gastado de solución patrón pH punto final Cálculo: N de la solución incógnita 4 - Valoración de una solución con un electrodo de pH Incorporar la tabla de valores (pH en función del tiempo) y construir el gráfico correspondiente. Identificar el punto final y el de equivalencia. Completar la tabla siguiente en función de la información obtenida de la tabla de valores y del gráfico: 1era determinación pH inicial de la solución Volumen de solución a titular Volumen inicial de solución patrón Volumen final de solución patrón Volumen gastado de solución patrón pH punto final pH punto de equivalencia Cálculo: N de la solución titulada 5- Observaciones ...................................................................................................................................….. 6- Conclusiones ...................................................................................................................................….. ...................................................................................................................................….. 6/7 Química II - T P N° 1 Titulación Ácido-base 3era Parte Cuestionario 1- ¿Qué características debe tener una droga patrón? 2- ¿Qué es un indicador? ¿Cuál es el rango de viraje de la fenoftaleína y cómo son sus cambios de color? 3- ¿Qué es titular una solución? ¿Qué clases de titulación conoces? 4- ¿Qué se entiendo por curva de valoración? 5- ¿Qué diferencia hay entre punto final y punto de equivalencia? Bibliografía consultada: 1- Vergelón – Piccardo. Química 1 - Trabajos Prácticos. 1980. 2- ... 3- ... 7/7