Titulación Potenciométrica - Universidad de Puerto Rico Humacao
Anuncio

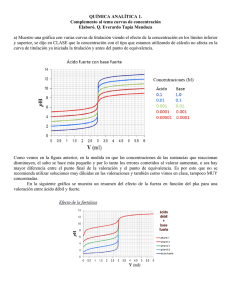
Rolando Oyola Martínez, Ph. D. Universidad de Puerto Rico-Humacao Departamento de Química Call Box 860 Humacao, PR 00792-4300 [email protected] Derechos Reservados@ene-mayo 2014-15 Titulación Potenciométrica Introducción El método de titulación potenciométrica consiste en medir el potencial (voltaje) en una solución por medio de un electrodo como función de volumen de agente titulante. El potencial que se mide se puede transformar a unidades de concentración de una especie en solución. La ventaja de medir potencial es que éste se mide por medio de un electrodo que es selectivo a la especie o analito que se quiere determinar. Por lo tanto, el voltaje que se mide en la solución es representativo de la concentración de la especie en solución. Este alto grado de selectividad (señal analítica que puede mostrar un pequeño grupo de analitos en una solución que contiene múltiples especies químicas) se debe a la propiedad física del electrodo con que se mide el voltaje. En este experimento el voltaje es selectivo a la concentración del ión hidronio en solución. Existen electrodos selectivos a otros iones tales como cloruro, el ión ferroso, etc. Otra ventaja del uso de potenciometría es que la determinación del punto final es mucho más precisa que el determinado con indicadores visuales. Este último dato se podrá comprobar en este experimento. La reacción de titulación en este experimento es una de neutralización. Sin embargo, el número de puntos de equivalencia que puede observar en la curva de titulación potenciométrica depende de los analitos presentes en la solución de su desconocido. En este experimento se le brindará una solución de desconocido que consistirá de una de las siguientes posibles alternativas: HCl+H3PO4, H3PO4+NaH2PO4, H3PO4 o NaH2PO4. En el caso de las posibles mezclas binarias en este experimento existen dos que son incompatibles para efectos cuantitativos: HCl+NaH2PO4 y H3PO4 + HPO4-. Observe que para la primera mezcla al HCl ser un ácido fuerte el H+ liberado puede reaccionar con H2PO4-. Esto quiere decir que una mezcla de HCl + H2PO4- en equilibrio puede consistir de las siguientes especies: HCl + H3PO4, H3PO4 + H2PO4- o H3PO4. Estas combinaciones de especies en equilibrio dependen de las cantidades iniciales del HCl y H2PO4- al momento de preparar la solución, es decir dependen del reactivo limitante. Por consiguiente, como no se conoce la preparación de las soluciones del desconocido, para efectos cuantitativos no es posible determinar la concentración de las especies iniciales. De igual forma, la segunda mezcla incompatible, H3PO4 + HPO42- resulta en las siguientes posibles combinaciones dependiendo del reactivo limitante entre las especies iniciales: H2PO4-, H3PO4+H2PO4-, H2PO4- + HPO42-. En este experimento se analizará una solución desconocida de una solución compatible, para efectos cuantitativos, mediante una titulación con hidróxido de sodio y medidas de potencial usando un electrodo de vidrio sensitivo a la concentración de hidronio en solución. El análisis cualitativo se llevará a cabo mediante uso de indicadores mientras que el análisis cuantitativo será por medio de gráficas de la segunda derivada de lecturas de pH como función de volumen de NaOH. Objetivo Llevar a cabo análisis cualitativo y cuantitativo de una composición en una solución desconocida que puede contener una de las siguientes posibles alternativas; a) HCl+H3PO4, b) H3PO4+NaH2PO4 y c) H3PO4 por medio de una titulación potenciométrica. Método Titulación potenciométrica consiste en medir potencial por medio de un electrodo selectivo a cierto analito en solución. En este experimento el electrodo será un electrodo de vidrio sensitivo a la concentración de hidronio en solución. Reactivos y su preparación: 1) Solución de NaOH (Aproximadamente 0.1 M) = Posiblemente la solución ya se encuentra preparada en el extractor o de experimento anterior. De no estar presente, proceda a preparar la solución de NaOH mediante dilución y agua libre de CO2 (g). 2) Estándar primario de hidrógeno talato de potasio (KHP, PM 204.226) = secar el sólido en el horno por una hora a 110 ̊C de acuerdo al procedimiento de secada. 3) Solución del desconocido = una semana antes del experimento usted le debe entregar al encargado del laboratorio un vaso de 150 mL limpio y seco. El vaso debe estar claramente identificado con su nombre y sección de laboratorio. El día del experimento se le devolverá el vaso con cierto volumen del desconocido. Transfiera cuantitativamente la solución a un matraz volumétrico de 250.0 mL y complete hasta la marca con agua deionizada. Recuerde homogenizar la solución. 4) Indicadores indicador anaranjado de metilo y fenolftaleína = se encuentran preparadas en el extractor. Procedimiento 1) Valoración de NaOH 0.1 M a) Pese por diferencia tres réplicas de KHP cuyo peso requiera aproximadamente entre 25 y 30 mL de NaOH 0.10 M. Transfiera cada réplica a su respectivo vaso cónico de 150 mL. Asegúrese de LA UNIVERSIDAD DE PUERTO RICO EN HUMACAO NO DISCRIMINA POR EDAD, SEXO, ORIENTACIÓN SEXUAL, RAZA, COLOR, NACIONALIDAD, ORIGEN O CONDICIÓN SOCIAL, NI POR IDEAS POLÍTICAS, RELIGIOSAS E IMPEDIMENTOS FÍSICOS O POR CONDICIÓN DE VETERANOS ■ PATRONO CON IGUALDAD DE OPORTUNIDADES DE EMPLEO 2 Titulación Potenciométrica que el vaso tenga una rotulación adecuada. Disuelva cada réplica con 50 mL de agua deionizada y añada de 2 a 3 gotas de fenoftaleína. Titule cada réplica con NaOH ≈ 0.10 M. Recuerde que debe identificar cada vaso con el peso de muestra correspondiente. Asegúrese de obtener un color rosado tenue en el punto final. 2) Titulación de la muestra desconocida con lecturas de metro de pH a) Transfiera una alícuota de 25.00 mL de la solución del desconocido a un vaso de 250 mL. b) Antes de proceder con la titulación asegúrese de que la bureta se encuentre llena y que la lectura sea de 0.00 mL de NaOH 0.10 M y que el metro de pH este calibrado con el amortiguador de 4.00 y de 7.00 o 9.00. El instructor le dirá el procedimiento de calibración. c) Enjuague el electrodo con agua deionizada y seque con papel fino (Kimwipe) la parte inferior externa del electrodo. Coloque el electrodo dentro de la solución del desconocido asegurándose de que no toque el fondo del vaso. d) Coloque suavemente el agitador magnético dentro del vaso con la muestra asegurándose de que el mismo no choque con el electrodo al estar en movimiento. e) Añada 3 gotas de anaranjado de metilo y 3 gotas de fenolftaleína a la muestra del desconocido. f) Proceda a titular la muestra añadiendo 0.50 mL de NaOH y anote la lectura del metro de pH. Repita la adición de 0.50 mL y lectura de pH hasta aproximadamente un volumen de 3.00 mL. Desde este momento en adelante debe añadir 0.10 mL y tomar lectura de pH hasta que la lectura de pH sea mayor de 10.00. Luego puede hacer adiciones de 0.50 mL y tomar lectura de pH hasta que repita lecturas de pH mayores de 11.00 y que se defina la curva correctamente. Recuerde anotar el volumen del cambio color rosa/amarillo y el de amarillo/rosa correspondientes al primer y segundo puntos finales, respectivamente, en la Tabla 2. Datos Experimentales Tabla 1: Valoración de NaOH Peso KHP (g) Inicial Volumen NaOH (mL) Final Añadido 1 2 3 Tabla 2: Titulación muestra desconocida con indicadores 1er Punto Equivalencia 2do Punto Equivalencia Volumen NaOH (mL) Inicial Final ∆V 0.00 Tabla 3: Titulación muestra desconocida metro pH 1 2 3 Volumen NaOH (mL) Lectura 0.00 0.50 Etc… pH Cálculos 1) Determinación de concentración de NaOH (Datos experimentales en Tabla 1) a) Determine la concentración de NaOH para cada réplica de KHP con los datos de Tabla 1. b) Determine los parámetros estadísticos para la concentración de NaOH. 2) Identificación de los analitos en la muestra original. a) Pasos para construir curvas de titulación, primera y segunda derivada (Datos experimentales en Tabla 3). Prepare una hoja de cálculo (Excel, Quatro Pro, Sigma Plot, Graph Pad, Origin, Kaleida Graph, etc) con los datos de volumen de NaOH y lecturas de pH. Construya las gráficas para determinar los valores de ΔV en los puntos finales en base a la hoja de información que se le provee y/o la discusión en el laboratorio. b) Identifique la composición de su desconocido mediante el análisis de ΔV1 y ΔV2 de los puntos de finales de la Tabla 2 y/o los identificados mediante las gráficas de segunda derivada. c) Calcule los milimoles, con su incertidumbre absoluta, presentes en la alícuota de 25.00 mL de muestra de cada uno de los analitos presentes. d) Calcule la molaridad y su incertidumbre absoluta de cada analito en la muestra original. 3) Gráficas que tiene que entregar con el informe: a) pH como función de volumen de NaOH. (No imprima los datos de la hoja de cálculos) b) curva de la primera derivada del primer punto de equivalencia c) curva de la primera derivada del segundo punto de equivalencia d) curva de la segunda derivada del primer punto de equivalencia e) curva de la segunda derivada para el segundo punto de equivalencia Cálculos de milimoles o moles en el desconocido 1) Recuerde que en el experimento los posibles desconocidos pueden ser uno de los casos 1 a 3 que se presentan a continuación. 2) Los milimoles que calcula en estas instrucciones se refieren a los presentes en la alícuota de su desconocido que tituló. Para calcular los milimoles de cada analito en la muestra original tiene multiplicar los milimoles o moles en la alícuota por el factor alícuota (Vmatraz/Valícuota). 3) Observe que los valores de MNaOH y ∆V1 y ∆V2 son sus valores experimentales obtenidos mediante valoración y segunda derivada, respectivamente. 4) Observe que los cálculos se refieren a milimoles ya que se asume que la unidad de volumen es mL, pero si LA UNIVERSIDAD DE PUERTO RICO EN HUMACAO NO DISCRIMINA POR EDAD, SEXO, ORIENTACIÓN SEXUAL, RAZA, COLOR, NACIONALIDAD, ORIGEN O CONDICIÓN SOCIAL, NI POR IDEAS POLÍTICAS, RELIGIOSAS E IMPEDIMENTOS FÍSICOS O POR CONDICIÓN DE VETERANOS ■ PATRONO CON IGUALDAD DE OPORTUNIDADES DE EMPLEO 3 Titulación Potenciométrica H 3 PO4 M NaOH ∆V2 = Ymmoles la unidad de volumen es litros entonces se calculan moles. Caso 1: Mezcla de HCl y H3PO4 En este caso se presentan dos puntos de equivalencias donde ∆V1 > ∆V2 por lo tanto se puede concluir que en el primer punto de equivalencia se titula el HCl y el H3PO4 produciendo H2PO4- y Cl-. Se puede establecer un balance de masa de acuerdo a la ecuación (1). H 3 PO4 HCl (1) M NaOH ∆= V1 X mmoles + Ymmoles El volumen consumido luego del primer punto de equivalencia contiene los milimoles de NaOH para neutralizar el H2PO4- produciendo HPO42-. Observe que los milimoles de H2PO4- son iguales a los de H3PO4 presentes en la alícuota que tituló. Por lo tanto se puede establecer la ecuación (2): H 3 PO4 M NaOH ∆V2 = Ymmoles (2) Note que al sustituir la ecuación (2) en la ecuación (1) se puede obtener los milimoles de HCl en la alícuota. Note que puede calcular dos valores de milimoles de H3PO4 en la alícuota. En este caso puede hacer informe con el valor promedio de los milimoles de H3PO4 calculados. Conclusiones Presente los resultados obtenidos junto con sus incertidumbres absolutas o relativas en base al objetivo del experimento. Identifique posibles fuentes de error y discuta como el error afecta el valor reportado en sus resultados. Identifique en qué dirección, mayor o menor relativo al valor esperado, el error descrito afecta sus resultados. Instrucciones programa Logger Lite (Vernier) para lecturas de pH con la computadora. Caso 2: Mezcla de H3PO4 y H2PO4En este caso se presentan dos puntos de equivalencias donde ∆V1 < ∆V2 por lo tanto se puede concluir que en el primer punto de equivalencia se titula el H3PO4 produciendo H2PO4-. Se puede establecer la ecuación (3); H 3 PO4 (3) M NaOH ∆V1 = Ymmoles El volumen consumido luego del primer punto de equivalencia contiene los milimoles de NaOH para neutralizar el H2PO4- produciendo HPO42-. Observe que los milimoles totales de H2PO4- son iguales a los de H3PO4 presentes en la alícuota que tituló en el primer punto de equivalencia más los milimoles de H2PO4- originales en la alícuota. Por lo tanto se puede establecer la ecuación (4). − H 3 PO4 H 2 PO4 M NaOH ∆V= Ymmoles + Z mmoles 2 (6) (4) H2PO4- donde Zmmoles son los milimoles originales de H2PO4en la alícuota. Note que al sustituir la ecuación (3) en la ecuación (4) se puede obtener los milimoles de H2PO4originales en la alícuota. Caso 3: H3PO4 En este caso se presentan dos puntos de equivalencias donde ∆V1 = ∆V2 por lo tanto se puede concluir que en el primer punto de equivalencia se titula el H3PO4 produciendo H2PO4-. Se puede establecer un balance de masa de acuerdo a la ecuación (3); H 3 PO4 (5) M NaOH ∆V1 = Ymmoles El volumen consumido luego del primer punto de equivalencia contiene los milimoles de NaOH para neutralizar el H2PO4- produciendo HPO42-. Observe que los milimoles de H2PO4- son iguales a los de H3PO4 presentes en la alícuota que tituló en el primer punto de equivalencia. Por lo tanto se puede establecer la ecuación (4). LA UNIVERSIDAD DE PUERTO RICO EN HUMACAO NO DISCRIMINA POR EDAD, SEXO, ORIENTACIÓN SEXUAL, RAZA, COLOR, NACIONALIDAD, ORIGEN O CONDICIÓN SOCIAL, NI POR IDEAS POLÍTICAS, RELIGIOSAS E IMPEDIMENTOS FÍSICOS O POR CONDICIÓN DE VETERANOS ■ PATRONO CON IGUALDAD DE OPORTUNIDADES DE EMPLEO