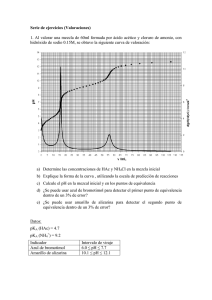
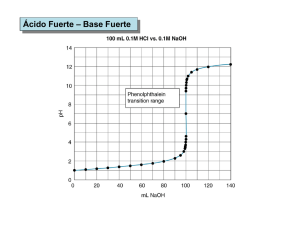
QUÍMICA ANALÍTICA 1. Complemento al tema curvas de
Anuncio

QUÍMICA ANALÍTICA 1. Complemento al tema curvas de concentración Elaboró. Q. Everardo Tapia Mendoza a) Muestro una gráfica con varias curvas de titulación viendo el efecto de la concentración en los límites inferior y superior, se dijo en CLASE que la concentración con el tipo que estamos utilizando de cálculo no afecta en la curva de titulación ya iniciada la titulación y antes del punto de equivalencia. Como vemos en la figura anterior, en la medida en que las concentraciones de las sustancias que reaccionan disminuyen, el salto se hace más pequeño y por lo tanto los errores cometidos al valorar aumentan, o sea hay mayor diferencia entre el punto final de la valoración y el punto de equivalencia. Es por esto que no se recomienda utilizar soluciones muy diluidas en las valoraciones y también como vimos en clase, tampoco MUY concentradas. En la siguiente gráfica se muestra un resumen del efecto de la fuerza en función del pka para una valoración entre ácido débil y fuerte. Se mencionó en clase que valoración de ácido débil con base débil, no se realiza. A continuación se presenta el gráfico de las posibles curvas de calibración. Como se puede apreciar, el salto de pH en los alrededores del punto de equivalencia se hace menor en la medida en que disminuyen la fortaleza del ácido y/o de la base. Esto hace que al detectar este punto se cometan errores relativamente grandes (ver sección de selección de indicadores). Por ese motivo en las valoraciones ácido base se evita esta situación y se diseñan de manera que al menos el ácido o la base sean fuertes. SELECCIÓN DE INDICADOR PARA DETERMINACIÓN DEL PUNTO FINAL DE UNA VALORACIÓN. Se revisó en clase los criterios para la selección de un indicador en una titulación. Se dijo que era un indicador cuyo vire estuviera lo más próximo al punto de equivalencia y que el error de indicador sea máximo 1.0 %. (AQUÍ TUVE UN ERROR, EN CLASE LES DIJE 0.1 %, pero es 1 %, si queremos 99% de cuantitatividad) Para que quede aún más claro, se muestra un cálculo más de error por selección de indicador. OJO AQUÍ MUESTRA OTRA MANERA DE HACERLO, al que vimos en clase, creo yo que es más sencillo. De cualquier forma el modo que decidan hacerlo se obtiene resultados muy similares. EJEMPLO Se desea valorar 50 mL de HCl 0.01 M con NaOH 1 M. Usando como indicador fenolftaleína (8.09.6) NOTA: El valor de vire de cada indicador puede variar dependiendo de la referencia. Calcular el % de error por selección de indicador. La expresión que determina el error por indicador es: 𝐸 = 𝑉!"#$% − 𝑉!" 𝑥 100 𝑉!" Entonces lo primero que debemos conocer es el volumen en la equivalencia, esto se realiza con la estequiometría. 50 𝑚𝐿 𝐻 𝑥 0.01 𝑚𝑜𝑙 𝐻 1 𝑚𝑜𝑙 𝑂𝐻 1000 𝑚𝐿 𝑥 𝑥 = 0.5 𝑚𝐿 𝑑𝑒 𝑏𝑎𝑠𝑒 1000 𝑚𝐿 𝐻 1 𝑚𝑜𝑙 𝐻 1 𝑚𝑜𝑙 Como sabemos la fenolftaleína presenta dos tonos de color el incoloro y el rosa, el rosa es a pH básico, el cambio de color incoloro a rosa es arriba de pH= 9.6, lo que indica el intervalo es que entre 8.0 y 9.6, se da una combinación de colores, NO perceptibles para el ojo humano. Esto indica que cuando yo determino por el cambio brusco de color el pH, esto implica que la reacción se detuvo a pH = 9.6. Es decir a pH, se tiene [H+] = 10-9.6 M y [-OH] = 10-4.4 M, es decir se tiene ese valor de [OH-] en exceso. Lo que sigue es obtener en que volumen de NaOH 0.1 M se tiene esa concentración, el problema se trata de DILUCIÓN. C1V1 = C2V2 V1= (10-4.4 M)(50.0 mL)/1 = 1.9905 x 10-3 mL Esto se debe sumar al volumen en la equivalencia, y se suma, x que el error es por exceso, ya que el pH final es mayor al pH de la equivalencia. 𝐸 = 0.5019 − 0.5 𝑥 100 = 0.38 % 0.5 Es un error aceptable, por tanto se puede usar el indicador. HASTA EL MOMENTO HEMOS ESTUDIADO EL ERROR DE INDICADOR EN TITULACIONES ÁCIDO-BASE DE FUERTES, LA PRÓXIMA SESIÓN ESTUDIAREMOS COMO CALCULAR EL ERROR DE INDICADOR EN ÁCIDOS Y BASES DÉBILES.