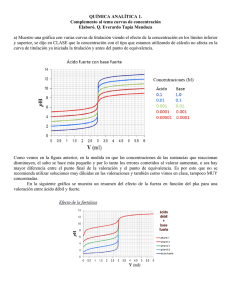
DETERMINACIÓN DE LA CONSTANTE DE ACIDEZ DEL ÁCIDO ACÉTICO GLACIAL Objetivo: Determinar la constante de acidez K de acido acético (CH 3COOH) por valoración con hidróxido de sodio NaOH y con medidas potenciométricas de pH. Planteamiento del problema: ¿Cómo determinar la constante de acidez Ka del ácido acético glacial CH3COOH utilizando la titulación acido-base con indicadores respaldada por el método de titulación potenciométrica? Hipótesis: Se calculará la ka del ácido acético glacial por métodos de titulación volumétrica y potenciométrica ácido-base y potenciométrica para obtener la concentración del ácido acético y así se obtener un valor aproximado a 1.8x10-5. Variables: independiente [H+], dependiente: constante de acidez (ka) MARCO TEÓRICO: Equilibrio químico: El equilibrio químico en una condición en la cual las< velocidades de reacción directa e inversa son iguales, y las concentraciones de ractivos y productos no varian a una temperatura constante. El equilibrio químico se logra sea que inicie con los reactivos a los productos. Tal hecho puede demostrarse empleando trazadores isotópicos. Teoría ácido-base de Arrhenius: La primer definición de ácidos y bases fue dada por el químico sueco Svante Arrhenius alrededor de 1884 enunciando que: “Las sustancias ácidas son aquellas que en solución acuosa se disocian en iones hidrógeno, mientras que las sustancias básicas son aquellas que en solución acuosa se disocia en iones hidroxilo”, esta teoría está basada en su teoría de ionización de las sustancias en soluciones acuosas. Las sustancias que se disociaban total o parcialmente como iones se consideran electrolitos. Aquellas que se disociaban totalmente electrolitos fuertes, las que no, se consideraban como electrolitos débiles. 1 Teoría ácido-base Brönsted - Lowry: La teoría fue propuesta en 1923 y dice que un ácido es aquella sustancia que puede donar o ceder protones H + mientras que una base es aquella sustancia que puede aceptar o ganar protones H +. Puede ser una molécula o un ion y aplica para cualquier tipo de disolvente, las bases pueden presentar o no el ion OH-, la presencia del agua es relevante y se determina por medio de una reacción ácido-base de transferencia: ÁCIDO + BASE ÁCIDO CONJUGADO + BASE CONJUGADA Teoría ácido-base Lewis: Para Lewis un ácido es la especie química capaz de aceptar como mínimo un un par de electrones, formando un enlace, mientras que una base es la especie química capaz de donar o compartir como mínimo un par de electrones; puede dar el par completo. pH: Es una medida utilizada por la química para evaluar la acidez o alcalinidad de una sustancia por lo general en estado liquido (también puede utilizar para gases). Se entiende por acidez la capacidad de una sustancia para aportar a una disolución acuosa iones de hidrogeno, hidrogeniones (H+) al medio). La alcalinidad o base aporta hidroxilo (OH)- al medio. Por lo tanto el pH mide la concentración de iones de hidrogeno de una sustancia, a pesar de que muchas definiciones al respecto. Se mide de una escala que va del 0 al 14. Si pH>7, la sustancia es básica o alcalina, si pH<7 la sustancia es ácida, si pH=7 la sustancia es neutra. Cálculos de pH: El cálculo del pH da como resultado una cantidad a dimensional. Los ácidos y bases fuertes, se encuentran casi completamente ionizada en disolución acuosa así que pueden calcularse las concentraciones de los iones hidronio [H3O+] y [OH-], también el pH directamente a partir de las concentraciones del ácido o de la base en cuestión. La medición del pH de las disoluciones se lleva a cabo mediante aparatos conocidos como potenciómetros o pHmetros que funcionan mediante electrodos que se introducen en la disolución a tratar, pudiendo leer rápidamente la escala de valor de pH. 2 pH= - log |H+|, el pH y el pOH mantienen una relación cuando son de la misma solución acuosa, siendo fácil deducir a través de la expresión del producto iónico del agua. Kw= (H3O+) (OH-)= 10 -14 Aplicando logaritmo: log (H3O+) (OH-)= 10 -14 log (H3O+) + log (OH-)= -14 log10 Multiplicando por -1 toda la igualdad -log (H3O+) – log (OH-)= 14 pH + pOH = 14 Cálculo de la constante de acidez (Ka): Para calcular la ka la reacción tiene que estar balanceada, equilibrada y los reactivos tienen que estar en estado natural. No participan los elementos en estado líquido ni sólido, en estado acuoso sí. Por ejemplo: HA H+ + A- Ka= [A-] [H+] [HA] Cálculo del porcentaje de ionización (%α): Se calcula dividiendo la concentración de la base conjugada entre la concentración de la sustancia antes de que se ionizara. %α= [Sustancia ionizada] ∕ [sustancia inicial] x 100 3 Clasificación de acuerdo al %α: Si ka/Co >102 10 0.5 10-1 10-2 <10-4 Α x 100% > 99.9% 91.5 50 27 10 1 Fuerza Ácido fuerte Ácido de fuerza media Ácido débil Dilución: Es la preparación de una disolución a partir de otra del mismo tipo de soluto con concentración conocida. Se calcula con la expresión: C1V1= C2V2. Titulación ácido fuerte-base fuerte: En disolución acuosa los ácidos y bases fuertes se encuentran totalmente disociados, por tanto el pH a lo largo de la titulación se puede calcular directamente de las cantidades estequiométricas de ácido y base que van reaccionando. En rl punto de equivalencia el pH está determinado por el grado de disociación del agua; a 25°C el pH del agua pura es de 7.00. Para la titulación de una base fuerte con un ácido fuerte el cambio de pH en el punto de equivalencia es muy amplio y abarca los rangos de pH del anaranjado de metilo, azul de bromo timol y fenolftaleína (véase tabla 1) Titulación ácido fuerte-base débil: La valoración de una base débil con un ácido fuerte difiere un poco de la valoración de un ácido débil con una base fuerte, salvo en que están invertidos los papeles del ácido y de la base, en el punto de equivalencia se tendría que analizar si es un ácido diprótico ya que tiene dos puntos de equivalencia, o tripróticos que tienen tres puntos de equivalencia, para utilizar el indicador adecuado. Titulación ácido débil-base fuerte: Cuando se neutraliza ácido acético [x] con hidróxido de sodio[x], la sal formada-acetato de sodio- , tiende a hidrolizarse impartiendo reacción alcalina a la solución. La valoración presenta algunas complicaciones. Se considera como ejemplo la valoración del ácido acético (CH3COOH) con hidróxido de sodio (NaOH). La adición de NaOH neutraliza parte del ácido acético; por lo tanto, en puntos de la curva de valoración antes del punto 4 de equivalencia, la solución contiene CH3COOH y NaCH3COOH en cantidades varias y el pH es prácticamente el de un amortiguador ácido acético - acetato de sódico. Pasado el punto de equivalencia, la solución contiene sólo acetato sódico y NaOH en exceso. Como el ion OH- es una base mucho más fuerte que el ion acetato, se puede suponer que el efecto del ion acetato sobre el pH es insignificante. Titulación ácido-base débil: En el caso de emplear ácido o bases débiles en la titulación, las sales formadas tienden a seguir reaccionando con el agua. La reacción ácido-base de la sal formada modifica el pH de la solución en el punto de neutralización: El pH resultará alcalino si se titula un ácido débil con una base fuerte (por ejemplo, titulación de ácido acético con NaOH). El pH resultará ácido si se titula una base débil con un ácido fuerte (por ejemplo, titulación de amoniaco con HCl). Este mismo efecto se observa cuando se disuelve una sal que contenga un anión proveniente de un ácido débil o un catión proveniente de una base débil, y se denomina hidrólisis de sales. Por esta circunstancia, no todos los indicadores ácido-base son útiles para este tipo de ensayos, y se deben seleccionar aquellos que tengan un intervalo de cambio de color cercano al punto de equivalencia de la titulación. Curvas de valoración: Es una gráfica de como varía una propiedad fisicoquímica de la solución o función en relación al volumen del agente valorante. Nos informa como varía la propiedad en el transcurso de la valoración y nos permite determinar con certeza el punto final de la valoración y otras cantidades o características de las mismas. % de error en la titulación: Existen por lo menos dos fuentes de error al determinar el punto final de una titulación utilizando indicadores visuales. Uno de ellos ocurre cuando el indicador que se utiliza no cambia de color en el pH adecuado. Este es un error determinado que se puede corregir por medio de la 5 determinación del indicador en blanco. Este último es sencillamente el volumen de ácido o de base que se necesita para cambiar el pH del punto de equivalencia al pH en el cual el indicador cambia de color. La determinación del indicador en blanco casi siempre se hace en forma experimental. Indicadores ácido-base: Existen muchos ácidos y bases orgánicos débiles que presentan diferentes colores cuando están sin disociar y cuando están en forma iónica. Estas moléculas se pueden utilizar para la determinar cuándo se ha adicionado la cantidad suficiente de titulante y se les denomina indicadores visuales. Es importante saber el pH del titulante y de la sustancia a valorar ya que así se podrá escoger el indicador adecuado. Tabla 1. Algunos indicadores ácido- base 1 Cambio de color al aumentar Indicador el pH Forma ácida Forma básica Intervalo de pH Forma ácida Forma básica 0.1 0.8 Amarillo de metilo 2.9 4.0 Azul de bromofenol 3.0 4.6 Anaranjado de metilo 3.1 4.4 Verde de bromocresol 3.8 5.4 Rojo de metilo 4.2 6.2 Tornasol 5.0 8.0 Púrpura de metilo 4.8 5.4 Azul de bromotimol 6.0 7.6 Rojo neutro 6.8 8.0 Rojo de fenol 6.8 8.4 8.0 9.6 Ácido pícrico Fenoftaleína incoloro incoloro 6 Punto de equivalencia: Punto en el que la cantidad de agente valorante y de sustancia valorada coinciden estequiométricamente. Punto final: Punto experimental en el que se detecta el punto de equivalencia, la disolución vira y la titulación se detiene. Potenciómetro: Es un equipo electrónico que contiene un electrodo de vidrio y lecturas de 0.1, unidades de pH. Para calibrar el equipo se realiza con soluciones amortiguadoras o Buffer de pH 7 o 10 y pH 4. Solución Buffer o amortiguadora: Las soluciones buffer o amortiguadoras son capaces de mantener su pH en valores aproximadamente constantes, aún cuando se agreguen pequeñas cantidades de ácido o base, o se diluya la solución. Una disolución buffer o amortiguadora se caracteriza por contener simultáneamente una especie débil y su par conjugado: un ácido débil y la sal de su par conjugado HA + H2O A– + H3O+ una base débil y la sal de su par conjugado B + H2O BH+ + OH– La disolución buffer debe contener una concentración relativamente grande de cada uno de los integrantes del par conjugado, de modo que: la especie ácida del sistema buffer pueda reaccionar con los iones OH– que se le añadan la especie básica del sistema buffer pueda reaccionar con la cantidad de iones H+ que se añadan MATERIAL 7 - Para verter/entregar - Bureta de 10 y 25 mL - Pipeta volumétrica de 2, 5 y 50 mL - Para contener - 5 vasos pp de 10mL - 1 matraz aforado de 100mL - 3 vasos pp de 30mL - 1 matraz aforado de 25 mL - 1 vaso pp de 100mL - Frascos de vidrio y de plástico General - Soporte Universal - Piseta - Vidrio de reloj - Agitador magnético - Pesafiltros - Etiquetas - Desecador - Perilla de seguridad - Espátula - Pinzas de doble presión - Instrumentos - Balanza analítica - Potenciómetro - Termómetro de inmersión parcial 0-200 °C - Equipo - Parrilla de agitación - Estufa - Campana PROCEDIMIENTO RESULTADOS Tabla 2. Estandarización del Hidróxido de Sodio con Ftalato ácido de Potasio # de muestra Volumen de NaOH (mL) Molaridad (mol/L) 1 1.9 0.1837 2 2 0.1745 8 3 1.7 0.2052 4 1.8 0.1938 5 2.3 0.1517 Molaridad promedio del Hidróxido de sodio: 0.1818 mol/L Tabla 3. Titulación del ácido acético glacial con el Hidróxido de Sodio # de muestra Volumen de NaOH (mL) Molaridad (mol/L) 1 2 3 4 5 Molaridad promedio del ácido acético: 0.1942 mol/L Tabla 4. Cambio del pH en la titulación potenciométrica de ácido acético e hidróxido de sodio. Volumen (mL) 0 0.5 1 1.5 2 2.5 3 3.5 4 4.5 4.6 4.7 pH 2.58 3.56 3.97 4.22 4.42 4.67 4.92 5.12 5.36 5.71 5.77 5.81 9 4.8 4.9 6.45 6.9 Gráfica 1. Gráfica de la curva de la titulación potenciométrica del CH3COOH con NaOH Curva de la titulación potenciométrica de CH3COOH y NaOH 8 7 6 5 pH 4 3 2 1 0 0 1 2 3 4 5 6 Volumen mL Tabla 5. Comparación de resultados teóricos vs experimentales 0.1745 2.73 Valores experimentales 0.1942 2.58 1.8x10-5 2.5322x10-5 Valores teóricos Molaridad (mol/L) pH Constante de acidez (Ka) Margen de error 11.29% 5.49% 40.68% CÁLCULOS PREVIOS CÁLCULOS CORREGIDOS DISCUSIÓN: Se puede apreciar que en este experimento los márgenes de error no son muy bajos, se lo podemos atribuir a que nos e hizo una correcta lectura en la bureta o quizás se preparó mal la disolución, en cuanto a la cuerva de titulación se debe al error instrumental ya que varios de los potenciómetros tardaban en estabilizarse o de plano no servían, en cuanto a la constante de acidez nos salió muy baja pero entra en el rango de x10-5 así que no se pudo descartar ningún dato 10 de la titulación/ estandarización. Fue complicado hacer la titulación potenciométrica ya que si no se sumergía bien el electrodo no era fácil leer el pH, la valoración ácido acético-hidróxido de sodio tiene un punto de equivalencia en un pH arriba de 8, la valoración que se realizó teóricamente tiene su punto de equivalencia en 4.9 mL pero queda incompleta la curva, eso se puede atribuir al error instrumental además, también pudo haber influido que el Hidróxido es una sustancia higroscópica y que mientras se pesaba, no sólo se estaba pesando la masa del hidróxido sino también lo que absorbía. CONCLUSIÓN: Experimentalmente se obtuvo una constante muy alejada de la teórica, se tiene que tener más cuidado al momento de titular con o sin indicador, tratando de eliminar mayoritariamente todos los errores que pueda haber, para que no vuelva a ocurrir que al momento de graficar el pH contra el V(mL) se obtenga una curva incompleta. BIBLIOGRAFÍA: Day Jr, et. al., Química Analítica Cuantitativa, trad. Arroyo Espinosa, María Cristina, 5ª ed., Prentice-Hall, México, 1989. pág. 182. 1 R.A. B. Fischer, Robert, G. Petters, Dennis, Compendio de análisis químicos cuantitativos, trd. María Teresa, Editorial Interameticana, México, 1971. R. O’Connor, Paul, Química: Experimentos y teorías, trad. Casabí Gispet Jaime, Reevrté, España. 1982. E. Brady, James, E. Humiston, Gerard, Química, Tomo IV, trad. Sangines Franchini, Ma. Cristina, Grupo Noriega Editores, México, 1993. pp.835. Gary D. Christian, Química Cuantitativa, trad. Aguilar Ortega, María Teresa, 2ª ed., Limusa, México, 1990. pp. 684. 11 12