Dispersiones coloidales
Anuncio

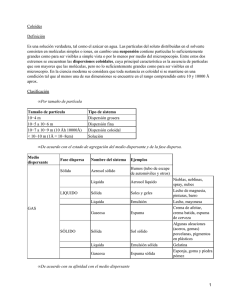
Química: ciencia que estudia a la materia, sus transformaciones y las leyes que rigen esas transformaciones. Materia: todo aquello que ocupa un lugar en el espacio, tiene peso y dimensiones. Ej. : aire, agua, aluminio, una planta (todo lo que nos rodea). Su clasificación según su composición química: Materia homogénea: • Cuando una determinada porción de materia es igual en todas sus partes, y posee en su totalidad las mismas propiedades y composición. • Si se fragmenta en trozos pequeños, cada uno tendrá las mismas características de los otros; no se pueden distinguir. Por ej: una porción de agua en cualquier parte posee las mismas propiedades físicas y químicas (color − sabor − densidad − etc.). • Constituida por una sola fase (es un estado de la materia que posee límites definidos e identificables). • Se divide en: sustancias puras (tiene una composición y propiedades definidas y constantes), no se pueden separar por métodos físicos. • Clasificación de las sustancias puras: átomos: son la parte más pequeña de un elemento que puede sufrir cambios en una reacción. Los símbolos químicos no solo representan a los elementos, sino también cada uno de ellos es un átomo del elemento. Ej: NA representa un átomo del elemento sodio. elementos: es una sustancia pura, formada por un conjunto de átomos de una sola especie, que no puede descomponerse en sustancias más sencillas por métodos químicos ordinarios; se representan por símbolos; 90 se han descubierto en la naturaleza y 19 se han producido en los laboratorios (artificialmente). compuestos: son sustancias constituidas por dos o más elementos, cuya proporción es definida y que no pueden ser separados por procesos físicos, pero sí por métodos químicos para obtener dos o más sustancias diferentes más simples; se representan por fórmulas químicas; se clasifican en orgánicos (presentan carbono) e inorgánicos (ausencia del carbono); su unidad mínima es la molécula. • Están compuestas por dos o más sustancias puras cuyas proporciones pueden variar sin límite en algunos casos. ej: aire (oxigeno, nitrógeno y otros). • Se les llaman también mezclas de gases. • Dentro de ellas están las disoluciones o soluciones (compuestas por gases líquidos o sólidos disueltos en líquidos), ej: solución de azúcar o de sal. • Las soluciones sólidas son mezclas homogéneas de dos o más sólidos, ej: bronce (cobre y zinc). Ejemplos de disoluciones: Aire, oxígeno en agua, alcohol en agua, sal en agua, hidrogeno en Pt, mercurio en plata y plata en oro Materia heterogénea: • Se le llama mezcla heterogénea, mezclas mecánicas o mezclas groseras ya que sus componentes se pueden separar por medios físicos fácilmente y sus propiedades físicas y químicas se mantienen invariables. • Este tipo de mezcla esta constituida por la unión de dos o más sustancias presentando diferentes fases. • Estas mezclas se pueden identificar mediante una observación visual o con un lente de aumento, ej: la 1 combinación de sal y arena. Dispersiones coloidales ó Coloides (del griego Kolla−significa micelas dispersas.) Son mezclas que se encuentran en un punto límite entre la disolución y la mezcla grosera. Nombre se lo dio químico Thomas Graham. Al realizar estudio ve que ciertas sust. se disuelven fácilmente en el agua(sal, azúcar) y otras no se disuelven o lo hacen lentamente(cola, gelatina). Determina que sust constituidas de moléculas o iones se difunden fácilmente son CRISTALOIDES, pero no lo mismo pasa con los COLOIDES cuyas moléculas se aglutinan. Todos los seres vivos se encuentran en estado coloidal (la sangre se coagula = fenómeno coloidal; también la formación de deltas de los ríos, la mayonesa, formada por huevo como agente emulsificante y aceite en un medio ácido, la yema forma una membrana alrededor de cada gota de aceite, otros ejemplos: goma, plástico, carbohidratos en tejido animal.) Presenta dos fases: se pueden presentar en líquido, sólido o gaseoso • Dispersa: partículas coloidales o micelas con formas diversas • Dispersante: medio de dispersión de las micelas. (1 semejante a soluto, 2 al disolvente de disoluciones) Clasificación según el medio dispersante: Hidrófobos o liofóbicos (odian el agua) Cuando las partículas de la fase dispersa y dispersante(agua) presentan poca afinidad No alteran mucho la viscosidad de la dispersante. Precipitan con facilidad Son de naturaleza inorgánica(agua y aceite) Hidrófilos o Liofílicos o emulsiones (amantes de agua) Cuando las fases tienen poca afinidad y aumenta la viscosidad de la f− dispersante = forma un gel, No precipita con electrolitos Son orgánicos (gelatina en agua). No se observa el efecto de Tyndall Se observa el efecto de Tyndall. 2 Cuando precipitan forman un sol Las partículas coloidales son muy pequeñas, no se pueden separar por filtración, algunas suspenciones como la arena y agua se separan al sedimentarse con el reposo. Propiedades de los coloides: • Propiedad cinética (Movimiento Browniano): Partículas están en movimiento constante en forma desordenada, en zigzag constante.Descubierta por Robert Brown al observar que los granos de polen suspendidos en el agua tienen ese movimiento, deduce se mueven al ser bombardeadas por partículas del medio. • Efecto de Tyndall (en honor de John Tyndall: rayo de luz atraviesa un coloide se da una trayectoria definida coloidal. Es una propiedad óptica, es el efecto de la luz sobre un coloide, debido al tamaño de las partículas refleja la luz y la dispersa dejando ver el recorrido (partículas de polvo suspendidas en el aire a través de un rayo de luz). • Precipitación: cuando a un coloide se le agrega un electrolito con carga eléctrica opuesta a sus partículas y estas neutralizan las cargas provocando una precipitación. La mayoría de las partículas coloidales permanecen estables.(coagulación) • Mayoría de partículas conducen cargas eléctricas, se comportan como iones en disolución bajo corriente eléctrica. • Propiedad de absorción (diálisis): cuando las partículas se separan de los iones o moléculas através de una membrana semipermeable, frecuente a nivel celular, por que partículas se dirigen del medio de mayor al de menor concentración. Tienen un tamaño intermedio entre las mezclas homogéneas y heterogéneas Relación entre mezclas homogéneas, heterogéneas y coloides, según tamaño. Mezclas homogéneas hasta los 10° A Disoluciones de 10°A hasta 100°A Mezcla heterogénea de 100°A hasta 1000°A 3