Coloides Definición Es una solución verdadera, tal como el azúcar en agua....
Anuncio
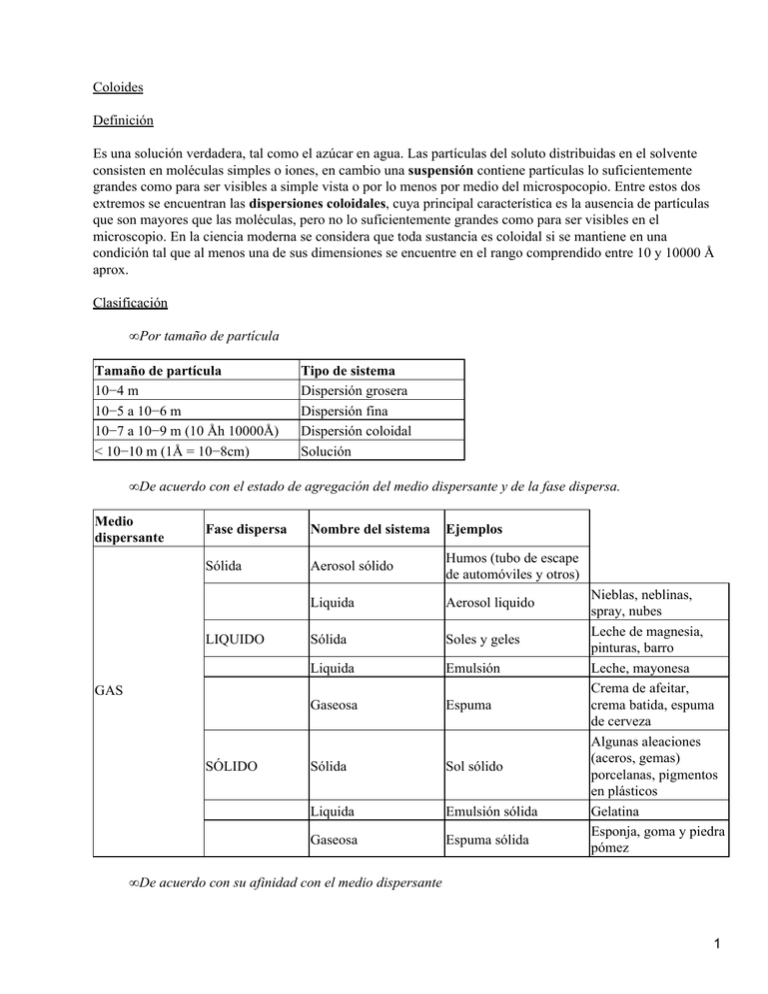
Coloides Definición Es una solución verdadera, tal como el azúcar en agua. Las partículas del soluto distribuidas en el solvente consisten en moléculas simples o iones, en cambio una suspensión contiene partículas lo suficientemente grandes como para ser visibles a simple vista o por lo menos por medio del microspocopio. Entre estos dos extremos se encuentran las dispersiones coloidales, cuya principal característica es la ausencia de partículas que son mayores que las moléculas, pero no lo suficientemente grandes como para ser visibles en el microscopio. En la ciencia moderna se considera que toda sustancia es coloidal si se mantiene en una condición tal que al menos una de sus dimensiones se encuentre en el rango comprendido entre 10 y 10000 Å aprox. Clasificación • Por tamaño de partícula Tamaño de partícula 10−4 m 10−5 a 10−6 m 10−7 a 10−9 m (10 Åh 10000Å) < 10−10 m (1Å = 10−8cm) Tipo de sistema Dispersión grosera Dispersión fina Dispersión coloidal Solución • De acuerdo con el estado de agregación del medio dispersante y de la fase dispersa. Medio dispersante Fase dispersa Nombre del sistema Ejemplos Sólida Aerosol sólido Humos (tubo de escape de automóviles y otros) Liquida Aerosol liquido Sólida Soles y geles Liquida Emulsión Gaseosa Espuma Sólida Sol sólido Liquida Emulsión sólida Gaseosa Espuma sólida LIQUIDO GAS SÓLIDO Nieblas, neblinas, spray, nubes Leche de magnesia, pinturas, barro Leche, mayonesa Crema de afeitar, crema batida, espuma de cerveza Algunas aleaciones (aceros, gemas) porcelanas, pigmentos en plásticos Gelatina Esponja, goma y piedra pómez • De acuerdo con su afinidad con el medio dispersante 1 • LIOBOBOS: (del griego aversión al liquido) si el medio dispersante es el agua, se llama hidrófobos. Los soles liófobos son inestables en comparación con los liófilos, bastan pequeñas cantidades de electrolitos para provocar la coagulación y precipitación de las partículas dispersas. Algunos ejemplos típicos son los soles de metales, de azufre y los sulfuros y haluros de plata. • LIOFILOS: (afición por el liquido) si el medio dispersante es el agua, se llama hidrófilos, son mas estables y no son afectados mientras NO se agreguen cantidades grandes de electrolitos. Por evaporación o calentamiento de sistemas liófilos se pueden convertir nuevamente en soles invirtiendo los factores físicos a los que los liófobos no. Los soles liófilos deben su estabilidad a su capacidad de hincharse en un solvente, quedando así, suspendidas. Algunos ejemplos son: almidones, proteínas Preparación de coloides Hay dos métodos importantes para preparar dispersiones coloidales: CONDENSACION: se produce la fase dispersa por medio de iones o moléculas en soluciones que reaccionan químicamente generando un producto cuyas partículas tienen un tamaño del rango coloidal. DISPERCION: se subdivide la fase dispersa por molienda u otros medios mecánicos hasta que las partículas queden suficientemente pequeñas como para permaneces suspendidas en otros medios. Purificación de suspensiones coloidales Dos procedimientos principales se han empleado para separar de los soles sustancias que se hallan en solución verdadera. • DIALISIS: utiliza el hecho de que la gran mayoría de las sustancias en solución verdadera pueden pasar a través de una membrana mientras que las partículas coloidales son retenidas. La membrana puede ser de origen animal, celofán, papel pergamino o nitrato de celulosa, tal que el diámetro los poros deben ser menores a 10mm. Las partículas coloidales se difunden con mucha lentitud debido principalmente a sus dimensiones relativamente grandes mientras que las moléculas y iones difunden con velocidad mucho mayor. En la ELECTRODIALISIS se facilita la separación de los electrolitos por medio de un campo eléctrico. Las dispersiones coloidales que contiene el electrolito que se desea eliminar se coloca entre dos membranas de diálisis, de cada lado de la membranas hay un compartimiento con agua pura y por medio de electrodo se aplica una f.e.m. que produce la migración de los iones. • ULTRAFILTRACION: consiste en preparar membranas con poros suficientemente pequeños como para retener las partículas coloidales, tales como el celofán. Protección de coloides Si se agrega una pequeña cantidad de sol hidrofólico (Gelatina) a un sol hidrofóbico (Au), el último aparece protegido contra la acción floculante de los electrolitos. La sustancia hidrofílica se denomina coloide protector. La gelatina también se utiliza para estabilizar coloides de abr con que se preparan películas fotográficas, formando una capa sobre la partícula de la sal. La gelatina absorbe agua resultando 2 capas protectoras. Partícula hidrofóbica Coloide protector Los coloides hidrofóbicos no pueden existir en presencia de agentes emulsionantes aquellos que recubran las 2 partículas de la fase dispersa e impidan la floculación en una fase separada. Ej: Los jabones sólidos de ácidos orgánicos(estearato de sodio (ac. esteárico + NaOH)) en presencia de una mezcla de agua y aceite, se obtiene una emulsión ya que los cuerpos hidrocarbonatos son atraídos por el aceite, estando las cabezas polares en contacto con el agua Propiedades de los coloides Propiedades de adsorción de los coloides La adsorción es un fenómeno de superficie, que tiene lugar entre las distintas partículas que forman una solución. De ahí que las micelas coloidales, de gran superficie, gocen de la propiedad de adsorber los iones del medio que las rodean. Este fenómeno explica, por ejemplo, sobre la carga de las micelas, o bien la estabilidad de los coloides, que se aumenta agregando a la solución coloidal una pequeña cantidad de electrólito, suficiente para formar alrededor de la micela una envoltura o capa eléctrica de mismo signo. Propiedades ópticas Efecto Tyndall: Cuando se hace pasar luz por una solución verdadera, un observador ve que la trayectoria de la luz no puede ser revelada fácilmente, en cambio si el medio tiene partículas coloidales, las mismas producen dispersiones de luz y el haz se hace visible. Propiedades de soles hidrófobos Estas partículas se encuentran eléctricamente cargadas con respecto al medio dispersante. El fenómeno de migración de las partículas coloidales por influencia de un potencial eléctrico se denomina ELECTROFORESIS. La carga eléctrica que llevan las partículas coloidales es de importancia fundamental puesto, que como se verá mas adelante, es probable que sin ella los soles liófobos serian extremadamente inestables. Se ha observado que los sistemas coloidales contiene pequeñas cantidades de electrolitos. Si estos se eliminan por diálisis el sol se hace inestable y las partículas dispersas aumentan de tamaño y eventualmente precipitan. Se ve, por lo tanto, que en muchos casos los vestigios presentes en el sol son responsables de las cargas y de la estabilidad del sistema coloidal. Considerando hechos experimentales los soles liófobos pueden permaneces suspendidos debido al fenómeno de adsorción ( es la existencia de una concentración mayor en la superficie de un liquido o un sólido que la que se observa en el resto del sistema). La estabilidad del sol es debida a la repulsión electroestática de partículas cargas con igual signo. Regla de HARDY−SCHULTZE: Se bien la presencia de vestigios de electrolitos parece ser esencial para la estabilidad de los soles liófobos, la existencia de de cantidades mayores de electrolitos forman precipitados. El fenómeno se produce como COAGULACION, se puede concluir este fenómeno con dos reglas que dio Hardy−Schultze: • El ión que produce la precipitación de un sol es aquel cuya carga es del signo de las partículas coloidales. • El efecto precipitante aumenta notablemente al aumentar la valencia del ión. Propiedades de los soles liófilos Una de las diferencias mas notables entre los soles liófobos y los liófilos es la viscosidad elevada de estos últimos. Esta se atribuya a la gran solvatación (hidratación) de las partículas liófilas, el tamaño relativamente grande de las partículas y la disminución en el número de moléculas de agua libre se traduce en un aumento de la viscosidad. 3 Las partículas de soles liófilos presentan el fenómeno de migración electroforética en un campo eléctrico la estabilidad de un sol hidrófilo queda determinada por dos factores: la hidratación y la carga eléctrica. Si se disminuye la hidratación, el sol se hace sensible a los electrolitos, en cambio cuando la carga eléctrica se neutraliza, la precipitación puede provocarse mediante agentes deshidratantes como el alcohol. El agregado de grande cantidades de electrolitos a soles liófilos provoca la precipitación de la sustancia dispersada. Definiciones Espumas: dispersión de burbujas de gas (generalmente aire) suspendidas en el seno de un liquido viscoso o de un semisólido, y se producen por medio de una adsorción de moléculas reactivas en la interfase gas liquido; el fluido que se localiza entre los glóbulos de gas se designa con el nombre de lamela y sirve como estructura básica. La mayor estabilidad de las espumas se obtiene cuando la lamela, o la distancia entre dos burbujas, es del orden de 0.2 a 1 ðm Soles: uno de los principales sistemas coloidales que se encuentran en los alimentos, integrados por una dispersión de un material sólido en un liquido; las moléculas que intervienen son fundamentalmente polímetros, tales como polisacáridos y proteínas, que pueden crear dos tipos de coloides los hidrofóbos y los hidrófilos. Los primeros precipitan con facilidad y son menos estables que los segundos, por su parte los segundos están fuertemente hidratados y su mecanismo de estabilidad esta determinado por su grado de interacción con el medio dispersante. Emulsiones: sistemas constituidos por dos líquidos inmiscibles en los que la fase dispersa se encuentra dispersa en pequeñas gotas, entre 0.1 y 10 ðm distribuidas en la fase continua y dispersante; son inestables y se les permite reposar por algún tiempo, las moléculas de la fase dispersa tienden a asociarse para construir una capa que puede precipitar o migrar a la superficie, según la diferencia de densidades entre las dos fases. La producción de emulsiones estables requiere de necesariamente de agentes emulsionantes que reduzcan la tensión superficial entre ambas fases. Geles: sistemas creados por una red continua de macromoléculas interconectadas y entrelazadas en una estructura tridimensional en la que queda atrapada la fase continua de agua. Se pueden concebir como un estado en el que las macromoléculas coloidales se orientan formando fibrillas que al interaccionar establecen un cuerpo básico o esqueleto, que sirve de soporte para retener el agua mediante puentes hidrogeno. Este mecanismo se observa en la gelificación de las pectinas durante la elaboración de mermeladas. Quimica 63.01 B B. Ricotti − L Diaz[Author ID2: at Thu May 15 13:20:00 2008 ] 1 Cl− Cl− Cl− Cl− Cl− Cl− 4 xFe2O3. yH2O Fe3+ Fe3+ xFe2O3. yH2O Fe3+ H+ H+ H+ H+ H+ H+ Cl− Cl− Cl− Cl− Cl− Cl− Fe3+ Fe3+ Fe3+ Fe3+ Fe3+ Cl− No ve la luz Ve la luz Coloide 5 Memebranas Agua pura Agua pura + − 6

