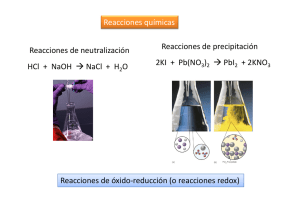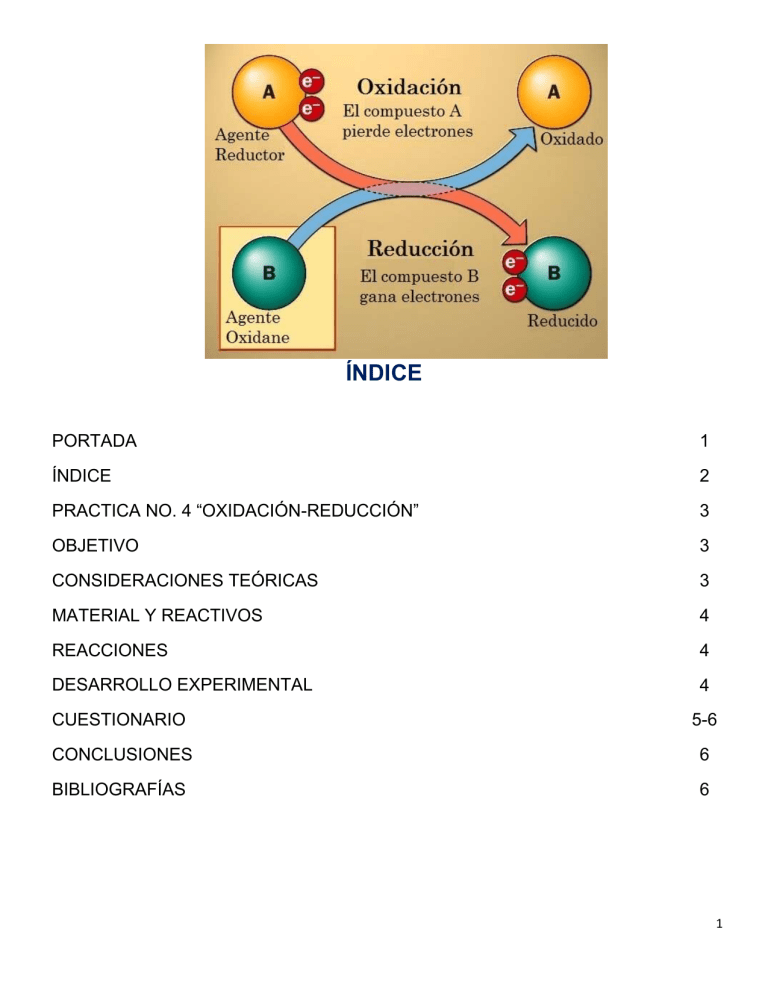
ÍNDICE PORTADA 1 ÍNDICE 2 PRACTICA NO. 4 “OXIDACIÓN-REDUCCIÓN” 3 OBJETIVO 3 CONSIDERACIONES TEÓRICAS 3 MATERIAL Y REACTIVOS 4 REACCIONES 4 DESARROLLO EXPERIMENTAL 4 CUESTIONARIO 5-6 CONCLUSIONES 6 BIBLIOGRAFÍAS 6 1 PRACTICA NO. 4: “OXIDACIÓN-REDUCCIÓN” OBJETIVO El alumno reconocerá un proceso de Oxidación-Reducción. CONSIDERACIONES TEÓRICAS Química Básica: Estudia la composición, estructura y propiedades de la materia, cambios que esta experimenta durante las reacciones químicas y su relación con la energía. Reacción Oxidación-Reducción o Reacción Redox: Es toda la reacción química en la que unos o más electrones se transfieren entre los reactivos, provocando un cambio en sus estados de oxidación. Para que exista una reacción de Reducción-Oxidación, en el sistema debe de haber un elemento que ceda electrones, y otro que los acepte. Agente Oxidante: Es aquel elemento químico que tiende a captar esos electrones, quedando con un estado de oxidación inferior al que tenía, es decir, siendo reducido. Agente Reductor: Es aquel elemento químico que suministra electrones de su estructura química al medio, aumentando su estado de oxidación, es decir, siendo oxidado. Reducción: Ganancia de electrones. Es el compuesto capaz de producir una reducción y se llama reductor, durante el proceso este dicho reductor se oxida se oxida (porque pierde electrones, se los cede a otro compuesto para reducirlo). Oxidación: Perdida de electrones. Es el compuesto capaz de producir una oxidación, es un oxidante, durante el proceso este dicho oxidante se reduce (porque gana electrones, se los arranca a otro compuesto para reducirlo). Oxidación Lenta: Se produce por causa del agua o del aire y que supone que los metales pierdan su brillo al tiempo que provocan su corrosión. Oxidación Rápida: Tiene lugar cuando ha hecho acto de presencia la combustión, desprendiendo importantes niveles de calor. Suele producirse, de modo fundamental, en lo que son elementos que cuentan con hidrógeno o carbono. Ecuación Química: Descripción simbólica de una reacción química (Reactivos y Productos) y los ayuda a visualizar más} fácilmente. Balanceo de Ecuaciones Químicas: Existen diversos métodos y el objetivo que se persigue es que la ecuación química cumpla con la ley de la conservación de la materia. Método por Tanteo: Consiste en igualar el número y clase de átomos, iones o moléculas reactantes con los productos a fin de cumplir la Ley de la conservación de la materia. Ley de Lavoisier o Ley de la Conservación de la Masa: “La masa no se crea ni se destruye, sólo se transforma”. En una reacción química la suma de la masa de los reactivos es igual a la suma de la masa de los productos. 2 MATERIAL Y REACTIVOS MATERIAL 2 Vasos de precipitado de 100cm^3 1 Embudo 1 Triangulo de porcelana Papel filtro 2 Probetas de 100ml 1 Pipeta graduada 2 Espátulas 1 Anillo de fierro REACTIVOS NaHO3 solución al 25% peso. H2S04 solución al 5% volumen. Cu en polvo. Zn en polvo. HNO3 concentrado REACCIONES A) Cu(s) + HNO3(l)→ Cu(NO3)2(s) + NO(g) + H2O(l) B) Cu(NO3)2(s) + NaHCO3(ac)→ CuCO3(s) + CO2(g) + NaNO3(ac) + H20(l) C) CUCO3(s) + H2SO4(1) CuSO4(s) + CO2(g) +H20 (l) D) CuSO4(s) + Zn(s)→ Cu(s)+ZnSO4(ac) DESARROLLO EXPERIMENTAL 1. Se colocan de 0.1 a 0.2 gramos de Cobre en un vaso de precipitados de 100 cm3 y se agregan 2 cm3 de Ácido Nítrico. Realizar esta operación en la campana de Extracción. Por medio de la báscula, y una palilla, obtenemos la cantidad requerida, y es muy importante tener esta medida en cuenta, ya que el experimento trata de cantidad como reactivo a cantidad como producto. PRECAUCION: Tener cuidado al manejo del Ácido Nítrico, ya que al, mezclarse con el Cobre, produce un gas altamente tóxico. 2. Agregar 25 cm³ de solución de bicarbonato de sodio al 25% en peso hasta la formación de un precipitado de color azul. Tener cuidado al agregar el bicarbonato y hacerlo de manera lenta, ya que al ser bicarbonato hará que se libere gas si lo haces de manera rápida, se derramará y el experimento ya no funcionará. 3. Se procede a filtrar la solución anterior conservando el precipitado y desechando la solución 4. Al precipitado se le agregan 20 cm³ de solución de ácido sulfúrico al 5% en volumen, hasta que reaccione y si reciben un vaso de 100 cm³. Después de esperar el filtrado y agregar los 20 cm³ de solución de ácido sulfúrico debes esperar un poco en lo que se filtra al agregar la solución la masa o la mezcla que es como una pasta de color azul se va a hacer líquida y se volverá a filtrar. 5. A la solución obtenida se le agregan de cero uno a cero 2 g de zinc en polvo y se agita continuamente hasta la formación de un precipitado de color rojo de ladrillo o café. A continuación, puedes filtrar esta solución y el cobre en polvo se quedarán tu papel filtro debes esperar a que seque para poder medir la cantidad de sustancia y saber si funcionó el experimento. Se anexa evidencia fotográfica de la Practica no. 4 “Oxidación-Reducción”, con un respectivo orden de todo el procedimiento de esta práctica. 3 CUESTIONARIO 1. Balancear por el método “Redox” la reacción del inciso A. a) Balancear la reacción del inciso B. b) De las reacciones A y D, indicar los elementos que se oxidan y los que se reducen A) Reductor=>Cu(s) B) Reductor=>Zn Oxidante=>HNO3(l) Oxidante=>CuSO(l) c) ¿A qué sustancia corresponde el precipitado de color rojo o café obtenido en el punto 5? El precipitado de color rojizo que se formó corresponde al Cobre. CONCLUSIONES Los alumnos concluimos en esta práctica que logramos visualizar como actúan las sustancias entre ellas, igual comprendimos que las reacciones de óxido-reducción son importantes para todos nosotros ya que las vemos en todas partes ya sea en una pila de nuestro reproductor de música o en los alambres de cobre de nuestras instalaciones. También aprendimos a balancear las diferentes sustancias y a identificar si es un agente reductor u oxidante, cumplimos con el objetivo que fue identificar de manera experimental como cambia una sustancia de acuerdo a la oxidación-reducción. BIBLIOGRAFÍAS 4 http://depa.fquim.unam.mx/amyd/archivero/Balanceo_25801.pdf https://es.khanacademy.org/science/chemistry/oxidation-reduction/redoxoxidation-reduction/a/oxidation-reduction-redox-reactions https://rodas5.us.es/file/a118d936-c339-481d-7132d54a28dc4b22/1/tema4_word_SCORM.zip/page_02.htm https://metodoss.com/redox/ https://www.periodni.com/es/balanceo_de_ecuaciones_redox.php 5