Redox. - Sistema educativo virtual UNLP
Anuncio

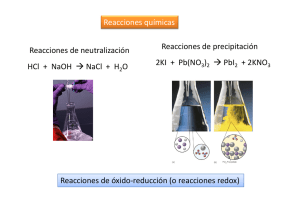
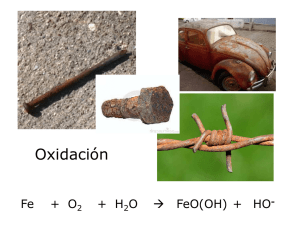
REACCIONES DE ÓXIDOREDUCCIÓN. INTRODUCCIÓN TEÓRICA Comisión 8A 2013 Página web: http://catedras.quimica.unlp.edu.ar BIBLIOGRAFÍA Atkins P.W.; Jones L. Principios de Química. Ed. Médica Panamericana. Brown, T.L.; Le May, H.E.; Bursten, B.E. Química: la ciencia central. Ed. Prentice Hall. Chang, R.; College, W. Química. Ed. Mc Graw-Hill. Whitten, K.W.; Davis, R. E.; Peck, M.L. Química General. Ed. Mc Graw-Hill. Petrucci, R.; Harwood, W. S.; Herring, F. Química General. Ed. Prentice Hall. Ebbing, Gammon. Química General. Ed. Houghton Mifflin Company Glasstone, S.; Elementos de Química Física. Ed. El Ateneo. Tedesco, P.; Química Universitaria. Ed. UNLP. Mahan, B.; Química: Curso Universitario. Fondo Educativo Interamericano. REDOX REACCIONES DE ÓXIDO-REDUCCIÓN REACCIONES DE TRANSFERENCIA DE ELECTRONES OXIDACIÓN REDUCCIÓN Pérdida de electrones ( aumento en el número de oxidación) Ganancia de electrones ( disminución en el número de oxidación) Siempre que se produce una oxidación debe producirse simultáneamente una reducción. Alambre de Cu en contacto con solución de Ag+ Se observan cambios en la superficie del alambre y en la solución EJEMPLOS DE REACCIONES DE REDOX Limpieza: uso de lavandina (hipoclorito de sodio) para limpieza en hogar, piletas, etc. Uso de dentífricos para aclarar los dientes (peróxidos). Energía: Combustión .Uso de pilas, baterías, celdas solares. Biología: reacciones metabólicas en los seres vivos. Alimentos: Uso de antioxidantes para conservar. Industria: metalurgia (producción de hierro, acero, etc.) Medio ambiente: ciclos de los elementos. Corrosión. ESTADOS DE OXIDACIÓN Los estados de oxidación (E.O.) nos permiten identificar los elementos que se han oxidado y reducido. ESTADOS DE OXIDACIÓN Los elementos que muestran un aumento en el E.O., se han oxidado. (oxidación) Los elementos que muestran una disminución en el E.O., se han reducido. (reducción) Cada una de estas reacciones se denomina hemirreacción. HEMIRREACCIONES REDOX Un proceso de reducción implica simultáneamente un proceso equivalente de oxidación. El número de electrones ganados por un átomo, debe ser igual al número de electrones cedidos por otro átomo en el mismo proceso total. AGENTES OXIDANTES Y REDUCTORES Agente oxidante: Sustancia capaz de oxidar a otra sustrayéndoles electrones. Se reduce (contiene al elemento cuyo número de oxidación disminuye). Reducción: Agente oxidante Agente reductor: Sustancia capaz de reducir a otra. Se oxida. Oxidación: Agente reductor AJUSTE DE REACCIONES REDOX: MÉTODO DEL ION-ELECTRÓN Conservación de la masa Conservación de la carga Se escriben las dos hemirreacciones que tienen lugar y después se igualan el nº de ē de ambas, para que al sumarlas los electrones desaparezcan. MÉTODO DEL ION-ELECTRÓN 1 Identificar reactivos y productos de reacción. 2 Escribirlos en forma iónica (salvo compuestos gaseosos, insolubles y no ionizados que se escriben en forma molecular). Identificar cuál es el elemento que se reduce y cuál el que se oxida, así como el medio (ácido o básico) en el que ocurre la reacción. Medio: ácido (HCl) MÉTODO DEL ION-ELECTRÓN 3 Balancear cada hemirreacción en masa respecto al elemento que se oxida y se reduce. 4 Indicar los electrones perdidos o ganados en cada hemirreacción. MÉTODO DEL ION-ELECTRÓN 5 Equilibrar las cargas en cada hemirreacción Medio ácido: H+ Medio básico: OH- 6 Balancear respecto de los otros elementos (puede faltar en uno de los lados de una o ambas hemirreacciones un número entero de moléculas de H2O). Verificar que las hemirreacciones hayan quedado balanceadas en carga y en masa. MÉTODO DEL ION-ELECTRÓN 7 Multiplicar, si es necesario, cada hemirreacción por un número entero tal que el número de electrones perdidos en la oxidación sea igual al número de electrones ganados en la reducción. Sumar las hemirreacciones y simplificar los coeficientes (cuando corresponda) para obtener la ecuación iónica total. Ecuación iónica balanceada MÉTODO DEL ION-ELECTRÓN 8 De ser requerido, trasladar los coeficientes resultantes de cada compuesto o ión a la ecuación molecular. Ecuación molecular balanceada EQUIVALENTE QUÍMICO PARA REACCIONES REDOX Peso Equivalente redox de una sustancia es peso de la misma que gana o pierde un mol de electrones. Para saber cual es la masa equivalente, además de saber de qué sustancia se trata, es necesario conocer en qué sustancia se transforma (hemirreacción). PESO EQUIVALENTE REDOX VALORACIÓN O TITULACIÓN REDOX Es similar a la valoración ácido base. Se determina el número de moles de especie oxidante y reductora que reaccionan entre sí. El nº de moles de ē que pierde el oxidante es igual a los que gana el reductor. Se necesita conocer qué especies químicas son los productos y no sólo los reactivos. TENDENCIA A OXIDARSE O REDUCIRSE Descripción cualitativa del poder reductor u oxidante