Caracterización de elementos representativos por reacciones de oxidación y reducción. INTRODUCCIÓN
Anuncio

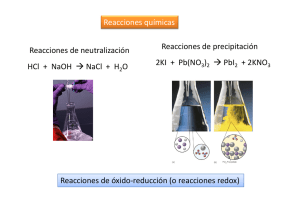
Caracterización de elementos representativos por reacciones de oxidación y reducción. INTRODUCCIÓN Reacción de oxidación−reducción es la reacción química correspondiente a la acción de un cuerpo oxidante sobre un cuerpo reductor, que da lugar a la reducción del oxidante y a la oxidación del reductor. Pero ¿Qué es una reacción química? Una reacción química es el proceso en el que una o más sustancias los reactivos se transforman en otras sustancias diferentes los productos de la reacción. Un ejemplo de reacción química es la formación de óxido de hierro producida al reaccionar el oxígeno del aire con el hierro. Los productos obtenidos a partir de ciertos tipos de reactivos dependen de las condiciones bajo las que se da la reacción química. No obstante, tras un estudio cuidadoso se comprueba que, aunque los productos pueden variar según cambien las condiciones, determinadas cantidades permanecen constantes en cualquier reacción química. Estas cantidades constantes, las magnitudes conservadas, incluyen el número de cada tipo de átomo presente, la carga eléctrica y la masa total. OXIDANTE Y REDUCTOR Una disolución acuosa de iones Cu2+ es azul. Si se le añaden limaduras de hierro (Fe), se comprueba que el color azul desaparece: los iones Cu2+ han reaccionado. Por otra parte, en la disolución se forman iones Fe2+, lo que se manifiesta por el precipitado verdoso que forman en presencia de sosa. También se observa que el 1 hierro queda recubierto por un depósito rojo. Efectivamente, se forma cobre metálico, Cu. El balance de la reacción es el siguiente: Fe + Cu2+ ! Fe2++ Cu El hierro ha sido oxidado por los iones Cu2+, que a su vez han sido reducidos por el hierro. La reacción anterior es una reacción de oxidación−reducción (o reacción redox) en la que el hierro es el reductor y el cobre el oxidante. La reacción es de hecho la suma de las dos semirreacciones siguientes: oxidación: Fe ! Fe2+ + 2e− reducción: Cu2+ + 2e− ! Cu Por tanto, la oxidación de un cuerpo corresponde a una pérdida de electrones y la reducción corresponde a una ganancia de electrones. Un oxidante (en este caso los iones Cu2+) es una sustancia susceptible de captar uno o varios electrones; un reductor (en este caso el hierro) cede fácilmente uno o varios electrones. Si se designa el oxidante por Ox, el reductor por Red y el número de electrones implicados por n, las semirreacciones pueden escribirse del modo siguiente: El concepto de oxidación y reducción se empieza a ver a partir del estado elemental; estado de oxidación = 0 #n de protones = #n de electrones 2 APLICACIONES DE LA OXIDACIÓN−REDUCCIÓN Las reacciones de oxidación−reducción son muy frecuentes en la industria: constituyen el principio de funcionamiento de las pilas eléctricas y se emplean para refinar electroquímicamente determinados metales. En la naturaleza, intervienen en la respiración celular y la fotosíntesis. La electrólisis de las disoluciones salinas es una reacción de oxidación−reducción: se produce oxidación en el ánodo y reducción en el cátodo. Para llevar a cabo una electrólisis se establece una diferencia de potencial entre los electrodos con el fin de seleccionar la reacción deseada. Objetivo: El alumno corroborará el comportamiento de algunos elementos representativos por medio de reacciones de oxi−red. Confirmará tal comportamiento con base en su configuración electrónica y su posición en la tabla periódica. Reactivos: Na , K , Ca , Mg , S Indicador universal (ph) H2O Material: Mechero de Bunsen Cucharilla para combustión Pinzas para crisol 2 matraz Erlen−Meyer 250ml 2 tapón de hule 1 caja petri 3 4