1º Ciencias - Colegio Cristo Rey de Las Rozas
Anuncio

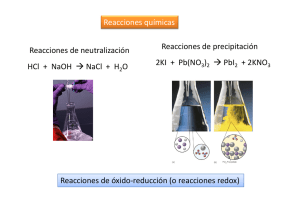
1º Ciencias REACCIONES DE OXIDACIÓN - REDUCCIÓN Concepto electrónico de oxidación y de reducción Oxidación es el proceso por el cual un reductor pierde electrones. Reducción es el proceso por el cual un oxidante gana electrones. No puede haber procesos de oxidación o de reducción aislados. Si una sustancia pierde electrones (oxidación), otra debe ganarlos (reducción). Sustancias oxidantes y reductoras Toda reacción redox, transcurre entre una especie (o agente) oxidante y una especie reductora. Oxidante es toda especie química que toma electrones de otra, a la cual oxida. Reductor es toda especie química que cede electrones a otra, a la cual reduce. Por tanto, el oxidante, al tomar electrones, se reduce; y, a la inversa, el reductor, al ceder electrones, se oxida. Reductor1 + Oxidante2 Reductor2 + Oxidante1 Número de oxidación Se define el estado de oxidación, o número de oxidación (n.o.), de un átomo en un compuesto con enlace covalente como el número de cargas eléctricas que tendría ese átomo si los electrones del enlace covalente se asignasen al átomo más electronegativo. Reglas para asignar el n.o.: 1. El n.o. de cada átomo en los elementos libres (no combinados) es cero. Por ejemplo: el Na. Al Mg, el O2, el P4,… 2. En el caso de iones monoatómicos, el n.o. coincide con su carga. Por ejemplo: el ion O2- tiene n.o. igual a -2, Na+ tiene n.o. igual a +1. Los metales alcalinos siempre tienen +1, los alcalino-térreos +2 y el Al +3. 3. El n.o. del oxígeno es -2, salvo en los peróxidos, que es -1. 4. El n.o. del hidrógeno es +1, salvo en los hidruros metálicos (LiH, NaH, etc) que es -1. 5. El n.o. del fluor es siempre -1. el resto de los halógenos (Cl, Br, I) tienen números de oxidación negativos cuando están combinados con elementos menos electronegativos, y, por el contrario, positivos, si se combinan con elementos más electronegativos. En el caso de los haluros, el halógeno tiene siempre -1. 6. En una molécula neutra, la suma algebraica de todos los n.o. debe ser cero. Por tanto, en un ion poliatómico, la suma algebraica debe ser igual a la carga del ion. 7. Los n.o. no tienen porque ser números enteros y pueden tomar el valor cero (por ejemplo, el C en HCHO). Nenina Martín Ossorio Química 1 1º Ciencias Ajuste de ecuaciones redox Método del número de oxidación 1. Escribir la reacción completa sin ajustar. Por ejemplo: Fe2O3 + C Fe + CO2 2. Identificar los elementos que experimentan variación en su n.o. +3 -2 0 0 +4 -2 Fe2O3 + C Fe + CO2 3. Escribir las variaciones en los números de oxidación del hierro y del carbono, ajustando las cargas en ambos miembros mediante el número de electrones necesario. +3 0 Fe + 3 e- Fe 0 reducción +4 C - 4 e- C oxidación El hierro actuó de oxidante, ganó electrones y, por tanto se redujo. Y el carbono actuó de reductor, él se ha oxidado por perder electrones. 4. Ajustar por separado en masa y carga las dos semirreacciones, igualar el número de electrones y sumarlas: 4 Fe+3 + 12 e- 4 Fe0 reducción 3 C0 - 12 e- 3 C+4 oxidación 4 Fe+3 + 3 C0 4 Fe0 + 3 C+4 5. Obtener la ecuación molecular ajustada: 2 Fe2O3 + 3 C 4 Fe + 3 CO2 Método del ion-electrón (en medio ácido) 1. Escribir la reacción completa sin ajustar. Por ejemplo: HNO3 + Cu Cu(NO3)2 + NO2 + H2O 2. Identificar los elementos que experimentan variación en su n.o. -6 n.o. +1+5-2 0 +10 -12 +2 +5 -2 -4 +4-2 +1-2 HNO3 + Cu Cu(NO3)2 + NO2 + H2O 3. Identificar las especies oxidante y reductora. Al estar en disolución acuosa, la especie reductora sería el Cu, que se oxida a Cu+2 (par conjugado Cu2+ / Cu). La especie oxidante sería el ion NO3-, ya que en agua, el HNO3 está disociado en NO3- y H+ (par conjugado NO3- / NO2). Nenina Martín Ossorio Química 2 1º Ciencias 4. Escribir las semirreacciones que experimentan los dos pares redox: NO3- NO2 reducción Cu Cu2+ oxidación 5. Ajustar por separado ser: - en masa y carga las dos semirreacciones. El orden puede ajustar los oxígenos añadiendo moléculas de agua ajustar los hidrógenos añadiendo H+ añadir electrones donde corresponda NO3- + 2 H+ + 1 e- NO2 + H2O Oxidante (se reduce) Cu Reducción Forma reducida - 2 e- Cu2+ Reductor (se oxida) Oxidación Forma oxidada 6. Igualar en ambas semirreacciones el número de electrones y sumarlas. Se obtiene así la reacción iónica ajustada. En este ejemplo multiplicamos la 1ª ecuación por 2. 2 NO3- + 4 H+ + 2 e- 2 NO2 + 2 H2O Reducción 2+ Cu - 2 e Cu Oxidación 2 NO3- + Cu + 4 H+ 2 NO2 + Cu2+ + 2 H2O R. iónica ajustada 7. Obtener la ecuación molecular ajustada. 4 HNO3 + Cu Cu(NO3)2 + 2 NO2 + 2 H2O Nenina Martín Ossorio Química 3