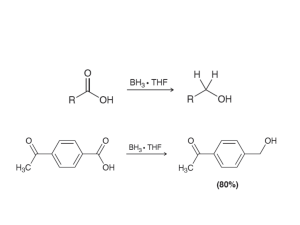
H SO - IES Eduardo Merello
Anuncio

1 INDEX 1.INTRODUCCIÓN 2.IONES ESPECIALES 3 A. Óxidos B. Peróxidos C. Cianuros 5 D. Amónicos 3.COMBINACIONES BINARIAS CON EL HIDRÓGENO 9 4. OTRAS COMBINACIONES NO METAL+NO METAL 13 5.SALES BINARIAS 14 6.HIDRÓXIDOS 18 7.ÁCIDOS OXOÁCIDOS 19 8.CATIONES Y ANIONES 27 9.SALES IÓNICAS POLIATÓMICAS 29 2 FORMULACIÓN INORGÁNICA 1. Introducción Los átomos de un elemento se combinan a veces con átomos de otros elementos y forman compuestos químicos. Estos compuestos constituyen un conjunto muy numeroso, por lo que es necesario establecer unas reglas que permitan a la comunidad científica denominar un mismo compuesto de igual forma. Esto facilita la comunicación entre los miembros de esta comunidad. Por tanto, cada compuesto químico tiene una fórmula y un nombre. La fórmula química es una representación simbólica de la molécula o unidad estructural de una sustancia química. Contiene los símbolos de los elementos que forman el compuesto y, al lado de estos, unos subíndices que indican el número de átomos de los elementos. Las fórmulas proporcionan, pues, la relación numérica en la que intervienen los átomos (o iones) que constituyen los elementos de los compuestos. Los números que figuran están relacionados con la cantidad de enlaces posibles de unos átomos (o iones) con otros y dan una idea de la capacidad de combinación de los elementos en cuestión. El conjunto de reglas mediante las cuales se denominan los compuestos constituye una nomenclatura. Estudiaremos a continuación la nomenclatura sistemática, propuesta por la IUPAC (International Union of Pure and Applied Chemistry); no obstante, también veremos la nomenclatura de Stock y la tradicional (admitidas por la IUPAC), ya que algunos compuestos continúan denominándose así en la bibliografía. Antes de proceder al estudio de las reglas para cada tipo de compuesto, es necesario conocer los símbolos de los diferentes elementos químicos, así como el concepto de valencia. La valencia es el poder de combinación de un átomo para unirse con otros y formar un compuesto. En los compuestos iónicos, la valencia es igual a la valencia iónica o electrovalencia, es decir, a la capacidad para ceder o captar electrones hasta adquirir una configuración electrónica estable. Así, por ejemplo, en el cloruro de calcio, CaCl2, calcio tiene valencia 2 (Ca+2), y el cloro, valencia 1(Cl-). En los compuesto covalentes, la valencia es igual al número de enlaces formados, también llamada covalencia. De esta manera, en el metano, CH4, el hidrógeno tiene valencia 1, y el carbono, valencia 4. El número de oxidación es el número de cargas que tendría un átomo si todos los enlaces que lo forman fueran iónicos, es decir, si se encontrara en forma de ion. 3 Este número es más o menos equivalente a su capacidad de combinación, pero con signo + o –, en función de si ha perdido o ha ganado electrones. En general podemos clasificar los compuestos inorgánicos según el tipo de enlace. Es decir, teniendo en cuenta la forma en la que están unidos sus átomos. Desde este punto de vista podemos hablar de compuestos iónicos y covalentes. CONCEPTO DE VALENCIA. La valencia es un número que indica la capacidad de combinación de un elemento, y dado que es una propiedad periódica puede deducirse en el caso de los elementos representativos a partir del SP (sistema periódico). +1 +2 +3 +4 +5 +6 +7 +2 +3 +4 +5 +1 +2 +3 EXCEPCIONES: H (+1 y –1); O (sólo –2) y F (sólo –1) 0 +1 H -3 -4 -3 -2 -1 Hidrógeno He Helio Li Be B C N O F Ne Litio Berilio Boro Carbono Nitrógeno Oxigeno Fluor Neón Na Mg Al Si P S Cl Ar Sodio magnesio Aluminio Silicio Fosforo Azufre Cloro Argón K Ca Cr+2,3,6 Mn+2,3,4,6,7 Fe+2,3 Co+2,3 Ni+2,3 Cu+1,2 Zn+2 Potasio Calcio Cromo Rb Sr Pd+2,4 Ag+1 Cd+2 Rubidio Estroncio Paladio Cadmio Cs Ba Pt+2,4 Au+1,3 Hg+1,2 Pb Cesio Bario Platino Plomo Manganeso Hierro Cobalto Niquel Cobre Plata Oro As Se Br Kr Arsenico Selenio Bromo Kriptón Sn Sb Te I Estaño Antimonio Teluro Iodo Zinc Mercurio CRITERIOS DE FORMULACIÓN. Suponemos todos los compuestos formados por anión (parte electronegativa) y catión (parte electropositiva) 1. Se escribe en primer lugar el símbolo de la parte electropositiva y a continuación la parte electronegativa. 2. Se intercambian las respectivas cargas colocándose como subíndices sin signo. 3. Los subíndices se simplifican cuando sea posible y se omiten al tener valor 1. Los compuestos son eléctricamente neutros y la suma algebraica de sus cargas es 0. 4 TIPOS DE COMPUESTOS. NOMENCLATURA. Se nombra primero el anión (o parte electronegativa) seguido del nombre del catión (o parte electropositiva). Nomenclatura de Stock: la valencia se indica con números romanos. Afijos para valencias positivas Valencias negativas IV V VI VII Sólo hay un Nomenclatura moderna o sistemática: A A A A compuesto mediante un prefijo se indica el número y valencia posible per +7 ico de átomos. Los prefijos numerales +4 +5 +6 +5 ico griegos son: +3 +4 +3 oso Ácido............-hídrico di-, tri-, tetra-, penta-, hexa- y hepta-. hipo +1 +2 +1 oso Nomenclatura antigua o tradicional: mediante un sufijo o un prefijo se indica la valencia del no metal, se usa en óxidos, ácidos y sales. 2. IONES ESPECIALES Además de compuestos formados por aniones no metálicos y cationes metálicos, también hay compuestos formados por aniones o cationes poliatómicos: ION O2- Nombre óxido Ejemplo PbO2 O22- Peróxido Na2O2 OH- Hidróxido Fe(OH)3 CN- Cianuro Hg(CN)2 NH4+ Amonio NH4Cl A) Nomenclatura Óxido de plomo(IV), dióxido de plomo, oxido plúmbico Peróxido de sodio Hidróxido de hierro(III), trihidróxido de hierro, hidróxido férrico Cianuro de mercurio(II), dicianuro de mercurio, cianuro mercúrico Cloruro de amonio ÓXIDOS Formulación 1) En primer lugar se coloca el símbolo del elemento y después el del E2Ox oxígeno. 2) Después se intercambian las valencias (el oxígeno siempre tiene valencia 2) Si se puede se simplifican los subíndices., y se nombran según la formula simplificada. valencia del elemento E 5 Nomenclatura 1) Sistemática Prefijo+ÓXIDO DE prefijo+NOMBRE DEL ELEMENTO Ej: Fe2O3 Trióxido de dihierro Nº de átomos Prefijo Nº de átomos Prefijo 1 Mono 6 Hexa 2 Di 7 Hepta 3 Tri 8 Octo 4 Tetra 9 Nona 5 Penta 10 Deca 2) De Stock ÓXIDO DE NOMBRE DEL ELEMENTO (Valencia del elemento en números romanos*) * Siempre que tenga más de una Ej: Fe2O3 Óxido de hierro (III) 1. Completa la siguiente tabla teniendo en cuenta el ejemplo resuelto: FÓRMULA VAL ELEM. ÓXIDO 1 Cl Cl2O 3 Cl Cl2O3 5 Cl 7 Cl NOMENCLATURA SISTEMÁTICA DE STOCK Monóxido de dicloro S S S Be Na 6 Óxido de cloro (I) 2. Nombra los siguientes óxidos utilizando la nomenclatura sistemática y de Stock. NOMENCLATURA FÓRMULA SISTEMÁTICA DE STOCK CaO HgO P205 Co2O3 Ag2O Au2O3 BaO K2O CdO SnO2 PbO Hg20 3. Formula los siguientes óxidos NOMENCLATURA óxido de zinc NOMENCLATURA FÓRMULA Trióxido de dihierro óxido de mercurio (II) pentaoxido de difósforo óxido de bromo (V) óxido de iodo (III) dioxido de plomo B) FÓRMULA óxido de bario Monóxido de dipotasio óxido de cesio óxido de plata Trióxido de dioro PERÓXIDOS Se nombran con la nomenclatura de Stock, recuerda que el ion peróxido es O22- y el O2 no se simplifica. Ejemplos: Peróxido de Litio Li2 O2 ,Peróxido de hierro(III) Fe2O6 Un caso muy común es el peróxido de hidrógeno o agua oxigenada H2O2 7 4.-Nombra y formula los siguientes peróxidos: Fórmula Na2O2 CaO2 PtO2 Mn2O6 HgO2 Nomenclatura Nomenclatura Peróxido de cadmio Peróxido de cromo(II) Peróxido de estaño(IV) Peróxido de hierro (III) Peróxido de plata C) Fórmula Fórmula H2O2 Co2O6 PbO4 CuO2 Rb2O2 Nomenclatura Nomenclatura Peróxido de potasio Peróxido de cesio Peróxido de bario Peróxido de zinc Peróxido de oro (III) Fórmula CIANUROS 5.- Nombra y formula los siguientes compuestos NOMENCLATURA Fórmula STOCK SISTEMÁTICO TRADICIONAL AgCN Al(CN)3 Fe(CN)2 NaCN Cd(CN)2 NOMENCLATURA Cianuro de mercurio (II) Dicianuro de magnesio Cianuro de calcio Cianuro cúprico Cianuro de hierro(II) D) FÓRMULA AMÓNICOS + - - 2- El NH4 actúa con valencia +1 y se une a aniones no metálicos Cl , Br , S átomos poliatómicos como SO42- , NO3- … 6.- Nombra y formula los siguientes compuestos FÓRMULA NH4Br (NH4)OH (NH4)2S NH4Cl NOMENCLATURA Los hidróxidos se verán en el apartado 6 (compuestos ternarios) 8 , también se une a 3.COMBINACIONES BINARIAS CON EL HIDRÓGENO a) HIDRUROS METÁLICOS A) Formulación 1) Se escribe primero el símbolo del elemento metálico y después el del hidrógeno: MHX 2) Se intercambian las valencias (recuerda que el hidrógeno tiene valencia 1) B) Nomenclatura 1) Sistemática prefijo+HIDRURO DE NOMBRE DEL METAL Ej. CaH2: Dihidruro de calcio indica número de átomos 2) De Stock HIDRURO DE NOMBRE DEL METAL (Valencia del metal) Ej. FeH2: Hidruro de hierro(II) en números romanos 7. Completa la siguiente tabla teniendo en cuenta el ejemplo resuelto: FÓRMULA VAL ELEM. Hidruro 2 Ca CaH2 2 Fe FeH2 3 Fe NOMENCLATURA SISTEMÁTICA DE STOCK Dihidruro de calcio Hidruro de calcio Cu Cu Li 8.- Nombra los siguientes hidruros metálicos utilizando la nomenclatura sistemática y de Stock. NOMENCLATURA FÓRMULA SISTEMÁTICA DE STOCK SnH2 PbH4 AuH3 MgH2 AlH3 NiH2 ZnH2 CdH2 SnH4 9 PbH2 KH 9. Formula los siguientes hidruros metálicos: NOMENCLATURA NOMENCLATURA FÓRMULA Hidruro de potasio Tretrahidruro de plomo Hidruro de calcio Dihidruro de magnesio Dihidruro de hierro Monohidruro de oro Trihidruro de aluminio Hidruro de estaño (II) Hidruro de cobre (I) Hidruro de oro (III) Hidruro de cobalto (III) Hidruro de bario FÓRMULA b) HIDRUROS NO METÁLICOS Las combinaciones binarias del hidrógeno con los elementos carbonoideos y nitrogenoideos no se nombran como hidruros. Todos ellos tienen nombres especiales no sistemáticos: CH 4 : Metano SiH4 : Silano NH3 : Amoniaco PH3 : Fosfano (1) AsH3 : Arsano (2) SbH3 : Estibano (3) (1) Antes fosfina Antes arsina (3) Antes estibina (2) Los hidruros del boro merecen una mención aparte por sus características especiales. La especie BH3 (borano), no existe. El hidruro más sencillo es el B2H6, llamado diborano. 10 Las recomendaciones de la IUPAC indican que el número de átomos de boro se indique con un prefijo multiplicador, poniendo entre paréntesis el número de átomos de hidrógeno con el número arábigo apropiado: B2H6 diborano(6) B4H10 tetraborano(10) Las combinaciones binarias del hidrógeno con los no metales del grupo de los anfígenos y halógenos no se consideran hidruros. El halógeno o anfígeno, como son más electronegativos que el hidrógeno, funcionan con el estado de oxidación negativo y deberán situarse a la derecha a la hora de escribir la fórmula. Se nombran terminando en URO el nombre del halógeno o anfígeno. Los cuatro son gases y cuando se disuelven en agua se comportan como ácidos (ácidos hidrácidos) por lo que también pueden nombrase con la palabra ácido-nombre del elemento-terminación HIDRICO. HF : Fluoruro de hidrógeno o fluorano , disolución acuosa: ácido fluorhídrico HCl : Cloruro de hidrógeno o clorano , disolución acuosa: ácido clorhídrico HBr : Bromuro de hidrógeno o bromano , disolución acuosa: ácido bromhídrico HI : Yoduro de hidrógeno o yodano, disolución acuosa: ácido yodhídrico H2S : Sulfuro de hidrógeno o sulfano , disolución acuosa: ácido sulfhídrico A)Formulación de Hidruros con carácter ácido 1) Hx A En primer lugar se coloca el símbolo del hidrógeno y después el del no metal. 2) Después se intercambian las valencias (el hidrógeno siempre tiene valencia I) B)Nomenclatura 1) Sistemática prefijo+ NOMBRE DEL NO METAL+ URO DE HIDRÓGENO o NOMBRE DEL NO METAL+ANO indica número de de átomos Ej. HF Fluoruro de hidrógeno o fluorano 2) Tradicional En disolución acuosa, los compuestos de hidrógeno con los elementos de los grupos 16 (S, Se y Te) y 17 (F,CI,Br, y I) dan disoluciones acidas y reciben el nombre de ácidos hidrácidos. ÁCIDO NOMBRE NO METAL+ -HÍDRICO Ej. HF (aq): Ácido fluorhídrico Los hidruros de los elementos de los grupos 13,14 y 15, como el B,N,P,As,Sb,C y Si; se nombran según la nomenclatura sistemática, a pesar de que la IUPAC todavía admite también el nombre común o 11 tradicional. NOMENCLATURA HIDRURO SISTEMÁTICA TRADICIONAL BH3 NH3 PH3 AsH3 SbH3 CH4 SiH4 10.- Completa la tabla siguiente teniendo en cuenta el ejemplo resuelto. FÓRMULA VAL. NO Metal 1 F 1 Cl 1 Br 1 I 2 S 2 Se 2 Te HIDRURO No Metálico HF NOMENCLATURA DISOLUCIÓN SISTEMÁTICA ACUOSA (Tradicional) Fluoruro de hidrógeno Fluorano Ácido fluorhídrico 11.- Nombra los siguientes hidruros no metálicos utilizando la nomenclatura sistemática y tradicional NOMENCLATURA FÓRMULA SISTEMÁTICA TRADICIONAL o disolución acuosa HCl H 2S HBr NH3 12 SbH3 HF CH4 PH3 12.- Formula los siguientes hidruros no metálicos: NOMENCLATURA FÓRMULA NOMENCLATURA Fluoruro de hidrógeno Ácido clorhídrico Cloruro de hidrógeno Trihidruro de boro Sulfuro de hidrógeno Ácido bromhídrico Yoduro de hidrógeno Seleniuro de hidrógeno Trihidruro de nitrógeno Ácido sulfhídrico Tetrahidruro de carbono Trihidruro de fósforo Metano Amoniaco FÓRMULA 4. OTRAS COMBINACIONES NO METAL+NO METAL Los no metales pueden combinarse entre sí para dar compuestos binarios. La terminación URO del nombre del no metal más electronegativo (que se escribirá a la derecha) es característica de estos compuestos. El orden es el indicado debajo de menos a más electronegativo, por tanto el más electronegativo es el F. Ejemplos: SF6 ; PCl3 ; CCl4 ; SiCl4 ; PCl5 ; CS2 SF6: hexafluoruro de azufre, CCl4: tetracloruro de carbono 13 13.- Nombra y/o formula las siguientes combinaciones de No Metal y no metal NOMENCLATURA Fórmula STOCK SISTEMÁTICO C3N2 P2S5 BP P2S3 SeI4 NOMENCLATURA Yoduro de selenio(II) Pentasulfuro de diarsénico Nitruro de boro Yoduro de nitrógeno(V) Bromuro de carbono(IV) FÓRMULA 5. SALES BINARIAS A)Formulación 1) MaAm En primer lugar se coloca el símbolo del metal y después el del no metal. 2) Después se intercambian las valencias. 3) Si se puede se simplifica B)Nomenclatura 1) De Stock NOMBRE NO METAL + URO DE NOMBRE DEL METAL (Valencia del metal en números romanos) Ej. PCl3 Cloruro de fósforo (III) 2) Sistemática prefijo+ NOMBRE DEL NO METAL+ URO DE prefijo+ NOMBRE DEL METAL indica número de de átomos Ej. Fe2S3 Trisulfuro de dihierro Las combinaciones binarias no metal - metal reciben el nombre de sales haloideas. Los no metales pertenecen al grupo de los halógenos y anfígenos. 14 La terminación en URO del no metal es característica de estos compuestos. Cuando los metales que se combinan tienen estado de oxidación fijo (alcalinos, alcalino-térreos, Ag, Zn, Al... etc), está permitido omitir los prefijos numerales (nomenclatura sistemática) o el estado de oxidación (Stock) en el nombre del compuesto, ya que no existe ninguna ambigüedad: Cloruro de sodio, sulfuro de magnesio, cloruro de plata... etc. En estos casos se debe tener especial cuidado a la hora de formular. Se debe de tener en cuenta el estado de oxidación del metal y del no metal y formular el compuesto correspondiente cruzando, como subíndices, los correspondientes números de oxidación. Si los subíndices resultantes son divisibles por un mismo número es obligatorio simplificar. PbS2 Solución (sistemática): Disulfuro de plomo Solución (Stock):Sulfuro de plomo(IV) 14.- Completa la siguiente tabla teniendo en cuenta el ejemplo resuelto: NOMENCLATURA FÓRMULA Hidruro Element Sal Val. No o Binaria Metálico HCl 2 Ca HCl 2 Fe HCl 3 Fe HCl 4 Pb H 2S 2 Ca H 2S 2 Fe H 2S 3 Fe H 2S 4 Pb CaCl2 SISTEMÁTICA TRADICIONAL Dicloruro de calcio Cloruro de calcio 15.- Nombra las siguientes sales binarias utilizando la nomenclatura sistemática y de Stock: NOMENCLATURA FÓRMULA SISTEMÁTICA STOCK NaCl MgCl2 K 2S MnS CCl4 15 Li2S FeBr3 PbI2 Au2S3 SiCl4 PCl5 CoI2 NaF CdCl2 BaS Ni2Se3 ZnTe 16.- Formula las siguientes sales binarias: NOMENCLATURA NOMENCLATURA FÓRMULA Cloruro de magnesio Cloruro de fósforo (III) Sulfuro de hierro (III) Cloruro de sodio Tricloruro de fósforo Tetracloruro de carbono Sulfuro de hierro (II) Cloruro de fósforo (V) Yoduro de hierro (III) Fluoruro de bario 17.- Nombra los siguientes compuestos: NOMENCLATURA FÓRMULA SISTEMÁTICA STOCK Fe2O3 CaO2 CO2 CdH2 SO2 16 FÓRMULA HCl Al2O3 CH4 SO3 H 2S Ca(CN)2 NH3 Au2O3 Cl2O3 PbO SiH4 P2O5 N2O3 CuH (NH4)2S 18.- Formula los siguientes compuestos: NOMENCLATURA NOMENCLATURA FÓRMULA Óxido de azufre (VI) Trióxido de dioro Ácido clorhídrico Sulfuro de hidrógeno Hidruro de cobre (I) Dihidruro de cadmio Heptaóxido de dicloro Monóxido de cobre Hidruro de hierro (II) Trihidruro de nitrógeno Óxido de cadmio Óxido de plata Óxido de cobre (II) Hidruro de plomo (IV) Hidruro de magnesio Óxido de nitrógeno (III) Óxido de sodio Trihidruro de antimonio Yoduro de hidrógeno Trióxido de dibromo 17 FÓRMULA 6. HIDRÓXIDOS A)Formulación 1) M (OH)x En primer lugar se coloca el símbolo del metal y después el grupo hidroxilo (OH). 2) Después se intercambian las valencias, recuerda que el OH tiene valencia 1 B)Nomenclatura 1) Sistemática prefijo+ HIDRÓXIDO DE NOMBRE DEL METAL indica número de de átomos Ej. Ca(OH)2 Dihidróxido de calcio 2) De Stock HIDRÓXIDO + DE NOMBRE DEL METAL (Valencia del metal en números romanos) Ej. Fe(OH)2 Hidróxido de hierro (II) 19.- Nombra los siguientes hidróxidos utilizando la nomenclatura sistemática y de Stock: NOMENCLATURA FÓRMULA SISTEMÁTICA STOCK NaOH KOH Al(OH)3 Fe(OH)2 Cd(OH)2 Au(OH)3 Fe(OH)3 Li(OH) Ba(OH)2 Cu(OH)2 Mn(OH)2 Ni(OH)3 18 20.Formula los siguientes hidróxidos: NOMENCLATURA FÓRMULA NOMENCLATURA Hidróxido de aluminio Trihidróxido de oro Dihidróxido de hierro Hidróxido de mercurio (II) Dihidróxido de cobre Hidróxido de plata Hidróxido de hierro (II) Hidróxido de oro (I) Hidróxido de calcio Hidróxido de bario Trihidróxido de oro Hidróxido de Cobalto (II) Hidróxido de plata Hidróxido de platino (IV) Dihidróxido de mercurio Hidróxido de cinc Hidróxido de estaño (II) Hidróxido de sodio Hidróxido de cadmio Hidróxido de magnesio Hidróxido de berilio Dihidróxido de manganeso FÓRMULA 7. ÁCIDOS OXÁCIDOS Son compuestos ternarios formados por los siguientes elementos: Hidrógeno + No metal + Oxígeno A)Formulación Obedecen a la fórmula: HaXbOc. En esta a, b y c son los subíndices, y X es casi siempre un NO METAL, aunque también puede ser un metal de transición como el Cr y el Mn. Para determinar la valencia con la que actúa X, tenemos que tener en cuenta que en este caso el Oxígeno actúa con valencia -2 y el Hidrógeno +1. Y como el compuesto es neutro: a.(+1) + z. b + c . (-2) = 0 Con un ejemplo lo entenderemos mejor: +2 +6 −8 H 2 S O4 +1 El azufre actúa con valencia 6 −2 Para obtener el ácido en primer lugar se obtiene el óxido y a continuación se le añade una molécula de agua. Ejemplo: C (val 4); C2O4 = CO2 + H2O = H2CO3 19 B)Nomenclatura 1) Tradicional ÁCIDO prefijo + nombre del no metal + sufijo Los prefijos y sufijos se colocan en función del número de valencias que tenga el elemento no metálico. NÚMERO DE PREFIJOS (de menor a NÚMERO DE PREFIJOS (de menor a VALENCIAS mayor) VALENCIAS mayor) 1 - HIPO- -OSO -OSO 2 3 -OSO 4 -ICO -ICO HIPO- -OSO PER- -ICO -OSO -ICO 2) Sistemática Prefijo+ OXO+ NOMBRE DEL NO METAL + -ATO(valencia NM.en romanos sin espacio entre los números romanos y -ato) DE HIDRÓGENO +2 +6 −8 Ej: H 2 S O4 : tetraoxosulfato(VI) de hidrógeno +1 −2 21.- Completa la siguiente tabla teniendo en cuenta el ejemplo resuelto: NOMENCLATURA FÓRMULA VAL. ELEM. ÓXIDO ACIDO TRADICIONAL SISTEMÁTICA 2 C CO H2O+CO=H2CO2 Ácido carbonoso Dioxocarbonato(II) de hidrógeno 4 C CO2 H2O+CO2=H2CO3 Ácido carbónico Trioxocarbonato(IV) de hidrógeno 1 Cl 3 Cl 5 Cl 7 Cl 2 S 4 S 6 S 20 22.- Nombra los siguientes ácidos oxácidos utilizando nomenclatura tradicional y sistemática: NOMENCLATURA FÓRMULA TRADICIONAL SISTEMÁTICA HClO HIO2 HBrO3 HClO2 H2CO3 H2SO4 HNO3 H2SO3 HClO4 HBrO HNO2 HBrO3 23.- Formula los siguientes ácidos oxácidos: NOMENCLATURA NOMENCLATURA FÓRMULA Ácido nítrico Ácido sulfuroso Ácido hipocloroso Ácido clórico Ácido sulfúrico Ácido nítrico Ácido cloroso Ácido perclórico Ácido nitroso Ácido carbónico Ácido carbonoso Ácido bórico 21 FÓRMULA 24.- Nombra los siguientes compuestos, completando las columnas que sean posibles. NOMENCLATURA FÓRMULA SISTEMÁTICA STOCK TRADICIONAL HBr H2CO3 HIO3 ZnO Al(OH)3 Cr2O3 AlCl3 Ni2O3 CuBr2 PCl5 H 2S CaH2 HCl HIO2 PbO2 CoO H2Se H2SO2 PH3 25.- Formula los siguientes compuestos: NOMENCLATURA NOMENCLATURA FÓRMULA Óxido de hierro (II) Sulfuro de aluminio Cloruro de bario Cloruro de hidrógeno Bromuro de sodio Ácido perclórico Sulfuro de mercurio (II) Óxido de plata Amoniaco Óxido de fósforo (V) Ácido sulfhídrico Teluro de bario 22 FÓRMULA Hidróxido de hierro (II) Ácido arsénico Dióxido de estaño Hidruro de calcio Hidróxido de estaño (II) Dioxonitrato (III) de hidrógeno Ácido clorhídrico Metano Dióxido de carbono Dihidróxido de manganeso Monóxido de carbono Ácido perbrómico Trioxoclorato (V) de hidrógeno Hidróxido de niquel (III) Óxido de Cobre (II) Trióxido de azufre Ácido cloroso arsina Trihidruro de nitrógeno Monóxido de carbono Cloruro de sodio Sulfuro de calcio Ácido hipocloroso Disulfuro de plomo Ácido yodhídrico Nitrógeno Óxido de cobre Ácido telurhídrico Ácido arsenioso Oxoclorato (I) de hidrógeno 7.1.ÁCIDOS DEL MANGANESO Y EL CROMO El manganeso y el cromo, aunque son metales, también forman ácidos oxoácidos. En este caso lo hacen con valencia 6 y 7 para el manganeso y con valencia 6 para el cromo. 26.- Completa la siguiente tabla: NOMENCLATURA FÓRMULA VAL. ELEM. ÓXIDO ACIDO TRADICIONAL 6 Mn Mn2O6=MnO3 Ácido mangánico 7 Mn Mn2O7 Ácido permangánico 6 Cr Cr2O6=CrO3 Ácido crómico 6 Cr Cr2O6 Ácido dicrómico SISTEMÁTICA 7.2. ÁCIDOS POLIHIDRATADOS Solamente pueden formar ácidos polihidratados (con más de 1 molécula de agua) los siguientes elementos: P, As, Sb y Si. 23 Para poder distinguirlos entre si, hay que anteponer en la nomenclatura tradicional un prefijo que indique el número de moléculas de agua utilizadas, así: Nº MOLÉCULAS DE AGUA PREFIJO 1 META 2 PIRO 3 ORTO o sin prefijo 27.- Completa la siguiente tabla teniendo en cuenta el ejemplo resuelto: NOMENCLATURA FÓRMULA VAL. ELEM. ÓXIDO ACIDO TRADICIONAL SISTEMÁTICA 3 P P2O3 1 P2O3 + H2O=H2P2O4 =HPO2 Ácido metafosforoso Dioxofosfato(III) de hidrógeno 3 P P2O3 2 P2O3 + 2H2O= H4P2O5 Ácido pirofosforoso Pentaoxodifosfato(III) de hidrógeno 3 P 3 5 As 1 5 As 2 5 As 3 Ácido (orto)fosforoso 28.- Nombra los siguientes ácidos oxoácidos polihidratados utilizando la nomenclatura tradicional y sistemática: NOMENCLATURA FÓRMULA TRADICIONAL SISTEMÁTICA HPO2 H4As2O5 H3SbO3 HSbO3 H4P2O7 H3AsO4 H4SiO4 HSbO2 H4As2O7 H3SbO4 H2SiO3 24 29.- Formula los siguientes ácidos oxoácidos polihidratados: NOMENCLATURA FÓRMULA Ácido metaarsenioso Ácido piroantimonioso Ácido ortofosforoso Ácido piroarsénico Ácido metaantimonioso Ácido silicico Dioxoarseniato(III) de hidrógeno Heptaoxodiantimoniato(v) de hidrógeno Trioxofosfato(III) de hidrógeno Heptaoxodiarseniato(v) de hidrógeno Pentaoxosilicato(IV) de hidrógeno NUEVA NOMENCLATURA de los OXOÁCIDOS de la IUPAC 2005 El objetivo de la nomenclatura sistemática es que el nombre refleje la composición del compuesto, y hoy en día se pide más, que incluso refleje la composición estructural del compuesto. Los oxácidos la IUPAC propone en las normas 2005 dos nomenclaturas, aparte de admitir como válida la tradicional vista anteriormente, una es la nomenclatura de adición y otra es la nomenclatura de hidrógeno. La nomenclatura de adición se basa en la estructura de los ácidos, nombrando de diferente forma los oxígenos que están unidos a los hidrógenos ácidos (hidróxido), los oxígenos unidos únicamente al elemento central (oxido). Cada uno de estos nombres se acompaña de los prefijos pertinentes: di-, tri-, tetra-, etc. y se nombran por orden alfabético seguidos del nombre del átomo central Prefijo-hidróxido-prefijo-oxido-ELEMENTO CENTRAL La nomenclatura de hidrógeno se basa en nombrar con un prefijo: di-, tri-, tetra-, etc. los hidrógenos del ácido (se usa la palabra "hidrogeno" sin tilde pero enfatizada en la sílaba "dro") seguido del nombre de adición del anión terminado en "-ato" entre paréntesis y unido sin espacios a la palabra "hidrogeno". Prefijo-hidrógeno(prefijo-oxido-ELEMENTO CENTRAL-ato) 25 F. Estructural Nomenclatura de adición Fórmula HClO HClO2 HClO3 HClO4 H2SO3 H2SO4 HNO2 HNO3 H3PO3 H3PO4 H2CO3 H4SiO4 H2CrO4 H2Cr2O7 H2MnO4 HMnO4 Nomenclatura de hidrógeno Cl(OH) ClO(OH) ClO2(OH) ClO3(OH) SO(OH)2 SO2(OH)2 NO(OH) NO2(OH) P(OH)3 PO(OH)3 CO(OH)2 Si(OH)4 CrO2(OH)2 (HO)Cr(O)2OCr(O)2( OH) MnO2(OH)2 MnO3(OH) hidroxidocloro hidroxidooxidocloro hidroxidodioxidocloro hidroxidotrioxidocloro dihidroxidooxidoazufre dihidroxidodioxidoazufre hidroxidooxidonitrógeno hidroxidodioxidonitrógeno trihidroxidofósforo trihidroxidooxidofósforo dihidroxidooxidocarbono tetrahidroxidosilicio dihidroxidodioxidocromo µoxidobis(hidroxidodioxidocromo)* dihidroxidodioxidomanganeso hidroxidotrioxidomanganeso hidrogeno(oxidoclorato) hidrogeno(dioxidoclorato) hidrogeno(trioxidoclorato) hidrogeno(tetraoxidoclorato) dihidrogeno(trioxidosulfato) dihidrogeno(tetraoxidosulfato) hidrogeno(dioxidonitrato) hidrogeno(trioxidonitrato) trihidrogeno(trioxidofosfato) trihidrogeno(tetraoxidofosfato) dihidrogeno(trioxidocarbonato) tetrahidrogeno(tetraoxidosilicato) dihidrogeno(tetraoxidocromato) dihidrogeno(heptaoxidodicromato) dihidrogeno(tetraoxidomanganato) hidrogeno(tetraoxidomanganato) * En los ejercicios se usará en vez de la letra griega "µ" la letra "m", pero sólo por necesidades del teclado. 26 8. CATIONES Y ANIONES Átomos (iones monoatómicos) o conjunto de átomos (iones poliatómicos) con carga eléctrica Iones con carga eléctrica positiva: CATIONES Iones con carga eléctrica negativa: ANIONES Cationes monoatómicos: cationes metálicos Cu2+ Catión (ion) cobre(II) Aniones monoatómicos: aniones no metálicos S2- Anión (ion) sulfuro Cationes poliatómicos NH4+ Ion (catión) amonio H3O+ Ion (catión) oxonio 30.- Nombra y/o formula los siguientes iones ION NOMENCLATURA ION Li+ NOMENCLATURA Catión mercurio(I) Fe3+ N3- O22- Ion fosfuro Ion cesio Ba2+ Catión calcio B3- Aniones poliatómicos Son los grupos atómicos que resultan de quitar los hidrógenos a los oxoácidos. Nomenclatura tradicional Para nombrar: Obtener el estado de oxidación del átomo central: la suma algebraica de los estados de oxidación debe ser igual a la carga del ion: (SO4)2n + 4 (-2) = - 2 ; n = + 6 (+6) : ico -> ato -> anión sulfato Para formular: Determinar el estado de oxidación del átomo central a partir de la terminación. Escribir el ácido correspondiente, quitarle los hidrógenos y obtener el anión: Anión nitrato: ato :(+5) -> ácido nítrico : HNO3 -> NO3 – ion nitrato En el caso de que el anión todavía conserve algún átomo de Hidrógeno, se nombra anteponiendo el prefijo que indica el número de átomos de H, seguido de la palabra Hidrógeno. Ejemplos: ÁCIDO ION Ácido sulfúrico H2SO4 Ion hidrógenosulfato H2SO4- Ácido fosforoso H3PO3 Ion dihidrógenofosfito H2PO3- 27 Nomenclatura sistemática Se nombran de la siguiente forma: ION+ prefijo del nºátomos de oxígeno+OXO+nombre átomo central+ATO (valencia del átomo central en números romanos) EJ: SO42- ion tetraoxosulfato(VI) 31.- Nombra y/o formula los siguientes iones ION NOMENCLATURA ION NO2 - NOMENCLATURA Ion cromato SO42- CO3 2- HCO3- Ion fosfuro Cr2O72- Ion permanganato Ion perbromato Ion fosfato Sistema EWENS-BASSET: se nombran con la palabra ION y el nombre del elemento seguido, sin espacio, del número de carga con el signo CATIÓN + K Na+ Mg2+ Ca2+ Al3+ Fe2+ Fe3+ Cu2+ Cu+ Nombre de Ewens-Bassett Ion potasio(1+) Ion sodio(1+) Ion magnesio(2+) Ion calcio(2+) Ion aluminio(3+) Ion hierro(2+) Ion hierro(3+) Ion cobre(2+) Ion cobre(1+) ANIÓN H– B3– C4– Si4– N3– P3– H– Nombre de Ewens-Bassett Ion hidruro(1–) Ion boruro(3–) Ion carburo(4–) Ion siliciuro(4–) Ion nitruro(3–) Ion fosfuro(3–) Ion hidruro(1–) 28 9. SALES IÓNICAS POLIATÓMICAS Combinación: catión metálico (Al3+, Cu2+, Na+) o un ion poliatómico (CO3 2- Anión poliatómico procedente de un ácido(HCO3-, SO4 , CO3 2- 2- , NH4+) + ) 32.- Nombra y/o formula los siguientes iones Na+ Cu2+ ion cobre (II) CO3 2Ion carbonato Na2CO3 Carbonato sódico CuCO3 Carbonato de cobre(II) PO43-, NO3 - SO42- Mg2+ Al3+ Co3+ Ag+ Na+ CO3 2Ion trioxocarbonato(IV) Na2CO3 Tioxocarbonato(IV) de sodio NO3 - SO42 Au+ Hg2+ Son compuestos ternarios o cuaternarios formados (***) por estos elementos: METAL + NO METAL + OXIGENO Se forman sustituyendo los hidrógenos del oxoácido correspondiente por cationes metálicos, teniendo en cuenta el estado de oxidación con el que actúan. 29 A)Formulación Formulamos el oxoácido correspondiente HaXbOc, si el metal M, actúa con valencia d, se coloca en lugar del hidrógeno y le pasa su valencia al grupo XbOc, quedando: Ma(XbOc), quedando: Ma(XbOc)d. B)Nomenclatura 1) Sistemática Prefijo+OXO+NOMBRE NO METAL+ -ATO (Valencia del no metal en números romanos) DE NOMBRE DEL METAL Ej. (valencia del metal en números romanos) Cu2SO4: tetraoxosulfato (VI) de cobre (I) 2) De Stock Prefijo+NOMBRE NO METAL+ sufijo DE NOMBRE DEL METAL (valencia del metal en números romanos En la nomenclatura deStock los prefijos de los ácidos se cambian por –ITO y –ATO quedando de la siguiente forma: Nº de VALENCIAS PREFIJOS (menor a Nº de VALENCIAS mayor) - 1 PREFIJOS (menor a mayor) HIPO- -ITO 4 -ITO 2 -ITO (oso) -ATO (ico) -ATO HIPO- -ITO 3 PER- -ATO -ITO -ATO Ej. HClO: Ácido hipocloroso a) Cu (1) →CuClO: Hipoclorito de cobre (I) b) Cu (2) →Cu(ClO)2 : Hipoclorito de cobre (II) 30 33.- Completa la siguiente tabla teniendo en cuenta el ejemplo resuelto: NOMENCLATURA FÓRMULA VAL. METAL. ÁCIDO 2 Fe HNO3 3 Fe HNO3 1 Cu H2SO4 Cu H2SO4 Mg HClO3 Na HClO Ag H2SO3 Cu HNO2 Cu HNO2 Ca HClO4 Ca H4P2O7 STOCK SAL Fe(NO3)2 SISTEMÁTICA Nitrato de hierro (II) Trioxonitrato (V) de hierro (II) 34.- Formula las siguientes sales ternarias: NOMENCLATURA NOMENCLATURA FÓRMULA Clorato de sodio Trioxoclorato (I) de sodio Carbonato de hierro (II) Trioxosulfato (IV) de mercurio (I) Sulfato de potasio Trioxonitrato (V) de hierro(II) Sulfito de plomo (IV) Trioxocarbonato (IV) de plomo (II) Nitrito de mercurio (I) Dioxonitrato (III) de plata Nitrito de cobre (II) Tetraoxosulfato (VI) de potasio (orto)fosfato de calcio Heptaoxodifosfato (V) de sodio Trioxosulfato (IV) de niquel (III) Heptaoxodicromato (VI) de potasio Fosfato de aluminio Cromato de hierro (II) Permanganato de potasio Nitrato de magnesio 31 FÓRMULA 35.- Formula las siguientes sales ternarias: NOMENCLATURA NOMENCLATURA FÓRMULA Sulfato de aluminio Trioxosulfato (IV) de sodio Hipoclorito de estaño (II) Carbonato de calcio Fosfato de hierro (III) Trioxoclorat (V) de calcio Permanganato de potasio Sulfito de cobalto (II) Dicromato de zinc Tetraoxofosfato (V) de aluminio Sulfato de cobre (I) Hiposulfito de mercurio (II) Trioxonitrato (V) de cobre (II) Clorato de bario Heptaoxodifofato(V) de sodio Peryodato de estroncio Bromato de Cadmio Silicato de calcio Pirohipofosfito de Niquel (III) Seleniato de mercurio (I) FÓRMULA 36.- Formula los siguientes compuestos: NOMENCLATURA NOMENCLATURA FÓRMULA Ácido clorhídrico Permanganato de plata Cloruro de aluminio Yoduro de zinc Óxido de fósforo (V) Sulfato de litio Carbonato de bario Trioxosulfato (IV) de hidrógeno Ácido nítrico Acido nitroso Hidróxido de calcio Trióxido de dicobalto Fluoruro de calcio Hidruro de cobre (II) Tetracloruro de carbono Amoniaco Dicloruro de estaño Trioxoclorato (V) de hidrógeno Sulfato de estaño (II) Carbonato de manganeso (II) Yodito de mercurio (I) Trioxonitrato (V) de cobalto (III) Estibano Ácido metaantimónico 32 FÓRMULA 37.- Nombra los siguientes compuestos: NOMENCLATURA NOMENCLATURA FÓRMULA FÓRMULA Br- Ag2S HIO3 S2- AlCl3 NaBrO3 Al(OH)3 NaNO2 Al2(SO4)3 BaS HgO FeCl2 PO4 3- PH3 CoCl2 HgI2 CuI2 SnCl2 H2S (aq) PbS2 CuSO4 Cu(NO3)2 Cr2(SO4)3 FeCO3 KClO4 KBrO2 FeSO4 AuF3 AgNO2 Al2S3 MgSO2 KI NH4NO3 Na2O NH4Cl CsI SrBr2 NaPO2 HMnO4 Cr2O3 SO3 Cu(IO2)2 HgO H2O2 FeH3 Ca(ClO)2 MnO2 H3SbO4 33