universidad veracruzana
Anuncio

UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS REGIÓN POZA RICA -TUXPAN “ANÁLISIS DE LA EFICIENCIA DE SEPARACIÓN CONSIDERANDO EL DISEÑO DEL PLATO EN LA DESTILACIÓN EXTRACTIVA DE LA MEZCLA ETANOL – AGUA A TRAVÉS DE ASPEN PLUS” TESIS PARA ACREDITAR EL EXAMEN DEMOSTRATIVO DE LA EXPERIENCIA RECEPCIONAL EN EL PROGRAMA DE INGENIERÍA QUÍMICA PRESENTA: RUBÍ ESMERALDA GARCÍA VELÁZQUEZ DIRECTOR DE TESIS: M.C. CARLOS ANTONIO MÁRQUEZ VERA POZA RICA DE HIDALGO VER. SEPTIEMBRE 2014 AGRADECIMIENTOS A Dios le agradezco por haberme acompañado y guiado a lo largo de mi carrera, por ser mi fortaleza en los momentos de debilidad al estar lejos de casa, por brindarme una vida llena de aprendizajes, experiencias y sobre todo felicidad a lado de familiares y amigos. Le doy gracias a mis padres Marcelo y Margarita por apoyarme en cada decisión que he tomado desde pequeña hasta el día de hoy que culmino mis estudios de licenciatura, por los valores que me han inculcado y las enseñanzas que me han otorgado, por haberme dado la oportunidad de tener una excelente educación en el transcurso de mi vida. Sobre todo porque son un excelente ejemplo a seguir, mi triunfo es de ustedes. A mis hermanos Oscar Marcelo y Juan Ángel, gracias por formar parte de mi vida porque son un gran complemento para representar la familia que somos, por cada momento de juegos, de compañía y de travesuras. Por la inspiración que me han dado para estudiar y salir a delante en cada adversidad. A mis amigos por confiar y creer en mí, ustedes hicieron de mi etapa universitaria un trayecto de vivencias que nunca olvidare. Gracias ingeniero Carlos Antonio Márquez Vera por creer en mí, por haberme brindado la oportunidad de desarrollar mi tema profesional y por todo lo que me ha enseñado durante la carrera. CONTENIDO Pág. Introducción…………………………………………………………………….. 8 Planteamiento del problema…………………………………………………. 10 Justificación…………………………………………………………………….. 10 Hipótesis……………………………………………………………………….... 11 Objetivos……………………………………………………………………….... 11 Capitulo I.- Marco teórico y antecedentes……………………………….... 12 1.1 Equilibrio de fases…………………………………………………………... 12 1.1.1 Equilibrio de fases para un sistema multicomponente…………. 1.1.2 Sistemas termodinámicos…………………………………………. 1.1.3 Ecuaciones de estado……………………………………………... 1.1.4 Azeótropos………………………………………………………….. 14 15 17 22 1.2 Operación unitaria de destilación…………………………………………. 27 1.2.1 Características de la destilación………………………………….. 1.2.2 Operaciones industriales y componentes de las torres de destilación…………………………………………………………………. 28 1.3 Destilación extractiva………………………………………………………. 32 1.3.1 Separación de mezclas azeotrópicas……………………………. 1.3.2 Variación del equilibrio por agentes másicos de separación….. 1.3.3 Solvente empleados en la destilación extractiva……………….. 1.3.4 Tipos de platos (bubble cap, sieve, glitsh ballast, koch flexitray y nutter float valve)……………………………………………………….. 1.3.4.1 Características termodinámicas consideradas para la elección de platos……………………………………………………. 32 36 36 1.4 Simulación de Aspen Plus…………………………………………………. 47 1.4.1 Utilidad y aplicaciones de Aspen Plus en ingeniería química…. 1.4.2 Parámetros del sistema de destilación extractiva………………. 47 50 Capítulo II.- Metodología............................................................................ 51 2.1 Elección del solvente y revisión de las ecuaciones de estado………… 2.2 Condiciones de operación más adecuados para el proceso de destilación extractiva……………………………………………………………. 51 30 38 46 53 CONTENIDO 2.2.1 Flujos………………………………………………………………… 2.2.2 Número de platos…………………………………………………... 2.2.3 Relación de reflujo…………………………………………………. 53 55 56 2.3 Variación del diseño del plato empleado en la columna extractiva…… 57 2.3.1 Tipo de plato………………………………………………………... 2.3.2 El diámetro del plato……………………………………………….. 2.3.3 Altura del vertedero para el plato………………………………… 2.3.4 Espaciamiento entre platos de la torre…………………………... 58 59 60 61 Capítulo III.- Resultados y discusión………………………………………. 62 3.1 Elección del solvente para la destilación extractiva…………………….. 62 3.2 Análisis de las condiciones de operación de la torre de destilación extractiva…………………………………………………………………………. 62 3.3 Efecto del diseño de plato en la eficiencia de separación……………... 65 CONCLUSIONES……………………………………………………………….. 75 CONTENIDO DE TABLAS.......................................................................... 76 CONTENIDO DE FIGURAS…………………………………………………… 77 BIBLIOGRAFÍA…………………………………………………………………. 79 INTRODUCCIÓN Con el avance de la tecnología en los países desarrollados, la industria química debe encontrar procesos eficientes, eficaces y rentables para mejorar la producción de los diferentes productos que se manejan en la actualidad, para conocer el proceso sin hacerlo a gran escala, los ingenieros químicos tenemos la facultad de realizar simulaciones con los diferentes softwares, en este trabajo utilizamos el simulador Aspen Plus. La simulación de un proceso nos representa de forma esquematizada las características a analizar, como la fabricación, si el costo es competitivo en el área laboral, para saber si el servicio que se presenta será de gran utilización para los clientes, sobre todo los elementos y el tiempo que se deben emplear. En este trabajo se analizará el comportamiento del equilibrio de fases en la mezcla azeotrópica etanol – agua con la ayuda del simulador Aspen Plus para lograr una pureza mayor del 90% de etanol , considerando el efecto que tiene la elección del solvente, el tipo de plato así como sus diferentes características que incluyen al diámetro, altura de vertedero, distancia de los platos en la torre, del mismo modo se tomarán en cuenta las condiciones más adecuadas de operación en la torre de destilación, considerando flujos, número de platos y relación de reflujo, para realizar un estudio más sofisticado se dividió el trabajo en tres capítulos, los cuales abarcan cada uno de los puntos antes mencionados. En análisis del proceso se ejecuta en base a los términos termodinámicos estudiados a lo largo de la carrera como las ecuaciones de estado, en que consiste un azeótropo, en el primer capítulo se deja en claro las características y los tipos de la destilación, profundizando más en la extractiva que es con la que se trabajó en la simulación para un mejor resultado, de igual forma se mencionan los tipos de platos y sus características, para conocer las condiciones de operación. Se da un 8 INTRODUCCIÓN panorama de lo que consiste una simulación y la utilidad que se tiene al manejar el programa de Aspen Plus. El segundo capítulo es la metodología del proyecto, elemento primordial ya que se presenta el desarrollo de la simulación, se hace la elección del solvente que por sus propiedades es el etilenglicol, se detallan las particularidades de los platos y se determinan datos importantes del que se eligió, en este caso el Bubble Cap. Los resultados se muestran en el tercer y último capítulo, siendo uno de los más importantes, explica y deduce el porqué de los elementos que intervienen durante todo el proceso, uno de los primeros es el solvente para la destilación, ya que debe ser un agente orgánico que no forme otro azeótropo en la mezcla, de igual manera se analizan las condiciones de operación que se utilizaron en la torre de destilación que fueron las estándar y el diseño del plato que se empleó. 9 PLANTEAMIENTO DEL PROBLEMA: El trabajo presenta las condiciones a las cuales se someterá la mezcla azeotrópica etanol – agua por lo que se debe saber la composición de la mezcla con la que saldrá de la torre de destilación, el proceso se analiza ya que el etanol es un factor primordial en el sector industrial y farmacéutico, se utiliza como forma alterna de combustible por lo que se han realizado varios estudios para lograr una mejor purificación, para el seguimiento del desarrollo se determina cuál es el tipo de plato más eficiente y adecuado. El análisis del efecto que tiene la variación en el diseño de platos con la destilación extractiva debe ser rigurosa para poder hacer la mejor elección. JUSTIFICACIÓN Para el uso de energéticos se maneja una amplia gama de sustancias, en este caso el etanol es uno de los más importantes y para su purificación se mostrará un proceso, en el cual su composición con respecto al agua aumenta considerablemente, para que así se tome en cuenta como una opción para ser un aditivo en gasolinas y su manejo como combustible alternativo sea adecuado. Para lograr lo anterior se busca identificar las características benéficas de los platos de las torres de destilación extractiva, la cantidad que se debe emplear para la eficiencia y condiciones que favorezcan el proceso. 10 HIPÓTESIS En base a la simulación se requiere lograr una purificación de más del 90% del compuesto de etanol, sin exceder la cantidad de cien platos en la torre de destilación, recirculando el solvente que se manejara para el amplio ahorro económico que se pretende dar al proceso de destilación, se requiere dar una propuesta para mejorar los procesos que se encuentran en el mercado de la industria química, esto para dar a conocer al etanol azeotrópico como un combustible alterno en la actualidad. OBJETIVOS OBJETIVO GENERAL El objetivo principal es analizar la eficiencia de la simulación en la separación de la mezcla azeotrópica etanol – agua, lograr una pureza mayor del 90% con una composición inicial de 52.27% de etanol y 47.73% de agua y proponer al destilado como un combustible alterno. OBJETIVOS ESPECIFICOS Establecer las condiciones de operación en forma estándar, esto quiere decir que se ha de utilizar los valores de temperatura a 25 °C y una presión de 1 atm. Analizar la variación de diseños y conocer las características de los platos (diámetro, espacio entre platos y vertedero) a manejar durante las corridas de las simulaciones. Optar por el plato que proporcione una mejor extracción de la concentración del etanol en la torre de destilación, para que en el condensador se obtenga un mayor grado de pureza del compuesto. 11 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES 1.1.- EQUILIBRIO DE FASES En la industria química se cuenta con una diversa variedad de mezclas como por ejemplo: etanol-gasolina, bituminosas y cada una de ellas han sido clasificadas por el diferente comportamiento de sus componentes presentes, es por eso que en las operaciones unitarias como la destilación, la absorción o la extracción por mencionar algunos, se relacionan varias fases coexistiendo en el equilibrio. En un equilibrio existe una condición estática en la cual no ocurrirá ningún cambio en las propiedades macroscópicas de un sistema en un determinado tiempo, denominado estado estacionario. Observándolo desde la termodinámica un sistema en estado de equilibrio se encuentra en condiciones tales que no presentan ninguna predisposición para que ocurra un cambio de estado. La termodinámica trata con estados de equilibrio, los cuales tienen un estado de balance, un estado de equilibrio donde no hay potenciales desbalanceados o fuerzas impulsoras dentro de un sistema y no experimenta cambios cuando es aislado de sus alrededores. Existen muchos tipos de equilibrios como por ejemplo: Equilibrio térmico: si se tiene la misma temperatura en todo el sistema, es decir, que no implica diferencial de temperatura, que es la fuerza impulsora para el flujo de calor. Equilibrio mecánico: está relacionado con la presión, y un sistema lo posee si con el tiempo no hay cambio de presión en alguno de sus puntos, sin embargo, al interior del sistema la presión puede variar con la elevación como resultados de efectos gravitacionales. Equilibrio de fases: existe si en un sistema hay dos fases y es cuando la masa de cada fase alcanza un nivel de equilibrio y permanece allí. 12 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES Equilibrio químico: si la composición química del sistema no cambia con el tiempo, es decir, si no ocurren reacciones químicas. Un sistema no estará en equilibrio a menos que se satisfagan los criterios de equilibrio necesarios. (Yunus A. Cengel, 2009) Para la determinación de los datos de una mezcla binaria como lo es el etanol – agua, en equilibrio líquido – vapor las composiciones a establecer son la temperatura y la presión. Los datos con frecuencia se presentan en reportes de destilación, representando el equilibrio de fases, estos son en forma de tablas de fracción molar de vapor y, y fracción molar de líquido x, para un componente en un intervalo de temperatura, teniendo en cuenta que la presión P permanece fija o en un intervalo de presión para una temperatura fija, los valores más manejables son T y P ya que se pueden manipular de una manera accesible conociendo así el comportamiento de la mezcla en diferentes momentos. (Perry, 2010) La composición química de una mezcla no cambia a menos que la temperatura y presión de la mezcla cambien. Esto es una mezcla reactiva ya que tiene diferentes composiciones de equilibrio a presiones y temperaturas distintas. Por lo tanto se considera un sistema reactivo bajo una presión y temperatura establecidas. El equilibrio de dos fases de una sustancia pura como el agua se desarrolla considerando una mezcla de líquido y vapor saturados en equilibrio, bajo una presión y temperaturas especificadas: 𝐺 = 𝑚𝑓 𝑔𝑓 + 𝑚𝑔 𝑔𝑔 Ec. 1.1 Donde gf y gg son las funciones de Gibbs de las fases liquida y de vapor por unidad de masa, si existe un disturbio durante el cual se evapora una cantidad diferencial de líquido dmf que se evapora a temperatura y presión constantes. 13 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES (𝑑𝐺) 𝑇,𝑃 = 𝑔𝑓 𝑑𝑚𝑓 + 𝑔𝑔 𝑑𝑚𝑔 Ec. 1.2 Puesto que gf y gg permanecen constantes bajo una presión y temperatura constantes. En el punto de equilibrio, (𝑑𝐺) 𝑇,𝑃 = 0. A partir del principio de conservación de la masa, 𝑑𝑚𝑔 = −𝑑𝑚𝑓 . Sustituyendo se obtiene: (𝑑𝐺) 𝑇,𝑃 = (𝑔𝑓 − 𝑔𝑔 )𝑑𝑚𝑓 Ec. 1.3 La cual debe ser igual a cero en el punto de equilibrio. Obteniendo: 𝑔𝑓 = 𝑔𝑔 Ec. 1.4 Las dos fases de una sustancia pura se encuentran en equilibrio cuando cada fase tenga el mismo valor de una función específica de Gibbs, como se muestra en la figura 1.1. En el punto triple las funciones específicas de Gibbs de las tres fases son iguales entre sí. (Yunus A. Cengel, 2009) Figura 1.1 Mezcla líquido - vapor en equilibrio a temperatura y presión constantes. 1.1.1 EQUILIBRIO DE FASES PARA UN SISTEMA MULTICOMPONENTE. En un sistema multifase y multicomponente determinado bajo una presión y temperatura especificadas, se encuentran en equilibrio de fases cuando no existe una fuerza impulsora entre las diferentes fases de cada componente, al no existir 14 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES esta fuerza los componentes no sufre ningún cambio tanto de fase, como físico o químico, por lo tanto para lograr el equilibrio de fases, se utiliza la función específica de Gibbs donde cada componente debe ser igual para todas las fases. Esto es: 𝑔𝑓,1 = 𝑔𝑔,1 = 𝑔𝑠,1 para componente 1 Ec. 1.5 𝑔𝑓,2 = 𝑔𝑔,2 = 𝑔𝑠,2 para componente 2 Ec. 1.6 …………………… 𝑔𝑓,𝑁 = 𝑔𝑔,𝑁 = 𝑔𝑠,𝑁 para componente N Ec. 1.7 Algunos componentes pueden existir en más de una fase sólida bajo una presión y temperatura específicas, la función específica de Gibbs de cada fase sólida de un componente debe ser la misma para lograr el equilibrio de fase. Se puede mencionar que las dos fases de un sistema de dos componentes no tienen la misma composición en cada fase, la composición molar de cada componente difiere cuando éste se encuentra en fases diferentes. (Yunus A. Cengel, 2009) 1.1.2.- SISTEMAS TERMODINÁMICOS La rama de la Física conocida como Termodinámica es la que se encarga de estudiar las transformaciones que ocurren en las distintas fases de la materia en general cuando ocurren cambios de temperatura o de presión. Un sistema termodinámico ésta constituido por cierta cantidad de materia o radiación en una región del espacio, implicados en un proceso que ésta bajo un estudio en específico, por lo que este material podría ser el contenido de un recipiente con los reactivos, una disolución de electrolitos con una celda electroquímica, o el conjunto formado por el cilindro y el pistón móvil de un motor, claros ejemplos 15 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES dentro del trabajo de un ingeniero, por lo que se puede mencionar el concepto de frontera la cual significa que es la región que separa al sistema del resto del universo físico. Con respecto a la frontera que determina a un sistema del resto del universo o ambiente físico que lo rodea, ésta constituida por las paredes del recipiente que contiene a los componentes ya sea en un sistema de fluidos o radiación electromagnética, no obstante podría ser su superficie exterior como un trozo de metal o una membrana superficial. Sin embargo, puede darse el caso de que la frontera del sistema sea una superficie abstracta, representada por una porción de masa de fluido en movimiento o en reposo. El observador es el personaje principal pues es quien determina tanto el sistema termodinámico y sus fronteras. Si se conoce las fronteras del sistema de igual manera se debe estar al tanto de cómo son sus alrededores, ya que la interacción de este con el sistema estará caracterizada por los intercambios que existirán entre ellos con respecto a la masa y energía que se hallaran en sus diversas formas, el grado de relación con sus alrededores dependerá de la naturaleza de sus paredes. Paredes adiabáticas: no permiten que un sistema modifique su grado relativo de calentamiento. Los llamados aislantes térmicos a nivel comercial son ejemplos de materiales con esta propiedad. Paredes diatérmicas: permiten interacciones que modifiquen el grado relativo de calentamiento. Los metales son materiales que constituyen excelentes paredes diatérmicas. Con respecto a las paredes que se mencionaron, si en un sistema puede intercambiar materia o energía con el medio que lo rodea, se le denomina como sistema abierto; si sus características son paredes impermeables y el nulo 16 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES intercambio de componentes con sus alrededores y su masa permanece constante, se le conoce como sistema cerrado. En los dos sistemas mencionados (abierto y cerrado) si se puede intercambiar energía en el medio ambiente. El sistema que no pueden intercambiar materia ni energía y ninguna interacción con el medio que los rodea se denomina sistema aislado. La interfase entre el sistema y el medio que los rodea se denomina límite. Los límites determinan si se puede transferir energía y masa entre el sistema y el medio ambiente, dando lugar a la distinción entre sistemas abiertos, cerrados y aislados. (Thomas Engel, 2007) 1.1.3.- ECUACIONES DE ESTADO En termodinámica existen relaciones entre las variaciones de las diversas magnitudes físicas y químicas que deben ser tomadas en cuenta en las distintas reacciones que presente en su sistema, las relaciones directas entre las magnitudes son las ecuaciones de estado o las ecuaciones fundamentales creando una relación a partir de dos o más propiedades. En un sistema de un solo componente y de una fase, la ecuación de estado incluirá tres propiedades, dos de las cuales pueden ser consideradas como independientes, otro caso por mencionar sería en un sistema cerrado el cual posee ciertos valores de sus variables como el volumen V, presión P y temperatura T constantes en todo el sistema, al hacer referencia de las anteriores propiedades se llega a la conclusión que el tercero es función de los otros dos. 𝐹(𝑃, 𝑉, 𝑇) = 0 Ec. 1.8 Cada sustancia posee una ecuación de estado térmica que por lo general, es muy difícil de obtener; en algunos casos se presentan formas relativamente sencillas, pero otras muy complejas: la más sencilla y la mejor conocida para las 17 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES sustancias en la fase gaseosa es la ecuación de estado de gas ideal, la cual predice el comportamiento de P-v-T de un gas con bastante exactitud, dentro de una región adecuada. Se ha estudiado el comportamiento con un termómetro de gas con el cual se encuentra experimentalmente que todos los gases, a baja presión y lejos de la región de la línea de condensación, se comportan de la misma manera en lo que se refiere a la temperatura siempre y cuando en el sistema no tengan lugar reacciones químicas. Si se utiliza como propiedad termodinámica el producto PV de una masa fija de gas, se apreció que cuando se usa diferentes gases aparecen solamente diferencias pequeñas entre las temperaturas indicadas, sin embargo en la práctica no se suele utilizar el producto PV ya que se mantiene constante V y se usa a P como propiedad termodinámica, o viceversa. (Mulero & Cachaduña, 2004) Existen bastantes ecuaciones de estado que se han recomendado para conocer y estudiar el comportamiento no ideal de un gas, este comportamiento aparece cuando la presión es relativamente alta, para la mayoría de los gases sería de 4 MPa; o cuando la temperatura es próxima a la de saturación. De igual forma las ecuaciones de estado son útiles para describir las propiedades de los fluidos, mezclas, sólidos e inclusos del interior de las estrellas, cada sustancia o sistema hidrostático tiene una ecuación de estado característica dependiente de los niveles de energía moleculares y sus energías relativas. El uso más importante de una ecuación de estado es para predecir el estado de gases y líquidos, una de las más simples para este propósito es la ecuación de estado de los gases ideales, que es aproximable al comportamiento de los gases a bajas presiones y temperaturas mayores a la temperatura crítica. La ecuación de estado de los gases ideales realiza las siguientes aproximaciones: 1. Considera que las moléculas del gas son puntuales, es decir que no ocupan volumen. 18 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES 2. Considera despreciables a las fuerzas de atracción-repulsión entre las moléculas. Esta ecuación no tiene buena correlación con el comportamiento de los gases reales, al considerar el volumen molecular y las fuerzas de atracción-repulsión despreciables, no es fiable cuando el volumen es pequeño o la temperatura es baja, ya que los valores que se despreciaron influyen más. Es por eso que se utiliza a altas temperaturas y bajas presiones. En general el criterio utilizado es que se puede utilizar dicha ecuación cuando la temperatura a la que se está trabajando es superior a dos veces la temperatura crítica del compuesto. (Castellan, 1974-1987) En la siguiente tabla aparecen algunas ecuaciones de estado de uso más común. Tabla 1.1 Ecuaciones de estado para 1 mol (Himmelblau, 2002). Ecuaciones de estado para 1 mol 𝑎 (𝑝 + 2 ) (𝑉 − 𝑏) = 𝑅𝑇 𝑉 27 𝑅 2 𝑇𝑐2 𝑎 = (64) Van de Waals 𝑃𝑐 Ec. 1.9 1 𝑅𝑇𝑐 𝑏=8 Peng-Robinson 𝑝= 𝑃𝑐 𝑅𝑇 𝑎∝ − 𝑉 − 𝑏 𝑉(𝑉 + 𝑏) + 𝑏(𝑉 − 𝑏) 𝑎 = 0.45724 ( 𝑅 2 𝑇𝑐2 ) 𝑃𝑐 𝑅𝑇𝑐 𝑏 = 0.07780 ( ) 𝑃𝑐 ⁄ ∝= [1 + 𝐾(1 − 𝑇𝑟1 2 )𝐽2 𝐾 = 0.37464 + 1.5422𝜔 − 0.26992𝜔2 𝜔 = 𝐹𝑎𝑐𝑡𝑜𝑟 𝑎𝑐𝑒𝑛𝑡𝑟𝑖𝑐𝑜 19 Ec. 1.10 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES Tabla 1.1 Ecuaciones de estado para 1 mol Ecuaciones de estado para 1 mol Soave- Redlich-Kwong 𝑝= 𝑅𝑇 𝑎′ 𝜆 − 𝑉 − 𝑏 𝑉(𝑉 + 𝑏) 0.42748𝑅 2 𝑇𝑐2 𝑎 = 𝑃𝑐 ′ 𝑏= Ec. 1.11 0.08664𝑅𝑇𝑐 𝑃𝑐 1 𝜆 = [1 + 𝑘′(1 − 𝑇 2 𝑟]2 𝑘 = (0.480 + 1.574𝜔 − 0.176𝜔2 ) Redlich-Kwong 𝑝= 𝑅𝑇 𝑎 − 1 (𝑉 − 𝑏) 𝑇 ⁄2 𝑉(𝑉 + 𝑏) 𝑅 2 𝑇𝑐2.5 𝑎 = 0.42748 𝑃𝑐 𝑏 = 0.08664 Ec. 1.12 𝑅𝑇𝑐 𝑃𝑐 La primer ecuación cúbica de estado es la de Van der Waals creada en 1873, en esta a y b son constantes, cuando son cero se obtiene la ecuación de los gases ideales, pueden evaluarse mediante un ajuste de los datos de presión, temperatura y volumen disponibles en el problema. Permite justificar los cambios de estado con referencia a la energía mínima que se esté utilizando, está igualdad no proporciona los valores específicos, son razonables y se pueden determinar porque se conocen las temperaturas y presiones críticas, pero los resultados son una estimación, por lo que para un resultado especifico no da confiablidad. Lo que sigue es, en su mayor parte, una reelaboración de las recomendaciones realizadas por G. J. Suppes del Departamento de Ingeniería Química de la Universidad de Missouri-Columbia para la selección de la metodología de cálculo del equilibrio líquido - vapor o líquido - líquido (ELL) 20 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES Cuando la temperatura reducida de la mezcla, calculada como Tr = T / zi Tci, es mayor que 0,75 y no se prevén fases líquidas inmiscibles, se debe usar una ecuación de estado como Soave- Redlich-Kwong o Peng-Robinson, privilegiando aquellas que cuentan con datos experimentales en la base de datos del simulador. De acuerdo a Hyprotech, es preferible utilizar Peng-Robinson a Soave- Redlich-Kwong, aunque existen opiniones en contrario. El desarrollo moderno de las ecuaciones de estado comenzó en 1949 con la publicación de la ecuación de Redlich-Kwong, sus constantes se obtienen de la misma forma que la de Van der Waals, por lo que no proporciona los mejores valores posibles, pero ellos son razonables y casi siempre pueden determinarse. (Himmelblau, 2002) Las ecuaciones de estado se utilizan para determinar entalpías, presiones, volúmenes y otras propiedades termodinámicas, la elección de cada una de ellas depende de la presión que se requiera y de las condiciones de operación en las que se trabaje. Para el cálculo de los coeficientes de actividad existen varias alternativas: Ecuación de Wilson Ecuaciones de Margules Modelo Non Random Two Liquids (NRTL) Modelo Universal Quasi Chemical (UNIQUAC) Modelo Uniquac Funtional Group Activity Coefficient (UNIFAC) El modelo que se utilizó para la simulación es el NRTL ya que es muy útil para las mezclas orgánicas con presencia de agua y para las mezclas binarias, elimina limitaciones para el equilibrio líquido – líquido, es capaz de representar el comportamiento de los equilibrios líquido – líquido, líquido – vapor y líquido – 21 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES líquido – vapor. Es consistente termodinámicamente y puede aplicarse a sistemas ternarios y de orden superior usando parámetros obtenidos por la regresión de datos del equilibrio binario. (Henley, 1988) La ecuación de estado NRTL describe el equilibrio líquido - vapor para la mezcla etanol-agua (Quintero, 2007), observando así el mismo comportamiento en la figura 1.2. Figura 1.2 Datos de equilibrio para la mezcla etanol-agua. 1.1.4.- AZEÓTROPOS La mezcla que se estudia en el presente trabajo tiene una característica particular ya que es una mezcla azeotrópica, para empezar a hablar de ella se debe definir en qué consiste. Un azeótropo es una mezcla de dos o más líquidos, de tal forma que una simple destilación no puede alterar sus componentes, en términos comunes esto sucede cuando se hierve un azeótropo y el vapor tiene las mismas proporciones de los componentes en la mezcla sin hervir. (Costa, 2005) Debido a la composición que poseen estas mezclas no se pueden modificar por una destilación simple, también se les llama mezclas de punto de ebullición constante, porque las sustancias que conforman la mezcla llegan a tener un punto de ebullición igual sin permitirles separarse por medio de este método. 22 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES Existen diferentes tipos de azeótropos pues las diferencias son sus puntos de ebullición y el tipo de mezcla que lleguen a formar esto por las sustancias que se combinan. Como cada azeótropo tiene un punto de burbuja particular no poseerá el mismo que cualquiera de sus componentes por lo que será igual, menor o mayor que esas temperaturas. Azeótropos positivos: este tipo de azeótropo hierve a una temperatura más baja que cualquier de sus constituyentes, también se llaman mezclas de ebullición mínimos donde hace referencia a la disminución del punto de burbuja o azeótropos de presión máxima, ya que a mayor presión menor temperatura, esto por la presión que se ejerce en el destilador. Azeótropos negativos: en este caso hierve a una temperatura más alta que cualquiera de sus constituyentes, también se llaman mezclas máximas de ebullición o azeótropos de presión mínima. Azeótropo homogéneo: es cuando la composición azeotrópica es fuera de la falta de miscibilidad o de los componentes de las mezcla son completamente miscibles con el tipo de azeótropo. Azeótropo heterogéneo: es cuando los componentes de la mezcla no son completamente miscibles. Otra de las clasificaciones es por el número de componente como por ejemplo: si son dos componentes se denomina azeótropos binarios, si constan de más de tres componentes son llamados azeótropos ternarios. Para la síntesis de cada una de las mezclas y la designación de una columna de destilación se deben de conocer los puntos más importantes del compuesto azeotrópico, existen más de 500 mezclas azeotrópicas y sistemas binarios y terciarios medidos a presiones de 3.5 bares en una banda de columnas, algunos 23 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES ejemplos se muestran en las tablas 1.2, 1.3 y 1.4 Los sistemas azeotrópicos no pueden separarse por una destilación simple, para lograrlo se realiza una destilación más compleja llamada destilación extractiva, la composición de los azeótropos para los sistemas binarios han sido publicados por varios autores enmarcados a funciones de temperaturas y con respecto a los sistemas ternarios se basan con un sistema triangular, para la experimentación de los datos azeotrópicos se han comparado gráficamente con los resultados predichos por diferentes grupos que contribuyeron con métodos para la UNIFAC (Hansen et al., 1991). Los investigadores para obtener la separación más purificada utilizaron diferentes técnicas como la cristalización, extracción y la destilación; con la ayuda de tamices moleculares, esto para la destilación extractiva, otra forma para purificar son por medio de un cromatógrafo de gas, en algunos casos químicos por el grado de purificación se obtiene cerca del 99.8%. (Bölts, 1996) Tabla 1.2 Información azeotrópica para sistemas binarios seleccionados. Componente 1 + componente 2 t/°C P/KPa Acetonitrilo + 2-propanol 33.30 19.66 Acetona - Éter isopropil 29.30 40.31 Acetona + 1-hexeno 28.90 46.42 Acetona + metanol 54.70 99.28 Acetona + tetraclorometano 21.90 26.53 Acetona + tetrahidrofurano 31.20 40.09 Acetona - propilbromuro 33.80 32.74 Etanol - benceno 67.80 100.42 Etanol - florurobenceno 31.50 19.89 acetato de etilo + butanona 33.75 20.05 2-butanol - etilbenceno 30.40 3.82 Benceno + heptano 24.80 12.89 2-butanona - dipropileter 34.80 19.77 24 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES Tabla 1.2 Información azeotrópica para sistemas binarios seleccionados. Cloroformo + metanol 54 103.55 Ciclohexano + propilacetato 34.50 19.76 Metilciclohexano – 3-pentanona 30.65 9.52 Metilciclopentano – 2-propanol 30.20 26.65 Metilciclopentano – 1-propanol 41.90 26.65 Diclorometanol - etanol 27.20 12.76 acetato de metilo + ciclohexano 32.10 40.03 Metanol + florurobenceno 28.80 26.55 Pentano + metanol 24.40 79.91 Tetrahidrofloruro + agua 63.25 100.93 Tetracloroetileno + octano 30.40 3.36 1-pentano + metanol 26.90 102.47 Tabla 1.3 Información azeotrópica para sistemas ternarios seleccionados. (Bölts, 1996) Componente 1 + componente 2 + t/°C P/PKa componente 3 Acetona + metanol + etanol 99.28 Acetona + metanol + beceno 99.04 Acetona + metanol + ciclohexano 51.90 103.35 Acetona + metanol + hexano 30.80 53.20 Etanol + acetonitrilo + agua 55.30 52.57 Acetona + etanol + benceno 100.42 Etanol + 2-butanona + ciclohexano 30.90 26.17 Etanol + 2-butanona + agua 39.20 26.03 Etanol + 1,2-dicloroetano + tricloroetileno 31.40 20.37 Etanol + agua + etilbenceno 35.50 14.54 Benceno + ciclohexano + 2-metil-2-propanol 29.60 19.74 Cloroformo + metanol + etanol 103.55 25 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES Tabla 1.4 Lista de ejemplos de mezclas azeotrópicas con su respectivo disolvente para la separación de la misma por el método de destilación extractiva. SISTEMA Etanol-agua Benceno-ciclohexano TIPO DISOLVENTE RESEÑA Azeótropo de mínimo punto Etilen-glicol, de Ebullición acetato azeotrópica, Para procesos con sal extractiva Azeótropo de mínimo punto sales de Alternativa a la destilación destilación Anilina de Ebullición Acetato de etilo-etanol THF-agua Azeótropo de mínimo punto Esteres altos o alcoholes Proceso similar para otros de Ebullición Aromatices sistemas alcohol-ester Azeótropo de mínimo punto Propilen-glicol Alternativa a la destilación de Ebullición Acetona-metanol por variaciones de presión Azeótropo de mínimo punto Agua, anilina, etilen-glicol de Ebullición Isopropeno-pentano Azeótropo de mínimo punto Furfural, DMF. Acetonitrilo de Ebullición Piridina-agua Azeótropo de mínimo punto Bisfenol de Ebullición Acetato de metilo-metanol Azeótropo de mínimo punto Etilen-glicol, monometil éter de Ebullición Elemento de un sistema de recuperación como alternativa a la producción de acetato de metilo destilación por reactiva; alternativa a la destilación azeotrópica, por variación de presión Isómeros de heptano- ciclohexano Isómeros Puntos de ebullición Anilina, fenol de ebullición Anilina, fenol cercanos de heptano- tolueno Puntos cercanos y azeótropos de minino punto de ebullición Acetato de vinilo-acetato Puntos de etilo cercanos Propano-propileno Puntos de ebullición Fenol, aromáticos Alternativa a la destilación simple de ebullición Acrilonitrilo Alternativa a la destilación cercanos Etanol-isopropanol Puntos simple de ebullición Benzoato de metilo Alternativa a la destilación cercanos Ácido clorhídrico-agua simple Azeótropo de máximo punto Ácido sulfúrico, cloruro Los procesos de ácidos de ebullición cálcico sulfúrico Para procesos salinos Depende n fuertemente de la curvatura del limite Ácido nítrico-agua Azeótropo de máximo punto Ácido sulfúrico, nitrato de Los de ebullición Magnesio sulfúrico salinos para procesos procesos ácidos Dependen fuertemente de la curvatura del limite 26 de CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES 1.2.- OPERACIÓN UNITARIA DE DESTILACIÓN La destilación es un método para separar los componentes de una solución; depende de la distribución de las sustancias entre una fase gaseosa y una líquida, y se aplica en los casos donde todos los componentes están presentes en las dos fases. En lugar de introducir una nueva sustancia en la mezcla, con el fin de obtener la segunda fase la nueva fase se crea por evaporación o por condensación a partir de la solución original de los componentes de una solución líquida. La destilación se refiere a separar soluciones en la cual todos los componentes son apreciablemente volátiles, a esta categoría corresponde la separación de los componentes de una solución líquida, la nueva fase difiere de la original por su contenido calorífico, pero el calor se incrementa o se elimina sin dificultad, se debe de considerar el costo de aumentarlo o disminuirlo por las consecuencias que le traería a la mezcla. La destilación se lleva a cabo mediante dos métodos principales que ayudan a obtener una mayor pureza, el primero se basa en la producción de vapor mediante la ebullición de la mezcla líquida que se desea separar y condensación de los vapores sin permitir que el líquido retorne al calderín, esto quiere decir que mediante el proceso no existe reflujo. El segundo método consiste en el retorno de una parte del condensado a la columna, una de las condiciones es que el líquido que se retorna se pone en íntimo contacto con los vapores que ascienden hacia el condensador. 27 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES 1.2.1.- CARACTERÍSTICAS DE LA DESTILACIÓN. Los procesos de destilación continúan en estado estacionario incluyen con una vaporización parcial en una sola etapa sin reflujo en la cual está la destilación flash y la destilación continua. Destilación flash: Consiste en la vaporización de una fracción definida del líquido, en una forma tal que el vapor que se forma está en equilibrio con el líquido residual como se muestra en la figura 1.3. Figura 1.3 Planta para una destilación flash Destilación continúa de reflujo: Se utiliza para la separación de componentes que tienen temperaturas de ebullición muy diferentes, no es eficaz en la separación de componentes de volatilidad comparable, puesto que tanto el vapor condensado como el líquido residual distan mucho de ser componentes puros. Utilizando muchas destilaciones sucesivas se pueden obtener pequeñas cantidades de componentes prácticamente puros, pero este método es muy poco eficaz para las destilaciones 28 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES industriales porque estas desean separaciones en componentes casi puros. (Warren L. McCabe, 1995) Figura 1.4 Columna de fraccionamiento continúo con secciones de rectificación y agotamiento Destilación extractiva: es una de las técnicas más utilizadas en la industria por los bajos consumos energéticos que tiene esta operación unitaria, acompañado de los competentes costos de inversión inicial y de operación hacen de la destilación extractiva una tecnología atractiva para deshidratar etanol como el modelo de la figura 1.5. Figura 1.5 Diagrama esquemático de la destilación extractiva En algunas plantas se recuperan productos volátiles a partir de una disolución líquida por la destilación discontinua, el proceso es el siguiente: se carga en un calderín y se le comunica calor por medio de un serpentín o a través de la pared 29 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES del recipiente hasta que el líquido alcanza la temperatura de ebullición y después una parte de la carga se vaporiza. Todo ocurre de una forma tan sencilla durante la operación ya que los vapores pasan directamente desde el calderín hasta el condensador. Destilación discontinua con reflujo: en muchos casos se utiliza una columna de rectificación con reflujo para mejorar la eficacia de un destilador discontinuo, si la columna no es demasiado grande se puede instalar sobre la parte superior del calderín, o bien puede acoplarse independientemente por medio de las tuberías de conexión para las corrientes de líquido y vapor. Estas columnas pueden ser analizadas por un diagrama de McCabe-Thiele. 1.2.2.- OPERACIONES INDUSTRIALES Y COMPONENTES DE LAS TORRES DE DESTILACIÓN Para poder obtener un etanol más puro se han realizado diversa técnicas de estudio, para poder utilizarlo como carburante en la gasolina ya que en la mezcla etanol – gasolina debe contener la menor cantidad de agua evitando así la generación de problemas en la operación del motor. Entre las principales tecnologías para la deshidratación del etanol se encuentran la destilación al vacío, adsorción por tamices moleculares, destilación azeotrópica y la destilación extractiva. En la destilación extractiva actúa un tercer componente para separar una mezcla binaria difícil de separar por una destilación convencional. Este tercer componente se conoce como solvente y se caracteriza por ser no volátil, miscible y de alto punto de ebullición, hablando ahora de la mezcla etanol - agua y considerando que es una mezcla azeotrópica cumple también una destilación azeotrópica ya que se encuentran como sus principales solventes el etilenglicol y la glicerina los cuales satisfacen con las anteriores propiedades. 30 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES Algunos procesos industriales en los que se usan: Industria alimentaria. Extracción de aceites y grasas de ciclohexano y sulfuro de carbono. Industria siderúrgica. Limpieza y desengrasado de piezas tricloroetileno y cloruro de metileno. Refrigeración en procesos de corte hidrocarburos alifáticos. Industria del calzado. Como disolventes de colas y pegamentos mezcla de hexanos. Industria de plásticos y caucho. Como disolvente de materias primas y de transformación dimetilformamida, cloroformo, acetona. Industria de la madera. Como disolventes de lacas y barnices trementina, tolueno. Industria cosmética. Como dispersante alcohol etílico, alcohol isopropílico, cloroformo. Industria farmacéutica. En síntesis de fórmulas. Industria de pintura. Como diluyente tolueno, acetatos, cetonas, etc. Limpieza en seco. Como disolvente de sustancia orgánica tetracloroetileno. Artes gráficas. En las imprentas en la limpieza de rodillos y máquinas. Una columna de destilación (figura 1.6) está compuesta en su interior de platos, en cada uno de los cuales ocurre un equilibrio líquido – vapor y se favorece la transferencia de masa entre las dos fases, con el objetivo de que al llegar la mezcla al domo de la torre, para que se tenga una mayor pureza del componente ligero. Dentro de la torre existe un flujo de vapor que sube de plato en plato y un flujo de líquido que proviene de la parte superior de la torre y desciende también de plato a plato. En el domo de la torre existe un condensador, el cual tiene la función de condensar el vapor que sale del domo de la torre, obteniendo así el destilado. Una parte de este regresa a la torre para favorecer la transferencia de masa entre las fases y mantener el flujo de líquido. A la relación entre el líquido 31 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES que regresa a la torre y el destilado que se toma como producto se le llama reflujo, y es un parámetro de suma importancia para el diseño de la torre de destilación. Figura 1.6 Diagrama de una torre de destilación 1.3 DESTILACIÓN EXTRACTIVA 1.3.1 SEPARACIÓN DE MEZCLAS AZEOTRÓPICAS Existen sustancias que en ciertas proporciones forman mezclas llamadas azeotrópicas que se caracterizan porque su vapor tiene la misma composición que la fase líquida y que por tanto no se pueden separar por destilación. Un ejemplo típico es la mezcla azeotrópica que estamos manejando formada por el etanol y el agua con una composición de 95.6% de etanol y 4.4%agua, cuyo punto de ebullición a una atmósfera es de 78.2 °C, la figura 1.7 representa el comportamiento de la mezcla. Es necesario que los puntos de ebullición de los componentes puros presentes en la mezcla estén lo suficientemente cercanos para permitir la formación de un azeótropo. 32 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES Figura 1.7 Diagrama del comportamiento de la mezcla etanol-agua. Por la gran demanda que ha existido en la separación de mezclas azeotrópicas, la principal de ellas etanol – agua y por el interés del primer componente como gestor del aumento del octanaje en la gasolina, reducir las emisiones contaminantes a la atmósfera y mejorar la eficiencia de la combustión, han propiciado que se utilicen y se investiguen más métodos con los cuales se llegue a un máximo porcentaje de pureza. Algunas de las opciones que se han generado para la reducción del consumo energético demandado por la deshidratación del etanol son: Destilación azeotrópica: en este tipo de destilación se aprovecha la adición de un agente de separación que modifique las condiciones de la mezcla azeotrópica, estos agentes son utilizados para separar los componentes que la conforman, la efectividad corresponde en el aprovechamiento que tengan para lograr la separación de las fases. El agente de separación se selecciona con criterios económicos, de baja toxicidad, de eficiencia en la separación y de conservación de la energía. Destilación al vacío: Es una de las primeras técnicas utilizadas para eliminar el azeótropo etanol - agua, aprovechando el efecto conseguido al disminuir la presión del sistema y así obtener etanol, para obtener un 33 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES producto de alta pureza es necesario utilizar columnas de deshidratación con un gran número de etapas y con altas relaciones de reflujo, incurriendo en elevados consumos energéticos y altos costos de construcción de la torre. Destilación extractiva con solventes: método de separación de azeótropos binarios de mínimo punto de ebullición, y ocurre en presencia de una sustancia de alto punto de ebullición, llamada solvente, la cual es completamente miscible con los componentes de la mezcla binaria en todas las proporciones y no forma azeótropos adicionales, se adiciona a la mezcla para alterar las volatilidades relativas de los componentes de la mezcla. Las características más importantes de un solvente son: Debe afectar el comportamiento de la fase líquida de los componentes claves. Debe tener un punto de ebullición superior al de los componentes a separar y ser relativamente no volátil, para asegurar su permanencia en la fase líquida. No debe formar azeótropos con los componentes de la mezcla a separar. Debe tener baja viscosidad, baja toxicidad y bajo costo. Destilación con sal: en este método se adiciona sal iónica, soluble y no volátil, para modificar el comportamiento de la fase líquida de la mezcla a separar. En la deshidratación del etanol se han utilizado las siguientes sales: cloruro de calcio, cloruro de potasio, cloruro de cobalto (II), cloruro cúprico, cloruro de níquel (II), bromuro de estroncio, acetato de sodio, acetato de potasio, nitrato de calcio, yoduro de sodio y yoduro de potasio Destilación extractiva con sal y solvente: surge como una alternativa para la obtención de productos de alta pureza, características: 34 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES Se mejora el desempeño del solvente, comparado con la destilación extractiva ya que la cantidad de solvente a recircular se reduce a una cuarta parte, el número de etapas baja a una tercera parte, así como el consumo energético y el costo de equipos también descienden de manera importante. Permite la operación continua dada la alta eficiencia y el bajo desperdicio del solvente. Se obtiene un producto de mayor limpieza Se incrementa la volatilidad relativa del sistema, comparada con el efecto producido por cada uno de los agentes de manera independiente. Adsorción con tamices moleculares: son sustancias granulares de forma cilíndrica o esférica denominadas zeolitas, que pueden ser naturales o fabricados a partir de aluminosilicatos de potasio, se caracterizan por su excelente capacidad para retener sobre su superficie tipos definidos de especies químicas, por lo general estas especies químicas son solventes que se desean retirar de una mezcla para la obtención de un producto final, el proceso de separación por tamices moleculares puede operar en fase líquida o vapor. Pervaporación: es un proceso de separación relativamente nuevo en el que se remueven compuestos orgánicos volátiles de mezclas acuosas por evaporación, a través de una membrana que tiene elementos en común con la ósmosis inversa y la separación de gases. Una de las principales ventajas de este proceso es que el alcohol obtenido está exento de agentes de separación, lo que amplía su aplicación a productos alimenticios y farmacéuticos. 35 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES Procesos híbridos: son tecnologías para mejor la deshidratación del etanol, en este proceso se integra la destilación con la pervaporación. (Uyazán, Aguilar, Rodríguez, & Caicedo, 2004) 1.3.2 VARIACIÓN DEL EQUILIBRIO POR AGENTES MÁSICOS DE SEPARACIÓN Para la separación de la mezcla azeotrópica etanol – agua se pueden utilizar diferentes solventes entre los cuales se encuentran glicoles, aminas, fenoles hidrofóbicos, parafinas, tiofenos y sales. Para realizar esta operación unitaria de los componentes con una pureza máxima se deben tomar en cuenta las condiciones con las que deben entrar a la columna de destilación como por ejemplo el flujo del alimento, del solvente y la obtención del destilado así como la fracción molar del etanol que se obtiene para conocer su composición, las temperaturas a las que serán sometidas, el reflujo molar, los numero de etapas teóricas que se tomaron en cuenta en la simulación, la etapa en donde ira el alimento, la presión con la que se trabajara, la etapa de alimento del solvente, la relación que exista entre el solvente y el alimento, de igual forma el consumo energético. En general se puede mencionar que la relación de reflujo no es una variable determinante en la composición de destilado en comparación con el gasto energético. Las temperaturas de entradas deben ser inferiores a los 90 °C para favorecer la operación de reflujo con el fin de seguir manteniendo la relación etanol – agua. (Uyazán, Aguilar, & M, 2006) 1.3.3 SOLVENTES EMPLEADOS EN LA DESTILACIÓN EXTRACTIVA La separación de mezclas azeotrópicas en fracciones de elevada pureza constituye uno de los problemas técnicos y económicos más importantes y retadores de la industria de procesos químicos. Las políticas ambientales como la entrada en vigencia a partir del mes de Septiembre de 2005, de la Ley 693 de 2001 del Ministerio de Minas y Energía de Colombia, donde se reglamenta que 36 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES la gasolina debe poseer un contenido del 10% en volumen de etanol, el cual por limitaciones técnicas la cantidad de agua debe ser de muy bajo contenido, obligan a desarrollar procesos rentables para la producción de etanol. Las mezclas etanol-gasolina, poseen una baja tolerancia al agua, la cual disminuye al incrementar el porcentaje de etanol o la temperatura. Si la temperatura del motor de un vehículo baja y se sobrepasan los valores máximos permitidos de contenido de agua se forman dos fases y se comienzan a generar problemas en el funcionamiento del motor. En este sentido, la producción de etanol se convierte en una prioridad a nivel ambiental, tecnológico y económico. La separación del sistema etanol-agua se hace con destilación azeotrópica, usando benceno, pentano o dietil éter como solventes, o mediante destilación extractiva empleando etilenglicol o gasolina; estas tecnologías, sin embargo, involucran altos costos de capital y de operación. El uso del pentano, por ejemplo, es efectivo pero requiere altas presiones, mientras que con etilenglicol la proporción del solvente en el alimento es demasiado alta, normalmente 5:1, lo que incrementa el consumo energético; además el etilenglicol aunque es muy factible, es de difícil manejo por su toxicidad, ya que causa irritación de ojos, nariz y garganta, la exposición repetida puede causar daños a los riñones y al cerebro; por otra parte, éste es un líquido combustible cuyo punto de inflamabilidad es 111ºC y al incendiarse produce gases venenosos; además esta sustancia debe tratarse como un teratógeno, es decir, un agente ambiental que causa anomalías morfológicas cuando hay exposición entre la tercera y la novena semana de gestación. Para romper o desplazar el azeótropo también se puede aprovechar el efecto salino, el cual se presenta cuando una sal se disuelve en una solución de líquidos y altera el equilibrio termodinámico, e incluso puede afectar la solubilidad del sistema. Generalmente, dado que la sal es un componente no volátil, sólo está presente en la fase líquida mientras que el vapor en equilibrio tiene la mayor concentración 37 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES del componente en el cual la sal es menos soluble. Los iones de la sal tienen tendencia a aglomerarse preferencialmente con moléculas de los componentes más polares, por eso la selectividad y la magnitud del efecto de la sal sobre la composición de la fase vapor depende de la diferencia de solubilidades individuales de la sal con los componentes líquidos. En la década de los 30’s, aparece como alternativa el proceso HIAG (licenciado por DEGUSSA en Alemania) que se implementó en cerca 100 plantas con capacidades de producción superiores a 43000 ton/año; este proceso utilizaba una mezcla 70/30 de KCOOCH3 y NaCOOCH3 como agente de separación para romper el azeótropo, pero el problema de corrosión en los equipos, generado por el manejo de las sales, lo han ido desplazando de la producción industrial. Con el tiempo, se han utilizado nuevas sales y solventes buscando hacer más factible el proceso desde el punto de vista técnico y económico. Se debe comparar los costos energéticos de los diferentes métodos (destilación azeotrópica, destilación extractiva con solventes y destilación extractiva con sales) para obtener etanol y así encontrar que la destilación extractiva puede presentar los requerimientos de energía más bajos entre los sistemas comparados. (Colombia, 2006) 1.3.4.- TIPOS DE PLATOS (BUBBLE CAP, SIEVE, GLITSH BALLAST, KOCH FLEXITRAY Y NUTTER FLOAT VALVE) El contacto entre fases en operaciones con transferencia de masa se realiza a través de diferentes formas, según la clase de equipo que se emplee. Normalmente, los equipos para las operaciones gas – líquido permiten dos tipos de contacto, por etapas y diferencial, cuyos ejemplos típicos son las columnas de platos y las columnas empacadas, en su orden. Las columnas de platos son cilindros verticales cuyos constituyentes esenciales, son los platos, se diseñan con las dimensiones y características apropiadas para que condiciones de operación específicas, esto se hace posible generalmente entre las fases y volumen de los platos para fomentar el contacto íntimo, la 38 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES transferencia interracial y la separación de los fluidos. Además, la velocidad de las corrientes del proceso debe ser tal que permitan un tiempo de contacto adecuado, así como la generación de turbulencia suficiente para favorecer la eficiencia de la operación, considerando limitaciones mecánicas como la caída de presión. Las principales operaciones gas – líquido que se puede llevar acabo en una torre de platos son: absorción, absorción reactiva, desorción, destilación, destilación extractiva, destilación reactiva, condensación y enfriamiento. (Bernal Daniel, 2011) BUBBLE CAP Los bubbles cap (casquetes de burbujeo) comprenden un canal vertical dotado de un extremo inferior situado dentro de una abertura en una placa del dispositivo de distribución y extendiéndose a través de la misma, y un extremo superior que define un paso entre los extremos, incluyendo el paso una entrada y una salida, un casquete situado sobre el extremo superior del canal vertical, teniendo el casquete una parte superior y una parte de faldón que se extiende de forma descendente, y una caperuza separada, un paso queda definido entre la parte superior y la parte inferior, y proporciona un medio de comunicación de fluido a través de la placa de redistribución las características la define claramente la figura 1.8 (a). Preferentemente, el casquete tiene una serie de ranuras separadas entre sí para permitir el flujo de fluidos a través del casquete, pasando hacia adentro de un elemento anular definido por el casquete y el canal vertical, un casquete de burbujeo puede incluir también el deflector: puede tener cualquier construcción deseada, y controla la dirección de la mayoría del fluido que pasa hacia abajo desde el canal vertical, de manera que el fluido forma un modelo de chorro relativamente ancho sobre el lecho catalizador de la parte de abajo; y las válvulas del canal vertical: situadas entre el extremo superior del mismo y la parte superior del casquete. Se crea un anillo (“anillo del casquete de burbujeo”) entre el canal vertical y el casquete. Las válvulas del canal vertical están preferentemente enrasadas con respecto a la cara inferior de la pared superior del casquete de burbujeo. Las válvulas del canal vertical están separadas entre 39 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES sí formando pasos de válvula. Preferentemente, los pasos de válvula son los únicos (o exclusivos) medios de comunicación de fluido entre el anillo del casquete de burbujeo y el paso vertical (Figura 1.8 b). (Jacobs, Stupin, & Kuskie, 2008) a b Figura 1.8 a) Esquema del plato Bubble cap SIEVE b) Esquema del plato Bubble cap en la torre de destilación SIEVE Las mallas moleculares o tamices moleculares son fabricados en dos tipos de cristal, un cubo simple o un cristal tipo A y un cubo centrado en el cuerpo o cristal tipo X. Un tamiz molecular es un material que contiene poros pequeños de un tamaño preciso y uniforme que se usa como agente adsorbente para gases y líquidos. Las moléculas que son lo suficientemente pequeñas para pasar a través de los poros son absorbidas, mientras que las moléculas mayores no. A diferencia de un filtro, el proceso opera a nivel molecular. Por ejemplo, una molécula de agua puede ser lo suficientemente pequeña para pasar, mientras que otras moléculas más grandes no pueden hacerlo. Aprovechando esta propiedad, a menudo se emplean como agentes desecantes. Un tamiz molecular puede adsorber hasta un 22% de su propio peso en agua, consisten de minerales de aluminosilicatos, arcillas, vidrios porosos, carbones microporosos, zeolitas, 40 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES carbón activado o compuestos sintetizados que tienen estructuras abiertas a través de las cuales pueden difundir moléculas pequeñas como las del agua o el nitrógeno. Los tamices moleculares se usan ampliamente en la industria del petróleo, especialmente para la purificación de corrientes de gas, y en los laboratorios de química para separar compuestos y para el desecado de los reactivos. Excelente para remover el ácido sulfúrico, CO2, altas temperaturas de deshidratación, líquidos Más que costosos la hidrocarburos sílica gel, pesados pero ofrece y alta mayor selectividad. deshidratación. Requiere altas temperaturas para regeneración, lo que resulta en un alto costo de operación. Los tamices moleculares deshidratadores son usados comúnmente en las plantas diseñadas para recuperar etanol. Aplicación: Deshidratar olefinas, metanol y etanol. Adsorbe NH3, H2O, (pero no C2H6), para secar líquidos polares Diámetro: 3Å Deshidratar gases y líquidos, remover H2S. Adsorbe: H2O, CO2, SO2, H2S, C2H4, C2H6, C3H6, etanol. No adsorbe C3H8 e hidrocarburos superiores. Para secar líquidos y gases no polares. Diámetro: 4.2 Å Separar parafinas normales de cadenas ramificadas e HC cíclicas, remover H2S. Adsorbe hidrocarburos normales (lineales) hasta n-C4H10, alcoholes hasta C4H9OH, mercaptanos hasta C4H9SH. No adsorbe isocompuestos o anillos mayores que C4. Diámetro: 5Å Remover mercaptanos y H2S, remover H2O y CO2 de una planta alimentada de aire. Adsorbe di-n-butilamina (pero no tri-n-butilamina). Útil para secar hexametilfosforamida. Diámetro: 10Å. GLITSH BALLAST En la torre de diseño, se debe considerar los siguientes puntos cuando de separaciones se trata: 41 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES La bandeja extra de espaciamiento generalmente es requerida en bandejas de transición, es decir, donde un cambio en el número de fases es contemplado. Una separación de cuatro pulgadas es preferido, particular en grandes torres. Espacio extra que es requerida si la alimentación es vaporizada. El espacio extra debe ser proporcionado para establecer la parte interna de los tubos de alimentación de líquidos si la torre tiene un punto de carga máxima. Es una válvula tipo bandeja similar a la bandeja "remache", utilizada por primera vez 1922. Esto difiere desde otros tipos de bandejas, con tres importantes aspectos. En primer lugar, dos etapas con una ranura como apertura queda lugar a una sola etapa convencionalmente utilizada. Esté proporciona permisos para un flujo de vapor que pasa a través todas las válvulas de bajo de las tarifas y resultados en un amplia gama de operativos con estables condiciones. En segundo lugar, el borde afilado acentúa la turbulencia en la posición donde el vapor entra el líquido y genera adicionalmente vapor - líquido interfacial en la zona para dar una alta eficiencia en la bandeja. En tercer lugar, una pesada unidad es normalmente usada en torres al vacío. Por la pesada cantidad de material aumenta la presión al caer y de ese modo aumenta la eficiencia de la bandeja en el operativo de la región donde las válvulas son totalmente abiertas como el esquema de la figura 1.9. Ventajas de bandejas de lastre puede ser resumido de la siguiente manera: Máxima eficiencia con bajas cargas y asegura una mínima cantidad de apagado. El alto grado de flexibilidad hace que sea posible operar con una mínima utilidad de gasto durante una gama de alimentación en las tasas. 42 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES Alta eficiencia en condiciones de 5 a 10 por ciento a continuación incipiente resultados de capuchas para aumentar en capacidad utilizable. Esto permite una manipulación más eficaz de la columna y auxiliar equipo. Alta eficiencia en condiciones intermedias de carga, ya que puede ser utilizado para mejorar la calidad del producto; para reducir la relación de reflujo, lo que resulta un ahorro en los servicios públicos, o, para reducir el número de bandejas. La combinación de una baja caída de presión y la alta eficiencia de los sistemas de vacío significa una caída de presión de una torre baja. El Glitsh Ballast se ha utilizado para separar la etilbenceno-sistema de estireno en una sola columna. El diseño mecánico de la pestañas como parte fundamental para prácticamente eliminar problemas donde se pegue. El mantenimiento es la comodidad del trabajo porque es mejorado debido a que el disco superior es suave y plana. Y las proyecciones por encima de la bandeja son cubiertas. (Manual de Diseño del Ballast Tray) Figura 1.9 Esquema del plato Glitsh Ballast KOCH FLEXITRAY Esta es la válvula estándar, redonda, de tamaño completo, de una sola pieza que se ha utilizado con éxito en las columnas alrededor del mundo por más de 50 años. 43 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES Flexitray maneja cargas de hasta un 10% más alta que las bandejas de tamiz mientras que proporciona una mayor eficiencia. El agujero contorneada de la válvula de tipo T0 proporciona la caída de presión más bajo por la bandeja en una amplia gama de caudales Figura 1.10. (Flexitray Valve Trays, 2003) Se suministra en varias longitudes para dar cavidad a diferentes plataformas de las bandejas de distintos espesores. Sus orificios normalmente son para ayudar a evitar que se pegue la cubierta. El orificio se puede hacer para evitar que la válvula gire. El peso de las válvulas duales pueden usarse en filas alternas para ampliar el rango de operación. Características Mayor capacidad de bandejas de tamiz estándar Alta eficiencia Amplio rango de funcionamiento Baja caída de presión Rentable Figura 1.10 Esquema del plato Koch Flexitray. 44 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES NUTTER FLOAT VALVE Desde que Earl Nutter desarrolló la primera bandeja de la válvula moderna en 1945, Nutter Ingeniería desarrolló continuamente una nueva bandeja rentable con diseños, los cuales introdujeron a la industria, con un comercial independiente de la escala pruebas como la figura 1.11. Desarrollado en los años 70, el Flotador auto-retenido Valve y V-Grid que son bandejas con válvulas fijas determinan un desempeño de la industria y el mantenimiento normas oficiales. Las pruebas independientes en 1998 demostró la superioridad del rendimiento de la Nutter Float Valve optimizando la bandeja. Sulzer adquirió la innovadora bandeja de Nutter y el anillo de Nutter, con una tecnología de ese mismo año para completar su transferencia de masa de embalaje de una cartera de productos de componentes más eficientes. Una bandeja convencional tiene uno o más tubos de descenso para transporte de líquidos a la bandeja siguiente y una activa zona por donde pasa vapor y líquido en contacto. Esta área activa puede estar equipada con una amplia variedad de burbujeantes dispositivos. En la industria de hoy, los dispositivos utilizados son predominantemente simples porque consisten en orificios de tamiz, con movimiento y una fijación de las válvulas, dependiendo del rango de operación requerida. Después de una evaluación que involucra una aceptación industrial, el rendimiento técnico, referencias y precios, Sulzer Chemtech eligió el rectangular Nutter Float Valve. Lo más factible es su movimiento estándar y la válvula fija del plato Nutter. La cartera de válvula se completa con la Metawa Snap-in válvula, predominantemente utilizado para las bandejas de Shell, una robusta válvula redonda, así como una válvula estándar redonda, que se utiliza principalmente para servicios de sustitución para las Bandejas Sulzer Chemtech. (Roza, Nutter, & Chemtech, 2000) Figura 1.11 Esquema del plato Nutter Float Valve 45 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES 1.3.4.1.- CARACTERÍSTICAS TERMODINÁMICAS CONSIDERADAS PARA LA ELECCIÓN DE PLATOS Se consideran cinco características que presentan los platos durante las corridas del simulador Aspen Plus las cuales son: Temperatura: se refiere a la intensidad de energía térmica en su totalidad y con independencia en el tamaño del sistema, difiere fundamentalmente de las magnitudes mecánicas, debido a que está relacionada con la energía cinética de una gran cantidad de partículas. (Roller & Blum, 1996) Velocidad de flujo: es el volumen que pasa por un área determinada dada en la unidad de tiempo, se identifica con el flujo másico o masa que pasa por un área dada en la unidad de tiempo. (McCabe & Smith, 1981) Concentración: La concentración es la relación que hay entre la cantidad de soluto y la cantidad de disolvente, donde el soluto es la sustancia que se disuelve, el disolvente es la sustancia que se disuelve en el soluto y la disolución es el resultado de la mezcla homogénea de las dos anteriores. A menor proporción de soluto disuelto en el disolvente, menos concentrada está la disolución y a mayor porción más concentrada está. (Jaramillo Sánchez, 2004) Hidráulica: En las corridas el simulador mide la presión en las tuberías con respecto a la velocidad de flujo en cada etapa de la torre de destilación, por lo que define el volumen del flujo que cruza por un punto dado en la unidad de tiempo. (Fernández Boro, 2002) Exergía: Es un parámetro que mide la calidad de la energía, se emplea para analizar la eficiencia energética de los procesos industriales. Con un análisis de exergía se pueden comparar diferentes alternativas para 46 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES comprobar cual tiene mayor rendimiento energético, sin embargo no proporciona soluciones por sí misma. (Carrión Carrión, 2011) 1.4 SIMULACIÓN DE ASPEN PLUS Las simulaciones de procesos se realizan a través de simuladores comerciales o por la programación de Excel, MatLab, visual Basic o cualquier otro programador que se pueda utilizar, ya que nos proporcionan una herramienta tan factible para el análisis de los comportamientos de algún proceso ya sea de la industria química, petrolera, energética y demás, contribuyen a convertir los objetivos de una asociación en realidad, esto ya que una planta virtual construida con simuladores ayuda en el ahorro de dinero y tiempo, así como también protege el medio ambiente y las vidas humanas de quienes trabajan en las plantas, consiguiendo evitar problemas y consecuencias desastrosas. Por lo que se puede decir que la simulación es una operación de un proceso del mundo real o de un sistema en el tiempo, ya que es una técnica donde un modelo es iterado con diferentes valores de entrada, con la intención de conseguir una completa representación de todos los escenarios que podrían ocurrir en una situación incierta. El simulador Aspen Plus es uno de los simuladores comerciales más robustos y dinámicos, es un software de gran optimización de procesos, por ello la utilidad en los bosquejos para encontrar las eficiencias más convenientes y proseguir a realizar los métodos necesarios para la creación de nuevos proyectos. 1.4.1 UTILIDAD Y APLICACIONES DE ASPEN PLUS EN INGENIERÍA QUÍMICA Aspen Plus permite el acceso a amplias bases de datos termodinámicos útiles en el desarrollo y análisis de diferentes experimentos, dándole resolución a los problemas de diseño de procesos, algunos requieren gran cantidad de datos y cálculos, que pueden volverse muy complejos para los estudiantes, consumiendo 47 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES tiempo y finalmente haciendo que el tiempo dedicado para el análisis no sea suficiente, es por eso que simular con Aspen Plus nos otorga muchas ventajas y utilidades tales como: Optimizar procesos con estimaciones de costos y el estudio de factores ambientales con el fin de establecer comparaciones entre alternativas para seleccionar la que mejor se acomode a las especificaciones técnicas, económicas y ambientales en un proceso. Se desarrolla potencialmente los niveles de síntesis y evaluación, es muy útil en la industria puesto que ayuda a reducir costos en el desarrollo de proyectos. Dentro de la industria química, los simuladores son muy útiles en la investigación y desarrollo al agilizar los ensayos en laboratorios y en plantas piloto porque permite predecir resultados o rangos de trabajo optimo lo cual ahorra mucho tiempo en la experimentación; y en la etapa de diseño, al ofrecer una manera más rápida de diseñar un proceso para establecer comparaciones entre diferentes alternativas. Se han creado investigaciones en donde han puesto en práctica el simulador de Aspen Plus para ver el comportamiento del proceso que se quiere lograr como por ejemplo: Producción de alcohol carburante por destilación extractiva: simulación del proceso con glicerol aborda el problema de la deshidratación a través de la simulación del proceso de destilación extractiva de etanol azeotrópico utilizando glicerol como agente de separación. Las simulaciones fueron realizadas con el simulador Aspen Plus versión 11.1, involucrando dos columnas de destilación, una deshidratadora y una recuperación de glicerol. (Uyazán, Aguilar, & M, 2006) 48 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES Deshidratación del etanol: presenta los procesos de deshidratación del etanol y sus características más importantes, además de las principales variables de operación y algunos criterios utilizados en el diseño del esquema de separación. Se han hecho una diferencia entre los procesos que involucran operaciones de equilibrio líquido-vapor para la separación y aquellos que lo hacen a través de diferencias de tamaño molecular, también se presenta una comparación de los tres principales procesos aplicados a nivel industrial, resaltando sus fortalezas y debilidades desde el punto de vista operativo, de consumo energético y de servicios industriales. Estandarización de parámetros de operación para obtener bioetanol anhídrido por destilación extractiva: en este trabajo se presentó los resultados de separación de la mezcla azeotrópica etanol-agua utilizando glicerol como solvente extractor para obtener bioetanol anhídrido, se desarrolló en el simulador Aspen Plus por medio de una columna de destilación, se analizó el comportamiento de las diferentes condiciones de operación y los resultados se estandarizaron como parámetros de operación. (Mendoza Rojas & Enciso López, 2006) Evaluación de la deshidratación de alcohol carburante mediante simulación de procesos: la deshidratación de etanol juega un papel crucial en la obtención de alcohol carburante en especial cuando se consideran los costos del proceso global. Para la etapa de recuperación se han propuesto una destilación extractiva, destilación azeotrópica, destilación al vacío y la adsorción de tamices moleculares, este trabajo se evalúo el efecto que tiene casa sistema mediante el uso de un simulador de procesos Aspen Plus. Entre las configuraciones se encontró que el mejor esquema de deshidratación es el de tamices moleculares, pero con altos costos de capital en comparación de la destilación extractiva, por lo que esta es más eficiente energéticamente. (Quintero, Montoya, Sánchez, & Cardona, 2007) 49 CAPÍTULO I.- MARCO TEÓRICO Y ANTECEDENTES Simulación del proceso de deshidratación de etanol utilizando el software Aspen-Hysys V3.2: se basa en la simulación del proceso en el software Aspen –HYSYS, consta de dos columnas de destilación, un sub-diagrama y separadores de fases. La obtención de etanol anhídrido se realiza a partir de la mezcla de etanol en agua a concentración azeotrópica de pureza del 85% en peso, utilizando benceno como solvente. La destilación se implementa con datos reales de una destilería cubana. 1.4.2 PARÁMETROS DEL SISTEMA DE DESTILACIÓN EXTRACTIVA. Para la obtención y el análisis del etanol se deben tomar en cuenta parámetros específicos para conocer su comportamiento durante la destilación extractiva como por ejemplo: la relación molar entre el solvente y la alimentación para saber de qué manera sustancial afectara el solvente a la mezcla azeotrópica, la relación molar de reflujo, la temperatura y la etapa de alimento del solvente. Como también se debe tomar a consideración la relación entre la temperatura y la presión a las cuales trabajara la torre de destilación, por parte de la literatura es recomendable utilizar la ecuación de estado NRTL, porque realiza una correlación más adecuada y correcta de los datos. Las condiciones de operación de la columna se encuentran por medio del análisis de sensibilidad, determinando así la etapa de alimentación del etilenglicol que es nuestro solvente, por medio de una relación molar solvente/alimento y la temperatura de entrada de solvente sobre la composición del destilado y el gasto energético del rehervidor. (Uyazán, Aguilar, & M, 2006) 50 CAPÍLTULO II.- METODOLOGÍA 2.1.- ELECCIÓN DEL SOLVENTE Y REVISIÓN DE LAS ECUACIONES DE ESTADO Los solventes tiene una gran utilidad en la industria, productos como pinturas de base de agua, barnices, tintas, aerosoles, en la coloración de textiles, marcadores, pegamentos y adhesivos, su término se refiere a sustancias orgánicas en estado líquido, utilizadas para disolver sólidos o gases, la mayoría son derivados del petróleo o sintéticos, ninguno es completamente confiable ya que todos son tóxicos. Para la destilación extractiva se debe elegir correctamente el solvente a manipular, típicamente se ha utilizado el benceno por ser más económico, en esta ocasión recurrimos al etilenglicol, porque para este tipo de destilación la tercer sustancia llamada agente extractivo debe modificar las volatilidades de los compuestos de la mezcla etanol – agua, sin formar nuevos azeótropos permitiendo de esta forma la separación. El agente agregado debe tener un punto de ebullición mayor que el del etanol y el agua, para que la separación de la mezcla azeotrópica se dé favorablemente sin formar otro azeótropo, en la segunda torre donde se recupera interactúa con el agua, por lo que también debe tener un punto de ebullición alto. La entrada de alimentación comienza en el mezclador que combina el etilenglicol que viene de la recirculación con agente que se presenta desde el principio. El etilenglicol tiene una pureza del 100%, con un flujo total de 175 Kg/hr, se incorpora a 80 °C para no disminuir la temperatura que está presente en la torre de destilación RadFrac, también para mantener el punto de ebullición del solvente que es de 197.3 °C y mantenerlo en equilibrio con la emulsión que se envía de la recirculación para que de esta forma no afecte al proceso y no se forme otro azeótropo en la mezcla, la presión manejada durante todo el transcurso es de 14.7 psia como medida estándar, las características se muestran en la figura 2.12. 51 CAPÍTULO II.- METODOLOGÍA Para optimizar la destilación se recuperó el etilenglicol por medio de la recirculación, a través de un FSplit se llegara a separar un poco más el agua del solvente y la cantidad de flujo que regreso al mezclador es de 336 Kg/hr. El etilenglicol tiene una gran calidad como disolvente, pero los costos energéticos son un poco elevados, así que en el proceso se mejorará la calidad del etanol para su uso en la industria. Como agente en la destilación extractiva, está se convierte competitiva energéticamente. (Quintero, Montoya, Sánchez, & Cardona, 2007) T= 80 °C P= 14.7 psia Pureza= 100% Flujo total= 175 Kg/hr Flujo de solvente en recirculación Figura 2.12 Condiciones del solvente para el proceso de destilación extractiva El modelo que se utilizó para la simulación es el NRTL ya que es muy útil para las mezclas orgánicas con presencia de agua y para las mezclas binarias, es consistente termodinámicamente y puede aplicarse a sistemas ternarios y de orden superior 52 CAPÍTULO II.- METODOLOGÍA usando parámetros obtenidos por la regresión de datos del equilibrio binario. (Henley, 1988) La ecuación de estado NRTL describe el equilibrio líquido - vapor para la mezcla etanol-agua (Quintero, 2007), indicando que el tipo de proceso es total observando así el mismo comportamiento de la mezcla. Tipo de proceso: Total Ecuación de estado: NRTL Figura 2.13 Ecuación de estado en la simulación 2.2.- CONDICIONES DE OPERACIONES MÁS ADECUADAS PARA EL PROCESO DE DESTILACIÓN EXTRACTIVA Para la simulación de la destilación extractiva de la mezcla etanol - agua se utilizó el programa Aspen Plus 2008 V7.0 – aspen ONE, en el cual se concentraron datos precisos para el proceso, tales como la temperatura, presión, flujo másico, número de platos y el solvente agregado. 2.2.1 FLUJOS Para el control de la destilación extractiva se manejó como primer equipo un mezclador el cual recibe el solvente puro y posteriormente el de la recirculación para que la composición y la temperatura de estas dos entradas lleguen a un equilibrio. Como primer corriente se tiene el etilenglicol puro que conlleva la función de solvente durante el proceso, aquí mismo se concentra el etilenglicol de recirculación porque se recupera una porción de la que se introduce desde un 53 CAPÍTULO II.- METODOLOGÍA principio, los flujos que entran en este sistema son el número 8 y el 9 que se representan en la figura 2.14 (a). Este solvente es introducido a la torre de destilación, el cual lleva una entrada más que consiste en la mezcla etanol – agua, con una composición de 52.27% y 47.73% respectivamente (Treybal) para la destilación se utilizó una torre de 80 platos, los más importantes son cuatro en el primer plato se encuentra el condensador, en el segundo plato se introdujo el solvente, en el plato número cuarenta se agregó la mezcla azeotrópica y en el plato ochenta se colocó el reboiler, en el domo se obtuvo el azeótropo de etanol con una pureza de 91.73%, en la parte inferior se tubo agua con etilenglicol (figura 2.14 b), este último se purifico para enviarlo al mezclador por lo que fue remitido a otra torre de destilación que consta de cuatro platos por lo que se consideró como un proceso sencillo, ya que no existía ningún problema en separar el agua del etilenglicol por lo que se consiguió una pureza del 92.33%, se utilizó el mismo proceso que en la destilación anterior, ya que la mezcla se introdujo en el plato medio de la torre en esta caso el número dos (figura 2.14 c), el flujo siete está conectado a un FSplit (figura 2.14 d) para amenizar la mezcla ya que en esta existe una pequeña porción de agua que será enviada con el etilenglicol al mezclador. El proceso fue ejecutado con 5 platos diferentes para elegir el adecuado de acuerdo a la composición de la mezcla. a) b) 54 CAPÍTULO II.- METODOLOGÍA c) d) Figura 2.14 Esquema de los equipos utilizados en la simulación de la mezcla azeotrópica etanol – agua. (a) Mezclador de etilenglicol (b) Torre de destilación de la mezcla etanol – agua (c) Torre de destilación empleado para la separación del etilenglicol y el agua (d) FSplit recircula el etilenglicol que se recuperó al mezclador 2.2.2 NÚMERO DE PLATOS Al realizar el proceso de destilación se debe de utilizar una serie de platos para mejorar la pureza del destilado que se quiera obtener y así realizar una eficiente separación de los componentes, en la destilación de la mezcla azeotrópica etanol – agua se manejaron cinco platos diferentes para la simulación en Aspen Plus: Bubble cap Sieve Glitsh ballast Koch flexitray Nutter float valve La cantidad que se utilizó para la simulación fueron de ochenta platos ya que se presentaba una pureza del etanol del 91.73% en el primer plato se colocó el 55 CAPÍTULO II.- METODOLOGÍA condensador, en el último está el reboiler ya que esto sistemas están activados en las simulaciones de Aspen Plus. El solvente es introducido en el segundo plato y la mezcla de etanol – agua en el numero cuarenta. Figura 2.15 a) Número de platos en el proceso de destilación Figura 2.15 b) Entrada de alimentación de la mezcla etanol – agua a la torre de destilación 2.2.3 RELACIÓN DE REFLUJO En el proceso de la simulación de la destilación extractiva emerge un vapor en la parte superior de la torre siendo este el azeótropo del etanol, como el destilado puro de la operación unitaria, en la misma columna regresa otra parte de la mezcla en este caso el agua y el etilenglicol el cual se utilizó como solvente, los dos componentes constituyen el reflujo todo esto para conseguir una mejor 56 CAPÍTULO II.- METODOLOGÍA separación de la mezcla. La relación entre la cantidad de producto destilado obtenido en la simulación y el reflujo que produce el segundo componente de la mezcla más el solvente se denomina relación de reflujo. Figura 2.16 Relación de reflujo del proceso de destilación 2.3.- VARIACIÓN DEL DISEÑO DE PLATO EMPLEADO EN LA COLUMNA EXTRACTIVA El programa de Aspen Plus utiliza cinco platos diferentes para el proceso de la destilación con un equipo RadFrac tipo FRACT2, para la elección de cada uno de los componentes principales de la torre, se basó en diferentes datos que el simulador proporciono para elegir la mejor opción y realizar un procedimiento eficiente. La temperatura que se empleó durante toda la simulación fue de 25 °C en cada uno de los equipos, por lo que no fue de gran importancia para la elección del plato a utilizar, se diferenció con respecto a la temperatura del solvente que fue de 80 °C, pero este solo intervino en la etapa en donde se mezcló con el etanol y el agua. Con respecto a la velocidad de flujo de la mezcla es similar en los valores por lo que las gráficas no tuvieron un cambio significativo. El siguiente factor consistió en la concentración que presentó el etanol dentro de la torre de destilación, donde se pretendió que este compuesto existiera en menor 57 CAPÍTULO II.- METODOLOGÍA cantidad, logrando que en la etapa del condensado se obtuviera una pureza del 91.73%. El cuarto dato obtenido por las gráficas que el simulador nos proporciona es el funcionamiento hidráulico el cual consiste en la comparación de la velocidad del flujo molar, contra la velocidad del flujo del vapor en las 80 etapas que posee la columna de destilación, los resultados no tuvieron gran variación entre los cinco ya que la velocidad del vapor se encontraba entre los 0.042 y 0.045 Kmol/h y el aumento fue en el plato número 79. El último factor es la exergía es considerado por que nos muestra la cantidad de energía que se puede transformar en trabajo, en nuestra simulación para los cinco platos aumenta hasta 40,000 cal/s cuando la mezcla paso por los ochenta platos. 2.3.1.- TIPO DE PLATO Para la elección del plato que se utilizaría en el proceso de la destilación, el simulador proporciono información de los cinco platos que emplea en este tipo de procesos (figura 2.17) y menciona cuatro factores importantes todo esto para la toma de decisión de un equipo eficiente y la obtención de alta pureza en el azeótropo de etanol, considerando también la economía. Como uno de los primeros valores se tuvo el factor de inundación, el cual consiste en la capacidad que tiene los platos en contener la mezcla que se está destilando dentro de la torre en este caso es el plato Koch flexitray fue el que obtuvo uno de los valores más altos, sin embargo el bubble cap y el glitsh ballast obtuvieron los mismos datos. La caída de presión disminuye dentro del sistema cada que traspasa los platos, el más eficiente es el Bubble cap ya que el transcurso entre etapa y etapa es pausado, el Sieve obtuvo la mayor caída de presión por lo cual lo hace deficiente en ese aspecto. 58 CAPÍTULO II.- METODOLOGÍA Con respecto a la velocidad de la mezcla azeotrópica tres platos obtuvieron la misma Glitsh ballast, Koch flexitray y el Nutter float valve, después el Bubble cap y por último el Sieve, la unidad de medida es en m/s. Y por último la pureza del etanol, tres platos presentan los mismos datos el Glitsh ballast, Koch flexitray y el Nutter float valve, sin embargo el bubble cap se acerca a los valores que estos tienen por lo que presenta un mejor comportamiento, porque al tomar en cuenta la pureza los cuatro platos están en el rango del 91%, el Sieve presenta un bajo rendimiento, por lo que se optó por el plato Bubble Cap. Tipos de platos Figura 2.17 Tipo de platos del simulador de Aspen Plus 2.3.2.- EL DIÁMETRO DEL PLATO Con respecto al diámetro del plato se debe de diseñar de acuerdo a la capacidad de la columna de destilación ya que debe de operar entre un 65 a 90 % o para una determinada caída de presión, (Treybal). Con la ecuación 2.14 encontramos la medida adecuada del diámetro del plato para el proceso. 1 1 𝑉 = 0.761( )2 𝑝 59 Ec. 2.13 CAPÍTULO II.- METODOLOGÍA 4 𝑇 1 1 1 𝐷𝑉 𝐷𝑐 = [(𝜋𝑉) 𝐷(𝑅 + 1)(22.2) ( 273 ) (𝑃) (3600)]2 Ec. 2.14 Donde: V= Parámetro del domo P= presión Dc= diámetro del plato D=flujo del destilado R=reflujo TDV= temperatura del vapor que sale por el domo 𝑉 = 0.7661( 1 1 )2 1 𝑎𝑡𝑚 𝑉 = 7661 𝐷𝑐 = [( 1 4 𝐾𝑔 298 𝐾 1 1 (238 + 1)(22.2) ( ) 40 )( )( )]2 𝜋 (0.7661) ℎ𝑟 273 𝐾 1 𝑎𝑡𝑚 3600 1 𝐷𝐶 = [(1.6619)(40)(239)(22.2)(1.0915)(1)(2.77 ∗ 10−4 )]2 0𝐷𝐶 = 10.34 𝑚 El diámetro de cada plato con respecto a los cálculos realizados fue de 1034 cm (figura 2.18). 2.3.3.- ALTURA DEL VERTEDERO PARA EL PLATO La altura de un vertedero es de gran utilidad porque cuando este es demasiado bajo para el flujo crítico, el nivel de la mezcla azeotrópica cae durante el proceso de la simulación y por lo tanto el destilado que se encuentra en la parte del domo de la columna no se ve afectado, pero una vez que se consigue el flujo critico hay una probabilidad de elevar el vertedero más de lo indicado, pero por eso el espacio entre los platos es constante de igual manera la temperatura y la presión, por lo que el proceso será de manera constate para no llegar a ese punto crítico. Por lo que se podría identificar como un controlador para el manejo del flujo de la mezcla. 60 CAPÍTULO II.- METODOLOGÍA 2.3.4.- ESPACIAMIENTO ENTRE PLATOS PARA LA TORRE Generalmente para el espaciamiento entre los platos se escoge con base en la facilidad para la construcción en la simulación ya que busca la eficiencia de la columna para la mejor obtención del azeótropo; posteriormente se verifica para evitar cualquier inundación y arrastre excesivo del agua en el etanol para una producción mejor purificada. Para casos especiales en que la altura de la torre es de importancia se han usado espaciamientos de 2 ft (figura 2.18), para todos los diámetros a excepción de los diámetros más pequeños de la torre, que suelen ser de 15 in, pero por lo regular son utilizados para torres empacadas. Diámetro del plato Espacio entre platos Figura 2.18 Diámetro y espaciamiento de los platos 61 CAPÍTULO III.- RESULTADOS Y DISCUSIÓN 3.1.- ELECCIÓN DEL SOLVENTE PARA LA DESTILACIÓN EXTRACTIVA Para la elección de un solvente se tomó en cuenta la miscibilidad que es un caso particular de la solubilidad, ya que la presión como la temperatura tiene influencia en la mayor o menor solubilidad que se pueda presentar en la mezcla azeotrópica que se está manejando; por lo que se operó con condiciones estándar para la manipulación del proceso, la temperatura para todos los equipos fue de 25 °C y la presión de 1 atm, con respecto al concepto de azeótropo, el que se utilizó en la simulación es etanolagua que por sus componentes es binario y como se sabe al momento de someterlo a una destilación normal este no se llevara a acabo ya que al instante de llegar al punto de ebullición más cercano en este caso la del etanol no ocurre la evaporación ya que se logra un grado de estabilidad donde la composición de la mezcla es igual en cualquier punto. El mejor solvente para esta operación fue el etilenglicol ya que comparado con otros como el benceno o las sales mineras es mejor energéticamente. Para optimizar la destilación se recuperó el etilenglicol por medio de la recirculación, la primer entrada es de 175 Kg/hr, con una temperatura de 80 °C, se mantuvo en este grado por el punto de ebullición del solvente que es de 197.3 °C y mantenerlo en equilibrio con la emulsión que se envía de la recirculación para que de esta forma no afecte al proceso y se forme otro azeótropo en la mezcla. 3.2.- ANÁLISIS DE LAS CONDICIONES DE OPERACIÓN DE LA TORRE DE DESTILACIÓN EXTRACTIVA. Durante las primeras corridas del proceso de simulación se comenzó incluyendo los componentes de la mezcla azeotrópica etanol – agua, junto con el solvente que se eligió, en este caso el etilenglicol, como se muestra en la figura 3.19. 62 CAPÍTULO III.- RESULTADOS Y DISCUSIÓN Figura 3.19 Componentes que se utilizaron en la simulación El proceso fue total quiere decir que todos los equipos trabajaron a su máxima capacidad, el modelo que se utilizó para la simulación fue el NRTL (Non Random Two Liquids), porque es capaz de representar el comportamiento de los equilibrio líquido – vapor, líquido – líquido y líquido – líquido – vapor, es superior a otros modelos en sistemas de agua con compuestos orgánicos, termodinámicamente el modelo es consistente y puede aplicarse a sistemas ternarios y de orden superior, comparado con las ecuaciones de estado de Van der Waals y Redlich-Kwong los resultados que estos proporcionan no son de gran confiabilidad para procesos de suma importancia en la industria, Soave- Redlich-Kwong y Peng-Robinson son un poco más sofisticados, pero para realizar un análisis de mezclas orgánicas suelen tener algunos errores en las deducciones. Para el control de la destilación extractiva se manejó como primer equipo un mezclador ya que la corriente número ocho tiene el etilenglicol puro que conlleva la función de solvente durante el proceso el flujo que transporta consigo es de 175 kg/hr a una temperatura de 80 °C y una presión de 14.7 psia, aquí mismo se concentra el etilenglicol de recirculación que es de 336 kg/hr, con una temperatura de 170.7 °C y la 63 CAPÍTULO III.- RESULTADOS Y DISCUSIÓN presión de 1 atm (14.7 psia), porque se recupera una porción de la que se introduce desde un principio, este solvente es introducido a la torre de destilación el cual lleva una entrada más que consiste en la mezcla etanol – agua, para la destilación se utilizó una torre de 80 platos, en el segundo plato se introdujo el solvente y en el plato número cuarenta se agregó la mezcla azeotrópica con una cantidad de 100 kg/hr, con una temperatura de 25 °C y una presión de 14.7 psia, el flujo de destilado manejado es de 40 kg/hr y la velocidad de reflujo de 238 m/s; en el domo se obtuvo el azeótropo de etanol con una pureza de 91.73%, en la parte inferior se obtuvo agua con etilenglicol, este último se purifico para enviarlo al mezclador por lo que fue remitido a otra torre de destilación con cuatro etapas, un flujo de destilado de 60 kg/hr y una velocidad de reflujo de 5 m/s, en donde se consiguió una pureza del 92.33%, este flujo está conectado a un splitter para realizar la recirculación del solvente dirigido al mezclador. El proceso fue ejecutado con 5 platos diferentes para elegir el adecuado de acuerdo a la composición de la mezcla. Figura 3.20 Esquema de la simulación de la destilación etanol – agua. 64 CAPÍTULO III.- RESULTADOS Y DISCUSIÓN 3.3.- EFECTO DEL DISEÑO DE PLATO EN LA EFICIENCIA DE SEPARACIÓN. El diseño del plato que se utilizó en el proceso de la destilación es el bubble cap por las siguientes características, el simulador proporciono información acerca de cuatro factores: el factor de inundación, la caída de presión, la velocidad y la pureza del azeótropo, para la toma de decisión de un equipo eficiente y la obtención de una pureza en el azeótropo de etanol, mostrado en la tabla 3.5. Como los valores fueron semejantes el análisis se resumió a elegir el plato por la segunda variable que es la caída de presión, con respecto al factor de inundación los tres primeros tienen cantidades similares, el cuarto plato es muy alto y afectaría al vertedero, el ultimo tiene una capacidad demasiado pequeña. La velocidad del flujo de la mezcla está en un rango de 2.0*10ˆ-4 para los cinco platos por lo que otra variable definirá cual es el más preciso. Con respecto a la pureza del azeótropo el más bajo fue el Sieve por lo que definitivamente quedo excluido, las demás opciones tiene el 91 % por lo que es un muy buen resultado el que se obtuvo, examinando la caída de presión entre más baja mejor, porque la presión manejada durante todo el proceso es de 14.7 psia, así que el plato que proporciono todas las características favorables es el Bubble cap con respecto al análisis estadístico que se realizó. Tabla: 3.5 Factores de para la eficiencia de los platos Tipo de platos Factor de Caída inundación de presión (atm) Pureza Velocidad m/s azeótropo de etanol Bubble cap 0.00668385 0.10624515 0.00021011 0.9173 Sieve 0.00698094 0.32360399 0.00020568 0.7526 Glitsch ballast 0.00668185 0.25034347 0.00021015 0.9186 Koch flexitray 0.00937193 0.14767851 0.00021015 0.9186 0.00443530 0.28207249 0.00021015 0.9186 Nutter float valvue 65 del CAPÍTULO III.- RESULTADOS Y DISCUSIÓN Análisis estadístico Medidas de dispersión: Factor de inundación: 𝑀𝑒𝑑𝑖𝑎 𝑥 = 0.005692311 Varianza 2 𝑆 = 2 𝑆 = ∑ 𝑥2− (∑ 𝑥)2 𝑛 Ec. 2.15 𝑛−1 0.00024555 − 4 0.001166 5 𝑆 2 = 3.063 ∗ 10−6 Desviación estándar 𝑆 = √𝑆 2 𝑆 = 0.00175 68 % = 0.005692311 ± 0.00175 1° = 0.00744 2° = 0.00394 Con los datos obtenidos hay tres platos posibles a elegir: Bubble cap Sieve Glitsch ballast Caída de presión 𝑀𝑒𝑑𝑖𝑎 𝑥 = 0.1849 Varianza 2 𝑆 = 0.28 − 4 66 1.232 5 Ec. 2.16 CAPÍTULO III.- RESULTADOS Y DISCUSIÓN 𝑆 2 = 0.0084 Desviación estándar 𝑆 = 0.09165 68 % = 0.1849 ± 0.09165 1° = 0.09325 2° = 0.27655 El primer valor se acerca al plato Bubble Cap y el segundo al Nutter Float Valve, en la literatura se menciona que entre menos caída de presión mejor porque se realiza una purificación mayor para cada componente a separar, por lo tanto el mejor plato es el Bubble Cap. Velocidad de flujo 𝑀𝑒𝑑𝑖𝑎 𝑥 = 0.000209248 Varianza 𝑆2 = 2.19 ∗ 10−7 − 4 1.094 ∗ 10−6 5 𝑆 2 = 2.5 ∗ 10−10 Desviación estándar 𝑆 = 0.000015811 68 % = 0.000209248 ± 0.000015811 1° = 0.0002250 2° = 0.0001934 El primer valor es el considerado ya que existe una mejor velocidad de flujo, que corresponde a cuatro de los platos empleados ya que se aproximan al resultado: Bubble Cap Glitsh Ballast 67 CAPÍTULO III.- RESULTADOS Y DISCUSIÓN Kock Flexitray Nutter Float Valve Pureza del azeótropo 𝑀𝑒𝑑𝑖𝑎 𝑥 = 0.88514 Varianza 2 𝑆 = 3.9393 − 4 19.5868 5 𝑆 2 = 0.00548 Desviación estándar 𝑆 = 0.07405 68 % = 0.88514 ± 0.07405 1° = 0.95919 2° = 0.81109 Lo que se pretende es obtener la mejor pureza para el etanol azeotrópico por lo que la mejor opción en este factor es el primero de 0.95919, los platos próximos a este valor son: Bubble Cap Glitsh Ballast Kock Flexitray Nutter Float Valve El simulador también proporciono las siguientes gráficas para conocer el comportamiento de la mezcla en el plato empleado: En el gráfico de la figura 3.21 se muestra el comportamiento de la temperatura en los ochenta platos con respecto a los valores de la tabla 3.6. 68 CAPÍTULO III.- RESULTADOS Y DISCUSIÓN Tabla 3.6 Variación de la temperatura Plato / No. 1 40 80 Bubble Cap 177.5 221.9 355 Sieve 177.5 180 348 Glitsh Ballast 150 150 354 Kock Flexitray 120 120 354 Nutter Float Valve 160 160 353 Temperatura Variación de la temperatura 400 350 300 250 200 150 100 50 0 0 10 20 30 40 50 60 70 80 90 No. de platos Bubble Cap Sieve Glitsh Ballast Kock Flexitray Nutter Float Valve Figura 3.21 Comportamiento de la temperatura en los diferentes platos Con respecto al flujo del vapor (Kmol/hr) la figura 3.22 demuestra que el plato que presenta el valor más alto sobre los diferentes platos utilizados es el Sieve, ya que en los cuatro restantes los valores son similares como lo expresa la tabla 3.7. Tabla 3.7 Datos de la velocidad del vapor por cada plato utilizado Plato / No. Bubble Cap Sieve Glitsh Ballast Kock Flexitray Nutter Float Valve 1 10 0 0 0 0 69 40 202 223 206 200 200 80 180 210 185 187 180 CAPÍTULO III.- RESULTADOS Y DISCUSIÓN Velocidad de vapor (Kmol/hr) Velocidad de vapor 240 220 200 180 160 140 120 100 80 60 40 20 0 0 10 20 30 40 50 60 70 80 90 No. de platos Bubble Cap Sieve Glitsh Ballast Kock Flexitray Nutter Float Valve Figura 3.22 Comportamiento de la velocidad del vapor en los platos Los resultados de simulación arrojo dos graficas con respecto a la Velocidad (Kmol/hr) en este caso es con al Líquido (figura 3.23), los datos son próximos en cada uno de los platos como lo muestra la tabla 3.8. Tabla 3.8 Datos de la velocidad de flujo (líquido) por cada plato utilizado Plato / No. Bubble Cap Sieve Glitsh Ballast Kock Flexitray Nutter Float Valve 1 212 237 212 210 213 70 40 212 237 220 218 212 80 12.5 12.5 12.5 10 10 CAPÍTULO III.- RESULTADOS Y DISCUSIÓN Velocidad del líquido (Kmol/hr) Velocidad del líquido 250 200 150 100 50 0 0 20 40 60 80 100 No. de platos Bubble Cap Sieve Glitsh Ballast Kock Flexitray Nutter Float Valve Figura 3.23 Comportamiento de la velocidad del líquido en los diferentes platos La concentración del etanol en el proceso es de gran importancia porque lo que se busca en esta simulación es obtención de un producto con una calidad de pureza más alta, los resultados se muestran en la tabla 3.9 los cuales favorecen al Bubble Cap y se representan en la figura 3.24, el compuesto obtiene menor concentración en la torre de destilación. Tabla 3.9 Concentración de etanol en la torre de destilación Plato / No. Bubble Cap Sieve Glitsh Ballast Kock Flexitray Nutter Float Valve 1 0.05 0.83 0.98 0.97 0.98 71 40 0.11 0.68 0.9 0.89 0.87 80 0.38 0.46 0.4 0.42 0.41 CAPÍTULO III.- RESULTADOS Y DISCUSIÓN Concentracción Concentración de etanol en la torre de destilación 1.2 1 0.8 0.6 0.4 0.2 0 0 10 20 30 40 50 60 70 80 90 No. de platos Bubble Cap Sieve Kock Flexitray Nutter Float Valve Glitsh Ballast Figura 3.24 Concentración de etanol con respecto a los platos En la simulación, la hidráulica consiste en la velocidad de flujo del vapor (Kmol/hr) en todos los flujos del proceso. Tabla 3.10 Datos del sistema hidráulico de los flujos Plato / No. 1 40 80 Bubble Cap 41000 42000 48000 Sieve 43000 44000 44900 Glitsh Ballast 41000 42000 46000 Kock Flexitray 52000 54000 63000 Nutter Float Valve 38000 41000 59000 72 CAPÍTULO III.- RESULTADOS Y DISCUSIÓN 70000 60000 50000 40000 30000 20000 10000 0 0 10 20 30 40 50 Bubble Cap Sieve Kock Flexitray Nutter Float Valve 60 70 80 90 Glitsh Ballast Figura 3.25 Comportamiento del sistema hidráulico de los flujos La exergía es la cantidad de energía para agilizar un trabajo, todos los platos la presentan en la torre de destilación, pero el simulador solo presenta dos de los cuales el Bubble Cap tiene una pérdida menor en comparación con el Sieve como se representa en la tabla 3.11 y la figura 3.26. Tabla 3.11 Datos de exergía en la torre de destilación Plato / No. 1 40 80 Bubble Cap -100500 0 36000 Sieve -100800 0 41000 Glitsh Ballast -100675 0 39000 Kock Flexitray -150700 0 43000 Nutter Float Valve -150950 0 43000 73 CAPÍTULO III.- RESULTADOS Y DISCUSIÓN Exergía pérdida Exergía pérdida Cal/sec 100000 50000 0 -50000 0 10 20 30 40 50 60 70 80 90 -100000 -1500003.26 Grafica de la exergía perdida durante el proceso Figura -200000 No. de platos Bubble Cap Glitsh Ballast Nutter Float Valve Sieve Kock Flexitray Figura 3.26 Grafica de la exergía perdida durante el proceso 74 CONCLUSIONES Al comenzar la redacción de esta tesis la finalidad principal era obtener un grado de pureza del etanol por encima del 90% para que se comprobara que se puede utilizar como un combustible alterno, su manejo en el sector industrial y farmacéutico siguiera en pie, este punto se cumplió ya que en las corridas de rate based con el plato Bubble cap se logró obtener un azeótropo de 91.73% de purificación, con una alimentación de 100 Kg/hr en la torre, el solvente que se utilizó por sus propiedades físicas es el etilenglicol que como primer flujo de entrada fue de 175 Kg/hr y en la recirculación se planteó un flujo de 336 Kg/hr. Con lo que respecta a los platos, los datos proporcionados por el simulador resultaron con mucha similitud, de los cuatro primeros factores: el factor de inundación, la caída de presión, la velocidad y la pureza del azeótropo que se presentaron, solo la caída de presión mostro un punto favorable al plato Bubble Cap, que se capturo mediante un análisis estadístico obteniendo la primer característica de eficiencia con respecto a los demás. Para realizar un análisis un poco más amplio el simulador proporciono graficas con respecto al comportamiento de la temperatura, velocidad de flujo, concentración, hidráulica y exergía en los cinco diferentes platos, sucedió lo mismo en los factores anteriores ya que solo en el tercer punto (concentración) hubo un cambio favorable para un plato en este caso el Bubble Cap, por la cantidad de etanol que se encuentra dentro de la torre de destilación, pues entre menor cantidad de etanol en la torre mejor destilado se obtiene. 75 CONTENIDO DE TABLAS Pág. Tabla 1.1 Ecuaciones de estado para 1 mol……………………………………… 18 Tabla 1.2 Información azeotrópica para sistemas binarios seleccionados……. 23 Tabla 1.3 Información azeotrópica para sistemas binarios seleccionados……. 24 Tabla 1.4 Lista de ejemplos de mezclas azeotrópicas con su respectivo disolvente para la separación de la misma por el método de destilación extractiva…………………………………………………………………………….. 25 Tabla 3.5 Factores de la eficiencia de los platos…………………………………. 64 Tabla 3.6 Variación de la temperatura……………………………………………. 68 Tabla 3.7 Datos de velocidad de flujo (vapor) por cada plato utilizado………… 68 Tabla 3.8 Datos de la velocidad de flujo (líquido) por cada plato utilizado…… 69 Tabla 3.9 Concentración de etanol en la torre de destilación…………………… 70 Tabla 3.10 Datos del sistema hidráulico de los flujos……………………………. 71 Tabla 3.11 Datos de exergía en la torre de destilación…………………………. 72 76 CONTENIDO DE FIGURAS Pág. Figura 1.1 Mezcla líquido-vapor en equilibrio a temperatura y presión constantes…………………………………………………………………………… 13 Figura 1.2 Datos de equilibrio para la mezcla etanol-agua……………………… 21 Figura 1.3 Planta para una destilación flash……………………………………… 27 Figura 1.4 Columna de fraccionamiento continúo con secciones de rectificación y agotamiento……………………………………………………….... 28 Figura 1.5 Diagrama esquemático de la destilación extractiva…………………. 28 Figura 1.6 Diagrama de una torre de destilación………………………………… 31 Figura 1.7 Diagrama del comportamiento de la mezcla etanol-agua…………. 32 Figura 1.8 a) Esquema del plato Bubble Cap…………………………………….. 39 b) Esquema del plato Bubble Cap en la torre de destilación……….. 39 Figura 1.9 Esquema del plato Glitsh Ballast……………………………………… 42 Figura 1.10 Esquema del plato Koch Flexitray…………………………………… 43 Figura 1.11 Esquema del plato Nutter Float Valve………………………………. 44 Figura 2.12 Condiciones del solvente para el proceso de destilación extractiva 51 Figura 2.13 Ecuación de estado de la simulación………………………………... 52 Figura 2.14 Esquema de los equipos utilizados en la simulación de la mezcla etanol-agua a) Mezclador de etilenglicol………………………………………….. 53 b) Torre de destilación de la mezcla etanol - agua………………… 53 c) Torre de destilación empleado para la separación del etilenglicol y el agua……………………………………………….. 54 d) FSplit recircula el etilenglicol que se recuperó al mezclador…… 54 Figura 2.15 a) Número de platos en el proceso de destilación………………… 55 b) Entrada de alimentación de la mezcla etanol-agua a la torre de destilación…………………………………………………………………………… 55 Figura 2.16 Relación de reflujo del proceso de destilación……………………… 56 Figura 2.17 Tipo de platos del simulador Aspen Plus……………………………. 58 Figura 2.18 Diámetro y espaciamiento de los platos…………………………….. 60 Figura 3.19 Componentes que se utilizaron en la simulación…………………... 62 77 CONTENIDO DE FIGURAS Figura 3.20 Esquema de la simulación de la destilación etanol-agua………… 63 Figura 3.21 Comportamiento de la temperatura en los diferentes platos……… 68 Figura 3.22 Comportamiento de la velocidad del vapor en los platos………… 69 Figura 3.23 comportamiento de la velocidad del líquido en los diferentes platos………………………………………………………………………………… 70 Figura 3.24 Concentración de etanol con respecto a los platos………………… 71 Figura 3.25 Comportamiento del sistema hidráulico de los flujo……………….. 72 Figura 3.26 Grafica de la exergía perdida durante el proceso………………….. 73 78 BIBLIOGRAFÍA Bernal Daniel, C. O. (2011). Analisis y diseño de platos y columnas de platos. Bogotá, Colombia: Universidad Nacional de Colombia. Bölts, J. G. (1996). Azeotropic data for Binary and ternary sistems at moderate pressures. Journal of Chemical and Engineering, 202 - 209. Carrión Carrión, E. (2011). Termoquímica. Castellan, G. W. (1974-1987). Fisicoquimica. Colombia, U. A. (2006). Producción de Etanol Absoluto por Destilacion Extractiva Combinada con Efecto Salino. Dyna. Costa, J. (2005). Diccionario de química física. Barcelona, España: Ediciones UB. Fernández Boro, J. F. (2002). Problemas resueltos de flujo de canales. Universidad politecnica de valencia. Flexitray Valve Trays. (2003). Henley, S. (1988). Operaciones de Separación por Etapas de Equilibrio en Ingeniería Química. Reverté S.A. Himmelblau, D. M. (2002). Principios básicos y cálculos en ingeniería química. México: Pearson Educación. Jacobs, G., Stupin, S., & Kuskie, R. y. (2008). Aparato para la distribución de reactor y de mezcla en la zona de atemperación. España: Fluor Corporation. Jaramillo Sánchez, J. A. (2004). Química. España: Mad S.I. Manual de Diseño del Ballast Tray. (s.f.). Bolletin 4900; 6 ed. McCabe, W., & Smith, J. (1981). Operaciones básicas de ingeniería química. Barcelona, España: Reverté. Mendoza Rojas, C., & Enciso López, B. (2006). Estandarización de parámetros de operación para obtener bioetanol anhídrido por destilación extractiva. Ingenieria Química. Mulero, A., & Cachaduña, I. (2004). Validez y Presición de Correlaciones Empíricas Sencillas para el Cálculo de Entalpías de Exceso. Información Tecnológica. Mulero, A., & Cachaduña, I. (2044). Validez y Precisión de Correlaciones Empíricas Sencillas para el Cálculo de Entalpías de Exceso. Información Tecnológica. 79 BIBLIOGRAFIA Perry, R. H. (2010). Manual del Ingeniero Químico. Mc Graw Hill. Quintero, J., Montoya, I., Sánchez, O., & Cardona, C. (2007). Evaluación de la deshidratación del alcohol carburante mediante simulación procesos . Ciencias Agropecuarias, 72. Roller, D., & Blum, R. (1996). Física. Barcelona, España: Reverté. Roza, M., Nutter, D., & Chemtech, S. (2000). The Right Tray for any Application. Sulzer Technical Review. Thomas Engel, P. R. (2007). Introducción a la fisicoquímica: termodinámica. Treybal, R. E. (s.f.). Operaciones de Transferencia de Masa. Mc Graw Hill. Uyazán, A. M., Aguilar, J. L., Rodríguez, G., & Caicedo, L. A. (2004). Deshidratación de etanol. 24, 49 - 59. Uyazán, A. M., Aguilar, J., & M, L. C. (2006). Producing fuel alcohol by extractive distillation: simulating the process with glycerol. 26, 45-50. Warren L. McCabe, J. C. (1995). Operaciones unitarias en Ingeniería Química. España: McGraw-Hill. Yunus A. Cengel, M. A. (2009). Termodinámica. México: Mc Graw Hill. 80



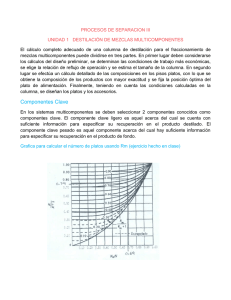

![practica 5[1]](http://s2.studylib.es/store/data/007425075_1-61f96af50a4c20310ac423e2aba15d52-300x300.png)


