Teórico 5
Anuncio
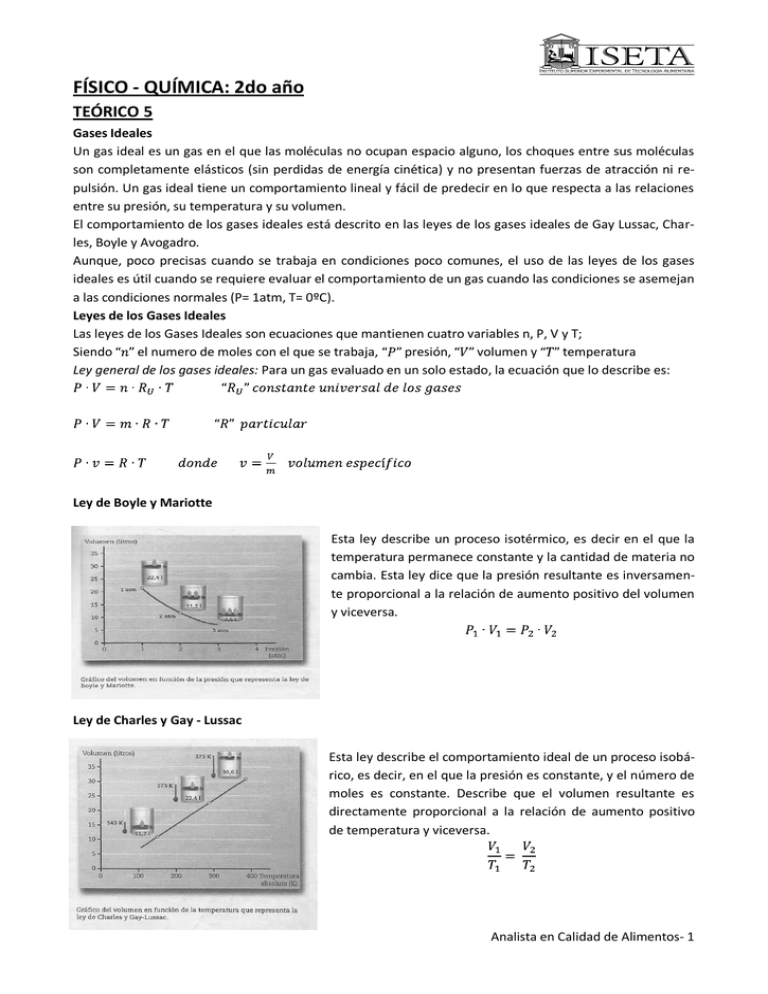
FÍSICO - QUÍMICA: 2do año TEÓRICO 5 Gases Ideales Un gas ideal es un gas en el que las moléculas no ocupan espacio alguno, los choques entre sus moléculas son completamente elásticos (sin perdidas de energía cinética) y no presentan fuerzas de atracción ni repulsión. Un gas ideal tiene un comportamiento lineal y fácil de predecir en lo que respecta a las relaciones entre su presión, su temperatura y su volumen. El comportamiento de los gases ideales está descrito en las leyes de los gases ideales de Gay Lussac, Charles, Boyle y Avogadro. Aunque, poco precisas cuando se trabaja en condiciones poco comunes, el uso de las leyes de los gases ideales es útil cuando se requiere evaluar el comportamiento de un gas cuando las condiciones se asemejan a las condiciones normales (P= 1atm, T= 0ºC). Leyes de los Gases Ideales Las leyes de los Gases Ideales son ecuaciones que mantienen cuatro variables n, P, V y T; Siendo el numero de moles con el que se trabaja, presión, volumen y temperatura Ley general de los gases ideales: Para un gas evaluado en un solo estado, la ecuación que lo describe es: Ley de Boyle y Mariotte Esta ley describe un proceso isotérmico, es decir en el que la temperatura permanece constante y la cantidad de materia no cambia. Esta ley dice que la presión resultante es inversamente proporcional a la relación de aumento positivo del volumen y viceversa. Ley de Charles y Gay - Lussac Esta ley describe el comportamiento ideal de un proceso isobárico, es decir, en el que la presión es constante, y el número de moles es constante. Describe que el volumen resultante es directamente proporcional a la relación de aumento positivo de temperatura y viceversa. Analista en Calidad de Alimentos- 1 Ley de Gay Lussac Esta ley describe el comportamiento de un proceso isométrico o de volumen constante y número de moles es constante. Indica que la presión resultante es directamente proporcional a la relación del cambio positivo de temperatura y a la presión original también enuncia que la temperatura resultante es directamente proporcional al cambio positivo de la presión. Calores Específicos La diferencia de calores específicos en los gases se explica en términos de la primera ley de la termodinámica: En el proceso a volumen constante En el proceso a presión constante remplazando por (1) tenemos Simplificando, obtenemos . Analista en Calidad de Alimentos- 2











