Tema 2 - OCW UPM
Anuncio

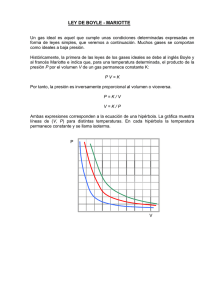
TEMA 2 CONCEPTOS BÁSICOS Gases ÍNDICE 1.2.3.4.5.6.- Leyes de los gases Ley de Boyle – Mariotte Ley de Charles - Gay Lussac Principio de Avogadro Ley de estado de los gases ideales Aplicaciones 1. Leyes de los gases El comportamiento físico de un gas está determinado por cuatro variables (denominadas variables de estado): presión (P), volumen (V), temperatura (T) y número de moles del gas (n). Ahora bien, estas variables no son independientes. La Presión que ejerce un gas sobre las paredes del recipiente que lo contiene, el Volumen que ocupa, la Temperatura a la que se encuentra y la cantidad de sustancia que contiene (número de moles) están relacionadas. Las leyes de los gases se basan en observaciones experimentales y describen el efecto, sobre el volumen de un gas, de la modificación de una variable mientras se mantienen constante las otras dos. 2. Ley de Boyle - Mariotte La ley de Boyle - Mariotte relaciona el volumen y la presión de una cierta cantidad de gas mantenida a temperatura constante. La ley dice que el volumen es inversamente proporcional a la presión manteniendo la P r e s i ó n temperatura constante: 1 V P P × V = cte P1 × V1 = P2 × V2 Volumen 3. Ley de Charles y Gay-Lussac El volumen de los gases varía con la temperatura El volumen de un gas, a presión constante, es directamente proporcional a la temperatura absoluta. La presión y la temperatura están relacionadas A volumen constante, la presión de un gas es directamente proporcional a la temperatura absoluta del sistema. V T que es lo mismo que: V = cte T (ºK) 4. Ley de Avogadro Hipótesis de Avogadro: En las mismas condiciones de presión y temperatura volúmenes iguales de gases diferentes contienen el mismo número de moléculas. Ley de Avogadro: a una determinada temperatura y presión el volumen de un gas es directamente proporcional al número de moles. V = constante × n 5. Ecuación de estado de los gases ideales A partir de las Leyes de Boyle–Mariotte, Charles Gay Lussac y Avogadro, se puede determinar la ecuación que relaciona estas variables, conocida como ecuación de estado de los gases ideales. 1 V P V T V n 1 V T , n, P (constantes n y T) Ley de Boyle) (constantes n y P) Ley de Charles) (constantes T y P) Ley de Avogadro) Agrupando Es decir PV=nRT El valor de R (constante de los gases ideales) puede determinarse experimentalmente y tiene un valor de (0,082 atm.L/K.mol ). 6. Aplicaciones En condiciones de presión constante, una muestra de gas hidrógeno con un volumen inicial de 9,6 L a 88ºC se enfría hasta que se reduce el volumen a 3,4 L. ¿Cuál es su temperatura final? Al resolver ejercicios utilizando la ecuación En las condiciones iniciales: P1 V1 = n RT1 En las condiciones finales: P2 V2 = n RT2 P V n RT n R PV PV PV 1 1 2 2 T T1 T2 Sustituyendo los valores tenemos: 9,6 3,4 3,4 361 T2 127,8 K 273 88 T2 9,6