Cálculo de pH
Anuncio

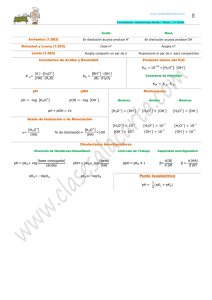
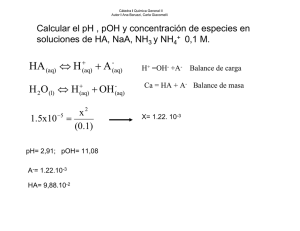
Cálculo del pH de disoluciones de ácidos Si se disuelve en agua un ácido HA, de concentración CA y constante Ka: HA ⇔ A- + H+ H2O ⇔ H+ + OHPara calcular las concentraciones de las especies en el equilibrio, planteamos: B.M. CA = [HA] + [A-] B.C. [H+] = [A-] + [OH-] [ A − ] [H+ ] La expresión de la constante sería: K A = [HA ] [A-] = [H+] - [OH-] Del balance de carga: Sustituyendo en el balance de masa: CA = [HA] + [H+] - [OH-] [HA] = CA – [H+] + [OH-] [H ] = K + A ⋅ [HA ] [A − ] = KA ⋅ C a − [H + ] + [OH− ] [H+ ] − [OH− ] * Ácido fuerte: se encuentra totalmente desplazada hacia la derecha, por tanto, [HA] será igual a cero [HA] = CA - [H+] + [OH-] = 0 [H+] = CA + [OH-] Excepto en el caso de disoluciones extremadamente diluidas (CHA < 10-6 M), se puede despreciar el segundo sumando [H+] = CA En caso contrario [H+] = C A + K w [H+] * Ácido de fuerza media. [H+] >> [OH-]. Por tanto, *Ácido débil. [H+] << CA [H+] = K a C A - [H+] [H+] [H+] = K a CA * Ácido muy débil [H+] = K a CA +] - [ [H OH-] [H+ ]2 - [H+][OH-] = K a CA [H+] = K a CA + K w Cálculo del pH de disoluciones de bases Todo lo dicho para los ácidos es válido para las bases. B + H2O ⇔ BH+ + OHH2O ⇔ H+ + OHB.M. CB = [B] + [BH+] B.C. [BH+] + [H+] = [OH-] KB = [BH + ] [OH − ] [B] [BH+] = [OH-] – [H+] Del balance de carga: Sustituyendo en el balance de masa: CB = [B] + [OH-] – [H+] [B] = CB – [OH-] + [H+] [OH − ] = K B ⋅ [B] [BH + ] = KB ⋅ C B − [OH − ] + [H + ] [OH − ] − [H + ] * Base fuerte. Las consideraciones a tener en cuenta serán [OH-] >> [H+] [B] = CB + [H+] - [OH-] = 0 [OH-] = CB + [H+] Se puede simplificar CB = [OH-] siempre que CB > 10-6 M. En caso contrario [OH-] = CB + K w[OH ] * Base de fuerza media. [OH-] >> [H+] [OH − ] = K B ⋅ C B − [OH − ] [OH − ] * Base débil. CB >> [OH-] [OH − ] = K B ⋅ CB [OH − ] * Base muy débil [OH − ] = K B ⋅ CB − [OH ] − [H + ] Mezclas de ácidos Supongamos dos ácidos monopróticos HA y HB, [A-] [H+] = KA [HA] [B-] [H+] HB ↔ B- +H+ KB = [HB] + H2 O ↔ H + OH HA ↔ A- +H+ [H+] = [ A -] + [B-] + [OH-] [HA] [HB] [ A -] = K A + [B-] = K b + [H ] [H ] B.C. Sustituyendo en el balance de cargas [H+] = K A [HA] [HB] K W + + K B [H+] [H+] [H+] [OH-], al tratarse de una mezcla de ácidos, en principio, será despreciable. [H+] = K A [HA] [HB] + KB + + [H ] [H ] Si llamamos CA y CB a las concentraciones iniciales de los ácidos, CA = [HA] + [ A -] = [HA] + K A [HA] +] [H [HA] = CA [H+] [H+] + K A CB = [HB] + [B-] [HB] = = [HA] [H+] ([H+] + K A ) CB [H+] [H+] + KB Sustituyendo las expresiones de [HA] y [HB] en la de [H+] [H+] = K A CA [H+] KB CB [H+] + [H+] [H+] + K A [H+] [H+] + KB K A CA KB CB [H+] = + + [H ] + K A [H+] + KB ( ) ( ) Esta expresión general permite conocer la concentración de protones de una mezcla de dos ácidos, conociendo sus constantes de disociación y su concentración inicial. Sin embargo, al desarrollar esta expresión se obtiene una ecuación cúbica difícil de resolver, por lo que es más frecuente utilizar las simplificaciones para los siguientes casos: * Mezcla de ácidos fuertes KA >> [H+]; KB >> [H+] K C K A CA ≈ A A = CA [H+] + K A KA Por tanto K A CB K C ≈ B B = CB + [H ] + KB KB [H+] = CA +CB * Mezcla de un ácido fuerte y otro débil. La primera aproximación hecha en el apartado anterior es válida K A CA ≈ CA [H+] + K A Sin embargo, si HB es débil, KB << [H+], ya que está en presencia de un ácido fuerte K C KB CB ≈ B B [H+] + KB [H+] De donde obtenemos una ecuación de segundo grado que podemos resolver. * Mezcla de ácidos débiles. Hay que resolver la expresión general en la que obteníamos una ecuación de tercer grado. Mezclas de bases Supongamos dos bases B1OH y B2OH de concentración CB1 y CB2, respectivamente B1 OH ↔ B+ 1 + OH + B2 OH ↔ B2 + OH [B+ 1 ] [OH ] KB 1= [B1 OH] KB 2 = [B+ ] [OH − ] 2 [B2 OH] Siguiendo el mismo razonamiento empleado para las mezclas de ácidos, haciendo balance de cargas [ OH] KB 2 [B2 OH] K W [OH-] = [B1+] + [B+2] + [H+] = KB 1 B1+ + [OH ] [OH-] [OH-] Despreciando el último término por tratarse de una mezcla de bases [ OH] KB 2 [B2 OH] [OH-] = KB 1 B1+ [OH ] [OH-] Haciendo ahora balances de masa y sustituyendo CB 1 = [B1 OH] + [B1+] CB 2 = [B2 OH] + [B+2] [OH-] = KB 1 CB1 BB 2 CB 2 + [OH ] + KB 1 [OH-] + KB 2 Expresión general que podemos simplificar para: * Mezcla de bases fuertes. [OH-] = [B1+] + [B2+] * Mezcla de una base débil y una fuerte. [OH-] = CB 1 + KB 2 C-B 2 [OH ] * Mezcla de bases débiles. Resolveríamos la ecuación general de tercer grado o recurriríamos al método de aproximaciones sucesivas. pH de un ácido diprótico (H2A) + H2 A ⇔ HA + H K1 = HA - ⇔ A 2- + H+ K2 = [HA -] [H+] [H2 A] [ A 2-] [H+] [HA -] [ A 2-] [H+ ]2 K1 ⋅ K 2 = [H2 A] Si hacemos un balance de masas: CA = [H2A] + [HA-] + [A2-] Haciendo también un balance de cargas: [H+] = [OH-] + [HA-] + 2 [A2-] Si en la expresión anterior despreciamos [OH-], y ponemos [HA-] y [A2-] en función de [H2A], nos queda [ A] [ A] [H+] = H2 + K1 + 2 K1 K 2 H22 = [H2 A] K+1 + 2 K1 K22 [H ] [H ] [H+ ] [H+ ] en la expresión del balance de masas CA = [H2 A] + K1 [H2 A] K1 K 2 [H2 A] + = [H2 A] 1 + K+1 + K1 K22 + 2 [H ] [H ] [H+ ] [H+ ] Si dividimos esta última expresión por la anterior nos queda 1 + K+1 + K1 K22 [H ] [H+ ] [H+ ]2 + K1 [H+] + K1 K 2 CA = = + K1 + 2 K1 K 2 [H+] K1 [H ] + 2 K1 K 2 [H+] [H+ ]2 Haciendo operaciones obtenemos [H+]3 + K1[H+]2 + K1K2[H+] - K1CA[H+] - 2 K1K2CA = 0 [H+]3 + K1[H+]2 + [H+](K1K2 - K1CA) - 2 K1K2CA = 0 Ecuación de tercer grado cuya resolución nos daría el pH de la disolución. Si K1 >> K2; K1CA >> K1K2 , y 2 K1K2CA será despreciable [H+]3 + K1[H+]2 - K1CA [H+] = 0 De las tres soluciones de la ecuación, sacando factor común [H+], quedaría [H+]2 + K1[H+] - K1CA = 0 que es la misma expresión que se obtenía para un ácido monoprótico de fuerza media. Cálculo del pH de un anfolito Consideremos un anfolito de forma general que se disocia NaHA ⇔ Na+ + HAcomo ácido HA- ⇔ H+ + A2como base HA- + H+ ⇔ H2A H2O ⇔ H+ + OHB.M.: Canf = [H2A] + [HA-] + [A2-] B.C.: [H+] + [Na+] = [H+] + Canf = [OH-] + [HA-] + 2 [A2-] restando el balance de masas del balance de cargas B.C. – B.M.: [H+] + Canf - Canf = [OH-] + [HA-] + 2 [A2-] – ([H2A] + [HA-] + [A2-]) [H+] = [OH-] + [A2-] – [H2A] Si ponemos todo en función de [HA-] (anfolito) K1 = [HA -] [H+] [H2 A] K1 ⋅ K 2 = K2 = [ A 2-] [H+] [HA -] [ A 2-] [H+ ]2 [H2 A] Por otra parte [H+] = K 2 [HA ] K W [HA -] [H+] + [H+] [H+] K1 2 2 K1 [H+ ] = K1 K 2 [HA -] + K1 K W - [HA -] [H+ ] ( ) [H+ ]2 K1 + [HA -] = K1 K 2 [HA -] + K1 K W [H+] = K1 K 2 [HA -] + K1 K W K1 + [HA -] [HA − ] [H+] [ -] +[HA-]+ K2 HA [H+] K1 [H+] 2 - = [ ] 1 + + K+ Canf HA [H ] K1 Canf =[H2 A]+[HA-]+[A2-]= Si α = 1, Canf = [HA-]; para que esto se cumpla [H+] << K1 y [H+] >> K2;: ( + ) + [H+] = K1 K W K 2 Canf = K W K 2 Canf K1 + Canf 1 + Canf K1 Normalmente: - Canf >> K1; por tanto 1 + Canf/K1 Canf/K1 - además K2Canf >> Kw Sustituyendo [H+] = K 2 Canf = Canf / K1 K1 K 2 log [H+] = 1/2 (log K1 + log K2) pH = 1/2 (pK1 + pK2) Cálculo de la concentración de las especies a un pH dado Ácido monoprótico HA ↔ A- +H+ Ka = [A-] [H+] [HA] Las fracciones molares de las especies que participan en el equilibrio serán α0 = [HA] [HA] + [ A -] y α1 = [ A -] [HA] + [ A -] Sustituyendo el valor de [HA] deducido de la constante de equilibrio queda α0 = [H+] [H+] + K a [HA] = C aα y α1 = Ka +] + [H Ka [A-] = C aα 1 0 Diagrama de distribución de especies 1,2 α0 α1 1,0 0 0,8 0,6 pK a 0,4 0,2 A- HA Diagrama de distribución para el ácido acético Ka = 1.8·10-5 0,0 0 2 4 6 pH 8 10 Ácido diprótico H2A Ca = [H 2A] + [HA-] + [A2-] Esta expresión se puede poner en función de [H2A] Ca = [H2 A] + K1 [H2 A] + K1 K 2 [H2 A] [H+] [H+ ]2 [HA -] K1 [H+] = = α1 Ca [H+ ]2 + K1 [H+] + K1 K 2 [ A 2 -] K1 K 2 = = α2 2 + Ca [H ] + K1 [H+] + K1 K 2 Diagrama de distribución de especies 1,2 1,0 H 2A HA α0 α1 - A 2- α2 α 0,8 0,6 pK a2 pK a1 0,4 0,2 0,0 -1 1 3 5 7 pH Diagrama de distribución del ácido oxálico (H2C2O4), K1 = 5,62·10-2, K2 = 5,15·10-5 Ácido poliprótico, HnA En este caso, el denominador es el polinomio con (n+1) términos [H+]n + K1[H+] n-1 + K 1K 2[H +] n-2 + ..... + K 1K 2.....K n Las fracciones α 0, α 1, α 2, ....., α n se obtienen tomando sucesivamente como numerador de la fracción cada uno de los n + 1 términos: α0 = [H+]n [H+]n +K1 [H ]n-1+K1 K2 [H+]n-2 +.....+K1 K2 .....Kn n-1 α1 = K1 [H+ ] [H+ ]n + K1 [H+ ]n-1 + K1 K 2 [H+ ]n- 2 + ..... + K1 K 2 .....Kn α2 = K1 K 2 [H+ ] [H+ ]n + K1 [H+ ]n-1 + K1 K 2 [H+ ]n- 2 + ..... + K1 K 2 .....Kn αn= K1 K2 ..... Kn [H ] +K1 [H ] +K1 K2 [H+]n-2 +.....+K1 K2 .....Kn n- 2 +n + n-1