Escala de pH Para expresar la concentración de iones de
Anuncio

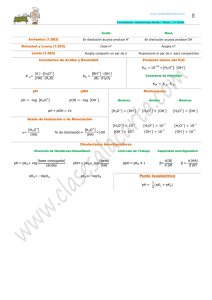
Escala de pH Para expresar la concentración de iones de hidrógeno se emplea una escala de medida denominada pH (se lee “pehache”) la cual se puede interpretar de la siguiente forma: Por ejemplo: el zumo de la fruta de maracuyá tiene un pH de aproximadamente 2. Esto quiere decir que este zumo es ácido y que la concentración (o también la cantidad) de iones de hidrógeno en el zumo de maracuyá es mayor que la concentración de iones hidróxido. Y que si le agregamos agua pura al zumo de maracuyá, le estamos disminuyendo la acidez. El pH se puede medir con un instrumento que se denomina “pehachímetro” el cual tiene generalmente sensor de temperatura. También se puede medir con una solución o con tiras de papel indicador universal de pH los cuales toman un color determinado según la solución a medir. El pH depende levemente de la temperatura. Cálculo del pH pH = - Log [H+] La fórmula anterior indica que para calcular el pH (potencial de hidrógeno) de una solución se debe conocer su concentración molar del ión hidrógeno que se representa por el símbolo MH o por [H+], lo que nos indica cuántas moles de H+ hay en un litro de solución. Para una solución de un ácido fuerte que contenga un solo hidrógeno como por ejemplo el ácido clorhídrico, [H+] es igual a la concentración molar del ácido. Suponga que tiene cualquier volumen de una solución de ácido clorhídrico con [HCl] = 0.05 (lo que se puede representar también como HCl 0.05 M; la M se lee molar). El valor del pH para esta solución se calculará de la siguiente forma: PH = - Log [H+] = - Log 0.05 = 1.3 Es decir que esta solución tiene un pH de 1.3 Para una solución de una base fuerte que tenga un solo grupo OH-, como por ejemplo el hidróxido de sodio, se debe calcular primero el pOH con la siguiente fórmula: pOH = - Log [OH- ] teniendo en cuenta que [OH- ] es la concentración molar del ión OH- el cual es igual para este caso a la concentración molar de la base. Por ejemplo para una solución de hidróxido de sodio 0.1 M, [OH- ] = 0.1 y por lo tanto: pOH = - Log [OH- ] = - Log 0.1 = 1 Es decir que esta solución tiene un pOH de 1 Para hallar el pH se emplea la siguiente relación: pH + pOH = 14 Por lo tanto pH = 14 – pOH = 14 – 1 = 13 que corresponde a una solución básica. Si desea más claridad o profundizar sobre el tema puede consultar Química y Ambiente 1 de Fidel A. Cárdenas.








![[editar]Definición](http://s2.studylib.es/store/data/008533524_1-f53108428f2c43501e4a8807a3697a86-300x300.png)











