para descargar el archivo
Anuncio
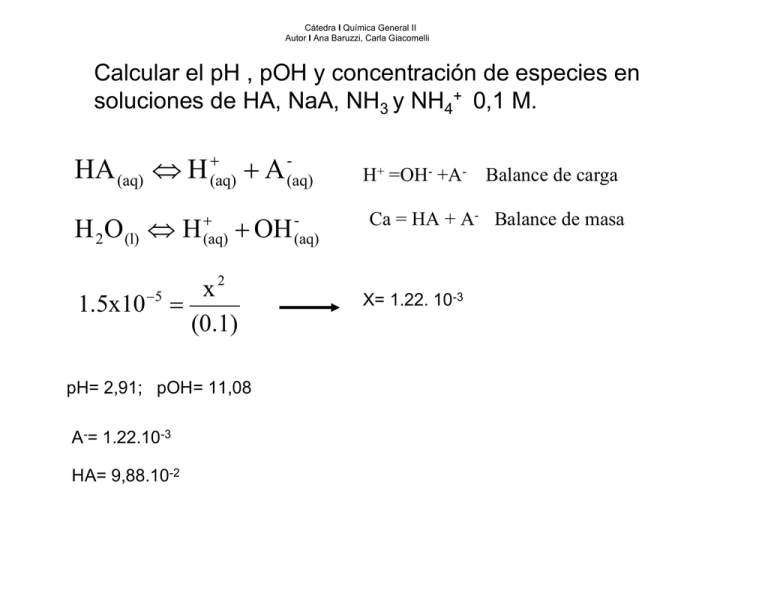
Cátedra I Química General II Autor I Ana Baruzzi, Carla Giacomelli Calcular el pH , pOH y concentración de especies en soluciones de HA, NaA, NH3 y NH4+ 0,1 M. HA (aq) ⇔ H H 2 O (l) ⇔ H + (aq) + (aq) +A + OH 2 x 1.5x10 −5 = (0.1) pH= 2,91; pOH= 11,08 A-= 1.22.10-3 HA= 9,88.10-2 (aq) (aq) H+ =OH- +A- Balance de carga Ca = HA + A- Balance de masa X= 1.22. 10-3 Fracción de Especies que se encuentra como ácido y como base. A-/Ca = grado de disociación = α . FRACCIÓN QUE ESTA COMO BASE 1,22x10-3 = 0,0122 0.10 HA/Ca =0,9878 . FRACCION QUE ESTÁ COMO ACIDO 0,9878+ 0,0122 =1 La fracción que está como base, en este caso A- , se conoce como α1 La fracción que está como ácido , en este caso HA, se llama α0. Esto es general para cualquier par ácido – base conjugado. NaA 0,01M NaA A- +Na+ A - + H + ⇔ HA K = 1/Ka + H 2 O (l) ⇔ H (aq) + OH -(aq) A + H 2 O (l) ⇔ HA + OH - H+ + Na+=OH- +ACa = HA + A- Kw = 1.10 -14 - Kb = Kw/Ka Balance de carga Balance de masa Sumando ambos balances H+ + HA + A- =OH- +A- Kb = 1.10-14 / 1,5.10 −5 = 6,6.10 −10 = x 2 / 0,1 x = 8,12.10 −6 pOH = 5,09 pH = 8,91 HA = 8,12 .10-6 A - = 0,1 − 8,12.10 −6 = 9,99.10 − 2 A-/Ca = 9,99.10-2/ 0,1= 0,9999= α1 HA/Ca = 8,12 .10-6/ 0,1= 8,12.10-5 = α0 Comparar con el caso anterior. α0 = fracción como ácido α1 = fracción como base Amoniaco 0,1 M NH 3(aq) + H 2 O (l) ⇔ NH + 4(aq) + OH (aq) 2 [NH 4+ ][OH - ] x Kb = = 1,8 . 10 - 5 = [NH 3 ] 0,1 - x x = 1 . 3 . 10 − 3 M [1,3 .10 −3 ] / 0 ,1 = 0 , 013 = α 0 ≅ 0 pOH = 2 ,87 pH = 11 ,12 NH NH + 4 = 1 . 3 . 10 − 3 M 3 = 0,1 - 1 . 3 . 10 − 3 = 0 , 0987 α 1 = 1 − 0 , 013 = 0 ,987 ≅ 1 Observar que la fracción que está como amonio es α0, , ya que es la fracción que está como ácido , mientras que α1, es la fracción que está como base en este caso amoníaco. Cloruro de amonio 0,1 M NH +4(aq) + H 2 O (l) ⇔ NH 3(aq) + H 3O + (aq) [NH 3 ][H 3O + ] −5 -14 Kw Ka = = / K = 1.10 / 1 , 8 . 10 b [NH +4 ] = 5,5.10 −10 = x 2 / 0,1 x = 7,41.10 −6 pH = 5,12 pOH = 8,87 [NH 3 = 7,41.10 −6 NH +4 = 0,1 − 7,41.10 −6 = 9,999.10 − 2 α0 ≅ 1 α1 ≅ 0 RESUMIENDO Solución pH Especies α0 α1 En orden de concentración HA ácido HA A- ~ H+ OH- ≅1 ≅0 A- básico AHA~ OH- ≅0 ≅1 ≅0 ≅1 H+ NH3 básico NH3 NH4+ ~OHH+ NH4+ ácido NH4+ NH3~ H+ OH- ≅1 ≅ 0 COMPOSICIÓN Y pH Es muy importante en muchos casos saber cómo varían las concentraciones de las especies con el pH. Sabiendo que la fracción de cada especie es una medida de su concentración se puede encontrar una expresión que la relacione con el pH Si se quiere calcular α0 , poner la concentración de A- en función de la concentración de HA y de H+. [A ] = - Ka [HA ] [H ] + Y reemplazarla en el balance de masa Ca = HA + Ka [HA ] [H ] + Luego encontrar la expresión para HA/ Ca HA Ca [ H ] = [H ]+ Ka = α 0 + + De la misma manera se puede encontrar la expresión para α1 A − Ca [Ka ] = [H + ]+ Ka = α1 Estas expresiones son válidas para la fracción de cualquier ácido y cualquier base. De esta manera conociendo el pH se puede conocer la concentración de cualquier especie y viceversa CONCLUSION IMPORTANTE Estas expresiones para α0 y para α1 , están de acuerdo con lo mostrado en la tabla para situaciones extremas donde predomina la especie básica o la especie ácida y los α valen 0 o 1. Existirán por lo tanto situaciones intermedias a las cuales se puede calcular la composiciÓn o el pH conociendo uno u otro a partir de las expresiones planteadas. Por ejemplo: Si las concentraciones de las especies ácida y básica son iguales los valores de α serán iguales e iguales a 0,5. Gráficos de α vs pH Gráficos de α vs pH