Descargar PDF
Anuncio

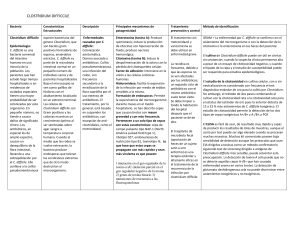
Documento descargado de http://www.elsevier.es el 20/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Ventana a otras especialidades Infección por Clostridium difficile Dolors Rodríguez-Pardo y Benito Almirante Servicio de Enfermedades Infecciosas. Hospital Universitario Vall d’Hebron. Barcelona. España. C. difficile es un bacilo grampositivo anaerobio esporulado asociado por primera vez a enfermedad en humanos en 1978, al identiicarse como agente causal de la colitis seudomembranosa1,2. Estudios realizados en Estados Unidos, Canadá y Europa han demostrado que desde principios de los años noventa la incidencia de diarrea asociada a C. difficile (DACD) se ha multiplicado entre 2 y 4,5 veces, convirtiéndose en una importante causa de morbilidad y mortalidad2-5. Actualmente C. difficile es la principal causa de diarrea en pacientes adultos hospitalizados, aunque también se han descrito episodios en el ámbito comunitario2,6. El objetivo de este artículo es presentar una revisión sobre la situación actual de la DACD. Puntos clave C. dificile es el principal agente causal diagnosticado de diarrea en pacientes adultos hospitalizados, aunque también se han descrito casos de adquisición comunitaria. Los diferentes factores de riesgo asociados a la aparición de esta enfermedad son: el consumo reciente de antibióticos, la edad superior a los 65 años, la estancia hospitalaria prolongada y haber presentado un episodio previo de diarrea asociada a C. dificile. El diagnóstico de la enfermedad se realiza mediante la detección de la toxina de C. dificile en heces de un paciente con un cuadro diarreico. El metronidazol, por vía oral, es el tratamiento de primera línea recomendado en una enfermedad no grave, mientras que en el caso de una enfermedad grave se aconseja la utilización de vancomicina oral. La detección precoz de los casos, el establecimiento de medidas de prevención de contacto, así como una política activa de uso adecuado de los antibióticos, son fundamentales para evitar la aparición de brotes de la enfermedad en pacientes institucionalizados. 140 GH CONTINUADA. mAyO-jUNIO 2011. VOL. 10 N.º 3 Epidemiología C. difficile forma parte de la lora normal fecal en el 1-3% de los residentes de la comunidad y en más del 20% de los adultos hospitalizados1,4. Se encuentra en las heces de pacientes sintomáticos y asintomáticos y el contagio se produce, a menudo, dentro del hospital en un entorno contaminado por esporas, por lo que el riesgo aumenta en proporción a la duración de la hospitalización1,4. El neonato raramente sufre la enfermedad, probablemente porque su intestino no expresa los receptores para la toxina1. C. difficile afecta especialmente a pacientes mayores de 65 años (tasas de incidencia de hasta 228 casos/100.000 habitantes), internados en hospitales y geriátricos, en quienes, debido a la coexistencia de diferentes comorbilidades, el consumo de antibióticos es muy elevado1,2,4. También se han descrito brotes de DACD que afectan a grupos de población considerados como de riesgo bajo (jóvenes de la comunidad, puérperas, etc.)2,6. Aspectos patogénicos y factores de riesgo La patogenia de la DACD se relaciona con la producción de diversas toxinas (toxina A enterotóxica, toxina B citotóxica y toxina binaria), que son reguladas por el gen tcdC, y con la respuesta inlamatoria que desencadenan1,2,7. Es probable que la respuesta deiciente de la IgG a la toxina A de C. difficile por parte del hospedador sea el factor que determine qué pacientes presentarán diarrea y quiénes serán únicamente portadores asintomáticos7. Recientemente, se ha descrito la aparición de la cepa denominada NAP I/ribotipo 027/toxinotipo III, capaz de producir toxina binaria y, debido a una mutación en el locus tcdC, presentar una elevada síntesis de toxinas A y B2,3,5,7. Esta cepa, dotada de una mayor virulencia, se ha asociado a los brotes descritos en América del Norte y en diversos países europeos2,3,5, se ha relacionado con Documento descargado de http://www.elsevier.es el 20/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Ventana a otras especialidades Infección por Clostridium difficile D. Rodríguez-Pardo y B. Almirante Detección de toxina de C. dificile en heces Primer episodio de DACD • Suspender o sustituir el antibiótico causal • Evitarloperamida,opiáceoseIBP • Brotenograve:metronidazol500mg/8h v.o.por10-14días • Brotegrave*:vancomicina125mg/6hv.o. por10-14días Resolución de los síntomas Primera recidiva Misma estrategia que en episodio inicial Portador asintomático Notratar Persistenciadelaclínica(≥6días)omegacolon • Cambiaravancomicinav.o.(simetronidazol previo) • Asociartratamientoporotravía(metronidazol i.v./vancomicinaenenemaoSNG) • Asociarinmunoglobulinas(400mg/kg/semana por2-3dosis) • Considerarcolectomía subtotal Segunda recidiva o posteriores Vancomicina125mg/6hv.o.por10-14días,seguidode •Vancomicinav.o.dosisdecrecientes: 125mg/12hpor7días 125mg/24hpor7días 125mg/48hpor8días(4dosis) 125mg/72hpor15días(5dosis)o •Rifaximina400mg/12hv.o.por14días Considerartratamientosadyuvantes: •Asociarprobióticos(Sacharomyces boulardii) •Inmunoglobulinai.v.400mg/kg/3semanaspor2-3dosis Tratamientos en estudio Tolevamer Fidaxomicina Bioterapias: •AnticuerpomonoclonalcontralastoxinasAyB •Trasplantefecal •ColonizaciónporcepasnotoxigénicasdeC. dificile •VacunacontoxoidedeC. dificile Figura 1. Algoritmo de actitud terapéutica de la diarrea asociada a C. diicile (DACD). IBP: inhibidores de las bombas de protones. SNG: sonda nasogástrica. *Se considera brote grave si el paciente presenta 3 o más de los siguientes criterios: leucocitosis > 15.000 cél/µl, aumento de la creatinina > 1,5 veces el valor basal, lactato sérico > 2,5 mmol/l, temperatura > 38,5°C y más de 10 deposiciones diarreicas diarias. fracasos terapéuticos y con una mayor mortalidad (del 6 al 13,6% de los casos a los 30 días)2. Los factores de riesgo asociados a DACD son: consumo reciente de antibióticos (especialmente luoroquinolonas, betalactámicos como cefalosporinas de segunda y tercera generación y clindamicina), edad superior a 65 años, estancia hospitalaria prolongada, padecer una enfermedad inlamatoria intestinal, cirugía digestiva previa, nutrición enteral, tratamientos con citostáticos o haber presentado un episodio previo de DACD1,2. Existen datos no concluyentes respecto al posible efecto favorecedor de DACD de los laxantes, los antiinlamatorios no esteroideos y los fármacos inhibidores de la bomba de protones (IBP)1,2. Manifestaciones clínicas El cuadro clínico es amplio y puede variar desde el portador asintomático a los casos de enfermedad fulminante1,4. La diarrea, síntoma fundamental, suele aparecer coincidiendo con un tratamiento antibiótico, aunque puede hacerlo semanas después de su retirada e incluso en ocasiones no existe este antecedente1,7. Se acompaña de iebre, dolor abdominal, leucocitosis importante, hipoalbuminemia y aumento de la proteína C reactiva1,7. La infección grave puede cursar con megacolon tóxico, que puede evolucionar a sepsis grave y fallecimiento del paciente1,7. GH CONTINUADA. mAyO-jUNIO 2011. VOL. 10 N.º 3 141 Documento descargado de http://www.elsevier.es el 20/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Ventana a otras especialidades Infección por Clostridium difficile D. Rodríguez-Pardo y B. Almirante Diagnóstico El diagnóstico se basa en criterios clínicos (diarrea) y en la detección de toxinas A y/o B en heces mediante técnicas de enzimoinmunoanálisis (EIA)1,8. Otras técnicas utilizadas son la detección de los genes codiicadores de las toxinas mediante PCR o EIA para detección de antígeno glutámico deshidrogenasa8. La visualización endoscópica de seudomembranas en la luz de colon, aunque es patognomónico, no se utiliza por el riesgo de su perforación1,8. El método diagnóstico de referencia es el cultivo en un medio celular para demostrar el efecto citotóxico de la toxina, pero no tiene utilidad clínica debido a su laboriosidad y retraso diagnóstico2,8. Tratamiento (fig. 1) El portador asintomático no requiere tratamiento9,10. Es importante suprimir el antibiótico desencadenante o sustituirlo por otro con menor efecto anaerobicida7,9,10 y ha de evitarse el empleo de opiáceos y fármacos inhibidores del peristaltismo intestinal9,10. Aunque existe controversia respecto al papel de los IBP como factor de riesgo y de evolución desfavorable de DACD, parece prudente evitar su uso si no hay una clara indicación2. En las formas no graves, el tratamiento de elección7,9,10 es metronidazol 500 mg/8 h, por vía oral durante 10-14 días. En las formas graves (que presentan leucocitosis > 15.000 cel/ml, aumento de la creatinina > 1,5 veces el valor basal, lactato sérico > 2,5 mmol/l, temperatura > 38,5°C y más de 10 deposiciones diarreicas diarias) el tratamiento indicado7,9,10 es la vancomicina 125 mg/6 h por vía oral. En caso de íleo o intolerancia a la vía oral, se aconseja asociar metronidazol i.v. y considerar la administración de vancomicina por sonda nasogástrica y/o en enema7,9,10. Si la evolución no es favorable, se recomienda aumentar la dosis de vancomicina a 500 mg/6 h, considerar la administración de gammaglobulinas a dosis de 400 mg/ kg y valorar la práctica de una colectomía subtotal7,9,10. Hasta un 20% de los pacientes tienen recidivas tras la desaparición de la clínica, generalmente durante el primer mes tras el tratamiento, aunque estas pueden observarse hasta transcurridos 3 meses9,10. Hasta el 40% de estos pacientes sufrirán un tercer episodio9,10. El alto índice de recidivas se cree que es debido a la germinación de esporas no eliminadas con los antibióticos o a la reinfección por reexposición en el hospital, más que al desarrollo de resistencias bacterianas7. En caso de una primera recidiva, se aconseja utilizar el mismo esquema terapéutico que en el episodio inicial7,9,10. La segunda recidiva se tratará con vancomicina oral durante 14 días, seguida de dosis decrecientes de vancomicina durante 4-6 semanas o de rifaximina 400 mg/12 h v.o. durante 2 semanas7,9,10. Existen experiencias limitadas con el uso de otros antibióticos (ácido fusídico, nitazoxamida o 142 GH CONTINUADA. mAyO-jUNIO 2011. VOL. 10 N.º 3 teicoplanina por vía oral o tigeciclina i.v.), con probióticos (Saccharomyces boulardii) asociados a los tratamientos clásicos, con resinas de intercambio iónico (tolevamer, de menor eicacia, pero que puede aportar beneicio en cuanto a reducción de las recidivas) o con nuevos antibióticos como idaxomicina (antibiótico macrocíclico no absorbible)9,10. Se hallan en estudios de fase III un anticuerpo monoclonal contra las toxinas A y B, una vacuna con toxoide de C. difficile o la colonización de la mucosa intestinal por cepas no toxigénicas de C. difficile9,10. Prevención y control de casos La detección precoz de los casos, el establecimiento de medidas de la transmisión de tipo de contacto de los pacientes hasta la resolución de la diarrea, la higiene de las manos con agua y jabón (las soluciones alcohólicas no eliminan las esporas de C. difficile), así como una política activa de uso racional de los antibióticos, son puntos clave para evitar la enfermedad y su transmisión en las instituciones sanitarias1,2. Bibliografía • Importante •• Muy importante n Epidemiología 1. Sunenshine RH, mcDonald LC. Clostridium diicile-associated disease: new challenges from an established pathogen. Cleve Clin j med. 2006;73:18797. 2. Freeman j, Bauer mP, Baines SD, Corver j, Fawley WN, Goorhuis B, et al. he changing epidemiology of Clostridium diicile infections. Clin microbiol Rev. 2010;23:529-49. 3. mcDonald LC, Killgore GE, hompson A, Owens RC jr, Kazakova SV, Sambol SP, et al. An epidemic, toxin gene-variant strain of Clostridium dificile. N Engl j med. 2005;353:2433-41. 4. Shannon-Lowe j, matheson Nj, Cooke Fj, Aliyu SH. Prevention and medical management of Clostridium diicile infection. Bmj. 2010;340:c1296. 5. Loo VG, Poirier L, miller mA, Oughton m, Libman mD, michaud S, et al. A predominantly clonal multi-institutional outbreak of Clostridium dificile-associated diarrhea with high morbidity and mortality. N Engl j med. 2005;353:2442-9. 6. Severe Clostridium diicile-associated disease in populations previously at low risk-four states, 2005. mmWR morb mortal Wkly Rep. 2005;54:1201-5. Kelly CP, LaMont JT. Clostridium difficile-more difficult than ever. N 7. Engl J Med. 2008;359:1932-40. 8. Crobach MJ, Dekkers OM, Wilcox MH, Kuijper EJ. European Society of Clinical Microbiology and Infectious Diseases (ESCMID): data review and recommendations for diagnosing Clostridium difficile-infection (CDI). Clin Microbiol Infect. 2009;15:1053-66. 9. Bauer MP, Kuijper EJ, van Dissel JT. European Society of Clinical Microbiology and Infectious Diseases (ESCMID): treatment guidance document for Clostridium difficile infection (CDI). Clin Microbiol Infect. 2009;15:1067-79. 10. Cohen SH, Gerding DN, Johnson S, Kelly CP, Loo VG, McDonald LC, et al. Clinical practice guidelines for Clostridium difficile infection in adults: 2010 update by the Society for Healthcare Epidemiology of America (SHEA) and the Infectious Diseases Society of America (IDSA). Infect Control Hosp Epidemiol. 2010;31:431-55. n n n n • • •• ••