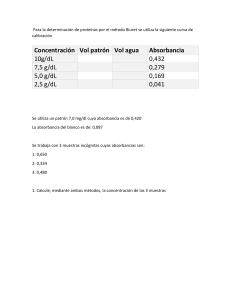
Cátedra de Química Biológica Facultad de Ciencias Exactas, Físicas y Naturales Universidad Nacional de Córdoba © 2021. This manuscript version is made available icense http://creativecommons.org/licenses/by-nc-nd/4.0/ under the CC-BY-NC-ND 4.0 2 Química biológica : guía de trabajos prácticos 2016 para alumnos de ciencias biológicas y profesorado en ciencias biológicas : Facultad de Ciencias Exactas, Físicas y Naturales, Universidad Nacional de Córdoba / María Angélica Perillo ... [et al.] ; compilado por María Angélica Perillo. - 1a ed . - Córdoba : Universidad Nacional de Córdoba. Facultad de Ciencias Exactas, Físicas y Naturales, 2016. CD-ROM, DOC ISBN 978-950-33-1248-3 1. Bioquímica. 2. Fotosíntesis. 3. Proteínas. I. Perillo, María Angélica II. Perillo, María Angélica , comp. CDD 572 AUTORES María Angélica Perillo Daniel A. García Raúl H. Marín Julieta María Sanchez Anahi del V. Turina Eduardo M. Clop Jackelyn M. Kembro Benjamín Caruso Verónica Nolan Mariela E. Sánchez Inés Burgos Dolores Carrer Virginia Miguel RESUMEN La presente Guía incluye una descripción de las actividades Experimentales de Laboratorio, de Resolución de Problemas y de Discusión de Trabajos Científicos que se desarrollan a lo largo de la asignatura Química Biológica. Está dirigida a los alumnos de Ciencias Biológicas y Profesorado en Ciencias Biológicas de la Facultad de Ciencias Exactas, Físicas y Naturales de la Universidad Nacional de Córdoba. El objetivo principal de este documento es presentar el programa y el perfil de la asignatura, orientar a los alumnos en el estudio de los contenidos teóricos y reforzar el aprendizaje mediante un conjunto de actividades prácticas. El trabajo se desarrolla en pequeños grupos, con encuentros semanales, bajo la orientación de los docentes y con respeto a las normas de seguridad que aquí también se explican. Esta guía está disponible en versión digital con acceso en la web a través del aula virtual de la FCEFYN, Universidad Nacional de Córdoba: https://fcefyn.aulavirtual.unc.edu.ar/login/index.php Palabras claves: “bioquímica”, “fotosíntesis”, “proteínas” 3 INDICE DOCENTES ...................................................... 5 INFORMACIÓN GENERAL ................................ 6 PROGRAMA ANALÍTICO ............................................. 6 PROGRAMA SINTÉTICO .............................................. 9 TEÓRICO-PRÁCTICOS ................................................. 9 TRABAJOS PRACTICOS.............................................. 10 OBJETIVOS GENERALES DE LA ASIGNATURA. .......... 10 BIBLIOGRAFIA .......................................................... 10 Bioquímica General .............................................. 10 Problemas ............................................................ 10 Bibliografía de consulta sobre temas específicos 10 Bibliografía especializada ..................................... 11 CRONOGRAMA 2020 .................................... 12 CONDICIONES PARA EL CURSADO y REGULARIZACIÓN ......................................... 13 TRABAJOS PRÁCTICOS.............................................. 13 ASISTENCIA .............................................................. 13 ACTIVIDADES............................................................ 13 EVALUACIONES ........................................................ 13 CONDICIONES PARA LA REGULARIZACIÓN .............. 14 CONDICIONES PARA LA PROMOCIÓN ...................... 14 RECUPERATORIOS .................................................... 14 FIRMA DE REGULARIDADES: .................................... 14 EXAMEN LIBRE ......................................................... 14 NORMAS BASICAS DE TRABAJO Y SEGURIDAD EN LABORATORIOS ....................................... 17 1. ORGANIZACIÓN DEL TRABAJO ............................. 17 2. HABITOS PERSONALES ......................................... 17 3. MANIPULACIÓN EN LOS LABORATORIOS ............ 18 4. MEDIOS DE PROTECCIÓN ..................................... 20 5. ACTUACIÓN EN CASO DE ACCIDENTES ................ 20 6. TELÉFONOS IMPORTANTES .................................. 21 TRABAJO PRACTICO Nº 1 .............................. 23 ESPECTROFOTOMETRÍA (Práctico de Resolución de Problemas) ................................................ 23 OBJETIVOS: .............................................................. 23 PROPIEDADES DE LOS MÉTODOS DE ANÁLISIS QUÍMICO .................................................................. 23 ERRORES EN LAS MEDICIONES DE LABORATORIO ... 23 ESPECTROFOTOMETRÍA - GENERALIDADES ............. 24 Esquema 1: Espectro de Radiación Electromagnética ................................................. 25 MECANISMOS DE ABSORCIÓN DE RADIACIÓN ELECTROMAGNÉTICA ............................................... 25 LEYES DE LA ABSORCIÓN ......................................... 26 DESVIACIONES DE LA LEY DE LAMBERT Y BEER ....... 28 ANÁLISIS CUANTITATIVO ......................................... 28 ANÁLISIS CUALITATIVO ............................................ 29 EQUIPAMIENTO Y PROCEDIMIENTOS...................... 30 GUIA DE ESTUDIO .................................................... 32 PROBLEMAS ............................................................. 33 EJERCITACION ADICIONAL ....................................... 36 TRABAJO PRACTICO Nº 2 .............................. 38 ESPECTROFOTOMETRÍA (Práctico de Laboratorio) .................................................. 38 OBJETIVOS: .............................................................. 38 CUANTIFICACIÓN DE ALBÚMINA POR EL MÉTODO DE BIURET ..................................................................... 39 MATERIALES Y MÉTODOS: ....................................... 39 RESULTADOS............................................................ 39 DISCUSIÓN ............................................................... 40 BIBLIOGRAFÍA ESPECÍFICA ....................................... 40 PROTEÍNAS ................................................... 41 TRABAJO PRACTICO Nº 3 .............................. 42 PURIFICACIÓN, CUANTIFICACIÓN Y ANÁLISIS ESTRUCTURAL DE PROTEÍNAS (Práctico de Resolución de Problemas) ............................... 42 PRIMERA PARTE. Resolución de problemas...... 42 OBJETIVOS ............................................................... 42 INTRODUCCIÓN ....................................................... 42 TÉCNICAS UTILIZADAS EN EL ESTUDIO DE PROTEÍNAS: ............................................................. 43 PROBLEMAS ............................................................. 44 SEGUNDA PARTE: Elaboración de un protocolo para purificar”fosfatasa ácida” de hígado ........ 47 BIBLIOGRAFÍA ESPECÍFICA ....................................... 47 TRABAJO PRACTICO Nº 4 .............................. 48 PURIFICACION, CUANTIFICACION Y ANALISIS ESTRUCTURAL DE PROTEÍNAS. (Práctico de Laboratorio).................................................... 48 OBJETIVOS: .............................................................. 48 PRIMERA PARTE: Purificación de fosfatasa ácida de hígado de rata. ........................................... 49 PROTOCOLO ............................................................ 49 SEGUNDA PARTE: Cuantificación de la actividad catalítica de fosfatasa ácida. ............................ 51 Experimento Nº1: Cuantificacióin de proteínas totales: Método de Biuret ....................................... 51 Sistema de Incubación ......................................... 51 4 Experimento Nº2 : Determinación de la Actividad enzimática ................................................................ 51 Sistema de Incubación ......................................... 51 RESULTADOS ............................................................ 51 BIBLIOGRAFÍA .......................................................... 52 CINÉTICA ENZIMÁTICA.................................. 53 TRABAJO PRACTICO Nº 5 .............................. 54 CINÉTICA ENZIMÁTICA. (Práctico de Resolucion de Problemas) ................................................ 54 OBJETIVOS ............................................................... 54 CONCEPTOS TEÓRICOS ............................................ 54 MODELO CINÉTICO DE MICHAELIS-MENTEN ........... 58 PROBLEMAS ............................................................. 60 TRABAJO PRACTICO Nº 6 .............................. 62 CINÉTICA ENZIMÁTICA. (Práctico de Laboratorio) ...................................................................... 62 PARTE PRÁCTICA: Estudio sobre la fosfatasa ácida de hígado. ...................................................... 62 I. CURVA DE TIEMPO .............................................. 62 OBJETIVOS ............................................................... 62 MATERIALES Y MÉTODOS ........................................ 63 PROTOCOLO: ............................................................ 63 RESULTADOS ............................................................ 64 II. CURVA DE ENZIMA............................................... 64 OBJETIVOS ............................................................... 64 PROTOCOLO: ............................................................ 65 RESULTADOS ............................................................ 65 III. CURVA DE SATURACION ..................................... 66 OBJETIVO ................................................................. 66 PROTOCOLO ............................................................. 66 RESULTADOS ............................................................ 66 CONCLUSIONES ........................................................ 67 TRABAJO PRÁCTICO Nº 7 .............................. 68 CINÉTICA ENZIMÁTICA: Discusión del Trabajo Científico ........................................................ 68 OBJETIVOS ............................................................... 68 GUÍA DE ESTUDIO. ................................................... 68 BIBLIOGRAFIA .......................................................... 68 TRABAJO PRACTICO Nº 8 .............................. 69 MECANISMOS DE TRANSDUCCIÓN DE ENERGÍA. (Practico de Laboratorio) ................................. 69 OBJETIVOS ............................................................... 69 LA ENERGÍA ASOCIADA A LAS REACCIONES QUÍMICAS EN LA CÉLULA......................................... 69 TRANSPORTE ........................................................... 70 TEORÍA QUIMIOOSMÓTICA Y FOSFORILACIÓN OXIDATIVA ............................................................... 75 MOVIMIENTO DE ÁCIDOS Y BASES A TRAVÉS DE LA MEMBRANA ............................................................. 76 BIBLIOGRAFIA .......................................................... 77 TRABAJO PRACTICO Nº 9 .............................. 78 MECANISMOS DE TRANSDUCCIÓN DE ENERGÍA. (Práctico de Resolución de Problemas). ........... 78 MOTORES MOLECULARES ....................................... 78 POTENCIAL REDOX Y LA POSIBILIDAD TERMODINÁMICA DE LA TRANSFERENCIA DE ELECTRONES ............................................................ 78 OTROS EJERCICIOS ................................................... 82 DISCUSIÓN DEL TRABAJO CIENTÍFICO .............. 84 OBJETIVOS ............................................................... 84 GUÍA DE ESTUDIO. ................................................... 84 TRABAJO PRACTICO Nº 10 ............................ 85 FOTOSÍNTESIS. (Práctico de Resolución de Problemas) ..................................................... 85 OBJETIVOS ............................................................... 85 INTRODUCCIÓN ....................................................... 85 PROBLEMAS ............................................................. 89 BIBLIOGRAFÍA .......................................................... 91 TRABAJO PRACTICO Nº 11 ............................ 92 FOTOSÍNTESIS. (Práctico de Laboratorio) ......... 92 OBJETIVOS ............................................................... 92 INTRODUCCIÓN ....................................................... 92 EXPERIENCIA Nº 1: Fotosíntesis y luz. ................. 95 OBJETIVOS: .............................................................. 95 MATERIALES: ........................................................... 95 PROTOCOLO ............................................................ 95 EXPERIENCIA Nº 2: Reacción de Hill. ..................... 96 OBJETIVO ................................................................. 96 MATERIALES: ........................................................... 96 PROTOCOLO ............................................................ 96 BIBLIOGRAFÍA .......................................................... 97 5 DOCENTES Profesora Titular: Profesores Adjuntos: Dra María Angélica Perillo (Inv. Principal CONICET)) Dr. Daniel A. García (Inv. Principal CONICET) Dr. Raúl H. Marín (Inv. Principal CONICET) Profesores Asistentes Dr. Benjamín Caruso (Inv. Adjunto CONICET) Dra. Dolores Carrer (Inv. Adjunta CONICET) Dr. Eduardo M. Clop (Inv. Adjunto CONICET) Dra. Jackelyn M. Kembro (Inv. Independiente CONICET) Dra. Verónica Nolan (Inv. Adjunta CONICET) Dra. Mariela E. Sánchez (Inv. Adjunta CONICET) Dra. Anahi del V. Turina (Inv. Adjunta CONICET) Dra. Virginia Miguel (Inv.Adjunta CONICET) Ayudante Alumno Biól. Paula Muratori Aspirantes a Adscripto Biól. Iván Felsztyna (Becario doctoral CONICET) Lic. Milagro Mottola (Becaria Doctoral CONICET) Biól.Sandra Flores (Becaria Doctoral CONICET) 6 INFORMACIÓN GENERAL PROGRAMA ANALÍTICO - 1. La lógica molecular de la vida Diversidad biológica y unidad bioquímica. Generalidades sobre metabolismo celular. Obtención, almacenamiento, liberación y utilización de la energía. Ubicación subcelular de la actividad metabólica; fraccionamiento subcelular por centrifugación diferencial. Macromoléculas y ensambles supramoleculares: caracterización; papel del agua, efecto hidrofóbico e importancia de las interacciones débiles (puente de hidrógeno, van del Waals) en su estructura y función. Propiedades coligativas de disoluciones acuosas. Superpoblación molecular: efectos sobre la actividad del agua y sobre la actividad y difusión de los solutos. - 2. Evolución Bioquímica Composición química de la materia viva. Evolución prebiótica. Ribozimas. Evolución: desde la información unidimensional de la secuencia (ADN) a la información tridimensional de la función (proteína). Transferencia de información biológica a nivel molecular (ADN- ARN- Proteína; gradientes de carga y de materia) y de la dinámica estructural (cambios conformacionales en proteínas, catástrofe microtubular, el citoplama celular como una matriz de percolación de dimensión fractal). Evolución de la estructura: molécula, agregados supramoleculares, compartamentalización, aparición de gradientes y de bombas. Mecanismos de transducción de energía y de señales. Evolución de la complejidad. Patrones bioquímicos: metabolones. - 3. Estructura y función de las Proteínas Equilibrios ácido-base en aminoácidos. Unión peptídica. Proteínas: estructura primaria, secundaria (α-hélice, hoja β, giros, bucles), terciaria (motivos: patrones de clasificación estructural) y cuaternaria. Plegamiento: cooperatividad, estabilización progresiva. Desplegamiento. Cambios conformacionales y actividad. Aislamiento, purificación y fraccionamiento de proteínas (precipitación selectiva, cromatografías de intercambio iónico, filtración molecular y de afinidad). Electroforésis: determinación de la masa molecular, número de protómeros y localización de puentes disulfuro. Ultracentrifugación. Secuenciación de proteínas. MALDI-TOFF. Inmunodetección y cuantificación, ELISA, “Western blot”. Síntesis en fase sólida. Determinación de estructura tridimensional: RMN (unidimensional y NOESY), dicroismo circular, fluorescencia, difracción de Rayos X. Cuantificación de proteínas. - 4. Ácidos nucleicos y flujo de información genética Estructura química de los ácidos nucleicos. Bases púricas y pirimídicas. Nucleósidos y nucleótidos: nomenclatura. Acido desoxirribonucleico (ADN): estructura primaria, secundaria y terciaria. Estructura de los ácidos ribonucleicos: mensajero(ARNm), de transferencia(ARNt) y ribosomal (ARNr). Duplicación del ADN, Transcripción de ADN en ARN, Procesamiento del RNA, intrones y exones, Código genético. Virus: tipos ADN-virus y ARN-virus de uno y de dos filamentos. replicación. Virus oncogénicos. El bacteriofago λ: mecanismo de integración al genoma de la celula huesped. Oncogenes. Viroides. Plásmidos. - 5. Investigación en genética Ingeniería genética: aplicaciones y obtención del gen: por corte del ADN con endonucleasas de restricción, por síntesis orgánica en fase sólida y a partir del ARNm. Secuenciación por interrupción controlada de la replicación. Amplificación: PCR. Tecnología del DNA recombinante: Unión de segmentos de ADN de distinto origen: método de las colas homopoliméricas. Vectores: plásmidos semisintéticos y derivados del bacteriofago λ: características deseables. Introducción del vector a la célula huésped (transformación). Selección del clon con el ADN recombinante y clonado. Manipulación de genes de eucariotas, bibliotecas de genes a partir de ARNm. Niveles de expresión génica, chips de genes (microarrays). Animales transgénicos. Mutagénesis dirigida para producir proteínas nuevas. - 6. Investigación en evolución Relaciones evolutivas a partir de secuencias de proteínas. Homologías de secuencias: secuencias alineadas, significación estadística (“shuffling”), matriz de sustitución, bancos de datos para detectar secuencias homólogas. Estudio de estructuras tridimensionales. Gráfico autodiagonal (autoalineamiento) para detectar secuencias repetidas. 7 Relación estructura/función: evolución divergente y convergente. Construcción de árboles evolutivos. Evolución molecular en el laboratorio. - 7. Bioenergética Estados de equilibrio y estados estacionarios. Entropía y vida. Bioenergética: cambios de energía libre de una reacción. Relación entre la constante de equilibrio y el cambio de energía libre estandar. Cálculo del cambio de energía libre estandar y el cambio de energía libre de una reacción redox. Reacciones acopladas. Energética del transporte activo. Compuestos con alto potencial de transferencia de fosfato: factores que influyen en el cambio de energía libre estandar durante la hidrólisis. - 8. Enzimología Enzimas clasificación y nomenclatura. Ribozimas. Cofactores. Coenzimas: definición: estructura química y clasificación. Coenzimas de oxido-reducción: nicotinamida adenina dinucleótido (NAD), nicotinamida adenina dinucleótido fosfato (NADP), flavina adenina dinucleótido (FAD), coenzima Q (CoQ) y ácido lipoico. Coenzimas que transfieren grupos fosfato; que transfieren grupos acilo: Coenzima A (Co A). Que transfieren grupros glicosilo. Que intervienen en reacciones de decarboxilación: piridoxal fosfato y biotina. Otras coenzimas. Vitaminas hidrosolubles que forman parte de coenzimas. Vitaminas liposolubles, estructura y función. Estrategias catalíticas. - 9. Cinética Enzimática Mecanismo de la actividad enzimática. Cinética. Reacciones monosustrato: el modelo de Michaelis- Menten; determinación de la Km y Vm por el método deLineweaver-Burk. Activadores e inhibidores. Tipos de inhibición. Análogos del estado de transición. Anticuerpos catalíticos (reconocen el estado de transición). Reacciones bisustrato: de desplazamiento simple y desplazamiento doble. Estrategias reguladoras: enzimas alostéricas (cinética y modelos), isozimas, modificación covalente, escisiones proteolíticas. - 10. Glúcidos y Lípidos Glúcidos: Monosacáridos, carbohidratos complejos, glicoproteínas, lectinas. Lípidos: lípidos de membranas, balance hidrofílico-hidrofóbico, estructuras de autoagregación. - 11. Biomembranas Estructura y función de la membrana biológica. El modelo del mosaico fluido. Membranas internas de células eucariotas. Membranas de células procariotas. Tipos de movimientos de las moléculas constituyentes. Difusión (FRAP, SPT). Fluidez (anisotropía) y curvatura. Efectos de factores físico-químicos y de la composición. Proteínas de membrana: extrínsecas, ancladas, intrínsecas. Predicción de secuencias transmembrana a partir de la estructura primaria. Secuencias señalizadoras de direccionamiento de proteínas. Fusión de membranas. - 12. Transporte Difusión: Difusión facilitada. Transporte activo:Las bombas de Na+, K+ y Ca2+. Cotransporte y contratransporte. Antibióticos de transporte. Medidas de conductancia: platch clamp. Sinapsis. Potenciales de acción. Canales activados por voltaje. Canales activados por ligando. Canales iónicos. Nexus o uniones íntimas. Potenciales electroquímicos. Potencial Donnan. - 13. Transducción de la información Receptores de superficie. Curvas de saturación. Receptores ionotrópicos. Receptores 7TM. Segundos mensajeros. Conversación cruzada. Sistema nervioso. Ultraestructura de la sinapsis. Teoría química de la transmisión nerviosa. El potencial de membrana. Liberación, recaptación y degradación de los neurotransmisores. Unión mioneural. El receptor nicotínico de acetilcolina: inhibidores. La acetil coilinesterasa: inhibidores. Receptores de otros neurotransmisores. - 14. Metabolismo Metabolismo: visión de conjunto. Reacciones aclopladas. El ATP como divisa universal de energía libre. Potencial de transferencia de grupos fosfato. Potencial de fosforilación. Motivos recurrentes en las vías metabólicas. Transportadores activados. Evolución de las vías metabólicas. 8 Oxidaciones biológicas. Enzimas de oxido-reducción: Clasificación y ejemplos. Metabolismo del superóxido. Glucólisis: reacciones, consumo y generación de ATP a nivel de sustrato. Generación de NADH. Balance energético. Destinos del piruvato: formación de acetil-CoA, de etanol y de lactato. Entrada de fructosa y galactosa. Gluconeogénesis: reacciones. Ciclo de Cori: rendimiento de ATP del lactato. - 15. Ciclo de Krebs Ciclo de Krebs o de los ácidos tricarboxílicos (TCA): reacciones, formación de coenzimas reducida y ATP a nivel de sustrato. Acoplamiento de las reacciones. Interacción de los metabolismos de glúcidos, lípidos y proteinas. rendimiento de ATP en la oxidación total de glucosa. Ciclo del glioxalato. - 16. Fosforilación oxidativa. Fosforilación oxidativa. Ubicación submitocondrial. Cadena Respiratoria Componentes. Niveles de formación de ATP. La hipótesis quimio-osmótica. Motores moleculares: ATPsintasa. Bioenergética. Regulación de la fosforilación oxidativa. Inhibidores. - 17. Metabolismo de glúcidos Via de las pentosas-fosfato. Biosíntesis del ácido ascórbico. Degradación intracelular del almidón y del glucógeno: reacciones. Digestión. Interconversión de hexosas. Biosíntesis del glucógeno, almidón y celulosa: reacciones. Regulación del metabolismo del glucógeno via AMPc. Biosíntesis de disacáridos. - 18. Fotosíntesis Fotosíntesis: ecuación global. Ubicación del proceso en el cloroplasto, pigmentos. Reacción de Hill. Las reacciones luminosas: fotosistemas I y II. Cadena transportadora de electrones. Formación de ATP y NADPH. Bioenergética. Mecanismo de formación de ATP. Reacciones enzimáticas: ciclo de Calvin. Eficiencia de la fotosíntesis. - 19. Metabolismo de lípidos Biosíntesis y degradación de los triglicéridos, glicerofosfolípidos y esfingolípidos. Biosíntesis del colesterol a partir de acetato. Formación de colecalciferol y ácidos biliares Metabolismo de los ácidos grasos, degradación por β -oxidación de ácidos grasos saturados de cadena par e impar y de ácidos grasos insaturados. Balance energético. α y ω-oxidación. Ubicación subcelular. Biosíntesis: sistema del citosol, reacciones. Sistemas microsomal y mitocondrial. - 20. Metabolismo de amino ácidos Metabolismo de los aminoácidos. Ciclo de fijación del nitrógeno. Degradación de los aminoácidos: reacciones de tipo general: desaminación por transaminación, desaminación oxidativa, desaminación no oxidativa y descarboxilación, ejemplos. Transporte del amoníaco. Ciclo de la urea: reacciones. Los aminoácidos como precursores de otras biomoléculas: metabolismo del triptofano, fenilalanina, tirosina, histidina y glutamato. Glutatión. Porfirinas. Biosíntesis del Hem. Hemoglobinas A, F y A2. Derivados de la hemoglobina: oxihemoglobina, carboxihemoglobina, metahemoglobina y carbohemoglobina. Degradadción de la hemoglobina. Formación de pigmentos biliares. - 21. Metabolismo de ácidos nucleicos Síntesis de novo de pirimidinas. Biosíntesis de bases púricas y desoxiribonucleótidos. Síntesis de NAD+, FAD, Coenzima A. Uratos. Replicación, recombinación y reparación del DNA, polimerasas, topoisomerasas y helicasas. Fragmentos de Okazaki. Síntesis de DNA en eucariotas, ciclo celular, telomerasa. Síntesis y maduración del RNA. El ribosoma como estructura desupramolecular. - 22. Metabolismo de proteínas Biosíntesis de proteínas. Codigo genético: características. Formación de aminoacil-ARNt. Mecanismo de la síntesis de proteínas: etapas de iniciación, elongación y terminación. Modificaciones post-traduccionales. Antibióticos inhibidores. Endo y Exopeptidasas. Tipos de mutaciones. 9 - 23. Integración metabólica y control de la expresión génica Regulación metabólica. Control de la expresión genética en procariotas. Ooperón lac y operón trp: inducción y represión. Control en eucariotas. Regulación por modificación de la actividad de la enzima: activación por precursor e inhibición por producto final. Regulación hormonal. Hormonas de mamíferos: bases moleculares del mecanismo de acción. Receptores de hormonas de estructura esteroide, peptídica y derivada de aminoácidos. Endocitocis y reciclo de los receptores. Hormonas vegetales y de insectos. - 24. Inmunoquímica Inmunoquímica. Inducción de anticuerpos específicos. La unión Ag-Ac. Heterogeneidad de los anticuerpos. Estructura química de las inmunoglobulinas. Teorías sobre la formación de anticuerpos. - 25. Bioquímica de sistemas sensoriales Olfato, gusto, visión, audición y tacto, aspectos bioquímicos. Receptores y mecanismos de transducción de señales involucrados. - 26. Motores moleculares NTPasas de lazo P. Mecanismo de la contracción muscular, asociación cíclica de la actina y miosina. Microtúbulos, tubulina, quinesina y dineína. Movimiento flagelar en bacterias, motor rotativo; quimiotaxis. PROGRAMA SINTÉTICO 1. La lógica molecular de la vida 2. Evolución Bioquímica 3. Estructura y función de proteínas 4. Ácidos nucleicos y flujo de información genética 5. Investigación en genética 6. Investigación en evolución 7. Bioenergética 8. Enzimología 9. Cinética Enzimática 10. Glúcidos y lípidos 11. Biomembranas 12. Transporte 13. Transducción de la información 14. Metabolismo 15. Ciclo de Krebs 16. Fosforilación oxidativa 17. Metabolismo de glúcidos 18. Fotosíntesis 19. Metabolismo de lípidos 20. Metabolismo de amino ácidos 21. Metabolismo de ácidos nucleicos 22. Metabolismo de proteínas 23. Integración metabólica y control de la expresión génica 24. Inmunoquímica 25. Bioquímica de sistemas sensoriales 26. Motores moleculares TEÓRICO-PRÁCTICOS 1. ProteÍnas 2. Ácidos nucleícos 3. Investigacion en genética 10 4. Bioenergética 5. Cinética Enzimática 6. Ciclo de Krebs y cadena respiratoria 7. Fotosíntesis 8. Inmunoquímica 9. Integración metabólica TRABAJOS PRACTICOS TP 1 y 2: Espectrofotometría. TP 3-4: Purificación, cuantificación y análisis estructural de proteínas TP 5-7. Cinética Enzimática TP 8 y 9: Mecanismos de transducción de energía. TP 10 y 11: Fotosíntesis. OBJETIVOS GENERALES DE LA ASIGNATURA. Al terminar el curso el estudiante deberá: • Adquirir una clara comprensión del metabolismo celular a la luz de conceptos de: - Mecanismos de transducción de energía y de información. - Termodinámica, cinética y catálisis de reacciones bioquímicas - Importancia de la compartamentalización en la generación de gradientes químicos y electroquímicos. - Modulación dinámica de la estructura y función de biomembranas, proteínas y de la organización compleja del citoplasma - Vías metabólicas fundamentales y su integración - Patrones bioquímicos y su evolución • Desarrollar del pensamiento crítico. • Adquirir destreza en el uso de metologías del laboratorio bioquímico BIBLIOGRAFIA Bioquímica General - Blanco, A. Química biológica, Ed.El Ateneo, 2006. - Bezkorovainy, A, Rafelson M.E. Concise Biochemistry. Ed. Marcel Dekker, New York, 1996*. - Harper, H.A, Manual de Química Fisiológica. Ed. El manual moderno 1980* - Horton, R.H, Moran, L.A., Ochs, R.S., Rawn, J.D., Scrimgeour, K.G. Bioquímica. Ed.Pentice Hall, Hispanoamericana, SA. Mexico, 1995, 1999*. - Lehninger, Albert L.. Principios de bioquímica . 2ºEd., Omega, Barcelona, 2001. - Nelson, David L.. Lehninger : principios de bioquímica .3º Ed., Omega, Barcelona, 2001. - Stryer L, Berg, JM y Tymoczko, JL. Bioquímica, 5º Ed., Reverté SA, España, 2003. - Torres, H.M., Carminatti H. Y Cardini E. Bioquímica General. Ed. El Ateneo, Bs.As. 1983*. - Voet D., Voet JG, Pratt C.W. Fundamentos de Bioquímica. La vida a nivel molecular, Ed. Médica Panamericana. 2006. - Walker, J. M.. Biología molecular y biotecnología .2º Ed. Acribia, Zaragoza, 1997. Problemas - Esteban J.M. y Cavanillas J.M.. Problemas de Química. Ed. Alhambra. 4a. España. 1976. - Holme, David J. . Resolución de problemas de bioquímica analítica, Acribia, Zaragoza, 1996. - Segel I.J. Cálculos en Bioquímica. Acribia. Saragoza. España. 1972. Bibliografía de consulta sobre temas específicos Química General, Química Orgánica y Química-Física - Atkins, P.N y M.J Clugston. Principios de Fisicoquímica. 1986. Addisson-Wesley. Ed. Iberoamericana. México. - Atkins, P.W. Fisicoquimica. Ed. Addison-Wesley Iberoamericana, S.A. Wilmington, Delaware, USA.1991 11 - Brown, T. L., LeMay, H. E. y Bursten, B.E.. Química, La Ciencia Central. Prentice-Hall Hispanoamericana, S.A., Quinta Edición. 1993. - Morris, J.G. Fisicoquímica para biólogos. Ed. Reverté. Barcelona. 2002. - Whitten, W.K y K.D Gailey. Química General. Ed. Interamericana. México. 1986. Biofísica-Química y Biología Celular - Alberts, B. Biología molecular de la célula, 3º Ed., Omega, Barcelona, 1996-2002. - De Robertis, E.M.F. Biología celular y molecular de Eduardo D. P. De Robertis.12º Ed., El Ateneo, Buenos Aires, 1998. - Estrada Cerqueda, C. Cinética del transporte a través de membranas, Ed. Blume, Madrid, 1976. - Grigera, J.R. Introducción a la biofísica del agua, Eudeba, Buenos Aires, 1976. - Maggio B. Introducción a la biofísico-química. Ed. Gonzalez Truccone. Córdoba, Argentina. 1987*. - Vicente Córdoba, C. Biofísica, Ed. Síntesis, Madrid, 1992 Cinética enzimática - Segel I.H. Enzyme kinetics. Behavior and analysis of rapid equilibrium and steady-state enzyme systems. Wiley Classics Library Editions. Wiley Intersci.Pub., New York. 1993*. - Neilands J.B., Stumpf P.K., Principios de enzimología. Ed Aguilar. 1967. - Methods Enzimology ed. Colowick-Kaplan vol. XXXI Fotosíntesis - Andreo C., Vallejos R. Fotosíntesis. Serie Biología, monografía no 30 OEA, 1984. - Hall D.O., Rao K. Fotosíntesis. Ed. Omega, Barcelona, 1977. - Tribe M y Whitaker P. Cloroplastos y motocondrias. Ed. Omega, Barcelona, 1977. Análisis Bioquímico e Instrumental - Gore M. G. Spectrophotometry and Spectrofluorometry A practical Approach. Ed. Oxford University Press. Inc. NY. USA. 2000. - Henry RJ, Cannon D.C. y Winkelman J.W. Química Clínica: Bases y Técnicas. Tomo I. 2a Ed. Jims. Barcelona. España.1980*. - Willard H.H. Merritt Jr. L, y Dean J.A. Métodos Instrumentales de Análisis. Ed. CECSA. México. 1974. - Skoog D.A. y West D.M. Análisis Instrumental. Ed. Interamericana México. 1975. - D'Ocon Navaza, María Carmen. Fundamentos y técnicas de análisis bioquímico, Paraninfo, Madrid, 1999. Bibliografía especializada - Aon M.A. and Cortassa S. Dynamic Biological Organization. Fundamentals As Applied To Cellular Systems. Chapman and Hall, London, UK. 1997*. - Daune, M. Molecular Biophysics. Structures in motion, Oxford University Press, Oxford. 1999*. - Makishima, Shoji. Pattern dynamics: a theory of self-organization, Ed. Kodansha Scientific, Tokio, 2001. La bibliografía citada está disponible en la Biblioteca “Ricardo Lutti" (Centro) de la FCEFyN, UNC. * disponibles en la Cátedra de Química Biológica. 12 Semana CRONOGRAMA 2023 CLASES TEÓRICAS y TEÓRICO- PRÁCTICAS Comienzan: 8 de marzo Finalizan: 14 de junio Miércoles TEMA Viernes Clase inaugural. Redes- La lógica molecular 10/03/23 de la vida- Metabolismo. TEMA COMISIÓN TEMA y modalidad A: Aula (Problemas) (2hs) L: laboratorio (4hs) Evolución Bioquímica -- -- 17/03/23 Proteínas II (Teórico-Práctico) 1, 3, 5, 7 Espectrof 1 (A) 24/03/23 FERIADO 1, 3, 5, 7* 2, 4, 6, 8* Espectrof 2 (L) Espectrof 1 (A) 1, 3, 5, 7 2, 4, 6, 8 Purif. Prot 1 (A) Espectrof 2 (L) FERIADO 1, 3, 5, 7* 2, 4, 6, 8* Purif. Prot. 2 (L) Purif. Prot 1 (A) 14/04/23 Cinética Enzimática/ /Enzimología 1, 3, 5, 7 2, 4, 6, 8 Cinet. Enz 1 (A) Purif. Prot 2 (L) 21/04/23 Biomembranas Transporte 1, 3, 5, 7 2, 4, 6, 8 1, 3, 5, 7 2, 4, 6, 8 Cinéti. Enz 2 (L) Cinét Enz 1 (A) Cinet Enz 3 (A) Cinet Enz 2 (L) 1, 3, 5, 7 2, 4, 6, 8 Bioenerget 1 (L) Cinet Enz 3 (A) 1 8/03/23 2 15/03/23 Proteínas I 3 22/03/23 Ácidos nucleicos (Teórico-Práctico) 4 29/03/23 5 05/04/23 Bioenergética Cinética Enzimática 07/04/23 6 12/04/23 Cinética Enzimática (Teórico-Práctico) 7 19/04/23 8 26/04/23 9 03/05/23 Glucólisis Gluconeogénesis 10 10/05/23 Ciclo de Krebs Cadena Respiratoria (Teórico-Práctico) 11 17/05/23 Investigación en Genética Investigación en evolución 31/03/23 (Teórico-Práctico) / Bioenergética Lípidos/ Glúcidos Biomembranas Hormonas/ Transducción de señales TRABAJOS PRÁCTICOS Comienzan: 14 de marzo Finalizan: 02 de junio 28/04/23 1° EXAMEN PARCIAL Glucógenolisis. 05/05/23 Interconversión de hexosas. Vía de las pentosas 12/05/23 Fotosíntesis + Ciclo de Calvin (Teórico-Práctico) 1, 3, 5, 7 2, 4, 6, 8 Bioenerget 2 (A) Bioenerget 1 (L) Metabolismo de lípidos 19/05/23 Metabolismo de lípidos 1, 3, 5, 7 2, 4, 6, 8 Fotosint 1 (L-2h) Bioenergt 2 (A) 12 24/05/23 Metab. aminoácidos/ Biosínt. de Nucleótidos 26/05/23 FERIADO 1, 3, 5*, 7* 2, 4, 6*, 8* Fotosint 2 (L) Fotosint 1 (A) 13 31/05/23 Integración Metabólica 02/06/23 Biosíntesis de ácidos nucleicos 1, 3, 5, 7 2, 4, 6, 8 Recup. TP (A) Fotosint 2 (L) 14 07/06/23 Biosíntesis de proteínas 09/06/23 Regulación de la expresión génica 1, 3, 5, 7 2, 4, 6, 8 -Recup. TP (A) 15 14/06/23 Bioquímica de sistemas sensoriales Inmunoquímica (Teórico-Práctico) 16/06/23 2º EXAMEN PARCIAL 16 21/06/23 RECUPERATORIO EXAM. PARCIALES 23/06/23 Firma Regularidad *Recupera en otra comision, coordinar con el/la profesor/a de Trabajos Prácticos. 30/06/23 EXAMEN FINAL (1º TURNO JULIO) 13 Horario y Aula 8 -10 hs (Aula 203) 8 -10 hs (Aula 203) 13:30-15:30 hs (303) 13:30-15:30 hs (303) 13:30-15:30 hs (303) 13:30-15:30 hs (303) 10:30-12:30 hs (Aula 101) 10:30-12:30 hs (Aula 101) 14-16 hs (303) 14-16 hs (303) 14-16 hs (303) 14-16 hs ( 303) 7 8 -10 hs (Aula 203) 10:30-12:30 hs (Aula 101) 8 8 -10 hs (Aula 203) 10:30-12:30 hs (Aula 101) Jue 1 2 3 4 5 6 Martes Teóricos y teórico-prácticos Miércoles Viernes Vie Comisión Distribución aulas y horarios Trabajos Prácticos Práctico de Problemas Práctico de Laboratorio (A) (L) 8-10 hs (Aula 101) 8-12 hs (Aula 224) 8-10 hs (Aula 101) 8-12 hs (Aula 224) 14:30-16:30 hs (Aula 101) 14:30-18:30 hs (Aula 224) 14:30-16:30 hs (Aula 101) 14:30-18:30 hs (Aula 224) 8-10 hs (Aula 301) 8-12 hs (Aula 224) 8-10 hs (Aula 301) 8-12 hs (Aula 224) 17:00-19:00 hs (Aula 213) 17:00-21:00 hs (Aula 224) 17:00-19:00 hs (Aula 213) 17:00-21:00 hs (Aula 224) CONDICIONES PARA EL CURSADO y REGULARIZACIÓN TRABAJOS PRÁCTICOS Los alumnos deberán: - Aprobar antes de comenzar los trabajos prácticos un examen sobre Normas Básicas De Trabajo y Seguridad en Laboratorios. Los contenidos a evaluar se encuentran en la guía de trabajos prácticos. - Concurrir con guardapolvo, gafas, guantes, calzado adecuado (cerrado) y cabello recogido. No podrá realizar el TP quienes concurran sin estos elementos mínimos de seguridad personal. ASISTENCIA Clases Teóricas: no obligatoria Teórico Prácticos: 80% obligatoria Trabajos Prácticos: 80% obligatoria ACTIVIDADES Clases teóricas: Exposición y discusión de temas teóricos. Clases teórico-prácticas: Discusión de problemas teóricos. Trabajos prácticos: Los mismos se diferencian en dos modalidades: Prácticos de Problemas (A): Los problemas y la guía de estudio deberán ser resueltos por los alumnos antes de concurrir a la clase. En caso de necesitar aclarar dudas, los docentes estarán disponibles en sus horarios de consulta, en la cátedra. Los alumnos serán evaluados al final del TP (evaluación escrita) y durante el desarrollo de la experiencia práctica (evaluación oral), sobre los contenidos que se encuentran en la guía de TP. Prácticos de Laboratorio (L) Los lineamientos para el desarrollo de la actividad práctica de laboratorio se encuentran descriptos en la guía de TP. El protocolo será discutido en la clase inmediata anterior para optimizar el uso del laboratorio. Para los seminarios de discusión de trabajos científicos en inglés, se espera la participaciín activa de los alumnos quienes contarán con los docentes que estarán disponibles en sus horarios de consulta, en la cátedra. Los alumnos serán evaluados al final del TP (evaluación escrita) y durante el desarrollo de la experiencia práctica (evaluación oral), sobre los contenidos que se encuentran en la guía de TP. EVALUACIONES I. Trabajos Prácticos: a) Evaluación oral durante el desarrollo del TP. Se tendrá en cuenta: desempeño, destreza, atención, participación, puntualidad, y la presentación de Trabajos Científicos (cuando corresponda). b) Una evaluación escrita al final de cada TP. El resultado de la evaluación estará disponible en el TP siguiente. II. Exámenes Parciales: Se tomarán 2 (dos) exámenes parciales sobre temas desarrollados en clases teóricas y prácticas. 14 CONDICIONES PARA LA REGULARIZACIÓN - Correlativas regularizadas: Química Orgánica y Física I. - Asistir al 80% de las Clases Teórico-Prácticas - Desempeñarse satisfactoriamente durante los TP (item a) y - Aprobar como mínimo 9 de los 11 TPs. No se podrá desaprobar más de 1 Práctico de Laboratorio (L). (Las evaluaciones de los TP se aprueban con el 60% de las respuestas correctas o alcanzando el 60% de los contenidos de TP). En caso de inasistencia, el estudiante podrá recuperar la clase en otro horario sólo presentando un certificado médico. Los certificados médicos (públicos o privados) deben estar firmados por la Dirección de Salud Estudiantil (Av. Juan Filloy S/N, donde también atiende Pasos y SAE). El trámite es personal, presentando la libreta y se realiza después del período de reposo que dice el certificado. En caso de desaprobar 3 TPs, se podrá recuperar uno al final del cuatrimestre. Las ausencias no podrán recuperarse. - Obtener un puntaje mínimo de 4 (cuatro) puntos en los exámenes parciales teóricos. CONDICIONES PARA LA PROMOCIÓN: Correlativas Aprobadas (al comenzar el cursado): Química Orgánica y Física I. Cumplir con las condiciones de regularización Alcanzar un promedio de 7 puntos entre ambos Exámenes Parciales, con una nota no inferior a 4 puntos. RECUPERATORIOS Se podrá recuperar al final del cuatrimestre: - Un TP que haya resultado reprobado, para alcanzar las condiciones indicadas más arriba. - Un examen parcial (por cualquier razón: inasistencia, reprobado o para aumentar nota). Inasistencias: En caso de inasistencia a un TP sólo podrá recuperarse por causa debidamente justificada (con certificado médico expedido por Bienestar Estudiantil), en alguna Comisión donde el mismo TP aún no se hubiera dictado. En el caso de inasistencias no habrá recuperatorio al final del cuatrimestre. FIRMA DE REGULARIDADES: Día 24/06/2022 en el horario de Teóricos. Como segunda instancia, y de manera excepcional, se podrá asistir para la firma de la regularidad, únicamente la semana siguiente a los recuperatorios, sólo en los horarios de consulta. El trámite no es personal. EXAMEN LIBRE: El alumno que se presente a rendir la materia en condición de Libre deberá avisar con 1 semana de anticipación, con respecto al turno de examen. 15 NORMAS BÁSICAS DE TRABAJO Y SEGURIDAD EN LABORATORIOS He leído las NORMAS BÁSICAS DE TRABAJO Y SEGURIDAD EN LABORATORIOS incluidas en la Guía de Trabajos Prácticos de Química Biológica (Ciencias Biológicas-Facultad de Ciencias Exactas, Físicas y Naturales-Universidad Nacional de Córdoba) y estoy al tanto de las medidas de seguridad de trabajo en el laboratorio. Nombre y Apellido: …………………………………………………………….. DNI: ………………………………. Nº de Matrícula: …………………………………… Firma: …………………………………………………………….. Lugar y Fecha: …………………………………………………………….. Completar, firma, cortar y entregar al Profesor Asistente. 16 17 NORMAS BASICAS DE TRABAJO Y SEGURIDAD EN LABORATORIOS 1 TEMAS 1. ORGANIZACIÓN DEL TRABAJO 2. HABITOS PERSONALES 3. MANIPULACIÓN EN LABORATORIOS 4. MEDIOS DE PROTECCIÓN 4. ACTUACIÓN EN CASO DE ACCIDENTES 5. TELÉFONOS IMPORTANTES TEMAS 1. ORGANIZACIÓN DEL TRABAJO • La organización del laboratorio, debe ser estudiada a fondo y procurar que sea adecuada para el mantenimiento de un buen nivel preventivo. • No debe trabajar nunca una persona sola en el laboratorio fuera de horas habituales, por la noche o en operaciones con riesgo. • Cuando se realicen operaciones con riesgo, incluso las personas que no intervengan en ellas deben estar informadas de las mismas. • Deberá trabajarse en las campanas extractoras siempre que se manipulen productos tóxicos, inflamables y/o que se desprendan en el proceso. En éstas deberá comprobarse periódicamente el funcionamiento del extractor, su estado general, el cumplimiento de los caudales mínimos de aspiración, que su uso sea el adecuado, etc. • La programación de trabajos con productos químicos, deberá ir acompañada de la adopción de medidas preventivas que se requiera en cada caso. • Deberá comprobarse la ventilación general del laboratorio. • Los reactivos almacenados en el laboratorio deben preservarse del sol, no guardarse en estanterías altas, cuidar su etiquetado y mantenerlos en las cantidades imprescindibles. No deberá haber botellas con líquidos inflamables, incluso las botellas empezadas o los reactivos preparados con mezclas de productos inflamables. Ha de controlarse que las botellas una vez utilizadas, se cierren correctamente. • Está prohibido fumar, beber y comer en los laboratorios. • Los envases para recuperar se enjuagarán y colocarán, sin taponar, para el posterior proceso de lavado. • No se permitirá la presencia de personas no autorizadas y debidamente informadas de los riesgos inherentes en el laboratorio. 2. HABITOS PERSONALES • Mantener en todo momento guardapolvos, camisas y vestidos abrochados. • No abandonar objetos personales en mesas de trabajo. • No comer o beber en los laboratorios. • No guardar alimentos ni bebidas en las heladeras del laboratorio. • No fumar en los laboratorios. • Llevar recogidos los cabellos. • No llevar pulseras, anillos, colgantes o mangas anchas que pudieran engancharse en los montajes. • Los guardapolvos no deberán llevarse a lugares de asistencia común como son las bibliotecas, cafeterías, 1 Extraído de “Seguridad y condiciones de trabajo en los laboratorios” del CSIC-España. 18 salas de reuniones, comedores etc. • No es aconsejable guardar la ropa de calle en la mesada del laboratorio, para lo cual deberá disponerse de armarios o lugares específicos fuera del área de trabajo. • Es recomendable usar gafas de seguridad cuando se manipulen productos químicos líquidos de cualquier tipo en ebullición. • Si la naturaleza del trabajo lo requiere, el personal del laboratorio deberá utilizar los medios de protección adecuados. • No utilizar lentes de contacto en el laboratorio, ya que en caso de accidentes por salpicaduras de productos químicos o sus vapores, al pasar por detrás de las lentes, podrían provocar lesiones en el ojo antes de retirarlas. En estos casos se recomienda el uso de gafas graduadas. • Si un producto químico salpica a los ojos, utilizar inmediatamente un lavaojos y lavarlos durante 15 minutos sin interrupción. Actuar con urgencia en menos de 10 segundos. No dirigir una corriente de alta presión directamente al ojo porque podría lesionarse. Es necesario mantener los ojos abiertos con ayuda de los dedos para el lavado debajo de los párpados. • Lavarse las manos: antes de abandonar el laboratorio, siempre que se quiten los guantes protectores y después de toda operación que haya comportado el posible contacto con material irritante, cáustico, tóxico o infeccioso. • Para secarse las manos, en vez de toallas es preferible el uso de papel desechable o secadores de aire. • La persona que al término de la jornada sea la última en abandonar el laboratorio deberá asegurarse que los procesos que no queden en funcionamiento, las conducciones de agua y gas estén cortadas, la energía eléctrica desconectada y que el local se encuentra en un estado que excluya el riesgo de incendio. 3. MANIPULACIÓN EN LOS LABORATORIOS Laboratorios con riesgo químico • Toda persona que manipule un producto químico, deberá tener conocimiento de sus características físicoquímicas y toxicológicas. • Deberán conocerse, como mínimo, las frases de riesgo y seguridad (R y S) de los productos. • Como norma general, cualquier manipulación de una sustancia química deberá realizarse dentro de las vitrinas de laboratorio. • No llenar los tubos de ensayo más de la mitad de su volumen total. • Calentar los tubos de ensayo de lado y utilizando las pinzas. • Utilizar en todo momento gradillas y soportes. • Tomar los tubos de ensayo con los dedos, nunca con las manos. • No llevar tubos de ensayo ni productos en los bolsillos. • No calentar nunca un recipiente totalmente cerrado. Cuando se caliente, dirigir siempre la abertura en dirección contraria a uno mismo y a las demás personas cercanas. • Transportar los productos en bandejas o recipientes para evitar derrames en caso de roturas. • No oler productos químicos si no se está debidamente informado. • No tocar con las manos ni probar los productos químicos. • En caso de producirse una contaminación se limpiará la zona y no podrá utilizarse hasta tener seguridad de su descontaminación utilizando los productos adecuados en cada caso y que deben conocerse previamente. • No tocarse ninguna parte del cuerpo, material o instrumental con los guantes contaminados. En el caso de que esta circunstancia hubiera ocurrido, limpiar con los productos adecuados y eliminar los elementos utilizados en la limpieza, como residuos tóxicos. • No efectuar pipeteo con la boca. Se realizará con peras de goma para pipetas o pipetas de seguridad. • No trabajar separado de la mesa. • Para el encendido de mecheros, utilizar encendedores piezoeléctricos; no usar fósforos ni encendedores de bolsillo. • Los mecheros no deberán dejarse encendidos sin vigilancia. • Asegurarse del enfriamiento de los materiales antes de aplicar directamente las manos 19 para tomarlos. • Al finalizar una tarea u operación, recoger materiales, reactivos, equipos, etc., evitando las acumulaciones innecesarias y dejando la zona de trabajo en las debidas condiciones de limpieza. • Al terminar el trabajo, asegurarse de la desconexión de los aparatos, agua, gases, etc. • Usar y almacenar sustancias inflamables en las cantidades imprescindibles. • Deberá ponerse especial cuidado en cerrar botellas y frascos inmediatamente después de su utilización. • No transportar frascos o recipientes tomados por la tapa o tapón. • Siempre que sea posible se trabajará en bandejas con el fin de confinar un posible derrame. Será muy conveniente forrar con papel de filtro dichas bandejas. • Siempre que sea necesario, deberán utilizarse guantes específicos para los productos que se manipulan. • Los guantes y todo material contaminado con productos tóxicos y /o infecciosos deberán descontaminarse y/o esterilizarse antes de ser eliminados. Cuando no se utilicen guantes en la manipulación de sustancias químicas, las manos deberán lavarse frecuentemente. Al finalizar la sesión de trabajo, es aconsejable un lavado cuidadoso antes de abandonar el laboratorio. • Las puertas de los laboratorios deberán permanecer cerradas durante la jornada de trabajo. • Deberá mantenerse la limpieza y el orden en los laboratorios en todo momento. • Deberán mantenerse libres los espacios de trabajo, así como las zonas de paso y salida de los recintos. • No utilizar nunca un equipo o aparato sin conocer perfectamente su funcionamiento. • Antes de comenzar un experimento asegurarse de que los montajes y aparatos están en perfectas condiciones de uso. Ante cualquier mínima duda consultar con el responsable del equipo. • Los trapos o materiales ensuciados con aceite o sustancias inflamables deberán colocarse en recipientes cerrados que deberán vaciarse diariamente y su contenido será neutralizado. • Las instalaciones, aparatos e instrumentos destinados a reparación, deberán enviarse limpios, sin trazas de sustancias químicas nocivas. • Antes de utilizar sustancias inflamables deberemos asegurarnos de que no hay cerca mecheros encendidos, calentadores etc. • No debe dejarse sin vigilancia ningún tipo de reacción química. • Al finalizar un experimento los productos deberán etiquetarse y colocarse en lugar seguro. • Las sustancias cuya disolución sea exotérmica, deberán disolverse por porciones, agitando y enfriando continuamente. • Durante la destilación de sustancias inflamables de bajo punto de ebullición, deberá controlarse la llegada de agua al refrigerante y alejar del aparato cualquier otra materia inflamable. • Cuando se derrame alguna sustancia combustible se procederá a: - Apagar el mechero, si ha lugar. - Cortar la corriente eléctrica en el exterior del laboratorio. - Asegurar una ventilación eficaz. - Se absorberá el líquido con un cuerpo poroso que posteriormente se depositará en un lugar sin peligro. - Se eliminará como residuo tóxico. • Las sustancias químicas deberán estar colocadas en recipientes con materiales adecuados y etiquetados debidamente. Los recipientes deberán estar cerrados. • Los recipientes que contengan líquidos deberán estar protegidos contra la acción directa de los rayos solares o contra el calentamiento. • Los metales alcalinos como sodio o potasio deberán conservarse con una capa protectora de un solvente con un punto de ebullición elevado (petróleo, aceite de parafina) y el fósforo blanco con una capa de agua. • Los productos incompatibles deberán guardarse separadamente. • Los recipientes que contengan productos agresivos no deberán almacenarse a una altura superior a sesenta y cinco cm. Y serán recipientes de pequeña capacidad para su fácil manejo. 20 4. MEDIOS DE PROTECCIÓN • El trabajo en laboratorios requiere la utilización de guardapolvos, que en trabajos con riesgo deberá considerarse el tejido de los mismos. • Los guardapolvos deberán tener los puños ajustados a las muñecas. Asimismo, deberán estar cerrados en la parte delantera y en el cuello. • Tener siempre a disposición las gafas de seguridad. Es recomendable el uso permanente de las mismas. Estas serán de uso personal. • Utilizar los guantes adecuados para cada tarea que requiera el uso de tales prendas. • Conocer la protección brindada por los distintos equipos de protección individual para las vías respiratorias. • Conocer la aplicación de los productos de primeros auxilios del botiquín y los mecanismos para recibir posibles ayudas exteriores. • Mantener en condiciones de uso las duchas de emergencia y lavaojos. • Conocer y ensayar el funcionamiento de equipos extintores. 5. ACTUACIÓN EN CASO DE ACCIDENTES 5.1 Derrames . Líquidos inflamables Absorber con carbón activado productos específicos. Alejar cualquier foco de calor. . Ácidos Neutralizar con bicarbonato o emplear productos específicos comercializados para su neutralización o absorción. Si por casualidad se ha producido un derrame sobre la piel, el remedio inmediato sería exponer la zona afectada al chorro de agua del grifo durante cinco o diez minutos. Las duchas de emergencia serán utilizadas en los casos en que la zona afectada del cuerpo sea grande. Es necesario quitar la ropa contaminada de la persona afectada mientras esté bajo la ducha. Si se produjesen quemaduras se precisará la asistencia médica. No utilizar cremas ni pomadas grasas en las quemaduras graves. .Bases Emplear productos específicos comercializados para su neutralización y absorción. .Otros líquidos no corrosivos ni inflamables Absorber con aserrín. 5.2. Salpicaduras. En piel y ojos Deben lavarse con abundante agua (si es en los ojos, mediante un lavaojos). No intentar neutralizar. Acudir al médico con prontitud. En la ropa Debe quitarse rápidamente la ropa, lavándola, o colocarse bajo la ducha, según la magnitud de la impregnación. Si hay contacto con la piel, lavar la zona afectada y acudir al médico. 5.3. Cortes Se deberán lavar con abundante agua corriente durante diez minutos como mínimo. Si son pequeños y dejan de sangrar en poco tiempo, lavar con agua y jabón y taparlos con una venda o apósito adecuado. Si son grandes y no dejan de sangrar, se requiere asistencia médica inmediata. 5.4. Ingestión Si es un ácido o una base. Beber abundante agua, salvo que la sustancia ingerida reaccione con ella. No provocar el vómito, salvo indicación expresa. 21 Disponer de información sobre los productos que se manipulan, consultando a un servicio de información toxicológica cuando sea posible. Si la persona está inconsciente, Ponerlo en posición inclinada con la cabeza de lado y estirarle la lengua hacia fuera. Taparlo para que no coja frío. Acudir al médico con una etiqueta del producto. 5.5. Inhalación Conducir a la persona afectada a un lugar con aire fresco. Al primer síntoma de dificultad respiratoria, iniciar la respiración artificial boca a boca. Tratar de identificar el vapor tóxico. 5.6. Incendio Dar la alarma inmediatamente Apagar los fuegos pequeños tapándolos sin utilizar agua. Escoger adecuadamente el tipo de extintor, recordando el modo de empleo y la duración de la carga. No utilizar nunca sobre una persona. Si prende fuego la ropa: -Tenderse en el suelo y rodar sobre si mismo para apagar las llamas. No correr ni intentar llegar a una ducha de emergencia salvo que esté muy cercana. -Se le cubrirá con una manta apagafuego, llevarle a una ducha de emergencia o hacerle rodar por el suelo. Una vez apagado el fuego, mantener a la persona tendida procurando que no coja frío y proporcionarle asistencia médica. Si se evacua el laboratorio, cerrar las puertas al salir. Comportamiento ante un incendio en un local donde existan botellas de gases La elevada temperatura provoca un aumento de la presión interna de la botella pudiendo explotar. Las botellas que puedan activar el fuego no deberán abrirse, cerrando las que estén en servicio. Siempre que se pueda se desalojaran de la zona del incendio y si se han calentado se refrigeraran con chorro de agua fría para disminuir la presión interna, avisando de ello al suministrador. En caso de intervenir el Cuerpo de Bomberos se les advertirá de la presencia de éstas indicándoles, cuantas son, donde están y contenido. 6. TELÉFONOS IMPORTANTES En todos los laboratorios debe haber un listado telefónico con los Centros de URGENCIA que enumeramos a continuación, el cual será de conocimiento general. ECCO (visitantes y alumnos) 4466666 BOMBEROS 100 SEGURIDAD INTERNA 4334408 ART Docentes y becarios SeCyT GALENO ART Becarios e Inv. CONICET Prevención 4686868 0800-333-1400 0800-888-3297 22 23 TRABAJO PRACTICO Nº 1 ESPECTROFOTOMETRÍA (Práctico de Resolución de Problemas) Los problemas y la guía de estudio deberán ser resueltos por los alumnos antes de concurrir a la clase. En caso de necesitar aclarar dudas, los docentes estarán disponibles en sus horarios de consulta. Los alumnos serán evaluados al final del TP (evaluación escrita), sobre los contenidos que se encuentran en la guía de TP. OBJETIVOS: - Comprender las propiedades que deben reunir los métodos experimentales de análisis. - Conocer los fundamentos teóricos y las aplicaciones de la espectrofotometría. - Valorar la importancia del dominio de técnicas auxiliares, adquiriendo la capacidad de aplicarlas con criterio ante los problemas planteados. TEMAS PARA REPASAR: - Disoluciones. Estequiometría. Luz. Teoría ondulatoria. Teoría cuántica. Ondas electromagnéticas. longitud, frecuencia, período de una onda y unidades en que se miden. Relación entre velocidad, longitud de onda y frecuencia. Energía de ondas electromagnéticas. PROPIEDADES DE LOS MÉTODOS DE ANÁLISIS QUÍMICO Las mediciones, cualquiera que estas sean, generalmente involucran la utilización de un instrumento como un medio físico para determinar una cantidad de algún parámetro o de alguna variable, por lo tanto, cuando se practica un método de análisis químico, se debe tener en cuenta, para la correcta interpretación de los resultados, el grado de exactitud, presición, sensibilidad y especificidad de la técnica. Exactitud: es el grado en que la medida promedio se aproxima al valor real. La determinación de la exactitud se logra comparando los resultados observados con el valor real. Expresa la corrección de una medición. Un método exacto no es necesariamente preciso. Precisión: es el error debido al azar, la variación de los resultados obtenidos con una técnica cuando la misma muestra se analiza repetidamente. Expresa la reproducibilidad de una medición. Cuanto menor sea la variación observada, mayor es la precisión. Un método preciso no es necesariamente exacto. Sensibilidad: es la variación mínima en la cantidad de un compuesto que puede ser detectada, o la mínima cantidad significativamente diferente del blanco. Especificidad: es la propiedad del método de medir sólo la especie química en estudio, sin la interferencia de otras que puedan estar presentes. ERRORES EN LAS MEDICIONES DE LABORATORIO Las mediciones que se realizan en el laboratorio inevitablemene conllevan un error asociado, por lo tanto, es de suma importancia conocer los tipos de errores posibles que puede tener la técnica que se utiliza. En este contexto, error se define como la diferencia entre el valor observado y el real, es decir, la combinación del error sistemático y el error debido a la falta de precisión. Los errores pueden dividirse en dos clases: 1) errores determinados, 2) errores indeterminados. 24 Errores determinados: son aquellos cuya magnitud puede determinarse: a) errores instrumentales y debidos a aparatos y reactivos: balanza y pesas, aparatos volumétricos, material de vidrio calibrado, reactivos, etc.; b) errores operativos: son de naturaleza física, asociados con manipulaciones en un análisis. c) errores personales: errores operativos del analista. d) errores del método: tienen origen en las propiedades químicas y fisicoquímicas del sistema analítico. Errores indeterminados o aleatorios: son pequeñas fluctuaciones en los sucesivos valores de una cantidad medida. No son evitables ni previsibles por parte del observador. Pueden tratarse por métodos estadísticos. Dada una cantidad de datos el analista puede estimar la incertidumbre introducida por errores aleatorios y concluir con respecto al efecto de esos errores en un resultado analítico. ESPECTROFOTOMETRÍA - GENERALIDADES El estudio a nivel bioquímico de cualquier biomolécula requiere la utilización de técnicas analíticas que permitan su determinación cualitativa y cuantitativa, así como su caracterización físico-química y biológica. Uno de los métodos más sencillos, accesibles, útiles y utilizados es la espectrofotometria, en general, y la espectroscopía ultravioleta-visible, en particular. Estos métodos permiten identificar y cuantificar biomoléculas en solución y en muestras biológicas. A veces es necesario el empleo de reactivos específicos que reaccionan con el compuesto a analizar y forman un producto coloreado que permite detectarlo en muestras complejas. La espectrofotometría es una técnica que permite medir la absorción de radiación electromagnética, dentro de los rangos ultravioleta (UV) y visible, de numerosas especies químicas inorgánicas y orgánicas, para su análisis cualitativo y cuantitativo. Las bandas de absorción de radiación electromagnética en las regiones UV-Visible del espectro se asocian con transiciones electrónicas en la capa de valencia. Los electrones involucrados en dichas transiciones corresponden a aquellos más débilmente atraídos por el conjunto de núcleos atómicos que componen la molécula y cuyos estados pueden ser descritos a través de orbitales moleculares. La Espectroscopía UV-Visible se ha aplicado en el campo de la elucidación de estructuras de compuestos orgánicos desde los años 40 del siglo XX. El espectro de absorción es una propiedad física de gran utilidad para caracterizar un compuesto y es un elemento corroborativo de una estructura propuesta. Por ejemplo: permite detectar con rapidez la presencia de insaturación conjugada y ciertos grupos funcionales (carbonilos en cetonas y aldehidos, algunos grupos funcionales nitrogenados). Además, la espectroscopia UV-Visible es un método de extensa aplicación en la cuantificación de sustancias. A partir de datos espectrofotométricos es posible calcular diferentes tipos de constantes de equilibrio (ácido-base, formación de complejos, etc) y parámetros cinéticos, siendo condición necesaria que las especies involucradas en el equilibrio difieran en su absorción en la región UV-Visible del espectro de radiación electromagnética. 25 Esquema 1: Espectro de Radiación Electromagnética Color λ en el vacío (nm) ν x 10-17 (Hz) Violeta 390 – 455 7.69 – 6.59 Azul 455 – 492 6.59 – 6.10 Verde 492 - 577 6.10 – 5.70 Amarillo 577 – 597 5.70 – 5.03 Naranja 597 – 622 5.03 – 4.82 Rojo 622 – 780 4.82 – 3.84 E = h.ν E= ν = c λ h.c λ h, Constante de Planck (6.626 10-34 J.s) ν, frecuencia de la radiación c, velocidad de la luz en el vacío (300000 km/s) MECANISMOS DE ABSORCIÓN DE RADIACIÓN ELECTROMAGNÉTICA Las moléculas son capaces de absorber radiaciones electromagnéticas. Tanto la longitud de onda de la radiación absorbida como la eficiencia con que se absorbe, dependen de: • la estructura de la molécula y • el medio en que se encuentra. En el proceso de absorción de la radiación, un fotón incidente cede su energía a una molécula, lo que da lugar a la excitación de la misma que pasa a un nivel de energía superior: A* A E = hν En donde A es la molécula absorbente, A* es la molécula absorbente en estado de excitación energética, hν corresponde a la energía de un fotón siendo h la Constante de Planck y ν la frecuencia de la radiación. -9 Los estados excitados de los átomos o moléculas poseen una vida media corta (10 s) y, en consecuencia, la molécula en estado excitado vuelve rápidamente al estado fundamental. Comunmente, la energía es 26 liberada al medio como calor, pero en ciertos casos la especie química excitada puede sufrir un cambio (reacción fotoquímica) o emitir parte de la energía absorbida como radiación electromagnética de longitud de onda mayor a la incidente (fluorescencia o fosforescencia). La Fig.1 muestra un esquema de los procesos de absorción, fluorescencia y fosforescencia. Estados Excitados Singlete S2 Conversión Interna Cruzamiento Intersistemas Absorción Fluorescencia Estado Excitado Triplete T0 Fosforescencia Estado Fundamental Singlete S0 Fig. 1: Diagrama de Jablonsky LEYES DE LA ABSORCIÓN Cuando la luz atraviesa una muestra, sólo una fracción de ella es transmitida. La proporción de luz transmitida se denomina Transmitancia (T) y se calcula de la siguiente manera: I1 T = I1 / I0 I0 b Donde I1 = la intensidad de luz transmitida por la muestra I0 = la intensidad de luz incidente La transmitancia toma valores entre 0 – 1. También se expresa como porcentaje si se multiplica por 100 y sus valores están en el rango de 0-100%. %T = (I1 / I0) x 100 La relación (I / I0), también puede ser expresada como luz absorbida en lugar de luz transmitida. En ese caso nos referimos a la Absorbancia 2 (A) de una muestra. La Absorbancia es adimensional, varía desde 0 hasta ∞ y se define como: A = log 1/T = log10 (I0 / I1) 2 Note que el equipo detecta la transmitancia y un sistema computacional le permite calcular la absorbancia. Finalmente, el equipo puede mostrar uno de estos valores o ambos. 27 Por sustitución se comprueba que la absorbancia y el porcentaje de transmitancia están relacionados mediante la siguiente expresión: A= log (100 / %T) A = 2 - log (% T) Todos los métodos espectrofotométricos que miden absorción, responden a dos leyes básicas: LEY DE LAMBERT: ¨La fracción de luz absorbida por un medio transparente es independiente de la intensidad de luz incidente, y cada capa sucesiva del medio, absorbe una fracción igual de la luz que pasa a través de él¨. Esto lleva a un decaimiento exponencial de la intensidad de luz a lo largo del paso óptico (b) en la muestra, que puede ser expresado matemáticamente como sigue: %T Log10 (I0/I) = A = K b b b Donde b = la longitud del paso óptico de la cubeta de espectrofotometría y K es una constante del medio, que fue descifrada por Beer. LEY DE BEER: ¨La cantidad de luz absorbida es proporcional al número de moléculas de cromóforo que la luz atraviesa¨. En el esquema siguiente, la concentración de cromóforo en la Condición 1 (C1) es menor a la concentración de cromóforo en la Condición 2 (C2), es decir C1 < C2. El decaimiento del %T es más pronunciado en la Condición 2. Condición 1 Condición 2 %T %T b b b b La constante K, es proporcional a la concentración de cromóforo (c): K = a.c, donde a es la absortividad o coeficiente de absorción, una propiedad del cromóforo en sí misma. La absortividad a es una constante que depende: • de la longitud de onda de la luz incidente, • de la identidad de la sustancia analizada y • del medio en que ésta se encuentre (pH, solvente e interacción con otras sustancias) 28 La constante a representa la probabilidad de absorción a una longitud de onda determinada La LEY DE LAMBERT Y BEER queda resumida entonces, en la expresión: Log10 (I0/I) = a.c.b A = a.c.b Cuando el paso óptico está expresado en cm y la concentración en M (molar), la absortividad se denomina ¨coeficiente de extinción molar o absortividad molar¨ (ε), entonces sus unidades son M-1 cm-1. Cuando b=1 cm, la absorbancia se denomina Densidad óptica (DO). DESVIACIONES DE LA LEY DE LAMBERT Y BEER En algunas situaciones es posible que no se cumpla la relación lineal entre la A y la c, en esos casos estamos ante desviaciones de la Ley de Lamber y Beer, por ejemplo: 1- En soluciones muy concentradas puede que se establezcan equilibrios entre dos especies con diferente ε. (Por ej: dimerización). 2- En soluciones muy concentradas, la probabilidad de que todas las moléculas sean alcanzadas por la radiación y puedan ser excitadas disminuye (efecto pantalla). 3- Cuando se trabaja con reacciones acopladas, debe esperarse sufuciente tiempo como para que se alcance el equilibrio en ellas. (Por ej. El tiempo de incubación en el metodo de Biuret). Por otro lado, a altas concentraciones la desviacion puede ser generada por insuficiente cantidad de uno de los reactivos (Por ej. Insuficiente cantidad de Reactivo de Biuret). 4- Falta de uniformidad de la muestra o presencia de impurezas (fenómenos que dispersan la luz). ANÁLISIS CUANTITATIVO DETERMINACIÓN DE LA CONCENTRACIÓN DE SOLUTO EN UNA DISOLUCIÓN CURVA DE CALIBRACIÓN La gran mayoría de métodos instrumentales requieren una calibración, proceso que relaciona la señal analítica medida con el instrumento con la concentración del analito que se desea estudiar. Uno de los métodos frecuentemente utilizado es la curva de calibración En el caso de la espectrofotometría, la curva de calibración es de especial interés porque permite determinar si existe una relación lineal entre la absorbancia y la concentración del soluto (ver Ley de Lambert y Beer). Una curva de calibración es un gráfico de absorbancia (A) o porcentaje de trnasmitancia (%T) en función de la concentración de soluto; su empleo es necesario en los trabajos cuantitativos en los que hay que calcular la concentración del absorbente. En general se grafica A en función de la concentración (Fig. 2a) pero, hay instrumentos que sólo expresan %T (Fig. 2b). En éste caso, el operador debe transformar las lecturas de %T en valores de A, mediante el empleo de la ecuación: A = 2 - log (% T). Papel semilogarítmico b Concentración (mg/ml) c %T %T a A Alternativamente, puede trazarse el gráfico de %T en función de la concentración en papel semilogarítmico (Fig.2c). De otro modo, resultaría difícil utilizando un número limitado de puntos obtenidos experimentalmente, comprobar gráficamente si la lectura sigue o no la ley de Lambert y Beer. Concentración (mg/ml) Concentración (mg/ml) Fig. 2: Curvas de calibración 29 Los espectrofotometros miden T por lo que la escala del sistema de registro del aparato es lineal para %T y logarítmica para A. Por este motivo, el error en las lecturas de %T es constante en toda la escala, lo cual no ocurre con la A. Sin embargo, debido a que A y concentración se relacionan proporcionalmente, en la práctica se lee A. Por consideraciones del error fotométrico, debe procurarse que los puntos situados entre valores de A de 0,1 y 1,0 (80% y 10% T) sean representados de la forma más exacta posible al trazar la gráfica. Los errores en la determinación de absorbancia dependen de la calidad del equipo. Por ejemplo, según el grafico que se muestra a continuación (Fig. 3a), seria recomendable trabajar en el rango de absorbancia 0.3-0.8, en la región de mínimo error. En los equipos más modernos la precisión fotométrica que se alcanza permite extender los límites antes mencionados. Mediante una regresión lineal de los datos que caen en la región de mínimo error y teniendo en cuenta el punto (0,0) se obtiene la constante de proporcionalidad entre absorbancia y concentración (absortividad) la que permite calcular el valor de concentración de una muestra problema (A) (B) FIG. 3: A) VARIACIÓN DEL ERROR DE LA MEDICIÓN EN FUNCIÓN DE LA ABSORBANCIA MEDIDA. B) CURVA DE CALIBRACIÓN EN DONDE SE grafican los valores experimentales de absorbancia promedio ± el error (puntos y barras) en función de la concentración y, en rojo, el ajuste de la ecuación de la recta realizada mediante una regresión lineal por el método de los cuadrados mínimos. ANÁLISIS CUALITATIVO ESPECTRO DE ABSORCIÓN Las soluciones absorben energía preferentemente en una ó más regiones del espectro electromagnético, siendo la absorción inferior o nula en las demás regiones. La representación gráfica de la probabilidad de absorción en función de la longitud de onda se denomina Espectro de absorción (Fig. 4a). Este último se determina midiendo la absorbancia a distintas longitudes de onda y permite caracterizar a las sustancias y establecer la longitud de onda de máxima absorción (λmax). En el siguiente ejemplo (Fig. 4a) λmax es aproximadamente 550nm. En la Fig. 4b se muestran 4 curvas de calibración realizadas a diferentes longitudes de onda. Para hacer determinaciones cuantitativas, en general es preferible trabajar a la λmax pues, en esas condiciones, el error de la medición es mínimo y la sensibilidad es máxima. 30 0.8 0.4 A490nm 0.2 0.0 400 A550nm (λmax) A640nm 0.6 Absorbancia Absorbancia 0.6 1 mg/ml 2 mg/ml 3 mg/ml 4 mg/ml 5 mg/ml 8 mg/ml 10 mg/ml A670nm 0.4 0.2 0.0 450 500 550 600 650 700 0 2 λ (nm) 4 6 8 Proteinas (mg/ml) 10 Fig.4 a) Espectros de Absorción. b) Curvas de Calibración a diferentes longitudes de onda. EQUIPAMIENTO Y PROCEDIMIENTOS Espectrofotómetro Las mediciones de absorbancia se realizan en un espectrofotómetro, que básicamente consta de una fuente de luz, un monocromador para seleccionar la longitud de onda, una cubeta transparente para contener la muestra, un detector de intensidad luminosa y un sistema de registro. Fig. 5 Esquema de un espectrofotómetro Medicion de la Absorbancia 1) Si tenemos una solución coloreada de concentración desconocida, la denominamos disolución Problema. Podemos conocer su concentración midiendo la absorbancia en el espectrofotómetro a una longitud de onda apropiada. 2) Previamente a la lectura, se determina la absorbancia de una disolución que contiene solvente, en ausencia de la sustancia problema. A esta disolución se le denomina disolución Blanco. Esta disolución puede contener otras sustancias, además de disolvente, a la misma concentración en que se encuentra en el Problema, pero no debe estar presente la sustancia que se desea cuantificar. Por ej. si la sustancia coloreada problema se encuentra disuelta en agua conteniendo NaCl al 1% e KOH al 2%, el tubo blanco contendrá 31 NaCl al 1% e KOH al 2% en agua, sin la sustancia en estudio. La finalidad de usar el Blanco es descontar la absorción de sustancias que no sean específicamente la sustancia problema y así poder medir la absorbancia propia de la sustancia en estudio. Los equipos permiten descontar de manera automática el valor de absorbancia del tubo blanco de la abosorbancia de los tubos testigo y problema. 3) Un tercer tipo de muestra que denominamos Testigos corresponde a disoluciones donde la sustancia en estudio se encuetra concentraciones conocidas. Se preparan disolviendo una cantidad conocida de soluto en un volumen conocido de solvente conteniendo, además, las mismas “otras” sustancias presentes en la solución problema: por ej. NaCl al 1% e KOH al 2% para el caso que se está analizando. Se mide la Absorvancia de la solución Testigo de la misma forma que se hizo con el Problema. Finalmente, la concentración del Problema se puede calcular mediante la interpolación del valor de absorbancia en una curva de calibración construida con los datos de A correspondientes a cada uno de los Testigos. 4) Lo descripto en los puntos anteriores es válido para medir la concentración de sustancias incoloras siempre que estas sustancias sean capaces de reaccionar con otras, dando productos de reacción coloreados y que la intensidad del color finalmente obtenido sea proporcional a la concentración de la sustancia en estudio. El tubo blanco 3, el cual no contiene la sustancia que desarrolla color, deberá ser tratado de forma similar al tubo problema y a los testigos, es decir tendrá los mismos reactivos y se los procesará de forma similar y paralela a los otros tubos. Hay sustancias incoloras que tienen la propiedad de absorber la luz ultravioleta; en estos casos pueden ser cuantificadas sin tratamiento previo, midiendo la absorbancia a una λ comprendida entre 200 y 400 nm (correspondiente al rango de luz ultravioleta). Experiencia Virtual: 1. Ingresar en el siguiente link https://phet.colorado.edu/sims/html/beers-law-lab/latest/beers-lawlab_es.html.( PhET Interactive Simulations, University of Colorado Boulder, https://phet.colorado.edu) y tomar la opcion Ley de Beer. 2. Encender la fuente de luz, elegir un cromoforo de la lista, elegir una concentración, seleccionar absorbancia y seleccionar un paso óptico de 1cm. Notar que en el inferior izquierdo hay una regla. 3. Realiza un espectro de absorción con por lo menos 20 puntos. (Para graficar debera utilizar un programa de analisis de datos o puede hacerlo manualmente en su cuaderno). ¿La solución absorbe igual a todas las longitudes de onda? ¿Por qué? 4. Teniendo en cuenta los resultados de la pregunta anterior. Realiza una curva de calibración. ¿Qué observa? ¿Por qué? Calcule la absortividad. Si utiliza una cubeta con otro paso óptico, ¿la absortividad cambia? 5. Ahora, selecione Transmitancia y registre 5 valores de transmitancia a diferentes tamaños de paso óptico. Grafique. Repetir, pero registrando absorbancia. ¿Qué se observa? ¿Por qué? 6. Repita este ejercicio a otra concentracion de cromoforo y compare con el grafico anterior. ¿Qué se observa? ¿Por qué? 7. Si modifica la longitud de onda: ¿Observa cambios en la curva de absorbancia en función de paso óptico? 3 Note que, por razones prácticas u operativas, es frecuente referirse indistintamente a ”muestra Problema”, “disolución Problema” o “Tubo Problema” (lo mismo para Blanco y Testigos). Sin embargo, no debe perderse de vista que la absorbancia que se mide corresponde a la disolución. 32 GUIA DE ESTUDIO 1. Observe el esquema del espectro electromagnético del Esquema 1 y compare c (velocidad), λ (longitud de onda), ν (frecuencia) y energía de la radiación electromagnética indicada. 2. Defina luz blanca y luz monocromática. 3. ¿Qué tipos de monocromadores conoce? 4. ¿Qué efecto produce la absorción de la luz por una molécula? 5. ¿Existe alguna restricción con respecto a la longitud de onda de la luz que una sustancia puede absorber? 6. ¿Cuál es la utilidad de un espectro de absorción? 7. Concepto de ley de Lambert y Beer. 8. Definición de absorbancia y transmitancia. 9. ¿Cómo se preparan y qué utilidad tienen los tubos blanco, testigo y problema? 10. ¿Cómo construye y qué utilidad tiene una curva de calibración? 11. ¿Cómo elige la longitud de onda de trabajo? 12. ¿Cuál es el fundamento químico del método de Biuret para cuantificar proteínas? (Ver TP2 de esta guía). 13. ¿Qué aplicaciones puede tener la espectrofotometria en el contexto de la biologia? 33 PROBLEMAS 1- Una disolución de proteínas de concentración desconocida, se diluye 5 veces con agua destilada. A partir de esta dilución, se vuelve a diluir 3 veces con agua destilada. Esta última dilución dió por método Biuret una absorbancia de 0,12 (a = 0,06 ± 0,01 ml/mg cm). ¿Cuál es la concentración de la solución original de proteínas? Rta = 30 mg/ml. 2- En un laboratorio se realiza de manera rutinaria la determinación de la concentración de proteínas en suero humano aplicando el método de Biuret. a) Para esto se preparan las disoluciones de reactivos que se utilizan para hacer reaccionar con una serie de testigos. Los valores de absorbancia de estos testigos se utilizan para construir una curva de calibración. ¿Cómo? b) Periódicamente el laboratorio recibe muestras de disoluciones de proteínas de concentraciones desconocidas (“problemas”) las que son ensayadas utilizando los mismos reactivos y producen valores de aborbancia que al ser interpolados en la curva de calibración permiten determinar la concentración de estos “problemas”. ¿Cómo? c) También periódicamente se debe corroborar la estabilidad físico-química de los reactivos utilizados en esa reacción colorimétrica. Para ello se utiliza una muestra testigo la cual debe producir siempre el mismo valor de absortividad. El día 30 después de la preparación de los reactivos y de la construcción de la curva de calibración un testigo de concentración 4mg/ml dio una A = 0,242. i)¿Es posible asumir que la absortividad es la misma que la indicada en el ejercicio 1? ii) ¿Será correcto utilizar aquella curva de calibración para interpolar el valor de A obtenido en una nueva disolución problema (A= 0,09) y así determinar su concentración de proteínas? iii) ¿Qué volumen de la disolución del punto ii se debe pipetear para tomar 100 µg de proteínas? R = 67 µl. d) Una semana después se desea cuantificar la concentración de proteínas en otra muestra problema utilizando los mismos reactivos para la reacción colorimétrica. El testigo de concentración 4 mg/ml dio un valor de absorbancia de A=0,35. Indique si es correcto hacer la cuantificación con los datos que dispone. JSR. 3- Para la determinación de la concentración de una sustancia X se construyeron tres curvas de calibración empleando métodos colorimétricos diferentes. Se estima que la concentración del tubo problema de X es el valor aproximado A. a) Indique cuál curva de calibración elegiría para determinar la concentración de X. JSR. b) Explique a qué podrían deberse las diferencias entre las tres curvas. c) ¿Cómo haría para determinar la concentración de X, si sólo contara con la curva de calibración 1? 1 Absorbancia 2 3 A Concentración (mg/ml) 34 4- Se realizó un espectro de absorcion del flunitrazepam, que es una droga que posee efectos hipnoticos, anticonvulsionante, ansiolitico y miorelajante de acción central. Los datos de la Tabla 1 corresponden a absorbancias de una solución de flunitrazepam 25 µM en etanol 3% V/V y en tris HCl 50 mM, pH 7,4 medidos a diferentes longitudes de onda: λ 210 220 250 260 270 280 290 320 330 340 350 360 370 A 0.2 0.604 0.446 0.407 0.320 0.286 0.272 0.250 0.190 0.120 0.070 0.040 0.020 a) Grafique el espectro de absorción y coloque el título correspondiente. b) ¿Qué longitud de onda elegiría para realizar una curva de calibración? c) ¿Cómo se preparó el tubo blanco? d) ¿Es necesario descontar el blanco cada vez que se cambia la longitud de onda? Si-No. J.S.R. 5- El siguiente es un protocolo de trabajo para la cuantificación de ADN en base a su contenido de desoxirribosa empleando el reactivo de difenilamina. Muestra Blanco NaCl 1M Testigo Problema 1ml ADN 100 µg/ml en Nacl 1M 1 ml ADN [ ] desc en NaCl 1M difenilamina 2ml Volumen final a) Completar los espacios en blanco. b) ¿Por qué coloca NaCl 1M y no agua destilada en el blanco? c) ¿Cómo realizaría una curva de calibración si sólo cuenta con una solución de ADN de 100 µg/ml? d) ¿Qué precauciones debe tener al elegir las concentraciones de los testigos? e) ¿Cómo corregiría este protocolo en los casos en que: 1-la absorbancia del problema sea >> 0,8 2- la absorbancia del problema sea << 0,3 f) ¿Por qué deben tener todos los tubos igual volumen final? 6- La siguiente tabla corresponde a absorbancias de soluciones estándares de albúmina sérica bovina: [Albúmina](M×10-3) A 0,0 0,00 0,2 0,033 0,5 0,081 1,25 0,195 3,12 0,440 7,81 0,703 a) ¿Se cumple la ley de Lambert y Beer en este intervalo de concentraciones? b) Si no fuera así.¿Cuál es el límite superior de concentración del rango lineal? c) Determinar la concentración de albúmina cuya absorbancia medida en las mismas condiciones experimentales es 0,116. 35 7- Calcular el coeficiente de extinción molar del p-nitrofenol cuya A = 0,2 y la concentración es 11,428 µmoles/l, λ= 410 nm y b = 1 cm. Rta = 17500 L.mol-1. cm-1 8- Se cuantificó una solución de tirosina por absorción al UV. Esta solución dio A = 0,16; calcular la concentración M de tirosina considerando que dicha solución había sido diluida primero 3 veces y luego 2 veces más. ε274nm= 14000 L.mol-1. cm-1, λ = 274 nm. Rta = 6,85.10-5 M. 9- Una solución de una sustancia de PM 600 g/mol con una concentración de 40 µg/ml tiene A = 0,3 a 540 nm, medida en una cubeta de 1 cm de paso óptico. Calcular el coeficiente de extinción molar. Rta = 4500 L.mol-1. cm-1 10- Si tuviera una mezcla de las sustancias A y B. ¿Qué longitud de onda elegiría para cuantificar cada una de ellas? Absorbancia 0.4 A 0.3 0.2 B 0.1 0.0 300 450 600 750 Long Onda (nm) 11- Una solución contiene dos flavonoides: flavonoide 1 (F1) y flavonoide 2 (F2). Se quiere cuantificar ambos sin una purificación previa. Analizando la Fig. 11 se observa que entre 200 nm y 420 nm sus espectros se superponen, por lo tanto, la cuantificación de cualquiera de ellos interfiere con la del otro. A longitudes de onda superiores a 420 nm sólo absorbe F1. Calcule la concentración molar de F1 y F2 en esa solución sabiendo que: Solución problema (mezcla de F1/F2) Testigo de F1 Testigo de F2 c1 = 15 µM c2 = 15 µM c1 = ? c2 = ? A350 = 0,05 A350 = 0,4 A350 = 0,6 A500 = 0,5 A500 = 0,4 36 EJERCITACION ADICIONAL 1- Calcule el número de moles, micromoles y milimoles que hay en 2g de Na(OH) (PM=40). 2- ¿Qué cantidad de glucosa (PM=180) tiene que pesar para preparar 200 ml de una solución 0,05 M? Rta = 1,8 g. 3- ¿Qué volumen de una solución 10 mM se puede preparar con 1 g de glucosa (PM=180)?. Rta = 555,6 ml. 4- Si tiene 3 litros de una solución de Na(OH) 0,5 M, ¿Cuántos moles y que concentración molar poseen los siguientes volúmenes: a) 50 ml; b) 0,25 ml; c) 1 litro. Rta: a) 0,025 moles, 0.5 M; b) 1,25 x 10-4 moles, 0,5 M; c) 0,5 moles, 0,5 M 5- ¿Qué molaridad tiene una solución que contiene 60 gr de NA(OH) (PM=40) por litro? Rta: 1,5 M. 6- ¿Qué cantidad de NA(OH) (PM=40) estan contenidos en 3 litros de una solución 2,5 M? Rta: 300gr. 7- Una solución de ácido sulfúrico al 98% P/P, cuya densidad es 1,8 g/cm3, ¿qué molaridad tiene? Rta: 18 M. 8- ¿Cuál será la molaridad de una solución de ácido clorhídrico (PM=36,5) al 37% P/P cuya densidad es 1,19 g/cm3?. Rta: 12 M 9- ¿Cómo procedería para preparar 2 litros de una solución de ClK 10 mM a partir de una solución 3 M ? Rta: tomar 6,67 ml (3 M) colocarlos en un matraz de 2 litros enrasar con agua destilada. 10-Se quieren preparar 6 litros de una solución 0,25 M de ácido sulfúrico a partir de una solución 63% P/P (densidad=1,7 g/cm3). ¿Qué volumen debe tomar?. Rta: 137,28 ml. 11-Los siguientes son los resultados de la cuantificación de H2SO4 en una misma muestra realizado por un método "A" por cuatro analistas diferentes: a- 50,00 % P/P, densidad= 1,3952 g/ml b- 70,00 % P/V c- 7,00 M d- 7100 mM De acuerdo al enunciado anterior diga: a- ¿Cómo procede para comparar los resultados anteriores? b- ¿Que puede decir acerca de la precisión del método empleado en la cuantificación? DATOS: PM H2SO4 = 98,08 12- Se desea investigar los efectos de flunitrazepam sobre el comportamiento de ratas en situación de "stress". Para ello cuenta con dos lotes de cinco ratas de 300 g cada una. El lote Nº1 (experimental) es inyectado con una solución de flunitrazepam 67µM en cloruro de sodio 0,8775 % P/V (solución fisiológica). a) ¿Cómo procede para preparar 100 ml de dicha solución? b) ¿Cuál es la utilidad del segundo lote de ratas? ¿Con qué inyecta esas ratas? ¿Cómo prepara esa solución? 37 c) Si la dosis de flunitrazepam cuyo efecto se desea investigar es 70 µg/kg de peso corporal, ¿qué volumen debe inyectar a cada animal?. DATOS: flunitrazepam = droga sólida, PMflunitrazepam = 313,3 PACl = 35,5 PANa = 23 13- En el siguiente gráfico se muestran espectros de absorción de varias sustancias. ¿Cuál de las longitudes de onda indicadas elegiría para luego trabajar con un fotocolorímetro y cuál para trabajar con un espectrofotómetro? ¿Estos espectros fueron obtenidos con un espectrofotómetro o con un fotocolorímetro? Podria obtener un espectro como el B si sólo dispusiera de un fotocolorímetro para analizar su muestra? Absorbancia 0.4 0.3 B A 0.2 0.1 0.0 C 300 450 600 750 Long Onda (nm) 14- Calcular la absorbancia que corresponde a cada uno de los siguientes valores de transmitancia: a) 0% b) 0,2% c) 0,8% d) 1,52% e) 68%. 15- Se desea investigar el contenido de glucosa en sangre después de la administración por vía oral de 0,5 g de dicho compuesto. Se trabajó con un grupo de 20 ratas de 2 meses de edad, peso promedio 300 g. Se tomaron muestras de sangre a 0, 30, 45, 60, 90 y 120 minutos después de la ingestión y se determinó en suero la cantidad de glucosa por un método fotocolorimétrico, expresó como el valor promedio en mg % P/V de glucosa en sangre. (Tabla 4). En otro experimento se tomó otro grupo de 20 ratas con las mismas características y sometidas al mismo tratamiento que las anteriores. Una hora antes del experimento fueron inyectadas por vía endovenosa con 200 µl de una solución 20 µM de Glucagón (el glucagón es una hormona pancreática que incrementa el nivel de glucosa por la estimulación de la degradación de glucógeno en hígado) (Tabla 5). a) Identifique para cada experimento la variable dependiente y la independiente. J.S.R b) Grafique los resultados y coloque título a los mismos. c) Indique la ecuación matemática a la que se ajustan los datos. TABLA 4 mg % p/v glu/sangre TABLA 5 tiempo min mg % p/v glu/sangre tiempo min 70 0 140 0 105 30 175 30 122 45 195 45 140 60 210 60 175 90 260 90 210 120 290 120 16- Postule dos modelos de experimentación donde pueda identificar variables dependientes e independientes. 38 TRABAJO PRACTICO Nº 2 ESPECTROFOTOMETRÍA: Cuantificación de Proteínas (Práctico de Laboratorio) No olvidar concurrir con guardapolvo, gafas, guantes, cabello recogido y calzado cerrado. Los alumnos serán evaluados al final del TP (evaluación escrita) y durante el desarrollo de la clase (evaluación oral), sobre los contenidos que se encuentran en la guía de TP. OBJETIVOS: - Adquirir destreza en el diseño del protocolo, en el manejo de técnicas de laboratorio y en el uso del espectrofotómetro. - Construir una curva de calibración a partir de una muestra de albúmina de concentración conocida. - Determinar la concentración de proteínas presente en una muestra problema. - Valorar la importancia del trabajo prolijo y ordenado para la obtención de resultados confiables. FUNDAMENTO DEL MÉTODO DE BIURET: Las sustancias que contienen dos grupos -CONH2 (amida); -CH2NH2 (amina); -C(NH)(NH2) (diamina); o -CSNH2 (tioamida), unidos, sea directamente entre sí, o a través de un átomo de carbono o nitrógeno; y las estructuras peptídicas que contengan como mínimo dos enlaces peptídicos, en presencia de Cu++y en solución alcalina, forma un complejo de color violeta, el complejo de Biuret. O C C NH RC H O C NH RC H O HN Cu2+ H CR C O HN H CR Violeta-púrpura El método de biuret desarrollado por Gornall et al. permite cuantificar soluciones que contengan entre 1 y 10 mg de proteínas por mililitro y no depende de la composición de aminoácidos de la proteína. (GORNALL, A.G ET AL., 1949, J. BIOL. CHEM., 177-766). Experiencia Virtual: Ingrese en el siguiente link http://biomodel.uah.es/lab/abs/espectro.htm Universidad de Alcalá, Alcalá de Henares, España). Realice las actividades propuestas. (Angel Herráez, Biomodel, 39 CUANTIFICACIÓN DE ALBÚMINA POR EL MÉTODO DE BIURET MATERIALES Y MÉTODOS: Se dispondrá de estos reactivos ya preparados: Reactivo de biuret: El mismo fue preparado disolviendo 1,5 g de sulfato de cobre (CuSO4.5H2O) y 6g de tartrato de sodio y potasio tetrahidratado en 500 ml de agua destilada. Se agitó constantemente para luego añadir 300ml de Na(OH) al 10%. Finalmente se diluyó hasta 1 litro con agua destilada y se conservó en frasco de plástico. Solución testigo madre: Albúmina bovina a una concentración de 5mg/ml en agua destilada. Protocolo: • En el tubo blanco colocar 0,25 ml de agua destilada • En los tubos testigo, de la curva de calibración, colocar entre 0,05 y 0,25 ml de solución testigo madre de albúmina y completar con agua tal que cada tubo contenga un volumen de 0,25ml. • En el tubo problema colocar 0,25 ml de la solución problema. • Agregar a cada uno de los tubos 1 ml de reactivo de biuret. • Agitar y dejar en reposo a temperatura ambiente durante 30 minutos. • Leer la absorbancia a 550 nm. Graficar la curva de calibración y realizar la regresión lineal de los datos. REACTIVOS CURVA DE CALIBRACIÓN T1 T2 T3 T4 T5 Agua Disolución de albumina 5 mg/ml Disolución de albumina de concentracion desconocida Reactivo de Biuret Volumen Final Concentración de proteínas RESULTADOS Tubo T1 T2 T3 T4 T5 P Absorbancia [Proteinas] (mg/ml) TUBO PROBLEMA TUBO BLANCO 40 CURVA DE CALIBRACIÓN DISCUSIÓN BIBLIOGRAFÍA ESPECÍFICA - Problemas de Química. J.M. Esteban y J.M. Cavanillas. Ed. Alhambra. 4a. 1976. España. - Cálculos en Bioquímica. I.J. Segel. Ed. Acribia. Saragoza. España. 1972. - Métodos instrumentales de análisis. H.H. Willard, L.Merritt Jr., y J.A.Dean. Ed. CECSA. México. 1974. - Análisis Instrumental. D.A. Skoog y D.M. West. Ed. Interamericana. México. 1975. - Química Clínica: Bases y Técnicas. R.J. Henry, D.C. Cannon y J.W. Winkelman. Tomo I. 2a Ed. Jims. Barcelona. España.1980. - Lehninger Principles of Biochemistry. David L. Nelson & Michael M. Cox. Worth Publishers. 3º Ed. NY. USA.2000. - Spectrophotometry and Spectrofluorometry A practical Approach. Edited by Michael G. Gore. Ed. Oxford University Press. Inc. NY. USA. 2000. - Experimentación en Química General. Joaquín Martínez Urreaga; Adolfo Narros Sierra; María del Mar de la Fuente García-Soto. Ediciones Paraninfo, S.A. - Análisis Químico Cuantitativo. Daniel C. Harris. Editorial Reverté. - Química Analítica Moderna. W. F. Pickering. Editorial Reverté. - Química Analítica Cuantitativa. Day, R. A., and A. L. Underwood. Edición Prentice Hall Hispanoamericana. - Química Analítica. Higson S. McGraw-Hill. - Química Analítica. Skoog, West, Holler. Cengeage Learning, 2001. - Instrumentación química: estudio sistemático del análisis instrumental. Strobel, Howard A. Limusa Wiley. 1968. - Química analítica cualitativa. Martí, Fernando Burriel. Editorial Paraninfo, 2002. - Análisis químico cuantitativo. Kolthoff, I. M. I. M No. 545 ANA. 1976. - Principios de análisis instrumental. Skoog, Douglas A., F. James Holler, and Timothy A. Nieman. (2001): 11-19. - Métodos instrumentales de análisis en química clínica. Bender, Gary T. Acribia, 1992. - Métodos instrumentales de análisis. Willard, Hobart H. Merritt, et al. No. QR148 W71e. 1991. - Espectroscopia. Browning, David Robert, María Xirau Vayreda, and Francisco Moreno Martín. Toray-Masson SA, 1971. 41 PROTEÍNAS Trabajos prácticos 3 y 4 El tema “proteínas” se desarrollará en tres clases de trabajos prácticos: Trabajo Práctico N°3: Primera Parte: Puesta en común de los problemas previamente resueltos de manera individual por el alumno sobre el tema: purificación de proteínas. Segunda Parte: Elaboración del protocolo de Trabajo para la clase de laboratorio de la semana siguiente. Trabajo Práctico N°4: Trabajo de laboratorio: “Purificación de fosfatasa ácida de hígado”. Puesta en común sobre dificultades, resultados y conclusiones 42 TRABAJO PRACTICO Nº 3 PURIFICACIÓN, CUANTIFICACIÓN Y ANÁLISIS ESTRUCTURAL DE PROTEÍNAS (Práctico de Resolución de Problemas) Los problemas deberán ser resueltos por los alumnos antes de concurrir a la clase. En caso de necesitar aclarar dudas, los docentes estarán disponibles en sus horarios de consulta en la cátedra. Los alumnos serán evaluados al final del TP (evaluación escrita) y durante el desarrollo de la experiencia práctica (evaluación oral), sobre los contenidos que se encuentran en la guía de TP. PRIMERA PARTE. Resolución de problemas OBJETIVOS - Conocer los fundamentos teóricos de las técnicas utilizadas en la purificación y caracterización de proteínas. - Valorar la importancia del dominio de diferentes técnicas y del conocimiento acerca de las características particulares de la proteína a purificar, para poder aplicarlos con criterio. - Adquirir y aplicar herramientas teóricas para la resolución de los problemas planteados. TEMAS PARA REPASAR 1- Estructura de Proteínas. Abreviaturas de los nombre de los aminoácidos: código de 1 y 3 letras. 2- Equilibrio Acido-Base de amino ácidos y de proteínas. 3- Coeficiente de sedimentación. 4- Enzimas proteolíticas. 5- Concepto Actividad específica 6- Temas 2-3 del programa de la materia. INTRODUCCIÓN Las proteínas constituyen uno de los grupos de moléculas biológicas más importantes en cuanto a su diversidad de funciones: catálisis, de movimiento, de recepción de información, de almacenamiento o de respuesta inmune, entre otras. Las proteínas son macromoléculas lineales constituidas por la unión covalente de aminoácidos. Estas estructuras lineales se pliegan adquiriendo una estructura tridimensional particular (estructuras secundaria y terciaria) que determinará su función. La secuencia de aminoácidos de la proteína (estructura primaria) está determinada a su vez por la información genética contenida en la secuencia de nucleótidos de los ácidos nucleicos de un organismo (en general el ADN, en el caso de algunos virus puede ser ARN). Algunas proteínas sufren la adición de residuos no aminoacídicos (modificaciones postraduccionales) que también modulan su estructura y función. La proteómica, ciencia que relaciona las proteínas con su estructura y función, estudia el conjunto de proteínas (proteoma) que se expresan en la célula a partir del genoma en un momento dado. Esto permite tener una imagen de todas las proteínas expresadas en un determinado momento y bajo determinadas condiciones ambientales. Permite identificar aquellas proteínas cuya presencia, ausencia o alteración está relacionada con diferentes condiciones metabólicas y/o patológicas, correlacionándolas con diferentes estadios fisiológicos o patológicos. La enorme complejidad del proteoma de los organismos vivos obliga al empleo de diversas técnicas para separar las proteínas. Muchas de estas técnicas, como la cromatografía líquida y la electroforesis entre otras, permiten tanto la separación de proteínas (purificación) como su caracterización. 43 Durante la separación de las proteínas es importante poder cuantificar el rendimiento del proceso de purificación de las proteínas de interés, es decir medir cuánto de la proteína de interés nos va quedando en la muestra en cada paso de purificación. Normalmente, es inevitable que la purificación se consiga a expensas de la cantidad: mientras más pura resulta nuestra proteína más proteína habremos perdido en el proceso. Para cuantificar la cantidad de proteína en cada muestra se utilizan diferentes técnicas espectroscópicas (fluorescencia, espectrofotometría). El análisis de la estructura y de la actividad de las proteínas nos permitirá relacionar cambios en estos dos parámetros con condiciones fisiólógicas o patológicas. TÉCNICAS UTILIZADAS EN EL ESTUDIO DE PROTEÍNAS: PROCESO PURIFICACIÓN CUANTIFICACIÓN ANÁLISIS DE ESTRUCTURA ANÁLISIS DE ACTIVIDAD Fraccionamiento subcelular por centrifugación diferencial y por gradiente de sacarosa. Espectrofotometría Espectrofluorimetría Actividad enzimática Precipitación salina. Espectrofluorimetría Dicroismo circular Unión de radioligandos Diálisis. ELISA RMN Formación de complejo Ag-Ac Cromatografía de filtración por gel. FT-IR Conductancia a iones Cromatografía de intercambio iónico. MALDI-MS Cromatografía de afinidad. Secuenciación Cromatografía líquida de alta presión (HPLC). Perfil hidropático Electroforesis en geles. Difracción de rayos X Isolelectroenfoque y electroforesis bidimensional. Comparación de secuencias. Note que cada cada columna muestra un listado es independiente de técnicas para cada fin (purificar, cuantificar, analizar, etc). 44 PROBLEMAS 1- Una disolución de una proteína cuya secuencia incluye tres residuos de triptofano (Trp), sin residuos de tirosina, ni de fenilalanina, tiene una absorbancia de 0,1 a 280 nm en una celda de 1 cm de paso óptico. Obtener la concentración de la proteína en unidades de molaridad. Si la proteína tiene una masa molecular de 100 kDa, calcular la concentración en miligramos de proteína por mililitro de disolución. εtrp =3400 cm-1.M-1. 2- Determinación del tamaño. Las movilidades electroforéticas relativas de una proteína de 30 kDa y una de 92 kDa utilizadas como estándar en un gel de SDS-poliacrilamida son, respectivamente, 0,8 y 0,41. ¿Cuál es la masa aparente de una proteína que tiene una movilidad de 0,62 en este gel? 3- Elegir la columna. El octapéptido AVGWRVKS se digirió con tripsina. (a) ¿Sería el intercambio iónico o la exclusión molecular la técnica más apropiada para separar estos productos? ¿por qué? (b) Suponer que el péptido se digiere con quimiotripsina. ¿Cuál sería la técnica de separación óptima? ¿por qué? Datos: La tripsina corta del lado carboxilo de los residuos arginina y lisina, mientras que la quimiotripsina lo hace del lado carboxilo de los residuos tirosina, triptofano, fenilalanina, leucina y metionina. 4- Secuencia de proteínas I. Determinar la secuencia de un hexapéptido basándose en los siguientes datos. Nota: Cuando no se conoce la secuencia, los aminoácidos se separan con una coma. (ver datos en la Tabla de ruptura específica de los polipéptidos). Datos: Composición de aminoácidos Análisis N-terminal del hexapéptido Digestión por tripsina Digestión por carboxipeptidasa Digestión por quimiotripsina Reactivo Ruptura química Bromuro de cianógeno O-Iodobenzoato Hidroxilamina 2-Nitro-5tiocianobenzoato Ruptura enzimática tripsina clostripaína Proteasa de Staphylococcus trombina quimiotripsina Carboxipeptidasa A (2R,A,S,V,Y) A (R,A,V) y (R,S,Y) no hay digestión (A,R,V,Y) (R,S) Ruptura específica de los polipéptidos Lugar de ruptura Lado carboxilo de los residuos metionina Lado carboxilo de los residuos triptofano Enlaces asparragina-glicina Lado amino de los residuos cisteína Lado carboxilo de los residuos lisina y arginina Lado carboxilo de los residuos arginina Lado carboxilo de los residuos aspartato y glutamato (el glutamato solo en ciertas condiciones) Lado carboxilo de los residuos arginina Lado carboxilo de los residuos tirosina, triptofano, fenilalanina, leucina y metionina. Lado amino del aminoácido C-terminal (salvo arginina, lisina y prolina) 45 5- La tropomiosina, una proteína muscular de 93 kDa , sedimenta más lentamente que la hemoglobina (65 kDa). Sus coeficientes de sedimentación respectivos son 2,6 S y 4,31 S. ¿Cuál es la carácteristica estructural responsable de su lentitud en la sedimentación? 6- Suponga que desea purificar por cromatografía de intercambio iónico una enzima del metabolismo del ADN, cuyo sustrato es precisamente ADN, con el cual interactúa elestroctáticamente. ¿Seleccionaría una resina de intercambio aniónico o catiónico? ¿Por qué?. 7-La cromatografía de filtración en gel o de tamiz molecular es un método de separación proteica basado en el tamaño (o, más precisamente, en el radio hidrodinámico) de las moléculas. Una solución proteica se “siembra” en una columna conteniendo pequeñas esferas de polímeros entrecruzados (por ej. Sephadex), empaquetadas y suficientemente hidratadas 4. Este soporte funciona como un filtro al revés, donde las moléculas más grandes migran más rápido y salen de la columna antes que las pequeñas. Una segunda técnica de separación de proteínas es la electroforesis. Existen muchos tipos de electroforesis. En todos los casos, las proteínas, colocadas en un soporte (gel, papel, etc) se exponen a un campo eléctrico externo. Si el soporte es un gel de poliacrilamida y el proceso se realiza en presencia de un agente desnaturalizante, el dodecil sulfato de sodio (SDS) la técnica se denomina PAGE-SDS. En este caso las moléculas proteicas se separan por tamaño (Las más pequeñas migran más rápidamente). (El SDS desnaturaliza las proteínas uniéndose a ellas en forma no específica confiriéndoles carga negativa y en una proporción definida según el PM de la proteína, con lo cual la partícula que migra (complejo proteína-SDS) mantiene una relación carga/masa definida que se mantiene constante a lo largo de la corrida). Ambos procedimientos separan a las proteínas según el tamaño y utilizan polímeros entrecruzados como medio de soporte. ¿Cómo es posible que en la filtración en gel las moléculas pequeñas se retarden con respecto a las mayores, mientras que en electroforesis en gel de poliacrilamida ocurra lo contrario? 8- Problema de purificación de proteínas. Completar la siguiente tabla Actividad Actividad específica Procedimiento de Proteína total purificación total (mg) µmol/min/mg µmol/min proteína Extracto crudo Precipitación con (NH4)2SO4 Cromatografía DEAE-celulosa Cromatografía de exclusión molecular Cromatografía de afinidad 20 000 4.000000 5000 3.000000 1500 1.000000 500 750 000 45 675 000 Nivel de purificación Rendimiento (%) 1 100 4 Las proteínas de tamaños diferentes varían en su capacidad de penetrar los poros hidratados de las esferas. Las proteínas pequeñas lo hacen con mayor probabilidad que las grandes por lo cual, recorren un camino más lago y, a medida que bajan en la columna se van retrasando respecto a las proteínas de mayor tamaño las que tienen menor probabilidad de ingreso a los poros del gel. 46 9- ¿Haciendo más enzima? Durante la purificación de una enzima un investigador realiza un paso de purificación que produce un incremento en la actividad total dando un valor mayor que el que está presente en el extracto crudo. Explicar cómo se puede incrementar la actividad total. 10- Suponga que está desarrollando una marcha de purificación para obtener una enzima soluble propia del citoplasma de las células hepáticas de rata. Inicialmente se desea evaluar el rendimiento del primer paso del proceso que consiste en una centrifugación a 1000 x g durante 15 min de un homogenato de tejido hepático. (Fracción H) separando sus componentes en un precipitado llamado Pellet (Fracción P1 y en un sobrenadante (Fracción S1). Para ello es necesario cuantificar proteinas y actividad enzimática por lo que se tomaron alícuotas de 0,5 ml de las Fracciones H y S1 y se diluyeron hasta un volumen final de 4,5 ml con agua bidestilada obteniendose las Muestras H y S1 respectivamente. Por otra parte la fraccion P1 fue resuspendida en 10 ml de agua obteniendose la Muestra P1. El siguiente esquema resume el protocolo aplicado: Fracción Homogenato (H) Centrifugación 1000 x g Fracción Sobrenadante 1 (S1) (Vol. Recuperado= 4 ml) 0,5 gr de tejido en 5 ml de buffer Fracción Pellet 1 (P1) (Vol. Recuperado= 0,5 ml) Muestra H 0,5 ml de H en 4 ml de agua (Vol. Final= 4,5 ml) Muestra S1 0,5 ml de S1 en 4 ml de agua (Vol. Final= 4,5 ml) Muestra P1 P1 resuspendido en 10 ml de agua (Vol. Final= 10 ml) En la Tabla 1 se muestran los valores obtenidos para la concentración de proteínas y producto formado de las Muestras. Para cuantificar proteínas se autilizó el Método de Biuret. La cuantificación del producto formado durante 15 min de reacción, se realizó en un sistema que contenía 0,1 ml de Muestra en 5,5 ml finales. Tabla 1 Muestra mg prot/ml mg prot en la Muestra µmoles de Producto Muestra H 3,19 0,109 Muestra S1 1,50 0,098 Muestra P1 1,72 0,008 µmoles de Producto en la Muestra Actividad en la Muestra 47 Tabla 2 Fracción Proteína total (mg) Actividad total µmol/min Actividad específica µmol/min/mg proteína Nivel de purificación Rendimiento (%) H S1 P1 -- -- a) Complete la Tabla 1 calculando los mg de proteína y µmoles de producto presentes en el volumen total de cada Muestra y la Actividad de la enzima en cada Muestra. b) Calcule los valores de proteína total y actividad total en cada Fracción y complete la Tabla 2. c) En que fracción se recuperó la mayor cantidad de enzima? Por qué? d) Según los datos mostrados, la centrifugación a 1000 x g por 15 min permite purificar la enzima hepática? SEGUNDA PARTE: Elaboración de un protocolo para purificar”fosfatasa ácida” de hígado En la segunda parte del trabajo práctico los alumnos discutirán los pasos a seguir en el siguiente trabajo práctico en el cual purificarán la proteína fosfatasa ácida de hígado de pollo. Al finalizar la clase los alumnos deberán elaborar el protocolo de purificación. BIBLIOGRAFÍA ESPECÍFICA Lehninger Principles of Biochemistry. David L. Nelson & Michael M. Cox. Worth Publishers. 3º Ed. NY. USA.2000 Stryer L, Berg, JM y Tymoczko, JL. Bioquímica, Ed. Reverté SA, 5ºEd. España 2003. 48 TRABAJO PRACTICO Nº 4 PURIFICACION, CUANTIFICACION Y ANALISIS ESTRUCTURAL DE PROTEÍNAS. (Práctico de Laboratorio) No olvidar concurrir con guardapolvo, gafas, guantes, cabello recogido y calzado cerrado. Los alumnos serán evaluados al final del TP (evaluación escrita) y durante el desarrollo de la clase (evaluación oral), sobre los contenidos que se encuentran en la guía de TP. OBJETIVOS: - Adquirir destreza en el manejo de técnicas de laboratorio para purificación de proteínas - Obtener una fracción enriquecida en fosfatasa ácida, la cual será utilizada en las actividades prácticas de cinética enzimática. El objetivo principal de cualquier método de purificación es obtener una sustancia de interés aislada del resto de compuestos presentes en la muestra original. El rendimiento (o porcentaje de recuperación) alcanzado durante el proceso de purificación, es la relación entre la cantidad total de la sustancia de interés obtenida respecto a la cantidad inicial de la misma. El proceso de purificación a partir de muestras biológicas puede resultar muy trabajoso debido a que estas muestras son mezclas extremadamente complejas de sustancias químicas diferentes: lípidos, proteínas, hidratos de carbono, material genómico (ADN y ARN), compuestos solubles, entre otros. Por esta razón, los protocolos de purificación suelen constar de diversos pasos en los que se van eliminando sucesivamente diferentes sustancias, lo cual a su vez suele ser acompañado de métodos de monitoreo del grado de purificación logrado en cada paso. En el presente Trabajo Práctico se llevará a cabo una marcha de purificación con el objetivo de obtener una fracción enriquecida en fosfatasa ácida, la cual será utilizada en las actividades prácticas de Cinética Enzimática. Las fosfatasas son enzimas que catalizan la hidrólisis de uniones ésteres de fosfato. Fosfatasa Ácida es el nombre dado a todas las fosfatasas que tienen actividad óptima por debajo de un pH de 7.0. Éstas se localizan fundamentalmente en los lisosomas. Los lisosomas son estructuras esféricas rodeadas por una membrana. Podrían considerarse “bolsas de enzimas” las que, en caso de liberarse, destruirían la célula. Una característica común entre ellos es que contienen enzimas hidrolíticas que funcionan a pH ácido: se han identificado unos 40 tipos distintos de enzimas hidrolíticas que degradan proteínas (proteasas), ésteres de sulfato (sulfatasas), lípidos (lipasas y fosfolipasas) o fosfatos de moléculas orgánicas (fosfatasas),siendo la más común la fosfatasa ácida. El pH interno del lisosoma es de aproximadamente 5 que es, asu vez, pH óptimo para la actividad de las enzimas que se encuentran en su interior. Para obtener la proteína de interés debemos fraccionar la célula y conocer o determinar cuál es la fracción subcelular que está enriquecida en la proteína que nos interesa. Para esto, procederemos a diagramar un protocolo de centrifugación diferencial que nos permita obtener la fracción celular enriquecida en la proteína de interés. En nuestro caso, la fosfatasa ácida se encuentra, como se mencionó anteriormente, en los lisosomas, que se aislan en la fracción microsomal del protocolo de centrifugación diferencial. 49 PRIMERA PARTE: Purificación de fosfatasa ácida de hígado de rata. - Material de partida: hígado de rata congelado. - Buffer de purificación: sacarosa 0,33 M, buffer fosfato 10 mM pH 7,4, Cl2Mg 3 mM. Centrifugación 1000 x g Homogenato Sobrenadante 1 (S1) Pellet 1: fracción nuclear (P1) Centrifugación 10000 x g Sobrenadante 2: (S2) Lisosomas + Proteínas Pellet 2: fracción mitocondrial (P2) solubles citosólicas Figura 1. Representación esquemática de un fraccionamiento subcelular por centrifugación para obtener la fracción microsomal como sedimento. PROTOCOLO - Paso 1: cortar 0,5 gr hígado y resuspenderlo en 5 ml de buffer fosfato pH 7 + sacarosa 0,33 M (condiciones isosmóticas), concentración de tejido de 10 % P/V - Paso 2: homogeneización en frio. - Paso 3: centrifugación a 1000 x g (2800 rpm en la centrífuga del TP) durante 10 min. - Paso 4: tomar el sobrenadante de la centrifugación anterior y someterlo a una nueva centrifugación durante 20 min. a 10000 x g (8900 rpm en la centrífuga del TP). - Material final: sobrenadante. Tomar alicuotas de cada fracción (homogenato, sedimento 1, sobrenadante 1, sedimento 2 y sobrenadante 2). Estas muestras se utilizarán luego para cuantificar proteínas totales por el método de Biuret y medir actividad de fosfatasa ácida en cada una de las fracciones. Con estos datos podremos construir el cuadro de purificación. Dado que la fosfatasa ácida se encuentra encerrada en una vesícula, es decir rodeada de membrana (el lisosoma), para poder cuantificarla y medir su actividad es necesario liberarla. Esto se logra sometiendo a los lisosomas a condiciones hipo-osmóticas (agua bidestilada). PREGUNTAS: qué es la osmolaridad?. Qués son condiciones hipo, iso o hiperosmóticas? 50 Las distintas alícuotas serán diluidas en condiciones hipo-osmóticas de acuerdo al siguiente esquema: Fracción Alícuota de la fracción Agua bidestilada Volumen total Homogenato 0,5 ml 3,5 ml 4 ml Pellet 1 Todo el pellet ~20 ml 20 ml Sobrenadante1 0,5 ml 3,5 ml 4 ml Pellet 2 Todo el pellet ~10 ml 10 ml Sobrenadante 2 0,5 ml 3,5 ml 4 ml ESQUEMA DE DILUCIONES Esquema adaptado de la monografía presentada a esta materia por la alumna Antonella C. Gerbaldo (2015). 51 SEGUNDA PARTE: Cuantificación de la actividad catalítica de fosfatasa ácida. Cada grupo tomará las alícuotas colectadas correspondientes a las distintas fracciones obtenidas durante la purificación y cuantificará cantidad de proteínas totales y actividad enzimática. Experimento Nº1: Cuantificacióin de proteínas totales: Método de Biuret Se dispondrá de estos reactivos ya preparados: Reactivo de biuret el mismo que les fuera provisto en el TP 2. Solución testigo: Albúmina bovina a una concentración de 2.5 mg/ml en agua destilada. Sistema de Incubación En el tubo blanco colocar 0.25 ml de agua destilada; en el tubo testigo colocar 0.25 ml de solución testigo de albúmina (2,5 mg/ml); en los tubos problema (las distintas fracciones) colocar 0.25 ml de las fracciones colectadas. Agregar a cada uno de los tubos 1 ml de reactivo de biuret, agitando y dejar en reposo a temperatura ambiente durante 30 minutos. Determinar la absorbancia (λ = 550 nm) de los tubos testigo y problema. Todas los ensayos deben ser realizados por duplicado.(para qué y cómo se usa el tubo blanco?) Experimento Nº2 : Determinación de la Actividad enzimática Sistema de Incubación Sustrato (p-nitrofenilfosfato): 100 µl Buffer (acido acético- acetato de sodio, pH 5, 0,1 M): 250 µl Enzima (distintas fracciones): 100 µl Activador (Cl2Ca 11 mM): 100 µl Inactivador (NaOH 0,1M): 5 ml Recomendaciones: Colocar en un tubo todos los componentes menos la enzima. La reacción comienza con el agregado de la enzima y la incubación a 37°C. Mezclar rápidamente y continuar la incubación durante 15 min. La reacción se detiene por el agregado de 5 ml de NaOH 0.1 M (inactivador). El álcali, por un lado inactiva a la enzima y por otro da el medio alcalino necesario para que el producto (p-nitrofenol) desarrolle color. Es importante hacer en cada caso un control de tiempo de incubación sin actividad enzimática, este tubo contiene lo mismo que los tubos problema pero con la inactivador agregado previamente a la enzima. Este tubo se usa como blanco para el espectrofotómetro. Leer a 410 nm y calcular los µmoles de producto formado por minuto, utilizando un ε = 17500 M-1.cm-1. RESULTADOS Cuantificación de Proteínas Tubo Muestra Testigo Muestra H Muestra P 1 Muestra S1 Muestra P2 Muestra S2 Absorbancia [Proteinas] (mg/ml) mg proteína en la Muestra 52 Actividad Enzimática Tubo No Absorbancia µmoles de P µmoles de P/min Muestra H Muestra P1 Muestra S1 Muestra P2 Muestra S2 Tabla de Purificación Procedimiento de Proteína purificación total (Fracciones) (mg) Homogenato (H) Pellet Centrifugacion 1000 x g 10 min (P1) Sobrenadante Centrifugacion 1000 x g 10 min (S1) Pellet Centrifugación 10000 x g 20 min (P2) Sobrenadante Centrifugación 10000 x g 20 min (S2) Actividad total (µmoles/min) Actividad específica (µmoles/min/mg prot) Nivel de purificación Rendimiento 1 100 (%) CONCLUSIONES BIBLIOGRAFÍA - Lehninger Principles of Biochemistry. David L. Nelson & Michael M. Cox. Worth Publishers. 3º Ed. NY. USA.2000 - Stryer L, Berg, JM y Tymoczko, JL. Bioquímica, Ed. Reverté SA, 5ºEd. España 2003. 53 CINÉTICA ENZIMÁTICA Trabajos Prácticos 5, 6 y 7 El tema “Cinética Enzimática” se desarrollará en cuatro clases de trabajos prácticos: Trabajo Práctico N°5: Puesta en comun de los problemas previamente resueltos de manera individual por el alumno. En el presente TP se presentará el TRABAJO CIENTIFICO, el cual será EXPUESTO ORALMENTE por los alumnos en el TP Nº 7 Trabajo Práctico N°6: . Elaboración del protocolo y desarrollo de Trabajo de laboratorio. Puesta en común sobre dificultades, resultados y conclusiones de esta actividad. Trabajo Práctico N°7: Seminario de discusión del trabajo científico. Conclusión general. 54 TRABAJO PRACTICO Nº 5 CINÉTICA ENZIMÁTICA. (Práctico de Resolucion de Problemas) Los problemas deberán ser resueltos por los alumnos antes de concurrir a la clase. En caso de necesitar aclarar dudas, los docentes estarán disponibles en los horarios de consulta en la Cátedra. Los alumnos serán evaluados al final del TP (evaluación escrita) sobre los contenidos que se encuentran en la guía de TP. OBJETIVOS - Conocer el mecanismo por el cual transcurren las reacciones catalizadas por enzimas. - Comprender cómo influyen las variables tiempo de incubación, concentración de enzima, concentración de sustrato, temperatura, pH, y la presencia de inhibidores sobre la velocidad inicial y la cantidad de producto formado en reacciones catalizadas por enzimas “Michaelianas”. - Interpretar el significado de las constantes cinéticas KM y Vmax. - Valorar la importancia del trabajo prolijo y ordenado para la obtención de resultados confiables. CONCEPTOS TEÓRICOS Todas las reacciones químicas pueden ser descriptas en términos de su estado de equilibrio y de su cinética. La condición de equilibrio ocurre cuando las concentraciones de reactivos y productos permanecen constantes en un sistema cerrado. El estado de equilibrio está caracterizado por la constante de equilibrio (K) (ec.1), la cual relaciona las concentraciones de los reactivos y productos en el equilibrio ([A]eq y [B]eq). A su vez, el valor de K está relacionado directamente con la energía libre de Gibbs estándar (∆G0’) (ec.2), cuyo valor es una referencia y permite predecir la dirección en la que la reacción transcurrirá espontáneamente si ocurre en condiciones estándar (concentraciones 1M para A y B, T=25°C, P= 1 atm). .A k1 k-1 B (a) K= [B] [A] (ec. 1) ∆Gº' = - RT ln K (ec. 2) Si las condiciones no son las estandar, la dirección en la que transcurrirá la reacción se define mediante ∆G (ec.3) el cual depende de los valores de concentración y temperatura reales a los que ocurre el proceso. ∆𝐺𝐺 = ∆𝐺𝐺°′ + 𝑅𝑅𝑅𝑅 ln [𝐵𝐵] [𝐴𝐴] (eq.3) ∆G<0 indica cambio espontáneo en la dirección planteada Teniendo en cuenta las ecuaciones 2 y 3, vemos que el valor de K da una idea de la dirección y magnitud en que ocurriría la reacción alejada del equilibrio. La cinética de una reacción es la descripción de la velocidad y del mecanismo por el cual la reacción llega al estado de equilibrio y está caracterizada por las constantes de velocidad, k1 y k-1 (a). Una reacción con un valor grande de K implica que la formación del producto B está muy favorecida en términos energéticos, sin embargo, la velocidad a la cual A se transforma en B puede ser muy lenta, tardar años o cientos de años, o necestitar condiciones de presión y temperatura extremas para que ocurran en una escala de tiempo observable. La velocidad de la reacción aumenta con la temperatura, ya que aumenta la fracción de moléculas que tiene una energía cinética suficiente (energía de activación) para transformarse en productos (Fig. 1A). La cinética de la reacción estará condicionada por la magnitud de la barrera de energía 55 necesaria para pasar de reactivos a productos la que se denomina energía de activación (∆G‡), que como se observa en la figura 1B puede ser disminuida por la presencia de un catalizador teniendo como resultado un aumento en la velocidad de reacción. A B Fig.1 A: Efecto de la temperatura sobre la distribución del número de moléculas en función de la energía. B: Efecto de un catalizador sobre la energía de activación de la reacción (∆G‡). La mayoría de las reacciones biológicas transcurren lentamente si no son catalizadas. Las enzimas son catalizadores biológicos, en la mayoría de los casos de naturaleza proteica y en esencia, catalizan reacciones mediante la estabilización del/de los estados de transición, disminuyendo así la energía de activación necesaria para transformarse en producto. En un gráfico de número de moléculas en función de la energía indique cómo varía la fracción de moléculas capaces de saltar la barrera de activación en presencia y en ausencia de catalizador. En consecuencia, la velocidad de la reacción aumenta (aumenta la fracción de moleculas con energía igual o superior a ∆G‡) y aunque el equilibrio de esas reacciones no cambia, es alcanzado rápidamente. Para el caso de reacciones catalizadas por enzimas ¿Cómo cree que afectará el aumento de la temperatura en la cinética de la reacción? ¿Por qué? El esquema más sencillo para representar una reacción catalizada por una enzima es el siguiente: Una determinada enzima (E) se combina con un determinado sustrato (S) formando un complejo enzima-sustrato (E-S) el cual se descompone para dar el producto (P) y enzima libre (E): E + S k1 k-1 ES k2 k-2 E + P La naturaleza proteica de las enzimas determina que varios factores tales como: a) la temperatura del medio, b) el pH, c) la concentración de enzima, d) el tiempo de incubación y e) la concentración de sustrato, influyan en el transcurso de la reacción. a) EFECTO DE LA TEMPERATURA DE INCUBACIÓN: Dentro de ciertos límites, la velocidad de reacción aumenta con la temperatura (discutido previamente, Fig 1A). Se asume que las reacciones que ocurren a temperatura ambiente, cuya energía de activación ha sido determinada, aumentan al doble su velocidad por cada aumento de 10°C. Existe una temperatura óptima; por encima de ésta, la velocidad decrece rápidamente 56 por desnaturalización de la enzima (Fig. 2). La temperatura de máxima actividad no se corresponde necesariamente con la temperatura de máxima estabilidad. Actividad Fig.2. Actividad enzimática vs temperatura Temperatura b) EFECTO DEL PH DEL MEDIO DE INCUBACIÓN: Cambios moderados en el pH afectan el estado iónico de la enzima y con frecuencia también del sustrato. Muchas de las enzimas conocidas presentan actividad máxima a pH fisiológico (entre pH 5 y pH 9), por ejemplo la tripsina, la β-galactosidasa (Fig.3), sin embargo algunas enzimas como la pepsina (Fig.4) tiene su óptimo a valores de pH bastante alejados de dichos límites. A valores extremos de pH se produce desnaturalización de la enzima. Actividad Actividad 6 8 10 2 pH Fig. 3. Actividad de la tripsina a distintos pH. 4 6 pH Fig. 4. Actividad de la pepsina a distintos pH. c) CONCENTRACIÓN DE LA ENZIMA: La Fig. 5 muestra el comportamiento de la cantidad del producto de reacción en función del tiempo de incubación. Además se muestran varias curvas correspondientes a diferentes concentraciones de enzima (en orden creciente de concentración de enzima desde E1 a E5). ¿Cómo se obtiene la velocidad de formación de producto a cada tiempo a partir de las curvas? La Fig. 5 muestra que a un valor de tiempo corto la cantidad de producto formado es mayor cuanto mayor es la concentración de enzima. ¿Cómo es la pendiente de la curva a tiempos cortos? Esto se evidencia claramente en la Fig.6 donde se grafica la velocidad de formación de producto en función de la concentración de enzima, [E], si se toma la [P] a un mismo valor de tiempo. A una concentración inicial de sustrato [S] constante, y en un rango de baja [E], la velocidad de formación de producto aumenta en forma directamente proporcional a [E], es decir que toda la enzima que se incorpora al sistema tiene la posibilidad de reaccionar con el sustrato y formar producto (Fig. 6). La velocidad en función de la [E] en este rango de baja [E] puede ser explicada por la ecuación de una recta y se denomina velocidad inicial, V0 (ver modelo de Michaelis Menten, más adelante) 57 Sin embargo cuando [E] es alta la velocidad de la reacción tiende a permanecer constante a pesar de que [E] aumente. V Concentración de enzima óptima para trabajar a V0 Fig. 5. Formación de producto en función del tiempo con concentraciones crecientes de enzima y una [S] inicial constante E Fig. 6. Velocidad de reacción en función de la concentración de enzima. d) TIEMPO DE INCUBACIÓN: En la Fig. 7 se observa la variación de las concentraciones de: complejo enzima-sustrato ([E-S]), de sustrato [S], de enzima [E] y de producto [P], en función del tiempo. Las líneas verticales del gráfico separan 3 estados por los que transcurre una reacción: - estado pre-estacionario: período muy corto que se caracteriza por el aumento en la [E-S], - estado estacionario: la concentración del complejo (E-S) se mantiene estable en el tiempo. [P] crece (o [S] disminuye) de manera proporcional al tiempo de reacción. - estado de equilibrio: una vez transcurrido un tiempo suficiente, la reacción llega al equilibrio. En este periodo la velocidad de formación de producto es igual a la de transformación de éste en sustrato. Concentración → Fig. 7. Variación de la concentración de las especies químicas que participan en una reacción catalizada por enzimas, en función del tiempo. [E]: concentración de enzima; [S]: concentración de sustrato; [ES]:concentración de complejo enzimasustrato [P]: concentración de producto. Estado Preestacionario Estado estacionario Equilibrio Tiempo → e) EFECTO DE LA CONCENTRACIÓN DE SUSTRATO: A una concentración de enzima constante, la velocidad de la reacción aumenta de forma lineal con el incremento de la [S]. La velocidad crece hasta que la enzima es saturada por el S y por lo tanto se alcanza la máxima concentración de complejo E-S y por lo tanto la velocidad máxima (Vmax) de formación de producto (Fig. 8). 58 V0 V0, max Fig. 8. Velocidad de reacción en función de la concentración de sustrato. S MODELO CINÉTICO DE MICHAELIS-MENTEN Para explicar las características cinéticas de algunas reacciones, Michaelis y Menten propusieron un modelo sencillo que las describe. Este modelo supone que la reacción inversa, la de formación de ES a partir de E y P, prácticamente no ocurre, lo cual es posible cuando la [P] es muy baja. es decir, a tiempos cortos y en donde la cantidad de sustrato consumido es despreciable respecto a la cantidad de sustrato inicial. A su vez, la ecuación de Michaelis-Menten se deduce de ecuaciones que parten de la condición de estado estacionario (ver las etapas en el gráfico de la Fig.7), en donde la [E-S] se mantiene estable en el tiempo en este sistema termodinámicamente abierto. Se denominan condiciones de velocidad inicial (V0) a las condiciones en que se debe medir la velocidad de reacción para que los supuestos del modelo se cumplan. En estas condiciones (tiempos cortos y concentración del complejo E-S constante) la formación de producto es directamente proporcional al tiempo y la curva puede aproximarse a una recta (Fig. 7). El rango de tiempo en que puede hacerse esa aproximación, la velocidad de la reacción se denomina velocidad inicial (V0). E + S k1 k-1 ES k2 E + P Debido a que la etapa limitante de la reacción es la conversión del complejo E-S hacia producto y enzima… ¿Cuál es la ecuación de velocidad catalítica de la reacción? Teniendo en cuenta que para la aplicación del modelo de M-M la velocidad se mide en condiciones de estado estacionario para el complejo E-S, repase la deducción de la ecuación de M-M. Determinando V0 a distintas concentraciones de S los datos se pueden ajustar al modelo de MichaelisMenten (M-M ) (ec. 4 y Fig. 9a). V0= Vmax.[S] (ec.4) KM + [S] Tambien se pueden representar los valores de V0 para dis tintas [S] con sus correspondientes recíprocos, 1/ V0 y 1/[S] y construir una representación gráfica de dobles recíprocas o de Lineweaver-Burk. Este gráfico permite identificar más facilmente los recíprocos de los parámetros cinéticos, KM y Vmax (Fig. 9b). 59 Vo 1 Vo (a) Vmax Vmax 2 (b) 1 Vmax KM [S] 1 KM 1 [S] Fig.9 (a) Curva de Michaelis–Menten de Vo en función de la concentración de S; (b) Gráfico de LineweaverBurk o de dobles recíprocas. A partir de estos gráficos se pueden determinar los parámetros cinéticos que caracterizan a una enzima: KM (constante de Michaelis) y Vmax (velocidad máxima), para un sustrato y en condiciones determinadas. V= Vmax.[S] KM + [S] KM: este valor corresponde a la concentración de sustrato necesaria para alcanzar una velocidad igual a la mitad de la Vmax y esta relacionada inversamente con la afinidad de la enzima por el sustrato Vmax: es la velocidad que se alcanza cuando la enzima está saturada con sustrato (a altas concentraciones de sustrato). GUÍA DE ESTUDIO 1-Concepto de catalizador. 2-Enzimas. Características. Sitio activo de una enzima: características. Cofactor. Coenzima. Holoenzima 3. Clasificación de enzimas. 4. Ubicación de las enzimas en la célula. 5. ¿Alteran las enzimas el equilibrio de la reacción? 6. ¿Cómo se mide la concentración de una enzima? 7. ¿Qué es la actividad específica de una enzima y en qué unidades se expresa? 8. Factores que influyen en una reacción catalizada por enzimas. 9. Función de Michaelis Menten. Representación gráfica. 10. Velocidad inicial. Velocidad máxima. Unidades. 11. ¿Porqué se debe trabajar a velocidad inicial? 12. KM. Unidades. ¿Cómo se determina? 13. Ecuación de Lineweaver-Burk. Representación gráfica. 14. Inhibición reversible e irreversible, concepto. Inhibidores competitivos y no competitivos, concepto. ¿Cómo se diferencian? ¿cómo son las curvas de las directas e inversas de la velocidad en función de la concentración de sustrato? 15. Reacciones bisustrato. 16. Enzimas alostéricas. Modelos. 60 PROBLEMAS 1-¿En las curvas de la Fig. 5, se ha llegado al equilibrio en todos los casos? ¿Cómo es la concentración de P en el equilibrio? Si la concentración inicial de sustrato es 0.006 M, por qué la concentración de P nunca llega a ese valor? 2-Observar la Fig 9 y ecuacion 2 y responder: ¿Qué parámetros cinéticos se pueden obtener del ajuste de V0 vs. [S]? ¿Cómo se relacionan estos parámetros con las constantes de velocidad? ¿Qué condiciones experimentales se deben cumplir para que el ajuste del modelo de M-M a los datos experimentales sea válido? 3. Explique el siguiente gráfico V Tiempo 4 . Grafique la inversa de velocidad en función de la inversa de la concentración de sustrato. Identifique en cada una de estas curvas KM y Vmáx. 5. ¿Qué relación existe entre KM y la afinidad de una enzima por un determinado sustrato? 6. ¿Cuándo la concentración de sustrato es igual a KM, cual es el valor de la velocidad inicial? (resuelva analíticamente) 7. ¿Qué relación exíste entre KM y la concentración de sustrato cuando la velocidad de la reacción catalizada por la enzima alcanza el 80% de la Vmáx? 8. Se ha aislado una enzima dimérica que contiene dos centros de activos idénticos. La unión del sustrato a un centro activo disminuye la afinidad por el sustrato del otro centro activo. ¿Qué modelo alostérico se ajusta mejor a esta cooperatividad negativa (concertado o secuencial)? 9. Para medir la actividad catalítica de la fosfatasa ácida de higado de rata, la preparación enzimática fue obtenida homogenizando 0.5 g de hígado en 10 ml de buffer. Se incubaron 0.2 ml de la preparación enzimática a pH 5 y 37ºC en presencia de Ca++ durante 6 min., en un volumen de 0.4 ml de sustrato. Para detener la reacción se agregó 3,4 ml de NaOH. Calcule los µmoles de producto formado por min. y por mg de tejido, sabiendo que la absorbancia fue 0.2, ε: 17500 M-1 cm-1. 10. Se incubaron 200 µl de una preparación enzimática (0,3 mg proteínas/ml) en presencia de 0,5 ml del sustrato correspondiente y de 0,5 ml de buffer pH 5, durante 15 min. a una temperatura constante de 37ºC. La reacción se detuvo por dilución del incubado hasta un volumen final de 10 ml con NaOH 0,1 M. La absorbancia de esta solución fue 0,215. Calcular los µmoles de producto formado por min, y por mg de proteínas. Solución testigo 2 µM → Abs. 0,15. 61 11. La trehalasa cataliza la hidrólisis de la trehalosa, en determinadas condiciones (pH 7, 30ºC). Una muestra de trehalasa presenta un valor de Vmáx de 1.5 µmol de glucosa formada por minuto por mg de proteína. ¿Cuál será el valor de Vmáx para la misma preparación enzimática, pero en presencia de 5 mmoles de trehalosa 6-fosfato el cual es un inhibidor competitivo con Ki = 2mmol/ml? 12. Pseudomonas aeruginosa cultivada en un medio de acetato posee una enzima que puede hidrolizar la propionamida. CH3CH2CONH2 + H2O -----------------> CH3CH2COOH + NH3 los estudios de velocidad inicial en los que se midió la producción de amoníaco a partir de la propionamida a pH 7 y 37oC demostraron que la urea inhibe esta reacción. Examinando los efectos de dos concentraciones diferentes de urea sobre un rango de concentraciones de propionamida se obtuvieron los siguientes resultados: [Propionamida] 5 6.7 10 20 50 VELOCIDAD INICIAL (µmoles de NH3 liberados/min/mg de proteína) SIN INHIBIDOR 160 194 263 400 576 CON INHIBIDOR (Urea) 1 mM 111 140 183 279 400 2mM 76 95 123 188 277 Determinar la KM para las diferentes condiciones. ¿Actúa la urea como un inhibidor competitivo o no competitivo? 13. A partir de los siguientes datos correspondientes auna reacción enzimática, determinar: a. El tipo de inhibición b. La KM VELOCIDAD INICIAL (µg de producto formado/hora) Concentración de S (mM) Sin inhibidor Con inhibidor 6 mM 2 139 88 3 179 121 4 213 149 10 313 257 15 370 313 14. Realice el protocolo de trabajo para determinar los parámetros cinéticos de la fosfatas ácida. Incluya en el protocolo el uso de un inhibidor de fosfatasa ácida como (tartrato de sodio) para evaluar el tipo de inhibición que ejerce sobre la enzima. Tenga en cuenta cual es la variable independiente y que factores se deberán mantener constantes. 62 TRABAJO PRACTICO Nº 6 CINÉTICA ENZIMÁTICA. (Práctico de Laboratorio) No olvidar concurrir con guardapolvo, gafas, guantes, cabello recogido y calzado cerrado. Los alumnos serán evaluados al final del TP (evaluación escrita) y durante el desarrollo de la clase (evaluación oral), sobre los contenidos que se encuentran en la guía de TP. PARTE PRÁCTICA: Estudio sobre la fosfatasa ácida de hígado. Reacción Enzimática La fosfatasa ácida de hígado cataliza la siguiente reacción: HO Paso nº 1 P Paso nº 2 O OH O O- OH Enzima O2N p-nitrofenilfosfato H+ + Enz + PO4-3 O2N OH- + H2O O2N p-nitrofenol p-nitrofenilfosfato + H2O p-nitrofenolato p-nitrofenol + PO43- I. CURVA DE TIEMPO OBJETIVOS - Medir la formación de producto en función del tiempo de incubación. - Determinar rango de tiempo (t) donde la variación de [P] vs. t sigue la ecuación de una recta. Es decir, se determinarán las condiciones óptimas de tiempo de incubación, que garanticen condiciones de V0. Note que este valor de “tiempo óptimo” de incubación será el que se aplique en el experimento para determinar los parámetros cinéticos. El sustrato, p-nitrofenilfosfato disódico, es una reactivo artificial que tiene la propiedad de ser hidrolizado por la fosfatasa ácida del hígado y de otros tejidos, por ello puede ser usado para estudiar dichas enzimas. La reacción se mide registrando la cantidad de producto formado, el p-nitrofenol, a distintos tiempos. Para esto, se incuba el sustrato en presencia de la enzima purificada o de homogenato de tejido conteniendo la enzima (Paso nº 1). Una vez transcurrido el tiempo establecido, la reacción se detiene por medio del agregado de una base fuerte (NaOH) la cual, además de inhibir la actividad enzimática debido al cambio de pH, induce una disociación total del p-nitrofenol a p-nitrofenolato (Paso nº 2). La concentración de esta última especie química se puede medir mediante espectrofotometría en un medio alcalino a 410 nm (Coeficiente de extinción molar: 17500) (ref. Methods in Enzimology ed. Colowick-Kaplan vol. XXXI). 63 MATERIALES Y MÉTODOS Preparación de la enzima: Homogeneizar (en homogeneizador a émbolo) 0.25 g de hígado en 15 ml de agua destilada. Dejar en baño de hielo durante 10 min. En esas condiciones hipo-osmóticas, se rompen los lisosomas que contienen la enzima, la cual queda soluble. Luego, llevar la suspensión a 30 ml con buffer acético- acetato de sodio, pH 5 y 0,2 M. La suspensión queda con una concentración de 1 mg de proteína por ml (1mg/ml). Sistema de incubación: Contiene cantidades variables de los siguientes componentes: Sustrato: p-nitrofenilfosfato, 25 mM. PM 371,12. Buffer: acido acético- acetato de sodio, pH 5, 0,1 M. Enzima: homogeneizado de hígado 1 mg de proteína / ml. Activador: Cl2Ca 11 mM. Inactivador: NaOH 0,1 M. Recomendaciones: Colocar en un tubo todos los componentes menos la enzima. La reacción comienza con el agregado de la enzima y la incubación a 37°C. Mezclar rápidamente y continuar la incubación durante un tiempo que se indicará en cada caso. La reacción se detiene por el agregado de 5 ml de NaOH 0,1 M. El álcali, por un lado inactiva a la enzima y por otro provee el medio alcalino necesario para que el producto (p-nitrofenol) desarrolle color. Es importante preparar una muestra denominada tiempo cero de incubación. Esta muestra contiene los mismos componentes que las muestras problema pero en ella la enzima se agrega después que el NaOH. Esta muestra se usa como blanco para el espectrofotómetro. PROTOCOLO: Muestra No sustrato µl Cl2Ca µl buffer µl enzima µl 1 100 (5 mM) 100 250 100 (0,1 prot) tiempo (min) mg 2 3 4 5 Blanco Incubar a 37°C. Al cabo del tiempo de incubación frenar la reacción agregando 5 ml de NaOH 0.1 M. En el blanco la enzima debe añadirse después del alcali. Leer la absorbancia a 410 nm usando el espectrofotómetro y calcular los µmoles de producto formado. 64 RESULTADOS Tubo No Absorbancia µmoles de P µmoles de P/min 1 2 3 4 5 Curva de Tiempo Conclusión: II. CURVA DE ENZIMA OBJETIVOS - Evaluar la variación de la velocidad de formación de producto en función de la concentración de la enzima. - Determinar el rango de [E] donde la variación de V vs. [E] responda a la ecuación de la recta. Es decir, se determinarán la concentración de enzima óptima (que permita alcanzar condiciones de V0) que será usada luego para determinar KM y Vmax. 65 PROTOCOLO: Muestra Sustrato 5mM (µl) Cl2Ca (µl) Buffer (µl) 1 100 (5 mM) 100 300 Suspensión de enzima Volumen (µl) Masa proteína (mg) 50 0,05 2 3 4 5 blanco Incubar a 37°C durante 10 minutos. Frenar la reacción agregando 5 ml de NaOH 0.1 M. En el blanco la enzima debe añadirse después del álcali. Leer la absorbancia a 410 nm en el espectrofotómetro y calcular los µmoles de producto formado. RESULTADOS Muestra No Absorbancia 1 2 3 4 5 Curva de Concentración de enzima Conclusión: µmoles de P µmoles de P/min 66 III. CURVA DE SATURACION OBJETIVO Determinar los valores de KM y Vmáx de la fosfatasa ácida de hígado. Determinar el tipo de inhibición que induce tartrato de sodio sobre la fosfatas ácida. Análisis de datos: a) Calcular las inversas de las concentraciones de sustrato indicadas en el Protocolo. b) Calcular las inversas de la masa de producto (µmoles) formado en cada muestra. c) Graficar 1/Vo en función de 1/[S]. d) Determinar los valores de KM y Vmáx. PROTOCOLO Disolución de Sustrato Muestra [S] (mM) Volúmen (µl) 2.5 50 1 CaCl2 (µl) Buffer (µl) Inhibidor o Buffer (µl) 100 200 50 Suspensión de enzima (µl) Tiempo de Incubación (min) ESTIMADO EN: TP6 ESTIMADO EN: TP6 2 3 4 5 blanco Incubar a 37°C según el tiempo determinado en TP 8. Luego agregar a cada tubo 5 ml de NaOH 0.1 M. En el blanco la enzima se añade después del alcali. Leer en el fotocolorímetro a 410 nm y calcular los µmoles de P formado. RESULTADOS Curva de Saturación Mues tra No 1 2 3 4 5 Absorbancia Sin Inhibidor µmoles de P Con Inhibidor µmoles de P/min Absorbancia µmoles de P µmoles de P/min 67 Curva de dobles recíprocas Muestra 1 2 3 4 5 CONCLUSIONES 1/[S] 1/V sin inhibidor 1/V con Inhibidor 68 TRABAJO PRÁCTICO Nº 7 CINÉTICA ENZIMÁTICA: Discusión del Trabajo Científico OBJETIVOS Exponer el trabajo cientifico de manera clara y prolija. Responder individualmente a las preguntas formuladas por el docente. GUÍA DE ESTUDIO. Jung G.Y. and Stephanopoulos G. (2004). A functional protein chip for pathway optimization and in vitro metabolic engineering. Science 304: 428-431. 1. Escriba la cita bibliográfica completa (busque en bases de datos tales como PubMed). 2. Optimización de vías metabólicas: a) ¿cuál es su interés?, b)¿dónde reside su dificultad?, ¿cómo puede encararse?. 3. ¿Qué son los microarreglos?, ¿en qué contexto se comenzaron a desarrollar?. 4. ¿Cuál es el objetivo del presente trabajo? 5. ¿Cuál es la estrategia experimental elegida? (palabras clave: fusión RNA-proteína, polilisina, DNA, hibridización). 6. ¿Cuáles son las dos reacciones acopladas que se usan para poner apunto el sistema experimental?. ¿Cuál es la utilidad del DNA marcado con fluoresceína?. ¿Cómo se detecta el producto de estas reacciones acopladas?. Describa los experimentos realizados para poner a punto la técnica (Figs. 1 y 2). 7. ¿Qué es la trehalosa y cuál es su importancia? 8. ¿Cuál es la vía metabólica a cuyo estudio se aplica la técnica desarrollada? 9. Describa la Fig. 3. 10.¿Cuáles son las conclusiones alcanzadas respecto al funcionamiento de esta vía metabólica? ¿Es posible generalizar estas conclusiones a otras vías metabólicas?. BIBLIOGRAFIA . Stryer L, Berg, JM y Tymoczko, JL. Bioquímica, Ed. Reverté SA, 5ºEd. España 2003. . Lehninger Principles of Biochemistry. David L. Nelson & Michael M. Cox. Worth Publishers. 3ºEd. NY. USA. 2000. . Harper H.A, Manual de química fisiológica. Ed. El manual moderno 1980 . Neilands J.B., Stumpf P.K., Principios de enzimología. Ed Aguilar. 1967. . Morris J., Fisicoquímica para biólogos. . Bezkorovainy, A, Rafelson M.E. Concise Biochemistry. Ed. Marcel Dekker, New York, 1996. . Horton R.H, Moran L.A., Ochs R.S., Rawn J.D., Scrimgeour K.G. Pentice Hall, Hispanoamericana, SA. México, 1995. - Methods Enzimology ed. Colowick-Kaplan Vol. XXXI. 69 TRABAJO PRACTICO Nº 8 MECANISMOS DE TRANSDUCCIÓN DE ENERGÍA. (Practico de Laboratorio) Los problemas deberán ser resueltos por los alumnos ANTES de concurrir a la clase. En caso de necesitar aclarar dudas, los docentes estrán disponibles en sus horarios de consulta, en la cátedra. Los alumnos serán evaluados al final del TP (evaluación escrita), sobre los contenidos que se encuentran en la guía de TP . El tema MECANISMOS DE TRANSDUCCIÓN DE ENERGÍA se desarrollará en dos clases de trabajos prácticos: Trabajo Práctico N°8 Puesta en común de los problemas previamente resueltos de manera individual por el alumno y se distribuirá un TRABAJO CIENTIFICO entre los alumnos. Trabajo Práctico Nº 9 los alumnos realizarán una EXPOSICIÓN ORAL y responderán preguntas sobre el contenido del trabajo. También se realizará la puesta en común de problemas previamente resueltos de manera individual por los alumnos. OBJETIVOS - Reconocer la aplicabilidad de las leyes de la Física y la Físico-Química a los sistemas biológicos. - Analizar fenómenos biológicos desde un punto de vista termodinámico. Fotosíntesis, respiración y motores moleculares como ejemplos. TEMAS PARA REPASAR Energía libre de Gibbs; reacciones de óxido reducción; transferencia de energía en la fotosíntesis; cadena respiratoria; fuerza protón motriz; motores moleculares. LA ENERGÍA ASOCIADA A LAS REACCIONES QUÍMICAS EN LA CÉLULA Una reacción química puede tener lugar espontáneamente solo si ∆G, el cambio de energía libre, es negativo (reacción exergónica). Las reacciones químicas que ocurren en una célula en general se encuentran fuera del equilibrio, aA + bB cC + dD Donde las letras en minúscula indican la cantidad de moles de cada molécula que participan en la reacción. La expresión general que describe el cambio de energía libre asociado a una reacción química lejos del equilibrio se calcula basándose en el cambio de energía libre estándar (∆Gº): donde ∆G = ∆Gº + RT ln Q (ec.1) ∆Gº = - RT ln Keq (ec.2) Q = [C]c[D]d / [A]a[B]b Dado que: 70 y que la constante de equilibrio en condiciones estándares, Keq, se define como una relación de concentraciones de reactantes y productos en el equilibrio a 25°C y 1 atm.: Keq = [Ceq]c.[Deq]d / [Aeq]a.[Beq]b entonces ∆Gº = - RT ln ([Ceq]c[Deq]d / [Aeq]a[Beq]b) (ec.3) reemplazando la ec.1 en la ec3, se deduce que en el equilibrio ∆G=0 (ec4): 0=∆Gº + RT ln ([Ceq]c[Deq]d / [Aeq]a[Beq]b) (ec.4) Ejercicio 1 - Condiciones estándar frente a la vida real. La aldolasa cataliza la siguiente reacción en la glucólisis: aldolasa Fructosa 1,6-bifosfato dihidroxiacetona fosfato + gliceraldehído 3-fosfato El ∆G 0’ para esta reacción es de + 5,7 kcal.mol-1, mientras que el ∆G en la célula es -0,3 kcal.mol-1. Calcular la relación entre reactantes y productos en el equilibrio y en condiciones intracelulares. Utilizando los resultados obtenidos explicar: ¿cómo puede resultar esta reacción endergónica en condiciones estándar y exergónica en condiciones intracelulares? TRANSPORTE La difusión de iones y moléculas sigue las leyes de la termodinámica Desde el traslado de iones o moléculas a través de la membrana plasmática hasta los motores moleculares dentro de una célula, el movimiento de iones o moléculas requiere ser termodinámicamente espontáneo (∆G<0) o tener una reacción acoplada que provea la energía necesaria para que ocurra, por ejemplo, la hidrólisis de ATP. Una molécula en solución tiende a moverse de una región de alta concentración a una de baja concentración dado que esto produce un cambio favorable de energía libre (∆G < 0). En el caso de una molécula que puede moverse libremente a través de la membrana plasmática sólo se debe considerar la diferencia de concentración a ambos lados de la membrana. Debido a que los estados inicial y final se corresponden con el transporte de soluto, podemos denominarlos como las concentraciones del mismo en los compartimentos de origen y destino (Corigen y Cdestino , respectivamente): 𝐶𝐶𝑓𝑓𝑓𝑓𝑓𝑓𝑓𝑓𝑓𝑓 𝐶𝐶𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑 ∆𝐺𝐺 = 𝑅𝑅𝑅𝑅 ln � � = 𝑅𝑅𝑅𝑅 ln � � 𝐶𝐶𝑖𝑖𝑖𝑖𝑖𝑖𝑖𝑖𝑖𝑖𝑖𝑖𝑖𝑖 𝐶𝐶𝑜𝑜𝑜𝑜𝑜𝑜𝑜𝑜𝑜𝑜𝑜𝑜 (ec.5) Note que este ∆G es un potencial químico (∆µ) dado que mide la fuerza impulsora para la transferencia de materia. Cuando la especie química transportada es un ión (cualquier átomo o molécula con carga) hay otras consideraciones que se deben tener en cuenta tal como se muestra en las siguientes secciones. 71 Tanto las células como todas las organelas rodeadas por una membrana (mitocondrias, cloroplastos, lisosomas) se pueden considerar como compartimientos capaces de acumular ciertas moléculas, siendo delimitados por una membrana semipermeable. Las características de permeabilidad de esta membrana dependerán de la composición de la membrana y la presencia o no de canales y transportadores de iones en ella. De particular importancia es la capacidad que tienen estos compartimientos de acumular (o no) ciertas moléculas cargadas a ambos lados de una membrana y de esta manera crear un potencial de energía a través de la membrana (Fig. 1) que puede ser utilizado para la realización de trabajo. Fig. 1. Ilustración de la diferencia de carga a ambos lados de la membrana plasmática de una neurona. Figura adaptada de Wikipedia. Movimiento de iones a través de una membrana El potencial al que nos referíamos más arriba está determinado por el potencial eléctrico de membrana (la diferencia de potencial entre el lado de afuera y adentro de la célula, ∆Vm = Vadentro - Vafuera) y el gradiente de concentración de cada ion. Por convención, en el campo de la electrofsiología se considera que Vafuera = 0. La creacion del ∆Vm es muy importante para el funcionamiento celular, principalmente en la señalización eléctrica. La energía libre asociada a la transferencia de carga puede expresarse en función del potencial eléctrico ( V) mediante donde es la carga y ∆𝐺𝐺 = 𝑧𝑧𝑧𝑧∆𝑉𝑉𝑚𝑚 (ec.6) es la constante de Faraday. Entonces, el cambio de energía libre (∆G) para transportar una especie cargada depende no sólo de su concentración a ambos lados de la membrana (Cafuera/Cadentro) sino también del potencial eléctrico o ∆Vm transmembrana y de la carga de la especie química (note que los iones serán repelidos por las cargas del mismo signo). La suma de los términos de concentraciones y eléctricos se denomina potencial electroquímico. El cambio de energía libre viene entonces dado por: ∆𝐺𝐺 = 𝑅𝑅𝑅𝑅 ln � 𝐶𝐶𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑 � + 𝑧𝑧𝑧𝑧∆𝑉𝑉𝑚𝑚 𝐶𝐶𝑜𝑜𝑜𝑜𝑜𝑜𝑜𝑜𝑜𝑜𝑜𝑜 (ec.7) donde z es la carga eléctrica de la especie transportada, ∆Vm es el potencial transmembrana en voltios y F es la constante de Faraday (23,062 kcal V-1 mol-1 = 96.5 kJ V-1 mol-1). Los subíndices “destino” y “origen” se refieren al sentido en el que se mueve la especie química transportada. NOTA: 72 En el campo de la electrofisiología razonamos de la siguiente manera: “dada la definición de ∆Vm=Vadentro -Vafuera (ver más arriba), si el movimiento de la especie química cargada es de adentro hacia afuera, se deberá considerar un valor de -∆Vm (cambiar de signo el dato de ∆Vm) al aplicar la ec.7”. En el campo de la biofísica hablamos simplemente en términos de ∆V=Vfinal -Vinicial o ∆V=Vdestino – Vorigen. Ejercicio 2 – Considerando una membrana plasmática con un ∆Vm = -60 mV y un soluto pequeño sin carga (es decir que la puede atravesar libremente), cuya concentración es de 1 mM afuera de la célula y 10 mM adentro de la célula, calcular la energía libre para su transporte de afuera hacia adentro. Ahora suponiendo que el soluto es el ion K+, vuelva a calcular la energía libre para el mismo proceso. Explicar en cada caso si el soluto puede cruzar la membrana plasmática en la dirección planteada. Es importante notar que si pensamos en el transporte de una molécula a través de la membrana mediante una proteína (un canal o transportador), si ∆G es negativo el transporte será pasivo (se realizará sin gasto de energía), mientras que si es positivo el transporte es un proceso activo que requiere un suministro acoplado de energía libre, por ejemplo, mediante la hidrólisis de ATP. Un ejemplo de transporte y generación de gradiente electroquímico ocurre en las membranas de las neuronas. En las neuronas el transportador Na+K+ ATPasa expulsa a 3 Na+ hacia fuera de la célula por cada 2 K+ que acumula dentro de la célula. Este proceso de transporte es activo. El resultado es una carga neta negativa dentro de la célula comparado con el medio extracelular (la membrana está polarizada (∆Vm ≈ -60)). Cuando llega la señal de conducción del impulso nervioso (trabajo) se abren los canales y los iones fluyen libremente, ingresando a la célula Na+ y saliendo al espacio extracelular Cl-, despolarizando la membrana y llevando al ∆Vm cerca de 0. En esta dirección, el flujo de iones es pasivo, es decir espontáneo (sin gasto de energía) y se encuentra determinada por el potencial electroquímico de los iones a través de la membrana. En el equilibrio (ΔG = 0), no habrá flujo neto de moléculas, es decir que las contribuciones química y eléctrica se igualan. Entonces, si ∆G=0 −𝑅𝑅𝑅𝑅 ln � 𝐶𝐶𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎 � = 𝑧𝑧𝑧𝑧∆𝑉𝑉𝑚𝑚 𝐶𝐶𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎 En este caso ∆Vm corresponde a un potencial de equilibrio (∆Veq) y despejando obtenemos: ∆𝑉𝑉𝑒𝑒𝑒𝑒 = − � [𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎] 𝑅𝑅𝑅𝑅 � ln � � [𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎] 𝑧𝑧𝑧𝑧 (ec8) Esta ecuación es conocida como potencial de equilibrio de Nernst, y nos permite calcular el potencial que será establecido a través de una membrana si conocemos la carga y el gradiente de concentración de un ion (este potencial se representa con frecuencia con una “E”). En la fisiología se usa el potencial de Nernst para determinar el potencial de membrana al que un ion de interés (por ejemplo, el K+) se encontrará en equilibrio (no habrá movimiento neto de iones a través de la membrana), por lo que se le llama potencial de equilibrio de ese ion. El potencial de equilibrio difiere para cada especie iónica porque los gradientes de concentración son diferentes para cada uno. En el equilibrio, los gradientes químicos (∆µ) y eléctrico (∆V) son iguales y de signos opuestos. Por lo que se puede ver que, cuando el sistema está en equilibrio, la tendencia de un ion 73 difusible a moverse a través de la membrana, a favor de su gradiente de concentración, se balancea con la fuerza eléctrica que lo atrae a la dirección contraria. Distribución de los principales iones a través de una membrana de axón gigante de calamar. Datos tomados de The physiology of excitable cell. David I. Adley 4°Ed. Ejercicio 3 - Calcular el valor del potencial eléctrico de membrana que debería haber para que no haya movimiento neto de K+ a través de la membrana cuando la concentración del ion dentro de la célula es de 140 mM y afuera de la célula es de 5 mM. R= -89 mV. Equilibrio Gibbs-Donnan El equilibrio de Gibbs-Donnan o equilibrio Donnan es la base para los cambios eléctricos que ocurren a través de la membrana de muchas células, como las musculares y las nerviosas. Este tipo de equilibrio surge cuando existen moléculas cargadas que no pueden alcanzar su equilibrio de difusión porque no pueden atravesar la membrana. El flujo de moléculas e iones a través de las membranas de todas las células es regulado por el equilibrio Donnan. Las células contienen coloides aniónicos (por lo general proteínas y fosfatos orgánicos) que no pueden atravesar la membrana. Debido a esto, hay una alta concentración de aniones no difusibles en el interior de las células. Esto hace que haya más iones en el interior que en el exterior de las células. Afuera Na+ 67 mM Cl- 67 mM Adentro Na+ 133 mM Cl- 33 mM A- 100 mM Figura 2. Equilibrio Donnan. Iones de Na+, Cl-, y un polímero impermeable aniónico (A-), separados por una membrana semipermeable. Situación en el equilibrio. El potencial eléctrico en el equilibrio Donnan puede expresarse para los aniones o cationes, es decir: 74 ∆𝑉𝑉𝑒𝑒𝑒𝑒 .𝑐𝑐𝑐𝑐𝑐𝑐𝑐𝑐 ó𝑛𝑛 = ∆𝑉𝑉𝑒𝑒𝑒𝑒 .𝑎𝑎𝑎𝑎 𝑖𝑖ó𝑛𝑛 Por lo que, si utilizamos la siguiente expresión para despejar la relación de concentraciones de los iones que pueden atravesar la membrana, [𝐴𝐴𝐴𝐴𝐴𝐴𝐴𝐴𝐴𝐴𝐴𝐴] 𝑅𝑅𝑅𝑅 ∆𝑉𝑉𝑒𝑒𝑒𝑒 = − � � ln � � [𝐴𝐴𝐴𝐴𝐴𝐴𝐴𝐴𝐴𝐴𝐴𝐴𝐴𝐴] 𝑧𝑧𝑧𝑧 llegamos a: [𝑐𝑐𝑐𝑐𝑐𝑐𝑐𝑐ó𝑛𝑛]𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎 [𝑎𝑎𝑎𝑎𝑎𝑎ó𝑛𝑛]𝑎𝑎𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑 = [𝑎𝑎𝑎𝑎𝑎𝑎ó𝑛𝑛]𝑎𝑎𝑓𝑓𝑓𝑓𝑓𝑓𝑓𝑓𝑓𝑓 [𝑐𝑐𝑐𝑐𝑐𝑐𝑐𝑐ó𝑛𝑛]𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎 De esta manera, a partir de la siguiente expresión es posible predecir las concentraciones de iones en el equilibrio Donnan a partir de modificaciones en las condiciones iniciales: [𝑐𝑐𝑐𝑐𝑐𝑐𝑐𝑐ó𝑛𝑛]𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎 × [𝑎𝑎𝑎𝑎𝑎𝑎ó𝑛𝑛]𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎𝑎 = [𝑐𝑐𝑐𝑐𝑐𝑐𝑐𝑐ó𝑛𝑛]𝑎𝑎𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑 × [𝑎𝑎𝑎𝑎𝑎𝑎ó𝑛𝑛]𝑎𝑎𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑 Ejercicio 4- Completar la siguiente tabla Estado inicial Afuera: 9mM Na+, 9mM Cl- Equilibrio Afuera: X mM Na+, XmM Cl- Osmolaridad Afuera: 12 mOsM Adentro: 9mM Na+, 9mM Proteina- Adentro: XmM Na+, 9mM Proteina- Adentro: 24mOsM Notar que el equilibrio Donnan no se corresponde con el equilibrio osmótico (la cantidad total de osmolitos no es la misma de cada lado). ¿Cuál es la consecuencia de ésto? Al haber tantos iones dentro de la célula, el agua tenderá a entrar a la célula, hinchándola y finalmente haciéndola explotar. ¿Por qué no explotan las células? La respuesta es la bomba de sodio (la Na+K+ATPasa) que se encuentra en la membrana. Esta bomba trabaja utilizando el acoplamiento al ATP, que le da la energía libre necesaria a la reacción para poder bombear Na+ permanentemente hacia afuera de la célula, balanceando el efecto Donnan. Es este balance el que permite que las células mantengan su volumen normal. Resumiendo, el equilibrio Donnan a- Se desarrolla en ausencia de energía metabólica y procesos de transporte activo. b- El ΔVm generado es de aproximadamente -20mV. c- El ΔVm es el resultado de una muy pequeña separación de cargas. Hay un pequeño exceso de Cl- de un lado y un pequeño exceso de Na+ del otro. d- Los iones están en equilibrio termodinámico, no hay flujo neto de iones. e- Se genera un gran desbalance osmótico, que no es tolerado en células vivas. 75 Ejercicio 5 - Una solución 0.10M de palmitato de sodio se separa de un volumen igual de solución 0.20M de cloruro de sodio mediante una membrana permeable a los iones sodio y cloruro, pero no a los iones palmitato. Calcule las concentraciones finales y el potencial de Nernst de 298 K, suponiendo comportamiento ideal. Ejercicio 6 - Dos soluciones de igual volumen están separadas por una membrana permeable a los iones K+ y Cl- pero no a los iones P-. Las concentraciones iniciales se indican a continuación: [K+] = 0.05 M [K+] = 0.15 M [Cl-] = 0.05 M [P-] = 0.15 M Calcule las concentraciones a ambos lados de la membrana, una vez que se establece el equilibrio. ¿Qué lado de la membrana tiene carga positiva? Calcule el potencial de Nernst a través de la membrana si la temperatura es de 370C. TEORÍA QUIMIOOSMÓTICA Y FOSFORILACIÓN OXIDATIVA En 1961, Peter Mitchell propuso la hipótesis quimiosmótica en donde el transporte de electrones y la síntesis de ATP están acoplados mediante un gradiente de protones a través de la membrana interna mitocondrial. Explicó que la oxidación sucesiva de los sustratos en la cadena respiratoria por los Complejos I (NADH deshidrogenasa), III (citocromo c reductasa) y IV (citocromo c oxidasa) está acoplada a la translocación hacia afuera de protones a través de la membrana interna mitocondrial creando una fuerza proton motriz (f.p.m.) compuesta principalmente por una parte eléctrica (potencial de membrana, ΔVm), y una parte química (ΔpH=pHc -pHmatriz) f.p.m. (mV)= ΔVm −2.3(RT/z.F) ΔpH (ec9) De esta ecuación, donde z = +1, se puede observar cómo un incremento de pH puede generar una fuerza considerable. Esto implica una energía libre que es aprovechada para la síntesis de ATP por la ATP sintetasa. El cambio de energía libre para la síntesis de ATP (∆GP) se denomina potencial de fosforilación. Ejercicio 7- Estimar la fuerza protón motriz generada si ΔVm = -140 mV (signo afuera positivo por convensión) y el pH afuera de la mitocondria es 1.4 unidades menor que adentro 5. Rta: f.p.m. = -226 mV. Ejercicio 8- Suponiendo que la energia libre generada por la fuerza protón motriz estimada es de ∆G = 21.8 kJ por mol de H+ estime si esta fuerza aportaría suficiente energía para lograr una relación de [ATP]/([ADP]+[Pi])=10. 5 En este caso los protones se mueven hacia afuera de la matriz mitocondrial por lo cual se calcula ΔV=Vafuera -Vmatriz). Por otra parte, la diferencia en la concentración de protones también se calcula como Δ[H+]=[H+]afuera-[H+]matriz, pero como pH= -log[H+], al calcular ΔpH, el orden de los términos se invierte y ΔpH=[pHmatriz –pHafuera] resultando en este caso ΔpH =x-(x-1.4); ∆pH=1.4). 76 Ejercicio 9- Para una fuerza protón-motriz de 0,2 V (negativa en el lado de la matriz). ¿Cuál es el valor máximo del cociente [ATP]/ [ADP] [Pi] compatible con la síntesis de ATP? Calcular el valor de este cociente de tres maneras, suponiendo que el número de protones translocados por cada ATP formado es dos, tres, y cuatro respectivamente. La temperatura es de 25ºC. MOVIMIENTO DE ÁCIDOS Y BASES A TRAVÉS DE LA MEMBRANA Muchas moléculas de interés, por ejemplo, una variedad de fármacos, son ácidos o bases débiles. Una molécula sin carga es en general más liposoluble y puede difundir por la membrana plasmática. En contraste, una molécula ionizada por lo general no puede penetrar la membrana plasmática debido a su baja solubilidad en lípidos. Por lo tanto, la distribución transmembrana de electrolitos débiles es determinada por su pKa y el gradiente de pH a través de la membrana. El pKa es el pH en el cual la mitad de las moléculas del electrolito se encuentran en su estado ionizado. log 𝐹𝐹𝐹𝐹𝐹𝐹𝐹𝐹𝐹𝐹 𝑝𝑝𝑝𝑝𝑝𝑝𝑝𝑝𝑝𝑝𝑝𝑝𝑝𝑝𝑝𝑝𝑝𝑝 = 𝑝𝑝𝑝𝑝𝑎𝑎 − 𝑝𝑝𝑝𝑝 𝐹𝐹𝐹𝐹𝐹𝐹𝐹𝐹𝐹𝐹 𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑𝑑 (ec.10) Recordar que Ka es la constante de disociación ácida, por lo que hay que tener en cuenta si la molécula es una base o un ácido. [𝐴𝐴− ][𝐻𝐻 +]2 Acido: entonces 𝐾𝐾𝑎𝑎 = [𝐻𝐻2 𝐴𝐴] Base: entonces 𝐾𝐾𝑎𝑎 = [𝐵𝐵][𝐻𝐻 + ] [𝐵𝐵𝐻𝐻 +] Por otro lado, es útil recordar la relación entre ∆G y la constante de equilibrio de una reacción: ∆G = -RT ln K Ejercicio 10 - El pK de un ácido es una medida de su potencial de transferencia de grupos protónicos. a) Establecer una relación ∆G 0’ y pK. b) ¿Cuál es el ∆G 0’para la ionización del ácido acético, sabiendo que su pK es de 4,8? Ejercicio 11- Se está desarrollando un fármaco nuevo que es un ácido débil (pKa = 4.4) y que sería suministrado por vía oral, por lo que debe determinarse si puede ser absorbido a nivel del estómago. Calcular la relación este los estados protonado (no ionizado) y no protonado (ionizado) de la droga a cada lado de la barrera mucosa lipídica teniendo en cuenta el esquema representado abajo. ¿Cómo sería el caso si el fármaco fuese una base débil (pKa = 4,4; pKb =9,6)? 77 HA - A + H+ Plasma + pH = 7.4 Barrera mucosa lipídica Jugo gástrico HA - pH = 1.4 + A + H+ Figura adaptada de Goodman & Gilman's. The Pharmacological Basis of Therapeutics. BIBLIOGRAFIA -Goodman, L. S., Gilman, A., Brunton, L. L., Lazo, J. S. & Parker, K. L. Goodman & Gilman's the pharmacological basis of therapeutics, 11th edn. McGraw-Hill (2005) -Alberts, B., et al. Molecular Biology of the Cell, Third edition edn. Garland Publishing (1994). -Kandel, E. R., Schwartz, J. H. & Jessell, T. M. Essentials of Neural Science and Behavior. Appleton & Lange (1995). -Berg, J. M., Tymoczko, J. L. & Stryer, L. Biochemistry, 5th edition. Ed.2002. 78 TRABAJO PRACTICO Nº 9 MECANISMOS DE TRANSDUCCIÓN DE ENERGÍA. (Práctico de Resolución de Problemas). MOTORES MOLECULARES Las células eucariotas tienen tres familias de motores moleculares: miosina, kinesinas y dineínas, capaces de moverse por el citoesqueleto, contribuyendo así al movimiento de la célula como un todo y al transporte de proteínas, vesículas y organelas dentro de la célula. El funcionamiento de estos motores depende de cambios conformacionales asociados a la unión e hidrólisis de ATP. Una excepción notable son las bacterias flageladas. En este caso los flagelos rotan utilizando la energía almacenada por un gradiente de protones a través de la membrana. El mecanismo que acopla el transporte transmembrana de protones a la rotación macromolecular es aparentemente similar al usado por la ATP sintasa. Ejercicio 1 - Las helicasas tales como la PcrA pueden utilizar una hebra sencilla de ADN como guía. En cada ciclo la helicasa se desplaza una base en el sentido 3’-5’. Teniendo en cuenta que la PcrA en presencia de un molde formado por una hebra sencilla de ADN puede hidrolizar ATP con una velocidad de 50 moléculas por segundo (se hidroliza una molécula por ciclo) y que la longitud de una base de ADN es 3,4 Å. ¿Cómo es esta velocidad comparada con la velocidad de la quinesina que es de 6400 Å por segundo? ¿A qué se puede deber la diferencia de velocidad entre estos dos motores moleculares? Ejercicio 2 - Cuando a las bacterias tales como E. coli se las mantiene en ayunas durante un período de tiempo suficiente, dejan de moverse. Sin embargo, cuando estas bacterias inmóviles se colocan en un medio ácido nuevamente comienzan a moverse. Aportar una explicación teniendo en cuenta el mecanismo de movimiento del flagelo de una bacteria. POTENCIAL REDOX Y LA POSIBILIDAD TERMODINÁMICA DE LA TRANSFERENCIA DE ELECTRONES Nota sobre la nomenclatura: por cuestiones históricas, los potenciales eléctricos a veces se denominan con la letra V y a veces con la letra E. Sin embargo, para nuestros fines utilizaremos las dos letras como equivalentes. Los electrones que son derivados por ejemplo a la cadena respiratoria son transferidos desde una molécula en su forma reducida (Red1) hacia la forma oxidada (Ox2) de otra molécula, resultando en la oxidación de la primera (Ox1) y la reducción de la segunda (Red2). Podemos escribir las dos hemirreacciones que tienen lugar como: Red1 Ox1 + n e- (Eox') Ox2 + n e- Red2 (Ered') Sumando las dos hemirreacciones, la ecuación global es: Red1 + Ox2 ↔ Ox1 + Red2 La dirección del flujo de electrones está dada principalmente por la suma de los potenciales redox, E, de cada una de las especies involucradas. ∆E' = Ered' + Eox' 79 El potencial redox, o potencial normal, se determina a una temperatura y presión dadas (25 °C, 1 bar) y se define como el potencial normal E° para un sistema que conste de un electrodo de hidrógeno y del electrodo problema. Por convención, todos los potenciales normales son potenciales de reducción. Note que las tablas informan los potenciales de reducción. En consecuencia, para la hemireacción de oxidación, corresponde aplicar el valor absoluto del potencial redox tomado de la tabla, pero con el signo opuesto. Una reacción redox es una reacción de transferencia de carga, donde el incremento de energía libre estándar ∆Gº' está relacionado con el incremento del potencial de reducción ∆E' mediante la expresión: ∆Gº' = - nF∆E' donde n es el número de electrones transferidos, F es el constante de Faraday (23,06 kcal mol-1 V-1 = 96,48 kJ mol-1 V-1), ∆E' se expresa en voltios y ∆Gº' en kilocalorías o kilojulios por mol. La diferencia entre los potenciales redox de dos especies determina si la reacción es termodinámicamente favorable, es decir, si ∆G < 0, donde ∆G es el cambio en energía libre de Gibbs, una medida cuantitativa de la fuerza impulsora neta a temperatura y presión constantes. Ejercicio 3 - Calcular el incremento de energía libre de la reacción de reducción del piruvato por el NADH que cataliza la enzima lactato deshidrogenasa, teniendo en cuenta los potenciales de reducción estándar de las hemirreacciones que se muestran a continuación. (consultar el libro Stryer como guía) Piruvato + NADH + H+ lactato + NAD+ Hemireacciones de reducción (según las tablas): piruvato NAD+ lactato E= -0,19 V NADH + H+ E= -0,32 V El cambio de energía libre de una reacción depende de la presión, la temperatura, la composición, el campo eléctrico, el estado de reducción, etc. Ahora, si la concentración de reactantes y productos no se encuentran a concentraciones estándares y estos además se están oxidando o reduciendo, debemos combinar el cambio en ) con la energía libre la energía libre de reacción debido a la composición química ( asociada a la transferencia de electrones (∆G = -nF∆E). De esta manera podemos obtener una diferencia de potencial que nos permite calcular la fuerza electromotriz, y que se llama ecuación de Nernst: 𝑅𝑅𝑅𝑅 ∆𝐸𝐸 = ∆𝐸𝐸° − 𝑛𝑛𝑛𝑛 ln 𝑄𝑄 donde n es el número de electrones intercambiados en el proceso electroquímico, F es la constante de Faraday (96.485 C mol -1), R es la constante de los gases (8,315 C V K -1 mol -1), T es la temperatura absoluta (298,15 K), ∆E° es la fuerza electromotriz bajo condiciones estándar, es decir, la diferencia entre los potenciales de reducción estándar de las dos hemiceldas involucradas en el proceso, y Q es el cociente entre las (concentraciones de los productos) / (concentraciones de reactivos), cada uno elevado a su coeficiente estequiométrico. 80 Potencial redox (mV) Mayor tendencia a donar electrones e- Mayor tendencia a aceptar electrones Figura 1. Representación de Nernst de algunas parejas redox y la dirección principal de flujo de electrones. Los valores graficados fueron obtenidos a partir de la ecuación de Nernst. Notar que el valor del potencial redox depende de la relación entre las concentraciones de productos y reactivos (Q, en la Ecuación de Nerst), que en este caso se hace referencia al estado oxidativo (si están predominantemente en estado oxidado o reducido) de los compuestos involucrados. La pareja NADP+/NADPH posee el potencial de reducción más negativo 6, es decir posee la menor tendencia a la reducción, de manera que puede proveer los electrones necesarios para las otras parejas redox. Los cuadrados coloreados corresponden a potenciales redox fisiológicamente relevantes. Los potenciales de reducción estándar (∆E°) utilizados para producir este gráfico son -320 mV para el par NADPH/NADP+, -160 mV para el superóxido y 1,349 V para H2O2 . En el eje y se muestra el % de la forma oxidada = ([oxidado]/total) *100. El análisis se realizó a 25°C y pH= 7,2. Dado que la condición estándar corresponde a concentraciones 1M de reactantes y de productos, los ∆E° se pueden leer el eje x, al interpolar en las curvas el valor de 50% de y. Cuando ∆E = 0, ∆G = 0 y no hay flujo neto de electrones. Dado que el pH en una organela dada puede no ser igual a 7, la ecuación de Nernst puede modificarse para ser utilizada a otros pH. La ecuación de Nernst a 37°C (310 K), usando 2,303 como factor de conversión del ln al logaritmo en base 10, es [𝑅𝑅𝑅𝑅𝑅𝑅1] 61,51 𝑚𝑚𝑚𝑚 � ∗ log ) 𝐸𝐸 = 𝐸𝐸° + �(𝑝𝑝𝐻𝐻𝑚𝑚 − 7) ∗ (−61,51 𝑚𝑚𝑚𝑚)� − (� [𝑂𝑂𝑂𝑂1] 𝑛𝑛 (Esta ecuación se aplica a una sola especie que se reduce o se oxida). La Figura 1 ilustra el comportamiento de la ecuación de arriba para varios pares redox. Como ejemplo, podemos determinar la probabilidad termodinámica de la transferencia de electrones (n = 2) desde NADPH hacia O2, en la matriz mitocondrial a pH 7,2, calculando el ∆G. Considerando una relación de NADPH/NADP+ = 0,7/0,3 (NADP+ = 30%, cuadrado negro) y de O.2-/O2 = 0,8/0,2 (O2 = 20%, cuadrado verde), podemos escribir las hemirreacciones correspondientes: 6 NAD+ ===== NADH + H+ E= -0,32 V, es una hemi-reacción con tendencia espontánea a desplazase en la dirección opuesta a la que está planteada (es decir hacia la oxidación), de modo que la especie reducida (NADH) tiende a oxidarse y por lo tanto funciona como un buen reductor. 81 NADP+ + 2e- + H+NADPH E° = - 0,320 V 2 O2 + 2e- 2 O.2- E° = -0,160 V Analizando los potenciales de reducción se puede determinar cuál será la especie que se reduzca y cuál la que se oxide. El NADPH tiene un potencial de reducción más negativo que el O.2- por lo que el NADPH tendrá tendencia a oxidarse frente al oxígeno y éste a reducirse. Por lo tanto, la reacción global es: NADPH + 2 O2 NADP+ + H+ + 2 O.2Y el potencial estándar para la reacción global es: ∆E° = 0,32 +(– 0,16) = 0,16 V (Recordar que para hacer este cálculo le cambiamos el signo al potencial estándar de la especie que se oxida). Entonces, utilizando la ecuación 2, se obtienen los valores de potencial a las composiciones del problema: ENADPH/NADP+=-320 mV+�(7,2-7)*(-61,51 mV)� -( � [0,7] 61,51 mV � * log )= -343,6 mV [0,3] 2 [0,8] 61,51 mV E𝑂𝑂2/𝑂𝑂2−=-160 mV+�(7,2-7)*(-61,51 mV)� -( � � * log )= -209,33 mV [0,2] 1 Entonces, ∆E = E NADPH/NADP+ + E O2/O2- = 343,6mV + (– 209,33mV) = 134,27 mV ∆G = -n F ∆E = -2 x 0,0964 kJ/mV x 134,27 mV = -25,89 kJ La reacción de transferencia de electrones desde el NADPH hacia el O2 será entonces termodinámicamente favorable para esa composición y ese pH. Ejercicio 4 Es posible determinar el lugar exacto donde actúa un inhibidor de la cadena respiratoria gracias a la técnica de punto y corte. Britton Chance diseño elegantes métodos espectroscópicos para determinar el cociente entre las formas oxidada y reducida de cada uno de los transportadores. Este cálculo es posible porque cada uno de los estados tiene un espectro de absorción característico, tal y como se ilustra en el gráfico adjunto para el caso de citocromo c. Si usted se encuentra en posesión de un inhibidor y descubre que al añadirlo a mitocondrias que respiran, los transportadores localizados entre el NADH y QH2 se encuentran más reducidos y los transportadores localizados entre el fitocromo c y el O2 se encuentran más oxidados ¿cómo actúa el inhibidor? 82 OTROS EJERCICIOS 1- Las concentraciones de ATP, ADP y Pi difieren según el tipo de célula, consecuentemente la liberación de energía libre para la hidrólisis de ATP será también diferente según el tipo de célula. Utilizando los datos de la tabla siguiente, calcular ∆G para la hidrólisis de ATP en las células de músculo, hígado y cerebro. Teniendo en cuenta que el ∆G 0’ para esta reacción es de - 7,3 kcal.mol-1, ADP (mM) Pi (mM) Hígado 3,5 1,8 5,0 Músculo 8,0 0,9 8,0 Cerebro 2,6 0,7 2,7 b) ¿Cómo se puede explicar este efecto? 8.4 8.2 34 8.0 7.8 33 7.6 32 7.4 31 30 -1 35 -∆G (kcal.mol ) a) ¿Cómo afecta el descenso de [Mg2+] al ∆G para la hidrólisis de ATP? 36 -1 El gráfico siguiente muestra como el ∆G0 para la hidrólisis de ATP varía en función de la concentración de Mg2+. Nota: pMg=log (1/[ Mg2+ ]). -∆G (kj.mol ) 2- ATP (mM) 7.2 2 3 4 5 6 7 8 pMg2 3- Supongamos que la transferencia de energía entre dos moléculas de clorofila a distantes entre sí 10 Å tiene lugar en 10 picosegundos. Supongamos que la distancia se incrementa hasta 20 Å manteniendo constantes el resto de los factores. ¿Cuánto tardará en ocurrir la transferencia de energía? 4- A su máxima velocidad una molécula de quinesina se desplaza con una velocidad de 6400 Å por segundo. Teniendo en cuenta que el tamaño de la región motriz del dímero de quinesina es de 80 Å, calcular su velocidad en unidades de su tamaño por segundo. Según esta relación ¿cuál sería la velocidad correspondiente de un automóvil que tuviera una longitud de 3 metros? 5- Un único dominio motor de la miosina puede desarrollar una fuerza de aproximadamente 4 piconewtons (4pN) ¿Cuántas veces puede levantar su peso un dominio motor de miosina? Tener en cuenta que 1 newton = 1 kg fuerza (1kg masa m.s-2). Considerar que la masa molecular del dominio motor es de 100 kDa. 83 6- Considérese la actividad de una única molécula de quinesina que transporta una vesícula a lo largo de un microtúbulo. La fuerza necesaria para arrastrar una partícula esférica de radio a con una velocidad ν en un medio de viscosidad η es: F= 6 π η a x ν Supongamos que una esfera de 2 μm de diámetro se transporta con una velocidad de 0,6 μm. s-1 en un medio acuoso con una viscosidad de η= 0.01 g.cm-1. s-1. a) ¿Cuánta es la fuerza desarrollada por la quinesina? Expresar el valor en dinas (1 dina= 1 g.cm. s-2) b) ¿Cuánto trabajo realiza en un segundo? Expresar el valor en ergios (1 ergio=1 dina cm). c) Un motor de quinesina hidroliza aproximadamente 80 moléculas de ATP por segundo. ¿Cuánta es la energía asociada a esta hidrólisis de ATP expresada en ergios? Comparar este valor con el trabajo realizado. 84 DISCUSIÓN DEL TRABAJO CIENTÍFICO OBJETIVOS Exponer el trabajo científico de manera clara y prolija. Responder individualmente a las preguntas formuladas por el docente. GUÍA DE ESTUDIO. Trabajo científico: Yasuda, R., Noji, H., Kinosita, K., & Yoshida M. (1998). F1-ATPase Is a Highly Efficient Molecular Motor that Rotates with Discrete Steps. Cell. 93: 1117–1124. 1. ¿Cúal es la función del ATP sintetasa? ¿Cómo es su estructura? ¿Cuál es la función de cada una de las subunidades? 2. ¿Qué fenómeno se observa si la parte F1 se encuentra en ausencia de la parte F0 en un medio que contiene ATP? 3. ¿Cómo se logra experimentalmente observar la rotación γ del F1-ATPase? 4. Explicar brevemente los resultados que se observa en la Figura 2a y 2b. 5. A cuál de los experimentos que se realizaron en los Trabajos Prácticos de la materia, se asemeja el experimento del gráfico 2b. 85 TRABAJO PRACTICO Nº 10 FOTOSÍNTESIS. (Práctico de Resolución de Problemas) Los problemas y la guía de estudio deberán ser resueltos por los alumnos antes de concurrir a la clase. En caso de necesitar aclarar dudas, los docentes estarán disponibles en sus horarios de consulta en la cátedra. Los alumnos serán evaluados al final del TP (evaluación escrita) sobre los contenidos que se encuentran en la guía de TP. Deberán concurrir con guardapolvo, gafas, guantes, cabello recogido y calzado cerrado. El tema FOTOSÍNTESIS se desarrollará en dos clases de trabajos prácticos: Trabajo Práctico N°10 Puesta en común de los problemas previamente resueltos de manera individual por el alumno. Trabajo Práctico Nº 11 Elaboración del protocolo y desarrollo de Trabajo de laboratorio. Puesta en común sobre dificultades, resultados y conclusiones de esta actividad. OBJETIVOS - Valorar la importancia de la fotosíntesis como proceso necesario para la vida en el planeta - Conocer los procesos bioquímicos y termodinámicos involucrados en el proceso. TEMAS PARA REPASAR - Termodinámica de las reacciones redox. INTRODUCCIÓN La fotosíntesis es un proceso que consiste en la transducción de energía lumínica en energía química que lleva a la síntesis de sustancias orgánicas a partir de dióxido de carbono y agua. Este proceso puede tener lugar tanto en células vegetales como en bacterias verde-azuladas. Los organismos capaces de fotosintetizar se denominan fotoautótrofos (del griego: foto = luz, auto = sí mismo, trofos = nutriente). A través de la fotosíntesis estos organismos son capaces de utilizar la luz solar como fuente de energía para la sintesis de carbohidratos en primera instancia, y luego a partir de éstos se sintetizarán todos los otros compuestos orgánicos que conforman el cuerpo del organismo. La ecuación global de la fotosíntesis es : Luz 6 CO2 + 6 H2O -----------------> C6H12O6 + 6O2 Puede resolverse en dos etapas caracterizadas por el tipo de reacciones que se realizan en cada una. Éstas son: • Reacciones dependientes de la luz (o reacciones claras): la energía luminosa es captada por los pigmentos y transformada en ATP y NADPH. Simultáneamente se libera oxígeno molecular proveniente de la ruptura de moléculas de agua (Fotólisis del agua ó reacción de Hill). • Reacciones de fijación del carbono (o de fase oscura): llamada así porque no es necesaria la luz para llevarse a cabo; aquí el ATP y el NADPH se emplean como fuentes de energía y poder reductor, respectivamente, y se produce la reducción del CO2 y la síntesis de glucosa. 86 Fotólisis del agua: La fotólisis es la ruptura de enlaces químicos inducida por la energía radiante. El estudio del transporte electrónico inducido por la luz comienza con el descubrimiento de Robert Hill: "La iluminación de cloroplastos en presencia de aceptores electrónicos artificiales provocaba el desprendimiento de oxígeno y la simultánea reducción del aceptor”. Además, demostró que el CO2 no era necesario para la liberación de O2. Esta reacción se conoce como reacción de Hill: Luz 2 H2O + 2A ----------------> 2AH2 + O2 Donde A es el aceptor artificial de electrones. En la fotosíntesis normal el aceptor es el NADP+ pero en la reacción de Hill se utiliza un aceptor artificial por ejemplo, un colorante que al reducirse se decolora. Integración de fotosistemas I y II en el cloroplasto: Esquema en “Z” El “esquema en Z” (Fig. 1) es una representación gráfica que muestra el transporte de electrones transferidos desde el agua hacia el NADP+ en la fotosíntesis. La posición de cada transportador de electrones en escala vertical (Fig. 1, eje y), refleja su potencial de reducción estandar. Recordar que el potencial de reducción estandar es una medida de la capacidad que tiene una molécula para aceptar electrones; en general, un valor más negativo de potencial redox indica que esa molecula es un "mal" receptor de electrones y, en contrapartida, es un "buen" dador de electrones. Fig. 1: Esquema en Z. 87 Para elevar la energía de los electrones derivados del agua al nivel energético requerido para reducir NADP+ a NADPH, los electrones deben ser impulsados por fotones absorbidos por el Fotosistema I (P700) y por el Fotosistema II (P680). Luego de la excitación, estos fotosistemas (P680* y P700*) pasan a ser muy buenos dadores de electrones, por lo que los electrones de alta energía fluyen corriente abajo a través de una cadena transportadora. El proceso de captación y transferencia de la luz es el siguiente: • La luz excita al complejo antena (clorofila o pigmento accesorio), elevando un electrón a un nivel energético superior. • La energía se transfiere por Resonancia a una molécula de clorofila vecina, hasta ser captada por la clorofila del par especial, excitándola. • La clorofila excitada del centro de reacción pasa un electrón a un aceptor electrónico primario. • El hueco electrónico en el centro de reacción se cubre con un electrón de un dador electrónico. • La absorción de un fotón ha producido una separación de carga en el centro de reacción. De esta forma la excitación por la luz produce una separación de carga e inicia una cadena de oxidoreducción. Los protones generados durante la fotólisis del agua y durante el transporte de electrones a través del complejo citocromo b6f contribuyen al gradiente de protones que es central para la formación de ATP. La flecha punteada (Fig. 1) indica la vía cíclica de la transferencia de electrones, donde sólo está involucrado P700; los electrones regresan por una vía cíclica al P700, en lugar de reducir NADP+ a NADPH. Ordenar las siguientes sustancias según su tendencia creciente a ceder electrones: a) clorofila del fotosistema I, b) plastoquinona, c) ferredoxina, d) agua, e) Feofitina (pheo). Comparción entre las cadenas trasportadoras de electrones involucradas tanto en la fotofosforilación como en la fosforilación oxidativa, en cloroplastos y mitocondras, respectivamente. Las cianobacterias utilizan citocromo b6f, citocromo c y plastoquinonas para la fosforilación oxidativa y la fotofosforilación. En la fotofosforilación los electrones fluyen desde el agua al NADP+. En la fosforilación oxidativa los electrones fluyen desde el NADH al O2. Ambos procesos son acompañados por el movimiento de protones a través de la membrana (Fig. 2). Calcule la energia libre asociada al flujo de electrones desde el agua al NADP+ en la Fotofosforilacion y desde el NADH al O2 en la Fosforilación oxidativa. Justifique los resultados. 88 Fig.2 Esquema comparativo entre las cadenas trasportadoras de electrones de la fotofosforilacion (cloroplastos) y de la fosforilacion oxidativa (mitocondrias). Explique las diferencias entre los cloroplastos y las mitocondrias con respecto a la síntesis de ATP, basándose en la Fig. 2. GUIA DE ESTUDIO 1.Concepto de fotosíntesis. 2.Concepto de reacciones dependientes de la luz y de fijación del carbono. 3.Formas de captación y transferencia de Energía. 4.Fuerza electrón-motriz. 5.Fuerza protón motriz 6.Potencial redox. 7.Dadores y aceptores de electrones. 8.Diferencia entre mitocondrias y cloroplastos. 9.Importancia de la reacción de Hill. 10. Diferencias entre fosforilación a nivel de sustrato, fosforilación oxidativa y fotofosforilación. 89 PROBLEMAS 1. Interprete el siguiente gráfico en el que se observan varios factores que afectan la velocidad de la fotosíntesis: * Velocidad de fotosíntesis Efecto de la intensidad de luz a: 1 1. 25oC y CO2 0,4% 2. 15oC y CO2 0,4% 3. 25oC y CO2 0,01% 2 3 Intensidad de la luz incidente ¿Qué indica la zona marcada con *? 2. Explique las causas de las interconversiones entre RuDp (ribulosa 1,5-bisfosfato) y PGA (·3fosfoglicerato) en experimentos de fotosíntesis, cuando varían la intensidad de iluminación y la concentración de CO2. Oscuridad Concentración Luz 1% CO2 0,003% CO2 RUDP PGA RUDP Tiempo (min) PGA Tiempo (min) 3. El aparato fotosintético del alga verdeazulada contiene grandes cantidades de ficoeritrina y ficocianina, además de la clorofila A. La ficoeritrina tiene una absorción máxima entre 480 y 680 nm; la ficocianina a 620 nm. Sugerir la misión de estos pigmentos. 4. Ordenar las siguientes sustancia según su tendencia creciente a aceptar electrones: a) clorofila del fotosistema II, b) P680*, c) NADP+, d) plastocianina. 5. Calcular ∆Go´ para la reducción del NADP+ por Ferrodoxina. 6. Calcular la fuerza electrón-motriz expresada en voltios, registrada por un electrodo sumergido en una solución que contiene las siguientes mezclas de NAD+ y NADH a pH=7 y 25oC, con referencia a una semicelda de 0,00V: a) NAD+ 1 mM y NADH 10 mM b) NAD+ 1 mM y NADH 1 mM c) NAD+ 10 mM y NADH 1 mM 90 7. Observe y analice el siguiente gráfico. Indique el tipo de fotofosforilación y justifique su respuesta. - - - µmoles de oxígeno liberado ___ µmoles de fosfato esterificado Tiempo 8. Observe y analice el siguiente gráfico. Indique el tipo de fotofosforilación y justifique su respuesta. - - - µmoles de oxígeno liberado ___ µmoles de fosfato esterificado Tiempo 9. Suponiendo que se necesitan 8 cuantos de luz para la incorporación de una molécula de CO2 en moléculas de glúcidos por medio de la fotosíntesis, calcule la eficiencia termodinámica en condiciones estándar, para la síntesis de 1 mol de glucosa, si la longitud de onda de la luz utilizada es: a) 400 nm y b) 750 nm. (Energía necesaria para la síntesis de glucosa = 686 Kcal). 10. Cuantificación de carotenoides, clorofilas y feofitinas. Una manera de valorar el nivel de estrés en los vegetales es medir la disminución de los niveles de los distintos pigmentos presentes en las plantas. Preparación: homogeneizar 100 mg de material vegetal en 10 mL de etanol al 96% V/V. Luego separar el sobrenadante y en él medir la Absorbancia a 470, 665 y 649 nm para la cuantificación de carotenoides, clorofilas a y b (Carot, Cl-a, Cl-b) respectivamente, y a 666 y 654 nm para la cuantificación de feofitinas a y b (Feof-a, Feof-b) según el método de Wintermans y De Mots (1965). Se extrajeron muestras de material vegetal de las sierras de Córdoba de tres puntos distintos, como se muestra en el siguiente mapa Se midió la absorbancia de las distintas muestras a 649 nm, resultando: Sitios Punto 1 Absorbancia 0,15 Punto 2 0,25 Punto 3 0,20 91 Teniendo en cuenta que la absortividad de la clorofila b es de 44,65 ml.mg-1.cm-1, calcular el contenido de clorofila en las distintas muestras de plantas y elabore una hipótesis sobre el origen de estas diferencias encontradas en el nivel del pigmento. Qué experimento adicional debería hacer para aceptar o rechazar la hipótesis planteada?. Para resolver los problemas. DATOS DE POTENCIAL REDOX: Agua: +0,82 V Ferredoxina: -0,4 V P680: +0,95 V Feofitina (Pheo): -0.75 V Plastocianina: +0.13V NADP+: -0,324 V P700: +0,4 V P680*: -0,95 V Plastoquinona: +0,1 V NAD+: -0.32V BIBLIOGRAFÍA - Lehninger Principles of Biochemistry. David L. Nelson & Michael M. Cox. Worth Publishers. 3ºEd. NY. USA. 2000. - Stryer L, Berg, JM y Tymoczko, JL. Bioquímica, Ed. Reverté SA, 5ºEd. España 2003. - Hall D.O., Rao K. Fotosíntesis. Ed. Omega, Barcelona, 1977. - Tribe M y Whitaker P. Cloroplastos y motocondrias. Ed.Omega, Barcelona, 1977. - Andreo C., Vallejos R. Fotosíntesis. Serie Biología, monografía no 30 OEA, 1984. - Molt A.S. et al. 1951, Plant Physiology, 26, 164-175. - Torres H.M., Carminatti H. Y Cardini E. Bioquímica General Ed. El Ateneo, Bs.As. 1983. - Harper H.A, Manual de química fisiológica. Ed. El manual moderno 1980 - Morris J., Fisicoquímica para biólogos. - Bezkorovainy, A, Rafelson M.E. Concise Biochemistry. Ed. Marcel Dekker, New York, 1996. - Horton R.H, Moran L.A., Ochs R.S., Rawn J.D., Scrimgeour K.G. Pentice Hall, Hispanoamericana, SA. Mexico, 1999. 92 TRABAJO PRACTICO Nº 11 FOTOSÍNTESIS. (Práctico de Laboratorio) En caso de necesitar aclarar dudas, los docentes estarán disponibles en sus horarios de consulta en la cátedra. Los alumnos serán evaluados al final del TP (evaluación escrita) y durante el desarrollo de la experiencia práctica (evaluación oral), sobre los contenidos que se encuentran en la guía de TP. Deberán concurrir con guardapolvo, gafas, guantes, cabello recogido y calzado cerrado. OBJETIVOS Valorar la importancia de la fotosíntesis como proceso necesario para la vida en el planeta Conocer los procesos bioquímicos y termodinámicos involucrados en el proceso. Comprobar algunos aspectos de la fotosíntesis por medio de experimentos. TEMAS PARA REPASAR - Termodinámica de las reacciones redox. INTRODUCCIÓN La vida en la tierra depende de la energía derivada del sol, en este contexto la fotosíntesis es uno de los procesos más importantes para la vida de todos los organismos de nuestro planeta ya que es un proceso biológico que puede emplear esta energía solar para la sintesis de carbohidratos, a patir de dioxido de carbono y agua, liberando oxigeno. La energía almacenada en las moléculas sintetizada es usada luego como poder energético celular en la misma planta y además como recurso para el desarrollo de todas las formas de vida, donde gran parte de los recursos energéticos del planeta son el resultado de la actividad fotosintética del presente (Biomasa y Oxigeno) o del pasado (combustibles fósiles). El concepto de fotosíntesis fue forjado a lo largo del tiempo, como fruto de observaciones, generación de hipotesis e investigaciones, en un intento de comprender fenomenos naturales. En la antigua Grecia, Aristóteles propuso que la luz solar estaba directamente relacionada con el desarrollo del color verde de las hojas de las plantas, pero esta idea no trascendió en su época. También Empédocles propuso que las hojas de las plantas asimilaban el aire pero no fue apoyado por Aristóteles, ya que su discípulo Teofrasto pensaba que todo el sustento de las plantas provenía de la tierra. De hecho, estas ideas no volvieron a ser recuperadas hasta el siglo XVII. En 1648, Van Helmont desarrolló el primer experimento biológico relacionado a la nutrición o crecimiento vegetal. El experimento consistía en determinar si el crecimiento ocurría a expensas del suelo en que la planta crecía. Para ello, plantó un Sauce joven en una maceta que contenía suelo previamente pesado. Luego de regarlo con agua durante cinco años determinó que el suelo no era el único elemento que sustentaba la alimentación vegetal, porque durante todo ese tiempo el peso del suelo se mantuvo aproximadamente constante, a pesar del notable incremento de peso de la planta (Fig. 1). 93 Fig. 1: Experinecia del Sauce de J.B.Van Helmont (1648). Si el arbol no obtenia su masa desde el suelo, ¿de dónde se nutrían las plantas? Van Helmont consideraba al aire y al agua como los elementos básicos del Universo, y concluyó que era el agua quien desempeñaba un papel crucial en el crecimiento vegetal. A pesar de que Van Helmont fue tambien quien propuso la existencia del dióxido de carbono luego de sus experimentos quemando carbón, no lo relacionó con la causa del aumento de masa del vegetal, no estaba aún la idea de que las plantas incorporaran “aire”. Recién en 1727, Stephen Hales, después de que se conocieran los estomas, hizo mención a las antiguas hipótesis, y afirmó que el aire que penetraba por las hojas en las plantas era empleado por ellas como fuente de alimento y observó que el agua absorbida por las plantas a través de las raíces era expulsada de nuevo en forma de vapor por las hojas. Joseph Priestley alrededor de 1774 demostró la producción de oxígeno por los vegetales y propuso que este proceso era inverso al de la respiración animal. Llegó a esta conclusión luego de realizar un experimento en el que introduciendo en una cúpula cerrada, una planta y un ratón, los dos lograban sobrevivir, en tanto cuando colocaba al ratón en la cúpula, sin la planta, éste moría (Fig. 2). Lo mismo ocurría si se disponia en la cúpula una vela encendida. A pesar de ser el descubridor del oxígeno en otros experimentos, no llamó al gas producido por las plantas como Oxígeno sino que hablo del “aire deflogisticado”. Fig. 2: Resumen de las experiencias de J. Priestley en donde propuso la existencia del aire deflogisticado. Casi dos siglos después de los experimentos de Van Helmont, en 1778, Jan Ingenhousz observó, aparte de que las plantas también respiran, que las plantas sólo producen oxígeno en presencia de luz y no en la noche y le permitió acuñar el término FOTOSÍNTESIS. También concluyó que la fotosíntesis sólo podía ser llevada a cabo por las partes verdes de la planta (Fig. 3). 94 Fig. 3: Experiencias de J Ingenhousz. Observó los vegetales iluminados con luz solar liberan aire cargado con oxígeno. Hasta ese momento, se sabía que las plantas producían oxígeno y alimentos. En 1782 Jean Senebier diseñó un experimento que le permitió aceptar la tesis de Ingenhousz acerca de que la luz era esencial para la producción de oxígeno y además lo llevó a sospechar que el dióxido de carbono estaba relacionado con este proceso. La idea que las plantas necesitaban dióxido de carbono sólo fue comprobada doce años después en 1804 por Nicolas Theodore de Saussure (1804), quien comprobó cuidadosamente que el aumento de peso de la planta está relacionado con el consumo de CO2 y de agua. En 1932, Robert Hill concentró sus experimentos en la fotosíntesis y en la creación de oxígeno en los cloroplastos, lo que condujo al descubrimiento de la “Reacción de Hill”. En 1937 logró demostrar que los cloroplastos son capaces de producir oxígeno en ausencia de dióxido de carbono, uno de los primeros indicios de que la fuente de electrones en las reacciones de la fase clara de la fotosíntesis es el agua. En su experimento in vitro empleó un aceptor de electrones artificial, el 2,6 diclorofenolindofenol quien recibe los electrones a la altura entre el FII y el FI, entre las plastoquinonas. Varios años más tarde, Severo Ochoa demostró que el NADP+ es el aceptor biológico de electrones en los cloroplastos, según la siguiente ecuación: Luz 2H2O + 2NADP+ --------------- 2NADPH + 2H+ + O2 Estos son sólo algunos de los Investigadores que se interesaron y algunos de los experimentos que permitieron arribar al concepto de fotosíntesis que conocemos hoy que nos permite entender como es el flujo de la energía en los seres vivos de nuestro planeta. A continuación se proponen 2 experiencias prácticas que permiten estudiar diferentes aspectos de la fotosíntesis. En una de ellas se reproduce la reacción de Hill. Como aceptor artificial de electrones se utilizará el 2,6 diclorofenolindofenol, el cuál presenta color azul en su estado oxidado (máxima absorsión a 600 nm) y es incoloro en el estado reducido. En otra experiencia se utilizará como modelo vegetal al alga Elodea (Elodea sp). En el caso de las algas, éstas aprovechan el dióxido de carbono que se encuentra disuelto en el agua. Es sabido que el dióxido de carbono participa en la siguiente reacción: H2O(l) + CO2(g) ⇔ H2CO3(aq) ⇔ HCO3-(aq) + H+(aq) ⇔ CO3=(aq) + H+(aq) 95 El consumo de dióxido de carbono por parte del alga desplazaría la reacción hacia los reactivos, causando un aumento em el pH del sistema. Se utilizará el indicador de pH Rojo Fenol para monitorear la reacción, el cual presenta color amarillo en su forma protonada (pH ácido) y color rojo cuando se encuentra desprotonado (pH básico), siendo su intervalo de viraje pH = 6.6 - 8. Un indicador ácido-base o de pH es una molecula cuyas formas moleculares protonada y desprotonada presentan distinto color. Cuando el indicador es añadido a una disolución, el color del indicador dependerá de la forma molecular que se vea favorecida en el pH de la solución. Por ejemplo, Rojo Fenol. EXPERIENCIA Nº 1: Fotosíntesis y luz. OBJETIVOS: 1- Demostrar que durante el proceso fotosintético se libera O2 . 2- Demostrar que durante el proceso fotosintetico se consume CO2. MATERIALES: Material vegetal: un trozo de Elodea (Elodea sp). Solución de rojo de fenol. Papel de aluminio. Tubos de ensayo, tapones de goma atravesados por un tubo de 0,5 cm de diámetro, pipetas de 0,2 ml. Fuente de luz blanca. Soportes y gradillas. PROTOCOLO 1. Preparar 2 tubos de la siguiente manera:Introducir en cada tubo de ensayo un trozo de Elodea que ocupe al menos la mitad del largo del tubo. 2. Diluir la solución de Rojo Fenol provista con agua de la canilla hasta llegar a 50 ml. 3. Colocar 10 ml de solución de rojo de fenol diluida en dos tubos de ensayo e insuflar aire con una pipeta hasta que la solución vire de color rojo a color amarillo (Ver Fig. 4). 4. Disponer los elementos en la manera indicada en la Fig. 5, teniendo en cuenta que desde el tubo de ensayo hasta la pipeta graduada el sistema debe estar lleno de solución. 5. Marcar el nivel del líquido contenido en la pipeta. 6. Conectar la fuente de luz a 10 cm de distancia y observar la base del tallo de Elodea. 7. Exponer un tubo a la luz (Fig. 5) y cubrir el otro con papel de aluminio (oscuridad). 8. Observar los tubos y controlar el pH de la solución a los 45 min de iniciada la experiencia. Experiencias usando Rojo Fenol Fig .4 Rojo CO2 Amarillo Fig. 5 96 Discusión: Para discutir sus resultados tenga en cuenta las siguientes preguntas. a) ¿Qué efecto produce el desprendimiento de oxígeno en el sistema? b) ¿Qué función cumple el Rojo Fenol? c) ¿Por qué el color vira a amarillo cuando se insufla dióxido de carbono? d) ¿Cuál es la fuente de dióxido de carbono? e) ¿Cambió el pH? f) ¿Qué sucedería en el sistema si modificara la distancia entre la planta y la lámpara? g) ¿Que sucede en el sistema en ausencia de luz? Conclusiones EXPERIENCIA Nº 2: Reacción de Hill. OBJETIVO: Demostrar el poder reductor derivado del proceso de fotosíntesis. MATERIALES: Material vegetal: hojas de espinaca (Spinacea oleracea) (50 g) Solución de NaCl 0,035 M. Solución de NaCl 0,35 M. Solución de 2,6-diclorofenolindofenol 2,5 x 10-4 M Licuadora o mortero Atención: tanto el material vegetal como las soluciones que toman contacto con él deben mantenerse en frío (0 - 4 oC) durante todo el proceso. PROTOCOLO 1- Homogeneizar 50 g de material vegetal en 100 ml de NaCl 0,35 M. Filtrar por gasa doble, recoger en un vaso y mantener en baño de hielo. Tomar 30 ml del homogeneizado y centrifugar a 1000 rpm durante 5 min. Decantar y eliminar el precipitado de restos celulares. Centrifugar el sobrenadante a 4000 rpm durante 10 min. Separar el sobrenadante y resuspender el precipitado de tilacoides en NaCl 0,035 M (2.5 ml). Mantener en baño de hielo. 2- Preparar 2 tubos de la siguiente manera: Colocar 50 µl de la suspensión de tilacoides y agregar 5 ml de agua y 1 ml de 2,6 diclorofenolindofenol. Disponer los tubos de manera tal que sólo uno quede expuesto a la luz durante 20 min, de acuerdo con la Fig. 6. 97 Fig. 6 2,6 di-Cl-fenolindofenol Discusión: Para discutir sus resultados tenga en cuenta las siguientes preguntas. a) ¿Porqué utiliza NaCl 0.35 M para realizar el homogeneizado? b) ¿Porqué utiliza NaCl 0.035 M para resuspender los cloroplastos? c) ¿Qué función cumple el 2,6-diclorofenolindofenol? d) ¿Cómo podría demostrar la producción de oxígeno? e) ¿Cómo podría mejorar esta experiencia? Conclusiones BIBLIOGRAFÍA . Lehninger Principles of Biochemistry. David L. Nelson & Michael M. Cox. Worth Publishers. 3ºEd. NY. USA. 2000. . Stryer L, Berg, JM y Tymoczko, JL. Bioquímica, Ed. Reverté SA, 5ºEd. España 2003. . Hall D.O., Rao K. Fotosíntesis. Ed. Omega, Barcelona, 1977. . Tribe M y Whitaker P. Cloroplastos y motocondrias. Ed.Omega, Barcelona, 1977. . Andreo C., Vallejos R. Fotosíntesis. Serie Biología, monografía no 30 OEA, 1984. . Molt A.S. et al. 1951, Plant Physiology, 26, 164-175. . Torres H.M., Carminatti H. Y Cardini E. Bioquímica General Ed. El Ateneo, Bs.As. 1983. . Harper H.A, Manual de química fisiológica. Ed. El manual moderno 1980 . Morris J., Fisicoquímica para biólogos. . Bezkorovainy, A, Rafelson M.E. Concise Biochemistry. Ed. Marcel Dekker, New York, 1996. . Horton R.H, Moran L.A., Ochs R.S., Rawn J.D., Scrimgeour K.G. Pentice Hall, Hispanoamericana, SA. Mexico, 1999. 98 El ácido ribonucleico y la escalera de Jacob Salvador Dali