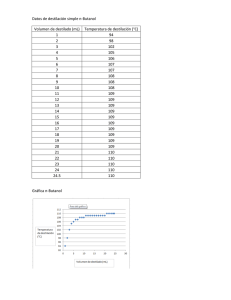
Determinación del grado de alcohol por medio de un densímetro mediante una destilación de vino. Jostin Vargas* Gabriel Corrales Escuela de Química, Universidad Nacional, Sede Región Brunca, Pérez Zeledón, Costa Rica. Palabras clave: Destilación, etanol, ebullición, destilado, porcentaje, densímetro. RESUMEN: En esta práctica se realizó una destilación de vino, la cual se obtuvo con ayuda de un sistema de destilación simple, destilando el vino se obtuvo etanolagua las cuales fueron separadas por una diferencia de puntos de ebullición, obteniendo un destilado y calculando el porcentaje de etanol obtenido por medio de un densímetro. INTRODUCCIÓN Una de las operaciones básicas de separación con mayor importancia es la destilación. Generalmente se basa en una operación doble provocando la ebullición de un líquido la cual genera una fase de vapor con distinta composición al estar en contacto con la fase liquida la cual se condensa de forma parcial. Mediante esta acción doble que se produce de evaporación y condensación, la fase de vapor se enriquece con los componentes más volátiles de la mezcla liquida por lo tanto la fase liquida se va a enriquecer de los componentes con menor volatilidad. (1) Al hablar de destilación existen varios tipos o formas de llevar a cabo una destilación, podemos llevar a cabo una destilación simple, (1) esta es el tipo más básico de destilación, en este tipo el ciclo de evaporacióncondensación se realiza una sola vez, se utiliza para llevar a cabo una destilación con puntos de ebullición inferiores a 150 ·c o también separar mezclas con componentes con diferente punto de ebullición al menos de 60-80·c. También se puede implementar la destilación fraccionada esta técnica permite realizar varias destilaciones sencillas en una sola operación de manera continua, es algo similar a la destilación simple, pero se ha colocado entre el matraz y la cabeza de destilación una columna que puede rellenarse de tipos de sustancias inertes, la eficacia de esta técnica se basa en el número de platos teóricos que tenga la columna lo cual nos ayuda a obtener una mejor separación. (2) Figura 1. Sistema de destilación simple Figura 2. Sistema de destilación fraccionada. Los principios de separación de la destilación incluyen la transferencia de calor y masa, equilibrio termodinámico la cual tiene como criterio la temperatura de ebullición de la sustancia más volátil. Al llevarse a cabo el proceso de separación encontramos 3 fases, la fase 1 vemos la formación de dos fases en la 2 la transferencia de calor y masa entre las dos fases y por último (la 3) vemos la separación de estas dos fases. Para realizar la purificación de este tipo de mezclas debe de ser tratada mediante unas operaciones de separación no muy convencionales como la destilación azeotrópica. (3) La separación de mezclas es la parte más importante en la química y por esto se utiliza el método de destilación, sin embargo, esta operación pierde efectividad a la hora de separar mezclas las cuales forman azeótropo lo cual significa que poseen valores de volatilidad relativamente cerca una de otra. Para poder separar esto se necesita adoptar técnicas distintas o tecnologías como lo es la destilación por cambios de presión azeotrópica para lograr la separación. (4) La formación de azeótropos se presentan una amplia variedad de procesos químicos, como es en este caso en la producción de etanol, lo más común para eliminar los componentes en un punto de azeótropo es la destilación extractiva. (11) Los objetivos de esta practica van a ser conocer y realizar una técnica de separación, ver las utilidades del destilado como un método utilizado de manera general de separación, conocer la utilidad de un densímetro y aprender a utilizarlo. SECCIÓN EXPERIMENTAL Se adicionaron 100 ml de una bebida alcohólica, 50 ml de agua destilada y unas perlas de vidrio a un matraz de destilación. Se armó un equipo de destilación simple donde se mantuvo en calentamiento lento pero continuo. Se recogió el destilado en un balón aforado de 100 ml, para luego aforar y homogenizar con agua destilada. Se transfirió el contenido del balón a una probeta de 100 ml y se procedió a colocar el densímetro para realizar una lectura con este. Se realizó una comparación entre la determinación del porcentaje de alcohol con el densímetro. RESULTADOS Y DISCUSIÓN Cuadro 1. Temperatura inicial del destilado. Temperatura primeras gotas (destilar) Dirección 78˚ 0,9860 La temperatura ideal para obtener una separación de los líquidos en este caso el agua y el etanol por medio de la destilación simple es de 78,3 ·C por lo cual al tener esta temperatura vamos a destilar la mayor cantidad de etanol posible como es nuestro caso en el cuadro 1. (9) Sin embargo, el mantener una temperatura tan exacta y estable es casi imposible, teniendo dos componentes que hiervan a una diferencia de 60·c a 80·C en ese marguen vamos a destilar una cantidad razonable de etanol y n de agua. (2) Por lo cual las temperaturas que obtuvimos comparando con las ideales en las referencias (9 y 2) nuestros datos obtenidos en la práctica nos dan un buen comienzo a la hora de comenzar a destilar el vino, obteniendo una cantidad razonable de destilado con mayor densidad de etanol que de agua. Cuadro 2. Volúmenes recogidos y densidad de las fracciones obtenidas en destilación simple. Volumen Probeta vacía Probeta Densidad (por diferencia) 20 ml 61,34 g 79,16 (20 ml) 0,892 50 ml 141,66 g 188,76 (50 ml) 0,930 150 ml 183,00 g 329,00 (150 ml) 0,973 Por medio de comparación entre sistemas de destilación simple y fraccionaria logramos visualizar que la energía con la que llegan los vapores desde el balón fluyendo por el tubo condensador hasta la salida, son muy difíciles de controlar a diferencia de una destilación fraccionada que esta llega a densidades mas cercanas a las densidades teóricas por lo tanto también se llega a una alta pureza de los componentes destilados. (10) El tipo de técnica utilizada en esta practica la destilación simple nos permitió determinar cantidades de volúmenes obtenidos en la destilación, ya pesados los diferentes volúmenes logramos obtener diferentes densidades las cuales son datos muy buenos. Claramente para obtener una mejor calidad o mejor producto seria ideal en este caso utilizar un sistema de destilación fraccionada la cual viendo el anexo 10 es un sistema con mejores resultados que el sistema utilizado en esta práctica. Cuadro 3. Densidad obtenida del destilado. Muestra Valor medido Alcohol 0,9860 Teniendo la cantidad extraída del destilado en una probeta se coloca el instrumento llamado densímetro el cual pone en práctica el principio de Arquímedes. (6) Teniendo la probeta con el destilado se sumerge con precaución así viendo la escala del densímetro se obtiene la densidad del destilado. En nuestro caso obtuvimos un valor de 0.9860 el cual vamos a ver que sacando el porcentaje de alcohol comparado con el porcentaje total de alcohol del vino nuestros resultados son muy cercanos por lo tanto son buenos resultados obtenidos en la práctica. Figura 3. Relación entre peso especifico y porcentaje de alcohol en una mezcla etanol-agua. (5) Es importante tener un cuidado grande a la hora de introducir el densímetro para calcular el % de alcohol. INFORMACIÓN DE LOS AUTORES Contacto de autor para efectos de correspondencia Jostin Vargas Tel: 85859585 [email protected] AGRADECIMIENTOS Los autores de este reporte quieren agradecer al laboratorio de la UNED por brindar su tiempo y hospitalidad para lograr realizar esta práctica y a la profesora Andreina Leal por su guía durante la realización de la práctica. La figura 3 nos muestra los valores entre un peso especifico y porcentaje de etanol el cual nos permite con el valor del cuadro 3 poder llevar a cabo la interpolación para llegar al valor del etanol del destilado. Cuadro 4. % De etanol (interpolación) Muestra % De etanol Vino 10,17% La interpolación nos da un caso de ajuste lineal, el cual se busca una recta la cual aproxime a todos los puntos representando por la siguiente expresión: Y= ax + b. A partir de esto se construyen las ecuaciones con incógnitas (8) a partir de esto con la figura 3 logramos obtener el porcentaje de alcohol en el cuadro 4, debido a esto podemos ver que nuestros datos son los esperados para una destilación de un vino ya que el vino utilizado posee un porcentaje total de 12% con una diferencia de alcohol de un 1% con los resultados obtenidos ya que obtuvimos un 10.17%, Esto no deja ver que nuestra práctica fue bien empleada logrando destilar el 90% de metanol del vino. CONCLUSIONES Se debe armar el sistema de manera que el destilado fluya de buena manera. En conclusión, se necesita utilizar una plantilla la cual caliente de manera uniforme para tener una temperatura estable. Concluyendo, debemos tener un mayor control y cuidado a la hora de estabilizar la temperatura. Concluimos que mantener la temperatura en los grados adecuados es muy difícil. Se necesita implementar una gran cantidad de tiempo para poder obtener una cantidad razonable de etanol. REFERENCIAS (1) Muñoz Camacho, E.; Grau Ríos, M. INGENIERÍA QUÍMICA; UNED: Madrid, 2013.. (2) Brito, D. P. Tipos de Destilacion. Academia.edu - Share research, 22 de marzo de 2020. https://www.academia.edu/43164709/T ipos_de_Destilacion (accedido el 09/05/2022). (3) Vanegas, D.; Rendón, J.; Velásquez, J. A.; Zapata, Z. Caso de estudio de la destilación etanol-agua en operación continua y discontinua y su simulación con ecuaciones cúbicas de estado y modelos de actividad. SciELO Colombia- Scientific Electronic Library Online, 13 de abril de 2020. http://www.scielo.org.co/scielo.php?scr ipt=sci_arttext&pid=S012377992020000300201 (accedido el 11/05/2022). (4) Gross, M. S. Separación de mezclas azeotrópicas vía destilación mejorada. Biblioteca Virtual, 17 de septiembre de 2021. https://bibliotecavirtual.unl.edu.ar:8443 /handle/11185/6165?localeattribute=en (accedido el 12/05/2022). (5) Legrá-Lobaina, A. A.; Atanes-Beatón, D. M.; Guilarte-Fuentes, C. Contribucion al metodo de interpolacion lineal con triangulacion de Delaunay. Gale Academic OneFile, 2014. https://go.gale.com/ps/i.do?id=GALE|A 470159936&sid=googleScholar&v =2.1&it=r&linkaccess=abs&is sn=02585979&p=AONE&sw=w&a mp;userGroupName=anon~cc07d232 (accedi do el 12/05/2022). (6) - Jiménez, M. J., Procesos de separación: destilación simple de un vino para la determinación de su grado alcohólico, 2016, 1, 130-137. (7) - Calvo, P. M.; Carballo, A. F.; Villegas, R. L.; Vargas, G. X.; Borbón, A. H.; Vega, G. I.; Mora, A. C.; Rodriguez J. A., Química Orgánica, 2013, 1, 69-74. (8) Efecto de la interpolación respecto al error en una aplicación. CON-CIENCIA 2015, 3 (1). (9) - Nor, A. R.; Suhaimi, I.; Suhaila, H.; Mohamad, S. A. I.; Mohd, N. O., Boiling curve and droplet evaporation lifetime on hot hemispherical copper surface, 2019, 8, 85898592. (10) - Grande, V. J. C.; Ortiz, B. S., Destilación simple y fraccionada: Método de purificación de líquidos, 2019, 1, 1-7. (11) MatosJ, I. Q.; VarandasJ, S.; Santos, P. THERMODYNAMIC MODELING OF AZEOTROPIC MIXTURES WITH [EMIM][TfO] WITH CUBIC-PLUSASSOCIATION AND CUBIC EOSs. SciELO Brasil, junio de 2018. https://www.scielo.br/j/bjce/a/Mgmjr9b njN9zZQ5shj8CsfF/?lang=en (accedido el 12/05/2022).



![practica 5[1]](http://s2.studylib.es/store/data/007425075_1-61f96af50a4c20310ac423e2aba15d52-300x300.png)