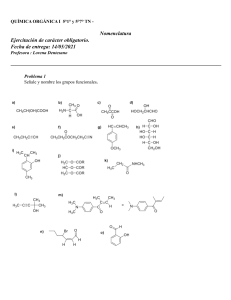
Compuestos orgánicos oxigenados y nitrogenados Objetivos Objetivo general Conocer la diversidad de los componentes orgánicos oxigenados y nitrogenados de la biósfera, su clasificación, sus propiedades químicas y físicoquímicas, y sus principales reacciones. Objetivos específicos ➢ Comprender las relaciones entre estructura, propiedades y reactividad de dichos compuestos. ➢ Interpretar las funciones e interacciones de algunos compuestos representativos en procesos biológicos y ambientales. ➢ Comprender los fundamentos y adquirir capacidades para extraer, purificar y realizar análisis sencillos que permiten determinar la presencia de algunos grupos de compuestos orgánicos oxigenados y nitrogenados. Bibliografía ✓ Fox, M.A., Whitesell, J.K. Química Orgánica. Ed. Addison-Wesley Longman. ✓ Hart, H., L.E. Craine, D.J. Hart, C.M. Hadad. Química Orgánica. Ed. McGraw-Hill. ✓ Lamarque, A., Zygadlo, J., Labuckas, D., López, L., Torres, M., Maestri, D. Fundamentos Teórico-Prácticos de Química Orgánica. Encuentro Grupo Editor. ✓ Morrison, R.T., Boyd, R.N. Química Orgánica. Ed. Pearson Addison-Wesley Iberoamericana. ✓ Wade, Jr. L.G. Química Orgánica. Ed. Pearson Prentice Hall. Grupos funcionales: Fórmula general Alcoholes Éteres R-OH R-O-R Epóxidos Fenoles R Aldehídos C O Compuestos carbonílicos Grupo carbonilo C O H R Cetonas R C O O Ácidos carboxílicos R C OH Derivados de ácidos carboxílicos Ésteres Anhídridos de ácido O R C O OR´ Cloruros de ácido O O R R, R´, R´´ = Grupos alquilo o arilo R N H H Amina primaria O C R Cl R C O C R Aminas Amidas R N H R´ Amina secundaria R N C NH2 R´ R´ Amina terciaria Alcoholes Grupo funcional Fórmula general OH R-OH R = Grupo alquilo o alquilo sustituido Clasificación y Nomenclatura Nomenclatura IUPAC 1- Elegir la cadena continua mas larga que contenga el grupo hidroxilo. 2- Cambiar la terminación O del alcano correspondiente por OL. 3- Indicar posiciones de los sustituyentes mediante números, el carbono que lleva el grupo hidroxilo recibe el número más bajo posible. H H C OH H2C CH2 H3C CH2OH Etanol Cl OH R OH H3C CH CH2 R´ C OH 2-Butanol Secundario Ciclohexanol R´ C OH R Terciario OH CH3 OH R R´´ 2-Propen-1-ol 2-Cloroetanol Primario H H2C CH CH2OH CH3 H3C C OH CH3 2-Metil-2-propanol 3-Ciclohexenol CH3 OH 1-Metilciclopentanol R OH Propiedades físicas y químicas Hidrófobo H R R O H H O H H O A R R H O H O H O H H O O Enlace por puente de hidrógeno entre moléculas de alcohol H OR RO H Cl H OR Anión solvatado H OR R R Cat R R O R O H Hidrófilo Alcoholes como disolventes Grupos alquilo lipófilos (hidrófobo): disuelven compuestos no iónicos. ✓Grupos –OH hidrófilos: disuelven compuestos iónicos. ✓Disolventes próticos: a) solvatan aniones b) solvatan cationes Alcoholes como bases y como ácidos ROH H2SO4 Alcohol Base más fuerte ROH Alcohol Acido débil ROH2 Alcohol protonado Na RO Na HSO4 Base más débil 1/2 H2 Alcóxido de sodio Base fuerte Solubilidad (g/100 g agua) Alcohol Peb (ºC) 64,5 CH3CH2CH2OH CH3CH2CH2CH2OH 7,9 118 CH3CH2CH2CH2CH2OH 2,3 138 CH3 10 108 83 HOCH2 CH2OH 197 H2C CH CH2 290 CH3OH CH3CH2OH H3C 78,3 97 CH CH2OH CH3 H3C C OH CH3 OH OH OH 1, 2, 3-Propanotriol Fuente industrial de alcoholes Caña de azúcar Melasas Cereales Fermentación Azúcares Almidón CH3 CH2OH H OH C C H Cracking Petróleo C C H2O (Adición Markovnikov) 1) Síntesis de alcoholes a partir de alquenos: Hidratación de alquenos catalizada por ácido Mecanismo Paso 1) H H C C H O H C C H2O Carbocatión H H Paso 2) C C C C H2O Alcohol protonado O H H H H Paso 3) H2O C C O H H C C OH H3O Orientación Markovnikov CH3 H CH3 C CH CH3 CH3 H O H CH3 C CH CH3 H CH3 Carbocatión 3º CH3 C CH CH3 Carbocatión 2º H 2) Síntesis de alcoholes a partir de halogenuros de alquilo R X OH R OH X 3) Reducción de compuestos carbonílicos, ácidos y ésteres Reacciones de alcoholes A) Ruptura del enlace C OH 1) Reacción con halogenuros de hidrógeno R OH HX Alcohol Halogenuro de hidrógeno R X H2O Halogenuro de alquilo a) La reacción es catalizada por ácidos b) Hay transposición del grupo alquilo, salvo en alcoholes primarios c) El orden de reactividad de los alcoholes con HX es 3º > 2º > 1º < CH3 Mecanismos Sustitución nucleofílica bimolecular (SN2: para la mayoría de los alcoholes primarios y metanol) X R OH2 H Cl H C OH2 H X R OH2 H Cl C H H OH2 X R H2O Cl C H H2O H H Sustitución nucleofílica unimolecular (SN1: todos, excepto metanol y la mayoría de los alcoholes primarios) Paso 1) R OH HX R OH2 X Alcohol protonado Paso 2) R R OH2 Paso 3) Carbocatión R X R H2O X Transposiciones H2O CH3 H3C C CH H3C OH HCl CH3 H3C C H3C CH3 H3C C CH CH3 CH3 CH3 CH3 Carbocation 3º CH OH2 CH3 H3C C CH H3C Carbocation 2º CH3 2) Deshidratación de alcoholes C C H H2O C C H OH H OH2 Alcohol protonado C C H C C H Carbocatión Alqueno a) Requiere catálisis ácida b) La deshidratación es reversible c) El orden de reactividad de los alcoholes frente a la deshidratación es 3º > 2º > 1º y va paralelo a la estabilidad de los carbocationes d) La orientación es fuertemente Saytzeff CH3 CH3 CH2 C CH3 OH 2-metil-2-butanol H CH3 CH3 CH3 CH C CH3 2-metil-2-buteno Producto principal CH3 CH2 C CH2 2-metil-1-buteno B) Ruptura del enlace C O H 3) Reacción como ácidos: con metales activos R O H M R CH3 CH2OH O M 1/2 H2 M = Na, K, Mg, Al, etc CH3 CH2O Na Na Etanol 1/2 H2 Etóxido de sodio 4) Formación de ésteres O R´ OH R C H OH Alcohol Acido carboxílico O R C HOH OR´ Éster 5) Oxidación de alcoholes H O R C OH R C H H Alcohol 1º R´ R Alcohol 2º R C OH Aldehído Ácido carboxílico R´ C O C OH H O R Cetona R´ R C OH No hay reacción R´´ Alcohol 3º Agentes oxidantes: KMnO4, K2Cr2O7, CrO3 RCH2OH KMnO4 RCOOH MnO2 KOH Alcoholes y derivados de interés biológico e industrial H3C Usos como disolvente y combustible. Usos en las industrias química, alimenticia, farmacéutica, cosmética. CH2OH Etanol CH3 Mentol OH CH3 H3C Mentha piperita CH2OH Geraniol CH2OH Farnesol Geranium spp. Rosa spp. H2C CH CH2 OH OH OH 1, 2, 3-Propanotriol HOCH2 O HO OH 1, 2, 3-propanotriol (glicerol, glicerina). Precursor biosintético de triglicéridos y fosfolípidos. Aplicaciones en las industrias química, cosmética, alimenticia. Hidratos de carbono: polihidroxialcoholes. Funciones fundamentales en los seres vivos: nutricionales y estructurales. HO OH Glucosa, un hidrato de carbono HO Colesterol (un esterol típico de animales) - Componente de las membranas celulares. - Precursor biosintético de ácidos biliares, hormonas sexuales (progesterona, testosterona), vitamina D. Éteres y epóxidos Éteres: estructura y nomenclatura Fórmula general R O R R O Ar CH3 H3C CH2 O CH2 CH3 Ar O Ar CH3 CH3 H3C CH O CH CH3 CH3 O C CH3 CH3 Dietil éter Diisopropil éter CH3 CH2 CH CH2 CH3 O CH3 3-Metoxipentano O Difenil éter t-Butil metil éter ( 2-Metil-2-metoxipropano) O CH3 Fenil metil éter Propiedades físicas R 110º R O Momento dipolar neto ( O) - Puntos de ebullición: similares a los de alcanos de PM semejante y mucho menores que los de alcoholes. - Solubilidad en agua: semejante a la de alcoholes. Fuente industrial: deshidratación de alcoholes 2 R OH H2SO4 Calor 2 CH3 CH2OH R O R Eter simétrico H2SO4 H2O CH3 CH2 O CH2 CH3 140ºC Etanol H2O Dietil éter Síntesis de Williamson: sustitución nucleofílica de un ion alcóxido o fenóxido por un ion halogenuro R X Halogenuro de alquilo 1º Na O R´ Alcóxido Na O R X Halogenuro de alquilo 1º R O R´ Na X Dialquil éter R O Na X Fenóxido Alquil fenil éter CH3 CH3 CH2Br Bromoetano Na O C CH3 Factible CH3 CH3 CH2 O C CH3 No factible CH3 CH3 CH3 t-Butóxido de sodio C Br Na O CH2 CH3 CH3 Etóxido de sodio NaBr CH3 t-Butil etil éter 2-Bromo-2-metilpropano Competencia sustitución nucleofílica/eliminación CH3 CH3 CH2Br Halogenuro 1º CH3 CH3 C Br CH3 Halogenuro 3º CH3 Sustitución Na O C CH3 CH3 CH2 CH3 O C CH3 NaBr CH3 Eliminación Na O CH2 CH3 CH3 CH3 C CH2 CH3 CH2OH NaBr Éteres cíclicos O O O Tetrahidrofurano Furano Tetrahidropirano Epóxidos C C Anillo epóxido (anillo oxirano) O Obtención de óxido de etileno H2C CH2 Eteno (Etileno) O2 / Ag2O H2C 300 ºC O2 O COOH Ácido 12, 13-epoxi-cis-9-octadecenoico O Óxido de etileno (1,2-epoxietano) Ácido cis 9, cis 12-octadecadienoico (ácido linoleico) (Componente mayoritario de aceites vegetales) COOH CH2 Compuestos carbonílicos: Aldehídos y Cetonas Estructura: el grupo carbonilo R C R´ O R R C 120º C O R´ O R´ Fórmula general R H R C O Aldehídos C R´ O Cetonas R y R´ = Grupos alifáticos o aromáticos Propiedades físicas de aldehídos y cetonas - Puntos de Ebullición: más elevados que los de compuestos no polares de PM , pero menores a los de alcoholes y ácidos de PM - Solubles en agua hasta los 4 ó 5 átomos de carbono Nomenclatura Aldehídos: Nomenclatura IUPAC 1- Elegir la cadena continua mas larga que contenga el grupo carbonilo. 2- Cambiar la terminación O del alcano correspondiente por AL. 3- Indicar posiciones de los sustituyentes mediante números, el carbono carbonílico lleva el número 1. H H H C O H Metanal H H2C CH C Propenal (Acroleína) O CH3 CH C CH2 CH2 Butanodial C H H CH CH2 C 3-Cloro-4-metilpentanal O O O Bencenocarbaldehído (Benzaldehído) CH3 Cl O H C C O H3C Etanal O CHO OH OH CH2 CH C C H H Ciclopentanal O 2,3-dihidroxipropanal (Gliceraldehído) CHO HO 3,7-dimetil-6-octenal p Hidroxibenzaldehído (Citronelal) Cetonas Nombres comunes: se nombran los dos grupos ligados al carbono carbonílico y se añade la palabra cetona Nomenclatura IUPAC: 1- Elegir la cadena continua más larga que contenga el grupo carbonilo 2- Reemplazar la terminación O del alcano correspondiente por ONA 3- Indicar posiciones de los sustituyentes mediante números, recibiendo el carbono carbonílico el más bajo posible O O O OH O C CH3 C CH3 CH2 CH CH CH2 C CH2 CH3 Propanona 5-Hidroxi-6-hepten-3-ona Ciclohexanona (Dimetilcetona) Benzofenona (Acetona) (Difenilcetona) O CH3 C CH2 CH2 4-Oxopentanal O O C H O Quinonas: dicetonas cíclicas conjugadas O O 1,4-Benzoquinona 4-metil-1,2-benzoquinona p-Benzoquinona CH3 Métodos de preparación Aldehídos Oxidación de alcoholes primarios O R H CH2OH Alcohol 1º R O R C O Aldehído CH2OH OH O Acido carboxílico C5H5NHCrO3Cl 3,7-dimetil-6-octen-1-ol (Citronelol) Oxidación de alcoholes secundarios R CH R Alcohol 2º CHO 3,7-dimetil-6-octenal (Citronelal) Cetonas OH C O = Agente oxidante KMnO4 HNO3 CrO3, H3O+ O O R C R Cetona Reacciones de aldehídos y cetonas O Oxidación O O C C R H Aldehído O O = Agente oxidante KMnO4 K2Cr2O7 CrO3, H3O+ R OH Acido carboxílico O No hay reacción C R R´ Cetona Reducción o hidrogenación H O R C AR AR R R´ H OH Compuesto carbonílico C R´ Alcohol B H R´ H R´ H OH O O H R´ C Na H C AR = Agente reductor NaBH4 LiAlH4 Hidrocarburo Mecanismo H R H R R C R´ H R C H Reacciones de Adición Nucleofílica R Z Z C O R´ Reactivo (Trigonal) R C R´ Z O R C Estado de transición Producto (Haciéndose tetraédrico) (Tetraédrico) Carga negativa parcial Carga negativa sobre el oxígeno sobre el oxígeno HOH (agua) Nucleófilos neutros O R´ ROH (un alcohol) H3N (amoníaco) Nucleófilos cargados negativamente HO (ion hidróxido) H (ion hidruro) R C RO N (un carbanión) (un ion alcóxido) C (ion cianuro) 1- Adición de agua: Hidratación OH O H2O C H H H C OH H Hidrato de formaldehído (99.9 %) Formaldehído (0.1 %) OH O H2 O C C CH3 H3C H3C OH H3C Hidrato de acetona (0.1 %) Acetona (99.9 %) Mecanismo de la hidratación catalizada por base O O C C OH H O H OH OH C OH OH 2- Adición de alcoholes: formación de hemiacetales y acetales RO R´ ROH H+ C O R´ H Alcohol R´ C R´ H+ C OH H Hemiacetal Aldehído Mecanismo C H R´ R´ Aldehído C RO C OH H Hemiacetal R´ OH ROH C OH H Hemiacetal RO H+ C RO H+ H Hemicetal protonado OH H Aldehído protonado R´ RO ROH H O H OH HOH C R´ OR H Acetal Hemiacetales cíclicos: la glucosa 1 CHO 2 H C HOH2C H 5 C 3 HO C 4 H H H Giro 90º C OH C OH 5 6 1 6 OH H H CHO OH 2 4 3 C C OH C Aproximación de C1 y C6 OH OH H H CH2OH D-glucosa H 4 HO 6 6 CH2OH CH2OH 5 H 4 C 5 O 1 Adición H 4 H C OH H CHOH Nucleofílica 3 2 HO HO C C H 6 5 OH Estructura cíclica hemiacetálica de la glucosa C OH 1 2 C H OH CH2OH 1 OH C OH H CHO 3 2 C C H OH Rotación en torno al enlace C4 - C5 H C OH H CHO 3 C C Hidrógenos Acidez de los hidrógenos alfa H O C C Carbono Estabilidad de los aniones enolato H HO C C O O O C C C C R R R Anión enolato estabilizado por resonancia 3- Condensación aldólica O O CH3 C H CH3 Etanal C OH OH H CH3 O CH CH2 C H 3-hidroxibutanal (Aldol) Mecanismo Paso 1 O CH3 C H O CH2 C OH Aldehído con Hidrógenos HOH H Anión enolato (nucleófilo) Paso 2 CH3 C CH2 C H O O O O CH3 H CH CH2 C Ion alcóxido H Paso 3 O CH3 CH O CH2 C OH H HOH CH3 CH O CH2 C Aldol H OH Aldehídos, cetonas y derivados de interés biológico e industrial Aldehídos producidos durante la oxidación (enranciamiento de grasas y aceites) O O O O CH3 CH2 CH CH CH CH C CH2 CH C C CH2 C H H H H Propenal Propanodial 2,4-Heptadienal Aldehídos y cetonas utilizados en perfumería y cosmética CHO 3,7-dimetil-6-octenal (Citronelal) Cymbopogon citratus (pasto limón) Compuestos con actividad biológica Juglans regia (nogal) OH O Juglona O 5-Hidroxi-1,4-naftalendiona O Jasminum spp. Jasmona 3-metil-2-(pent-2-enil)ciclopent-2-en-1-ona O CH3 O Vitamina K Acidos carboxílicos y derivados O Estructura RCOOH C RCO2H OH Nomenclatura Nº carbonos Fórmula Nombre IUPAC Nombre común 1 HCOOH Ac. metanoico Ac. fórmico 2 CH3COOH Ac. etanoico Ac. acético 3 CH3CH2COOH Ac. propanoico Ac. propiónico 4 CH3(CH2)2COOH Ac. butanoico Ac. butírico 5 CH3(CH2)3COOH Ac. pentanoico Ac. valeriánico 6 CH3(CH2)4COOH Ac. hexanoico Ac. caproico 7 CH3(CH2)5COOH Ac. heptanoico Ac. enántico 8 CH3(CH2)6COOH Ac. octanoico Ac. caprílico 9 CH3(CH2)7COOH Ac. nonanoico Ac. pelargónico 10 CH3(CH2)8COOH Ac. decanoico Ac. cáprico 2 3 3 1 2 4 1 H2C CH COOH CH3 CH COOH 3 2 1 CH3 CH CH2 COOH OH Br Ac. 2-bromopropanoico Ac. propenoico (Ac. -bromopropiónico) (Ac. acrílico) Ac. 3-hidroxibutanoico (Ac. -hidroxibutírico) COOH Acidos aromáticos COOH CH3 COOH Ac. bencenocarboxílico (Ac. benzoico) Cl Ac. 2-metilbenzoico Ac. 4-clorobenzoico Ac. o-metilbenzoico Ac. p-clorobenzoico CH2CH2COOH CH3 CHCH2COOH Ac. 3-fenilpropanoico Ac. 3-fenilbutanoico Acidos dicarboxílicos Acido Etanodioico (Oxálico) Propanodioico (Malónico) Butanodioico (Succínico) 2, 3-dihidroxibutanodioico (Tartárico) Estructura HOOC COOH HOOC CH2 COOH HOOC (CH2)2 COOH OH OH HOOC CH CH COOH 2-hidroxipropano-1, 2, 3-tricarboxílico OH (Cítrico) HOOC CH2 C CH2 COOH COOH Propiedades físicas de los ácidos carboxílicos O H O O C R C O H H H O R R C O O H Puntos de ebullición O H H Solubilidad en agua Acidez y constantes de acidez O R C O R C HOH OH H H O H O Ac. carboxílico Ion carboxilato RCO2 Ka = RCO2H H3O Ion hidronio Ionización del etanol CH3CH2OH Etanol CH3CH2O Ka = 10 H 16 Ion etóxido Ionización del fenol O OH Fenol 10 H Ka = 10 Ion fenóxido Ionización del ácido acético O O CH3C CH3C OH Acido acético H O Ion acetato Ka = 10 5 Ionización de un alcohol R O H H Alcohol La carga negativa del ion se localiza R O exclusivamente sobre el átomo de oxígeno (no hay resonancia): El ion Ion alcóxido es poco estable Ionización del fenol O H O H O O La carga negativa del ion se deslocaliza por resonancia IV Los iones fenóxido son más estables que los iones alcóxido H I Fenol O III II Ion fenóxido O O O El equilibrio se desplaza más fácilmente hacia la ionización III y IV V VI VII Estructuras de resonancia para el ion fenóxido Aumenta la acidez con respecto a la de acidez alcoholes Ionización de ácidos carboxílicos O CH3C O O O CH3C Ó O CH3C O Resonancia en un ion carboxilato La carga negativa del ion se dispersa o deslocaliza (por resonancia), en forma equivalente, sobre ambos átomos de oxígeno Los iones carboxilato son más estables que los iones alcóxido y fenóxido El equilibrio se desplaza con mayor facilidad hacia la ionización Aumenta la acidez con respecto a la acidez de alcoholes y fenoles Efecto de la estructura sobre la acidez de ácidos carboxílios: efecto inductivo O O G G C C O O G atrae electrones: estabiliza al anión, aumenta la acidez O CH3C O Acetato Cl CH2C G libera electrones: desestabiliza al anión, disminuye la acidez O Cl O Cl Cloroacetato CHC O O Dicloroacetato Cl O Cl C C O Cl Tricloroacetato El efecto inductivo tiende a dispersar la carga negativa del ion sobre un mayor número de átomos, por desplazamiento de electrones hacia los átomos electronegativos Se incrementa la estabilidad del ion Aumenta la acidez * El efecto inductivo es de corto alcance: Se ejerce fundamentalmente cuando el sustituyente electronegativo está unido al carbono Métodos de preparación de ácidos carboxílicos 1) Oxidación de alcoholes primarios o de aldehídos H AO R C OH R AO C O O R C H H Alcohol primario (Un enlace C O) OH Aldehído Ac. carboxílico (Dos enlaces C O) (Tres enlaces C O) AO = Agente Oxidante (KMnO4, CrO3, HNO3, K2Cr2O7) 2) Oxidación de alquilbencenos R COOH H2CrO4 / Calor KMnO4 / Calor Alquilbenceno CH3 Ac. benzoico H2CrO4 / Calor COOH Reacciones de los ácidos carboxílicos: Sustitución nucleofílica del acilo O R C O C Z HO R Nucleófilo sp2 Mecanismo R C O Z Z OH sp2 Intermediario tetraédrico (sp3) O R C H OH 1 OH OH OH R C OH OH 2 R C H 3 OH O R´ R C O R´ H OH OH R C O R´ OH 4 Adición Nucleofílica H O R C OR´ OH H 6 R C R´ O H2O H OH R C 5 R´ O H O H Eliminación Derivados de los ácidos carboxílicos O R O C OR´ Ester R C O X R Halogenuro de acilo C NH2 R O O C O C R´ Amida Anhidrido de ácido Esteres Nomenclatura: el nombre de los ésteres se compone de dos términos. El primero deriva del ácido correspondiente (cambio de la terminación ico del ácido por ato). El segundo término es el nombre del grupo alquilo del alcohol. Métodos de obtención O O R H C OH HO R´ Acido Alcohol R Calor C H2O OR´ Ester O CH3 COOH Ac. etanoico HOH2C CH3 Etanol Calor CH3 C O CH2 CH3 H2O Etanoato de etilo O O C H2SO4 OH Ac. benzoico HOCH3 Metanol H2SO4 C OCH3 Calor Benzoato de metilo H2O Grasas y aceites: ésteres del glicerol O HO C H2C OH HC (CH2)14 CH3 Acido palmítico (Ac. hexadecanoico) (CH2)16 Acido esteárico (Ac. octadecanoico) O OH HO C CH3 O H2 C OH Glicerol (1, 2, 3-propanotriol) HO C (CH2)7 CH CH (CH2)7 Acido oleico (Ac. 9 cis octadecenoico) CH3 O H2C O C O HC O C O H2C O C (CH2)14 CH3 Ester del ácido palmítico (CH2)16 CH3 Ester del ácido esteárico (CH2)7 CH CH (CH2)7 CH3 Ester del ácido oleico Un triglicérido: triéster del glicerol con ácidos grasos Esteres cíclicos: Lactonas 4 3 2 CH2 CH2 CH2 1 O C OH OH Ac. 4-hidroxibutanoico O H 2 1 O Calor 3 4 -butirolactona H2O Anhídridos de ácido O R C Fórmula general O O C R Nomenclatura: nombre del ácido del cual deriva y reemplazo de la palabra ácido por anhídrido. Métodos de obtención Anhídridos simétricos O O 2 CH3 C Calor OH Ac. etanoico (Ac. acético) CH3 C O O H2O C CH3 Anhídrido etanoico (Anhídrido acético) Anhídridos asimétricos o mixtos O O Na O C CH3 CH3 CH2 C O O CH3 CH2 C O C CH3 Cl Cloruro de propanoílo Acetato de sodio Anhídrido propanoico etanoico NaCl O Amidas Fórmula general R C NH2 Nomenclatura: reemplazo de la terminación oico del ácido carboxílico correspondiente por amida. O O O H O H C NH2 CH3 C NH2 CH3 C N CH3 CH3 C N Metanamida Etanamida N-metiletanamida O CH3 H2N C CH3 NH2 Urea N, N-dimetiletanamida Propiedades físicas y químicas de las amidas O O H C N R H H C N R H Resonancia en amidas La deslocalización por resonancia del par electrónico no compartido del nitrógeno genera un contribuyente dipolar: Las amidas son compuestos polares y pueden formar puentes de hidrógeno entre sus moléculas y con moléculas de agua. R C O H N H H N H O C R Formación de puentes de hidrógeno entre moléculas de amida El carbono carbonílico en el grupo amida tiene menor carácter electrofílico que en el resto de los derivados de ácidos carboxílicos: Las amidas son los derivados de menor reactividad frente a la sustitución nucleofílica. O O H C H3C O CH3 C N H3C H N H N metiletanamida 2 221 80 1 206 31 Obtención O Ac. carboxílico NH3 CH3 N,N dimetiletanamida O R C O NH4 Amoníaco N 0 165 20 O R C OH H3C Etanamida Cantidad de enlaces N H Punto de ebullición ºC Punto de fusión ºC CH3 C Sal de amonio R C NH2 H2O Amida El enlace peptídico: un enlace amida Enlace peptídico O H2N CH C R O OH H N CH C OH H O H2O O H2N CH C N CH C OH R H Un dipéptido Las proteínas son polímeros de aminoácidos unidos entre sí mediante enlace amida Reacciones de los derivados de ácidos carboxílicos: Resumen Las reacciones de los derivados de ácidos carboxílicos suceden a través del mismo mecanismo: Sustitución nucleofílica. El orden de reactividad de los derivados de ácidos carboxílicos ante la sustitución nucleofílica se explica fundamentalmente por la electronegatividad del átomo unido al carbono carbonílico. Nucleófilo Derivado de ácido O R C Cl H2O (Hidrólisis) O R´OH (Alcohólisis) O R C OH HCl O R C OR´ R C NH2 Disminuye la reactividad Cloruro de acilo O O O R C O C R O 2 R C OH O R C OR´ Anhídrido de ácido O R C O R´´ Ester O R C NH2 O O R C OH O R´´OH R C OR´ R´´OH Intercambio de éster R C NH2 R´´OH O R C OH Amida Producto principal NH4 Cl O R C OH R C NH2 O R C OH NH3 (Amonólisis) Acido NH3 __________ __________ Ester Amida Acidos carboxílicos y derivados de interés biológico e industrial Acidos grasos mayoritarios presentes en grasas y aceites COOH Acido hexadecanoico (Palmítico) COOH Acido octadecanoico (Esteárico) COOH Acido cis9-octadecenoico (Oleico) COOH Acido cis9, cis12-octadecadienoico (Linoleico) Triglicéridos: ésteres de ácidos grasos con el glicerol O H2C O C (CH2)14 CH3 Ester del ácido palmítico O HC O C (CH2)16 CH3 Ester del ácido esteárico O H2C O C (CH2)7 CH CH (CH2)7 CH3 Ester del ácido oleico Esteres como componentes del aroma y sabor de frutos y flores O O CH3 C O CH2 CH2 CH2 CH2 CH3 CH3 CH2 CH2 CH2 C O CH2 CH3 Butanoato de etilo (ananá) Etanoato de pentilo (banana) O CH3 CH2 CH2 CH2 C O CH2 CH2 CH2 CH2 CH3 Butanoato de pentilo (durazno) Hidroxiácidos y derivados de interés biológico O O OH C C OH OH HOOC CH2 C CH2 COOH Acido acetilsalicílico OH COOH O (Aspirina) Acido o hidroxibenzoico Acido cítrico C (Acido salicílico) CH3 O Lactonas con actividad biológica HO OH O O O O O O Cumarina Dicumarol Amidas y derivados de interés agrícola, industrial y medicinal O O O H H2N C NH2 Carbamida (Urea) HN(CH2)nNH C (CH2)nC NH Poliamida (Nylon) N C CH3 O HO N (4 hidroxifenil)etanamida (Paracetamol) Aminas Estructura N H - Derivados orgánicos del amoníaco (NH3) - Forma tetraédrica ligeramente distorsionada con un par de e- no enlazantes - Hibridización del N: sp3 N H H Amoníaco H3C CH3 CH3 108º Trimetilamina N: número atómico (Z) = 7 Electrones de valencia 4 orbitales híbridos sp3 (uno de ellos ocupado por 2 e- ) Clasificación de aminas R R, R´, R´´ = Grupos alquilo o arilo N H H Amina primaria R N H R´ Amina secundaria R N R´ R´ Amina terciaria Nomenclatura IUPAC Aminas alifáticas ➢Se elige la cadena continua más larga de átomos de carbono que contenga el grupo amino (estructura matriz) y se cambia la terminación o del alcano correspondiente por amina. ➢Se emplea un número (el más bajo posible) para indicar la posición del grupo amino (y otros sustituyentes) en la cadena. ➢Se emplea el prefijo N- para cada sustituyente en el átomo de nitrógeno. CH3 CH2 CH2 CH2 CH3 CH CH2 CH2 NH2 CH3 NH2 1-Butanamina CH3 CH3 CH3 CH2 CH3 H N-metil-2-butanamina H3C CH3 CH2CH3 N CH3 H3C N CH2CH2CH3 N H3C CH3 2,4,N,N-tetrametil-3-hexanamina CH3 N 3-metil-1-butanamina CH2 CH CH CH CH3 CH N etil, N metil-1-propanamina N,N dimetilciclopentanamina NH2 CH3CH2CHCO2H Acido 2-aminobutanoico O H2NCH2CH2CCH3 4-amino-2-butanona NH2 OH CH2 CH2 2-aminoetanol Aminas aromáticas NH2 NH2 Br H3C Br N Br Aminobenceno 2,4,6-tribromoanilina (Anilina) NH2 CH2CH3 N-etil-N-metilanilina CH3 p-aminotolueno Las aminas secundarias y terciarias simétricas se pueden nombrar añadiendo al nombre del grupo alquilo el prefijo di o tri H N CH3 CH2 N CH2 CH3 CH2 CH3 Difenilamina Trietilamina CH3 N CH3 H Dimetilamina Propiedades físicas ➢Las aminas son compuestos polares ➢Las aminas primarias y secundarias tienen enlaces N-H: forman puentes de hidrógeno intermoleculares ➢Tienen puntos de ebullición más elevados que los compuestos no polares de PM semejante, pero menores a los PEb de alcoholes y ácidos carboxílicos H H3C N H CH3 H N H N CH3 H H ➢Las tres clases de aminas pueden formar puentes de hidrógeno con el grupo OH del agua: las aminas sencillas de hasta 4 ó 5 átomos de carbono son solubles en agua. ➢Metil y etilaminas huelen semejante al amoníaco. ➢Las alquilaminas superiores tienen olor a pescado en descomposición. Basicidad de las aminas H H R N R H OH H Amina (Base de Bronsted Lowry) Kb = N H H Ion amonio RNH3 OH Ion hidróxido OH RNH2 Los valores de Kb para la mayoría de las aminas son del orden de 10-3 y el equilibrio de la reacción de disociación se encuentra desplazado hacia la izquierda. Comparación de la basicidad de aminas alifáticas y aromáticas NH2 Ciclohexilamina NH2 Anilina (aminobenceno) H NH2 NH2 H OH OH Ciclohexilamina: el par electrónico está localizado sobre el nitrógeno. No hay Resonancia NH2 NH2 NH2 NH2 NH2 H OH Anilina: el par electrónico se deslocaliza por resonancia sobre carbonos del anillo. En total hay cinco estructuras de resonancia para la molécula. H NH2 H NH2 OH Ion Anilinio: sólo dos estructuras de resonancia La menor basicidad de las aminas aromáticas se debe a que la molécula se estabiliza (por resonancia) más que su ion. Además, la deslocalización del par electrónico en la anilina hace que esté menos disponible para protonarse: disminuye la basicidad. Comparación de la basicidad de aminas (alifáticas) y amidas Amina Par electrónico localizado: disponible para protonarse Amida Par electrónico deslocalizado: menos disponible para protonarse O R NH2 R C NH2 O R C NH2 Las soluciones acuosas de las aminas son básicas, mientras que las soluciones acuosas de las amidas son prácticamente neutras. Las amidas son mucho menos básicas que las aminas porque sus moléculas se encuentran estabilizadas por resonancia: el par electrónico no compartido del nitrógeno se deslocaliza sobre el oxigeno, y se encuentra menos disponible para protonarse. Aminas como nucleófilos H H R N R CH3Cl N CH3 H Amina (Nucleófilo: Base de Lewis) Cl H Síntesis de Aminas empleando amoníaco o aminas como nucleófilos R CH2X Halogenuro de alquilo 1º NH3 (en exceso) CH3 (CH2)3 CH2Cl 1-Cloropentano NH3 SN2 SN2 CH3 R CH2 NH2 Amina 1º (CH2)3 CH2 NH4X NH2 1-Pentanamina CH3 SN2 CH3 (CH2)3 CH2 1-Pentanamina Amina 1º NH2 NH4Cl CH3Cl Clorometano CH3 (CH2)3 CH2 NH N-metilpentanamina Amina 2º Cl Reacciones de las aminas 1. Reacción de aminas como bases H H H X R N H Amina 1º Acido prótico R CH3 HBr CH3 N H Br Bromuro de trimetilamonio OH CH3 CH3 OH CH3 CH3 Efedrina (PF 79 ºC, maloliente, inestable) H3C CH3 Trimetilamina CH CH NH H X H Halogenuro de alquilamonio CH3 H3C N N HCl CH CH NH2 Cl Clorhidrato de efedrina (PF 217 ºC, sin olor, estable) 2. Reacción de aminas como nucleófilos R H R X R N R H Amina 1º Halogenuro de alquilo 1º Ion halogenuro CH3 CH3Cl HCl H3C N H Metanamina X H Amina 2º H H3C N N Clorometano H N metilmetanamina (dimetilamina) 3. Sustitución anular en aminas aromáticas NH2 NHR NR2 Activan poderosamente y dirigen a posiciones orto, para en la sustitución electrofílica aromática NH2 NH2 Br2 FeBr3 Br Br HBr Br Aminas y derivados de interés biológico y medicinal CH3 H3C N CH2 O CH3 CH2OH H3C N CH3 Colina CH2 CH3 CH2 O O C CH3 H2N N S NH N O Sulfodiazina Acetilcolina Alcaloides: Compuestos nitrogenados con actividad biológica H3CO OH CH3 CH3 Efedrina N H CH2 H3CO CH CH NH CH2 NH2 H3CO Mezcalina N CH2CH2CH3 CH3 N Coniína Nicotina N CH3 OCH3 CN O N HO O Morfina OH Anatoxina O H N O CH3 Ricinina CH3 O N CH3 N Cafeína N N CH3 OH H N CH3 CH3 •Descongestivo, broncodilatador •Alucinógeno Efedrina Ephedra spp. OCH3 CN N O CH3 Ricinina • Extremadamente tóxico. • Actúa sobre SNC • Pérdida de coordinación, convulsiones, Ricinus communis • Propiedades sedativas y N H CH2CH2CH3 Coniína antiespasmódicas • Neurotóxico (parálisis de músculos respiratorios) • Dosis letal para humanos: 200 mg Conium maculatum (Apiaceae) N O Morfina HO CH3 OH Papaver somniferum (Papaveraceae) El látex contiene aproximadamente 40 % de alcaloides Morfina: Actúa sobre SNC Actividad analgésica potente Altamente adictiva O •Neurotóxica H •Agonista de la acetilcolina N •Pérdida de coordinación •Convulsiones •Parálisis de músculos respiratorios Anatoxina O CH3 O N CH3 N Cafeína N N CH3 Anabaena flosaquae (Cianobacteria) •Una taza de café = 100 a 200 mg de cafeína •Estimulante del SNC •Dosis elevadas: vasoconstricción, insomnio, nerviosismo, excitación, aumento de la diuresis. DL50 = 10 g. HO N CH3 O O Hiosciamina Usos medicinales: antiespasmódico del tracto gastro-intestinal Datura stramonium (Solanaceae) O C O CH3 N CH3 O O Cocaína •Propiedades anestésicas (local), vasoconstrictoras •Estimulante del SNC, incremento de la presión sanguínea, hiperactividad, euforia Erythroxylum •Dosis elevadas: taquicardia, coca alucinaciones Erythroxylum coca H3CO NH2 H3CO Mezcalina OCH3 •Contenido en alcaloides: 8-9% (90% mezcalina) •Alucinógena, no adictiva Lophophora williamsii (Peyote)