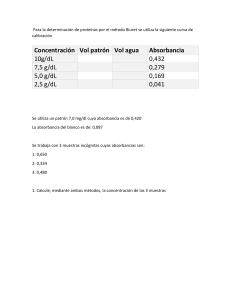
1 I. Introducción La espectrofotometría es una técnica analítica que nos permite determinar la concentración de una sustancia en disolución, se basa en la absorción de las radiaciones por parte de las moléculas y esta cantidad de radiación absorbida, depende directamente de la concentración de la sustancia; por lo tanto, a mayor concentración del analito mayor absorción de la radiación. Durante la práctica se aplicó el método espectrofotométrico diferencial para determinar el producto de solubilidad de un precipitado. Dentro de la práctica se obtuvo una curva de calibración con KMnO4 a distintas molaridades, de la misma manera obtener las absorbancias de dos muestras problemas proporcionadas por el laboratorio. I. Objetivos 2.1 Objetivo general Aplicar un método espectrofotométrico cinético diferencial para determinar el producto de solubilidad de un precipitado. 2.2 Objetivos específico: ● Definir experimentalmente un oxalato insoluble desconocido por el método de espectrofotometría diferencial ● Determinar experimentalmente la solubilidad de un oxalato desconocido. ● Determinar experimentalmente el producto de solubilidad del oxalato desconocido ● Identificar experimentalmente el nombre y la fórmula de un oxalato desconocido. II. Metodología 3.1 Preparación de disoluciones Se prepararon las siguientes disoluciones: una disolución de H2SO4 al 0.3 de 100 mL; dos disoluciones de KMnO4 una al 0.1M y otra al 0.05M, ambas se taparon con aluminio; después a partir de la solución de 0.05M se prepararon disoluciones de 10mL con concentraciones: 0.01, 0.005, 0.001, 0.0005 Y 0.0001 y se taparon con aluminio, por último se agregó los 10 mL sobrantes a una disolución de oxalato sobresaturado y se aforó a 100 mL. 3.2 Curvas de calibración Se generó una curva de calibración midiendo las absorbancias a 530 nm de las disoluciones indicadas, utilizando como blanco agua destilada. 3.3 Obtención de absorbancias de la muestras problema En un matraz volumétrico se mezcló 9.05 mL de disolución X, 10 mL de H2SO4 al 0.3M y 2 mL de solución de KMnO4 0.01M y se aforó con agua destilada, este procedimiento se realizó por triplicado. 2 En otro matraz se mezcló 10 mL de H2SO4 0,3M con 2 mL de KMnO4 0.1M y se aforó con agua destilada, se le nombró disolución B. Se calentó a baño maria de 40 a 50°C por 2 minutos las disoluciones preparadas y después de dejar enfriar a temperatura ambiente se leyó la absorbancia a 530 nm, se ajustó el espectrofotómetro a 0 de absorbancia con disolución M1 y después de leer la absorbancia de la disolución B el procedimiento se repitió con el triplicado de las diluciones realizadas. Diagrama de flujo A continuación se muestra el diagrama de bloques perteneciente a la secuencia experimental de la presente práctica Práctica 10. Determinación del producto de solubilidad de un precipitado por 5.1 Preparación de espectrofotometría diferencial disoluciones Preparar la disolución y 100 mL2H SO 4 etiquetarla 0.3 M Preparar la disolución y etiquetarla Colocarla en un vaso y taparla 10 mL KMnO 4 0.1 M Vaso 10 mL Aluminio Preparar la disolución y etiquetarla 10 mL KMnO 4 0.05 M Preparar las diluciones a partir de la disolución 0.05 M Colocarlas en un tubo y taparlas Aforar a 100 mL el sobrenadante y etiquetarla como disolución X 10 mL diluciones 0.01, 0.005, 0.001, 0.0005 y Tubo deMensaye 0.0001 Aluminio 10 mL sobrenadante de una disolución de oxalato sobresaturado 3 5.2 Curva de calibración Hacer la curva de 530 nm 40 y 50 °C 2 min 530 nm calibración midiendo la absorbancia de las disoluciones indicadas en Usar como blanco agua el cuadro destilada 5.3 Obtención de absorbancias de las Mezclar sustancias en muestraslas problema orden en el matraz volumétrico Realizar el procedimiento por triplicado y etiquetar las disoluciones como M1, M2 y M3 Mezclar las sustancias en orden en el otro matraz volumétrico Etiquetar la disolución como B Calentar en baño maría las disoluciones preparadas Matraz volumétrico 25 mL 2 4 4 9.05 mL disolución X 10 mL H SO 0.3 M Matraz 2volumétrico mL disolución 2 25 KMNO 0.1 M 4 4 mL Agua 10 mLdestilada H SO 0.3 M 2 mL disolución KMNO 0.1 M Agua destilada Dejar que las disoluciones alcancen la temperatura ambiente y leer las absorbancias Ajustar el espectrofotómetro a 0 de absorbancia con la disolución M1 Leer la absorbancia de la disolución B Repetir el procedimiento para las disoluciones M2 y M3 Registrar resultados 4 III. Resultados 4.2 Curva de calibración La siguiente tabla muestra los resultados para la curva de calibración realizada a través de las diferentes soluciones realizadas de diferente concentración, a partir de una disolución de 𝐾𝑀𝑛𝑂4 0.05 M Tabla 1. Datos de curva de calibración Molaridad Absorbancia a 530 nm 0.05 0 1𝑥10−4 𝑀 0.250 2𝑥10−4 𝑀 0.423 3𝑥10−4 𝑀 0.629 4𝑥10−4 𝑀 0.780 5𝑥10−4 𝑀 0.928 1𝑥10−3 𝑀 0.924 La figura 1 muestra la curva de calibración obtenida, así como la ecuación lineal que más se adapta a los valores, se encontró que la ecuación de la recta es 𝑦 = 1713𝑥 + 0.0881 Figura 1. Curva de calibración 4.3 Obtención de absorbancia de las muestras problema 5 En la tabla 2 se pueden observar la muestra B analizada (por triplicado) y las absorbancias obtenidas cuando se utilizaron como blanco 𝑀1 , 𝑀2 y 𝑀3 Tabla 2. Absorbancias experimentales Blanco Muestra Absorbancia Temperatura (°C) 𝑀1 B 1.362 23°C 𝑀2 B 1.362 23°C 𝑀3 B 1.362 23°C IV. Análisis y discusión de resultados En los resultados obtenidos en la Tabla 1, se puede apreciar que conforme aumenta la concentración de la disolución también lo hace la absorbancia, esto se reconoce debido a que existe una relación directamente proporcional dado que a mayor número de moléculas (mayor concentración) existe mayor interacción de la luz con ellas (lo que se interpreta como absorbancia), estos resultados permitieron obtener una curva de calibración donde se obtuvo una ecuación de la recta de forma 𝑦 = 1713𝑥 + 0.0881, el valor de R (0.9959) nos permitió conocer que esta ecuación se adapta bastante bien a los datos proporcionados y no existía tanto error, en este caso, la curva de calibración nos permitió calcular la absortividad molar (véase Memoria de 𝐿 cálculo) la cual resultó ser de 1713 𝑚𝑜𝑙⋅𝑐𝑚−1 . Por otro lado, para determinar la cantidad que no reaccionó de 𝐾𝑀𝑛𝑂4 con el oxalato, supondremos que lo que se tiene es un oxalato de un metal con número de oxidación 1, es decir, del tipo 𝑋2 𝐶2 𝑂4 . La reacción química entre este tipo de oxalato y el permanganato de potasio en medio ácido (presencia de ácido sulfúrico) es: 2𝐾𝑀𝑛𝑂4 + 5𝑋2 𝐶2 𝑂4 + 8𝐻2 𝑆𝑂4 → 5𝑋2 𝑆𝑂4 + 𝐾2 𝑆𝑂4 + 2𝑀𝑛𝑆𝑂4 + 10𝐶𝑂2 + 8𝐻2 𝑂 Observando la reacción química se puede apreciar que si se conoce el número de moles del permanganato que reacciona, se puede determinar mediante estequiometría el número de moles de oxalato presentes en una muestra. Como primer paso es necesario determinar el número de moles de permanganato en la solución, antes de que se lleve a cabo la reacción, es decir los moles iniciales de 𝐾𝑀𝑛𝑂4 (Ver Memoria de cálculo), en este caso se obtiene que los moles iniciales de 𝐾𝑀𝑛𝑂4 son 2 × 10−5 . Posteriormente se obtienen los moles restantes de 𝐾𝑀𝑛𝑂4 después de la reacción química con el oxalato, estos se encuentran mediante la curva de calibración, pues de la línea recta de tendencia se obtiene la ecuación de la recta (Ver Figura 1), donde 𝑦 = 𝐴𝑏𝑠 y 𝑥 = 𝑐𝑜𝑛𝑐𝑒𝑛𝑡𝑟𝑎𝑐𝑖ó𝑛 𝑑𝑒𝑙 𝑝𝑒𝑟𝑚𝑎𝑛𝑔𝑎𝑛𝑎𝑡𝑜, de esta ecuación se despeja la concentración y se transforma a moles (Ver Memoria de cálculo), teniendo así en la solución 1.859 × 10−5 moles que quedaron en la solución de 𝐾𝑀𝑛𝑂4 , es decir aquello que no reaccionó. Finalmente se calculan los moles de 6 𝐾𝑀𝑛𝑂4 que reaccionaron a partir de los moles iniciales y los moles en solución de 𝐾𝑀𝑛𝑂4 (Ver Memoria de cálculo). De esta manera, conociendo los moles reaccionantes de permanganato de potasio y con la estequiometría de la reacción, es posible calcular el número de moles de oxalato que reaccionaron (Ver Memoria de cálculo). Los moles obtenidos por dicha estequiometría corresponden a los moles de oxalato en la muestra problema que se tomó inicialmente, a partir de lo cuales se puede obtener la concentración experimental del oxalato desconocido. Dado que el oxalato no se puede calcular con la absorbancia, a partir de la concentración obtenida, se calculó el producto de solubilidad con estequiometria para varios tipos de oxalatos y así determinar el oxalato usado, no obstante el producto de solubilidad del oxalato de sodio es de aproximadamente 3.7 g/L a comparación de el producto de solubilidad experimental obtenida de 0.5244 g/L. Se obtuvo que se trataba de un oxalato 𝑋2 𝐶2 𝑂4 más específicamente del oxalato de sodio anhidro 𝑁𝑎2 𝐶2 𝑂4 . En las disoluciones de permanganato de potasio, se disuelve el oxalato en una disolución de ácido sulfúrico y con permanganato de potasio. En medio ácido la oxidación se puede describir en términos del ácido oxálico: Debido a que en la oxidación de cada molécula de ácido oxálico intervienen dos electrones, el peso equivalente es igual a la mitad del peso fórmula. La reacción total del ion permanganato con el ácido oxálico se puede conocer con tan solo los valores de potencial estándar de los reactivos: Al añadir el ion permanganato a una solución de ácido oxálico, se da una coloración rosa que persiste durante un tiempo, indicando que se trata de una reacción lenta. Al continuar la titulación, la decoloración se vuelve mucho más rápida, debido al ion manganeso (II) que se forma por la reducción del permanganato, catalizando la reacción. En las cercanías del punto final, la decoloración es prácticamente instantánea. La velocidad de reacción puede incrementarse por calentamiento de la solución, como se realizó con el baño maria. Sin embargo, a una temperatura muy alta, en un medio ácido fuerte, el ácido oxálico se descompone de la siguiente manera: V. Conclusiones Con las técnicas espectrofotométricas se logró determinar que la muestra se trató de un oxalato de sodio anhidro 𝑁𝑎2 𝐶2 𝑂4 dado que el 𝐾𝑝𝑠 experimental fue de 2.39 × 10−7, muy similar al valor teórico del 𝐾𝑝𝑠 que correspondía a 2.5 × 10−7 . También se 𝐿 obtuvo la absortividad (1713 𝑚𝑜𝑙⋅𝑐𝑚−1 ) mediante una curva de calibración, y mediante estequiometría se determinó la concentración de la muestra problema de oxalato, cuyo valor fue 3.91 × 10−3 M. 7 VI. Referencias oxalato de sodio cuya fórmula Na2C2O4 - Brainly.lat recuperado el 23 de mayo de 2023 (PDF) VALORACION DE PERMANGANATO CON OXALATO SODICO | Yisell D Academia.edu recuperado el 23 de mayo de 2023 Daniel C. Harris, Análisis Químico Cuantitativo 2ª edición, Ed. Reverte. Capítulo 13 Brown, T. (2004). Química, la ciencia central (novena edición). Naucalpan, México: Prentice Hall Skoog D.A y West D.A. “Fundamentos de la química Analítica”, 8va edición. Ed Thomson, México (2006). VII. Memoria de cálculo ● Cálculo de absortividad molar En base a la figura 1 (curva de calibración), se pudo determinar la siguiente ecuación de la recta: 𝑦 = 1713𝑥 + 0.0881, de la forma 𝑦 = 𝑚𝑥 + 𝑏, si se conoce la pendiente de la gráfica (m) y se sabe que la relación de este valor con la absortividad molar es 𝑚 = 𝜀𝑏, donde 𝜀 es la absortividad molar y 𝑏 es la longitud de la celda (en este caso, 1 cm), se puede despejar la ecuación de la siguiente manera: 𝑚 = 𝜀𝑏 → 𝜀 = 𝜀= 𝑚 𝑏 1713 𝐿 = 1713 1 𝑚𝑜𝑙 ⋅ 𝑐𝑚−1 8 9 10