- Ninguna Categoria
Química General: Apuntes de Laboratorio - Universidad de Lima
Anuncio
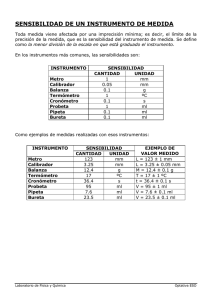
FACULTAD DE INGENIERÍA CARRERA DE INGENIERÍA INDUSTRIAL ASIGNATURA: QUÍMICA GENERAL APUNTES DE LABORATORIO Profesores de la asignatura: Este material de apoyo académico se hace para uso exclusivo de los alumnos de la Universidad de Lima y en concordancia con lo dispuesto por la legislación sobre los derechos del autor: Decreto legislativo 822 Agosto de 2023 Facultad de Ingeniería Carrera de Ingeniería Industrial Laboratorio de Química General NORMAS DE SEGURIDAD EN EL LABORATORIO Cuando se trabaja en un laboratorio existe el peligro potencial de un ACCIDENTE, en virtud de las sustancias y materiales que se utilizan, y la posibilidad de cometer algún error al realizar un experimento. SUSTANCIA PELIGROSA O DISPOSITIVO DE LABORATORIO + ERROR HUMANO = ACCIDENTE En la siguiente Figura se presenta algunos pictogramas de seguridad: Tóxico Inflamable Corrosivo Explosivo irritante Nocivo Peligroso al me dio ambiente Comburente Etiqueta de sustancias químicas (SQ) Fuente: ALMACENAMIENTO Y MANEJO DE REACTIVOS Y PRODUCTOS QUIMICOS LUZ MARINA RAMÍREZ DÍAZ IBLAB LTDA. IVONNE BERNIER LABORATORIO LTDA. WWW.IBLABORATORIO.COM. BOGOTÁ. COLOMBIA. MARZO DE 2005. Fuente: MANEJO DE SUSTANCIAS QUÍMICAS. CENTRO NACIONAL DE PROD LIMPIA Y TECNOLOGÍAS AMBIENTALES. Colombia UCCIÓN MÁS Es por ello, cuando se trabaja en el laboratorio, debe tenerse presente una serie de normas o reglas que se deben cumplir para disminuir y en algunos casos evitar los accidentes. Primera norma para empezar a trabajar: EL LUGAR DE TRABAJO DEBE ESTAR EN ORDEN 1) INDICACIONES: Siga todas las indicaciones que le ha proporcionado el profesor en materia de seguridad en el laboratorio y use los implementos de seguridad como mandil de algodón, guantes, lentes contra sustancias químicas y en caso de ser necesario, máscaras contra vapores ácidos y orgánicos. Implementos necesarios para iniciar una práctica de laboratorio 2) ESTUDIE CADA EXPERIENCIA ANTES DE CLASE Este procedimiento no sólo le ahorrará tiempo, sino que evitará errores y accidentes. Leer Procedimiento Experimental. 3) SEGURIDAD DE SUS COMPAÑEROS Considere la seguridad de sus compañeros. El laboratorio es un lugar para trabajar con seriedad. 4) COMUNICAR LOS ACCIDENTES Al profesor, asistente o ayudante de laboratorio. 5) VERTIDO DE SUSTANCIAS Proceda siempre con precaución cuando transfiera sustancias de sus recipientes. Si algo se derramara notifique al profesor, asistente o ayudante de laboratorio, de manera que puedan aplicarse los procedimientos de limpieza adecuados. 6) CALENTAMIENTO DE TUBOS DE ENSAYO Utilizar pinza para tubos de madera o metálicos, en el trabajo de laboratorio que involucra el calentamiento de tubos de ensayo, no debe mirarse el interior del mismo mientras se le calienta ni tampoco la boca del tubo debe estar orientada hacia algún compañero. 7) CALENTAMIENTO DE LIQUIDOS EN TUBOS DE ENSAYO Utilizar pinza para tubos de madera o metálicos, cuando calienta líquidos en un tubo de ensayo, debe hacerse partiendo de las zonas superiores hacia abajo. El vapor que asciende, al encontrarse con la capa de líquido situada por encima de él, puede causar proyecciones del contenido del tubo hacia el exterior. 8) OLOR DE LAS SUSTANCIAS GASEOSAS Investigar el olor de las sustancias gaseosas moviendo lentamente la mano y aspirando con precaución. 9) LIQUIDOS VOLATILES Cuando se está trabajando con líquidos volátiles inflamables, hay que tener cuidado de que no haya fuego cerca, generalmente si el mechero está encendido o se está usando el chispero. Ejemplo la solución de fenolftaleína 0,02% que está preparada en alcohol metílico. 10) RECIPIENTES CON GRANDES VOLUMENES DE SUSTANCIAS PELIGROSAS En cualquier recipiente donde se encuentran grandes volúmenes de sustancias químicas peligrosas como ácidos y álcalis, debe ser manipulado por el profesor, asistente o ayudante de laboratorio. Use los dosificadores de acuerdo a las indicaciones del profesor. Ejemplo: ácido clorhídrico, ácido nítrico, hidróxido de amonio, bromo en tetracloruro, etc. 11) PREPARACION DE ACIDOS DILUIDOS Nunca agregue agua sobre un ácido concentrado. Si es necesario preparar un ácido diluido, debe agregarse siempre el ácido concentrado, en pequeñas cantidades, sobre el agua y agitar permanentemente. Ejemplo: preparación de una solución de ácido clorhídrico 0,1 M. 12) SUSTANCIAS CORROSIVAS Manipule las sustancias corrosivas con máximo cuidado, es necesario emplear guantes apropiados y espátulas. Ejemplo: pesar granallas de hidróxido de sodio. 13) TRABAJO CON VIDRIO Tener cuidado para evitar cortaduras y cuando esté acodando vidrio dejar que el material se enfríe antes de cualquier manipulación posterior. 14) TAPONES DE GOMA CON MATERIAL QUEBRADIZO No forzar nunca hacia adentro o afuera los tapones de goma,, de los tubos de vidrio, ¿termómetros? o de cualquier otro material que se pueda quebrar. La glicerina o el detergente facilitan la tarea de quitar dichos tapones. Ejemplo: tapones trioharadados en balones. 15) NUNCA COMER, BEBER O FUMAR Nunca comer (o apoyar comida sobre la mesa), beber, fumar, en el laboratorio, ya que puede sufrir riesgo de ingestión de sustancias peligrosas o causar accidentes. 16) VENTILACION Se debe trabajar siempre en un lugar bien ventilado. 17) ACCESO AL LABORATORIO La puerta de acceso al laboratorio debe abrirse hacia afuera. 18) NO MANIPULAR EL CELULAR La distracción a consecuencia del uso del celular durante las prácticas de laboratorio puede provocar accidentes a la vez de distraer la atención de sus compañeros. 19) PELO LARGO Deberá tener el pelo recogido para evitar quemaduras con la llama del mechero y otros accidentes. 20) SISTEMAS CERRADOS Siempre que haya reacciones con desprendimiento de gases y vapores, la instalación del sistema deberá permitir la salida de los mismos, por lo que no debe ser cerrado. “Nunca quitar la abrazadera de las mangueras de los mecheros”. 21) ARMADO DE EQUIPOS Usar soportes cuya base permita que el ensamble se apoye apropiadamente en la mesa. Vigilar continuamente los aparatos con centro de gravedad alto. 22) PRIMEROS AUXILIOS Dispone usted de botiquín de primeros auxilios, y sistema lava ojos en cada mesa del laboratorio de Química (color rojo), debiendo de conocer los pasos a seguir en caso de un accidente llamando luego a un especialista. También dispone de una ducha externa (color rojo) a los ambientes hacia las escaleras centrales. 23) CALZADO ADECUADO No usar calzado que sea descubierto como sandalias para evitar riesgos ante derrame de reactivos o por materiales pesados que puedan caer. Solicitar una bolsa para protección. 7 FACULTAD DE INGENIERÍA Y ARQUITECTURA CARRERA DE INGENIERIA INDUSTRIAL ASIGNATURA: QUÍMICA GENERAL Guía de Laboratorio 1 RECONOCIMIENTO Y MANEJO DE MATERIALES DE LABORATORIO IMPORTANTE: Debe estudiar esta guía y realizar el visionado del video antes de asistir al laboratorio. El video se encuentra disponible en la carpeta “material del curso” en dos versiones idénticas con diferente resolución (360p y 720p) para su conveniencia. 1. OBJETIVOS • Reconocer los materiales e instrumentos de laboratorio de uso frecuente. • Aprender a medir volúmenes de líquidos y a manejar correctamente la balanza y el termómetro. • Aprender a usar el mechero Bunsen, identificando los tipos de llamas que se producen en él. 2. MARCO TEÓRICO 2.1. Descripción de los materiales de laboratorio. a) Buretas: Cilindros graduados de vidrio, alargados, que terminan en una llave a través de la cual sale el líquido que contienen. Se emplea para medir el gasto de volúmenes con exactitud, como los que se realizan en el análisis volumétrico cuantitativo (titulaciones). Las más comunes tienen graduaciones en 0,10 mL, de modo que se pueda medir hasta 0,05 mL. 8 b) Pipetas: Son aparatos de vidrio destinados a medir el volumen de líquidos, ya sea en operaciones rutinarias o en aquellas que requieren una mayor exactitud. Se cuenta con pipetas volumétricas, de diferentes capacidades que se usan para transferir un volumen definido de líquido y pipetas graduadas de diferentes capacidades que se utilizan para dosificar un volumen determinado. c) Probetas: Son cilindros graduados, con pico en la parte superior y con una base. Se emplean para medir volúmenes de líquidos en forma aproximada y las hay de diferentes capacidades. 9 d) Fiola o matraz volumétrico: Se utiliza para preparar soluciones de volumen exacto, cuya capacidad está especificado en la parte inferior. Existen fiolas de 50 mL, 100, 250 mL, etc. En el cuello de la fiola se encuentra grabada la línea de aforo. Este material no se utiliza para medir volúmenes parciales ya que no tienen graduación. e) Matraz Erlenmeyer Son recipientes de vidrio cónicos, empleados para calentar líquidos cuando y se usa frecuentemente en las titulaciones para determinar concentraciones exactas de sustancias ácidas, básicas, o agentes oxidantes o reductores. f) Termómetros Son instrumentos destinados a medir temperatura en la escala Celsius. Sobre la superficie del vidrio se encuentra una escala graduada y dentro del material de vidrio se encuentra el mercurio líquido. Los termómetros son de diferentes rangos y graduaciones. Cuanto menor es la graduación mayor será la precisión de la lectura. Se emplean para determinar la temperatura ambiental, la temperatura de fusión, temperatura de ebullición, etc. 10 g) Mecheros Son aparatos utilizados como fuente de calor para diversas operaciones. Funcionan quemando un combustible con un comburente (aire) y produciendo la llama correspondiente. El gas se quema combinándose con el oxígeno del aire generando así una llama; el más utilizado en el laboratorio es el mechero Bunsen, que en esencia consta de un tubo metálico por donde se conduce el gas, y un anillo que se hace girar para controlar el ingreso de aire necesario para la combustión. h) Tubos de ensayo: Los tubos de ensayo se emplean con mucha frecuencia en trabajos de laboratorio, ensayos físicos o químicos cuando se manipulan pequeñas cantidades de sustancias. Son de diferentes formas y capacidades, una de las principales características es su calidad termo resistente, es decir, su resistencia al calentamiento y a los cambios bruscos de temperatura. i) Vaso de precipitado (beaker): Recipientes cilíndricos que poseen una mayor escala graduada o aforo que permite medir volúmenes aproximados. Construido de vidrio, es el recipiente más utilizado en el laboratorio. Pueden usarse para calentar o pesar líquidos. 11 j) Piseta (frasco lavador) Recipiente de plástico, útil para contener agua destilada o disoluciones que no reaccionen con el material del cual está construido. Presionando ligeramente con los dedos en forma de pinza, se controla con facilidad el caudal de salida. El frasco sólo debe abrirse para llenarse. k) Gradilla de tubos Es una pieza metálica o de madera con orificios en los cuales pueden soportarse los tubos de ensayos. l) Balanza Es un instrumento que se usa para medir la masa de varios objetos. Existen diferentes tipos de balanzas. La figura muestra una balanza analítica digital de gran precisión. Medición de volúmenes Los líquidos tienden a formar superficies curvadas llamadas meniscos. Se presentan meniscos cóncavos (agua, soluciones acuosas) y en algunos casos meniscos convexos (mercurio). Para determinar correctamente el volumen medido con cualquiera de los recipientes descritos, es necesario que el enrase sea el adecuado, tal como se observa en la figura adjunta. Enrasar significa que la zona más baja del menisco coincida con la marca en el recipiente 12 FACULTAD DE INGENIERÍA Y ARQUITECTURA CARRERA DE INGENIERIA INDUSTRIAL ASIGNATURA: QUÍMICA GENERAL 3. PARTE EXPERIMENTAL 3.1. COMBUSTIÓN La combustión es una reacción de oxidación, y es la fuente principal de energía. En un laboratorio se utiliza el mechero para obtener esta energía calorífica, por ello es conveniente que se conozca su funcionamiento y los tipos de llama que produce. La llama representa el producto generado por la combustión, la misma que está compuesta por los gases y vapores a altas temperaturas que se producen por la combustión. De acuerdo con la cantidad de oxígeno (elemento comburente que está presente en el aire) con el cual se quema un hidrocarburo (combustible), se puede producir dos tipos de llama, que caracterizan a dos tipos de combustión respectivamente: a) COMBUSTION INCOMPLETA, origina la llama LUMINOSA que libera monóxido de carbono, dióxido de carbono y partículas sólidas que se vuelven incandescentes a altas temperaturas. Para la combustión del gas metano (CH4) se tienen, a manera de ejemplo, las siguientes reacciones: CH4(g) + 3/2 O2(g) → CO(g) + 2 H2O(g) CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(g) b) COMBUSTION COMPLETA, produce la llama NO LUMINOSA o “Llama Calorífica” que es la que se utiliza en los trabajos de laboratorio. Esta llama presenta un cono interno de color azul verdoso brillante donde se producen las reacciones necesarias para la combustión, que es la zona REDUCTORA, y un cono externo de color azul pálido, que está constituido por los productos de la combustión: CO2(g) y H2O(g). Esta zona se denomina zona OXIDANTE y tiene un exceso de oxígeno del aire y presenta la más alta temperatura. Para la combustión del gas butano (C4H10) se tiene la siguiente reacción: 2 C4H10 (g) + 13 O2 (g) → 8 CO2(g) + 10 H2O(g) 4. MATERIALES Y REACTIVOS Los materiales de laboratorio a ser empleados son: • • • • • • • Guantes de neopreno. Piseta de 500 mL con agua destilada. Pinza para vaso de 250 mL. Fiola de 100 mL. Probeta graduada de 100 mL. Vaso de precipitado de 250 mL. Vaso de precipitado de 100 mL 13 • • • • • • • • • • • • Matraz Erlenmeyer de 250 mL. Bureta manual. Bureta automática. Balanza analítica de precisión 0,1 g. Balanza analítica de precisión 0,01 g. Balanza analítica de precisión 0,0001 g. Calibrador digital. Mechero con trípode y malla metálica con dispersor de calor. Termómetro digital. Muestra metálica. Mechero bunsen. Malla metálica. 5. PROCEDIMIENTO EXPERIMENTAL 5.1. Estudio de los Materiales de Laboratorio 5.1.1. Reconocimiento de los instrumentos de vidrio para medición de volumen Completar el cuadro en la hoja de registro de datos indicando la capacidad, graduación y precisión de los distintos materiales de vidrio para la medición de volumen. 5.1.2. Fiola - Probeta - Vaso de Precipitado - Piseta Usted va a comparar la exactitud y precisión de los diversos materiales de laboratorio. a) Colocar una cierta cantidad de agua destilada dentro de una fiola de 100 mL de capacidad y luego con ayuda de la piseta, seguir agregando agua hasta la línea de aforo o enrase (marca que se encuentra en el cuello de la fiola). b) Trasvasar el agua de la fiola a la probeta de 100 mL de capacidad. Anotar el volumen obtenido. Comentar. Cuidar de no mojar mucho las paredes de la probeta. c) Trasvasar el agua de la probeta al vaso de precipitado de 250 mL de capacidad. Anotar el volumen experimental obtenido. Anote sus observaciones. 5.1.3. Bureta – Erlenmeyer Bureta Automática d) Llenar la bureta con agua hasta por encima de la marca cero, para ello es necesario presionar el recipiente plástico acoplada a la bureta automática, sobrepasando ligeramente la marca del cero y dejar de presionar el recipiente de plástico, momento en el cual la bureta quedará automáticamente enrasada (es decir, el menisco quedará sobre la marca de cero). e) Trasvasar hacia un matraz Erlenmeyer: 7,00; 12,50; 18,20; 22,60 y 32,80 mL de agua. En cada medición, usted debería desplazar el menisco sin necesidad de llenar nuevamente la bureta. Química General Página 14 5.1.4. Bureta Manual o Convencional (No será utilizada en este laboratorio) Química General Página 15 5.1.5. Operación de la balanza y determinación de la densidad de una muestra metálica Realice las siguientes mediciones utilizando una muestra metálica: a) Atender las indicaciones del profesor con referencia a cómo se enciende y se usan las balanzas. Proceder a pesar la muestra metálica en cada una de las tres balanzas, para ello, se coloca la muestra metálica sobre el plato de una balanza con mucho cuidado y dar lectura de la masa del metal cuando este valor sea estable. b) Proceder a hacer las pesadas de la misma manera en las otras balanzas hasta que la lectura sea estable y anotar su valor. c) Utilizando el calibrador digital determine el volumen de la muestra metálica correspondiente a su mesa. Aplique correctamente el número de cifras significativas. d) Con los datos obtenidos en b y en c calcule la densidad de su muestra. 6.1 Estudio del Mechero (no usar guantes en esta experiencia) 6.1.1. TIPO DE LLAMA a) Esquematice al mechero, identificando, la entrada del gas combustible, la válvula reguladora del aire y la boquilla. b) Con la válvula reguladora de aire cerrada, encienda un fósforo coloque en la boquilla del mechero y abra completamente la llave del gas. • ¿Qué tipo de llama obtuvo? • ¿Cuáles son las características de esta llama? • Abra gradualmente la válvula reguladora del aire y observe los cambios. Anote sus observaciones.: • ¿Qué tipo de llama obtuvo? • ¿Cuáles son las características de esta llama? 6.1.2. ZONA CALIENTE Y ZONA FRIA DE LA LLAMA NO LUMINOSA a) Con ayuda de una pinza, sujete de un extremo la malla metálica y colóquela en la parte superior de la llama por 30 segundos. Observe el color de la rejilla, lo que le ayudará a detectar la zona más caliente de la llama. b) Sin retirar la rejilla, repetir la experiencia en la parte media e inferior de la llama para lo cual descenderá lentamente la rejilla. Observe la forma de la zona más caliente ¿qué indica esto? 6.1.3. TEMPERATURA APROXIMADA ALCANZADA a) Tomar el alambre de cobre de menor de diámetro y someterlo a calentamiento en la zona más caliente de la llama No luminosa (determinada en la experiencia anterior) por 10 segundos. b) El alambre de cobre ¿se funde?, y si es así esto significará que la temperatura de la llama que se alcanza en ese momento es como mínimo de 1085 ºC. c) Observar si el color de la llama varía durante el calentamiento del alambre de cobre. Química General Página 16 d) Calentar por 20 segundos la malla metálica en la zona más caliente de la llama y observe el color del metal. La estimación de la temperatura máxima alcanzada la puede realizar de acuerdo con la siguiente información: Rojo oscuro Anaranjado Blanco 6.1.4. a) b) 500 a 650 ºC Rojo cereza 750 a 900 ºC Amarillo 1100º C o más 650 a 750 ºC 900 a 1100 ºC ZONAS: REDUCTORA Y OXIDANTE Calentar un alambre de cobre de 2 mm de diámetro, sosteniéndolo por un extremo (cubierto de plástico), atravesando simultáneamente los dos conos de la llama (el externo y el interno), por un minuto aproximadamente. Observar el color del metal al final de la experiencia e indique si se ha producido una oxidación o reducción, o no se ha producido cambio alguno. Nota: Si hay oxidación, la superficie del cobre variará de colores (azul, rojo, verde, etc.) y si hay reducción, este color desaparecerá o el color natural del cobre no variará. 7.1. Uso del termómetro digital 7.1.1 Medición de temperatura a) Medir la temperatura del ambiente, encienda el termómetro digital y sujételo por el mango, cuando la temperatura mostrada sea estable registre dicho valor. b) Medir la temperatura del agua del caño, para lo cual deberá abrir la llave de agua y colocar el extremo del termómetro en contacto con el chorro de agua. Registre la temperatura cuando ésta sea estable. c) d) En un vaso de precipitado de 100 mL, colocar 60 mL de agua del caño y registre la temperatura. Caliente el vaso de precipitado con agua utilizando la rejilla con el elemento difusor de calor, un trípode y el mechero con la llama no luminosa. Registre la temperatura de ebullición. 5. BIBLIOGRAFIA complementaria con acceso digital disponible a través de la página web de la biblioteca (ingreso con contraseña ULima). 1. Rodríguez, J. (2018). Laboratorio de química: Servicios auxiliares y operaciones unitarias. Cano Pina. https://www.digitaliapublishing.com/a/103161. 2. Müller Carrera, G., Llano Lomas, M., & Garcia Ortega, H. (2008). Laboratorio de química general. Editorial Reverte. https://www.digitaliapublishing.com/a/103259 Química General Página 17
Anuncio
Documentos relacionados
Descargar
Anuncio
Añadir este documento a la recogida (s)
Puede agregar este documento a su colección de estudio (s)
Iniciar sesión Disponible sólo para usuarios autorizadosAñadir a este documento guardado
Puede agregar este documento a su lista guardada
Iniciar sesión Disponible sólo para usuarios autorizados