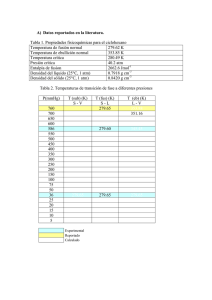
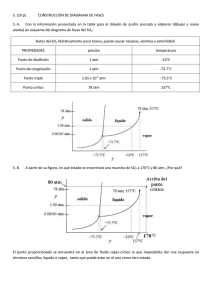
PRIMERA PRUEBA DE TERMODINÁMICA Profesora: Rosa Santoro 26 de Noviembre del 2015 Problema 1 Se cuenta con un dispositivo compuesto de un cilindro hermético con émbolo móvil que se desliza verticalmente sin roce. En su interior existen 100 g de CO2 (PM =44 g/mol; Cp=0,9 kJ/kg K) que ocupa un volumen de 10 L a la presión de 1 atm. Inicialmente se impide el desplazamiento del émbolo mediante el uso de topes y el gas es sometido a un calentamiento hasta una temperatura de 300 K. Una vez finalizado el proceso anterior, el recipiente es revestido con un material aislante que impide todo intercambio de calor con el exterior y el sistema es comprimido hasta alcanzar un volumen de 2 L. Luego, el material aislante es retirado y se impide nuevamente el desplazamiento del émbolo, permitiendo al sistema enfriarse. Finalmente, el gas es expandido isotérmicamente hasta las condiciones iniciales. Determine: a) El trabajo realizado en cada proceso b) La variación de la energía interna de cada proceso c) La transferencia de calor en cada etapa del ciclo Desarrollo Obtener los moles de CO2 𝑛= 𝑚 100𝑔 = = 2.272 𝑚𝑜𝑙 𝑃𝑀 44 𝑔 𝑚𝑜𝑙 (1 punto) Luego, obtener el calor específico a volumen constante 𝐶𝑣 = 𝐶𝑝 − 𝑅 𝐶𝑝 = 0,9 𝑘𝐽 𝑘𝑔 𝐽 44 = 39,609 𝑘𝑔 𝐾 𝑘𝑚𝑜𝑙 𝑚𝑜𝑙 𝐾 𝐶𝑣 = 39,609 𝐽 𝐽 𝐽 − 8,315 = 31,294 𝑚𝑜𝑙 𝐾 𝑚𝑜𝑙 𝐾 𝑚𝑜𝑙 𝐾 (2 puntos) Luego, para las condiciones iniciales, es posible obtener la temperatura inicial 𝑇1 = 𝑃1 𝑉1 1𝑎𝑡𝑚 10𝐿 = = 53,63𝐾 = −219,52°𝐶 𝐿 𝑎𝑡𝑚 𝑛𝑅 2,272𝑚𝑜𝑙 0,08206 𝑚𝑜𝑙 𝐾 Luego, del estado 1 al estado 2 calentamiento a volumen constante hasta alcanzar una temperatura de 300K. Así: 𝑃2 = 𝑃1 𝑇2 1𝑎𝑡𝑚 300𝐾 = = 5,59 𝑎𝑡𝑚 𝑇1 53,63𝐾 Además: 𝑉2 = 𝑉1 = 10𝐿 Luego, desde el estado 2 al estado 3 una compresión adiabática hasta alcanzar un volumen de 2 L. Así: 𝛾 𝑃3 = 𝑃2 𝑉2 𝛾 𝑉3 = 5,59 101,266 = 42,914 𝑎𝑡𝑚 21,266 𝛾−1 1−𝛾 𝑉3 𝑇3 = 𝑇2 𝑉2 = 300𝐾(10𝐿)0,266 (2𝐿)−0,266 = 460,31𝐾 = 187,16°𝐶 Luego, desde el estado 3 al estado 4 se enfría a volumen constante 𝑉3 = 𝑉4 = 2 𝐿 Finalmente, desde el estado 4 regresa nuevamente al estado inicial mediante una expansión isotérmica. 𝑇4 = 𝑇1 = 53,63 𝐾 𝑃4 = 𝑃1 𝑉1 1𝑎𝑡𝑚 10𝐿 = = 5 𝑎𝑡𝑚 𝑉4 2𝐿 (5 puntos) Variable Presión Volumen Temperatura Estado 1 1 atm 10 L 53,63 K Para la primera etapa: 𝑊1 = 0 𝐽 ∆𝑈1 = 𝑛𝐶𝑣(𝑇2 − 𝑇1 ) = 17519 𝐽 𝑄1 = ∆𝑈1 (4 puntos) Para la segunda etapa: Estado 2 5,59 atm 10 L 300 K Estado 3 42,914 atm 2L 460,31 K Estado 4 5 atm 2L 53,63 K 𝑄2 = 0 𝐽 ∆𝑈2 = 𝑛𝐶𝑣(𝑇3 − 𝑇2 ) = 11400 𝐽 𝛾−1 𝛾 𝑛𝑅𝑇2 𝑃3 𝑊2 = [( ) 𝛾 − 1 𝑃2 − 1] = 11400 𝐽 (4 puntos) Para la tercera etapa 𝑊3 = 0 𝐽 ∆𝑈3 = 𝑛𝐶𝑣(𝑇4 − 𝑇3 ) = −28918 𝐽 𝑄1 = ∆𝑈1 (4 puntos) Para la última etapa ∆𝑈4 = 0 𝐽 𝑉1 𝑊4 = 𝑛𝑅𝑇4 ln ( ) = 1631 𝐽 𝑉4 𝑄4 = 𝑊4 = 1631 𝐽 (4 puntos) Problema 2 10 gramos de gas ideal (aire) están inicialmente a 25°C y 1 atm de presión, la cual se comprime y se calienta en forma simultánea hasta alcanzar una presión de 6160 mm Hg y 300 °C. Considere que la capacidad calorífica molar a volumen constante es de 2,986 (cal/mol K). Determinar: a) La variación de energía interna en Joules b) La variación de entalpía en Joules c) Si el sistema recibiera un calor equivalente a 50 kJ, ¿Cuál es el valor del trabajo? Desarrollo Datos 𝑇1 = 298 𝐾 𝑇2 = 573 𝐾 𝑃1 = 1 𝑎𝑡𝑚 𝑃2 = 8,105 𝑎𝑡𝑚 ∆𝑈 = 𝑛 𝑐𝑣 (𝑇2 − 𝑇1 ) = 1186 𝐽 𝑐𝑝 − 𝑐𝑣 = 𝑅 ∆𝐻 = 𝑛 𝑐𝑝 (𝑇2 − 𝑇1 ) = 1974 𝐽 Ahora, con un Q = 50.000 J, aplicando la primera ley de la termodinámica: 𝑄 − 𝑊 = ∆𝑈 𝑊 = 48.814 𝐽 Por lo tanto, es un trabajo que sale del sistema. Problema 3 Un mol de gas ideal en que Cp=5/2 R y Cv=3/2 R cambia desde una presión 1 atm y 10 m3 hasta una presión de 10 atm y 1 m3, mediante los siguientes procesos mecánicamente reversibles: a) b) c) d) Compresión isotérmica Compresión adiabática seguida de un enfriamiento a volumen constante Enfriamiento a presión constante seguido de un calentamiento a volumen constante Explique el primer principio de la termodinámica para un sistema cerrado. Indique que representa cada término Determinar para cada caso W, Q, ΔU y ΔH para cada proceso. Desarrollo a) Isotérmico 𝑃1 𝑉1 = 𝑛 𝑅 𝑇1 𝑇1 = 121.862 𝐾 = 𝑇2 Para un proceso isotérmico ∆𝐻 = ∆𝑈 = 0 𝐽 𝑉2 𝑊 = 𝑃1 𝑉1 ln ( ) = −2.333 ∙ 106 𝐽 𝑉1 𝑄 = −2.333 ∙ 106 𝐽 b) Adiabático – Isocórico Para el estado intermedio: 𝑉2 = 1 𝑚3 𝑃1 𝑉11.667 = 𝑃2 𝑉21.667 𝑃2 = 46,45 𝑎𝑡𝑚 𝑇1 𝑉11.667−1 = 𝑇2 𝑉21.667−1 𝑇2 = 566.068 𝐾 Para el estado final 𝑃2 𝑃3 = 𝑇2 𝑇3 𝑇3 = 121.862 𝐾 y se mantienen las condiciones finales de presión y volumen Para el proceso adiabático: 𝑄 =0𝐽 ∆𝑈 = 𝑛 𝐶𝑣 (𝑇2 − 𝑇1 ) = 5,54 ∙ 106 𝐽 ∆𝐻 = 𝑛 𝐶𝑝 (𝑇2 − 𝑇1 ) = 9,23 ∙ 106 𝐽 𝑊= 𝑃1 𝑉1 𝑉1 𝛾−1 [1 − ( ) ] = −5,54 ∙ 106 𝐽 𝛾−1 𝑉2 Para el proceso isocórico 𝑊 =0𝐽 ∆𝑈 = 𝑛 𝐶𝑣 (𝑇3 − 𝑇2 ) = −5,54 ∙ 106 𝐽 ∆𝐻 = 𝑛 𝐶𝑝 (𝑇3 − 𝑇2 ) = −9,23 ∙ 106 𝐽 𝑄 = ∆𝑈 = −5,54 ∙ 106 𝐽 𝑄𝑛𝑒𝑡𝑜 = 𝑄𝑎𝑑𝑖𝑎𝑏á𝑡𝑖𝑐𝑜 + 𝑄𝑖𝑠𝑜𝑐ó𝑟𝑖𝑐𝑜 = −5,54 ∙ 106 𝐽 𝑊𝑛𝑒𝑡𝑜 = 𝑊𝑎𝑑𝑖𝑎𝑏á𝑡𝑖𝑐𝑜 + 𝑊𝑖𝑠𝑜𝑐ó𝑟𝑖𝑐𝑜 = −5,54 ∙ 106 𝐽 c) Isobárico – Isocórico Para el estado intermedio 𝑃2 = 𝑃1 = 1 𝑎𝑡𝑚 𝑉2 = 𝑉3 = 1 𝑚3 𝑇2 = 𝑃2 ∙ 𝑉2 = 12.186 𝐾 𝑛∙𝑅 Luego, para el proceso isobárico: 𝑊 = 𝑃1 (𝑉2 − 𝑉1 ) = −9,12 ∙ 105 𝐽 ∆𝐻 = 𝑛 𝑐𝑝 (𝑇2 − 𝑇1 ) = −2,28 ∙ 106 𝐽 = 𝑄 ∆𝑈 = 𝑛 𝑐𝑣 (𝑇2 − 𝑇1 ) = −1,37 ∙ 106 𝐽 Finalmente para el proceso Isocórico: 𝑊 =0𝐽 ∆𝐻 = 𝑛 𝑐𝑝 (𝑇2 − 𝑇1 ) = 2,28 ∙ 106 𝐽 ∆𝑈 = 𝑛 𝑐𝑣 (𝑇2 − 𝑇1 ) = 1,37 ∙ 106 𝐽 = 𝑄 𝑄𝑛𝑒𝑡𝑜 = 𝑄𝑖𝑠𝑜𝑏𝑎𝑟𝑖𝑐𝑜 + 𝑄𝑖𝑠𝑜𝑐ó𝑟𝑖𝑐𝑜 = −0,91 ∙ 106 𝐽 𝑊𝑛𝑒𝑡𝑜 = 𝑊𝑖𝑠𝑜𝑏𝑎𝑟𝑖𝑐𝑜 + 𝑊𝑖𝑠𝑜𝑐𝑜𝑟𝑖𝑐𝑜 = −9,12 ∙ 105 𝐽