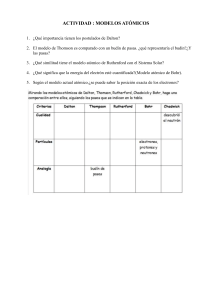
Aquí hay algunas preguntas de opción múltiple sobre las normas de seguridad en el laboratorio: ¿Cuáles son los elementos de seguridad que se deben conocer antes de empezar a trabajar en un laboratorio? a) La ubicación de los muebles del laboratorio b) La ubicación de las entradas y salidas c) La ubicación de los baños ¿Qué elementos de protección personal se deben utilizar en el laboratorio? a) Gafas de sol y pantalones cortos b) Guantes de jardín y sandalias c) Gafas de seguridad y guardapolvo ¿Por qué razón es importante recoger el cabello largo antes de trabajar en el laboratorio? a) Porque el cabello puede obstruir el equipo de laboratorio b) Para evitar la acumulación de productos químicos en el cabello c) Para evitar el contacto accidental del cabello con productos químicos peligrosos ¿Por qué es peligroso dejar mochilas, abrigos o bolsos en la mesada del laboratorio? a) Porque pueden ser robados por otros estudiantes b) Porque pueden interferir con el trabajo de otros estudiantes c) Porque pueden contener objetos peligrosos para el laboratorio ¿Está permitido fumar o consumir alimentos o bebidas en el laboratorio? a) Sí, siempre y cuando no se haga cerca de los productos químicos b) No, está estrictamente prohibido c) Solo si se pide permiso al profesor ¿Por qué no se debe llevar a la boca ningún producto químico para conocer su sabor? a) Porque los productos químicos pueden ser tóxicos b) Porque los productos químicos pueden tener un sabor desagradable c) Porque no es higiénico ¿Por qué se deben agitar las disoluciones de modo suave y controlado? a) Para evitar la formación de burbujas b) Para evitar salpicaduras c) Para disolver el soluto más rápidamente ¿Cómo se deben manipular los ácidos? a) Con precaución bajo campana b) Con las manos desnudas c) Agitando vigorosamente la solución ¿Qué elementos deben mantenerse alejados de las llamas? a) Todos los productos químicos b) Todos los disolventes orgánicos c) Todos los productos que contengan agua ¿Por qué es importante revisar el material de vidrio antes de su uso a vacío o presión? a) Para comprobar posibles fisuras b) Para ver si está sucio c) Para asegurarse de que es resistente a la corrosión Respuestas: b c c c b a b a b a Cuestionario sobre el reconocimiento de materiales y equipos de uso frecuente en el laboratorio: Objetivos: Identificar materiales y equipos de uso frecuente en el laboratorio. Conocer el uso y función de materiales y equipos del laboratorio. ¿Por qué el vidrio corriente no sirve para la fabricación de instrumentos de laboratorio? a) Porque es muy resistente a la acción de los agentes químicos. b) Porque es muy frágil y vulnerable a los agentes químicos y físicos. c) Porque es muy caro. ¿Cuál es la principal función de los instrumentos construidos con vidrio grueso? a) Contener y trasvasar. b) Medir. c) Calentar. ¿Para qué se usan los instrumentos de porcelana en el laboratorio? a) Para contener y trasvasar líquidos. b) Para medir sustancias químicas. c) Cuando se van a someter sustancias a elevadas temperaturas, triturarlas o evaporarlas completamente. ¿Qué materiales de plástico son resistentes a ácidos, solventes orgánicos e hidróxidos? a) Polímeros. b) PVC. c) Nylon. ¿Para qué se utilizan los equipos de laboratorio conocidos como flujo laminar? a) Para purificar el aire ambiente. b) Para mantener las sustancias a tratar en asepsia. c) Para evitar la contaminación del material a tratar. ¿Qué es el menisco en un tubo estrecho? a) Una superficie plana que presentan los líquidos. b) Una superficie curva que presentan los líquidos debido al fenómeno de capilaridad. c) Una marca que indica la cantidad de líquido contenida en el tubo. ¿Cómo se debe realizar la lectura del menisco en una pipeta o bureta? a) Se lee la graduación en la parte superior del menisco. b) Se lee la graduación tangente a la curva superior del menisco. c) Se lee la graduación tangente a la curva inferior del menisco. ¿Cómo se debe sostener el recipiente o instrumento al realizar la lectura del menisco? a) En posición horizontal y al mismo nivel de la curva del menisco. b) En posición vertical y al mismo nivel de la curva del menisco. c) En posición horizontal y por debajo del nivel de la curva del menisco. ¿Cómo se controla el flujo al llenar una pipeta? a) Aspirando el líquido rápidamente. b) Aspirando el líquido lentamente. c) Aplicando presión en la parte superior de la pipeta. ¿Qué técnica se debe seguir al usar la propipeta? a) Levantarla hasta la altura de los ojos y observarla horizontalmente. b) Aspirar el líquido rápidamente. c) Controlar el flujo hasta que el menisco coincida con la marca cero. GUÍA DE ESTUDIO 1. Realizar un resumen de la Teoría Atómica de Dalton (1807) y destacar sus principales hipótesis y leyes. 2. Investigar y escribir sobre la crítica de la Teoría Atómica de Dalton y sus limitaciones. 3. Estudiar el Modelo Atómico de Thomson (1904), compararlo con la Teoría Atómica de Dalton y destacar sus similitudes y diferencias. 4. Investigar sobre el descubrimiento del electrón por Joseph John Thomson y su importancia en la comprensión de la estructura del átomo. 5. Analizar el Modelo Atómico de Rutherford (1911) y explicar la importancia de sus experimentos en la comprensión de la estructura del átomo. 6. Investigar sobre el descubrimiento del núcleo atómico por Ernest Rutherford y su influencia en el Modelo Atómico de Bohr. 7. Estudiar el Modelo Atómico de Bohr (1913), compararlo con los modelos anteriores y destacar sus principales características. 8. Realizar un cuadro comparativo de los diferentes modelos atómicos estudiados, resaltando sus similitudes y diferencias. 9. Reflexionar sobre la importancia de la evolución de las teorías atómicas en la comprensión de la estructura de la materia y en el desarrollo de la tecnología y la industria. 10. Investigar sobre las aplicaciones prácticas de la física atómica y nuclear en la medicina, la energía y la industria, y realizar un informe al respecto. Aquí te presento algunas preguntas: 1. ¿Qué es la estructura de la materia? 2. ¿La materia es continua o discontinua? Explique su respuesta. 3. ¿Quién propuso la Teoría Atómica en 1808? 4. ¿Cuáles fueron las hipótesis propuestas por Dalton en su Teoría Atómica? 5. ¿Qué críticas se le hacen a la Teoría Atómica de Dalton en la actualidad? 6. ¿Quién descubrió el electrón y cuándo lo hizo? 7. ¿Cuál fue el modelo atómico propuesto por Thomson? 8. ¿Qué es un catión y qué es un anión? 9. ¿Qué descubrimientos hizo Rutherford sobre la estructura del átomo? 10. ¿Qué modelo atómico propuso Bohr en 1913? 11. ¿Qué son las órbitas o niveles de energía de los electrones en el modelo atómico de Bohr? 12. ¿Qué relación existe entre la absorción o emisión de energía y las órbitas de los electrones en el modelo atómico de Bohr? Actividades: 1. Calcula la cantidad de átomos que caben en una distancia de 1 cm considerando que su diámetro es del orden de 1.10-8 centímetros. 2. ¿Qué son las masas atómicas relativas? ¿Por qué es imposible medir directamente la masa de un átomo? 3. ¿Por qué se eligió inicialmente la masa atómica del hidrógeno como patrón para establecer la escala de masas atómicas relativas? 4. ¿Qué es el mol y cuál es su relación con el número de Avogadro? 5. Si el isótopo más abundante del carbono es el C-12, ¿cuánto equivale 1 uma? 6. Si tenemos una muestra de hierro y sabemos que su masa es de 4,5 g, ¿cuántos moles de hierro hay en la muestra? 7. Si tenemos 3 moles de átomos de oxígeno, ¿cuántas partículas elementales hay en total? Respuestas: 1. Considerando que el diámetro de los átomos es de 1.10-8 cm, en una distancia de 1 cm cabrían cerca de 100,000,000 de átomos alineados. 2. Las masas atómicas relativas indican cuántas veces es más pesado un átomo respecto a un patrón elegido arbitrariamente. Es imposible medir directamente la masa de un átomo debido a su tamaño extremadamente pequeño. 3. La masa atómica del hidrógeno se eligió como patrón porque es el átomo más liviano conocido. 4. El mol es una unidad de medida de la cantidad de sustancia y se define como la cantidad de materia que contiene 6,02 x 1023 partículas elementales. El número de Avogadro (NA) es una constante que indica que 1 mol siempre significa 6,023.1023 partículas elementales. 5. Si el isótopo más abundante del carbono es el C-12, entonces 1 uma equivale a 1/12 de la masa del isótopo C-12, es decir, 1 uma = 1,6605 x 10-24 g. 6. Para calcular la cantidad de moles de hierro, se divide la masa de la muestra (4,5 g) entre la masa molar del hierro (55,85 g/mol). Entonces, hay 0,0804 moles de hierro en la muestra. 7. Si tenemos 3 moles de átomos de oxígeno, entonces hay 3 x 6,02 x 1023 = 1,806 x 1024 partículas elementales en total.