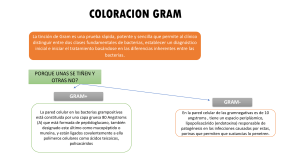
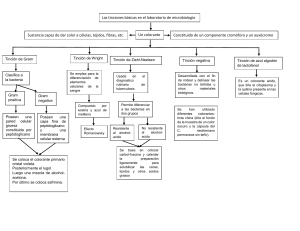
UNIVERSIDAD MILITAR NUEVA GRANADA TÉCNICAS DE COLORACION BACTERIANA Guías de Prácticas de Laboratorio Codificación: (1) GL-AA-F-1 Número de Revisión No.: Páginas: (2) (3) 16 1 Fecha Emisión: (4) 2011/08/31 Laboratorio de: (5) MICROBIOLOGIA BASICA Titulo de la Práctica de Laboratorio: (6) TÉCNICAS DE COLORACION BACTERIANA Elaborado por: (7) Revisado por: (8) Aprobado por: (9) Martha Liliana Rodríguez Docente Titular Maribeb Castro Presidente Comité de curriculo María Nubia Quevedo Vicedecano Facultad de Ciencias El uso no autorizado de su contenido así como reproducción total o parcial por cualquier persona o entidad, estará en contra de los derechos de autor Pagina 1 de 16 UNIVERSIDAD MILITAR NUEVA GRANADA TÉCNICAS DE COLORACION BACTERIANA Control de Cambios Razones del Cambio Cambio de formato Colocar resultados esperados y criterios a evaluar. Se retiro la pregunta 3 de los resultados Modificación de objetivos, de acuerdo a la práctica de coloración. Cambio competencias a desarrollar. Reducción marco teórico, de acuerdo con la práctica a desarrollar. Modificación materiales a utilizar. Reducción procedimiento, en relación con la práctica de coloración. Corrección resultados que serán obtenidos en la práctica de coloración. Retiro preguntas 4,5,6 y 7 por no relacionarse con la práctica. Adición de preguntas diferentes. Corrección revisión No., Revisado por, aprobado por Se amplió el marco teórico referente a tinción simple, tinción de esporas, cápsula, flagelos y de gram. Se incluyeron recomendaciones para la preparación de frotis en la metodología Cambio a la Revisión # 1 2 Fecha de emisión 16/09/07 15/06/09 3 10/12/10 3 05/02/13 3 05/02/13 3 05/02/13 3 05/02/13 3 05/02/13 3 05/02/13 3 05/02/13 4 31/07/16 31/07/16 4 31/07/16 El uso no autorizado de su contenido así como reproducción total o parcial por cualquier persona o entidad, estará en contra de los derechos de autor Pagina 2 de 16 UNIVERSIDAD MILITAR NUEVA GRANADA TÉCNICAS DE COLORACION BACTERIANA Se incluyeron dos precauciones adicionales en el numeral 9 durante el trabajo del laboratorio. Se incluyeron tres pasos adicionales para la preparación de muestras para tinción de flagelos Se rescribió la metodología para la tinción de cápsulas. Se incluyeron dos preguntas en el cuestionario y dos criterios de evaluación adicionales. 4 31/07/16 4 31/97/16 4 31/07/16 4 31/07/16 El uso no autorizado de su contenido así como reproducción total o parcial por cualquier persona o entidad, estará en contra de los derechos de autor Pagina 3 de 16 UNIVERSIDAD MILITAR NUEVA GRANADA TÉCNICAS DE COLORACION BACTERIANA 1. FACULTAD O UNIDAD ACADÉMICA: FACULTAD DE CIENCIAS 2. PROGRAMA: BIOLOGIA APLICADA 3. ASIGNATURA: MICROBIOLOGIA BASICA 4. SEMESTRE: IV 5. OBJETIVOS: - Analizar la importancia del uso de coloraciones en observación de morfología microscópica bacteriana. Identificar el fundamento de las coloraciones llevadas a cabo. Interpretar los resultados obtenidos a partir de una coloración determinada. 6. COMPETENCIAS A DESARROLLAR: Capacidad de descripción microscópica de las diferentes morfologías bacterianas. Adquisición de destreza para leer las tinciones llevadas a cabo. 7. MARCO TEORICO: 7.1. TÉCNICAS DE COLORACIÓN Las tinciones aumentan el contraste entre las células bacterianas y el medio que las rodea por ello es importante conocer la diferentes coloraciones existentes y sus características particulares. Las bacterias son generalmente transparentes, lo que dificulta su estudio morfológico en estado natural. El examen directo que permite observar el movimiento bacteriano, no permite observar la anatomía bacteriana e identificar sus estructuras, por ello es necesario recurrir a los colorantes que permiten hacer visibles los microorganismos e identificar sus estructuras revelando la naturaleza química de los mismos. Para teñir los microorganismos se dispone de un gran número de compuestos orgánicos coloreados llamados Colorantes, cada uno de ellos tiene una afinidad particular por sustancias y elementos celulares específicos. El uso no autorizado de su contenido así como reproducción total o parcial por cualquier persona o entidad, estará en contra de los derechos de autor Pagina 4 de 16 UNIVERSIDAD MILITAR NUEVA GRANADA TÉCNICAS DE COLORACION BACTERIANA Las técnicas de coloración simple pueden ser positivas cuando el colorante es fijado por las células apareciendo los microorganismos de color oscuro o coloreado sobre un fondo luminoso o claro, y son negativas cuando los microorganismos no fijan el colorante, en cuyo caso el fondo es el que se tiñe y los microorganismos aparecen brillantes sobre fondo oscuro. Las propiedades ácidas o básicas de los colorantes permiten su clasificación en: Ácidos: Estos ionizan en soluciones acuosas para producir un núcleo colorante con carga (-), es decir el grupo iónico que imparte el color (cromóforo) tiene carga negativa, o sea, es un anión. Estos colorantes tiñen material citoplasmático, no son muy usados en microbiología. Por ejemplo: eosina, rojo congo, fucsina ácida. Básicos: En los que el ion que lleva el color (cromóforo) tiene carga (+). Estos colorantes tienen afinidad por el material nuclear y otros componentes. Estos son los más usados en microbiología, ya que debido a la gran cantidad de ribosomas que contienen ácido ribonucleico en todo el protoplasma de la célula bacteriana, éstas se tiñen fácilmente. Por ejemplo: azul de metileno, fucsina básica, cristal violeta. Neutros: Se obtienen cuando se mezclan colorantes ácidos y básicos, donde la carga eléctrica de éstos es cero. Ejemplo: Giemsa, derivados de sal de amonio y eosina. TINCION DE GRAM La coloración de Gram fue descrita en 1888 por Christian Gram y está basada en la diferente composición de la pared de las bacterias que corresponde a las capas de la envoltura celular ubicadas entre la membrana citoplasmática y la cápsula. La pared está conformada por una capa de peptidoglucano (N-acetil glucosalina, Nacetil muramico unida por enlaces peptídicos a un grupo pequeño de aminoácidos, D-alanina, D-lisina, D-glutámico, Ácido diaminopimelico), y por enlaces éster a un grupo de carbohidratos denominados ácidos teicoicos. La composición del peptido glucano y el entrecruzamiento de los enlaces peptídicos varía de una especie a otra al igual que la presencia de una capa externa denominada lipopolisacárido (LPS). Ésta diferencia en la composición define la afinidad por los colorantes de Gram. La composición base varía de una especie a otra y es así como vemos que en Gram positivas predomina el peptidoglucano, y otros elementos como el ácido El uso no autorizado de su contenido así como reproducción total o parcial por cualquier persona o entidad, estará en contra de los derechos de autor Pagina 5 de 16 UNIVERSIDAD MILITAR NUEVA GRANADA TÉCNICAS DE COLORACION BACTERIANA teicoico y teicurónico. En Gram negativas predomina el Lipopolisacárido, En Mycobacterias el ácido micólico, Los Actinomices poseen Ornitina y Lisina pero sin DAP, Las Nocardias poseen el DAP en forma meso - abundantes azúcares tipo Arabinosa – Galactosa. Los Streptomyces poseen Levo ADP unida a glicina. Los Micoplasmas carecen de pared. Las Arqueobacterias carecen de Peptidoglicano, y algunas bacterias que poseen pared son de carácter intracelular como las Ricketsias y Clamidias. Estas variaciones en la constitución química de la pared hace que su reacción ante la coloración de Gram sea diferente y por ello sólo las Eubacterias que poseen pared clásica puede clasificarse como positivas o negativas dentro de la coloración. Las micobacterias y otros microorganismos acido alcohol resistentes necesitan de otra coloración más específicas como es Ziehl Neelsen, las intracelulares se colorean con Giemsa, y los micoplasmas se identifican por coloraciones con marcadores inmunológicos. La pared en las bacterias confiere la forma y es así como las capas de peptidoglicano hace que la bacteria crezca de manera circular dándole esa forma de Coco en tanto que el crecimiento por la parte proteica hace que se alarguen adquiriendo la forma de bacilo. Éste crecimiento varía de acuerdo a la composición y es por ello que microorganismos como Nocardias se observan como hifas micóticas, Streptomyces se observan como forma filamentosas alargadas, y Actinomyces presenta estructuras globosas y conidiales similares a hongos. Las bacterias se colorean inicialmente con un colorante primario básico (cristal violeta) debido a intercambios iónicos entre los radicales del colorante y radicales de la bacteria. Al adicionar lugol, éste actúa como fijador que se une al cristal violeta (CV) formando un complejo Lugol-CV que se fija a la célula. Al adicionar el alcohol acetona este produce tanto una hidratación de pared como disolución de lípidos. Aquellas bacterias que tienen una gran cantidad de peptidoglucano y pocos lípidos mantendrán el colorante en su interior en tanto que aquellas que tienen poco peptidoglucano y mucho lípido permitirán la salida del complejo CVlugol decolorándose su pared, de tal forma que al adicionar el segundo colorante de contraste, las primeras no lo tomarán porque el cristal violeta está ocupando los sitios de intercambio en tanto que las segundas al estar decoloradas toman el colorante y se tiñen de fucsia o rosado. De acuerdo con la permeabilidad de la pared las bacterias se clasifican en: El uso no autorizado de su contenido así como reproducción total o parcial por cualquier persona o entidad, estará en contra de los derechos de autor Pagina 6 de 16 UNIVERSIDAD MILITAR NUEVA GRANADA TÉCNICAS DE COLORACION BACTERIANA GRAM (+): Paredes gruesas que se deshidratan con el alcohol, cierran los poros evitando que el complejo insoluble cristal violeta-yodo salga de la célula y permanecen coloreadas de violeta. Se observan de color morado. GRAM (-): El solvente (alcohol-acetona) entra fácilmente penetrando al interior y atravesando la capa externa. La capa delgada de peptidoglicano no evita la entrada ni la salida del solvente. La teoría de la estructura atribuye la fijación del cristal violeta al ácido teicóico y al ribonucleato de magnesio presente en la pared de las Gram (+). Si unimos morfología y afinidad tintorial la coloración nos sirve para clasificar los microorganismos en cuatro grandes grupos: cocos Gram positivos, cocos Gram negativos, Bacilos Gram positivos, Bacilos Gram negativos. Esta clasificación es la base para iniciar la identificación de cada microorganismo. TINCION DE CAPSULA (Método Tyler): La cápsula es una estructura gelatinosa secretada por algunas bacterias que está conformada por capas de glicoproteínas, polipéptidos y polisacáridos que revisten el exterior de un bacteria. Tiene como función la adherencia y formación de biopelículas (capas de crecimiento bacteriano) y protección contra fagocitosis. La mayoría de las cápsulas están compuestas de polisacáridos, por lo que son solubles en agua. TINCION DE ESPORAS (Método de Shaeffer-Fulton): Existen diversos tipos de esporas microbianas, pero la espora bacteriana tiene especial importancia ya que son organelos de gran resistencia que se producen en el interior de la célula, por lo que reciben el nombre de endosporas. La endospora es una estructura compuesta, de dipicolinato de calcio en el centro, dentro de su compleja cubierta que consta de siete capas que contienen mureína. Pocos géneros de bacterias son capaces de formar endosporas, siendo los principales: Bacillus y Clostridlum. La esporulación de una bacteria no es debida a condiciones desfavorables del medio, sino que se forman en cierto período del desarrollo de la célula. La función de las endosporas no es la reproducción, ya que de un bacilo que forma una espora sólo surge una bacteria por su germinación. Tanto el tamaño, como la El uso no autorizado de su contenido así como reproducción total o parcial por cualquier persona o entidad, estará en contra de los derechos de autor Pagina 7 de 16 UNIVERSIDAD MILITAR NUEVA GRANADA TÉCNICAS DE COLORACION BACTERIANA forma y posición de la espora en la célula bacteriana son caracteres relativamente constantes de cada especie, ya que poseen cierto valorpara distinguir entre sí los diferentes tipos de bacterias esporuladas. La posición de la espora en la célula puede ser central, sub-terminal o terminal y de forma redonda u ovalada. La espora puede también ser más grande que el diámetro de la bacteria o menor que éste. Las endosporas bacterianas son muy resistentes y refractarias a la desecación, a los agentes químicos y sobre todo a temperaturas elevadas, ya que pueden sobrevivir expuestas a altas temperaturas durante largos períodos, a diferencia de las bacterias vegetativas normales que mueren con breves exposiciones. Uno de los métodos más usados para teñir esporas es con verde de malaquita donde las células bacterianas colorean de rojo y las esporas de verde. TINCION FLAGELAR: Muchos microorganismos son móviles, desplazándose de un lugar a otro para obtener nutrientes, crecer y reproducirse. Muchas de las bacterias poseen esta capacidad, debido a la presencia de unos órganos de locomoción denominados flagelos. Estos son filamentos simples químicamente compuestos de proteína conocida como flagelina. Tienen su origen en el protoplasma de la célula bacteriana y su espesor es alrededor de 0.01micrones. El número y disposición de los flagelos es variable en las diferentes bacterias, pero generalmente es constante para cada especie. Algunas tienen solamente un flagelo, otras dos o más y pueden ser polares o perítricos (alrededor del cuerpo de la célula). Las bacterias flageladas cuando están suspendidas en una gota de líquido son activamente móviles. Sin embargo, es muy importante distinguir entre el movimiento real debido a los impulsos originados por los flagelos permitiendo el desplazamiento de la bacteria dentro del campo microscópico y el llamado movimiento browniano que se produce siempre que se suspenden en un líquido partículas pequeñas y que presentan las bacterias inmóviles debido al bombardeo molecular sobre la superficie de la célula. Los flagelos pueden ser teñidos, pero debido a su diámetro tan pequeño, se requieren técnicas especiales. Los flagelos de organismos eucarióticos, como algas y protozoarios, son mucho más gruesos y pueden observarse en preparaciones en fresco o con tinciones simples. 8. MATERIALES, REACTIVOS, INSTRUMENTOS, SOFTWARE, HARDWARE O EQUIPOS: El uso no autorizado de su contenido así como reproducción total o parcial por cualquier persona o entidad, estará en contra de los derechos de autor Pagina 8 de 16 UNIVERSIDAD MILITAR NUEVA GRANADA TÉCNICAS DE COLORACION BACTERIANA CANTIDAD MATERIAL Incubadora Microscopios Micropreparados (esporas, cápsulas flagelos) Agua destilada estéril Bacterias del cepario en Agar nutritivo Kit de tinción de Gram Láminas y laminillas Aceite de inmersión Asas en hipoclorito al 5% y 1 4 8 1 Lt 5 cajas 1 canastilla 1 caja 1 gotero 4 USO Equipo para facilitar el crecimiento Observaciones generales Observación microscópica Preparación de Medio de cultivo Sembradas por aislamiento Observación diferencial Ubicar la muestra Observación en 100x Toma de la muestra 9. PRECAUCIONES CON LOS MATERIALES, REACTIVOS, INSTRUMENTOS Y EQUIPOS A UTILIZAR : - Manejo correcto de los reactivos, soluciones y láminas que serán usados en las tinciones. - Cuidado en el manejo de mechero durante la preparación de los frotis. - Lectura previa de las etiquetas de cada uno de los reactivos a utilizar para su correcto manejo y precauciones a tener en cuenta. 10. CAMPO DE APLICACIÓN: - Todo laboratorio que procese y analice muestras de tipo microbiológico. 11. PROCEDIMIENTO, METODO O ACTIVIDADES: 11.1 Recomendaciones para la preparación de extensiones o frotis: Se deberán emplear portaobjetos perfectamente limpios y sin raspaduras para evitar interferencias en la observación. Las extensiones deberán ser finas y uniformes para permitir el paso de la luz a través de ellas y facilitar su observación. Flamear el portaobjetos para desengrasarlo. Si el cultivo es sólido, colocar una gota de agua en el centro del portaobjetos, y con el asa bacteriológica estéril, tomar una pequeña cantidad de material, emulsionar y extender uniformemente en una superficie aproximada de 1 cm. El uso no autorizado de su contenido así como reproducción total o parcial por cualquier persona o entidad, estará en contra de los derechos de autor Pagina 9 de 16 UNIVERSIDAD MILITAR NUEVA GRANADA TÉCNICAS DE COLORACION BACTERIANA Si la muestra es líquida, tomar directamente el material con el asa estéril y extenderlo uniformemente sobre la superficie indicada anteriormente; Dejar secar la extensión al aire. Una vez seca la extensión, fijarla al calor suave, pasando rápidamente el portaobjetos sobre la flama del mechero, sin calentar demasiado, unas 10 veces. 11.2. TINCION DE BACTERIAS POR GRAM: Sobre la mesa hay una canastilla con 4 goteros marcados así: Cristal violeta, Lugol, Alcohol/acetona y Fucsina. El procedimiento es el siguiente: 1. Tome una de las cajas de petri del material que recolectó la clase pasada que contenga la bacteria crecida (idealmente una de las tres a las cuales les describió su morfología macroscópica), sujétela con la mano izquierda (derecha si es zurdo). 2. Con la otra mano tome una de las asas metálicas redondas que se encuentran suspendidas en la solución de alcohol a 70%. Flaméela en el mechero hasta que se ponga roja. Espere un poco que se enfríe. 3. Levante la tapa de la caja de petri y cerca al mechero tome un poco de la colonia. 4. De nuevo tape la caja. Tome una lámina y extienda la colonia que tiene en el asa hacia la parte central de la lámina, trate de hacer un extendido longitudinal. Flamee el asa e introdúzcala de nuevo al recipiente con alcohol. 5. Fije la muestra pasando la lámina sobre la llama del mechero varias veces. Repita el proceso para cada una de las bacterias. 6. Rotule la lámina como CG (Coloración Gram) y colóquele el número de la colonia que seleccionó. Inicie la Coloración: El uso no autorizado de su contenido así como reproducción total o parcial por cualquier persona o entidad, estará en contra de los derechos de autor Pagina 10 de 16 UNIVERSIDAD MILITAR NUEVA GRANADA TÉCNICAS DE COLORACION BACTERIANA 1. Coloque la lámina ya seca sobre la rejilla de coloración sobre el lavaplatos. Con el gotero marcado cubra la lámina con Cristal violeta y registre un minuto de espera. 2. Lave suavemente con agua destilada y retire el exceso 3. Agregue Lugol, cubriendo la lámina durante otro minuto. 4. Lave suavemente con agua destilada y retire el exceso. 5. Agregue ahora Alcohol-acetona, cubriendo la lámina durante 30 segundos. 6. Lave suavemente con agua destilada y retire el exceso. 7. Finalmente cubra la lámina con Fucsina por un minuto. 8. Lave suavemente con agua destilada y retire el exceso. 9. Ponga a secar la lámina en posición vertical sobre un papel absorbente al lado del mechero. 10. Cuando esté seca, móntela en el microscopio y haga observación iniciando en 4x y terminando en 100x. Para teñir otras colonias de interés siga los pasos anteriores de fijación por calor y luego el procedimiento que se explicó para cada colorante. 11.3. TINCION DE CAPSULA (Método Tyler). Material biológico a utilizar: Azobacter sp, Klebsiella sp,. y una gota de cultivo. Cristal violeta...............0.18 g o al 1% Ácido acético glacial.....0.25 ml Agua destilada............ 100 ml Fijador o contratinte: CuSO4.5H2O (20% acuoso) El uso no autorizado de su contenido así como reproducción total o parcial por cualquier persona o entidad, estará en contra de los derechos de autor Pagina 11 de 16 UNIVERSIDAD MILITAR NUEVA GRANADA TÉCNICAS DE COLORACION BACTERIANA PROCEDIMIENTO: 1. Prepare un frotis delgado y déjelo secar. 2. Aplique la tinción sobre todo el frotis y déjelo actuar por 6 minutos, observará que todo queda teñido de color oscuro. 3. Aplique abundantemente pero de forma rápida un flujo de CuSO4.5H2O. Este reactivo es absorbido en el material de la cápsula que ha sido decolorada - función de contratinte. 4. Seque con un papel absorbente sin enjuagar ya que la cápsula es soluble en agua. Las cápsulas se observan como una zona azul clara que rodea a la bacteria que se observa azul oscura. 11.4. TINCION DE ESPORAS (Método de Shaeffer-Fulton) PROCEDIMIENTO: 1. Prepare un frotis de Bacillus sp. y fije al calor, o suspenda una pequeña porción de la colonia de bacterias que se desarrolló sobre el agar nutritivo en una gota de agua sobre una lámina muy limpia y seque al aire. 2. Extienda sobre el frotis una solución acuosa de verde de malaquita al 5% y repose 10 minutos. 3. Lave con agua corriente y seque. 4. Esparza sobre el frotis safranina 0.5% durante 30 segundos. 5. Enjuague con agua y seque la lámina. 6. Observe las células a 40X Las células bacterianas colorean de rojo y las esporas de verde. El uso no autorizado de su contenido así como reproducción total o parcial por cualquier persona o entidad, estará en contra de los derechos de autor Pagina 12 de 16 UNIVERSIDAD MILITAR NUEVA GRANADA TÉCNICAS DE COLORACION BACTERIANA 11.5. TINCION FLAGELAR Solución I: NaCl al 15% Solución II: Acido tánico al 3% Solución III: Fucsina básica o Pararrosanilina 1,2g Etanol puro 100ml Contracolorante: Azul de metileno diluido PROCEDIMIENTO: 1. Hacer un círculo en un portaobjetos perfectamente limpio para lo cual previamente fue sumergido en mezcla crómica durante 24 horas, lavado posteriormente con agua destilada, enjuagado con alcohol y secado con un trozo de tela limpio. 2. Desengrasarlo pasando por una flama varias veces. 3. Colocar dentro del círculo, con pipeta Pasteur, una gotita de la suspensión bacteriana e inclinar el portaobjetos a uno y otro lado para extender la muestra. 4. Fijar la preparación al aire ya que si esta operación se hace usando la flama del mechero se pueden destruirlos flagelos 5. Cubra el frotis con la tinción (las 3 soluciones ya mezcladas) y dejarlo a temperatura ambiente por 10 minutos. 6. Coloque la lámina horizontalmente sobre una rejilla de goteo. 7. No quite el colorante antes de enjuagar. 8. Cubra luego con el contracolorante para mejorar el resultado 9. Lave generosamente con agua de la llave y seque. El cuerpo de la bacteria se tiñe de azul y el flagelo rojo. 12. RESULTADOS El uso no autorizado de su contenido así como reproducción total o parcial por cualquier persona o entidad, estará en contra de los derechos de autor Pagina 13 de 16 UNIVERSIDAD MILITAR NUEVA GRANADA TÉCNICAS DE COLORACION BACTERIANA Reporte los resultados en los cuadros que se presentan a continuación teniendo presente que: esferas violetas = cocos Gram positivos, esferas (rojo)= cocos Gram negativos, Bacilos violeta = Bacilos Gram positivos, Bacilos Fucsia (rojo)= Bacilos Gram negativos. - Micropreparados. Llene el siguiente cuadro dibujando lo que observa en cada lámina en 100x. MICROPREPARADO GRAM MORFOLOGIA OTROS 1 2 3 4. - Informe la morfología microscópica y la coloración de las bacterias de la clase pasada. COLONIA No. GRAM MORFOLOGIA OTROS 1. 2. 3. - Según las técnicas de coloración que haya evaluado reporte comparativamente sus observaciones. 12.1. RESULTADOS ESPERADOS: Conocer los diferentes métodos de tinción de las estructuras de la célula bacteriana (pared celular, esporas, cápsulas y flagelos) y poder diferenciar la morfología microscópica de bacterias en base a tinción de Gram. 12.2 PRESENTACIÓN DE INFORMES DE LABORATORIO Por disposición de la facultad, todos los informes de laboratorio serán presentados en forma de artículo científico, cuya estructura consta de: Título (primario): No mayor de 150 caracteres con espacios incluidos. Debe ir centrado, en negrilla y en mayúsculas. El uso no autorizado de su contenido así como reproducción total o parcial por cualquier persona o entidad, estará en contra de los derechos de autor Pagina 14 de 16 UNIVERSIDAD MILITAR NUEVA GRANADA TÉCNICAS DE COLORACION BACTERIANA Autores: Nombre (s) y los dos apellidos del primer autor, seguido de los otros autores en el mismo formato. Se debe utilizar superíndices para indicar la filiación de los autores. Resumen y abstract: Incluye una breve descripción del tema, los objetivos y el alcance del estudio, incluyendo resultados principales y conclusiones, sin exceder los 250 caracteres. Palabras claves: No deben encontrarse incluidas en el título. Introducción: Presenta brevemente el tema, exponiendo la definición del problema, su estado y la pertinencia del trabajo realizado. Materiales y métodos: Describe el diseño experimental, materiales y equipos utilizados. La idea en general es describir en detalle tal, que un investigador externo comprenda el procedimiento. Resultados y discusión: En los resultados deben presentarse los hallazgos del proceso de investigación. Consecuentemente, en la discusión se lleva a cabo la interpretación de dichos hallazgos. Se deben evitar conclusiones que no se encuentren respaldadas por los datos obtenidos. Bibliografía: Las citas deben presentarse numeradas y en orden alfabético. Para mayor información remitirse a la revista de la Facultad de Ciencias Básicas de la Universidad Militar Nueva Granada. 12.3. CUESTIONARIO 1. ¿Por qué resulta importante fijar la muestra durante el procedimiento de tinción? 2. Según su comportamiento químico, ¿cómo se clasifican los colorantes? Dé un ejemplo de cada uno. 3. ¿Cuáles son las fuentes de error más comunes en la tinción de Gram? 4. De dos ejemplos de otros colorantes empleados en Microbiología y explique su composición y el procedimiento para utilizarlos. 5. ¿Qué observaría en caso de montar una muestra proveniente de una colonia bacteriana, sin llevar a cabo tinción de Gram? 6. ¿Cómo se identifica una tinción simple y una tinción diferencial? 7. Escribir el nombre científico (género y especie), de cinco bacterias Gram positivas y Gram negativas, bacterias que forman esporas, que tienen cápsula y flagelos. 8. Explicar: ¿Por qué algunos microorganismos Gram positivos en un cultivo joven pueden volverse Gram negativos cuando éste envejece? El uso no autorizado de su contenido así como reproducción total o parcial por cualquier persona o entidad, estará en contra de los derechos de autor Pagina 15 de 16 UNIVERSIDAD MILITAR NUEVA GRANADA TÉCNICAS DE COLORACION BACTERIANA 13. CRITERIOS DE EVALUACIÓN: Manejar correctamente el microscopio, realizar la tinción de gram, diferenciar bacterias por su pared, describir la morfología microscópica de colonias bacterianas, identificar la cápsula, endospora y/o flagelos presentes en las bacterias. 14. BIBLIOGRAFIA: - MICROBIOLOGY. LABORATORY MANUAL. Principles and Applications. Stephen A. Norrell. Karen E. Messley. Ed. Prentice Hall. 1997 - BIOLOGY OF MICROORGANISMS. Brock, Madigan. Editorial Prentice Hall. Novena Edición. 1999. - MICROBIOLOGY: Principles and Explorations. Jacquelyn G. Black. Ed. Marymount University. Quinta Edición. 2002 www.microbiologia.com.ar - El uso no autorizado de su contenido así como reproducción total o parcial por cualquier persona o entidad, estará en contra de los derechos de autor Pagina 16 de 16