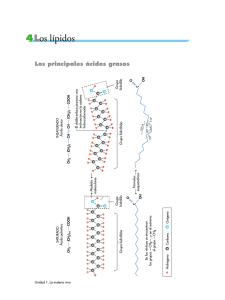
TABLA I PASOS PARA LA INTERPRETACIÓN DE UN ESPECTRO DE MASAS 1. Examine el aspecto general del espectro para ver si es interpretable 2. Seleccione un candidato para el ion molecular ( M •+ ). Base su selección en los criterios de la tabla II. 3. Examine el espectro buscando patrones isotópicos característicos (tabla III, fig. 1 y tabla IV). 4. Evalúe el candidato a M •+ , buscando señales correspondientes a pérdidas razonables (tablas V, complementar con tablas VI, VII). 5. Identifique el pico base del espectro y observe si puede proponerlo como un fragmento del ión molecular (M-x, tablas V-VII), o puede identificarlo como un fragmento de masa característica (tabla VIII). 6. Busque otros fragmentos de masa pequeña característicos. 7. En base a las conclusiones anteriores proponga una estructura para el compuesto. 8. Verifique su propuesta con información de otras técnicas. 9. Compruebe su interpretación obteniendo el espectro de un estándar del compuesto propuesto en las mismas condiciones, o cuando menos compare contra un espectro de referencia. TABLA II CRITERIOS PARA RECONOCER EL ION MOLECULAR 1. Si el compuesto es conocido, el ión molecular tendrá una razón m/z igual a la suma de las masas atómicas de los isótopos mas abundantes de los elementos que forman la molécula. 2. Si el compuesto contiene solamente C,H, O, Si, P y halógenos, la razón m/z nominal del ión molecular deberá ser un número par. • Los iones fragmento obtenidos por fisión homolítica (los mas probables), tendrán una razón m/z non. (ver tablas Va y VI) • Los iones fragmento obtenidos de la expulsión de fragmentos neutros (H2O, CO, etileno, etc., tabla Vb y VII) tendrán una masa (m/z) par, estos fragmentos ocurren en procesos con rearreglo. 3. REGLA DEL NITRÓGENO: Los compuestos que contienen un número non de átomos de nitrógeno en su molécula, tendrán un peso molecular non. • Este compuesto se fragmentará para generar iones de masa par, a menos que se pierda un número non de átomos de nitrógeno. • Un número par de átomos de nitrógeno producirá un ión de masa nominal par. TABLA III ABUNDANCIA ISOTÓPICA DE COMBINACIONES CLORO-BROMO Combinación X Cl Cl2 Cl3 Cl4 Cl5 Cl6 100.0 100.0 100.0 76.9 61.5 51.2 32.5 65.0 97.5 100.0 100.0 100.0 10.6 31.7 48.7 65.0 81.2 3.4 10.5 21.1 35.2 0.9 3.4 8.5 ClBr CI2Br CI3Br 76.6 61.4 51.2 100.0 100.0 100.0 24.4 45.6 65.0 6.6 17.6 1.7 ClBr2 Cl2Br2 Cl3Br2 43.8 38.3 31.3 100.0 100.0 92.0 69.9 89.7 100.0 13.7 31.9 49.9 3.9 11.6 1.0 ClBr3 Cl2Br3 26.1 20.4 85.1 73.3 100.0 100.0 48.9 63.8 8.0 18.7 2.0 100.0 51.0 34.0 17.4 98.0 100.0 100.0 68.0 49.0 98.0 100.0 32.0 65.3 16.0 Br Br2 Br3 Br4 X+2 X+4 X+6 X+8 X+10 0.2 1.1 Figura 1.- Representación gráfica de la abundancia isotópica relativa de iones conteniendo diferente número de átomos de Cl y Br. Cl Cl2 ClBr Cl2Br ClBr3 Cl2Br3 Cl3 Cl4 Cl3Br ClBr2 Br Br2 Cl5 Cl2Br2 Br3 Cl6 Cl3Br2 Br4 TABLA IV PESOS ATOMICOS Y ABUNDANCIAS ISOTÓPICAS NATURALES Elemento Hidrógeno Carbono Nitrógeno Oxígeno Flúor Silicio Fósforo Azufre Cloro Bromo Iodo Símbolo H D 12C 13C 14C 14N 15N 16O 17O 18O F 28Si 29Si 30Si P 32S 33S 34S 35Cl 37Cl 79Br 81Br I Masa nominal 1 2 12 13 14 14 15 16 17 18 19 28 29 30 31 32 33 34 35 37 79 81 127 Masa exacta 1.0078 2.0141 12.0000 13.0034 14.0031 15.0001 15.9949 16.9991 17.9992 18.9984 27.9679 28.9765 29.9738 30.9738 31.9721 32.9715 33.9679 34.9689 36.9659 78.9183 80.9163 126.9045 Abundancia 99.99 0.01 98.91 1.10 0.006 99.60 0.40 99.76 0.04 0.20 100. 92.20 4.70 3.10 100. 95.02 0.76 4.22 75.77 24.23 50.50 49.50 100. Factor X+1 1.1nC Factor X+2 0.006nC2 0.37nN 0.04nO 0.20nO 5.1nSi 3.4nSi 0.8nS 4.4nS 32.5nCl 98.0nBr TABLA V PÉRDIDAS MAS COMUNES DEL IÓN MOLECULAR MASA M-1 M-15 M-29 M-31 M-43 M-45 M-57 M-2 M-18 M-28 M-32 M-44 M-60 M-90 ORIGEN FÓRMULA A. PÉRDIDAS DE RADICALES Pérdida de radical hidrógeno M-•H Pérdida de radical metilo M-•CH3 Pérdida de radical etilo M-•CH2CH3 Pérdida de radical metoxilo M-•OCH3 Pérdida de radical propilo M-•CH2CH2CH3 Pérdida de radical etoxilo M-•OCH2CH3 Pérdida de radical butilo M-•(CH2)3CH3 B. PÉRDIDAS DE FRAGMENTOS NEUTROS Pérdida de hidrógeno M-H2 Pérdida de agua M-H2O Pérdida de CO o de etileno M-CO ó M-C2H4 Pérdida de metanol M-CH3OH Pérdida de CO2 M-CO2 Pérdida de ácido acético M-CH3COOH Pérdida de silanol: HO-Si(CH3)3 M-[Si(CH3)3-OH] PÉRDIDAS IMPOSIBLES DEL IÓN MOLECULAR Las siguientes no son pérdidas razonables del ión molecular. De ocurrir significa que se asignó incorrectamente el ión molecular, que alguna de las dos señales es ruido, o que se trata de una mezcla de compuestos. Pérdidas ilógicas: M-3 M-6 M-7 M-21 PÉRDIDAS POCO PROBABLES DEL IÓN MOLECULAR Las siguientes son pérdidas poco probables del ión molecular. Si bien tiene un origen aparentemente lógico (tablas VI y VII), en general no ocurren, por lo que indican que probablemente se asignó incorrectamente el ión molecular, que alguna de las dos señales es ruido, o que se trata de una mezcla de compuestos. Pérdidas poco probables: M-14 M-26 TABLA VI Fragmento •CH2SH PÉRDIDAS DEL IÓN MOLECULAR LIBERADAS COMO FRAGMENTOS NEUTROS CON ELECTRONES NON Y ESTRUCTURAS INICIALES PROBABLES. •CH2Cl •CHF2 •CH2CH2CN •C4H7 •C3H3O •C4H9 •C3H5O •C3H8N •C2H4NO •CNS •C3H7O •COOCH3 •CH2COOH •C2H5S •C5H5 •C4H6N •C5H9 •CF3 •C5H11 •C4H7O •C3H5O2 •C3H7S •C6H5 •Br •C6H7 •C6H9 •C5H5O •C6H11 •C6H13 •C5H9O •C4H7O2 •C7H7 •C7H13 •C7H15 •C6H14N •C8H9 •C7H5O •I Origen metilsulfuros, ésteres de tiolácidos, tioles primarios Nitrilos cadena alifática, buscar serie X14nC Etilcetonas Amidas Dimetilcarbinoles Metilésteres, acetatos, ácidos Tioles primarios, metilsulfuros (junto con M-47) Nitrilos (ver M-54 y M-40) cadena alifática, buscar serie X-14nC Cetonas Etilsulfuros nota: debe aparacer la pérdida M-81, con la misma altura. cadena alifática, buscar serie X-14nC Cetonas (ver M-71) Ésteres Aminas alifáticas primarias Fenilalquilos Benzoilos Masa M-47 M-49 M-51 M-54 M-55 M-55 M-57 M-57 M-58 M-58 M-58 M-59 M-59 M-61 M-65 M-68 M-69 M-69 M-71 M-71 M-73 M-75 M-77 M-79 M-79 M-81 M-81 M-83 M-85 M-85 M-87 M-91 M-97 M-99 M-100 M-105 M-105 M-127 Fragmento •H •CH3 •NH2 •OH •NH3 •F •CN •C2H3 •CH2N •C2H5 •CHO •CH3NH •CH2NH2 •NO •CH3O •CH2OH •ONH2 •SH CH2F H2O+•CH3 •Cl •C3H3 •CH2CN •C3H5 •C2H4N •CNO •C3H7 CH3CO• •NHC2H5 •CH2NO •C2H5O •COOH •NO2 •(CH2)3CH3 Origen Aldehídos, acetales, fenoles, metilaromáticos, aminas alifáticas. Amidas Alcoholes, ácidos, aromáticos osustituídos en los que un sustituyente contiene oxígeno y el otro hidrógeno. cadena alifática, buscar serie X-114nC Aldehídos, fenoles Aminas alifáticas primarias. Ésteres metílicos, éteres, alcoholes primarios. nota: debe aparacer la pérdida M-37, con 1/3 de altura. Nitrilos cadena alifática, buscar serie X-14nC Amidas primarias Ésteres etílicos, éteres, metilcarbinoles Ácidos cadena alifática, buscar serie X-14nC Masa M-1 TABLA VII PÉRDIDAS DEL IÓN MOLECULAR M-15 M-16 M-17 LIBERADAS COMO FRAGMENTOS NEUTROS CON ELECTRONES PAR POR PRODUCTO DE PROCESOS DE FRAGMENTACIÓN CON REARREGLO. nota: las pérdidas mas comunes aparecen en negritas. M-17 M-19 M-26 M-27 M-28 M-29 M-29 M-30 M-30 M-31 M-32 M-33 M-33 M-33 M-35 M-39 M-40 M-41 M-42 M-42 M-43 M-43 M-44 M-44 M-45 M-45 M-46 M-57 TABLA VIII PÉRDIDAS NO CONTEMPLADAS EN LAS TABLAS ANTERIORES Fragmento H2 CH2 O NH3 H2O HF C2H2 HCN C2H4 y homólogos CO (NO) CH2O CH5N CH4O H2S HCl C2H2O C3H6 CHNO Masa M-2 M-14 M-16 M-17 M-18 M-20 M-26 M-27 M-28, M-42, ..., (M-14n) M-28 M-30 M-30 M-31 M-32 M-34 M-36 M-42 M-42 M-43 Fragmento C2H4O CO2 C2H7N C2H6O CH4S C4H6 C4H8 C3H4O C3H6O Masa M-44 M-44 M-45 M-46 M-48 M-54 M-56 M-56 M-58 C3H9N C3H8O C2H4O2 C2H6S SO2 C3H6O2 C6H4 C6H6 HBr M-59 M-60 M-60 M-62 M-64 M-74 M-76 M-78 M-80 M-90 M-128 Si(CH3)3OH HI TABLA IX ALGUNOS IONES FRAGMENTO DE MASA PEQUEÑA CARACTERÍSTICOS M/Z 18 28 41 42 44 44 46 50 51 52 55 55 56 58 58 59 59 60 60 60 68 70 71 72 73 74 74 78 80 81 81 84 Fragmento NH4 N2 [CH2=C=NH]+• [CH2=CH(CH3)]•+ [CH2=CH(OH)]+• [O=CH•CH2(H)]+• [O=CH(OH)]•+ C4H2 C4H3 C4H4 C3H3O C3H5N C3H6N [CH2=C:CH3(OH)]]+• [CH2=CH(NH•NH2)]•+ [CH2=C:NH2(OH)]+• [CH2=CH(NH•OH)]+• [CH2=C:OH(OH)]+• C2H4S CH2NO2 C5H8 C4H8N C4H7O C4H8O C3H7NO [CH2=C:OCH3(OH)]+• C3H6S C5H4N C5H6N C5H5O C4H3S C4H4O2 84 85 88 91 C5H10N C4H5O2 C4H8O2 + · Tropilio: Origen McLafferty de nitrilos McLafferty de olefinas McLafferty de aldehídos McLafferty de éteres vinílicos McLafferty de ésteres carboxílicos Fenilos, piridilos Fenilos, piridilos Fenilos, piridilos Ciclohexanonas Nitrilos con metilos en Ciclohexilaminas McLafferty de cetonas McLafferty de hidrazonas McLafferty de amidas carboxílicas McLafferty de oximas McLafferty de ácidos carboxílicos Sulfuros cíclicos Ciclohexenos, ciclohexanoles Pirrolidinas Tetrahidrofurfurilos Aldehídos con etilos en Amidas con metilo en McLafferty de ésteres carboxílicos Sulfuros cíclicos Piridinas Pirrolil-CH2 Furil-CH2 Tienilos Ésteres de ácidos carboxílicos alifáticos dibásicos mayores al ácido pimélico Piperidinas -lactonas Ésteres metílicos con metilo en McLafferty de alquilbencenos 92 92 92 93 94 CH2 C [ C6H4O C6H6N C6H5O O C 94 95 95 97 98 [ C5H4NO C6H4F C5H3O2 C5H5S C5H6O2 99 103 107 108 111 111 119 119 120 121 122 123 126 C5H7O2 C8H7 C7H7O C6H6NO C6H4Cl C5H3OS C9H11 C8H7O C7H4O2 C7H5O2 C6H4NO2 C7H4FO C7H10O2 127 131 135 139 149 150 155 C10H7 C9H7O C8H7O2 C7H4ClO C8H5O3 C7H4NO3 C6H4Br CH(H) C2H4 CH(H) C2H4 McLafferty de arilalcanos ]+• Salicilatos Piridil-CH2 Feniléteres(y ésteres) McLafferty de ariloxialcanos ]+• Pirrolil-CO Furil-CO Tienil-CH2 Ésteres de ácidos carboxílicos alifáticos dibásicos mayores al ácido pimélico -lactonas Estirenos, cinnamatos Metoxifenilos y benziloxin-metil-pirrolil-COTienil-COFenilalquilos, toluilalquilos Toluoilos Salicilatos Hidroxibenzoílos, salicilatos Fluorobenzoílos Ésteres de ácidos carboxílicos alifáticos dibásicos mayores al ácido pimélico Naftilos Cinnamatos Metoxibenzoílos Clorobenzoílos Ftalatos de dialquilo Nitrobenzoílos