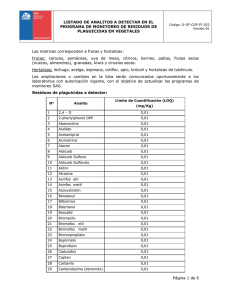
✿ ✿ Componentes del equipo de hplc: → Bomba: Su finalidad es permitir el paso de la fase móvil al interior de la columna a una velocidad definida y constante. Además, cuando se inyecte la muestra debe permitir que esta también circule a una velocidad constante. La bomba utilizada es isocrática, no permite trabajar en gradiente. Es importante recordar que, a partir de la bomba, todas los tubos deben ser de acero inoxidable debido a las altas presiones que se manejan en el interior del equipo HPLC. → Inyector: Su finalidad es permitir el ingreso de la muestra a la columna, se requiere utilizar este componente debido a la alta presión que alcanza el sistema cuando está funcionando, por lo cual se hace imposible pensar en inyectar directamente la muestra en un sistema de gran presión. Permite inyectar con una jeringa la muestra por donde no está circulando fase móvil en el momento del llenado, una vez se encuentra lleno, con un giro rápido permite el ingreso de la muestra al sistema sin que se pierda la presión. Tiene un tubo con una capacidad definida de volumen entre 10 a 200 microlitros, se trabaja en estos volúmenes de forma fija durante toda la corrida cromatográfica → Precolumna (opcional): No es indispensable, sin ella igual se produce la separación, su uso es recomendable, ya que, tanto la fase móvil como la muestra pueden crear pequeños residuos de material sólido que, de pasar a la columna, pueden taparla. Esta precolumna los filtra, aumentando la vida útil de la comuna. Su precio es 10 veces menor que la columna analítica, es mas recomendable cambiar precolumna que columna. Ambas tienen unas flechas impresas que indican el sentido en que deben ser instaladas en el equipo. → Columna analítica: Es el corazón del equipo cromatográfico, es donde lograremos la separación de los componentes a analizar. Su longitud es habitualmente 15 centímetros. → Detector: Indica el momento en que cada componente sale de la columna cromatográfica. Hay varios tipos, lo importante es utilizar uno que responda a alguna propiedad del analito o la fase móvil → Registrador: Computador con un software que nos permite visualizar el cromatograma, para identificar y cuantificar analitos en las muestras en estudio Funcionamiento del equipo hplc: Velocidad de flujo: Fluctúa entre 0,1 a 2 ml/minuto, habitualmente 1 ml/minuto. Esta velocidad genera al interior del instrumento grandes presiones del orden de 1000 a 3000 PSI. Esta presión es necesaria dado que se requiere gran energía para hacer pasar este pequeño flujo por la columna cromatográfica, la que está rellena con un material muy fino y compacto. Preparación de la fase móvil: El o los solventes a utilizar en la fase móvil deben ser de calidad HPLC (de muy alta pureza, y con indicaciones claras de la composición de posibles impurezas). El agua a utilizar debe ser también de calidad HPLC, de alta pureza y muy baja conductividad, para eso no debe tener sales disueltas, ya que pueden obstruir la columna cromatográfica además de dañar otras partes del equipo, como la bomba. Si el agua no es de calidad HPLC, se puede optar por un sistema de purificación. La fase móvil se prepara generalmente en un matraz. Luego de su preparación debe ser filtrada para evitar residuos sólidos, principalmente partículas pequeñas (como polvo que podría haber caído durante la preparación. Después de ser filtrada, se debe desgasificar antes de colocar la fase móvil en el equipo HPLC para evitar la formación de burbujas de aire al interior de la columna cromatográfica. La desgasificación suele hacerse por burbujeo con Helio. Luego colocar en frascos bien rotulados, indicando su contenido y fecha de preparación para evitar confusión con otra fase móvil. Propiedad del analito a detectar: En este caso, se detectará la absorbancia, ya que los analitos absorben en el mismo rango espectroscópico (200-300 nm). El máximo de absorbancia se presenta a una longitud de onda de 275 nm, por lo que trabajaremos a esa longitud de onda. Al comienzo de la corrida cromatográfica, se debe indicar un valor 0 de absorbancia, que corresponderá a la absorbancia de la fase móvil, que es lo único que inicialmente estará circulando por la columna. Una vez vaya pasando el analito, el valor de absorbancia irá aumentando, permitiendo que el registrador vaya dibujando el cromatograma, ya que el detector y el registrador están directamente conectados, todo lo que pase el detector será registrado. Tipos de HPLC: Hay varios tipos de HPLC, los que sirven para separar analitos de naturaleza muy variada. En este caso, trabajaremos con cromatografía de reparto. Esta a su vez se divide en dos tipos: fase normal (fase móvil apolar, fase estacionaria polar) y fase inversa (fase móvil polar, fase estacionaria apolar). Trabajaremos con la cromatografía de fase inversa, con ella es posible resolver más del 80% de los casos. Lograremos separar compuestos afines a la fase estacionaria, es decir, se usa en analitos relativamente apolares. Fase estacionaria: Es apolar, en este caso se utilizará una fase estacionada con cadena hidrocarbonada C18 (la cadena tiene 18 átomos de carbono) Fase móvil: Es polar, una mezcla de solventes polares, en este caso una mezcla de metanol y agua en proporciones definidas. Condiciones necesarias: El equipo HPLC se encuentra al aire libre, no al interior de algún horno, esto debido a que, ya que la separación en la cromatografía HPLC se debe por la afinidad del analito con la fase móvil y/o estacionaria, no depende mayormente de la temperatura. Tratamiento de la muestra: La muestra debe estar en solución, generalmente pasa por un tratamiento previo, sobre todo si la muestra es sólida. Debe ser filtrada previo ingreso al equipo. Los estándar también deben ser filtrados. Se emplean filtros de poro pequeño, (0,45 micrometros o menos). Se suelen utilizar filtros pirinola (filtros accionados por una jeringa). La muestra debe ser completamente soluble en la fase móvil para evitar que queden residuos sólidos dentro de la columna cromatográfica. Trabajo experimental: Finalidad: Determinar y posteriormente cuantificar componentes presentes en una muestra problema, la que puede contener cafeína, teobromina o teofilina. Tendrá dos de los tres compuestos mencionados. Muestra: La muestra se encuentra solubilizada y filtrada, contenida en un tubo de vidrio Identificación de los analitos: Tendremos a nuestra disposición el tubo de vidrio con la muestra problema, dos matraces con los solventes, una jeringa (de 20 microlitros de capacidad). Primero debemos preparar los materiales para un buen resultado analítico: 1. Lavar la jeringa con algún solvente (metanol), para así eliminar cualquier residuo de alguna otra muestra que pudo haber sido trasladada con la misma jeringa. Se debe limpiar al menos tres veces con cada uno de los solventes. Recordar que la jeringa es un medio de transporte. 2. Una vez limpia la jeringa, debemos ambientarla con la muestra problema, para evitar que parte de esta se diluya al interior de la jeringa. Ambientar al menos tres veces. 3. Inyectar muestra en el equipo, al menos tres veces para ambientar el equipo, y debemos tener el inyector lleno con la muestra 4. Comenzar la corrida cromatográfica, ingresando la fase móvil al equipo HPLC girando la perilla del inyector hacia abajo rápidamente. La fase móvil trasladará el contenido del inyector al equipo. En este momento se determina el tiempo cero de la corrida cromatográfica. Comienza a dibujarse el cromatograma en el registrador, será visible al comienzo una línea recta (correspondiente a la absorbancia cero de la fase móvil). 5. Una vez salgan los analitos de la columna cromatográfica, comenzará a verse en el visor del detector un aumento de la absorbancia, apareciendo en el registrador la primera señal cromatográfica, correspondiente al primer analito que sale de la columna. Se espera que el primer analito que salga sea el más polar, es decir, el más afín a la fase móvil, y que al final salga el analito más apolar, es decir, afín a la fase estacionaria. En este caso ya sabemos de antemano que habrá dos analitos presentes, por lo que aparecerán dos señales cromatográficas, con tiempos de retención muy distintos entre sí. El primer compuesto aparece a un tiempo de retención de 8,27 minutos, mientras que el segundo aparece a 29,96 minutos. 6. Definir qué analito está presente en la muestra NO se puede buscar en la bibliografía los tiempos de retención, debido a que no existe una bibliografía de esta índole por la gran cantidad de variables implicadas (tipo y largo de columna, mezcla y proporción de la fase móvil, velocidad de flujo distinta, etc). De hecho, teniendo dos equipos idénticos no se puede asegurar que un analito tenga el mismo tiempo de retención en ambos, pero sí saldrán en el mismo orden. Se podría determinar por otra técnica analítica, es posible, pero esto se nos complicaría por la presencia de dos analitos, los que podrían ser interferentes entre sí dado que absorben en la misma región espectral, aumentando aparentemente la absorbancia provocando resultados erróneos. Para determinar qué analito está presente, necesitaremos estándares de los analitos. Hay dos métodos para esto, que serán ejemplificados con la Teobromina como analito. Inyectamos una determinada cantidad de estándar de teobromina, y determinamos su tiempo de retención. En este caso, nos da un tiempo de retención de 8,27 minutos, esto quiere decir que si hay teobromina presente en la muestra, ya que la primera señal cromatográfica tiene el mismo tiempo de retención. Con esto, ya identificamos uno de los componentes. Ahora haremos lo mismo con la teofilina y con la cafeína, obteniendo los siguientes tiempos de retención: Teofilina: 13,79 minutos Cafeína: 29,96 minutos La segunda señal cromatográfica salía a 29,96 minutos, lo que nos indica que hay cafeína presente en la muestra. Finalmente, concluimos que en la muestra problema, identificamos teobromina y cafeína, y no hay presencia de teofilina. Debemos repetir la corrida cromatográfica, pero esta vez, le agregaremos una determinada cantidad del estándar puro de teobromina, y lo volveremos a inyectar. Si el compuesto que añadí está presente en la muestra, la señal cromatográfica correspondiente a ese analito aumentará su magnitud (altura o área). Si el compuesto que añadí no está presente en la muestra, el cromatograma nos arrojará tres señales en vez de dos. Si hubiéramos añadido teofilina, habría aparecido una tercera señal a 13,79 minutos de retención. Cuantificación de teobromina y cafeína en la muestra: Una vez identificados los analitos presentes en la muestra problema, debemos cuantificarlos. Esto lo realizaremos utilizando una curva de calibración, para luego interpolar los resultados de la muestra problema. La curva de calibración será de área bajo la curva v/s concentración del analito. Debemos determinar al menos 6 puntos de concentración de estándares que contengan ambos analitos de forma simultánea. Estas concentraciones deben estar entre 3 y 30 miligramos/litro, ya que, en esta zona, se tiene un comportamiento lineal y además está sobre el límite de cuantificación. Tendremos a disposición volúmenes de estándar de los tres analitos, en este caso sólo nos importa la cafeína y la teobromina, de concentración conocida 300 miligramos / litro, y un matraz con la fase móvil utilizada en la cromatografía para enrasar los matraces. Los estándares serán preparados en matraces de 10 mL, ya que sólo inyectaremos 20 microlitros, por lo que no tiene sentido preparar más. Para saber qué volumen de estándar de concentración 300 mg/L debemos agregar al matraz para lograr la preparación de 10 mL de una solución con concentración 3 mg/ L, debemos utilizar la siguiente fórmula: 𝐶1 ∙ 𝑉1 = 𝐶2 ∙ 𝑉2 𝑚𝑔 𝑚𝑔 300 ( ) ∙ 𝑉1 = 3 ( ) ∙ 10 (𝑚𝐿) 𝐿 𝐿 𝑉1 = 0,1 𝑚𝐿 = 100 𝑚𝑖𝑐𝑟𝑜𝑙𝑖𝑡𝑟𝑜𝑠 En el primer caso entonces, necesitaremos 100 microlitros de estándar de cada uno de los analitos. Debemos hacer lo mismo con las siguientes concentraciones que vayamos a utilizar en la curva de calibración, en este caso se utilizan los siguientes puntos de calibración: 3, 6, 9, 12, 18, 24 y 30 mg/L de teobromina y de cafeína (100, 300, 400, 600, 800 y 1000 microlitros de cada uno), luego enrasados hasta 10 mL con la fase móvil. Una vez listas las soluciones de estándar con concentración conocida, debemos inyectarlas en el cromatógrafo, obteniendo 6 diferentes cromatogramas, cada uno con dos señales. El software en el registrador nos indicará los tiempos de retención y magnitud (área, tiene menor error analítico que la altura) de cada una de las señales. El área se encuentra en microvolt/minuto. Ya listos los cromatogramas, y sabiendo que la primera señal el teobromina y la segunda cafeína, anotaremos en una tabla las concentraciones, tiempos de retención y magnitud de la señal cromatográfica de cada uno de los estándares, para luego con regresión lineal obtener la ecuación de la recta, debiendo siempre comprobar la linealidad de nuestra curva, viendo que siempre el R sea mayor a 0,99. Se recomienda siempre graficar la recta, así si algún dato se sale de la linealidad, será más fácil identificarlo y eliminar el dato o reemplazarlo por otra medición estándar. Ya lista la curva, inyectamos la muestra problema en triplicado. En este caso, se debió diluir la muestra, utilizando 500 microlitros (0,5 ml) de muestra enrasados a 10 mL con la fase móvil. El factor de dilución será el siguiente: 𝐹𝐷 = 𝑉𝑜𝑙𝑢𝑚𝑒𝑛 𝑓𝑖𝑛𝑎𝑙 𝑉𝑜𝑙𝑢𝑚𝑒𝑛 𝑎𝑙í𝑐𝑢𝑜𝑡𝑎 10 𝑚𝐿 𝐹𝐷 = 0,5 𝑚𝐿 𝐹𝐷 = 20 Es decir, la muestra fue diluida 20 veces. Este factor se debe tomar en cuenta para los cálculos finales. resultados: Al inyectar la muestra, nos da el área y tiempo de retención para cada una de las tres mediciones Utilizando la ecuación de calibración, determinar para cada una de las muestras la concentración (diluida) de analito. Es importante el calculo de cada medición por separado, es analíticamente correcto y nos permite mayor precisión al entregar la desviación estándar y el coeficiente de variación. Multiplicamos la concentración diluida por el factor de dilución (20) para cada una de las muestras, de esta manera calculamos la concentración en la muestra inicial. Recién ahora, calculamos promedio, desviación estándar, coeficiente de variación y si es posible, error relativo. Expresar la concentración: 𝑋̅ ± 𝜎 (promedio ± desviación estándar), tomando en cuenta las cifras significativas, en este caso, la concentración de teobromina es 236 ± 5 mg/L , con un coeficiente de variación de 2,13%, y de cafeína es 392±8 mg/L , con un coeficiente de variación de 2,09% Con HPLC es posible identificar y cuantificar analitos en presencia de otros compuestos o en matrices complejas, la determinación de analitos en concentraciones del orden de miligramos por litro usando un detector de absorbancia, si usamos otro detector como de fluorescencia, podemos medir menos, en el orden de microgramos por litro. Se puede identificar y cuantificar simultáneamente más de un analito por muestra con curvas de calibración multiestándar. Si hubiéramos tenido los 3 analitos en la muestra, habríamos podido identificar y cuantificar los 3. Esto disminuye el tiempo empleado en la determinación de analitos.