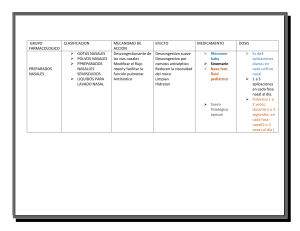
Oídos, nariz, garganta y cirugía de cabeza y cuello Cuarta edición Jesús Ramón Escajadillo Médico Adscrito, Servicio de Otorrinolaringología, Hospital “Fray Junípero Serra”, ISSSTE, Tijuana, B. C. Médico Adscrito al Servicio de Otorrinolaringología ISSSTECALI, Tijuana, B. C. Profesor de la Cátedra de Otorrinolaringología Universidad Autónoma de Baja California Tijuana, B. C. ERRNVPHGLFRVRUJ Editor responsable: Dr. Raúl Ossio Vela Editorial El Manual Moderno Cuarta edición Oídos, nariz, garganta y cirugía de cabeza y cuello Nos interesa su opinión, comuníquese con nosotros: Editorial El Manual Moderno, S.A. de C.V., Av. Sonora núm. 206, Col. Hipódromo, Deleg. Cuauhtémoc, 06100 México, D.F. (52-55)52-65-11-00 @ [email protected] [email protected] IMPORTANTE Los autores y la Editorial de esta obra han tenido el cuidado de comprobar que las dosis y esquemas terapéuticos sean correctos y compatibles con los estándares de aceptación general en la fecha de la publicación. Sin embargo, es difícil estar por completo seguro que toda la información proporcionada es totalmente adecuada en todas las circunstancias. Se aconseja al lector consultar cuidadosamente el material de instrucciones e información incluido en el inserto del empaque de cada agente o fármaco terapéutico antes de administrarlo. Es importante, en especial cuando se utilizan medicamentos nuevos o de uso poco frecuente. La Editorial no se responsabiliza por cualquier alteración, pérdida o daño que pudiera ocurrir como consecuencia, directa o indirecta, por el uso y aplicación de cualquier parte del contenido de la presente obra. Oídos, nariz, garganta y cirugía de cabeza y cuello, 4a ed. D.R. © 2014 por Editorial El Manual Moderno, S.A. de C.V. ISBN 978-607-448-414-4 ISBN 978-607-448-413-7 (Versión electrónica) Para mayor información sobre: t$BUÈMPHPEFQSPEVDUP t/PWFEBEFT t%JTUSJCVDJPOFTZNÈT www.manualmoderno.com Miembro de la Cámara Nacional de la Industria Editorial Mexicana, Reg. núm. 39 Todos los derechos reservados. Ninguna parte de esta publicación puede ser reproducida, almacenada en sistema alguno de tarjetas perforadas o transmitida por otro medio —electrónico, mecánico, fotocopiador, registrador, etcétera— sin permiso previo por escrito de la Editorial m Escajadillo, Jesús Ramón Oídos, nariz, garganta y cirugía de cabeza y cuello –- Cuarta edición. -- México : Editorial El Manual Moderno, 2014. xviii, 974 páginas : ilustraciones ; 28 cm. Incluye índice ISBN 978-607-448-414-4 ISBN 978-607-448-413-7 (versión electrónica) 1. Otorrinolaringología. 2. Cabeza- Cirugía. 3. Cuello – Cirugía. I. Título. 617.51-scdd21 Biblioteca Nacional de México Director editorial y de producción: Dr. José Luis Morales Saavedra Editora asociada: Lic. Vanessa Berenice Torres Rodríguez Diseño de portada: DP. Cynthia Karina Oropeza Heredia Al Creador Prefacio Esta obra es un libro de consulta, orientado tanto al médico general y el estudiante de medicina como al resi dente de la especialidad, ya que los temas se tratan de una manera versátil, sencilla, pero sin dejar por ello de estar actualizados, presentando los avances más importantes en el campo de la otorrinolaringología y la cirugía de cabeza y cuello. Está constituido por 31 capítulos, en los que se incluye la información más reciente con respecto a la etiología, diagnóstico y tratamiento de las diferentes enfermedades que afectan a los pacientes en esta especialidad. Se describen y comentan técnicas quirúrgicas de temas poco tratados en libros de texto anteriores, como son cirugía estética y reconstructiva de cabeza y cuello, colgajos, padecimientos oncológicos y una clasificación completa y actualizada de tumores, tanto benignos como malignos, de oídos, nariz, garganta y cuello. Se ha incluido en el libro un capítulo de fonocirugía, que constituye una subespecialidad relativa- mente joven en el campo de la otorrinolaringología y ofrece grandes posibilidades de creatividad para el cirujano de cabeza y cuello. En el capítulo de auxiliares de diagnóstico en otología, se trata de una manera concisa y precisa el difícil tema de la electronistagmografía. El libro introduce el nuevo botón de Escajadillo para rehabilitación de la voz posterior a la laringectomía total, así como una técnica innovadora de levantamiento de un colgajo fasciocutáneo de trapecio. Al final de cada capítulo aparecen las referencias de donde se obtuvo la información, así como las que el autor recomienda para obtener un mayor conocimiento del tema a tratar. El autor espera que esta obra pueda constituir una fuente de consulta actualizada rápida y eficaz para todos los médicos de la comunidad latinoamericana. J. R. Escajadillo VII Agradecimientos Agradezco a mis hijos Paul Alexei, Tamara, Natasha, Paulina y Camila, así como a mi compañera Alejandra su comprensión y ayuda para poder realizar esta nueva edición. Que Dios los bendiga, a todos. Jesús Ramón IX Contenido Prefacio ......................................................................................................................................................... VII Agradecimientos .............................................................................................................................................IX Introducción ................................................................................................................................................ XIII Capítulo 1. Embriología y anatomía del oído .................................................................................................. 1 Capítulo 2. Fisiología del oído ...................................................................................................................... 15 Capítulo 3. Auxiliares diagnósticos en otología ............................................................................................. 25 Capítulo 4. Oído externo .............................................................................................................................. 53 Capítulo 5. Oído medio y mastoides .............................................................................................................. 71 Capítulo 6. Oído interno ............................................................................................................................. 111 Capítulo 7. Nervio facial ............................................................................................................................. 153 Capítulo 8. Lesiones otoneurológicas .......................................................................................................... 177 Capítulo 9. Cirugía del oído medio infectado ............................................................................................. 211 Capítulo 10. Embriología, anatomía y anomalías congénitas de nariz y senos paranasales .......................... 229 Capítulo 11. Fisiología de nariz y senos paranasales .................................................................................... 247 Capítulo 12. Epistaxis, perforaciones del tabique, cara y colgajos faciales locales ...................................... 259 Capítulo 13. Rinitis alérgica y vasomotora ................................................................................................... 307 Capítulo 14. Infecciones de nariz y senos paranasales ................................................................................. 323 Capítulo 15. Tumores de nariz y senos paranasales ...................................................................................... 359 XI ERRNVPHGLFRVRUJ XII Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 16. Cirugía nasal ........................................................................................................................... 401 Capítulo 17. Embriología, anatomía y fisiología de boca, faringe y esófago ................................................. 433 Preliminares Capítulo 18. Cavidad bucal ......................................................................................................................... 443 Capítulo 19. Nasofaringe ............................................................................................................................ 471 Capítulo 20. Bucofaringe e hipofaringe ....................................................................................................... 485 Capítulo 21. Embriología, anatomía y fisiología de la laringe ...................................................................... 529 Capítulo 22. Enfermedades congénitas, infecciosas, traumáticas y funcionales de la laringe ....................... 543 Capítulo 23. Tumores laríngeos ................................................................................................................... 595 Capítulo 24. Fonocirugía .............................................................................................................................. 639 Capítulo 25. Endoscopia, tráquea, bronquios, mediastino y esófago ............................................................ 683 Capítulo 26. Patología del cuello: tiroides, paratiroides y colgajos miocutáneos ........................................ 727 Capítulo 27. Radioterapia y quimioterapia de cabeza y cuello: nutrición parenteral .................................. 819 Capítulo 28. Glándulas salivales ................................................................................................................. 841 Capítulo 29. Fracturas y dolores craneofaciales ........................................................................................... 875 Capítulo 30. Radiología................................................................................................................................ 901 Capítulo 31. Anestesia y fotografía .............................................................................................................. 923 Índice ........................................................................................................................................................... 935 ERRNVPHGLFRVRUJ Introducción LA OTORRINOLARINGOLOGÍA EN ALGUNAS DE LAS CULTURAS DE MESOAMÉRICA La otorrinolaringología en algunas de las culturas de Mesoamérica La historia médica de México constituye una parte de la historia médica universal, a la cual debe estar siempre ligada y fundida, pero sin perder por ello su individualidad. Los habitantes de lo que hoy llamamos Mesoamérica fueron creadores de importantes culturas. Pueblos de grandeza a quienes preocupaba el misterio de la muerte, contaban con una compleja organización política, social y religiosa, y llegaron a desarrollar no sólo la arquitectura, la ingeniería, las matemáticas, la artesanía y la astronomía, sino también dedicaron gran parte de sus observaciones a la medicina. Es interesante señalar que los médicos estaban ampliamente especializados, como los Papiani–Cani o naturistas, los Texoxotla–Tícitl o cirujanos y los Tlamatepatli o médicos internistas. Igualmente, cultivaban una especialización parecida a la que en nuestros días corresponde a ojos, oídos, nariz y garganta (Noriega 1976, Sahagún, 1956; De la Cruz, 1964). Es evidente que los padecimientos otorrinolaringológicos existieron con relativa frecuencia entre las poblaciones mesoamericanas, sobre todo si tomamos en cuenta la gran cantidad de recursos terapéuticos que existían para el manejo de las diversas afecciones en esta área, así como por las huellas de lesiones localizadas en materiales osteológicos. El médico que en la época prehispánica se dedicaba a los oídos, nariz y garganta ejercía su profesión aplicando dos artes: una, la del diagnóstico de los padecimientos, para lo cual se podría considerar como un Tlamatepatli; otra, en la que aplicaba pro- cedimientos quirúrgicos, desarrollando para ello las labores de un Texoxotla–Tícitl (cirujano). Lo anterior se hace patente en las heridas de nariz con desprendimiento, las cuales suturaban empleando cabello, y sobre los puntos aplicaban una mezcla de miel, metl y sal (Escajadillo, 1983). Sahagún (1956) y Flores Acosta (1974) han señalado que, cuando el tratamiento no daba resultado, se ponía una nariz postiza y, cuando la cicatriz quedaba defectuosa, volvía a intervenirse hasta corregir el defecto, situación que nos hace considerar la avanzada práctica rinológica que tenían. El autor y unos colaboradores realizamos un estudio (1983) en el Departamento de Antropología Física del Instituto Nacional de Antropología Humana (México), en donde se valoraron un total de 864 cráneos de tres diferentes poblaciones: a) Tlatilco (Estado de México), que corresponde al periodo preclásico medio (1400–400 a. C.) (458 cráneos). b) Jaina (Campeche), que representa al periodo clásico tardío (650–1000 d. C.) (56 cráneos). c) Tlatelolco (México, D. F), periodo posclásico tardío (1325–1521 d. C.) (350 cráneos). Además de determinar diferentes índices antropomórficos, se identificaron de manera macroscópica lesiones patológicas otorrinolaringológicas existentes en estos cráneos, completando el estudio en algunos de ellos con el uso de rayos X. Los resultados mostraron que, en los cráneos que correspondían al sexo masculino de la población de Tlatilco, predominaban las narices de forma leptorrina, y en las mujeres la mesorrina. En Tlatelolco no hubo diferencias significativas entre los sexos ni en los índices antropomórficos estudiados (índice nasal, distancia interorbitaria y ángulo nasofrontal). En Jaina, por otro lado, en los hombres predominaban la nariz mesorrina, mientras que en las mujeres era de tipo platirrina. XIII ERRNVPHGLFRVRUJ XIV Oído, nariz, garganta y cirugía de cabeza y cuello Preliminares Figura 1. Población de Tlatilco. Presencia de una exostosis sobre el conducto auditivo externo, al cual bloquea en forma parcial. Figura 2. Fotografía de un cráneo de Tlatelolco, en la que se aprecia una gran resorción de los huesos propios de la nariz, estenosis de la abertura piriforme, probable lesión expansiva del seno etmoidal izquierdo y deformación del piso orbitario, y región malar derechos, lesiones posiblemente secundarias a un proceso luético. ERRNVPHGLFRVRUJ Introduccióna XV XV Preliminares Figura 3. Radiografía del cráneo de la figura 2, en la que se observa hipoplasia del seno frontal derecho, crista galli prominente, destrucción de la pared lateral nasal izquierda y de la lámina papirácea. Nótese la opacidad en ambos antros maxilares. Figura 4. Osteoma del seno frontal izquierdo existente en un cráneo de la población de Tlatelolco. ERRNVPHGLFRVRUJ XVI Oído, nariz, garganta y cirugía de cabeza y cuello Preliminares Figura 6. Población de Jaina. Nótese la existencia de una fístula oroantral secundaria a un proceso infeccioso del segundo molar. Figura 5. Figurilla de Jaina, en la que se aprecia una afección del globo ocular izquierdo, con facies característica de dolor, la cual, por ser unilateral, se supone es debida a patología infecciosa o tumoral de los senos frontal y etmoidal. ERRNVPHGLFRVRUJ Introduccióna XVII XVII Preliminares Figura 7. Fotografía de la base del cráneo en la que se observa una erosión importante en la región del foramen yugular, que se considera pudo deberse a un tumor glómico (Jaina, Campeche). Figura 8. Radiografía tomada del cráneo de la figura 9. La flecha señala al sitio de la erosión existente a nivel del foramen yugular. ERRNVPHGLFRVRUJ XVIII Oído, nariz, garganta y cirugía de cabeza y cuello Preliminares En las poblaciones mencionadas se encontró una gran variedad de lesiones, habiendo en Tlatilco más exostosis y estenosis del conducto auditivo externo (figura 1); en Tlatelolco la patología nasal fue más frecuente (figuras 2 y 3) y en Jaina se hicieron más aparentes los abscesos grandes, tanto mandibulares como maxilares (figuras 4 y 5). El análisis de 210 figurillas mostró la presencia de fosas nasales en el 50% de las piezas elaboradas por la población de Tlatilco (N–100) y en el 70% de las de Jaina (N–110). El cuello, por lo general, es corto o ausente y, en cuanto al pabellón auricular, está representado en el 80% de las figurillas de Tlatilco, mientras que en Jaina únicamente en el 5%, predominando en este último las orejeras. Se sabe que las figurillas representan fuentes indirectas para el estudio de enfermedades en poblaciones ya que existen patrones de índole cultural y religioso que dieron origen a este tipo de representaciones; sin embargo, cabe señalar que las figurillas de Jaina son más realistas en relación a las de Tlatilco, cuya representación se aleja más de la forma humana. En una de las figurillas de Jaina se pudo apreciar la presencia de una afección del ojo izquierdo, acompañada de una facies característica de dolor, y la que se supone fue debida a patología infecciosa o tumoral de los senos etmoidal y frontal (figura 6); en uno de los cráneos de esta población también se detectó una erosión importante en la región del foramen yugular, que el autor considera pudo haberse debido a un tumor glómico (figuras. 7 y 8). Temazcalteci, abuela de los baños, era la diosa de la medicina y de las hierbas medicinales, siendo adorada tanto por médicos como por cirujanos. El estudio de los Códices Florentino y Badiano nos enseña el gran acervo de conocimientos existentes para el tratamiento de las enfermedades y, en especial, de los padecimientos otorrinolaringológicos, como puede observarse en el cuadro 1, en el que tan sólo se mencionan algunas de las hierbas más utilizadas para este fin La cirugía practicada por los Texoxotla– Tícitl era muy variada, ya que consistía desde la perforación del lóbulo de la oreja con puntas de metl Cuadro 1. Oído Nariz Garganta Padecimiento Tratamiento Otitis externa Cuechtli (mariscos) Otitis media Chipilli Otalgia Chatalhuic Sordera Tlápatl Rinitis atrófica Coztomal Sequedad nasal Ulli Epistaxis Chilpanton (chilillo) Rinitis aguda Yucuxoton Amigdalitis Xaltomatl (tallo) Disfagia Tlacizpatli (nuez) Laringitis Ulli–metl–miel Tos Chia Parálisis facial Copalli Tuberculosis pulmonar Huey Patli Parotiditis Cocoxohuitl (maguey), mutila ciones del tabique cartilaginoso y membranoso, y perfo raciones del labio inferior, hasta la aplicación de prótesis nasales. Es indudable la importancia que daban al pabellón auricular, pues se consideraba como trofeo de guerra (Códice Boturini); además, se menciona que efectuaban automutilaciones como ofrenda a sus deidades. La cirugía practicada por los Texoxotla–Tícitl era muy variada, ya que consistía desde la perforación del lóbulo de la oreja con puntas de metl (maguey), mutilaciones del tabique cartilaginoso y membranoso, y perforaciones del labio inferior, hasta la aplicación de prótesis nasales. Es indudable la importancia que daban al pabellón auricular, pues se consideraba como trofeo de guerra (Códice Boturini); además, se menciona que efectuaban automutilaciones como ofrenda a sus deidades. REFERENCIAS 1. De la Cruz M: Libellus de Medicinalibus Indorum Herbis. Manuscrito azteca de 1552. Según traducción latina de Juan Badiano, I.M.S.S., México, 1964. 2. Escajadillo JR, Salas ME, Pijoan C, Salas M: Manifestaciones de patología otorrinolaringológica en algunas culturas mesoamericanas. An Soc Mex Otorrinolar 1983;28: 3–8. 3. Flores F: Historia de la medicina en México. Desde la época de los indios hasta la presente. México, 1974, 1ª ed. 4. Noriega R: Esplendor del México antiguo. Centro de Investigaciones Antropológicas de México. México, 1976. 5. Sahagún B: Historia general de las cosas de la Nueva España. Libro IV, Cap. XXI, México, Ed. Porrúa, 1956, 1ª ed. 5. Sten M: Las extraordinarias historias de los códices mexicanos. México, Ed. Joaquín Mortin, 1972. ERRNVPHGLFRVRUJ Embriología y anatomía del oído EMBRIOLOGÍA PABELLÓN AURICULAR El pabellón auricular, el conducto auditivo externo y la capa epitelial de la membrana timpánica se derivan del ectodermo de la primera hendidura faríngea. TROMPA DE EUSTAQUIO La trompa de Eustaquio, la cavidad timpánica y la mucosa de la membrana timpánica se originan del endodermo de la primera bolsa faríngea. CADENA DE HUESECILLOS La cadena de huesecillos proviene del primero y segundo arcos branquiales. El martillo y el yunque se derivan del cartílago de Meckel (primer arco branquial). El estribo, el tendón y el músculo estapediales provienen del cartílago de Reichert (segundo arco branquial). A las 14 semanas de gestación, la cadena osicular es todavía cartilaginosa. El primer signo de osificación aparece en el martillo a la semana 15a. La presencia de periostio se identifica en un principio sobre el proceso largo del yunque a la 16a semana (embrión de 117 mm). El músculo tensor del tímpano tiene su origen en el primer arco branquial. Al quinto mes de gestación, la cadena osicular adopta su configuración adulta. HIPOTÍMPANO El hipotímpano se desarrolla en un periodo de 10 semanas (22 a 32 semanas de la gestación). El hueso timpánico se osifica en forma membranosa (ocho a 36 semanas). Una de las áreas que de manera temprana sufre resorción del mesénquima es el hipotímpano, al contrario del nicho de la ventana redonda que es una de las últimas. Las tres estructuras que se osifican en el hipotímpano son: En la fisura hipotimpánica medial se encuentra la rama timpánica del nervio glosofaríngeo o nervio de Jacobson, junto con una arteria y vena que suministran circulación a la porción lateral del hipotímpano y la superficie medial de la membrana timpánica. A la semana 32a de gestación, el hipotímpano adquiere su forma adulta. El nervio de Jacobson se origina en la porción cefálica del ganglio petroso inferior a las 16 semanas. La fisura timpanomeníngea (fisura de Hyrtl) se cierra debido a la fusión entre el centro medial de osificación de la cápsula ótica canalicular y la barra cartilaginosa que forma el labio medial del nicho de la ventana redonda. Esta fisura se oblitera a la 24a semana de la gestación. Antes de esta semana existen dos grandes comunicaciones entre el oído medio y la fosa craneal posterior: la fisura de Hyrtl y el hipotímpano primitivo. El cartílago de Reichert predetermina la altura del bulbo de la vena yugular y el nivel del piso del hipotímpano, por lo que algunas alteraciones en el desarrollo del cartílago de Reichert pueden producir dehiscencias y malformaciones del hipotímpano. La frecuencia de dehiscencias del bulbo de la yugular en el hipotímpano se calcula en casi 6%. Capítulo 1 a) El hueso timpánico. b) La porción canalicular lateral de la cápsula ática. c) El borde petroso del hueso. LABERINTO ÓTICO El laberinto ótico inicia su diferenciación al final de la tercera semana con la aparición de las placodas auditivas, que son engrosamientos del ectodermo, y se encuentran en forma bilateral en la porción media del telencéfalo. Estas placodas, al fusionarse, forman el otocisto. La porción craneal de éste crea el conducto endolinfático y la porción caudal del conducto coclear. Su porción intermedia se divide para conformar el utrículo y el sáculo. A la quinta semana de gestación aparecen tres bolsas arciformes en la porción utricular de la vesícula ótica, que luego se convertirán en los conductos semicirculares; primero se forma el superior (sexta semana), seguido por el pos- 1 ERRNVPHGLFRVRUJ 2 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 1 terior y el lateral. Entre la quinta y sexta semanas, una evaginación ventral del sáculo da origen al primordio coclear. La primera vuelta de la cóclea toma forma a la octava semana, la segunda a la l0a y con posterioridad la cóclea alcanza sus dos y media vueltas (forma adulta) a la 25a. Con el crecimiento de la cóclea, la comunicación con el sáculo, que corresponde al ductus reuniens, se torna más estrecha con la presencia de una luz no funcional. El conducto semicircular superior alcanza su tamaño adulto hacia la 20a semana. MÁCULA tiende desde el modiolo hasta la escala media. La pared anterior del conducto coclear se fusiona con la de la escala vestibular para formar la membrana vestibular; la pared posterior integra, junto con la escala timpánica, la membrana basilar, y la pared externa guarda relación con el ligamento espiral. La estría vascular descansa sobre este ligamento y, en el ser humano, ésta termina su mitosis en el posparto, con maduración máxima durante la primera semana de vida; además, constituye la fuente principal para alcanzar una concentración iónica madura del líquido endolinfático. SISTEMA PERILINFÁTICO Las máculas se derivan del epitelio del utrículo y el sáculo en el punto en que los nervios entran en sus paredes. Este proceso se inicia a la séptima semana de gestación. A la semana 12a se hacen aparentes dos tipos de células: a) Células de soporte, que secretan una capa gelatinosa de mucopolisacáridos. b) Las células ciliadas. Entre las semanas 14a y 16a aparecen en la membrana otolítica depósitos calcáreos, llamados otoconias; es en este momento cuando dichas estructuras adquieren su forma adulta. ÁMPULA Las ámpulas de los conductos semicirculares se localizan en la extremidad anterior del conducto superior y el lateral, y en la extremidad inferior del conducto semicircular posterior. Las crestas ampulares comienzan su crecimiento en la séptima semana y forman una cúpula, la cual actúa con mecanismo valvular que se mueve con el paso de los líquidos óticos. Tanto las crestas como las cúpulas integran un puente en ángulo derecho en la dirección de la endolinfa. EPITELIO DEL ÓRGANO DE CORTI El epitelio del órgano de Corti se diferencia en todas sus vueltas cocleares hacia la mitad de la gestación. Este proceso se inicia con mayor rapidez en la vuelta basal y es más lento en la región apical. A la 11a semana, el epitelio de la vuelta apical consiste en una capa gruesa seudoestratificada de células. A la 16a semana, el conducto de Corti empieza a aparecer en la porción basal de la cóclea y, a la 21a semana, este conducto esta desarrollado en todas las vueltas cocleares. A partir de entonces se origina la cápsula ósea que cubre al oído interno. En el feto de 25 semanas, el ganglio espiral se semeja en grado notorio al del adulto. El modiolo y las escalas vestibulares y timpánicas inician su diferenciación en la quinta semana. La separación entre estas escalas es efecto de la lámina espiral ósea, que se ex- El sistema perilinfático del laberinto posee un origen mesodérmico. Se inicia alrededor del segundo mes de la gestación y se completa en un periodo aproximado de cuatro meses. Este sistema comienza en la región que ocupará el vestíbulo, con la formación del retículo, el cual da origen al espacio periótico evidente entre la novena y 10a semanas. El vestíbulo se forma después de que las escalas timpánica y vestibular son evidentes. La escala timpánica se comunica con la escala vestibular sólo en la porción distal del conducto coclear, a través de una abertura denominada helicotrema. Tres importantes prolongaciones del espacio periótico son: a) El conducto periótico dentro del acueducto coclear. b) La fossula ante fenestram c) La fossula post fenestram El conducto periótico crea una comunicación trabecular hacia el espacio subaracnoideo. La fossula ante fenestram y la fossula post fenestram son prolongaciones externas del vestíbulo en la porción anterior y posterior de la ventana oval. La fossula experimenta necrosis en forma gradual y se reemplaza con tejido conectivo; durante la osificación de la cápsula ótica, la capa de tejido pericondrial en los bordes de la fossula conforma un revestimiento irregular de cartílago, que varía en forma y tamaño en las personas adultas. La fossula muestra un desarrollo más sacular y en dirección de la porción posterior del estribo, para comunicarse con el oído medio en el 25% de los casos; sólo el 5% experimenta cambios cartilaginosos y óseos. DESARROLLO DEL SISTEMA AUDITIVO Desarrollo del sistema auditivo: éste puede modificarse por alteraciones anatómicas y variaciones del estímulo acústico. Según Lim, las células del otocisto, formadas en la porción ventral, dan origen a la cóclea. En el ser humano, la maduración anatómica del laberinto ocurre en el quinto y sexto meses de vida fetal. Las células ciliadas concluyen su mitosis alrededor del segundo mes. Anomalías en el desarrollo del tubo neural causan modificaciones en la estructura del oído interno. Los núcleos auditivos del tallo cerebral alcanzan su ERRNVPHGLFRVRUJ Embriología y anatomía del oídoa varones. Al nacimiento y a los siete años de edad se presentan periodos de rápido crecimiento en el tamaño de la mastoides. Desde el primer año de vida hasta la etapa adulta es previsible, en promedio, un crecimiento aproximado de 2.6 cm en la longitud de la mastoides, con 1.7 cm en anchura y 0.9 cm en profundidad (varón); para la mujer, estas cifras son de 2.0 cm de longitud, 1.7 cm de ancho y 0.8 cm de profundidad. Al nacimiento, el conducto auditivo externo es corto debido al reducido crecimiento hacia fuera del anillo timpánico. La membrana timpánica se encuentra en forma horizontal. En el primer año de vida se alcanza la relación normal de una tercera parte del conducto cartilaginoso y dos terceras partes del óseo; de esta manera, la membrana timpánica adopta una posición más vertical. ANATOMÍA DEL OÍDO El oído se divide en las siguientes áreas (figura 1-1): a) Oído externo. b) Oído medio. c) Oído interno. Cartílago del pabellón auricular Techo del tímpano Martillo Conductos Yunque semicirculares Nervio auditivo Cóclea Hélix Vestíbulo Antihélix Cartílago del conducto auditivo externo Trompa de Eustaquio Arteria carótida interna Vena yugular interna Figura 1–1. Anatomía del oído. ERRNVPHGLFRVRUJ Capítulo 1 tamaño adulto cerca del duodécimo día posparto. La privación o disminución del sonido en el oído reduce el tamaño de varios grupos celulares de los núcleos auditivos centrales primarios y secundarios. La maduración de las células ciliadas se inicia en la región basal de la cóclea y termina en las porciones más apicales. Pujol señala que el núcleo coclear, el colículo inferior, el cuerpo geniculado medial y la corteza auditiva tienen un patrón centrípeto de maduración (desde la periferia hasta la corteza). Asimismo, se ha demostrado en el gato una organización tonotópica del núcleo central del colículo inferior. Keith refiere que, en los recién nacidos de término, la maduración del sistema auditivo se lleva a cabo en los primeros 18 meses. A las dos semanas de edad, el lactante puede reconocer el patrón rítmico del habla. La diferenciación en el tono y fonación se alcanza hasta el octavo mes. Hasta el tercer año de vida, la cápsula ótica queda formada por hueso compacto. El anillo timpánico inicia su osificación a la novena semana de gestación y alcanza su tamaño adulto a las 35 semanas; el anillo es incompleto en su parte superior. La neumatización del hueso temporal se completa hacia los seis años; no obstante, es posible reconocer su desarrollo máximo hasta los 10 a 15 años en las mujeres y 25 a 30 en los 33 Oído, nariz, garganta y cirugía de cabeza y cuello 4 OÍDO EXTERNO Pabellón auricular Capítulo 1 El pabellón auricular (PA) está compuesto por cartílago elástico cubierto por piel, sin tejido subcutáneo, y se une al cráneo por tres músculos extrínsecos: los músculos auriculares anterior, superior y posterior. Al estar bien desarrollados pueden mover al PA. Los músculos intrínsecos son casi indistinguibles y su función es mínima; entre éstos se encuentran el músculo de la hélice menor, el músculo del trago y el del antitrago. Riego: arteria temporal superficial y arteria auricular posterior, con sus venas correspondientes. Drenaje linfático: ganglios auriculares anterior, posterior e inferior. Inervación: el nervio auricular mayor inerva la porción medial de la aurícula; el nervio occipital menor la porción superior de ésta; y el nervio auriculotemporal la porción lateral. Los nervios motores de los músculos extrínsecos proceden de las ramas temporal y auricular posterior del nervio facial. Estructuras del PA: hélix, antihélix, tubérculo auricular de Darwin, fossa triangularis, escala, concha, trago, antitrago, lóbulo, incisura aural anterior (figura 1-2). El tamaño del pabellón auricular alcanza su anchura madura entre los seis y siete años de edad y su longitud al inicio de la pubertad, entre los 12 y 13 años. Fossa triangularis Sin embargo, con el paso de la edad aumenta de tamaño debido a cambios estructurales relacionados con cambios morfológicos de las fibras elásticas y los componentes de la matriz extracelular del cartílago auricular, que tienden a ser más evidentes después del sexto decenio de la vida. Conducto auditivo externo El conducto auditivo externo (CAE) se encuentra entre el pabellón auricular y la membrana timpánica. Tiene un curso medial e inferior en forma de S. La pared posterosuperior posee 25 mm de longitud y su pared anteroinferior 31 mm, lo cual se debe a la posición oblicua de la membrana timpánica. La visibilidad de la membrana timpánica puede aumentarse al jalar el pabellón auricular hacia arriba y atrás. Más de la mitad del CAE es óseo y el resto fibrocartilaginoso. La piel del CAE es más gruesa en su porción cartilaginosa y más delgada en la porción ósea, sobre todo en las partes anterior e inferior. La porción cartilaginosa también cuenta con folículos pilosos y glándulas sebáceas; estas últimas también pueden observarse en la porción posterosuperior del conducto óseo. Riego: arteria auricular posterior, arteria temporal superficial, arteria auricular profunda. Las venas drenan a través de las venas maxilar y yugular externa. Drenaje linfático: a través de los ganglios auriculares anterior, posterior e inferior. Inervación: la parte superior del CAE y una parte de la membrana timpánica reciben inervación del nervio de Arnold, rama del X par craneal, y de la rama auriculotemporal del nervio mandibular. Algunos pacientes experimentan tos durante la exploración del CAE debido a la estimulación del nervio de Arnold. Hélix Fossa semilunaris Membrana timpánica Crura antihélix Escafa Crus helicis Concha Antihélix Trago-incisura anterior Surco auricular posterior Antitrago Incisura intertrágica Lóbulo Figura 1–2. Anatomía del pabellón auricular. La membrana timpánica (MT) separa al CAE de la caja timpánica. Es semitransparente y de forma elíptica. Mide alrededor de 9 a 10 mm en sentido vertical y 8 a 9 mm en el horizontal. La porción más externa es cóncava; la más retraída corresponde al umbo, formado por el manubrio del martillo. El grosor de la MT es de 0.074 mm y es más gruesa cerca de la porción inferior del annulus y más delgada en su cuadrante posterosuperior. La apófisis corta del martillo, y los repliegues maleolares que se extienden hacia la incisura timpánica de Rivinus, dividen la membrana timpánica en la porción flácida (membrana de Shrapnell) y la tensa. La porción tensa se compone de cuatro capas: 1. Externa o epitelial (50 a 60 μ de ancho). 2. Capa fibrosa radiada, formada por fibras de colágena. 3. Capa fibrosa no radiada, compuesta por fibras circulares, parabólicas y transversas. 4. Capa mucosa en continuidad con la mucosa de la caja timpánica (20 a 40 μ de grosor). ERRNVPHGLFRVRUJ Embriología y anatomía del oídoa La porción flácida o membrana de Shrapnell contiene sólo las capas epiteliales y mucosas, y carece de la porción fibrosa. Por otro lado, Berger y Sade (1996) identifican cinco capas en la porción tensa de la membrana timpánica: La porción flácida de la membrana timpánica tiene tan sólo una lámina propia formada por tejido conectivo con abundantes fibras elásticas y de colágena. El epitelio de la membrana timpánica migra en forma centrífuga a partir del umbo a un ritmo de 0.05 mm por día. Riego: rama timpánica de la arteria auricular profunda, rama timpánica anterior de la arteria maxilar interna y rama estilomastoidea de la arteria auricular posterior. Drenaje venoso: es el mismo del CAE. Inervación: rama auricular del vago, rama timpánica del glosofaríngeo (nervio de Jacobson) y rama auriculotemporal del mandibular. OÍDO MEDIO Cavidad timpánica del oído medio La cavidad timpánica del oído medio es un espacio recubierto por mucosa que se extiende entre la membrana timpánica y el laberinto óseo. Longitud: 15 mm; altura: 15 mm el segmento anterior y 7 mm el posterior; grosor, 5 mm, aunque en el plano del umbo puede ser de 2 mm. La cavidad se divide en: 1. Caja timpánica. 2. Receso epitimpánico. 3. Antro timpanomastoideo. 4. Receso hipotimpánico. Caja timpánica La caja timpánica contiene seis paredes: 1. Pared interna: está formada por la porción horizontal del acueducto de Falopio, por donde pasa el nervio facial, y la porción suprafacial, que pertenece al áti- co, y que está limitada por la saliente del conducto semicircular lateral, que sirve como punto de referencia en una aticotomía. Por delante del conducto horizontal se encuentra el ático anterior, deprimido en forma de fosita para la cabeza del martillo. Parte subfacial: fosa de la ventana oval; por delante se halla el surco anterior a la ventana y por detrás se halla el seno timpánico posterior. Al fondo y hacia atrás de esta pared se encuentra la ventana redonda, adyacente al seno timpánico. La membrana de la ventana redonda se integra con tres capas: la externa o epitelial; la media, formada por fibras de colágena, elastina y fibroblastos; y capa interna, formada por células mesoteliales. El seno timpánico de Steinbrugge (1834) o cavidad subpiramidal de Hugier es el verdadero trasfondo de la caja del tímpano; su orificio se encuentra frente a la ventana redonda. Entre las ventanas redonda y oval se localiza el promontorio de Schwalbe, que corresponde a la primera vuelta de la espiral de la cóclea 2. Pared externa: está conformada en gran medida por el tímpano, el cual está sostenido por un anillo fibroso o rodete anular de Gerlach. 3. Pared anterior: se la denomina pared tubocarotídea. El segmento superior corresponde al protímpano, cuyo orificio sobresale por el conducto del músculo del martillo. Por delante de este orificio se identifica el orificio de salida de la cuerda del tímpano. El segmento inferior es una lámina ósea de 3 a 4 mm de grosor que separa la caja timpánica del conducto carotídeo. El nervio caroticotimpánico pasa a través de finos canalículos óseos. El orificio de la trompa de Eustaquio tiene un ángulo de 45°, con una longitud de 31 a 38 mm; su tercio posterior es óseo y las dos terceras partes anteriores son cartilaginosas. El orificio desemboca en el torus tubarius en la nasofaringe, el cual mide 10 a 15 mm de grosor. Riego: el de la trompa procede de la arteria palatina ascendente; rama faríngea de la arteria maxilar interna; arteria del conducto pterigoideo; arteria faríngea ascendente; y arteria meníngea media. Drenaje venoso: se lleva a cabo a través del plexo pterigoideo. El principal músculo dilatador de la trompa de Eustaquio es el tensor del velo del paladar, que está compuesto por un haz lateral, el cual termina en un tendón que se inserta en el proceso hamelar de la lámina pterigoidea, y un haz medial, que se encuentra adyacente a la pared membranosa lateral de la trompa. Inervación: rama mandibular del nervio trigémino. El haz medial, conocido como elevador del velo del paladar, recibe inervación de una rama faríngea del X par craneal. 4. Pared posterior: está limitada por el aditus ad antrum (conducto timpanomastoideo). En el ángulo inferior se encuentra la fosa del yunque, punto guía común en toda antroaticotomía. La eminencia estiloide es una saliente en la porción posteroinferior de la caja, y corresponde a la implantación de la apófisis estiloide en el temporal. Es la única parte del temporal que siempre contiene médula ósea. La pared posterior ERRNVPHGLFRVRUJ Capítulo 1 1. Una capa epitelial externa, compuesta de tres a cinco capas de células. 2. Una capa media, que forma la lámina propia y que contiene: a) Una capa subepitelial formada por tejido conectivo y en la que se encuentran capilares y nervios. b) Una capa fibrosa media que contiene fibras de colágena radiales en forma externa y circulares en forma interna. c) Una capa submucosa de tejido conectivo, idéntica pero más delgada que la capa subepitelial. 3. Una capa mucosa interna formada por una capa única de células aplanadas cuboidales. 55 6 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 1 de la caja no está en la prolongación de la parte posterior del conducto; hay un desligamiento: el retrotímpano que se prolonga por debajo, por fuera y por dentro del facial. 5. Pared superior: es el techo del tímpano, limitado por la sutura petroescamosa; su grosor es de 1 mm. De la pared superior desciende una cresta, la denominada cresta petroescamosa de Rouvière, que divide la parte posterior del ático y crea un receso medial; esta cisura en el niño puede ser una puerta de entrada para una complicación intracraneal de una otitis supurada 6. Pared inferior: es el receso hipotimpánico que constituye el techo de la fosa yugular y recibe también el nombre de pared yugular. Contiene al orificio timpánico del conducto de Jacobson, situado en dirección vertical de la cresta anterior de la ventana redonda. Hay vasos venosos que se dirigen hacia el golfo de la yugular, así como al orificio arterial de la arteria timpánica inferior. Huesecillos del oído medio La cadena osicular consta de tres huesecillos: martillo, yunque y estribo; éstos hacen posible la conducción del sonido desde el oído externo hasta el interno. Martillo: es el mayor de los huesecillos; mide 8 a 9 mm de longitud; su cabeza está situada en el áti- co; presenta una cara posterointerna articular; el cuello corresponde a la membrana de Shrapnell y la cara interna proporciona la inserción del tendón del músculo del martillo. El mango está dirigido hacia abajo y atrás, y termina en espátula, enganchado en el tímpano, entre las capas fibrosa y mucosa. Los ligamentos maleolares anterior y posterior se insertan en su apófisis externa. Yunque: es la pieza ósea más pesada, la menos fija y susceptible de luxación por traumatismos en su articulación con el estribo. Consta de un cuerpo con cara anterior articular, un proceso corto (5 mm) y uno largo (7 mm) que se articula con el estribo a través de la apófisis lenticular. Estribo: es el menor de los huesecillos, pesa 2.5 mg y es seis veces menor que el bloque incudomaleolar; su altura aproximada es de 3.3 mm; la platina mide 3 mm por 1.4 mm. Consta de una cabeza articular, un cuello en el que se inserta el tendón del músculo del estribo, los crura anterior y posterior, y la platina, que adopta la forma de la ventana oval. Además del ligamento anular del estribo, y de la unión del martillo con la membrana timpánica, otros cuatro ligamentos sostienen la cadena osicular: ligamentos maleolares superior, anterior, lateral y posterior; los músculos tensor del tímpano y estapedial conforman un soporte adicional (figura 1–3). Figura 1–3. Huesecillos del oído medio. ERRNVPHGLFRVRUJ Embriología y anatomía del oídoa Articulaciones del oído medio Las articulaciones del oído medio son tres: El utrículo se encuentra 1.5 a 2 mm de distancia, el sáculo a 1 mm y el conducto coclear a 1 mm del plano de la base. Espacios timpánicos 1. Espacio de Prussak: está limitado por la pars flaccida, el proceso corto del martillo y el ligamento maleolar lateral. 2. Espacio o bolsa de von Troltsch: se halla delimitado por el mango del martillo, la porción tensa y los ligamentos maleolares anterior y posterior. Riego de la caja timpánica Arteria timpánica anterior, rama de la arteria maxilar interna, arteria estilomastoidea, rama de la auricular posterior, arteria petrosa superficial, rama de la arteria meníngea media, arteria timpánica inferior, rama de la arteria faríngea ascendente; todas éstas son ramas de la arteria carótida externa. Figura 1–4. Fotografía que muestra la presencia de huesecillos del oído medio, así como el nervio de la cuerda del tímpano. Nótese la articulación incudoestapedial, el hipotímpano y el nicho de la ventana redonda. La arteria caroticotimpánica, rama de la arteria carótida interna, irriga la pared anterior. El drenaje venoso ocurre a través del seno petroso superior y el plexo pterigoideo. El drenaje linfático se proyecta a través de los ganglios retrofaríngeos y parotídeos. Inervación: plexo timpánico formado por la rama timpánica del glosofaríngeo (nervio de Jacobson), los nervios caroticotimpánicos inferior y superior, plexo carótico interno del sistema simpático y el nervio petroso superficial menor. El músculo tensor del tímpano recibe inervación de una rama del nervio mandibular y el músculo estapedial del nervio facial. Anatomía de la mastoides El sistema de celdillas neumáticas surge con el crecimiento del hueso temporal como una prolongación del oído medio y el antro. Las celdillas que se desarrollan a partir del antro son las más grandes. La lámina ósea que marca la fusión entre el proceso antral de la porción petrosa y el proceso timpánico de la escama (sutura petroescamosa) se conoce como tabique de Korner. Hacia dentro del tabique se hallan las celdillas antrales, que son extensiones mediales del antro original. También se identifica un grupo de celdillas que rodea al seno sigmoides, así como a la escama del temporal. Extensiones anteriores y laterales de estas celdillas llegan hasta el cigoma y se comunican con el ático. Las celdillas timpánicas del oído medio que neumatizan la porción petrosa forman el grupo de celdillas carotídeas que rodean al conducto carotídeo y emergen con el grupo de celdillas subtubarias, que surgen de la trompa de Eustaquio; de este grupo provienen las celdillas apicales de la porción petrosa, así como las precocleares. Un grupo supracoclear puede surgir a partir de la pared medial del ático y extenderse sobre la cóclea y alrededor del ganglio geniculado. Las celdillas retrofaciales surgen del seno timpánico, la parte petrosa medial al nervio facial. La neumatización del hueso temporal es muy individual y depende de factores hereditarios y ambientales (figura 1-5). Figura 1–5. Fotografía de una mastoides fresada. Nótese el conducto auditivo externo y el antro mastoideo. ERRNVPHGLFRVRUJ Capítulo 1 1. La articulación incudomaleolar, que une al cuerpo del yunque con la cabeza del martillo; es una diartrosis atípica. 2. La articulación incudoestapedial es la más frágil y une la apófisis lenticular del yunque con el estribo (figura 1–4). Puede ser el punto de luxación congénita, traumática o infecciosa. 3. La articulación estapediovestibular está constituida esencialmente por el ligamento anular del estribo. 77 8 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 1 El conducto petromastoideo se inicia en la fosa subarcuata, por encima del conducto auditivo interno y lateral a éste; se abre de manera directa en el antro, a través de una celdilla mastoidea interna. Su longitud varía de 6 a 10 mm. El orificio externo del conducto petromastoideo se encuentra casi siempre en una celdilla periantral, pero en 5% de los casos se abre en el antro en forma directa. Este conducto puede ser una vía para que una infección ótica pase desde el tímpano hasta las meninges, al seno petroso superior y al cerebelo. OÍDO INTERNO Laberinto óseo El laberinto óseo, situado en la porción petrosa del hueso temporal, alberga a los órganos de la audición y el equilibrio. Está compuesto por varias partes: 1. Vestíbulo, que contiene al sáculo y el utrículo. 2. Cóclea, que aloja al órgano de Corti. 3. Conductos semicirculares. 4. Acueductos vestibular y coclear (figuras 1–6 y 1–7). El vestíbulo es una cavidad ovoide irregular de 4 mm de diámetro localizada medial a la cavidad timpánica, con la cual se comunica a través de la fossula de las ventanas coclear y vestibular. Los conductos semicirculares surgen y terminan a nivel del utrículo; cada uno forma dos terceras partes de un círculo y se localizan en un plano perpendicular el uno del otro de la pirámide petrosa. El ámpula de los conductos semicirculares superior y lateral se localiza en la porción anterosuperior del vestíbulo. El conducto semicircular superior sigue un curso craneal, medial y posterior, para unirse con el acueducto semicircular posterior y formar la cruz común, que entra en la porción posterior del vestíbulo. El curso del conducto semicircular lateral, que es el más corto de los tres, se proyecta en un plano posteroinferior dirigido hacia la porción posterior del vestíbulo. Este conducto está muy relacionado con el conducto de Falopio del nervio facial a lo largo de sus porciones horizontal y vertical. Tres recesos se forman en la pared Conducto semicircular superior Conducto semicircular lateral Ámpula membranosa Nervio coclear Utrículo Sáculo Coclea Conducto semicircular posterior Acueducto coclear Figura 1–6. Laberinto óseo. ERRNVPHGLFRVRUJ Embriología y anatomía del oídoa 99 Capítulo 1 Figura 1–7. Fotografía de una cóclea humana. posterior del vestíbulo: uno en forma esférica, que aloja al sáculo, sobre su porción anteroinferior; otro de forma elíptica, que alberga al utrículo, y que se sitúa en la región posterosuperior del vestíbulo. El receso coclear se localiza en la pared posteroinferior del vestíbulo. La cresta vestibular separa al utrículo del sáculo y se divide en dos porciones que se unen al receso coclear. La abertura del acueducto vestibular pasa del área utricular a la superficie posterior del hueso temporal. A través del hueso temporal, el conducto endolinfático pasa hacia el saco endolinfático. El esqueleto óseo de la cóclea se encuentra en un plano anteroinferior al vestíbulo; posee forma de cono aplanado, con una base de 9 mm de diámetro y una altura de 5 mm. Tiene 2.5 a 2.75 vueltas sobre un eje central denominado modiolo, a través del cual los vasos cocleares y la división coclear del VIII par craneal atraviesan la cóclea. El conducto de Cotunnius lleva la vena del acueducto coclear hacia la porción posterior del hueso temporal. Riego del laberinto El laberinto recibe riego de la arteria auditiva interna, rama de la arteria cerebelosa anteroinferior o la basilar. Esta arteria emite las siguientes ramas: vestibular, que irriga parte del sáculo, utrículo y conductos semicirculares; arteria coclear, que riega las dos vueltas apicales de la cóclea; arteria cocleovestibular, que perfunde las dos terceras partes de la vuelta basal de la cóclea, gran parte del sáculo, el cuerpo del utrículo, el conducto semicircular posterior y parte del lateral y superior. Drenaje venoso: procede de la vena auditiva interna para las porciones apical y media de la cóclea; de la vena del acueducto coclear para la porción basal de la cóclea, el sáculo y parte del utrículo; y de la vena del acueducto vestibular para los conductos semicirculares y resto del utrículo. El saco endolinfático tiene irrigación de una rama de la arteria del acueducto vestibular, que a su vez es ramificación de la arteria meníngea posterior. Por otro lado, se sabe que el conducto accesorio del acueducto vestibular contiene las venas de casi todas las terminaciones del utrículo y conductos semicirculares. Laberinto membranoso El laberinto membranoso es un sistema de espacios y tubos que contienen endolinfa, rodeados por el laberinto periótico, por el que circula perilinfa. El saco endolinfático se halla en el acueducto vestibular y, en forma parcial, en la superficie posterior del hueso temporal entre las capas de la duramadre. Su luz es rugosa y mide 0.1 a 0.2 mm en su parte más estrecha. La pared externa se encuentra rodeada de tejido conectivo vascular, el cual es más denso en la porción del istmo. El saco endolinfático puede alcanzarse a través del hueso temporal al remover las celdillas óseas que se encuentran entre el conducto semicircular posterior y la porción sigmoidea del seno transverso. Tiene forma de botella o huso; su luz cuenta con una serie de túbulos o canalículos paralelos. Los receptores sensoriales y estructuras de soporte que responden a los cambios posicionales del cuerpo forman las máculas del utrículo y el sáculo. La mácula utricular se localiza en la región anterolateral ERRNVPHGLFRVRUJ 10 Oído, nariz, garganta y cirugía de cabeza y cuello del utrículo y la mácula sacular es una estructura de 2 por 3 mm, situada en la pared medial del sáculo. Estas máculas tienen inervación de las ramas utricular y sacular del nervio vestibular. Los receptores celulares primarios de las máculas son las células ciliadas, que pueden ser de dos tipos: Capítulo 1 Tipo I: de base ancha y rodeadas por terminaciones nerviosas aferentes en forma de cáliz. Tipo II: son células más tubulares inervadas por terminaciones nerviosas aferentes y eferentes más pequeñas. La porción superior de estas células es cuticular y contiene estereocilios no móviles. En la porción superior de cada célula se localiza un quinocilio. Todas las células ciliadas están sostenidas por una matriz de células de soporte. Tanto los quinocilios como los estereocilios se proyectan hacia una membrana otolítica, que yace sobre cada mácula. Esta membrana otoconial que cubre a las máculas vestibulares está constituida por capas de material gelatinoso, cubiertas por cristales calcáreos llamados otoconias, las cuales están formadas por carbonato de calcio, con una fracción de material orgánico. El movimiento de las células en dirección del quinocilio resulta en una despolarización, con estimulación de las células; el movimiento en dirección contraria tiene como resultado una hiperpolarización de la célula, con una hipoestimulación. El utrículo se conecta, en su cara posterior, con los conductos semicirculares, y en forma anterior a través del conducto utricular con los conductos sacular y endolinfático. La comunicación entre el utrículo y el conducto utricular tiene lugar mediante un doblez utricular o válvula de Bast. El sáculo se comunica, a través del ductus reuniens, con el conducto coclear. El conducto endolinfático surge en la unión de los conductos utricular y sacular. El laberinto membranoso de los conductos semicirculares es de forma tubular. Al final de cada conducto existe un ensanchamiento denominado ámpula. Lo conductos se abren hacia el utrículo a través de cinco orificios. Las ámpulas contienen un puente transversal de epitelio neurosensorial, la cresta ampular y elementos estructurales de soporte. Las crestas ampulares son muy similares a las máculas sacular y utricular. En esta estructura se encuentran células ciliadas de tipos I y II. La superficie externa de cada célula ciliada cuenta con 50 estereocilios y un quinocilio. La cúpula ampular se extiende desde la superficie de la cresta hacia el techo del ámpula. El movimiento del líquido endolinfático entre los conductos semicirculares mueve la cúpula hacia la superficie de la cresta, con el estímulo necesario para, a su vez, mover los cilios y estimular a las células ciliadas. La inervación aferente de estos receptores sensoriales ocurre a través de los nervios ampulares posterior, superior y lateral, ramas del nervio vestibular. Conducto coclear Se extiende desde el receso coclear del vestíbulo para terminar en una bolsa ciega denominada caecum cupulare, en el plano del vértice de la cóclea. En su porción basal, el ductus reuniens hace posible que la endolinfa pase hacia el laberinto membranoso sacular. El piso del conducto coclear está formado por la membrana basilar, que se inserta de manera lateral con el ligamento espiral. Pendiente del ligamento espiral, la estría vascular forma la pared lateral del conducto coclear. En la porción superior de la estría, la capa bicelular de la membrana vestibular o de Reissner se extiende hacia el limbo, superpuesto a la lámina espiral ósea. Esta membrana forma la tercera pared del conducto coclear. Las membranas basilar y de Reissner dividen al laberinto coclear en tres escalas: 1. Escala media o central, que contiene endolinfa. 2. Escala vestibular, adyacente a la membrana de Reissner. 3. Escala timpánica, en relación con la membrana basilar. Estas dos últimas escalas contienen perilinfa y se comunican a través del helicotrema. La escala timpánica termina en un saco ciego en el cual la ventana redonda se abre. La escala vestibular se abre en el vestíbulo. Junto con los receptores sensoriales, como estructuras de soporte encargadas de la energía acústica y localizadas a lo largo de la membrana basilar, se los conoce como órgano de Corti. La porción basal de la membrana basilar es estrecha y tensa, y se torna más flácida en su porción apical. La membrana tectorial, que es una membrana de contacto gelatinosa formada por una matriz de glucoproteínas y reforzada por fibrillas de colágena y el órgano de Corti, tiene un curso estructural similar en su longitud y modula el tono del conducto coclear, que concentra las frecuencias de tono alto en la porción basal de la cóclea y las de frecuencia grave o bajas en forma progresiva apical (figura 1–8). Existe 60 300 500 120 2 000 3 000 1 500 4 000 1 000 5 000 10 000 7 000 Figura 1–8. Distribución de las frecuencias en la cóclea. Las frecuencias de tonalidad aguda se localizan en la porción basal; las de tonalidad grave en la apical. ERRNVPHGLFRVRUJ Embriología y anatomía del oídoa Membrana tectorial y el borde medial de la membrana basilar que forma el surco espiral interno. El borde medial de este espacio contiene células cuboidales. La membrana basilar mide 32 cm de longitud, 0.08 mm de ancho en la porción basal y 0.498 mm en la región apical. Incluye 24 000 fibras transversales a lo largo. El órgano de Corti posee cerca de 15 500 células ciliadas. La capa de células ciliadas internas tiene 3 500 y cuatro a cinco capas de células ciliadas externas que contienen alrededor de 12 000 células. En la porción basal hay tres capas de células ciliadas externas, otra capa se agrega en la vuelta media y sólo de manera ocasional una quinta capa puede aparecer en la región apical. Existen alrededor de 26 000 células ganglionares en el ganglio espiral de una persona adulta con audición normal. Se observa una mayor concentración de células en la porción basal que en la apical. Hay dos tipos de terminaciones nerviosas en las células ciliadas, una con función aferente y la otra con actividad eferente. Las neuronas discurren a través de dos canalículos de la lámina espiral ósea para unirse a las células del ganglio espiral en la base de la lámina. Los axones forman la porción auditiva del VIII par craneal. La parte superior del nervio vestibular depende de las crestas de los conductos semicirculares lateral y superior, y de la mácula utricular. La porción inferior recibe fibras de la cresta del conducto semicircular posterior y la mácula sacular. El ganglio que contiene a los cuerpos celulares de estas fibras es el ganglio de Scarpa, el cual se encuentra en el conducto auditivo interno. Túnel de corti Célula ciliada interna Surco de las células ciliadas internas Células de Hensen Célula de Claudius Células ciliadas externas Célula de Deiters Túnel de van Nuel Membrana basilar Pilares de las células ciliadas externas Pilares de las células ciliadas internas Figura 1–9. Órgano de Corti. ERRNVPHGLFRVRUJ Habénula perforata Capítulo 1 una capa de células ciliadas internas y cinco de células ciliadas externas, que se hallan separadas por una V invertida formada por los tonofilamentos de las células de los pilares interno y externo, lo que tiene como resultado una fuerte estructura de soporte central. El espacio que se encuentra entre los pilares se denomina túnel de Corti y por él circula un líquido diferente de la endolinfa llamado cortilinfa. Las células ciliadas se asientan sobre las células falángicas. Sus bordes libres contienen cilios no móviles, que descansan sobre la superficie inferior de la membrana tectorial; el resto de las células de apoyo tiene diferente forma y mayor altura cerca de las células ciliadas, y su tamaño disminuye al alejarse de éstas, por lo que le confieren al órgano de Corti una forma inclinada. Cada célula ciliada interna descansa en una célula falángica en forma de copa. Las células ciliadas externas yacen sobre las células de Deiters. El tramado reticular que se observa en la superficie superior del órgano de Corti se debe a las prolongaciones de las células falángicas, a la lámina cuticular de las células ciliadas internas y externas y a las células de los pilares interno y externo. Las células de Hensen se extienden desde el borde lateral del órgano de Corti hasta las células epiteliales columnares altas. Las células de Claudius descansan en la membrana basilar y se extienden en sentido lateral hacia el ligamento espiral y la estría vascular (figura 1–9). La membrana tectorial se une con firmeza al borde libre de las células de Hensen para crear un espacio entre las células ciliadas y la membrana tectorial, que contiene los cilios de las células ciliadas. Este espacio se continúa con el formado por la membrana tectorial 11 11 12 Oído, nariz, garganta y cirugía de cabeza y cuello Líquidos del oído interno Capítulo 1 1. Perilinfa: se asemeja en su composición química al líquido extracelular; tiene un contenido elevado de sodio (140 mEq/L) y bajo de potasio (5.5 a 6.25 mEq/L). Su contenido de proteínas es de 200 mg/ 100 mL, que es mayor que el del líquido cefalorraquídeo. Es probable que la perilinfa se origine en un ultrafiltrado del plasma, procedente de los vasos de las paredes óseas de los espacios perióticos. La aportación del líquido cefalorraquídeo a través del conducto coclear es mínima. 2. Endolinfa: tiene un contenido alto de potasio (140 a 160 mEq) y bajo de sodio (12 a 16 mEq/L), al igual que el líquido intracelular. Su contenido de proteínas es algo menor respecto de la perilinfa. La membrana basilar es impermeable a estos iones y la membrana de Reissner participa de modo activo en el transporte de potasio hacia la escala media por un gradiente de concentración. Las células de la estría vascular participan en el proceso de absorción y secreción de la endolinfa. Estudios del líquido encontrado en el saco endolinfático difieren en cuanto al contenido de proteínas y iones, al realizar la comparación con el de la endolinfa; estos cambios sugieren la presencia de una gran absorción de líquido en esta región por las células contenidas en las paredes rugosas del saco endolinfático. 3. Cortilinfa: parece provenir del líquido cefalorraquídeo que pasa a través de las fibras del nervio coclear mediante los canalículos de la lámina espiral ósea. Este líquido contiene en apariencia mayor concentración de sodio que de potasio y una baja concentración de proteínas. 4. Existe un concentrado de mucopolisacáridos que secretan las células de soporte de los órganos sensoriales. Tiene una alta viscosidad y circula entre el espacio formado por las células ciliadas y las membranas adyacentes (figura 1–10). 5. Se ha identificado una familia de moléculas de agua a las que se denomina acuaporinas, las cuales se pueden transportar a lo largo de membranas biológicas. Estudios en animales de investigación han demostrado la presencia de varias acuaporinas que circulan en los líquidos del oído interno. En consecuencia, la acuaporina 1 se observa en células no epiteliales del oído interno, como en los fibrocitos de tipo III; la acuaporina 2 se ha observado en el saco endolinfático y el gen de ésta se halla en el cromosoma 12 o 13 del ser humano; la acuaporina 4 se puede localizar en las células de Hensen y Claudius en la cóclea, así como en la mácula vestibular y en las crestas de los canales semicirculares, y en las porciones centrales del nervio cocleovestibular; la acuaporina 5 se sitúa sobre las células de la prominencia espiral, en la región apical del conducto coclear. Riego de estructuras del oído interno Tanto el del órgano de Corti como el de otras estructuras del conducto coclear provienen de la estría vascular Perilinfa Conducto coclear Endolinfa Ligamento espiral Escala vestibular Na =150 mEq K = 5 mEq Na = 5 mEq K = 150 mEq Escala timpánica Prominentias spiralis Órgano de Corti Membrana basilar Figura 1–10. Líquidos y estructuras del oído interno. y los vasos espirales ubicados por debajo de la membrana basilar. Otro sistema arteriolar discurre a través del periostio a lo largo de la pared de la escala vestibular hacia la región del ligamento espiral; en este punto, el sistema arteriolar se desintegra para formar cuatro conexiones de lechos capilares a lo largo de la pared lateral del laberinto periótico. El primer grupo irriga la región del ligamento espiral hacia la inserción de la membrana de Reissner; el segundo grupo forma el lecho capilar de la estría vascular; el tercero riega los vasos de la eminencia espiral; y el cuarto grupo perfunde la porción inferior del ligamento espiral. Estos vasos drenan en vénulas que dan origen a las venas espiral posterior y auditiva interna. Conducto auditivo interno Se localiza en la región posterior de la región petrosa del hueso temporal. Por él pasan los pares craneales VII y VIII, así como la arteria auditiva interna. Tiene una anchura aproximada de 3.7 a 4.5 mm y un diámetro vertical de 4 a 4.6 mm. La profundidad es de 6 a 7 mm; la distancia entre la superficie interna de la escama del hueso temporal y el inicio del conducto auditivo interno es de casi 28 mm. La pared lateral terminal del conducto auditivo interno se divide en forma horizontal por la cresta falciforme. El compartimiento superior contiene al nervio facial, que se proyecta en forma an- ERRNVPHGLFRVRUJ Embriología y anatomía del oídoa terior, y a la rama superior del nervio vestibular en su cara posterior. El compartimiento inferior lleva al nervio vestibular en su cara anterior y a la rama inferior del nervio vestibular en su cara posterior. El ganglio geniculado del nervio facial se halla en un plano superficial sobre la pared superior del hueso petroso en 14 a 15% de los casos, y cuando se encuentra cubierto por hueso, éste yace a una profundidad de 1 mm. BIBLIOGRAFÍA Anniki M, Wroblewski R: Elemental composition of the developing inner ear. Ann Otol Rhinol Laryngol 1981;90:25–32. Bagger–Sjoback D, Janssen B, Friberg U: Three–dimensional anatomy of the human endolymphatic sac. Ar Otolaryngol 1990;116:345–349. Berger G, Sachs Z, Sadi J: Histopathologic changes of the tympanic membrane in acute and secretory otitis media. Ann Otol Rhinol Laryngol 1996;105:458–462. Bluestone C, Doyle W: Eustachian tube function. Physiology and role in otitis media. Ann Otol Rhinol Laryngol 1985;94 (Suppl):1–60. Curthoys IS, Blanks RH, Maqrkham CH: Semicircular canal structure during postnatal development in cat and guinea pig. Ann Otol Rhinol Laryngol 1982;91:185–192. Daniel H, Fulahom R, Brenn J, Barrett K: Comparative anatomy of Eustachian tube and middle ear cavity in animal models for otitis media. Ann Otol Rhinol Laryngol 1982;91:82–89. Davis LG, Hawrisiak MM: In vitro cultivation of the fetal guinea pig inner ear. Ann Otol Rhinol Laryngol 1981;90:246–250. Doyle WJ, Stewart RR: Comparison of the anatomy of the Eustachian tube in the Rhesus monkey and man. Ann Otol Rhinol Laryngol 1980;89:49–57. Eby T, Nadol J: Postnatal growth of the human temporal bone. Ann Otol Rhinol Laryngol 1986;95:356–364. Escajadillo JR: Abordaje quirúrgico del conducto auditivo interno a través de la fosa media. Otorrino 1993;2:36-39. Friberg V, Rask H, Bagger D: Human endolymphatic duct. Ar Otolaryngol 1984;110:421–428. Graham M: The annular ligament attachment to the normal human stapes footplate. Ann Otol Rhinol Laryngol 1985;94:171–175. Graham M, Perkins R: A scanning electron microscopy study of the normal human stapes. Ann Otol Rhinol Laryngol 1979;Suppl 64, Vol. 88. Ito I, Imoda M, Ikeda M et al.: A morphological study of age changes in adult human auricular cartilage with special emphasis on elastic fibers. Laryngoscope 2001;111:881– 886. Khan KM, Marovitz WF: Intercellular functions in the differentiating rat otocyst. Ann Otol Rhinol Laryngol 1979;88:540– 544. Li CW, McPhee J: Influences on the coiling of the cochlea. Ann Otol Rhinol Laryngol 1979;88:280–287. Lin C, Zak F: Studies on melanocytes. Melanocytes in the middle ear. Ar Otolaryngol 1982;108:489–490. Mazzoni A: Vein of the vestibular aqueduct. Ann Otol Rhinol Laryngol 1979;88:759–767. Merves M, Bobbit B, Porter K et al.: Developmental expression of aquaporin 2 in the mouse inner ear. Laryngoscope 2000;110:1925–1930. Pérez Olivares F, Scheknecht HF: Width of the internal auditory canal. A histological study. Ann Otol Rhinol Laryngol 1979;88:316–323. Proctor B, Bollabas B: Anatomy of the round window niche. Ann Otol Rhinol Laryngol 1979;88:316–323. Proctor B: The petromastoid canal. Ann Otol Rhinol Laryngol 1983;92:640–644. Ruah C, Schachorn P, Paparella M: Age related morphologic changes in the human tympanic membrane. Ar Otolaryngol 1991;117:627–634. Ruben JR, Rapin L: Plasticity of the developing auditory system. Ann Otol Rhinol Laryngol 1980;89:303–311. Salamat MS, Ross MD, Peacor DR: Otoconial formation in the fetal rat. Ann Otol Rhinol Laryngol 1980;89:229–238. Sando I, Egami T, Harada T: Course and contents of the paravestibular canaliculus. Ann Otol Rhinol Laryngol 1980;89:147– 156. Spector G, Xian–Xi G: Development of the hypotympanum in the fetus and neonate. Ann Otol Rhinol Laryngol 1981;90 Suppl 88:2–20. Tanaka K, Sakai N, Terayama Y: Organ of Corti in the human fetus. Scanning and transmission electromicroscope studies. Ann Otol Rhinol Laryngol 1979;88:749–758. Thalmann I, Thalmann R, Thallinger G: Composition and supramolecular organization of the tectorial membrane. Laryngoscope 1987;97:357–367. Voelker FA, Henderson CM, Macklin AW, Tucker WE: Evaluating the rat inner ear. Ann Otol Rhinol Laryngol 1980;106:613– 617. Wright C, Weinberg A, Hubbard D: Valerite otoconia in two cases of otoconial membrane dysplasia. Ann Otol Rhinol Laryngol 1982;91:193–199. Wright C, Hubbard DG, Clark GM: Observations of human fetal otoconial membranes. Ann Otol Rhinol Laryngol 1979;88:267–274. Wright C, Hubbard DG, Graham JW: Absence of otoconia in a human infant. Ann Otol Rhinol Laryngol 1979;88:779– 783. ERRNVPHGLFRVRUJ Capítulo 1 13 13 14 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 1 ERRNVPHGLFRVRUJ Fisiología del oído El sonido es una forma de energía física que se propaga en el aire a manera de compresiones y descompresiones alternantes que producen un movimiento vibratorio molecular en forma de ondas longitudinales; en el agua, estas ondas son transversales y longitudinales (trocoidales). En consecuencia, el sonido se transmite a través de un sistema sinusoidal de ondas, en el cual la distancia entre cresta y cresta o valle y valle se denomina longitud de onda. La velocidad de propagación del sonido en el aire a 20 °C es de 344 m/seg; en el agua a 30 °C es de 1 493.2 m/seg (cuatro veces más rápido que en el aire). 3. Líquido: líquidos laberínticos del oído interno. El sistema de transmisión del oído posee su propia impedancia y la onda sonora tiene que superar una resistencia que guarda relación con tres factores: 1. Masa. 2. Rigidez. 3. Roce o fricción, tanto del sistema timpanoosicular como de la propia cavidad timpánica. OÍDO EXTERNO Es una estructura que capta el sonido e incrementa la sensitividad total auditiva. Una de las funciones del pabellón auricular es la de favorecer la localización del sonido; con anterioridad, debido al mayor desarrollo de los músculos auriculares, este proceso era todavía más preciso al mover el pabellón auricular en la dirección en que se originaba aquél. Los diversos repliegues del pabellón ayudan a integrar la información de las características de transmisión de las diferentes frecuencias, en relación con el origen del sonido. OÍDO MEDIO Actúa como un transformador o acoplador de impedancias; su función es elevar la presión sonora, de tal manera que se transmita sin pérdida considerable desde el aire hasta los líquidos intralaberínticos. IMPEDANCIA Es la resistencia que ofrecen los distintos medios a la propagación de la onda sonora, en este caso a través del oído; los medios son los siguientes: 1. Aéreo: conducto auditivo externo. 2. Sólido: bloque timpanoosicular. 1. De tipo estático, representados por las cavidades del oído medio, tímpano, cadena osicular y sistema ligamentoso. 2. De tipo dinámico, ejemplificados por la actividad muscular endotimpánica, músculos del martillo y el estribo, y los cambios de aireación de la caja. Cuando un sonido llega al tímpano, parte de la energía acústica se absorbe, de tal modo que vibra el sistema de conducción timpanoosicular y parte de la energía de la onda sonora se refleja en función de la impedancia del medio. En este concepto se fundamenta el sistema de cuantificación de los actuales impedanciómetros. El oído medio regula la baja impedancia del aire con la alta impedancia coclear, al concentrar la presión incidente del sonido desde una gran área, la membrana timpánica, hasta una mucho menor en la ventana oval. En el hombre, la relación entre estas dos estructuras es de 20:1; empero, dado que no vibra toda la membrana timpánica como unidad, el radio efectivo es en realidad de 14:1. La acción de transformador del oído medio mejora la transmisión de la energía sonora. La combinación de la ganancia de la energía resultante del sistema de palanca de la cadena osicular y la diferencia de áreas entre la membrana timpánica y la platina del estribo hacen que se concentre la energía y supere la resistencia del Capítulo 2 Entre los factores que modifican el valor de la impedancia del oído medio figuran los siguientes: 15 ERRNVPHGLFRVRUJ 16 Oído, nariz, garganta y cirugía de cabeza y cuello líquido perilinfático, y que las ondas sonoras puedan transmitirse de un medio aéreo a uno líquido. Capítulo 2 FUNCIÓN DE LOS MÚSCULOS DEL OÍDO MEDIO Los músculos del oído medio soportan y tensan la cadena osicular, además de proteger al oído interno de la sobreestimulación por ruido. Otra función consiste en atenuar los sonidos que ocultan bajas frecuencias, capaces de interferir con la función auditiva; este efecto se observa durante la vocalización y en otros movimientos de la cara y el cuerpo, en los que se atenúan los sonidos provenientes del organismo y que tienen fundamentalmente frecuencias bajas. Además, estos músculos del oído medio ayudan a preservar la sensibilidad para sonidos externos de alta frecuencia. TROMPA DE EUSTAQUIO Para la función de la trompa de Eustaquio (TE) son importantes tres músculos: 1. El tensor del velo del paladar, inervado por la división mandibular del nervio trigémino y por el glosofaríngeo. Es el principal músculo encargado de abrir la TE. 2. El elevador del velo del paladar, inervado por el facial, neumogástrico y plexo faríngeo; contribuye de modo parcial a la dilatación del orificio faríngeo. 3. El salpingofaríngeo, cuya inervación motora procede del plexo faríngeo; su contracción ayuda en parte a la abertura de la luz tubaria. En condiciones normales, la porción cartilaginosa de la TE se encuentra cerrada. Se abre al deglutir, sobre todo sin agua (prueba seca), tras romper así el moco que sella la luz colapsada, una sustancia surfactante de baja tensión que pueden absorber las superficies mucosas de la trompa y que previene la adhesión entre un sólido y otro. Bostezar, estornudar y gritar son otras actividades que la abren en forma temporal. Cuando la presión diferencial entre ambos extremos de dicha porción excede las fuerzas de la luz tubaria, la trompa se abre de forma espontánea (movimiento pasivo). Cada vez que se abre la TE, el aire que entra hacia los compartimientos del oído medio iguala la presión del aire externo; de esta manera protege al oído de los cambios de presión. La abertura de la TE se inicia en el oído medio y avanza hacia el orificio nasofaríngeo. La rotura de la capa de moco del factor surfactante produce un sonido a manera de tronido, que es el percibido al deglutir. La presión del oído medio normal es negativa (alrededor de 25 mm H2O). Incluso cuando la deglución no se realiza por periodos prolongados, la presión del oído medio se torna negativa, como resultado de la resorción de oxígeno en los capilares de la mucosa. Cuando la presión negativa en el oído medio aumenta y se mantiene, se produce una retracción de la membrana timpánica, con edema de la mucosa y producción de un exudado que compensa la presión negativa, a expensas de una disminución de la aireación del oído medio. Por otro lado, la concentración de gases en el oído medio constituye un factor importante para la función auditiva, ya que su presión puede influir en la aparición de hipoacusias o reacciones vestibulares. En la actualidad pueden efectuarse determinaciones simultáneas de O2, N2, CO2 y N2O en el oído medio con métodos microcromatográficos. Estudios de experimentación en mamíferos han mostrado que la concentración de gases en el oído medio, al someterse a anestesia con N2O (óxido nitroso) durante una hora, son: O2, 20%; CO2, 10%; N2O, 30%; N2, 40%. Luego de la anestesia se registraron las siguientes concentraciones: O2, 9%; N2, 59.5%; CO2, 5.5%; N2O, 26%. Estudios de la trompa de Eustaquio han demostrado que su cartílago es inmaduro en lactantes y niños menores de seis años de edad, motivo por el cual su función es incompleta; es por ello que se colapsa con mayor facilidad que en los adultos y los niños de ocho a 12 años. La calcificación del cartílago de la trompa de Eustaquio y la atrofia del músculo tensor del velo del paladar guardan relación directa con el proceso de envejecimiento, por lo que es un factor predisponente de la disfunción tubaria en la vejez. CÓCLEA La cóclea tiene dos funciones básicas: 1. Transforma la energía sonora en un potencial bioeléctrico que estimula las terminaciones del nervio auditivo. 2. Codifica las señales acústicas para que el cerebro pueda procesar la información contenida en el estímulo sonoro. Función transductora: cuando la cóclea es activada por el sonido, la escala media, que es la extensión del laberinto membranoso (rica en potasio y baja en sodio) se mueve de manera integral. Las fibras del nervio auditivo hacen sinapsis en la porción basal de las células ciliadas en el órgano de Corti y entran a la escala media a través de las habenulae perforatae, en las cuales pierden sus vainas de mielina. Se han descrito dos tipos de terminaciones nerviosas: Tipo I: no son vesiculadas, contienen una membrana gruesa y son procesos dendríticos aferentes de los cuerpos celulares en el ganglio espiral. Tipo II: son vesiculadas y poseen abundantes vesículas presinápticas; se considera que son terminales del haz olivococlear. Las células de tipo I tienen una función básica aferente y las de tipo II muestran una función eferente. El órgano de Corti se mueve hacia arriba y abajo sobre la membrana basilar, y las membranas tectorial y reticular tiran de ERRNVPHGLFRVRUJ Fisiología del oídoa Potenciales cocleares 1. Potencial endococlear: tiene una constante de 90 a 115 mV y se mide mediante electrodos en la escala media. Este potencial es generado por la estría vascular, la cual tiene una estructura muy compleja. Sus células intermedias y marginales poseen muchos tentáculos que le proporcionan grandes áreas de superficie en cuanto a su volumen. La abundancia de mitocondrias en las células marginales produce una gran actividad metabólica, por lo que su estructura es ideal para mecanismos de absorción y secreción. Se lo ha denominado el “riñón” del oído interno. Este potencial duplica al potencial intracelular negativo de las células ciliadas, por lo que mejora la transducción de la energía. 2. Potenciales cocleares microfónicos: son potenciales terminales de los órganos sensoriales de la cóclea. Se generan por las células ciliadas del órgano de Corti. Este potencial reproduce la forma de onda del sonido estimulador. 3. Potenciales de sumación: los generan las células ciliadas, aunque tienen un origen más difuso. Estos potenciales predominan ante estímulos de alta intensidad, a diferencia de los potenciales cocleares microfónicos que predominan ante estímulos de baja intensidad. Estudios recientes han demostrado que las terminaciones del nervio auditivo se estimulan de forma eléctrica y química, a través de sustancias humorales que hay entre las estructuras de las células ciliadas y su unión con el nervio auditivo. Es importante señalar que la hipoacusia y el consumo de algunos fármacos, sobre todo vasodilatadores, diuréticos y antibióticos, modifican los potenciales cocleares. Codificación de la señal acústica: la cóclea modifica parámetros acústicos con actividad neural; distingue las características del estímulo acústico con respecto a su frecuencia e intensidad, a través de las propiedades mecánicas de la membrana basilar. Von Bekesy (1960) mostró que estímulos sonoros de tonos puros producían una onda viajera, que se movía a lo largo de la partición coclear, desde su base hasta el vértice; en consecuencia, la amplitud de las ondas viajeras aumenta con lentitud, alcanza un máximo y disminuye con rapidez. Tonos de frecuencias agudas hacen que la amplitud de las ondas viajeras alcance su punto máximo cerca de la ventana oval, y tonos de frecuencias bajas producen ondas viajeras con máxima amplitud en sitios más distales de ella. Las ondas viajeras poseen un límite de amplitud en sus oscilaciones hacia el vértice en función del sonido de una frecuencia particular. La deformación de los cilios producidos por el desplazamiento de las estructuras membranosas contiguas al órgano de Corti activa a las células ciliadas y esta activación es mayor en la zona de máxima amplitud de las oscilaciones. Las ondas viajeras experimentan movimientos radiales o de meseta y longitudinales o de caída (figura 2–1). El borde interno de la membrana tectorial produce de manera más eficaz respuestas eléctricas de las células ciliadas con movimientos longitudinales de las ondas, mientras que los movimientos radiales estimulan más al borde externo de la membrana tectorial. Las células ciliadas internas parecen ser más sensitivas a los movimientos longitudinales que a los radiales. Estos potenciales eléctricos producidos por las células ciliadas excitan a las fibras nerviosas para transmitir la información al sistema nervioso central (teoría del lugar). La codificación de la señal auditiva puede afinarse en forma mecánica y neural, a través de un mecanismo conocido como inhibición lateral, que consiste en que cada neurona inhibe a otras que proceden de áreas adyacentes de la membrana basilar. Las neuronas del área de máxima estimulación inhiben con más intensidad a las contiguas; por consiguiente, las neuronas que se encuentran en la periferia del estímulo se inhiben más debido a la mayor actividad de la región central. Teoría telefónica o de la volea, postulada por Wever (1949): los potenciales de acción durante la fase excitatoria (movimiento de la membrana basilar en dirección de la escala vestibular) son mayores que durante la fase inhibitoria; estos aumentos de actividad están sincronizados con las vibraciones de la membrana basilar y, por lo tanto, con la frecuencia del sonido. Esta teoría sugiere que frecuencias bajas (400 Hz) se codifican de forma telefónica, y frecuencias altas (mayores de 4 kHz) lo hacen por medio de la teoría del lugar. El principio de la teoría de la volea establece que unidades auditivas individuales se activan de modo sincrónico durante un ciclo estimulatorio y pueden dejar de activarse en ciclos subsecuentes. Este mecanismo Figura 2–1. Codificación de la señal acústica a través de ondas viajeras en la membrana basilar. ERRNVPHGLFRVRUJ Capítulo 2 los estereocilios de las células ciliadas externas; el movimiento del líquido en este sistema puede doblar (estimular) a los cilios de las células internas, que no están adheridos a la membrana tectorial a través de movimientos longitudinales. De esta manera, las células ciliadas internas se consideran sensores de velocidad y las células ciliadas externas sensores de desplazamiento. 17 17 18 Oído, nariz, garganta y cirugía de cabeza y cuello falla con frecuencias mayores de 4 kHz. Hasta el momento, la capacidad para diferenciar frecuencias distintas no se comprende del todo y requiere mayor investigación. Ambos mecanismos, el de la volea o telefónica, y del lugar, se complementan de manera recíproca. Estudios de experimentación han demostrado tres campos auditivos: Capítulo 2 a) En la región ventral del surco suprasilviano. b) Un segundo en el surco ectosilviano. c) Sobre el área que recibe conexiones del grupo talámico posterior del tálamo dorsal. Estos campos son secundarios y cada uno contiene un mapa coclear. La corteza auditiva tiene alrededor de 10 200 000 neuronas. VÍA AUDITIVA AFERENTE Se inicia en los siguientes puntos: 1. Órgano de Corti: la primera neurona tiene su soma en el ganglio espiral de Corti. 2. Nervio auditivo: contiene 31 000 neuronas. 3. Núcleo coclear (88 000 neuronas): posee una organización tonotópica de la cóclea. Se encuentra lateral a la raíz descendente del nervio trigémino. Contiene dos porciones: a) Ventral: recibe fibras provenientes de la vuelta apical de la cóclea. b) Dorsal: recibe fibras de la vuelta basal de la cóclea. Las frecuencias altas se hallan en la porción más dorsal del núcleo ventral, mientras que las frecuencias bajas se localizan en la parte más ventral. En estos núcleos se encuentran los somas de las neuronas de segundo orden. A partir de aquí, la vía auditiva se convierte en un complejo sistema de núcleos y vías interconectadas, y es a un mismo tiempo homolateral y cruzada. 4. Los axones de las neuronas de segundo orden forman tres ramas nerviosas: a) La estría de Monakow o estría acústica dorsal. b) La estría de Held o intermediaria. c) El cuerpo trapezoide. 5. Complejo olivar superior: contiene el núcleo medial, que es el más importante ya que constituye la mayor parte del complejo, y al núcleo lateral que es pequeño. Casi todas sus neuronas son sensitivas a la estimulación biaural. 6. Núcleo del lemnisco lateral (fascículo longitudinal externo): está integrado por los axones provenientes de las neuronas de segundo y tercer grados. Representa a la cóclea en forma homolateral y contralateral. Contiene dos grupos celulares: a) Núcleo dorsal, relacionado con la estimulación biaural. b) Núcleo ventral, vinculado con la estimulación del oído contralateral. 7. Colículo inferior (392 000 neuronas): tiene una representación tonotópica de la cóclea, tanto en su porción central, que es la que recibe a la mayor parte de las fibras provenientes del lemnisco lateral, como en su núcleo externo. 8. Cuerpo geniculado medial. 9. Formación reticular. 10. Corteza auditiva: circunvolución temporal superior o de Heschl, áreas 41 a 42 de Brodmann. VÍA AUDITIVA EFERENTE Contiene las siguientes estructuras: 1. Corteza auditiva. 2. Cuerpo geniculado medial. 3. Colículo inferior. 4. Oliva bulbar. 5. Núcleo coclear, con ramificaciones a la sustancia reticular y vermis cerebeloso. 6. Haz olivococlear o de Rasmussen, formado por unas 600 fibras, con un componente cruzado e ipsolateral. 7. Órgano de Corti; es probable que el sistema aferente actúe como un modulador de la sensibilidad del órgano receptor. APARATO VESTIBULAR Está formado por los conductos semicirculares (superior, posterior y lateral) y los órganos otolíticos (sáculo y utrículo). Los primeros son sensores de aceleración angular y los segundos de aceleración lineal. Las crestas son los órganos sensoriales terminales de los conductos semicirculares, localizados en las ámpulas; las células ciliadas emergen de la superficie de las crestas hacia una masa gelatinosa llamada cúpula. Los órganos receptores del utrículo y el sáculo se conocen como máculas, que consisten en células ciliadas rodeadas por elementos celulares de soporte. Las células ciliadas se adhieren a una sustancia gelatinosa, que en su porción superior posee depósitos de carbonato de calcio llamados otolitos o estatoconios. Existen dos tipos de células ciliadas en las máculas y crestas vestibulares: 1. Tipo I, con terminaciones nerviosas en forma de cáliz y aspecto de botella, que se concentran en el vértice de las crestas y en el área central de las máculas. 2. Tipo II, cilíndricas, con pequeñas terminaciones nerviosas en sus bases. Cada una de las células ciliadas contiene un quinocilio y 60 a 100 estereocilios, y grupos celulares de una ERRNVPHGLFRVRUJ Fisiología del oídoa misma área tienen tendencia a concentrar los quinocilios en el mismo lado del grupo de estereocilios (polarización direccional). FENÓMENOS BIOELÉCTRICOS EN LOS CONDUCTOS SEMICIRCULARES UTRÍCULO Y SÁCULO Las fibras nerviosas de las máculas utricular y sacular actúan de modo espontáneo a unas 60 espigas/seg. Estos neuroepitelios responden en esencia a aceleraciones lineales, pero también pueden ser angulares de baja frecuencia, sobre ejes horizontales transversos (cabeceo) y anteroposteriores (rodamiento). VÍAS VESTIBULARES El equilibrio depende de la interacción de diferentes sistemas: 1. Cerebelo. 2. Visión. 3. Sistema propioceptivo. 4. Sustancia reticular. 5. Sistema vestibular. Es el que más se altera por alguna enfermedad y produce vértigo o desequilibrio. Vía vestibular proveniente de las crestas de los conductos semicirculares: tiene conexiones a través de neuronas de segundo orden con los núcleos vestibulares: 1. Rama vestibulocerebelosa. 2. Proyección vestibulocular: surge de las neuronas de los núcleos vestibulares superior y medial. Desarrolla conexiones con los pares craneales III, IV y VI. Ésta es la base neuroanatómica de los movimientos oculares (nistagmo), que resultan de la estimulación de los conductos semicirculares. 3. Conexiones comisurales (vestibulovestibulares): a partir de los núcleos vestibulares medial y superior; se activan sólo por la estimulación de los conductos 4. Conexiones vestibuloespinales: de las crestas pasan hacia el núcleo vestibular medial y discurren por el fascículo longitudinal medio hacia las neuronas motoras de la médula torácica y cervical. Se encargan durante la estimulación de los conductos de los reflejos musculares de cuello y miembros torácicos (figura 2–2). Vía vestibular proveniente de la mácula utricular: las conexiones utriculares se dividen en ascendentes y descendentes. Conexiones ascendentes: determinadas fibras hacen contacto con el núcleo vestibular lateral y a continuación neuronas de segundo orden, a través del haz ascendente de Deiters, se conectan con los músculos extraoculares, que producen los movimientos horizontales del ojo. Conexiones descendentes, con descripción (aquí sólo se señala la más importante). La conexión más relevante del utrículo es descendente a través de los haces vestibuloespinales medial y lateral. El haz vestibuloespinal medial se origina en el núcleo vestibular medial y sus axones se proyectan por el fascículo longitudinal medio hacia la mácula cervical y torácica superior. El haz vestibuloespinal lateral procede del núcleo vestibular lateral y discurre a la largo de toda la médula espinal. Estos haces tienen un papel importante en los reflejos musculares antigravitacionales. El utrículo se relaciona de forma primordial con los reflejos musculares del cuello y extremidades torácicas, mientras que los reflejos de las extremidades pélvicas y torácicas dependen en primera instancia de las proyecciones cerebelosas de la división dorsal del núcleo vestibular lateral (figura 2–3). Vía vestibular proveniente de la mácula sacular: de esta última se proyectan las siguientes conexiones centrales: 1. Grupo neuronal del núcleo en Y, con conexiones comisurales hacia el núcleo vestibular contralateral, y el núcleo infracerebeloso, que se proyecta hacia los núcleos oculomotores. ERRNVPHGLFRVRUJ Capítulo 2 Tanto en los conductos semicirculares como en los órganos otolíticos hay un potencial constante de 8 a 20 mV a lo largo de las terminaciones de las células ciliadas; este potencial es positivo del lado de la endolinfa y negativo en la perilinfa; es análogo a la polaridad del potencial endococlear. En los conductos semicirculares cualquier estímulo que provoque desviación de los cilios hacia el quinocilio produce un aumento de respuestas, mientras que desviaciones en el sentido opuesto ocasionan una disminución de ellas. Corrientes endolinfáticas ampulípetas estimulan al conducto horizontal y corrientes ampulífugas activan a los conductos superior y posterior. Cuando las aceleraciones se producen alrededor del eje vertical provocan la excitación de ambos conductos verticales de un lado y del horizontal contralateral, mientras que los restantes son inhibidos. Aceleraciones angulares alrededor del eje horizontal transversal excitan a los dos conductos verticales posteriores. La mayor parte de las fibras nerviosas de las ámpulas de los conductos tiene un potencial de reposo, el cual se incrementa con las deflexiones de los cilios en las células ciliadas en una dirección y disminuye en la dirección opuesta. Existe una actividad espontánea de descarga de 90 espigas/seg y hay casi 20 000 fibras en cada nervio vestibular, por lo que cada laberinto emite, en promedio, 1.5 a 106 espigas/seg al sistema nervioso central en condiciones de reposo. La frecuencia máxima de descarga de las fibras, al ser estimuladas, es de 350 a 400 espigas/seg. Los conductos semicirculares también pueden responder a fuerzas lineales constantes, como la gravedad al inclinar la cabeza o cuando se someten a una fuerza centrífuga. 19 19 Oído, nariz, garganta y cirugía de cabeza y cuello 20 ND NIC III Capítulo 2 Núcleos Cerebelo PVO IV Superior PVV CCS Lateral Descendente Medial VI VVE FLM MEC MET Figura 2–2. Vía aferente a partir de las crestas de los conductos semicirculares. CCS, crestas de los conductos semicirculares; NIC, núcleo intersticial de Cajal; ND, núcleo de Darkschewitsch; PVO, proyección vestibuloocular; PVV, proyección vestibulovestibular; VVE, vía vestibuloespinal; MEC, médula espinal cervical; MET, médula espinal torácica; FLM, fascículo longitudinal medio; III, IV y VI pares craneales. III HAD MU Vía vestibular eferente: comprende un grupo neuronal pequeño, de unas 300 neuronas, localizado en el tallo cerebral y se proyecta en forma periférica a través del nervio vestibular hacia los órganos sensoriales vestibulares. Las neuronas que forman esta vía se localizan cerca de los núcleos vestibulares, donde pueden efectuar conexiones con fibras aferentes, y emiten sus axones a través del haz olivococlear hacia las ramas periféricas del nervio vestibular, para terminar en el neuroepitelio de los órganos sensoriales vestibulares. Este sistema vestibular eferente tiene un efecto inhibitorio en los potenciales de acción del nervio vestibular. Todavía se desconoce su función en el equilibrio. VI HVEM 2. Conexiones con el haz vestibuloespinal lateral a través del núcleo vestibular medial. 3. Conexiones con el haz vestibuloespinal medial a través del núcleo vestibular lateral. Estas proyecciones vestibuloespinales no son muy cuantiosas, y sí mucho menores que las provenientes del utrículo (figura 2–4). HVEL MEC MET MEL Figura 2–3. Vía vestibular aferente proveniente de la mácula utricular: MU, mácula utricular; HAD, haz ascendente de Deiters; HVEL, haz vestibuloespinal lateral; HVEM, haz vestibuloespinal medial; MEC, médula espinal cervical; MET, médula espinal torácica; MEL, médula espinal lumbar; III, VI pares craneales. MECANISMO DEL VÉRTIGO El vértigo es un trastorno del sentido del equilibrio, caracterizado por una sensación de movimiento giratorio del ERRNVPHGLFRVRUJ Fisiología del oídoa 21 21 III S NY MS L M D HVEM HVEL FLM MEC MET Figura 2–4. Vía vestibular aferente proveniente de la mácula sacular: MS, mácula sacular; NIC, núcleo infracerebeloso; NY, núcleo en “Y”; HVEL, haz vestibuloespinal lateral; HVEM, haz vestibuloespinal medial; FLM, fascículo longitudinal medio; MEC, médula espinal cervical; MET, médula espinal torácica; S, núcleo vestibular superior; L, núcleo vestibular lateral; D, núcleo vestibular descendente; M, núcleo vestibular medial; III par craneal. cuerpo o los objetos que rodean al individuo, y acompaña al nistagmo vestibular. El sistema oculomotor sacádico activa el movimiento de los ojos de un punto de fijación a otro. La rotación de los ojos se realiza por medio de saltos de relativa alta velocidad; durante los movimientos sacádicos, la visión posee un punto ciego central. El sistema oculomotor sacádico genera la fase rápida del nistagmo vestibular, por lo que no hay visión durante esta fase. Por otro lado, el sistema oculomotor de seguimiento ayuda a conservar la fijación de la mirada durante el movimiento de un objeto. La rotación de los ojos es la forma más suave y de menor velocidad respecto de los movimientos sacádicos. Estos movimientos forman las derivas, en las que se conserva la visión. Este sistema genera la fase lenta del nistagmo vestibular. En consecuencia, al virar el globo ocular sobre un punto ciego (o de visión nula) se produce la sensación de que el ambiente gira en dirección opuesta a la fase lenta del nistagmo. De esta manera se crea la ilusión de un campo visual de giro; debido a esto, Cawthorne (1963) define al vértigo como una alucinación de movimiento. En el hombre, el nistagmo vestibular se inhibe por la fijación visual en un 50%, lo cual depende de la integración del flocculus en el cerebelo, pero ciertas lesiones cerebrales, sobre todo parietales, alteran este mecanismo, y la supresión visual del nistagmo vestibu- lar desaparece o se reduce. Estas áreas de supresión se encuentran en el área 7 de Brodmann. MAREO El mareo es una sensación de malestar general. Puede acompañarse de síntomas neurovegetativos, como sudación, palidez, náusea y vómito. El mareo se puede presentar en ausencia de enfermedades vestibulares, cuando los órganos periféricos se someten a ciertos estímulos, como ocurre en vehículos en movimiento. Este mareo también se denomina enfermedad del movimiento o cinetosis. Babkin (1946) fue el primero en sugerir un posible elemento neurohumoral como causa de la cinetosis. En apariencia, el movimiento libera una sustancia neurohumoral (todavía no identificada) hacia el líquido cefalorraquídeo del tercer ventrículo, que pasa al cuarto ventrículo para estimular al centro quimiorreceptor del vómito en el área postrema de la médula y región superficial del bulbo raquídeo. Wood y Braybiel (1970) formularon otra teoría neurohumoral para la génesis del mareo. Ésta se basa en dos sistemas neuroquímicos competitivos que participan en el mareo: uno activado por la acetilcolina y el otro por la noradrenalina. Las neuronas que intervienen en las reacciones vestibulares tienen la mediación de la acetilcolina; esto concuerda con la experiencia ERRNVPHGLFRVRUJ Capítulo 2 NIC 22 Oído, nariz, garganta y cirugía de cabeza y cuello clínica y los fármacos anticolinérgicos son efectivos contra este síntoma y algunos simpaticomiméticos son útiles en su prevención. El sistema noradrenalínico parece adyacente al sistema acetilcolínico en la sustancia reticular y en las mismas zonas contiguas de los núcleos vestibulares y los centros del vómito. Capítulo 2 INFLUENCIA DE LA EDAD EN LAS FUNCIONES COCLEAR Y VESTIBULAR Estudios experimentales en ratas han demostrado que es necesario el estímulo auditivo para la maduración normal de los núcleos auditivos del tallo cerebral. Asimismo, existe un periodo crítico para la interacción bineural, dependiente de las neuronas del colículo inferior, que se extiende entre los días 10 a 60 de vida. Todo esto lleva a considerar que los núcleos auditivos del tallo cerebral se desarrollan después del nacimiento. Por lo tanto, si al inicio del desarrollo del lenguaje un niño no puede entender los sonidos, o utilizar los fonemas de las palabras como símbolo, se detiene el proceso de codificación y diferenciación. Se ha encontrado una disminución de las células ganglionares en el ganglio espiral relacionada con la edad. Es posible que la degeneración intrínseca de la cóclea humana se inicie a partir de su vértice y que, durante la vida, sea susceptible al daño causado por otros factores, como el ruido ambiental, fármacos y otras sustancias indeterminadas. La disminución de las células ciliadas en el vértice de la cóclea humana puede ser el principal componente de la presbiacusia. Además, existe una degeneración de las células ciliadas internas en la primera vuelta basal de la cóclea, más sobre las áreas apicales y basales. Se ha observado también una reducción de la sustancia nerviosa en el núcleo coclear, así como una degeneración concomitante de las máculas del utrículo y el sáculo. Fisch describe una atenuación de la adventicia de las arterias del conducto auditivo interno y una pérdida acentuada de capilares y arteriolas en el ligamento espiral y en las paredes de las arteriolas de la parte inferior de la vuelta basal de la cóclea. Se sabe que las personas de 70 años en adelante experimentan una disminución de las células ciliadas de casi 40% en relación con los niños y adultos jóvenes. El proceso de maduración de la electronistagmografía es paralelo al electroencefalograma; se ha comprobado que los valores absolutos del nistagmo durante su producción en las pruebas térmicas se hallan en relación directa con la edad y que la intensidad de la reacción decrece con su avance. Rosenhall y Bergstrom (1973) han mostrado una reducción considerable de células sensoriales y sus fibras nerviosas en el sistema vestibular periférico en relación con la edad; lo mismo ocurre con otros sentidos, como el olfato y el gusto. Estudios practicados en el nervio cocleovestibular demuestran que áreas axonales transversales de éste se reducen con la edad, mientras que áreas de cuerpos amiloides aumentan, sin cambiar el número de fibras nerviosas. BARRERA HEMATOLABERÍNTICA Hasta el momento, la naturaleza de la barrera hematolaberíntica no se ha documentado bien. La penetración de cualquier sustancia dentro del laberinto se realiza por difusión simple, ultrafiltración, ósmosis, solubilidad lípida, afinidad especial de tejido o actividad metabólica. Esta barrera ayuda a mantener una composición constante de los líquidos del oído interno. En animales de experimentación se ha advertido que, al producir hiperglucemia o hipoglucemia, la glucosa de la perilinfa aumenta o disminuye igual que en el suero. Esta barrera hematolaberíntica es análoga a la barrera hematoencefálica descrita por Ehrlich. El intercambio de sodio en la perilinfa es un proceso más lento, cuando se compara con el del líquido cefalorraquídeo o el del humor acuoso. Sin embargo, al aplicar un diurético, como el ácido etacrínico, el sodio en perilinfa y suero desciende de manera simultánea. La absorción de calcio es mucho menor en perilinfa que en suero, y la albúmina se asimila con mayor facilidad en perilinfa que en líquido cefalorraquídeo. BIBLIOGRAFÍA Adams JC: Neuronal morphology in the human cochlear nucleus. Ar Otolaryngol 1986;112:1253–1261. Albiin N, Hellström S, Stenfors L, Cerne A: Middle ear mucosa in rats and humans. Ann Otol Rhinol Laryngol 1986;95 (Suppl. 126):2–15. Arnold W, Altermatt HJ, Arnold R et al.: Somatostatin immunoreactive cells in the human inner ear. Ar Otolaryngol 1986;112:934–937. Babin RW, Ryu JH, McCabe BF: Second–order vestibular adaptation and cupular dynamics. Ann Otol Rhinol Laryngol 1980;89:262–267. Benítez LD: Traveling waves demonstrated by a revolving helix. Ann Otol Rhinol Laryngol 1979;88:768–770. Bhattacharyya TK, Dayal VS: Age related hair cell loss in chinchilla. Ann Otol Rhinol Laryngol 1985;94:75–80. Butler RN, Gastel B: Hearing and age. Ann Otol Rhinol Laryngol 1979;88:676–683. Cantekin EI, Saez CA, Bluestone CD, Bern SA: Airflow through the Eustachian tube. Ann Otol Rhinol Laryngol 1979;88:603–612. Cantekin EI, Doyle WJ, Bluestone CD: Comparison of normal Eustachian tube function in the Rhesus monkey and man. Ann Otol Rhinol Laryngol 1982;91:179–184. ERRNVPHGLFRVRUJ Fisiología del oídoa Lawrence M, Burgio PA: Attachment of the tectorial membrane revealed by scanning electron microscope. Ann Otol Rhinol Laryngol 1980;89:325–330. Lenhardt ML: Effects of hyperbilirubinemia on the hearing and vocal development in gunn rats. Ar Otolaryngol 1982;108:339–342. Li CW, Lewis ER: Structure and development of vestibular hair cells in the larval bullfrog. Ann Otol Rhinol Laryngol 1979;88:427–437. Muchnik C, Hildesheimer M, Rubinstein M: Influence of catecholamines on perilymph PO2. Ar Otolaryngol 1984;110:518–520. Nadol JB: Reciprocal synapses at the base of outer hair cells in the organ of Corti of man. Ann Otol Rhinol Laryngol 1981;90:12–17. Nakashima T, Ito A: Effect of increased perilymphatic pressure on endocochlear potential. Ann Otol Rhinol Laryngol 1981;90:264–266. Naremore RC: Influences of hearing impairment on early language development. Ann Otol Rhinol Laryngol 1979;88 (Suppl. 60):54–63. Nuttall AL, Lawrence M: Intracellular potential changes of Corti’s organ with anoxia. Ar Otolaryngol 1979;105:574– 578. Nuutinen J, Kårjä J, Karjalainen P: Measurement of mucociliary function of the Eustachian tube. Ar Otolaryngol 1983;109:669–672. Ostfeld E, Crispin M, Blonder J, Szeinberg A: Micromethod for determination of middle ear gas composition. Ann Otol Rhinol Laryngol 1979;88:562–565. Peppard S: Effect of drug therapy on compensation from vestibular injury. Laryngoscope 1986;96:878–898. Prazma J, Vance SG, Bolster E et al.: Cochlear blood flow. Ar Otolaryngol 1897;113:36–39. Prazma J, Biggers WP, Fischer ND: Effect of Ethaverine Hydrochloride on cochlear microcirculation. Ar Otolaryngol 1981;107:227–229. Prazma J, Fischer ND, Biggers WP, Ascher D: Variation of endocochlear PO2 and cochlear potentials by breathing carbon dioxide. Ann Otol Rhinol Laryngol 1979;88:222–227. Rahko T, Kallio V, Kataja M et al.: Prevalence of handicapping hearing loss in an aging population. Ann Otol Rhinol Laryngol 1985;94:140–144. Rubel EW, Lippe WR, Ryals BM: Development of the place principle. Ann Otol Rhinol Laryngol 1994;93:609–615. Salamy A, McKean CM: Postnatal development of human brainstem, potentials during the first year of life. Electroencephalogr Clin Neurophisiol 1976;40:418–426. Strutz J: Efferent innervation of the cochlea. Ann Otol Rhinol Laryngol 1981;90:158–160. Takasaki K, Sando I, Balaban C, Haganimori S: Histopathological changes of the Eustachian tube cartilage and the tensor veli palatini muscle with aging. Laryngosc 1999;109:1679– 1683. Takemori S, Ono M, Maeda T: Cerebral contribution to the visual suppression of vestibular nystagmus. Ar Otolaryngol 1979;105:579–581. Tomoda K, Morii S, Yamashita T, Kumazawa T: Histology of human Eustachian tube muscles. Effect of aging. Ann Otol Rhinol Laryngol 1984;93:17–24. ERRNVPHGLFRVRUJ Capítulo 2 Carlborg B, Densert B, Densert O: Functional patency of the cochlear aqueduct. Ann Otol Rhinol Laryngol 1982;91:209– 215. Chole RA: Autoradiographic localization of vitamin A in the stria vascularis of the rat cochlea Ar Otolaryngol 1980;106:741–743. Contrucci R, Wilpizeski C: Neurohumoral hypothesis of motion–induced vomiting. Ann Otol Rhinol Laryngol 1985;94:322–323. Cranford JL, Stream RW, Rye CV, Slade TL: Detection and discrimination of brief duration tones. Ar Otolaryngol 1982;108:350–356. Dayal VS, Bhattacharyya TK: Comparative study of age–related cochlear hair cell loss. Ann Otol Rhinol Laryngol 1986;95:510–513. Duvall AJ, Santi PA, Hukee MJ: Cochlear fluid balance. Ann Otol Rhinol Laryngol 1980;89:335–341. Duvall AJ, Hukee MJ, Santi PA: Mannitol–induced stria vascularis edema. Ar Otolaryngol 1981;107:87–91. Eden AR: Neural connections between the middle ear, Eustachian tube and brain. Implications for the reflex control of middle ear aeration. Ann Otol Rhinol Laryngol 1981;90:566–569. Elidan J, Lin J, Honrubia V: Effect of loop diuretics on the vestibular system. Ar Otolaryngol 1986;112:836–839. Fee WE: Clinical application of nonacoustic middle ear muscle stimulation. Ar Otolaryngol 1981;107:224–226. Fermin C, Igarashi M: Vestibular ganglion of the squirrel monkey. Ann Otol Rhinol Laryngol 1982;91:44–52. Fujio M, Goto N, Kikuchi K: Nerve fiber analysis and the aging process of the vestibulocochlear nerve. Ann Otol Rhin Laryng 1990;99:863–870. Gacek RR: Neuroanatomical correlates of vestibular function. Ann Otol Rhinol Laryngol 1980;89:2–5. Gacek RR: Vestibular neuroanatomy. Recent observations. Ann Otol Rhinol Laryngol 1979;88:667–675. Goycoolea MV, Carpenter A, Paparella, MM, Juhn SK: Ganglia and ganglion cells in the middle ear of the cat. Ar Otolaryngol 1980;106:269–271. Goycoolea MV, Paparella MM, Carpenter A: Ganglia and ganglion cells in the middle ear. Ar Otolaryngol 1982;108:276–278. Gyo K, Goode RL, Miller C: Effect of middle ear modification on umbo vibration. Ar Otolaryngol 1986;112:1262–1268. Hills B: Analysis of Eustachian surfactant and its function as a release agent. Ar Otolaryngol 1984;110:3–9. Honjo I, Okazaki N, Ushiro K, Humazawa T: Cineradiographic analysis of Eustachian tube function. Ann Otol Rhinol Laryngol 1980;89:276–278. Igarashi M, Mauldi L, Jerger J: Impedance audiometry in the squirrel monkey. Ar Otolaryngol 1979;105:258–259. Juhn SK, Rybak LP, Prado S: Nature of blood–labyrinth barrier in experimental conditions. Ann Otol Rhinol Laryngol 1981;90:135–141. Kileny P, McCabe BF, Ryu JH: Effects of attention–requiring tasks on vestibular nystagmus. Ann Otol Rhinol Laryngol 1980;89:9–12. Kimura RS, Ota CY, Takahashi T: Nerve fiber synapses on spiral ganglion cells in the human cochlea. Ann Otol Rhinol Laryngol 1979:88(Suppl. 62). 23 23 24 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 2 Troost BT: An overview of ocular motor neurophysiology. Ann Otol Rhinol Laryngol 1981;90(Suppl. 86):29–36. Uddman R, Aluments J, Densert O, Ekelund M et al.: Innervation of the felene Eustachian tube. Ann Otol Rhinol Laryngol 1979;88:557–561. Virtanen H, Palva T, Jauhiainen A: Comparative preoperative evaluation of Eustachian tube function in pathological ears D. Ann Otol Rhinol Laryngol 1980;89:366–369. Virtanen H, Marttila T: Middle–ear pressure and Eustachian tube function. Ar Otolaryngol 1982;108:766–768. Watanabe K, Ogawa A: Carbonic anhydrase activity in stria vascularis and dark cells in vestibular labyrinth. Ann Otol Rhinol Laryngol 1984;93:262–266. Webster DB, Webster M: Effects of neonatal conductive hearing loss on brain stem auditory nucIei. Ann Otol Rhinol Laryngol 1979;88:684–688. Yagi N, Fisch U: Effect of cholinergic drugs on the perilymphatic oxygen tension. Ann Otol Rhinol Laryngol 1979;88:626– 629. Yamaguchi N, Sando I, Hashida Y, Takahashi H: Histologic study of Eustachian tube cartilage with and without congenital anomalies. A preliminary study. Ann Otol Rhin Laryng 1990;99:984–987. ERRNVPHGLFRVRUJ Auxiliares diagnósticos en otología núa oyendo el sonido. Se obtiene así una referencia del grado de hipoacusia. Si la audición es buena, el número de segundos es igual al del examinador o al normal del diapasón. Cuando hay hipoacusia de conducción, el tiempo es mayor, y más corto en la hipoacusia sensorial. En consecuencia, la prueba de Schwabach se refiere como normal, alargada o acortada. DIAPASONES Los diapasones son instrumentos de acero o aleaciones de metales que constan de un mango y dos ramas iguales que, al someterse a vibración, producen tonos puros. Sirven como complemento del estudio audiométrico y como control de posibles errores con el audiómetro. Exploran frecuencias graves y medias. Por lo general hay cinco diferentes tonos emitidos por los diapasones, que son los empleados en clínica y oscilan entre 128 y 2 048. Su función principal es determinar, de manera sencilla y rápida, si la lesión que produce la sordera se encuentra en el oído medio o el interno. Prueba de Weber Se coloca el diapasón en vibración sobre la frente y se pregunta al paciente en cuál oído percibe el sonido más intenso. En oídos con audición similar, el sonido no se lateraliza. En hipoacusias de conducción, el sonido se lateraliza hacia el oído con peor audición; en hipoacusias sensoriales, el sonido lo hace hacia el mejor oído. Tonos utilizados en los diapasones de esta prueba son de 256 o 512. Prueba de Schwabach Se basa en la diferencia del tiempo de percepción por vía ósea entre el sujeto en estudio y el normal. Se coloca primero el diapasón en vibración sobre la mastoides del paciente y se le pide que comunique el momento en que deje de percibir el sonido; cuando cesa de oírlo, se retira y el examinador lo apoya en su propia mastoides. Si el examinador tiene un oído normal, puede reconocer la audición del paciente al contar el número de segundos que conti- Prueba de Rinne Esta prueba trata de establecer la diferencia del tiempo de audición en un mismo oído entre la vía ósea y la aérea. En lesiones conductivas se oye más tiempo el diapasón por la vía ósea y en lesiones sensoriales por la aérea. Primero se coloca el diapasón en la mastoides del paciente, tras indicarle que señale cuándo deja de percibirlo; en ese momento se aplica el instrumento por la vía aérea. Si el oído es normal o hay una hipoacusia de percepción, se percibe todavía el diapasón por vía aérea, aunque haya dejado de hacerlo por la ósea. Esto se considera un Rinne positivo. En cambio, si el diapasón no se oye por la vía aérea, se trata de un Rinne negativo, causado por una hipoacusia de conducción. Se sugiere usar en esta prueba los diapasones de 256, 512 y 1 024. Capítulo 3 AUDIOMETRÍA Prueba de Bornnier Consiste en cuantificar la audición por la vía ósea en puntos alejados del oído. Se utiliza el diapasón 256, que se apoya en diferentes puntos, como las vértebras cervicales, codo, rótula o clavícula. En hipoacusias conductivas, con buena reserva coclear, es posible percibir el tono en el oído. Prueba de Gelle Se efectúa al colocar el diapasón en la mastoides y a continuación se aplica una pera de Politzer en el conducto y se administra presión. Si el sujeto señala que decrece la percepción del tono que se aplica por vía ósea, se dice que el Gelle es positivo; si perdura la audición como antes es negativo. Esta prueba puede 25 ERRNVPHGLFRVRUJ 26 Oído, nariz, garganta y cirugía de cabeza y cuello indicar anquilosis a lo largo de la cadena osicular. Si la cadena se encuentra en condiciones normales, al ejercer la presión contra el tímpano aumenta la impedancia hasta el máximo y decrece por consiguiente la audición. Capítulo 3 AUDIOMETRÍA TONAL El audiómetro es un aparato eléctrico que emite sonidos puros de diferente tono con una intensidad constante. Por lo regular, el tono cubre todo el campo auditivo humano y es capaz de producir intensidades desde 10 hasta 110 o 120 decibeles y frecuencias desde el tono de 125 hasta el de 16 000. Valoración: para recordar los símbolos empleados en la anotación de los resultados del estudio audiométrico puede consultarse el dibujo de Fowler (figura 3–1). En el dibujo, la vía aérea se representa con una “O” para el oído derecho y una “X” para el izquierdo; las orejas indican la vía ósea derecha e izquierda. El color rojo se utiliza para la representación audiométrica del oído derecho y el color azul para el izquierdo. Debido a que los ruidos del ambiente inciden sobre la audición, es preciso estudiarla en un medio con silencio apropiado, por lo que se recomienda una “cámara silente sonoamortiguada”. El estudio audiométrico se registra en un audiograma: la frecuencia se representa en forma horizontal y medida en hercios de 125 a 8 000 Hz. El grado de audición se grafica en forma vertical, desde 0 dB hasta 100 dB (figura 3-2). Figura 3–1. Dibujo de Fowler: vía aérea: izquierda X, derecha O; vía ósea: izquierda >, derecha <. Figura 3–2. Audiómetro y cámara sonoamortiguada. Audiograma por vía aérea Metodología 1. Colocar los auriculares sin comprimir demasiado el pabellón auricular, ya que pueden producir una oclusión del conducto auditivo externo. 2. Comenzar a estudiar el tono en la frecuencia 1 000, al principio con una intensidad alta (40 a 50 dB) con el objeto de dar a conocer el sonido de que se trata; el paciente responde levantando la mano del mismo lado del oído que lo escucha, o bien presionando una perilla luminosa para tal fin. Es más recomendable pedirle que levante y baje la mano cada vez que escuche el estímulo sonoro, debido a que ambos oídos pueden percibir en ocasiones el sonido; en tal caso, se le indica que levante y baje las dos manos; el examinador puede percatarse así de esto y utilizar sonido enmascarador. A continuación se aplica la intensidad mínima del audiómetro y se incrementa de forma gradual de cinco en cinco decibeles hasta que el sujeto perciba el sonido, de tal modo que se localiza el umbral mínimo. 3. Se realiza lo mismo con las demás frecuencias. Se aconseja seguir una frecuencia ascendente hasta los 8 kHz y luego continuar en forma descendente a partir de la frecuencia de 500 Hz. 4. Tomar primero la audición del oído que se refiere como el mejor en términos clínicos. Por vía aérea existe audición cruzada a partir de los 50 dB; si se aplican más de 50 dB por un oído y se comienza a ERRNVPHGLFRVRUJ Auxiliares diagnósticos en otologíaa percibir por el contralateral, es necesario ensordecer a este último. Dicho fenómeno se presenta casi siempre con diferencia en sensibilidad auditiva de 30 a 50 dB entre ambos oídos. Para este efecto se utiliza un vibrador sobre la mastoides o la frente. El uso de enmascaramiento (aplicación de ruido en el oído contralateral) se recomienda cuando el paciente refiere que oye el tono dirigido al oído no estudiado. Las frecuencias analizadas aquí fluctúan entre 250 y 4 000 Hz. La técnica es similar al audiograma por vía aérea. LOGOAUDIOMETRÍA Los tonos más importantes que entran en la formación de la palabra son de 500, 1 000 y 2 000 Hz. Se puede considerar este nivel tonal con el objeto de comprender las dificultades de un sordo para captar la palabra hablada. No es lo mismo oír que entender; por ello, la audiometría tonal, sin soslayar su importancia, no establece la capacidad de comprensión del oído ante los fonemas. En forma genérica, existen dos tipos de medida logoaudiométrica: 1. Medida de sensibilidad (umbral de inteligibilidad): consiste en medir el nivel más bajo en que el paciente puede entender el habla (umbral de recepción al habla). En esta prueba se presentan al individuo palabras bisílabas a diferentes grados de intensidad, hasta localizar el umbral en el cual es capaz de responder en forma acertada el 50% de las palabras. Por lo general, este umbral concuerda con el promedio de los tonos puros en las frecuencias de 500, 1 000 y 2000. 2. Medida de entendimiento: consiste en estudiar la forma en que discrimina el sujeto las palabras que Interpretación del audiograma Un audiograma ayuda sobre todo a distinguir entre una lesión auditiva conductiva y una sensorineural. Las afecciones del oído externo y medio interfieren con la curva para tonos aéreos y no con la conducción de tonos óseos. La distancia que se crea entre estas curvas se denomina GAP (intervalo) y es de gran importancia en la valoración clínica de los pacientes. Las lesiones sensorineurales producen pérdidas o caídas tanto de los tonos aéreos como de los óseos. En consecuencia, las hipoacusias pueden clasificarse como conductivas, sensorineurales y mixtas (cuando existen ambos componentes). Respecto de su intensidad, se dividen en: Superficiales (tonos de 20 a 40 dB). Moderadas (tonos entre 40 y 60 dB). Graves (tonos de 60 a 80 dB). Profundas (tonos mayores de 80 dB) (figura 3–3). 125 250 500 1 000 2 000 3 000 4 000 8 000 0 N 10 20 S Decibeles 30 40 50 M 60 G 70 80 P 90 100 Figura 3–3. Audiograma: N, audición normal; S, hipoacusia superficial; M, hipoacusia moderada; G, hipoacusia grave; P, hipoacusia profunda. ERRNVPHGLFRVRUJ Capítulo 3 Por otro lado, no sólo contribuyen a la audición del habla las frecuencias de 500, 1 000 y 2 000, sino también los tonos más agudos. Frecuencias mayores de 10 kHz pueden suministrar información temprana acerca del estado de los órganos auditivos. La capacidad para captar sonidos de muy altas frecuencias decrece en forma gradual con la edad; este proceso inicia a partir del tercer decenio de la vida. Audiograma por vía ósea 1. 2. 3. 4. 27 27 Oído, nariz, garganta y cirugía de cabeza y cuello 28 se encuentran por encima de su umbral de recepción. Para conocer el porcentaje máximo de captación, para el idioma español, se elaboró una lista de trisílabos graves y otra de monosílabos sin sentido. Capítulo 3 Se ha demostrado ya la utilidad de esta lista. Su curva de discriminación constituye un elemento muy fidedigno en el diagnóstico otológico. Esta prueba se efectúa en una cámara sonoamortiguada; se le pide al paciente que repita las sílabas que oiga, incluso si cree que son incorrectas. Se emite un grupo de sílabas en cada intensidad, que se aumenta en emisiones de 20 dB. Con el resultado de la exploración se elabora una gráfica, en la cual las abscisas corresponden a la intensidad en decibeles y las ordenadas al porcentaje de captación correcta. Se registra así una curva de inteligibilidad. Cuando existe una diferencia en la audición mayor a 30 dB entre ambos oídos se recomienda explorar el oído con mejor audición y enmascararlo en forma posterior al estudiar el oído más afectado. Interpretación de las curvas de inteligibilidad en la logoaudiometría 1. Curva normal de la logoaudiometría: tiene una forma de S itálica y cruza el nivel del 50% a 15 dB. Entre 40 y 50 dB, el oído normal es capaz de entender toda la lista de palabras emitidas en español. Si se aumenta la intensidad, se seguirá contestando al principio el 100% de las palabras durante algún tiempo. Después, la curva se satura y, a grandes intensidades (más de 100 dB), decae por la distorsión de la voz (figura 3–4). 2. Curva en hipoacusia conductiva: la curva muestra una forma de S más vertical que la normal y más desplazada hacia la derecha. No existe discrepancia entre el umbral tonal y el logoaudiométrico. 3. Hipoacusia sensorial: la curva varía según sea el grado de sordera, pero no llega al 100% de discriminación y cuando existe reclutamiento al aumentar la intensidad, la curva desciende. 4. Hipoacusia mixta: la curva varía de acuerdo con las lesiones del oído medio y el aparato de percepción. 5. Hipoacusia neural: algunas lesiones del nervio auditivo pueden mostrar logoaudiometrías caracterizadas por la gran discrepancia entre el umbral tonal y el logoaudiométrico. En este caso, el porcentaje de captación es mínimo y se mantiene constante, cualquiera que sea la intensidad de exploración. En pacientes afásicos, autistas o con pérdida auditiva muy grave, el valor de la logoaudiometría es nulo (cuadros 3–1 y 3–2). ACUFENOMETRÍA Se refiere a la medición del acúfeno, definido éste como una sensación acústica anormal percibida en el oído, que se produce en el organismo y que tiene cierto grado de continuidad. El acúfeno se puede medir con el audiómetro. La técnica es la siguiente: 1. Se realiza un barrido tonal y se registra la audiometría tonal común. 2. Se equipan las frecuencias; para ello se le indica al paciente que conteste cuando oiga un sonido parecido o igual al acúfeno. 3. Una vez equiparado el acúfeno con la frecuencia más semejante, se aumenta de forma gradual la intensidad hasta que el paciente señale que el sonido es igual al acúfeno escuchado. El sitio 100 N 80 S 60 C 40 NE 20 0 0 20 40 60 80 10 12 Figura 3–4. Curvas logoaudiométricas: N, audición normal; C, hipoacusia conductiva; S, hipoacusia sensorial; NE, hipoacusia neural. Cuadro 3–1. Lista de monosílabos sin sentido (Corvera, 1978) pi ji fra bri bas pu yo ta klu da ki do dre ko du kre gq fle gle fu sa lu ra si ri tri blo gla al ña ir mo me es nu ru to re te on be fli blu fa gu en da bro ERRNVPHGLFRVRUJ Auxiliares diagnósticos en otologíaa 29 29 Cuadro 3–2. Lista de algunas palabras trisílabas graves Bolillo Bodega Rutina Maduro Fatiga Muñeca Fumada Filete Espejo Borracho Mimosa Borrego Peludo Fulano Litera Capullo Cotorra Pomada Luneta Cachete Uñero Picudo Copete Dudoso Tumulto Mochila Joroba Ocupa Paloma Gollete Coyote Rebaño Seguro Dudoso Billete Hechura Cariño Rotura Posada Capucha Garrafa Guerrero Visita Conejo Pocillo Helecho Divino de la frecuencia e intensidad del acúfeno en el audiograma se marca con un triángulo equilátero invertido. RECLUTAMIENTO Es un fenómeno paradójico basado en la incapacidad de algunos oídos hipoacúsicos de percibir el sonido a intensidades normales, mientras que por arriba del umbral tienen capacidad para oír igual que el oído sano o aun mejor. Se lo considera característico de una lesión neuroepitelial. Se dispone de dos pruebas básicas para su valoración: 1. Prueba de Fowler: requiere una diferencia de audición entre los dos oídos de al menos 30 dB. El método se basa en la comparación de la sensación de intensidad entre el oído sordo y el sano o menos hipoacúsico. Se elige una frecuencia mayor de 500 Hz y se le advierte al individuo que se aumentará la intensidad en el peor oído hasta que la percepción sea igual en los dos oídos. Una vez equilibrada la sensación de volumen, se comienza por incrementar 10 dB en el mejor oído y a continuación se aumenta la intensidad en el contralateral, hasta que el enfermo manifieste que oye igual en ambos oídos. Se anotan los resultados sobre la línea de la abscisa correspondiente y se equiparan los resultados entre ambos oídos mediante el trazo de líneas continuas. En presencia de reclutamiento, las líneas se vuelven horizontales y se acercan. 2. Prueba SISI (short increment sensitivity index): se le pide al sujeto que trate de detectar pequeños cambios de intensidad (de un decibel) en un tono continuo aplicado a 20 dB por arriba del umbral durante 2 min. El oído con reclutamiento percibe más que el oído normal estos pequeños incrementos de intensidad; cuando la diferencia es mayor de 30% debe sospecharse una lesión coclear. EMISIONES OTOACÚSTICAS En 1978, David Kemp fue el primero en demostrar y describir que la cóclea era capaz de producir y recibir sonidos, a lo cual se denominó emisiones otoacústicas evocadas; éstas se producen en las células ciliadas externas y se miden en el conducto auditivo externo; se conocen tres tipos de emisiones otoacústicas: 1. Espontáneas: se registran sin necesidad de estímulo, no son de utilidad clínica y ocurren en un 35 a 50% de los oídos con audición normal. 2. Transitorias: son respuestas evocadas producidas por una estimulación de la cóclea, en frecuencias de 500 a 5 000. 3. Producto de distorsión: consisten en respuestas evocadas producidas por estimulación a través de dos tonos puros simultáneos de diferente frecuencia. Se presentan en el espectro de 500 a 8 000 Hz; de manera característica no aparecen en hipoacusias mayores de 30 dB. Las hipoacusias de origen coclear superficiales a moderadas son resultado de una pérdida del sistema amplificador biomecánico y no de una reducción de la sensibilidad de las células sensoriales; estas emisiones son útiles en clínica para: a) Detectar sordera en niños. b) Diferenciar la alteración coclear de la retrococlear. c) Valorar la enfermedad de Ménière o hidropesía. d) Reconocer hipoacusia súbita o autoinmunitaria. e) Vigilar ototoxicidad en la cóclea. f) Valorar la audición en pacientes poco cooperadores. g) Reconocer en fase temprana traumatismo acústico en músicos o personas expuestas a niveles altos de contaminación por ruido. ERRNVPHGLFRVRUJ Capítulo 3 Mulato 30 Oído, nariz, garganta y cirugía de cabeza y cuello EMISIONES OTOACÚSTICAS TRANSITORIAS EVOCADAS Capítulo 3 Las emisiones otoacústicas transitorias evocadas son una herramienta para valorar la audición en los recién nacidos, en virtud de su rapidez y bajo costo. La prevalencia de hipoacusia sensorineural en neonatos es de 1 a 2 por 1 000 nacidos vivos. Esta prueba presenta un nuevo método de investigación de la función auditiva periférica. Cabe señalar que los individuos con lesiones retrococleares pueden presentar emisiones otoacústicas normales. Las emisiones otoacústicas evocadas comprenden desde los 0.8 kHz hasta los 5 kHz; las frecuencias de respuesta mayor son las situadas entre 4.8 kHz y 5.2 kHz y las frecuencias de respuesta menor varían entre 0.9 kHz y 1.3 kHz, y surgen del movimiento vibratorio de las células ciliadas externas de la cóclea. La maduración estructural de las células ciliadas externas y el desarrollo de su inervación eferente inician en la región basal y media de la cóclea y progresan en forma apical; la maduración de las células ciliadas externas se completa en el ser humano a las 32 semanas de gestación. AUDIOMETRÍA DE RESPUESTAS ELÉCTRICAS ELECTROCOCLEOGRAFÍA La electrococleografía (ECOCHG) consiste en el registro de los potenciales cocleares (microfónica, potencial de sumación y potencial de acción). Se utiliza para el diagnóstico clínico de hipoacusias sensorineurales. La latencia del potencial de acción del nervio constituye uno de los factores más importantes en su registro. El desarrollo de técnicas de registro extratimpánico (no invasivas) ha contribuido a su mayor difusión, ya que al principio era necesario introducir electrodos a través del tímpano y en contacto con el promontorio para obtener registros adecuados. Su registro se caracteriza por tres componentes: 1. El registro de la microfónica coclear. 2. Los dos componentes del potencial de acción, el nervio auditivo NI, onda con cresta inferior seguido por NII, que es una onda de cresta superior. La presencia o ausencia de estos potenciales microfónicos cocleares, junto con la prolongación de las latencias de las ondas I y II, orientan en la valoración topográfica de una lesión específica. Ferraro y Arenberg (1985) han mostrado que la información obtenida por la ECOCHG es de ayuda para apoyar el diagnóstico y valorar el resultado del tratamiento en pacientes con enfermedad de Ménière. Asimismo, la ECOCHG ósea favorece la valoración de sujetos con hipoacusias mixtas y conductivas. Los resultados obtenidos por Harder (1980) han mostrado una adecuada correlación entre la ECOCHG ósea y los estudios audiológicos habituales practicados en personas con otoesclerosis. RESPUESTAS AUDITIVAS DEL TALLO CEREBRAL Las respuestas auditivas del tallo cerebral (RATC) proporcionan una medida objetiva de la función auditiva del sujeto. En 1970, Lewett empleó las RATC mediante la colocación de electrodos en el cuero cabelludo. El electrodo positivo se aplica en el vértex, el negativo sobre la mastoides del oído en estudio, y la tierra en la mastoides contralateral. Los impulsos pasan a un preamplificador y de ahí a una computadora. En los primeros 10 mseg se detectan siete ondas; entre 10 y 50 mseg, aparecen las ondas de componentes medios o de latencia intermedia, y en más de 50 mseg se registran las ondas de componente tardío o respuestas lentas. Origen de las ondas de RATC Onda I. Nervio coclear. Onda II. Núcleo coclear (los estudios de Meller y Jannetta de 1982 han mostrado la posibilidad de que esta onda también se origine en el nervio coclear). Onda III. Complejo olivar superior. Onda IV. Núcleo ventral del lemnisco lateral. Onda V. Colículo inferior. Onda VI. Cuerpo geniculado medial. Onda VII. Se desconoce. En ocasiones se fusionan las ondas IV y V (figura 3–5). Estudio de RATC El estudio de RATC es útil en los siguientes casos: a) Niños con retardo en el habla. b) Parálisis cerebral. c) Lesiones centrales. d) Neurinoma del acústico. e) Auxiliar en el diagnóstico de esclerosis múltiple. f) Confirmación de la presencia de muerte cerebral. Para la determinación del grado de pérdida auditiva, el umbral de la onda V es el mejor indicador. En lesiones centrales y periféricas, la latencia de la onda V puede verse prolongada y su amplitud disminuida. El tiempo de intervalo entre las ondas I y V se utiliza para separar las lesiones centrales de las periféricas. En lesiones cocleares hay un periodo I a V corto; lesiones retrococleares: periodo I a V prolongado; lesiones del tallo cerebral con prolongación de I a V: insuficiencia vascular, enfermedades desmielinizantes, masas ocupativas. En forma genérica, el neurinoma del acústico prolonga la latencia de la onda V más de 0.4 mseg, en comparación con la latencia de la onda contralateral. Por otro lado, la combinación de una audiometría para tonos puros normal o cercana a lo normal, con RATC anormales, indica lesión retrococlear. ERRNVPHGLFRVRUJ Auxiliares diagnósticos en otologíaa 31 31 POTENCIALES MIOGÉNICOS EVOCADOS VESTIBULARES Se ha observado que los estímulos sonoros son capaces de producir respuestas sobre el músculo esternocleidomastoideo. Es probable que esto tenga un origen vestibular a nivel sacular. Dichas respuestas desaparecen después de la sección del nervio vestibular. IMPEDANCIOMETRÍA APLICACIONES DE LA IMPEDANCIOMETRÍA Figura 3–5. Ondas de las respuestas auditivas del tallo cerebral: I, nervio coclear; II, nervio o núcleo coclear; III, complejo olivar superior; IV, lemnisco lateral; V, colículo inferior; VI, cuerpo geniculado medial; VII, desconocida. Medidas aproximadas de las latencias de las ondas de RATC: onda I: 1.6 mseg/desviación estándar (DE) 0.1; onda II: 2.6 mseg/DE 0.3; onda III: 3.8 mseg/DE 0.1; onda V: 5.8 mseg/DE 0.3; periodo I–V: 4.2 mseg/ DE 0.3. El umbral de latencia de la onda V disminuye con la edad. Las ondas III, IV y V no se encuentran bien diferenciadas en neonatos y lactantes y alcanzan un patrón maduro alrededor de los dos años. Esta reducción de la latencia de la onda V se debe a una progresiva mielinización. También se ha observado que si la latencia de la onda I es normal, y el resto de las ondas muestra un patrón anormal, debe sospecharse una lesión neurológica. Por el contrario, si todas las ondas presentan una latencia prolongada, es posible un problema periférico. Las RATC no se afectan durante el sueño ni por sedación o anestesia general. En la muerte cerebral pueden encontrarse componentes de la onda I, así como la ausencia completa de respuesta. RESPUESTAS DE LATENCIA MEDIA Dentro de las respuestas de la latencia media (RLM) se reconocen cuatro ondas positivas (Po, Pa, Pb, Pc) y tres negativas (Na, Nb, Nc). Pa es la onda más consistente de las RLM. Entre los 12 y 15 mseg pueden observarse res- Aplicaciones de la impedanciometría: a) Medición de la impedanciometría absoluta (de escaso valor clínico, en virtud de la variación y amplitud de los límites normales). b) Timpanometría: 1. Estudio de la cadena osicular. 2. Enfermedad tubaria. 3. Otitis medias (serosas, adhesivas, timpanoesclerosis). 4. Alteraciones en el tímpano (perforación timpánica, tímpanos cicatrizales). c) Estudio del reflejo estapedial: 1. Audiometría objetiva en niños. 2. Audiometría en simuladores. 3. Diagnóstico topográfico de la hipoacusia neurosensorial. 4. Estudio del reclutamiento. 5. Prueba de adaptación del reflejo estapedial (lesiones retrococleares). TIMPANOMETRÍA Esta técnica estudia las variaciones de la impedancia al modificar las presiones en el conducto auditivo externo. El valor diagnóstico de la timpanometría reside en el hecho de que diferentes tipos de lesiones en el oído medio modifican la forma del timpanograma. Para obtener una curva de timpanometría se determinan de forma consecutiva las adaptabilidades (desplazamiento de la membrana timpánica al aplicar determinadas presiones) ERRNVPHGLFRVRUJ Capítulo 3 puestas miogénicas, sobre todo si el electrodo se coloca sobre la mastoides. Las RLM no son tan sensitivas como las RATC; tienen 24% de resultados falsos negativos. Según Musiek (1981), la onda V de las RATC es equiparable a las ondas Pa y Pb de RLM; las ondas I a III de RATC a la onda Pc de RLM. Las RLM ocurren con más frecuencia que las RATC a niveles de sensación auditiva bajos; se pueden obtener respuestas a baja frecuencia a partir de 10 dB. Con esta prueba se pueden medir los umbrales auditivos tanto en adultos como en niños. 32 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 3 a +200, +50, 0, –50, –100 y –200 mm. Las respuestas obtenidas se unen en la gráfica de Brooks para obtener así el trazo (figura 3–6). No hay peligro de que el tímpano se perfore con presiones de –400 mm, ya que tímpanos muy delgados o con lesiones cicatrizales toleran presiones de 3 000 a 5 000 mm. Existen cuatro tipos fundamentales de curvas en la timpanometría: Grupo IV. La curva timpanométrica es una línea recta. Su trazado es casi horizontal; se observa en casos de otitis adhesivas y perforaciones timpánicas. Kobayashi (1986) publicó estudios de timpanogramas con curvas nistagmoides en perforaciones pequeñas o puntiformes de la membrana timpánica. Grupo I o tipo A. El punto culminante de la curva está centrado en el punto 0 de la presión aérea. Significa que la presión aérea del oído medio es igual a la presión atmosférica. Tiene dos variantes: el tipo As tiene una adaptabilidad reducida debido a la rigidez de la cadena osicular (p. ej., anquilosis estapediovestibular); el tipo Ad posee una adaptabilidad aumentada y refleja discontinuidad de la cadena osicular o tímpanos con lesiones cicatrizales. Para un oído normal, el valor del gradiente (distancia de la curva comprendida entre –50 y +50 mm) es de 40 a 60% de la adaptabilidad máxima. Grupo II o tipo C. Incluye curvas que mantienen su perfil normal o casi normal, pero el punto máximo de la curva se halla desplazado hacia la zona de las presiones negativas. Grupo III o tipo B. El punto máximo de la curva desaparece y se transforma en una meseta desplazada hacia la zona de las presiones negativas. Se identifica en casos de secreción en la caja timpánica. REFLEJO ESTAPEDIAL GI Ad GII GII GIV Figura 3–6. Curvas de timpanometría (G, grupo). El reflejo estapedial (RE) aparece a intensidades de 70 a 80 dB por encima del umbral de audición del oído estimulado. La vía del reflejo acústico ipsolateral es la porción ventral del núcleo coclear y la porción media del núcleo motor facial. La vía del reflejo acústico contralateral se proyecta por el complejo olivar superior, fascículo longitudinal medio y pedúnculo cerebral con conexiones contralaterales con los núcleos de los pares craneales V, VI y VII. Los umbrales del RE aumentan con la ingestión de barbitúricos y alcohol. Aplicaciones clínicas del reflejo estapedial a) Permite realizar una audiometría objetiva. La aparición de una respuesta refleja normal (70 a 80 dB) permite afirmar que el sonido se ha percibido de modo subjetivo a dicha intensidad. En hipoacusias sensoriales con reclutamiento, el reflejo aparece a intensidades menores. b) Ayuda a identificar a individuos simuladores que pretenden pasar por sordos. c) Estudio del nervio facial. La desaparición o conservación del reflejo estapedial contribuye en la valoración topográfica de la lesión que causa la parálisis facial. El reflejo estapedial puede detectar lesiones en etapa temprana o, por el contrario, el comienzo de la recuperación funcional del nervio. d) Presencia de reclutamiento. Existe reclutamiento si la diferencia entre el umbral del reflejo y el umbral de audición es menor de 60 dB en el oído estimulado; esto sugiere lesión coclear. e) Prueba de adaptación del reflejo estapedial. Se considera anormal cuando la amplitud de la respuesta del reflejo disminuye a la mitad o más en cinco segundos, al aplicar un tono continuo de 500 o 1 000 Hz, 10 dB por arriba del umbral del reflejo acústico. Su presencia sugiere lesión retrococlear. Porcentaje de sensibilidad: 90 a 95%. f) Prueba de latencia del reflejo estapedial. Según Clemis (1980), el promedio de la latencia absoluta del reflejo es de 95 mseg, con desviación promedio de 24.5 mseg. La diferencia de latencia interaural es de 14.7 mseg, con una desviación promedio de 11.4 mseg. Por lo tanto, valores de 144 mseg (latencia absoluta) o 36 mseg (diferencia de latencia interaural) se consideran anormales y provocan lesiones retrococleares. La prueba del RE y las respuestas auditivas del tallo cere bral constituyen dos métodos diagnósticos valiosos para la detección temprana de alteraciones del VIII par craneal. ERRNVPHGLFRVRUJ Auxiliares diagnósticos en otologíaa AUXILIARES AUDITIVOS ELÉCTRICOS a) Micrófono. b) Amplificador. c) Fuente de energía. d) Microaltavoz. e) Reóstato. Los audífonos transforman en electricidad el sonido que entra y, después de aumentar la intensidad, sale convertido de nueva cuenta en energía sonora. En estos casos se emplean los términos ganancia auditiva, potenciales de entrada y potenciales de salida. El potencial de entrada y la ganancia auditiva producen los potenciales de salida. El concepto de amplitud de frecuencia de ondas del aparato se refiere a la gama de frecuencias en la cual la ganancia supera un cierto nivel. La amplitud de frecuencias se considera estrecha (sonido agudo), intermedia (sonidos medios y agudos) y ancha (sonidos graves, medios y agudos). La curva de respuesta a la frecuencia describe por tanto la ganancia relativa del aparato (figura 3–7). Durante la adaptación del AAE puede aparecer un ruido semejante a un silbido, de tonalidad alta, lo cual se debe a que el sonido amplificado y transmitido al auricular retorna a través de éste y aumenta otra vez, de tal manera que se crea un círculo vicioso; este fenómeno se conoce como retroalimentación. La única forma de evitarlo consiste en alejar el micrófono y el auricular o, lo que es más conveniente aún, conseguir una perfecta adaptación del auricular al conducto auditivo. Sin embargo, el problema reside en que, cuando está coaptado el conducto auditivo externo, no hay fenómeno de retroalimentación, pero se captan más los tonos graves y menos los agudos, que son más necesarios en casi todos los casos; de ahí que algunos enfermos prefieran un molde no demasiado ajustado, aunque de cuando en cuando escuchen silbidos. TIPOS DE AUXILIARES AUDITIVOS ELÉCTRICOS Están disponibles varios tipos de AAE: mesa, bolsillo, audiogafa, retroauricular, endoaural e intrameatal. a) Los AAE de mesa se usan para la reeducación acústica. Tienen gran potencial de salida. b) Los AAE de bolsillo son aparatos de gran rendimiento y económicos en costo y mantenimiento. Se utilizan mucho en niños porque suministran mayor potencia y ofrecen más resistencia a los golpes; también se usan en adultos mayores que no tienen la destreza manual suficiente para colocarlos y graduar el aparato. c) El AAE retroauricular es un aparato muy cómodo y discreto. Cuando se instala el micrófono al frente, se facilita la estereoacusia. En general, tiene menor potencia que los anteriores. d) El usuario de audiogafas está obligado a tenerlas puestas en todo momento. Su uso está limitado a ciertos tipos de enfermos, por ejemplo pacientes con cavidades de mastoidectomía y aquellos que tienen problemas visuales e hipoacusias. e) Tanto los AAE endoaurales como los intrameatales son frágiles y se rompen con facilidad al caer. El micrófono y el auricular se encuentran muy cerca y por consiguiente es más fácil que se presente el fenómeno de retroalimentación. Debido a su bajo rendimiento, se prescriben para cierta clase de hipoacusias poco acentuadas (figura 3-8). 130 Decibeles 120 3 110 100 90 80 Hercios 200 2 1 500 1 000 2 000 5 000 Figura 3–7. Curvas de respuesta a la frecuencia: 1, estrecha (agudos); 2, intermedia (agudos y medios); 3, ancha (graves, medios, agudos). Figura 3–8. Auxiliares auditivos eléctricos endoaurales. ERRNVPHGLFRVRUJ Capítulo 3 Entre 3 y 5% de la población total necesita instrumentos de comunicación. Un auxiliar auditivo eléctrico (AAE) es un aparato que se coloca en el oído y que sirve para aumentar la intensidad del sonido, de tal manera que se compense la deficiencia auditiva del oído hipoacúsico. Un audífono se compone de: 33 33 34 Oído, nariz, garganta y cirugía de cabeza y cuello AUXILIARES AUDITIVOS IMPLANTABLES Capítulo 3 En 1800, Volta intentó por primera vez estimular el oído en forma eléctrica. Vernon Jack investigó el uso de cristales piezoeléctricos. Sin embargo, estudios clínicos han demostrado que los magnetos implantados en el oído medio son capaces de vibrar en perfecta sincronía con las diferentes frecuencias auditivas. Hough (2001) recurrió a la articulación incudoestapedial como el lugar óptimo para implantes de magnetos envueltos en un cilindro de titanio sellado con láser. Dicha combinación ofrece una excelente biocompatibilidad. Estos auxiliares auditivos implantables están compuestos por los siguientes elementos: a) Procesador externo: está disponible en forma retroauricular (en el futuro será de tipo intracanal) y consta de un micrófono, un preamplificador y un amplificador clase D. b) Una porción implantable o interna, compuesta por un magneto (neodinio magnetizado), que mide 1.35 mm de diámetro y 2 mm de longitud y tiene un peso de 20 mg; está envuelto en un cilindro de titanio herméticamente sellado. En consecuencia, estos implantes reciben el sonido, lo amplifican y procesan de acuerdo con las frecuencias emitidas; de esta manera mantienen la integridad de la señal eléctrica y la envían directamente hacia un alambre electromagnético que alcanza el espacio en el oído medio; se estimula así al magneto y éste vibra en perfecta sincronía con la onda de sonido original para transmitir dichas vibraciones al estribo. El procedimiento se puede realizar bajo anestesia local, con un abordaje transmeatal, como el efectuado en una estapedectomía. Se desarticula la articulación incudoestapedial y con una cánula de aspiración no magnética o con pinzas de cocodrilo de plástico se coloca el magneto con su anillo de adhesión sobre la cabeza del estribo. Se sugiere esperar un tiempo de ocho a 10 semanas después de la intervención para iniciar la estimulación auditiva. Los pacientes idóneos para este implante son los que presentan una hipoacusia moderada a grave y sin antecedentes de otitis externa crónica, otitis media o enfermedad retrococlear. ADAPTACIÓN DE AUXILIARES AUDITIVOS ELÉCTRICOS En las sorderas de conducción puras, la diferenciación de fonemas es perfecta, por lo que la utilización de AAE no representa problemas. En las sorderas sensoriales, sobre todo las que tienen gran reclutamiento, hay un índice de inteligibilidad bajo. En las curvas auditivas con caídas bruscas de los tonos agudos también es difícil la adaptación, aunque no haya reclutamiento. Toda persona con umbral mínimo de audición, con menos de 30 dB de pérdida, puede desempeñarse en for- ma normal en su vida pública y privada. Estos casos, por lo general, no requieren AAE. Cuando la pérdida auditiva en ambos oídos sea de 30 a 60 dB, se adapta el AAE en el oído con peor audición. Cuando las curvas son menores de 60 dB en ambos lados, se coloca un AAE en el oído con el que mejor se escucha. Por otro lado, siempre es necesario tomar en cuenta el fenómeno de reclutamiento y adaptar el AAE en el oído que reclute menos, para que haya menor distorsión del sonido. La alta ganancia que ofrecen los aparatos modernos lleva a considerar la vía aérea en toda clase de hipoacusias. Los audífonos por vía ósea ofrecen aproximadamente la mitad de ganancia que los aéreos y se colocan en casos especiales, como otorreas crónicas, agenesias, atresias y conductos eccematosos. En 1960 Harford diseñó el sistema CROS (señal de dirección contralateral) con el objeto de ayudar a pacientes con sorderas graves unilaterales. Este sistema puede usar AAE retroauriculares o audiogafas. El micrófono se colocar en el oído con mayor hipoacusia, con alambres dirigidos hacia el amplificador y receptor que se encuentran en el oído con audición normal o cercana a lo normal. Un tubo de plástico conecta el receptor al molde auricular elaborado de forma previa. Este sistema hace posible que los sonidos amplificados por AAE entren al conducto auditivo, sin afectar la transmisión de sonido en el oído no dañado. El sistema BICROS es similar al CROS y dispone de otro micrófono en el oído con mejor audición. Se usa en sorderas graves, sobre todo de un oído. Este mecanismo permite captar, por el oído menos hipoacúsico, los sonidos que llegan de ambos lados. En general, el sistema CROS reduce el fenómeno de retroalimentación, ya que el macizo craneal separa al micrófono del auricular. SELECCIÓN DE AUXILIARES AUDITIVOS ELÉCTRICOS Antes de indicar la prótesis acústica se debe solicitar una prueba selectiva, con la finalidad de colocar el aparato más conveniente de acuerdo con el caso a tratar. La selección se puede efectuar en cámara audiométrica o en ambiente libre. En apariencia, esta última es la mejor prueba, ya que el sujeto con hipoacusia necesita desenvolverse en un ambiente normal lleno de ruidos y no en el silencio de la cámara sonoamortiguada. Los estudios de Macrae y Farrant (1965) han mostrado que, en niños con hipoacusias sensorineurales que utilizan auxiliares auditivos eléctricos con potenciales de salida mayores de 121 dB, pueden producir un deterioro mayor de la audición; sin embargo, otros autores no han comprobado este hecho. Doyle y Millen (1984) publicaron el caso de un paciente con hipoacusia sensorineural grave, con una diferenciación cercana a 0% a 100 dB, quien fabricó su propio AAE con el empleo de: 1. Un micrófono inalámbrico para FM. 2. Un receptor portátil para FM marca Sony, con un audífono integrado a una diadema. ERRNVPHGLFRVRUJ Auxiliares diagnósticos en otologíaa IMPLANTES COCLEARES En el decenio de 1960, el doctor William House y el ingeniero Jack Urban iniciaron la fabricación de los implantes cocleares. Después de numerosas investigaciones y pruebas con diferentes tipos de sistemas y electrodos, en 1972 se aplicó a un paciente el implante coclear de electrodo único tipo House–Urban. Por lo regular, los implantes cocleares constan de lo siguiente: a) Espiral interna: consiste en una espiral electromagnética y dos electrodos de platino. Los electrodos se utilizan en forma monopolar; el activo se implanta en la escala timpánica y el de tierra a lo largo del orificio de la trompa de Eustaquio. Los electrodos tienen un diámetro de 0.2 mm con punta en forma de bola de 0.5 mm; la longitud es de 78 mm. Esta espiral interna tiene una capa de silicona de unos 0.6 mm. b) Espiral externa: en su parte interna contiene una bobina de alambre de cobre aislada en plástico; en su superficie hay un adaptador, a través del cual hace contacto con la espiral interna. El tamaño aproximado de este aparato es de 19 × 9 mm. c) Micrófono. d) Estimulador externo, que funciona mediante baterías. Tiene dos botones de control: el primero para el volumen y el segundo para el nivel de modulación. El mecanismo de funcionamiento del implante coclear es el siguiente: el micrófono, casi siempre aplicado en el oído externo, capta el estímulo sonoro y lo transmite al estimulador externo; éste procesa la señal y la envía a la espiral externa. Aquí, la señal se induce magnéticamente y atraviesa la barrera de piel para estimular la espiral interna y transmitir información eléctrica del estímulo acústico recibido hacia los electrodos, el activo aplicado en la escala timpánica y el pasivo en la trompa de Eustaquio. De esta manera se estimulan las fibras nerviosas funcionales que se encuentran en la cóclea y se produce así la sensación de ruido. La evolución de los implantes cocleares ha sido sorprendente ya que, si bien al principio se aplicaron implantes de un solo electrodo con un solo canal, le siguieron en el decenio de 1980 implantes con electrodos múltiples y con estimuladores de un solo canal, como el tipo Viena, el desarrollado en Melbourne, Australia (1981). Sin embargo, todavía no alcanzaban el entendimiento de la palabra, motivo por el cual el tercer estadio en su fabricación consistió en la adición de estimuladores de canales múltiples, como el Nucleus 22 y el UCSF– Storz, en los cuales los pacientes alcanzan una mayor diferenciación de la palabra. El cuarto estadio consistió en el uso de procesadores pulsátiles no simultáneos a los sistemas de multicanal con electrodos múltiples, como el Clarion y los sistemas Nucleus C122 y C124M. Por lo tanto, hoy en día los implantes cocleares de múltiples canales ofrecen una mejor funcionalidad tanto en adultos como en niños. En la actualidad, los criterios generales para la selección de pacientes aptos para la colocación de estos implantes son los siguientes: a) Edad de dos años o más. Sin embargo, debido a la adecuada biocompatibilidad de éstos y a la experiencia obtenida en niños, que sugieren que un periodo crítico para el desarrollo fonológico tiene lugar en los primeros 12 meses de la vida, algunos autores como Novak (2000) iniciaron su aplicación a edades tan tempranas como los nueve meses, con resultados alentadores. b) Hipoacusia profunda en ambos oídos. c) Obtención de muy poco o nulo beneficio con el uso de auxiliares auditivos eléctricos o vibrotáctiles. d) Ausencia de contraindicaciones de origen médico. e) Gran motivación con expectativas reales del alcance de dichos implantes. f) Disposición de un adecuado programa educacional y entrenamiento que favorezca el desarrollo de la audición en los niños. DESCRIPCIÓN DE LA TÉCNICA QUIRÚRGICA DEL IMPLANTE COCLEAR a) Anestesia general. b) Incisión retroauricular con elaboración de un colgajo en forma de “J” invertida o “U”, con fresado de un área circular que acoplará la espiral interna sobre la porción escamosa del hueso temporal. c) Mastoidectomía con aticotomía y abertura del receso facial. d) Fresado sobre el techo de la ventana redonda hasta que su membrana sea claramente visible. e) Fijación de la espiral interna. f) Inserción de los electrodos: el de tierra pasa por el ático, por encima del tensor del músculo del martillo, y de ahí hacia el orificio tubario; el electrodo activo se inserta en la ventana redonda. Con el objeto de reducir la posibilidad de dañar la membrana basilar durante su introducción, se recomienda ERRNVPHGLFRVRUJ Capítulo 3 El micrófono inalámbrico contaba con una batería pequeña y dos alambres como antena que transmitían el mensaje a través de ondas de radio. La frecuencia se ajustaba tanto en el micrófono como en la radio y, al igualarlas, la persona con hipoacusia podía adecuar el volumen en la radio de acuerdo a sus necesidades. De esta manera, los individuos se comunicaban con el sordo a través del micrófono, el cual absorbe muy poco ruido del medio ambiente. Este método ofrece muy poca retroalimentación, es muy barato e ilustra la forma en que los AAE, hasta el momento, presentan muchos problemas por resolver, aunque su utilidad es incuestionable. 35 35 36 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 3 seguir sólo la curvatura externa de la escala timpánica; para ello, el cirujano debe imaginar que inserta el electrodo en la dirección de la nariz del paciente (hacia abajo y adelante). El electrodo debe introducirse 10 a 14 mm. Asimismo, se aplica un poco de fascia alrededor del electrodo activo en la ventana redonda con el objeto de sellar. g) Cierre de la herida por planos (figura 3–9). En estos casos se sugiere realizar el implante del electrodo en la luz patente residual de la porción media o apical de la cóclea, para lo cual se efectúa una cocleostomía 2.5 mm anterior a la ventana oval y 1 mm inferior al proceso cocleariforme, con lo que se consigue al menos implantar un total de cuatro electrodos, por lo que es una buena alternativa en casos de osificación de la vuelta basal de la cóclea (figura 3-10). COMPLICACIONES QUIRÚRGICAS PERSONAS CON SORDERA POSLINGUAL La incidencia de complicaciones quirúrgicas del implante coclear varía entre 8.4 y 19.5%. Entre éstas, las más frecuentes son las siguientes: Los individuos con sordera poslingual sometidos a implante coclear han señalado que la sensación de sonido que perciben proviene del interior del oído, a diferencia de la sensación conseguida con AAE, ya que en éstos el sonido se percibe como introducido al oído. Al inicio, todos los sonidos son iguales y pueden referirse como metálicos, en crujido o rasposos. Asimismo, las voces suenan iguales e incluso la propia voz de la persona que porta el implante puede resultar extraña. En este momento adquiere importancia la ayuda de personal de rehabilitación, para la interpretación de los diferentes sonidos, que se traduce con el tiempo en una maduración del proceso de aprendizaje. Algunos pacientes pueden empezar a reconocer diferencias entre las voces de varones y mujeres al segundo o tercer día, y su propia voz se torna más aceptable. Hasta ahora, los implantes cocleares no posibilitan la diferenciación de la palabra, pero sin duda alguna mejoran la comunicación de las personas; por ejemplo, pueden saber que alguien está hablando, si bien sin entender las palabras, aunque en algunos casos esta capacidad de diferenciación se ha observado con algunas palabras, sobre todo monosílabas y algunas bisílabas. 1. Dehiscencia de la herida quirúrgica. 2. Erosión del electrodo sobre la piel del conducto auditivo externo. 3. Falla del implante debido a una hemorragia en la cavidad mastoidea por una vena emisaria. 4. Fibrosis de la escala timpánica. 5. Infección de la herida quirúrgica. 6. Parálisis transitoria del nervio facial. 7. Alteración transitoria del sentido del gusto. 8. Presencia de vértigo o inestabilidad transitorios. 9. Aumento o aparición de acúfeno transitorio. 10. Osificación de la cápsula coclear. 11. Colocación de los electrodos en el conducto carotídeo. La osificación parcial o total de la cóclea se presenta en un 10 % de los implantes cocleares y en un 45% de los pacientes que sobreviven a una meningitis bacteriana. Espiral interna o receptor Espiral externa o transmisor Huesecillos del oído medio Conductos semicirculares Nervio auditivo Cóclea Electrodo activo en cóclea Conducto auditivo externo Membrana timpánica Electrodo de tierra en trompa de Eustaquio Figura 3–9. Implante coclear de electrodo único: a. conducto auditivo externo; b. membrana timpánica; c. electrodo de tierra en la trompa de Eustaquio; d. electrodo activo en la cóclea; e. nervio auditivo; f. cóclea; g. conductos semicirculares; h. huesecillos del oído medio; i. espiral interna; j. espiral externa; k. molde auditivo; l. micrófono. ERRNVPHGLFRVRUJ Auxiliares diagnósticos en otologíaa 37 37 Capítulo 3 Figura 3–10. Fotografía que muestra el electrodo dentro de la cóclea. La mejoría de la lectura labial es obvia con los implantes cocleares. En los estudios de Cohen (1985) aumentó la lectura labial de sus pacientes de 31 palabras por minuto (preimplante) a 66 (posimplante). Algunas situaciones desfavorables en que los implantes cocleares no ofrecen gran ayuda son: ver televisión y seguir una conversación de grupo y ambiente ruidoso. VALORACIÓN DE LOS IMPLANTES COCLEARES Con el objeto de determinar la utilidad de los implantes cocleares se han diseñado varias pruebas, como las siguientes: a) Prueba de Erber y Alencewicz (1976). Consiste en utilizar monosílabas y bisílabas, estas últimas con acento en la primera o segunda sílabas. Se proporciona una lista de cuatro palabras a escoger y un total de 24 preguntas. b) Prueba de sonidos ambientales (Norton, 1977). Se utilizan 30 diferentes sonidos identificados previamente por un grupo de 10 personas con audición normal. El formato consta de cinco opciones por pregunta, con un total de 20 preguntas. Las valoraciones anteriores al implante con AAE, y posteriores al implante coclear, han mostrado superioridad de este último. Por consiguiente, los implantes cocleares son una alternativa prostética adecuada para el sujeto con sordera profunda poslingual. ESTUDIOS EXPERIMENTALES Estudios experimentales y de pacientes que han fallecido tras la aplicación del implante coclear han mostrado una adecuada biocompatibilidad de los electrodos de platino introducidos en la cóclea, sin pruebas de inflamación crónica o reacción de cuerpo extraño y con una mínima formación de tejido conectivo en la escala timpánica. La estimulación eléctrica de la cóclea tiene un efecto mínimo en el sistema vestibular. También se ha observado que al utilizar estímulos eléctricos en el oído aumenta en grado significativo la actividad de la citocromooxidasa, en comparación con oídos no sometidos a estímulos eléctricos. Además, las neuronas auditivas privadas del estímulo por algún tiempo pueden reactivarse y responder a la estimulación. Se requiere un mínimo de 3 500 neuronas intactas para que el implante coclear sea exitoso, por lo que las hipoacusias sensorineurales profundas después de resección de neurinoma del acústico no implican que todo el nervio sea disfuncional o que el paciente no pueda ser elegible para un implante coclear. En casos de daño o pérdida bilateral del nervio coclear, la estimulación directa del núcleo coclear en el tallo cerebral ofrece amplias posibilidades. Los autores han publicado resultados satisfactorios en una paciente sometida a extirpación de neurinomas bilaterales del acústico por vía translaberíntica. Durante la última operación se aplicó un implante en la porción ventral del núcleo coclear, con una buena aceptación de los ERRNVPHGLFRVRUJ 38 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 3 electrodos y una evolución muy similar a la de los pacientes con implantes cocleares. En sujetos con laberintitis osificante o malformaciones del oído interno se puede implantar una prótesis extracoclear de tipo Melbourne de electrodos múltiples, tras practicar orificios sobre la cápsula coclear a través de una timpanotomía posterior y colocar cinco electrodos, con lo que es posible obtener cierta diferenciación auditiva. ELECTRONISTAGMOGRAFÍA Es un método mediante el cual se registran la posición y movimiento del globo ocular y los cambios en el campo eléctrico alrededor del ojo durante su movimiento. El registro permanente que se obtiene en el papel se denomina electronistagmograma. El ojo actúa como dipolo eléctrico; la córnea tiene una carga positiva y la retina negativa. Este potencial corneorretiniano varía de 300 a 1 200 μV, con un valor promedio de 1 mV. Si se colocan dos electrodos sobre la piel cercanos al ojo en el plano de movimiento que se pretende registrar, al girar el ojo en dirección de uno de ellos, la córnea se aproximará a éste, que se torna positivo en relación con el otro electrodo y más negativo al aproximarse a la retina. Esto produce un flujo de corriente eléctrica que amplifica el electronistagmógrafo para suministrar una prueba gráfica del movimiento ocurrido. Los electrodos se aplican a los lados de los ojos para registrar movimientos horizontales y arriba y abajo de ellos para los verticales. Para el registro eléctrico puede utilizarse el sistema DC o de corriente directa, en el cual hay una conexión directa entre el fenómeno por registrar y los diversos pasos del amplificador; o el sistema llamado AC, en el que existe entre dos de los pasos de amplificación una resistencia capacitada. Los amplificadores DC suministran los trazos más usados. PRUEBA DE LOS MOVIMIENTOS SACÁDICOS (SACADAS) OCULARES Es la primera de las pruebas que se realizan y tiene dos propósitos: a) Calibrar el sistema de registro del electronistagmógrafo. b) Valorar la capacidad del paciente en la producción de las sacadas. Técnica Se realiza en un cuarto con iluminación. El paciente se valora en posición sedente y se le indica que no mueva la cabeza. Los movimientos de los ojos se registran cuando el individuo mira hacia dos puntos de fijación o blanco en forma alternada, que se encuentran frente a sí y a una distancia de 2 a 3 m. Es preferible utilizar dos fuentes luminosas como puntos de fijación. Estas luces se colocan de tal manera que los ojos del sujeto realicen un barrido de 20° de ángulo visual en el plano horizontal. Cuando el paciente efectúa esta maniobra, el examinador puede ajustar la ganancia del conducto horizontal del electronistagmógrafo, de tal manera que la pluma del registro se mueva 20 mm cada vez que el paciente vuelve a fijar (figura 3-11). Figura 3–11. Electronistagmografía (realización de pruebas térmicas). ERRNVPHGLFRVRUJ Auxiliares diagnósticos en otologíaa 39 39 Capítulo 3 Figura 3–12. Dismetría hipermétrica de las sacadas relacionada con una lesión cerebelosa. Valoración de las sacadas a) Dismetría de las sacadas: la dismetría puede ser hipermétrica (el ojo se pasa del punto de fijación, al cual regresa con una nueva sacada en dirección opuesta) o hipométrica (el ojo realiza una serie de movimientos pequeños hasta que logra fijar en el nuevo blanco). La dismetría en las sacadas indica lesiones del sistema nervioso central (figuras 3–12 y 3–13). b) Paresia de las sacadas: la velocidad con que se ejecuta la sacada es menor que la normal. El trazo vertical se encuentra inclinado y la transición entre el movimiento horizontal y el vertical se halla redondeada. Es importante señalar que, si se pide a una persona normal realizar sacadas en forma continua por periodos prolongados, se puede producir paresia de las sacadas debido a fatiga. La paresia en las sacadas se observa en diversos trastornos del sistema nervioso central, como lesiones del tallo cerebral o de nervios oculomotores (figura 3–14). PRUEBA DEL RASTREO PENDULAR Estudia el mecanismo de fijación y seguimiento ocular, mediante la persecución de un blanco que tiene movimiento pendular. Figura 3–13. Dismetría en las sacadas secundaria a una oftalmoplejía internuclear por lesión del fascículo longitudinal medio. ERRNVPHGLFRVRUJ 40 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 3 Figura 3–14. Paresia de las sacadas secundaria a lesión del sistema nervioso central. Técnica Anomalías Se realiza en un cuarto con iluminación. Al paciente sentado se le solicita que no mueva la cabeza. Sus movimientos oculares se registran al fijar la mirada sobre una pequeña pelota que oscila con un movimiento armónico simple sobre un fondo liso. La pelota está sostenida del techo por un hilo. La amplitud de la oscilación se aproxima a 30° y su máxima velocidad es de 40°/seg. En otra manera de explorar el rastreo pendular el examinador se coloca frente al paciente y le pide que siga el movimiento oscilatorio de sus dedos; esta prueba le permite observar los ojos del individuo durante el rastreo. Valoración del rastreo pendular En condiciones normales, la curva del rastreo pendular presenta una morfología sinusoidal regular (figura 3–15). a) Rastreo sacádico unilateral o bilateral. En este caso, el desplazamiento gradual y suave del ojo desaparece y, en su lugar, el ojo sigue al estímulo por medio de sacadas de escasa amplitud en dirección del movimiento del blanco. La aparición en una sola rama del sinusoide indica afectación unilateral; si ocurre en las dos ramas es bilateral (figura 3–16). El rastreo sacádico sugiere lesión del sistema nervioso central (SNC). b) Ataxia del rastreo ocular. El sinusoide se pierde y hay movimientos rápidos de amplitud variable, sin un ritmo en particular. Éste es el equivalente ocular de la dismetría. Indica lesión del SNC. c) Ausencia del sinusoide. Ésta puede deberse a la imposibilidad del ojo de seguir el blanco, o bien a que la curva está sustituida por un solo movimiento aislado rápido en una o ambas direcciones. Figura 3–15. Rastreo pendular normal. ERRNVPHGLFRVRUJ Auxiliares diagnósticos en otologíaa 41 41 Capítulo 3 Figura 3–16. Rastreo pendular sacádico bilateral secundario a lesión del sistema nervioso central. d) Curva del sinusoide en el nistagmo congénito de fijación. La curva presenta movimientos de vaivén sobreañadidos sin perder su forma sinusoidal. e) Rastreo con temblor ocular. Se reconoce en la enfermedad de Parkinson. En general, la presencia de rastreos pendulares anormales ocurre en lesiones oculomotoras que afectan el tallo cerebral. Es importante señalar que la sedación con barbitúricos también puede producir registros anormales. b) Un sistema de seguimiento, que localiza blancos en la fóvea. El estudio por separado de estos sistemas puede proporcionar información que ayuda a localizar lesiones en el sistema nervioso central. La dirección del NOC es la de su componente rápido y, en condiciones normales, es opuesta a la del movimiento aparente de las imágenes. Valoración del nistagmo optocinético Se valora en su dirección, ritmo y fatigabilidad. NISTAGMO OPTOCINÉTICO El nistagmo optocinético (NOC) se presenta cuando se observa un objeto con un patrón repetitivo de movimiento, el cual llena la mayor parte del campo visual. El NOC tiene una fase lenta, en la dirección del patrón de movimiento, y una fase rápida (refijación) contraria a la dirección de dicho patrón. Técnica Se recomienda que el cuarto de exploración esté oscuro, con excepción de una pequeña lámpara sobre el electronistagmógrafo. El paciente debe permanecer sentado y se le indica que no mueva la cabeza. A continuación se hace girar frente al paciente, a unos 50 cm de distancia, un tambor con rayas longitudinales blancas y negras. El tambor debe ser lo bastante grande para que pueda cubrir la mayor parte del campo visual. Las dimensiones sugeridas para éste son de 30 a 50 cm de diámetro por 50 a 60 cm de altura. Las rayas deben tener una anchura aproximada de 5 cm. Estas rayas se mueven de modo horizontal a una velocidad lenta (20°/seg) por un periodo de 20 seg en cada dirección. Luego se mueven más rápido (unos 40°/ seg), durante 20 seg en cada dirección. Algunos autores sugieren el estudio del NOC a velocidades aún mayores, como 60, 90 y 120°/seg, con el objeto de detectar de manera más fácil las alteraciones. La fase lenta está generada por dos sistemas de movimiento ocular: a) Sistema optocinético, que sigue blancos u objetivos en la periferia del campo visual. 1. Asimetría del NOC. a) El NOC deprimido hacia un lado puede indicar lesión vestibular periférica aguda o evolutiva del lado de la depresión, siempre que coexista con nistagmo espontáneo hacia el lado opuesto, ya sea con ojos abiertos o cerrados. b) La lesión unilateral de las vías eferentes que producen NOC causa un defecto de éste hacia el lado opuesto de la lesión, si estuviera en el cerebro, y hacia el mismo lado si se encuentra en el tallo cerebral. c) Depresión unilateral y homolateral del NOC. Lesiones del tallo cerebral (figura 3–17). 2. Depresión bilateral del NOC. a) NOC normal a 20°/seg que se deprime en forma bilateral a 40°/seg. Indica lesión del sistema nervioso central. b) La depresión bilateral del NOC señala una lesión de la porción dorsal del tallo cerebral. También puede ser secundaria a lesiones fuera de éste pero que lo incluyen en forma secundaria, como tumores que trastornan las vías oculomotoras o infartos hemorrágicos. c) Intoxicación por barbitúricos, tranquilizantes y anticonvulsivos; también puede ocasionar alteraciones del NOC. 3. Inversión del NOC. En este caso, en lugar de encontrar un NOC hacia la izquierda con imágenes que se propagan hacia la derecha, se observa un componente hacia la derecha, es decir, en sentido inverso a lo normal. Esta inversión del NOC se reconoce sólo en ciertos indi- ERRNVPHGLFRVRUJ 42 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 3 Figura 3–17. Asimetría del nistagmo optocinético; depresión unilateral del nistagmo hacia el lado izquierdo. viduos que sufren nistagmo congénito. Según Yee (1980), estos pacientes no pueden seguir en forma adecuada las rayas del tambor y, en su lugar, tratan de seguirlas mediante sacadas. En este caso, la fase lenta del NOC corresponde a la fase lenta del nistagmo congénito preexistente. 4. Micrografía del NOC. La amplitud del nistagmo es muy pequeña (menos de 5°) y la frecuencia es alta (más de tres por segundo). Se relaciona con insuficiencia vertebrobasilar. 5. Alteraciones del NOC en sujetos con marcapasos. Según Wilson (1980), se pueden identificar deflexiones superiores generadas por el marcapasos a intervalos regulares entre las sacadas nistágmicas NISTAGMO ESPONTÁNEO El nistagmo consiste en un movimiento ocular sincrónico, compuesto de dos fases: a) La fase lenta en la que los ojos se desplazan en forma progresiva. b) Fase rápida, en la cual hay un movimiento brusco instantáneo de retorno de los ojos al punto en donde se inició la fase lenta. La dirección del nistagmo se denomina como la de su componente rápido; es decir, si los ojos se desvían lentamente a la derecha y regresan al punto de partida en forma rápida hacia la izquierda, se trata de un nistagmo hacia la izquierda. Técnica La valoración del nistagmo espontáneo se puede realizar al solicitarle al enfermo que mire fijamente un dedo colocado en distintas posiciones (derecha–izquierda, arriba–abajo), a una distancia aproximada de 1 m, y manteniendo la fijación por un lapso de 20 seg. Es preciso tener cuidado de no producir el nistagmo de posición extrema, que se presenta en algunos individuos al llevar los ojos a una posición de 40° o mayor. Por lo tanto, se recomienda llevar los ojos a una posición aproximada de 30° a la derecha, izquierda, arriba y abajo. Clasificación del nistagmo espontáneo 1. Nistagmo vestibular. Ocurre como resultado de una lesión laberíntica, del tronco del nervio o de los núcleos vestibulares. Aumenta de intensidad en condiciones en que se impide la fijación visual. Por lo tanto, la fijación visual reduce la intensidad y puede abolirlo ERRNVPHGLFRVRUJ Auxiliares diagnósticos en otologíaa Nistagmo vestibular Grado I Grado II Grado III Figura 3–18. Grados del nistagmo vestibular. 20 seg. Todo el ciclo puede tener una periodicidad de 2 a 12 min. La causa central es la más probable. Algunos trastornos relacionados con este nistagmo son traumatismo cerebral, insuficiencia vertebrobasilar, encefalitis, sífilis, deformidad de Arnold-Chiari y ataxia de Friedreich. Los barbitúricos pueden bloquear este nistagmo. 3. Nistagmo de reojo. Aparece en lesiones cerebelosas y del tallo cerebral. Es de dirección cambiante. No se observa en posición de reposo, pero cuando el sujeto dirige la mirada fuera de la posición primaria, en cualquier dirección aparece el nistagmo. Al impedir la fijación visual, el ojo tiende a regresar a la posición de reposo y el nistagmo desaparece. 4. Nistagmo de rebote. Al sostener la mirada lateral por algún tiempo y regresar la mirada al frente, aparece nistagmo en dirección opuesta al que aparecía en la mirada lateral. Es de corta duración y desaparece de modo espontáneo. Se reconoce en lesiones cerebelosas. 5. Nistagmo de paresia. Se vincula con lesiones que producen defectos en la motilidad ocular. Puede aparecer en personas normales cuando giran los ojos hacia el extremo, sobre todo si lo hacen de manera prolongada. Disminuye con la fatiga y aumenta con la tensión. Constituye el nistagmo que se describe con el nombre de fisiológico. Aparece también en la fase de recuperación de las paresias conjugadas, bien sea por lesión cerebral o del tallo. Este nistagmo es de tipo fásico y se forma por una desviación lenta hacia la posición primaria, seguida de un movimiento de corrección rápida hacia el punto de fijación. 6. Nistagmo de convergencia. Se reconoce por una separación lenta y periódica de los ojos, interrumpida por un movimiento rápido de convergencia. Ocurre en lesiones mesencefálicas. 7. Nistagmo de fijación. Se caracteriza por un aumento de intensidad al tratar de fijar la vista, y bajo tensión emocional; puede disminuir con los ojos cerrados, durante el sueño o en la oscuridad. Cuando la visión central se pierde en ambos ojos antes de la edad de dos años, siempre se desarrolla nistagmo. Al parecer, la causa del nistagmo de fijación es un defecto de la inervación tónica normal que la retina ejerce sobre los músculos extraoculares. El nistagmo de fijación aparece como síntoma aislado en el llamado nistagmo congénito o bien acompaña a otros trastornos como aniridia, albinismo, degeneración pigmentaria de la retina y monocromatismo. 8. Nistagmo latente. Es de tipo fásico y aparece sólo cuando se cubre el ojo. Es una forma de nistagmo congénito de fijación y a menudo se vincula con el estrabismo concomitante hereditario. NISTAGMO POSTURAL Se dispone de dos técnicas para su estudio: la primera a través de movimientos lentos de la cabeza en diferen- ERRNVPHGLFRVRUJ Capítulo 3 de manera momentánea. La intensidad de este nistagmo disminuye durante la fatiga. Dicho nistagmo aparece, las más de las veces, al lado opuesto de la lesión, y disminuye en forma gradual con el tiempo, hasta desaparecer debido a la compensación de los núcleos vestibulares centrales del piso del cuarto ventrículo. Este nistagmo se clasifica en tres grados (figura 3–18): t Grado I. El nistagmo aparece cuando el paciente desvía la mirada hacia el lado del componente rápido (a la derecha o la izquierda). t Grado II. Se presenta con la mirada desviada hacia el lado del componente rápido y en la posición de reposo (a la derecha o la izquierda, y también en la posición central). t Grado III. Aparece en todas las posiciones de los ojos; aumenta de intensidad al mirar al lado del componente rápido y decrece al mirar hacia el lado del componente lento (ley de Alexander). El nistagmo vestibular por lesión central puede ser vertical, horizontal o giratorio, y originarse por lesiones entre los núcleos vestibulares y el tálamo. Este nistagmo no se compensa y persiste si la lesión que lo ocasionó es irreversible. El nistagmo vertical y el giratorio puro reflejan lesión central, como lesiones bulbares bajas o mesencefálicas. 2. Nistagmo periódico alternante. Es una forma poco común de nistagmo giratorio horizontal, en el que periodos de descargas nistágmicas hacia la derecha alternan con periodos iguales hacia la izquierda, con un tiempo de inactividad característico entre éstos de 5 a 43 43 44 Oído, nariz, garganta y cirugía de cabeza y cuello tes posiciones para detectar la presencia de nistagmo posicional; la segunda mediante la maniobra de Hallpike, diseñada de manera específica para producir nistagmo en personas con sospecha de vértigo postural paroxístico benigno. Capítulo 3 Técnica I Se recomienda realizarla en un cuarto oscuro, con una pequeña lámpara sobre el electronistagmógrafo. Los movimientos oculares del paciente se registran por un periodo de 20 seg con los ojos abiertos y otros 20 con los ojos cerrados, con la cabeza en posiciones central, hacia la derecha y la izquierda y el individuo en las posiciones sedente y supina. Se le indica que mueva la cabeza lentamente de una posición a otra. Cuando los ojos están cerrados, se le pide que realice algunos cálculos aritméticos simples. Si durante la prueba aparece nistagmo, o se altera el preexistente con la cabeza en cualquier posición, el sujeto se valora otra vez, pero ahora moviendo todo el cuerpo y no sólo la cabeza como en la prueba inicial; esto se realiza para determinar si el giro del cuello fue la causa de la aparición del nistagmo. Técnica II (maniobra de Hallpike, 1952) El paciente se encuentra sentado, cerca de la cabecera de la mesa de exploración. El examinador toma la cabeza del individuo y la gira hacia un lado (unos 45°) y atrás; en esta posición se lo recuesta súbitamente, de tal manera que la cabeza quede fuera del sofá, hiperextendida y volteada con un oído hacia abajo. Este movimiento está ideado para producir un estímulo máximo en el plano del conducto semicircular posterior. Una vez realizado este movimiento, el examinador le solicita a la persona que fije la vista en su dedo índice, para observar así los movimientos oculares por un lapso de 20 seg. A continuación se levanta al enfermo, se voltea hacia el otro lado y se repite la maniobra. En caso de presentarse nistagmo, se estudian la presencia de latencia, dirección y duración, una posible relación con vértigo, náusea y vómito, y si es o no agotable (figura 3-19). 1. Nistagmo postural periférico. Tiene una latencia breve y transitoria, de dirección horizontal, con componente giratorio hacia el oído que queda abajo. Se acompaña de vómito. En la mayoría de los pacientes con vértigo postural paroxístico benigno, sólo un oído se afecta, por lo que el nistagmo aparece al producir la maniobra de Hallpike cuando el oído dañado se encuentra hacia abajo. En casos bilaterales aparece en los dos lados. Existen tres características importantes del nistagmo postural periférico: a) Un intervalo de algunos segundos entre la posición en que se coloca la cabeza y el inicio del nistagmo. b) El nistagmo alcanza con rapidez su máxima intensidad, luego se sostiene e inicia su atenuación hasta desaparecer durante los siguientes 10 a 15 seg, mientras la cabeza se mantiene en esa posición. c) El nistagmo se torna menos intenso de manera progresiva al repetir la maniobra de Hallpike (agotable). 2. Nistagmo postural central. Es de larga duración, cambia de dirección con las distintas posiciones de la cabeza, no tiene latencia, y no se relaciona con vértigo. Su presencia se considera un síntoma de lesión del sistema vestibulocerebeloso. Valoración del nistagmo postural (posicional) Según Barber y Stockwell (1980), muchos individuos normales pueden presentar nistagmo en la prueba postural con los ojos cerrados; en consecuencia, se considera patológico este tipo de nistagmo en los siguientes casos: 1. Cambio de dirección con cualquier posición de la cabeza. 2. Persistencia cuando menos en tres posiciones de la cabeza. 3. Intermitencia en todas las posiciones de la cabeza. 4. Fase lenta mayor de 6°/seg, en cualquier posición: a) Pacientes con nistagmo posicional de dirección cambiante (tipo geotrópico); aparece a la derecha cuando el oído derecho está hacia abajo, y a la izquierda cuando el oído izquierdo está hacia abajo; falta en posición sedente y supina (central). Se presenta en lesiones centrales y periféricas del sistema vestibular. También puede observarse en la intoxicación etílica. b) Nistagmo de dirección cambiante en una sola posición de la cabeza: indica lesión del sistema nervioso central. Debe distinguirse del que cambia de dirección en distintas posiciones de la cabeza, ya que este último puede deberse a lesiones centrales y periféricas. PRUEBAS TÉRMICAS Los conductos semicirculares son receptores giratorios que se activan por aceleraciones angulares, que pueden estimularse con procedimientos mecánicos, térmicos y con corrientes galvánicas. En general, la irrigación del conducto auditivo externo con agua fría produce una corriente descendente (ampulífuga) y el nistagmo aparece en dirección opuesta al oído estimulado. La irrigación con agua caliente origina una corriente ascendente (ampulípeta) y provoca nistagmo en dirección del oído estimulado. Técnica Se recomienda realizar esta prueba en un cuarto clínico oscuro, a excepción de una lámpara sobre el electronistagmógrafo. Se coloca el paciente en posición supina y con la cabeza en flexión ventral (unos 30°), con el objeto ERRNVPHGLFRVRUJ Auxiliares diagnósticos en otologíaa 45 45 Capítulo 3 Figura 3–19. Maniobra de Hallpike (1952). de llevar los conductos semicirculares horizontales a un plano vertical. Cada oído se irriga dos veces: primero con agua fría (30 °C) y luego con agua caliente (44 °C). El tiempo de irrigación sugerido es de 40 seg. Esta prueba también se puede realizar con aire a 50° y 24°, aplicado por un lapso de 60 seg y a un flujo de 8 L/min. Se dejan transcurrir ocho a 10 min entre las irrigaciones. Los movi- mientos oculares del paciente se registran desde el inicio de cada irrigación hasta la última sacada de la respuesta nistágmica. El nistagmo se registra con la mirada del paciente hacia el frente, con los ojos cerrados y fijando un punto en el techo del cuarto clínico con los ojos abiertos. Antes se investigaba este fenómeno mediante observación directa, pero el electronistagmógrafo posibilita una ERRNVPHGLFRVRUJ 46 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 3 valoración más exacta con un análisis cuantitativo adecuado. Por último, se le pide al individuo que efectúe cálculos aritméticos simples durante el tiempo en que se registre el nistagmo. Prueba monotérmica de Torok: consiste en cuatro estimulaciones, dos en cada oído, y uso de agua a 20 °C. En la primera prueba, llamada débil, se irrigan con 10 mL de agua durante 5 seg. Se coloca al sujeto en la misma posición empleada con las pruebas térmicas convencionales. La segunda prueba se efectúa con 100 mL de agua a 20 °C, por un periodo de 20 seg y con la cabeza del individuo extendida a un ángulo de 60°. Durante cada estimulación, el nistagmo se valora al contar el número de sacadas en un periodo de 5 seg. El objetivo es identificar un área de máxima actividad nistágmica durante dos periodos consecutivos de 5 seg. Este resultado representa la sensibilidad del conducto semicircular horizontal y se conoce como frecuencia de culminación. Los valores normales de esta frecuencia para estímulos débiles (10 mL de agua) son de 3 a 29 y para estímulos más intensos (prueba con 100 mL) de 10 a 39. El radio que se obtiene al dividir la frecuencia de culminación del estímulo fuerte entre la del débil es, en condiciones normales, de 1.2 a 3.5. Cuando la respuesta del estímulo más intenso es desproporcionadamente mayor que la del débil se emplea el término recruitment vestibular y, si el estímulo más intenso muestra valores similares al débil o con radio menor de 1.1, se usa el de decruitment vestibular. Este último suele observarse en lesiones de la fosa posterior. Prueba de enmascaramiento vestibular: esta prueba consiste en irrigar con agua a 20 °C ambos oídos en forma simultánea, con un mínimo de 20 mL durante un periodo de 20 seg. Cuando los pacientes refieren una mejoría marcada de su vértigo, así como de la prueba de Romberg y de su capacidad para caminar, situación que dura 1 a 2 min, se trata de una enfermedad periférica. En anomalías centrales, dicha prueba produce un aumento o agravación del desequilibrio. Evaluación de resultados Tiempo de duración de la respuesta nistágmica. La duración del nistagmo se cuantifica desde el momento de iniciar el estímulo hasta su desaparición total. Hallpike (1965) consideró el parámetro “duración” como el más útil desde el punto de vista clínico. En la figura 3–20 se muestra el método para graficar la duración del nistagmo. Las respuestas se numeran del uno al cuatro; la uno y la cuatro corresponden al nistagmo con componente rápido a la derecha (estímulos con 30° en oído izquierdo y 44° en oído derecho); las respuestas dos y tres corresponden al nistagmo izquierdo (estímulo con 30° en oído derecho y 44° en oído izquierdo). La sensibilidad total se determina al sumar los tiempos de las cuatro respuestas. Para el estudio de la paresia canalicular se utiliza la fórmula (1 + 3) – (2 + 4) y la preponderancia direccional con la fórmula (1 + 4) – (2 + 3). También pueden presentarse lesiones mixtas, en las cuales hay una paresia relacionada con una preponderancia direccional. Registro de la velocidad máxima del componente lento del nistagmo (VMCL). El estudio de la VMCL se correlaciona mejor con la intensidad del estímulo y se ha advertido que, en personas con hipoacusia sensorineural unilateral, la VMCL puede demostrar afectación vestibular más a menudo en comparación con el estudio de la duración de la respuesta calórica. La mayoría de los autores no registra toda la intensidad de la respuesta calórica, sino tan sólo segmentos de 10 seg en que la respuesta nistágmica es mayor, a lo cual se denomina clímax de la respuesta calórica. En consecuencia, se demuestran ejemplos de segmentos usados para el cómputo de esta respuesta (figura 3–21). Hay discrepancia entre los especialistas acerca de la mejor manera de calcular el clímax de la respuesta calórica; el autor concuerda con Stockwell (1984), quien asegura que es suficiente calcular la velocidad de la fase lenta de las tres sacadas nistágmicas más fuertes y que es el producto medio de éstas lo que representa al clímax de la respuesta calórica. D I D I Figura 3–20. Método para graficar la duración del nistagmo térmico. ERRNVPHGLFRVRUJ Auxiliares diagnósticos en otologíaa La paresia vestibular se registra mediante el uso de la siguiente fórmula: (OD C + OD F) – (OI F + OI C) × 100 (OD C + OD F) + (OI F + OI C) 47 47 En donde: OD = oído derecho OI = oído izquierdo C = estímulo con agua caliente F = estímulo con agua fría (véanse los resultados del ejemplo anterior). El análisis de los resultados obtenidos en la gráfica se muestra en la figura 3–17; son un ejemplo de este cálculo: Ojos cerrados: 19 + 18 + 18 = 18°/seg 3 Ojos abiertos: 5 + 4 + 6 = 5°/seg 3 El índice de fijación será: ojos abiertos 5 = 0.28 ojos cerrados 18 A partir de estos resultados, y con base en la fórmula anotada en el texto, se estudian la presencia de paresia, preponderancia direccional o respuestas calóricas normales. Valores negativos indican paresia unilateral derecha y valores positivos una paresia izquierda. Paresias unilaterales con valores mayores de 15 a 25% son patológicas. La paresia vestibular se considera una lesión que afecta al laberinto o nervio vestibular en el sitio ipsolateral a la paresia. La preponderancia direccional se registra mediante el uso de la siguiente fórmula: (OD C + OI F) – (OD F + OI C) × 100 (OD C + OI F) + (OD F + OI C) Los valores positivos indican preponderancia direccional hacia la derecha y los negativos hacia la izquierda. A B C D Figura 3–21. Método para graficar la duración del nistagmo térmico. ERRNVPHGLFRVRUJ Capítulo 3 Clímax de la respuesta calórica 48 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 3 A B Ojos cerrados: 19 + 18 + 18 = 18°/seg 3 Ojos abiertos: 5 + 4 + 6 = 5°/seg 3 El índice de fijación será: ojos abiertos 5 = 0.28 ojos cerrados 18 Figura 3–22. Índice de fijación: A. Ojos cerrados; B. Ojos abiertos. Con los valores obtenidos en este ejemplo se encuentra lo siguiente: Preponderancias mayores de 20 a 30% se consideran patológicas. La preponderancia direccional del nistagmo térmico puede aparecer en lesiones a cualquier nivel de las vías vestibulooculomotoras. La preponderancia direccional pura puede encontrarse en lesiones utriculares. Algunas lesiones cerebrales pueden producir preponderancia direccional ipsolateral a la lesión. Índice de fijación (IF). Valora la capacidad del sujeto de anular el nistagmo calórico mediante la fijación visual de un objeto. En esta prueba se compara la velocidad de la fase lenta del nistagmo con los ojos abiertos y cerrados. Hay que determinar la media de la fase lenta del nistagmo durante la fijación que se obtiene de sumar tres sacadas nistágmicas representativas y dividir el resultado entre tres. Lo mismo se realiza con sacadas nistágmicas que se presenten antes de abrir los ojos (ojos cerrados). El valor de los resultados se registra en grados/segundo. Para obtener el IF, el valor conseguido con los ojos abiertos se divide entre el obtenido con los ojos cerrados (figura 3–22). IF de 0.60 o mayor es patológico. La falla en la disminución del nistagmo calórico durante la fijación visual es un signo patológico que indica lesión del sistema nervioso central. Dos causas benignas pueden también causar esta anomalía: 1. Sedación por barbitúricos 2. Uso de lentes de contacto PRUEBAS GIRATORIAS Barany (1907) introdujo la importancia de las pruebas vestibulares giratorias. En estas pruebas, el sujeto se encuentra sentado con la cabeza fija sobre el eje vertical de giro e inclinada 10° hacia delante, para tener los conductos semicirculares horizontales en un plano horizontal. A continuación se impulsa la silla giratoria, que actúa como una barra de torsión. Los movimientos de vaivén giratorio hacia uno y otro lados que se producen en la silla originan aceleraciones y velocidades cuya magnitud se comporta de manera sinusoidal. Técnica La prueba se efectúa en la oscuridad. Los ojos deben estar abiertos y cubiertos por lentes opacos que no toquen las pestañas. Se coloca al sujeto sobre la silla giratoria, la cual se desplaza a 180° de su posición de equilibrio, con movimientos dextrógiros y levógiros progresivamente amortiguados. Se estudian 15 periodos de 20 seg cada uno; es decir, un total de 5 min, registrando la curva del movimiento y el nistagmo pregiratorio reactivo. Valoración de las respuestas En general, se recomienda que estas pruebas se valoren en conjunto con las pruebas térmicas. Tipos de alteraciones encontradas: a) La ausencia de nistagmo giratorio (arreflexia) o la atenuación (hiporreflexia) sugieren una alteración vestibular periférica. En ocasiones, la anomalía central que interfiere con el arco reflejo vestibuloocular también puede ocasionar una disminución de este nistagmo. b) Se observa preponderancia direccional del nistagmo cuando el nistagmo hacia un lado es más amplio, más frecuente o con velocidad angular mayor que hacia el otro. Refleja afectación vestibular periférica y central. Es indudable que las pruebas giratorias contribuyen también a la valoración del pronóstico de lesiones vestibulares; por ejemplo: 1. Si en las pruebas térmicas se identifica un laberinto con paresia vestibular y las pruebas giratorias son normales, es probable que la lesión que ocasionó la paresia esté compensada. ERRNVPHGLFRVRUJ Auxiliares diagnósticos en otologíaa Pruebas rotatorias adicionales a) En ellas, el sujeto gira con los ojos abiertos en un cuarto inmóvil iluminado. Aparece así la sensación de que el ambiente gira en dirección opuesta al propio paciente y se establece un nistagmo optocinético en la misma dirección del giro. A este estímulo se lo denomina optovestibular. b) El individuo gira y fija la vista en una imagen que gira junto con él. Esto puede ocurrir cuando el estímulo se efectúa en un cuarto giratorio o al colocar una cortina que bloquee la mayor parte del campo visual frente a la persona. Al haber un movimiento aparente de la imagen en sentido opuesto al giro, se activa el mecanismo de rastreo y aparece nistagmo optocinético en dirección opuesta a la del nistagmo vestibular; se conoce como estímulo vestibular con fijación retiniana ambiental. Estas pruebas pueden cuantificar déficits funcionales de los reflejos compensatorios oculomotores, así como los mecanismos que los inhiben. BIBLIOGRAFÍA Abel SM, Barber HO: Measurement of optokinetic nystagmus for otoneurological diagnosis. Ann Otol Rhinol Laryngol 1981;90(Sup. 79). Aidan D, Avon P: Auditory screening in neonates by means of transient evoked otoacoustic emissions. A report of 2,842 recordings. Ann Otol Rhinol Laryngol 1999;108:525–531. Alpert JN: Failure of fixation suppression: a pathologic effect of vision on caloric nystagmus. Neurology 1974;24:891–896. Babin R: Periodic alternating nystagmus. Ann Otol Rhinol Laryngol 1981;90:524–525. Baldwin RL, Birmingham AL, Formby C: Changes in caloric nystagmus induced by nasodilating drugs. Laryngoscope 1986;96:420–429. Baloh RW, Solingen L, Sills AW et al.: Caloric testing: effect of different conditions of ocular fixation. Ann Otol Rhinol Laryngol 1977;86(Sup. 43):1–16. Baloh RW, Sills AW, Honrubia V: Caloric testing: patients with peripheral and central vestibular lesions. Ann Otol Rhinol Laryngol 1977;86(Sup. 43):24–30. Baloh RW, Yee RD, Honrubia V: Optokinetic nystagmus and parietal lobe lesions. Ann Otol Rhinol Laryngol 1980;90:269– 276. Barany R: Physiologie and pathologie des Bogengangsapparates. Vienna: Deuticke, 1907. Barber HO, Stockwell CW: Manual of electronystagmography. 2nd ed. St. Louis, Mo: C.V. Mosby, 1980. Bauch CD, Olsen WO, Harner SG: Auditory brain–stem response and acoustic reflex test. Ar Otolaryngol 1983;109:522– 525. Bergström B: Morphology of the vestibular nerve. II. The number of myelinated vestibular nerve fibers in man at various ages. Acta Otolaryngol (Stockh) 1973;76:173–179. Bhonsali S, Stockwell C, Bojiab D, Schwan S: Evaluation of the monothermal caloric test. Laryngoscope 1989;99:500– 504. Bleeker JD, Wit HP: Cochlear implant versus vestibular stimulation. Communication. Ann Otol Rhinol Laryngol 1984;93:192–193. Bluestone CH, Cantekin E: Current clinical methods, indications and interpretation of Eustachian tube function tests. Ann Otol Rhinol Laryngol 1981;90:552–562. Bobbin RP, May JG, Lemoine RL: Effects of pentobarbital and ketamine on brain stem auditory potentials. Ar Otolaryngol 1979;105:467–470. Browning G, Gatehouse S: Estimation of the benefit of bone-anchored hearing aids. Ann Otol Rhinol Laryngol 1994;103:872–878. Brunner H: Uber die inversion des experimentellen optischen nystagmus. Monatchr F Ohrenheilk 1921;55:574. Byrne D: Hearing aid selection. An analysis and point of view. Ar Otolaryngol 1979;105:519–525. Chisin R, Perlman M, Sohmer H: Cochlear and brain stem responses in hearing loss following neonatal hyperbilirubinemia. Ann Otol Rhinol Laryngol 1979;88:352–357. Clark G, Cowan R: International cochlear implant, speech and hearing symposium. Ann Otol Rhinol Laryngol 1995;104(166):1–468. Clark GM, Tong YC, Martin LF et al.: A multiple–channel cochlear implant: and evaluation using nonsense syllables. Ann Otol Rhinol Laryngol 1981;90:227–230. Clark GM, Tong YC: A multiple–channel cochlear implant. Ar Otolaryngol 1982;108:214–217. Clark GM, Pyman BC, Webb RL et al.: Surgery for an improved multiple–channel cochlear implant. Ann Otol Rhinol Laryngol 1984;93:204–207. Clopton BM, Bosma MM: Effectiveness of middle ear electrical stimulation for activating central auditory pathways. Ann Otol Rhinol Laryngol 1982;91:285–291. Cogan DG: Neurology of the ocular muscles. In: Charles C. Thomas (ed.). Springfield, Mass. 1956. Cohen N, Hoffman R: Complications of cochlear implant surgery in adults and children. Ann Otol Rhinol Laryngol 1991;100:708–711. Cohen N, Waltzman S, Shapiro W: Clinical trials with a 22–channel cochlear prosthesis. Laryngoscope 1985;95:1448–1454. Dobie RA, Berlin CI: Binaural interaction in brainstem–evoked responses. Ar Otolaryngol 1979;105:391–398. Dobie RA, Kimm J: Brainstem responses to electrical stimulation of the cochlea. Ar Otolaryngol 1980;106:573–577. Doslak MJ, Dell’Osso LF, Daroff RB: Alexander’s law: a model and resulting study. Ann Otol Rhinol Laryngol 1982;91:316–322. ERRNVPHGLFRVRUJ Capítulo 3 2. Cuanto mayor sea la amplitud de la preponderancia del nistagmo en las pruebas giratorias, más reciente será la lesión que causó la paresia vestibular. 3. En las lesiones del sistema nervioso central, la asimetría de las respuestas vestibulares no es reversible y se mantiene de forma indefinida. 49 49 50 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 3 Don M, Eggermont JJ, Brackmann DE: Reconstruction of the audiogram using brain stem responses and high–pass noise making. Ann Otol Rhinol Laryngol 1979:88(Sup. 57). Dowell RC, Martin LF, Clarck GM, Brown AM: Results of a preliminary clinical trial on a multiple–channel cochlear prosthesis. Ann Otol Rhinol Laryngol 1985;94:244–250. Duckert L, MIller J: Acute morphological changes in Guinea pig cochlea following electrical stimulation. Ann Otol Rhinol Laryngol 1982;91:33–40. Elidan J, Sohmer H, Lev S, Gay I: Short latency vestibular evoked response to acceleration stimuli recorded by skin electrodes. Ann Otol Rhinol Laryngol 1984;93:257–261. Erber N, Alencewicz C: Audiologic evaluation of deaf children. J Speech Hear Dis 1976;41:256–267. Facer GW, Rose DE, McDonald TJ et al.: Individual data from the 3M/Vienna extracochlear implant. Laryngoscope 1986;96:1053–1057. Fayad J, Tabaee A, Micheletto J, Parigier S: Cochlear implantation in children with otitis media. Laryngoscope 2003;113:1224-1227. Ferraro J, Arenberg K, Stephenson HR: Electrocochleography and symptoms of inner–ear dysfunction. Ar Otolaryngol 1985;111:71–74. Fiellau–Nikolajsen M, Lous J: Prospective tympanometry in 3–year–old children. Ar Otolaryngol 1979;105:461–466. Fourcin A, Douek E, Moore B et al.: Speech pattern element stimulation in electrical hearing. Ar Otolaryngol 1984;110:145–153. Franz B, Kuzma J, Lehnharat E et al.: Implantation of the Melbourne cochlear multiple electrode extracochlear prosthesis. Ann Otol Rhinol Laryngol 1989;98:591–596. Fria TJ, Cantekin EI, Probst G: Validation of an automatic otoadmittance middle ear analyzer. Ann Otol Rhinol Laryngol 1980;89:253–256. Frye–Oster HA, Goldstein R, Hirsch JE, Weber LPN: Earlyand middle–AER components to clicks as response indices for neonatal hearing screening. Ann Otol Rhinol Laryngol 1982;91:272–276. Fujikawa S, Owens E: Hearing aid evaluation for persons with postlingual hearing levels of 90 to 100 dB. Ar Otolaryngol 1979;105:662–665. Gants B, Tyler R, McCabe BF et al.: IOwa cochlear implant clinical project. Results with 2 single–channel cochlear implants and one multichannel cochlear implant. Laryngoscope 1985;95:443–449. Gastman BR, Hirsch BE, Sando I, Fukui B, Wargo ML: The potential risk of carotid injury in cochlear implant surgery. Laryngoscope 2002;112:262-266. Gelfand SA: Usage of CROS hearing aids by unilaterally deaf patients. Ar Otolaryngol 1979;105:328–332. Goding G, Dobie RA: Gaze nystagmus and blood alcohol. Laryngoscope 1986;96:713–717. Goebel JA, Stroud MH, Levine LA, Muntz HR: Vertical eye deviation and nystagmus inhibition during mental tasking. Laryngoscope 1983;93:1127–1132. Gumprecht TF, Doyle CS, Millet DR, Caldwell HH: A new hearing assistance device. Laryngoscope 1984;94:706. Hall JW III, Mackey–Hargadine JR, Kim EE: Auditory brain–stem response in determination of brain death. Ar Otolaryngol 1985;111:613–620. Hambrecht FT: Current status of multichannel cochlear prostheses. Ann Otol Rhinol Laryngol 1979;88:729–733. Harder H, Kylén P, Arlinger SD, Ekvall L: Preoperative bone conducted electrocochleography in otosclerosis. Ar Otolaryngol 1980;106:757–762. Harford ER: A new clinical technique for verification of hearing aid response. Ar Otolaryngol 1981;107:461–468. Hart CW: Ocular fixation index. Ann Otol Rhinol Laryngol 1973;82:848–851. Hart CW: The optokinetic test and the ENG test. Ann Otol Rhinol Laryngol 1981:90(Sup. 86). Hayes D, Jerger J: The effect of degree of hearing loss on diagnostic test strategy. Ar Otolaryngol 1980;106:266–268. Hoffman R, Cohen N: Surgical pitfalls in cochlear implantation. Laryngoscope 1993;103:741–744. Honjo I, Kumazawa T, Honda K: Simple impedance test for Eustachian tube function. Ar Otolaryngol 1981;107:221– 223. Hough JVD, Dyer K, Matthews P, Wood M: Early clinical results: Soundtec implantable hearing device, Phase II study. Laryngoscope 2001;111:1–8. House WF, Brackmann DE: Brainstem audiometry in neurotologic diagnosis. Ar Otolaryngol 1979;105:305–309. House WF, Berliner KI: Cochlear implants: progress and perspectives. Ann Otol Rhinol Laryngol 1982:91(Sup. 91). House WF, Berliner KI, Eisenberg L: Experiences with the cochlear implant in preschool children. Ann Otol Rhinol Laryngol 1983;92:587–592. Hulka GF, Bernard EJ, Pillsbury HC: Cochlear implantation in a patient after removal of an acoustic neuroma. The implications of magnetic resonance imaging with gadolinium on patient management.Arch Otolaryngol Head Neck Surg 1995;121:465–468 Ibrahim RAA, Linthicum FH: Labyrinthine ossificans and cochlear implants. Ar Otolaryngol 1980;106:111–113. Jacobson G, Means E: Efficacy of a monothermal warm water caloric screening test. Ann Otol Rhinol Laryngol 1985;94:377–381. Javel E, Mouney DF, McGee J, Walsh EJ: Auditory brainstem responses during systemic infusion of lidocaine. Ar Otolaryngol 1982;108:71–76. Jewett DL, Williston JSq: Auditory–evoked far fields averaged from the scalp of humans. Brain 1971;94:681–696. Kaga K, Tanaka Y: Auditory brainstem response and behavioral audiometry. Ar Otolaryngol 1980;106:564–566. Kaga K, Shindo M, Tanata Y: Auditory brain stem responses and nonsense monosyllable perception test, findings in patients with auditory nerve and brain stem lesions. Laryngoscope 1986;96:1272–1278. Karlsen EA, Goetzinger CP, Hassanein R: Effects of six conditions of ocular fixation on caloric nystagmus. Ar Otolaryngol 1980;106:474–476. Kavanagh KT, Beardsley JV: Brain stem auditory evoked response. I. Basic principles and clinical applications in the assessment of patients with nonorganic hearing loss. Ann Otol Rhinol Laryngol 1979;88(Sup. 58):1–10. Kavanagh KT, Beardsley JV: Brain stem auditory evoked response. II. Clinical application in the assessment of patients with organic hearing loss. Ann Otol Rhinol Laryngol 1979;88(Sup. 58):11–21. ERRNVPHGLFRVRUJ Auxiliares diagnósticos en otologíaa McGee TM, Kartush J, Heide J, Bajroh D: Electromagnetic semi–implantable hearing device. Phase I, clinical trials. Laryngoscope 1991;101:355–360. Miller JM, Sutton D, Webster DB: Brainstem histopathology following chronic scala tympani implantation in monkeys. Ann Otol Rhinol Laryngol 1980;89(Sup. 66):15–17. Miyamoto R, Mynes W, Pope M et al.: Cochlear implants for deaf children. Laryngoscope 1986;96:990–996. Moller A, Jannetta P, Moller M: Neural generators of brainstem evoked potentials. Ann Otol Rhinol Laryngol 1981;90:591–592. Moller A, Jannetta P, Moller M: Intracranially recorded auditory nerve response in man. Ar Otolaryngol 1982;108:77–82. Mulch G, Petermann W: Influence of age on result of vestibular function tests. Ann Otol Rhinol Laryngol 1979:88(Sup. 56). Möller A, Jho H, Yokota M, Jannetta P: Contribution from crossed and uncrossed brainstem structures to the brainstem auditory evoked potentials. A study in humans. Laryngoscope 1995;105:596–605. Murofushi T, Marsuzaki M, Wu C: Short–term burst–evoked myogenic potentials on the sternocleidomastoid muscle. Ar Otolaryngol 1999;125:660–664. Musiek FE, Geurkink NA: Auditory brainstem and middle latency evoked response sensitivity near threshold. Ann Otol Rhinol Laryngol 1981;90:236–240. Musiek FE, Geurkink NA, Weider DJ, Donnelly K: Past, present, an future applications of the auditory middle latency response. Laryngoscope 1984;94:1545–1552. Nadol JB: Histological considerations in implant patient. Ar Otolaryngol 1984;110:160–163. Norton NB, Berliner KI: Environmental sounds: test and training program for the hearing impaired. Presented at American Speech and Hearing Association. Chicago, 1977. Novak MA, Firszt JB, Rotz LA et al.: Cochlear implants in infants and toddlers. Ann Otol Rhinol Laryngol 2000;109(185):46–49. Ostergard CA, Carter DR: Positive middle ear pressure shown by tympanometry. Ar Otolaryngol 1981;107:353–356. Parisier S, Chute P, Popp A, Suh G: Outcome analysis of cochlear implant reimplantation in children. Laryngoscope 2001;111:26–32. Pfingst BE, Donalson JA, Miller JM, Spelman FA: Psychophysical evaluation of cochlear prostheses in a monkey model. Ann Otol Rhinol Laryngol 1979;88:613–625. Podoshin L, Kremer M, Fradis M, Feiglin H: Effect of hearing aids on hearing. Laryngoscope 1984;94:113–117. Proctor L, Hansen D, Rentea R: Comoretinal potential variations. Significance in electronystagmography. Ar Otolaryngol 1980;106:262–265. Pyykko I, Henriksson NG, Wennmo C, Schalen L: Velocity of rapid eye movements and vertigo of central origin. Ann Otol Rhinol Laryngol 1981;90:164–168. Rahko T, Karjalainen M, Laine U, Lavonen A: Effect of word speed, number of words and habituation on the discrimination score of synthesized speech. Ann Otol Rhinol Laryngol 1980;89:69–71. Rhee C, Park H, Jang Y: Audiologic evaluation of neonates with severe hyperbilirubinemia using transiently evoked otoacoustic emissions and auditory brainstem. Laryngoscope 1999;109:2005–2008. Riko K, Pichora–Fuller MK, Alberti PW: Clinical evaluation of a two–channel amplitude compression hearing aid. Laryngoscope 1986;96:1226–1230. ERRNVPHGLFRVRUJ Capítulo 3 Kavanagh KT, Beardsley JV: Brain stem auditory evoked response. III. Clinical uses of bone conduction in the evaluation of otologic disease. Ann Otol Rhinol Laryngol 1979;88(Sup. 58):22–28. Kennedy D: Multichannel intracochlear electrodes. Mechanism of insertion trauma. Laryngoscope 1987;97:42–49. Kileny P: Auditory brainstem responses as indications of hearing aid performance. Ann Otol Rhinol Laryngol 1982; 91:61–64. Kimberley B: Applications of distortion–product emissions to an otological practice. Laryngoscope 1999;109:1908–18. Kim J, Winfield JA, Sutton D, Donaldson JA: Vestibular effects of electrical stimulation of the cochlea. Monitored in the awake primate. Ar Otolaryngol 1979;105:175–179. Kinney SE, Nodar RH: Brainstem auditory evoked potentials for detection of retrocochlear pathology. Ann Otol Rhinol Laryngol 1990;89:291–295. Kobayashi T, Okitsu T: Tympanograms in ears with small perforations of the tympanic membranes. Ar Otolaryngol 1986;112:642–645. Kubo T, Igarashi M, Jensen DW, Homick JL: Eyehead coordination during optokinetic stimulation in squirrel monkeys. Ann Otol Rhinol Laryngol 1981;90:95–88. Kubo T, Igarashi M, Jensen DW, Wright WK: Eyehead coordination and lateral canal block in squirrel monkeys. Ann Otol Rhinol Laryngol 1981;90:154–157. Kumar A, Sutton DL: Diagnostic value of vestibular function tests. An analysis of 200 consecutive cases. Laryngoscope 1984;94:1435–1441. Lehnhardt M, von Wallenberg EL, Brinch JM: Reliability of the Nucleus C122 and C124M cochlear implants. Ann Otol Rhinol Laryngol 2000;109(185):14–16. Lenhardt ML: Childhood central auditory processing disorder with brainstem evoked response verification. Ar Otolaryngol 1981;107:623–625. Liebman EP, Toglia JU: Inhibition of labyrinthine nystagmus by visual fixation: effects of ablation of visual cortex and superior colliculi. Ann Otol Rhinol Laryngol 1979;88:419–423. Linthicum E, Galey F: Histologic evaluation of temporal bones with cochlear implants. Ann Otol Rhinol Laryngol 1983;92:610–613. Mangham CA, Miller JM: A case for further quantification of the stapedius reflex. Ar Otolaryngol 1979;105:593–596. Mangham CA, Burnett PA, Lindeman RC: Standardization of acoustic reflex latency. Ann Otol Rhinol Laryngol 1982;91:169–174. Maniglia A, Ko W, Zhong R et al.: Electromagnetic implantable middle ear hearing device of the ossicular–stimulating type. Principles, designs and experiments. Ann Otol Rhinol Laryngol 1988;97:3–16. Martin LFA, Tong YC, Clark GM: A multiple–channel cochlear implant. Evaluation using speech tracking. Ar Otolaryngol 1981;107:157–159. Mathog RH: Sinusoidal harmonic acceleration. Ann Otol Rhinol Laryngol 1981;90(Sup. 86):10–14. Mauldin L, Jerger J: Auditory brain stem evoked responses to bone–conducted signals. Ar Otolaryngol 1979;105:656–661. McGee TJ, Clemis JD: Effects of conductive hearing loss on auditory brainstem response. Ann Otol Rhinol Laryngol 1982;91:304–309. 51 51 52 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 3 Robinson DA: Vestibular and optokinetic symbiosis: an example of explaining by modelling In: R. Baker and A. Berthoz eds., Control of Gaze by brain stem neurons. New York: Elsevier–North Holland, 1970:49–58. Rosenblum SM, Ruth RA, Gal TJ: Brainstem potentials in profound hypothermia. Ann Otol Rhinol Laryngol 1985;94:281–283. Rosenhall U: Degenerative patterns in the aging human vestibular neuro–epithelia. Acta Otolaryngol (Stockh) 1973;76: 208–220. Ruben RJ: A time frame of critical/sensitive periods of language development. Acta Otolaryngol (Stockh) 1997;117:202–205. Rubin W: Sinusoidal harmonic acceleration test in clinical practice. Ann Otol Rhinol Laryngol 1981;90(Sup. 86):18–25. Rubinstein A, Sohmer H: Latency of auditory nerve response in neonates one to eight hours old. Ann Otol Rhinol Laryngol 1982;91:205–208. Ruth RA, Johns ME, Gal TF: Acoustic reflex response during curare–induced weakness. Ann Otol Rhinol Laryngol 1980;99:188–193. Sataloff R, Hughes M, Small D: Vestibular “masking”: a diagnostic technique. Laryngoscope 1987;97:885–886. Senn P, Rostetier C, Arnold A, Vischer M: Retrograde cochlear implantation in postmeningitic basal turn ossification. Laryngoscope 2012;122:2043–2050. Schindler R, Kessler D: Preliminary results with the Clarion cochlear implant. Laryngoscope 1992;102:1006–1013. Schindler RA, Kessler DK, Rebscher SJ et al.: The UCSF/ STORZ multichannel cochlear implant. Patient results. Laryngoscope 1986;96:597–603. Shanon E, Gold S, Himmelfarb MZ, Carasso R: Auditory potentials of cochlear nerve and brain stem in multiple sclerosis. Ar Otolaryngol 1979;105:505–508. Shanon E, Himmelfarb MZ, Gold S: Pontomedullary vs. pontomesencephalic transmission time. Ar Otolaryngol 1981;107:474–475. Shepherd RF, Clark GM, Pyman BC, Webb RL: Banded intracochlear electrode array: evaluation of insertion trauma in human temporal bones. Ann Otol Rhinol Laryngol 1985;94:55–59. Shirinian MJ, Arnst DJ: Patterns in the performance–intensity functions for phonetically balanced word lists and synthetic sentences in aged listeners. Ar Otolaryngol 1982;108:15–20. Simmons FB: Electrical stimulation of the auditory nerve in cats. Ann Otol Rhinol Laryngol 1979;88:533–539. Simpson RA: Sinusoidal harmonic acceleration labyrinthine test: clinical experience. Ann Otol Rhinol Laryngol 1981;90(Sup. 96):26–28. Smith L, Simmons FB: Accuracy of auditory brainstem evoked response with hearing level unknown. Ann Otol Rhinol Laryngol 1982;91:266–267. Smith L, Simmons FB: Estimating 8 nerve survival by electrical stimulation. Ann Otol Rhinol Laryngol 1983;92:19–23. Starr A, Brackmann DE: Brain stem potentials evoked by electrical stimulation of the cochlear in human subjects. Ann Otol Rhinol Laryngol 1979;88:550–556. Takahashi M, Uemura T, Fujishiro T: Compensatory eye movement and gaze fixation during active head rotation in patients with labyrinthine disorders. Ann Otol Rhinol Laryngol 1981;90:241–245. Thomas WG, McMurry G, Pillsbury H: Acoustic reflex abnormalities in behaviorally disturbed and language delayed children. Laryngoscope 1985;95:811–816. Thompson GC, Stach BA, Jerger JF: Effect of ketamine on the stapedious reflex in the squirrel monkey. Ar Otolaryngol 1984;110:22–24. Tole JR: A protocol for the air caloric test and a comparison with a standard water caloric test. Ar Otolaryngol 1979;105:314–319. Tonndorf J, Kurman B: High frequency audiometry. Ann Otol Rhinol Laryngol 1984;93:576–582. Umeda Y: The eye–tracking test. I. Manual quantitative assessment of eye–tracking patterns. Ann Otol Rhinol Laryngol 1980;89(Sup. 71):1–6. Wazen J: Intraoperative monitoring of auditory function: experimental observations and new applications. Laryngoscope 1994;104:446–455. Webb R, Lehnhardt E, Clark G, Laszig R: Surgical complication with the cochlear multiple–channel intracochlear implant. Experience of Hannover and Melbourne. Ann Otol Rhinol Laryngol 1991;100:131–136. Wilson WR: Pacemaker artifact on ENG tracing. Ann Otol Rhinol Laryngol 1980;89:591. Wilson WR, Kim JW: Study of ventilation testing with electronystagmography. Ann Otol Rhinol Laryngol 1981;90: 56–59. ERRNVPHGLFRVRUJ MALFORMACIONES CONGÉNITAS DEL OÍDO EXTERNO FÍSTULAS Y QUISTES PREAURICULARES Existen cinco arcos branquiales que son estructuras mesodérmicas separadas por hendiduras. Estos arcos están cubiertos en forma externa por un epitelio plano y de manera interna por un epitelio de tipo columnar. Cada hendidura se halla en contacto con una saliente de la faringe denominada bolsa faríngea. Cada arco branquial consta de un cartílago central, un vaso sanguíneo y un nervio. Tan sólo la primera hendidura branquial persiste como una estructura definitiva en el embrión. Dicha hendidura forma el conducto auditivo externo y la membrana de la porción inferior de éste constituye la capa externa de la membrana timpánica. En consecuencia, las fístulas y quistes preauriculares son anomalías de la primera hendidura branquial y representan menos de 10% de todos los defectos de las hendiduras branquiales. Se originan por un cierre incompleto de su porción ectodérmica. Tienen una gran diversidad de manifestaciones clínicas y, por lo general, se relacionan con infección. Los síntomas ocurren en la región preauricular y cervical por arriba de la línea horizontal que pasa por el hueso hioides. Work (1972) los clasifica en dos tipos: Tipo I: tienen un origen ectodérmico puro y se localizan en los planos medial, inferior y posterior respecto del pabellón auricular, aunque son posibles extensiones hacia el lóbulo de la oreja. Su trayecto es superficial al nervio facial, paralelo al conducto auditivo externo, y termina en un fondo de saco cerca de la lámina ósea en el mesotímpano. Su trayecto puede estar circundado por tejido parotídeo. Tipo II: son de origen ectodérmico y mesodérmico y representan anomalías tanto de la primera hendidura branquial como del primero y segundo arcos branquiales. Consisten en fístulas o quistes en la concha o el conducto medial o inferior al conducto auditivo externo y pasan en un plano medial o lateral al nervio facial y se proyectan en dirección del músculo digástrico y terminan, las más de las veces, sobre el borde anterior del músculo esternocleidomastoideo a través de una fístula. Estas anomalías son más frecuentes que las del tipo I y se vinculan con otitis externas crónicas. En 20% de los casos también se observan masas quísticas aisladas, secundarias a alteraciones de la primera hendidura branquial. Las fístulas preauriculares poseen un trayecto corto, que tiende a arborizarse y terminar en un fondo de saco alrededor del conducto auditivo externo. Son más comunes en la raza asiática. Cuando se infectan hay casi siempre microorganismos anaerobios (peptococos y bacterioides). El tratamiento consiste en antibioticoterapia, sobre todo en infecciones repetitivas y fistulectomía. Cuando las resecciones son limitadas sin extraer el trayecto fistuloso, las recurrencias alcanzan 50%, por lo que está indicada una abertura amplia de la lesión con exposición del nervio facial y parotidectomía superficial, en caso necesario. En general, las anomalías congénitas del oído se clasifican en tres grupos. Malformaciones menores Puede encontrarse hipoplasia leve del conducto auditivo externo. La membrana timpánica puede estar opaca y muy poco engrosada. El mango del martillo puede verse en posición anómala. El aspecto y forma del pabellón auricular tienen apariencia normal. En ocasiones, la cavidad timpánica se encuentra hipoplásica. Capítulo 4 Oído externo Malformaciones moderadas Son las más frecuentes. El pabellón auricular se presenta con partes blandas rudimentarias. El conducto auditivo externo está total o parcialmente aplásico. Puede haber una membrana timpánica rudimentaria. El hueso timpánico está representado por una lámina ósea con una porción central de tejido conectivo. Las estructuras del oído medio muestran diversas alteraciones, con alteraciones de la configuración y posición de las estructuras derivadas del cartílago de Reichert. 53 ERRNVPHGLFRVRUJ 54 Oído, nariz, garganta y cirugía de cabeza y cuello El nervio facial tiene un curso más anterior y superior. El antro y las celdillas periantrales pueden o no identificarse, según sea el grado de neumatización. La cavidad del oído medio es hipoplásica, con anomalías en la cadena de huesecillos. Capítulo 4 Malformaciones graves No hay pabellón auricular. El conducto auditivo externo es aplásico y la neumatización en el oído es nula. El antro y el oído medio pueden estar representados por una pequeña luz en forma de hendidura. La cadena osicular puede mostrar sólo restos de huesecillos malformados o no existir en absoluto. El nervio facial sigue un curso anómalo. En este grupo es más común reconocer malformaciones del oído interno. La articulación temporomandibular está desplazada en sentido posterior. Los grupos uno y dos pueden corregirse de forma quirúrgica, desde el punto de vista funcional. En casos bilaterales se recomienda efectuar la operación a la edad de cinco o seis años, de preferencia en el oído con peor audición. En el segundo oído es conveniente diferir la intervención hasta los 16 o 20 años, por considerar que el paciente debe participar en el proceso de decisión. La misma conducta se adopta en pacientes con lesiones unilaterales. En malformaciones congénitas graves sólo se recomienda practicar procedimientos estéticos. ANOMALÍAS CONGÉNITAS DEL PABELLÓN AURICULAR Estas alteraciones son raras y ocurren en 1 de cada 20 000 nacimientos. Tipos: a) Anotia (ausencia del pabellón auricular). b) Microtia (hipoplasia del pabellón auricular). Tipo I: existe un pabellón auricular rudimentario y pueden reconocerse sus diferentes partes. Tipo II: la aurícula está representada por un doblez vertical y longitudinal que, en ocasiones, incluye cartílago y semeja un hélix primitivo. Tipo III (figura 4–1): muestra restos de partes blandas que no se asemejan a porción alguna del pabellón auricular. La microtia unilateral es más frecuente que la bilateral; predomina en el sexo masculino (2:1) y en el pabellón auricular derecho (3:2). Figura 4–1. Microtia de tipo III relacionada con una malformación de tipo 2 de Altmann. a) Melotia (desplazamiento del pabellón auricular hacia la mejilla). b) Criptotia: consiste en la depresión superior del borde del pabellón auricular debido a que los músculos auriculares superiores terminan en la porción superior del hélix, en lugar de hacerlo en la eminencia de la fosa triangular (figura 4–2). Su tratamiento consiste en el uso de prótesis sencillas elaboradas con alambre dental y cinta adhesiva tipo Micropore® con el objeto de prevenir la posición de decúbito del pabellón auricular. PRINCIPIOS QUIRÚRGICOS DE LA RECONSTRUCCIÓN DE LAS ANOMALÍAS DEL OÍDO 1. Meatoplastia: se recomienda un colgajo pediculado de base anterior, utilizando la piel del área de la concha auricular. Causas Puede aparecer como un proceso congénito: rubeola padecida por la madre al final del primer trimestre del embarazo o por el consumo de agentes teratógenos como la talidomida. La microtia consiste en una alteración en el mecanismo de fusión de los seis tubérculos de Hiss provenientes del primer y segundo arcos branquiales durante el primer trimestre del embarazo. Figura 4–2. Criptotia: nótese la depresión del borde superior del hélix del pabellón auricular; además, se observa la falta de desarrollo del esqueleto cartilaginoso vinculada con una malformación de tipo 1 de Altmann. ERRNVPHGLFRVRUJ Oído externo Algunos informes refieren resultados óptimos mediante el uso de pabellones auriculares homólogos, disecados de cadáveres frescos conservados en solución de Cialite®. El resto de la técnica quirúrgica es similar a la anterior. Otra opción en la reconstrucción del pabellón auricular consiste en utilizar las prótesis auriculares. Los materiales plásticos modernos semejan la textura de la piel y algunos pegamentos no irritantes aseguran una adecuada fijación de la prótesis. CORRECCIÓN DEL PABELLÓN AURICULAR PROTRUYENTE (OREJAS DE MURCIÉLAGO) Esta enfermedad es en realidad, más que una hipertrofia, una mala posición de un pabellón auricular de tamaño normal, el cual muestra un tamaño desproporcionado respecto de la cabeza. No hay doblez del antihélix. La indicación quirúrgica es sobre todo estética y se requiere una edad mínima de seis a siete años para realizarla, tiempo en el cual el pabellón auricular alcanza su tamaño adulto. Cada caso debe valorarse de manera particular y la finalidad es plegar el pabellón auricular hacia la región temporal para que armonice con el resto de la cara y cráneo. Técnica quirúrgica La operación puede practicarse bajo anestesia local con sedación, aunque en niños es preferible la anestesia general. Se sugiere, antes de efectuar cualquier incisión, que el cirujano presione ambos pabellones auriculares hacia la mastoides, lo que ayuda a valorar la cantidad de piel a resecar. Dicha área se marca e infiltra con xilocaína y epinefrina al 1 por 200 000; la incisión se inicia 3 a 5 mm en sentido lateral al pliegue o sulcus retroauricular y se continúa en forma paralela hasta los tercios superior e inferior de la región posterior del pabellón, para proseguir con el límite anterior de la resección, el cual debe discurrir paralelo al hélix y lóbulo de la oreja. A continuación se retira la piel y se diseca alrededor de la incisión con tijera, cortando el ligamento auricular anterior que avanza hacia delante y procede de la espina de Henle. También se divide el músculo auricular posterior y se libera con ello el pabellón auricular. Después se lleva a cabo el pliegue en el antihélix, marcando los límites de éste con agujas delgadas rectas, que se introducen en forma anterior por arriba y debajo del pliegue para incidir el cartílago, de tal forma que se expone el área de doblez requerida en el antihélix. Dicho cartílago se adelgaza con fresas de diamante y se colocan dos o tres suturas de material no absorbible como el nailon 4–0, las cuales se pasan a lo largo de los bordes del cartílago y el pericondrio por delante del pabellón auricular, con especial cuidado de no lesionar la piel de la concha auricular. Luego se cierra la herida y se coloca un vendaje compresivo. Es importante señalar que se dispone de otras técnicas otoplásticas para la reconstrucción de estos defectos. Sin embargo, la experiencia ha señalado que las técnicas que respetan el cartílago auricular, como la descrita, suministran mejores resultados estéticos. El tratamiento no quirúrgico para la corrección del pabellón auricular protruyente denominado método de auri consiste en la colocación de un clip de plástico durante la noche por espacio de 4 a 5 h para ejercer presión sobre el cartílago en el área donde no se ha desarrollado el antihélix, y crear así un doblez; además, se coloca una cinta adhesiva doble en dicho sitio (por las mañanas) durante 8 a 9 h diarias. Sorribes y Tos (2002) han obtenido resultados satisfactorios en más de 85% de los pacientes. ENFERMEDADES DIVERSAS DEL OÍDO EXTERNO PETRIFICACIÓN DEL PABELLÓN AURICULAR En 1866, Bochdalek describió el primer caso de osificación fisiológica del pabellón auricular. Hasta el momento se han publicado unos 140 casos. Existe una calcificación ectópica, distrófica o metastásica en am- ERRNVPHGLFRVRUJ Capítulo 4 2. Plastia del canal y timpanoplastia: se amplía con una fresa lo que será el conducto auditivo externo, hasta realizar una exenteración amplia de las celdillas mastoideas. Los procedimientos timpanoplásticos de reconstrucción de la cadena osicular varían según sea el caso en particular. No se recomienda crear ventanas, ya que los conductos pueden ser aberrantes y difíciles de encontrar. Lo más conveniente es una laberintotomía. Se utiliza fascia temporal para la reconstrucción de la membrana timpánica. 3. Se aplica un injerto libre de piel (0.014 pulgadas), obtenido al inicio de la operación (zonas donadoras: regiones mastoidea o supraclavicular). Se aplica gasa o un material expansible que proporcione soporte al conducto creado con objeto de prevenir la estenosis. 4. Procedimiento estético de reconstrucción del pabellón auricular. Consiste en: a) Toma de cartílago autólogo costal (técnica de Converse, 1958, y de Tanzer, 1958). b) Introducción del armazón cartilaginoso manufacturado a través de una incisión vertical por encima del último remanente caudal útil. c) Fijación del injerto con múltiples puntos de sutura con cojinetes externos. d) Segundo tiempo quirúrgico (se practica tres a seis meses después). Consiste en la rotación del lóbulo, en caso de ser necesario, y la separación del pabellón auricular de la prominencia mastoidea. e) El defecto dérmico retroauricular se resuelve mediante la aplicación de un injerto libre de piel proveniente de las regiones inguinal, supraclavicular o contralateral del pabellón auricular. 55 55 56 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 4 bos pabellones. Esta anomalía puede ser resultado de un traumatismo o manipulación, o relacionarse con otros síndromes, como hipercalcemia secundaria a sarcoidosis y trastornos metabólicos, como la enfermedad de Addison y gota. La petrificación auricular también puede ser consecutiva a congelación. En este caso, el cartílago elástico se reemplaza con hueso ectópico. LEISHMANIASIS CUTÁNEA Produce lesiones ulcerativas dolorosas que pueden localizarse sobre la periferia del hélix auricular. El diagnóstico se confirma al localizar los parásitos en muestras de piel tomadas de las zonas no ulceradas de la lesión. Esta enfermedad se presenta con mayor frecuencia en el sureste de México, Medio Oriente y la India. El tratamiento se basa en antimonio. A HEMATOMA AURICULAR AGUDO (OREJA DE LUCHADOR) El hematoma auricular aparece después de un traumatismo directo al oído externo. Produce un edema indoloro súbito debido a la hemorragia y, si no se trata, puede causar un engrosamiento y deformidad del oído externo que, en el caso de traumatismos repetitivos, da origen a la denominada “oreja de coliflor”. En estos casos, el hematoma es subpericóndrico y la necesidad de drenarlo se reconoce probablemente desde el inicio de los juegos olímpicos, debido a que los luchadores la padecen con frecuencia. Tratamiento a) Anestesia local con lidocaína al 2% y epinefrina. b) Incisión en la superficie anterior paralela al hélix o antihélix (según sea el sitio del hematoma). c) La incisión se cierra con sutura no absorbible 6–0. d) Se aplica compresión sobre la región auricular. Además se pueden aplicar puntos de sutura transfictiva con material no absorbible (9 Vycril 4-0 o catgut crómico 4-0), con lo cual se obtiene una mejor aproximación de la piel al cartílago. Si el hematoma se desarrolla en la concha, puede usarse un molde de un auxiliar auditivo externo. En caso de no drenarse, es obvia la posibilidad de infección con desarrollo secundario de pericondritis (figura 4–3). B Figura 4–3. A. Obsérvese el aumento de volumen de la aurícula a expensas del seroma pospicadura de araña. B. Colocación de botones de camisa para afrontar la piel de la aurícula con el cartílago fijados con hilo de nailon. edema debido a un aumento de la permeabilidad capilar. La cristalización del hielo en el líquido intracelular es la causa principal, así como la necrosis celular que se presenta en los tejidos vecinos. En esta etapa, la aurícula se torna edematosa, roja y dolorosa, y pueden aparecer vesículas con líquido tisular. El estadio final se caracteriza por la isquemia, que surge cuando disminuye la circulación a través de los capilares distendidos, con pérdida de plasma por sus paredes. Si no se recupera la permeabilidad normal en pocas horas se forman coágulos intravasculares y se presenta una trombosis permanente y necrosis isquémica de los tejidos. Tratamiento CONGELAMIENTO AURICULAR Se observa con frecuencia en países con climas fríos. Existe un periodo inicial de vasoconstricción, que deja los bordes del hélix con una palidez notoria y fríos al tacto. En seguida aparece un estadio de hiperemia y Se debe restituir en el oído una temperatura normal lentamente. Para ello se recomienda colocar al paciente en un cuarto frío o aplicar una corriente de aire frío sobre el área afectada. La vasodilatación produce sensaciones de quemadura y comezón, por lo que debe ERRNVPHGLFRVRUJ Oído externo SEROMA AURICULAR Se caracteriza por la acumulación de pequeñas cantidades de material seroso de color vino rosáceo o amarillento entre el antihélix y la concha del pabellón auricular, sin antecedente de traumatismo. No hay signos de inflamación y desaparece sin desfigurar la aurícula. Estos casos pueden tratarse con drenaje a través de una punción y sutura mediante una gasa para afrontar la piel al cartílago y evitar así recidivas. PERICONDRITIS La pericondritis del pabellón auricular puede presentarse a consecuencia de un procedimiento otológico, sobre todo cuando se emplea la vía endoaural. Otras causas son traumatismos cerrados o abiertos en el pabellón auricular, otitis externas después de nadar en aguas contaminadas, o la presencia de cuerpos extraños, entre ellos las agujas de acupuntura en el pabellón auricular. En raras ocasiones se relaciona con otitis externa maligna y en pacientes con alteraciones inmunitarias. Los microorganismos identificados con mayor frecuencia son gérmenes gramnegativos; de ellos, los más comunes son Pseudomonas aeruginosa y Proteus. La evolución de la pericondritis es larga; tiende a propagarse a regiones contiguas y a menudo termina en una deformidad engrosada de la oreja (“oreja de coliflor”). Al inicio, la pericondritis se caracteriza por hiperemia y edema difuso del pabellón auricular, los cuales producen un dolor intenso. Hay acumulación de suero en la capa subpericóndrica, la cual se torna purulenta en poco tiempo y produce a la palpación zonas fluctuantes locales o difusas. estas cánulas se les hacen múltiples perforaciones para irrigar posteriormente con solución de antibióticos y pueden aplicarse en forma de X o en paralelo (figura 4–4). Después se aplica vendaje compresivo por 24 horas. AVULSIONES O DESPRENDIMIENTOS TRAUMÁTICOS DEL PABELLÓN AURICULAR Casi siempre se deben a mordeduras de seres humanos o animales. El pabellón auricular debe lavarse con solución de Ringer. Se desbridan tejidos contaminados sobre la lesión en donde se encuentra la dehiscencia y en el mismo pabellón auricular. La reaproximación debe ser precisa, con el uso mínimo de material de sutura. Se recomienda la combinación de bajas dosis de heparina y dextrán, así como antibióticos como profilaxis para proteger el esqueleto cartilaginoso vascular del pabellón. CICATRICES QUELOIDES RETROAURICULARES Se mencionan ya en el Papiro de Smith y luego las describieron Retz (1790) y Alibert. Son cicatrices de la piel que crecen más allá de los límites de la herida original (figura 4–5), a diferencia de las cicatrices hipertróficas, que permanecen dentro de los límites de la herida. Se pierde el equilibrio durante las fases de síntesis y degra- Tratamiento 1. Administración de antibióticos. 2. Desbridamiento quirúrgico del absceso. El autor recomienda, si es extenso, efectuar cuatro incisiones: la primera hacia la punta del pabellón, la segunda inmediatamente por encima del antitrago, y otras dos retroauriculares, una superior y otra inferior. Una vez trazadas las incisiones, se drena la secreción purulenta y se procede a la extracción del cartílago necrosado. Después se aplican sondas para drenaje e irrigación (sondas para alimentación infantil 8 Fr de 2.5 mm de diámetro). A Figura 4–4. Fotografía que muestra la manera en que se aplicaron las sondas para drenaje e irrigación en una pericondritis aural. ERRNVPHGLFRVRUJ Capítulo 4 evitarse la manipulación del paciente sobre sus oídos. En casos graves con exposición prolongada es conveniente administrar heparina. Para prevenir la infección en el tejido desvitalizado debe recurrirse a la quimioprofilaxis. En caso de necrosis de algunas porciones del pabellón auricular, se debe dejar que se separen de modo espontáneo, lo que produce una mejoría estética ya que la operación temprana tiende a retirar por lo general una mayor cantidad de tejido. En caso de infección, el tratamiento quirúrgico es prioritario. 57 57 58 Oído, nariz, garganta y cirugía de cabeza y cuello 2. Seco, con un fenotipo recesivo (predomina en la raza asiática y los indios americanos) Capítulo 4 La concentración de lípidos en el cerumen es ligeramente mayor en niños, pero menor la de proteínas que en adultos. Ambas formas de cerumen tienen actividad bactericida, tanto para gérmenes grampositivos como para gramnegativos. Por otro lado, se ha identificado el virus de la hepatitis B en el cerumen, por lo que éste puede constituir una potencial fuente de transmisión. EXTRACCIÓN DEL CERUMEN Figura 4–5. Rechazo del pabellón auricular hacia delante por una cicatriz queloide retroauricular posquirúrgica. dación del metabolismo de la colágena y el resultado final es una gran masa de colágena. Los individuos de raza negra son más susceptibles que los caucásicos (3:1) al desarrollo de cicatrices queloides e hipertróficas como respuesta a traumatismos. Casi todos los pacientes son jóvenes menores de 30 años de edad. La síntesis de colágena en queloides es unas 20 veces mayor que en la piel normal sin lesión y tres veces más que en las cicatrices hipertróficas. Cohen (1971) ha señalado que la fase anabólica en las cicatrices queloides se encuentra acelerada en forma desproporcionada. Tratamiento 1. Cirugía. Estas lesiones deben removerse de manera atraumática, con el mínimo de material de cuerpo extraño. No debe haber tensión en los bordes quirúrgicos. 2. Inyecciones de triamcinolona sobre la masa queloide principal. 3. Presión local. CONDUCTO AUDITIVO EXTERNO (CERUMEN) Las glándulas ceruminosas se encuentran en la pared superior cartilaginosa del conducto auditivo externo (CAE). Su secreción se combina con la secreción sebácea de los folículos pilosos con lo que se forma el cerumen. El ritmo de movilización del cerumen varía entre las personas, ya que en algunas se presentan cantidades escasas y en otras se forman grandes masas que obstruyen periódicamente al CAE. El cerumen se puede encontrar en dos tipos básicos: 1. Pastoso, con un fenotipo dominante (predomina en las razas blanca y negra) Cuando el cerumen obstruye al CAE y se halla en cantidades pequeñas o moderadas, está indicada su eliminación por medios mecánicos. Para ello puede utilizarse una cucharilla o una pinza de Hartmann. Si la cantidad es abundante, se recomienda la irrigación, siempre y cuando la membrana timpánica no esté perforada; se utiliza una jeringa metálica de irrigación y solución salina o agua bidestilada tibia, con el objeto de no estimular a los conductos semicirculares y producir así vértigo durante la irrigación. Para colocar al CAE en una posición más recta se recomienda tirar el pabellón auricular hacia arriba y atrás, y la corriente de agua se dirige hacia la pared superior del CAE; de ese modo, el agua empuja al cerumen al regresar desde atrás y se deposita en un recipiente. Una vez terminado este procedimiento, el paciente puede experimentar la sensación de tener agua en los oídos; en tal caso se aspirar el remanente de agua bajo visión con el microscopio, sobre todo en la región anterior al annulus timpánico. Cuando el cerumen está seco e impactado, es aconsejable reblandecerlo mediante la aplicación de gotas de glicerina, o agua oxigenada dos a tres días antes de la irrigación. La prescripción de soluciones comerciales “disolventes de cerumen” es peligrosa, ya que a menudo irritan al CAE y causan otitis externas. La manipulación del CAE, sobre todo de su pared posterosuperior, puede inducir un reflejo tusígeno,por estimulación del nervio de Arnold. CUERPOS EXTRAÑOS Pueden ser animados o inanimados, vegetales o minerales. En niños es frecuente la introducción de materiales hidrófilos (semillas de frijol, sorgo), perlitas, borradores de lápices, pequeñas piedras de río. En ocasiones se identifica la introducción de insectos en niños o en personas que salen de campamento. Los intentos infructuosos para extraer el cuerpo extraño pueden producir su impactación más allá del istmo del CAE y ocasionar un edema grave. En el tratamiento de personas con cuerpos extraños en el CAE hay que distinguir entre cuerpos hidrófilos e hidrófobos, verificar si hay o no obstrucción completa de la luz, así como la edad del sujeto. Cuando se trata de cuerpos hidrófilos, no debe irrigarse el CAE, ERRNVPHGLFRVRUJ Oído externo OTITIS EXTERNA Consiste en la inflamación de alguna porción de la piel del CAE. Una proporción de 3 a 10% de la población general la padece. Senturia y Marcus (1967) la clasifican como sigue: 1. 2. 3. 4. 5. Infecciosas. Erupciones neurógenas. Dermatosis alérgica. Traumáticas. Lesiones idiopáticas. Un cambio en el pH del conducto auditivo externo, que lo haga alcalino, favorece el desarrollo de microorganismos patógenos gramnegativos, como Pseudomonas aeruginosa, Proteus vulgaris y Proteus mirabilis. Sayfield y Fraser (1980) estudiaron el pH del agua de las albercas y concluyeron que aquéllas relacionadas con una mayor producción de otitis externas contaban con un pH alcalino. Por otro lado, Driscoll (1993) analizó el cerumen de cientos de personas sin afectación ótica y encontró que éste tenía un pH de 6.9, pero los pacientes diabéticos con otitis externa necrosante tenían un pH cercano a 8. Otros factores que intervienen en su producción son la pérdida de lípidos de la piel del conducto auditivo externo, la sudación excesiva, la oclusión del conducto auditivo por audífonos, orejeras, cerumen ausente o escaso. Brook (1997) establece que las ojivas de los estetoscopios empleados por múltiples personas representan una causa de infecciones del oído externo nosocomiales, por lo que es recomendable su limpieza. Las otitis externas también pueden ser agudas, recurrentes y crónicas. Los síntomas son los siguientes: a) Prurito: al progresar la inflamación produce un dolor intenso y un edema marcado del CAE. b) La hipoacusia que se presenta es secundaria a la obstrucción. c) Otorrea, por lo general purulenta y relacionada con detritos epiteliales. d) Adenopatías en la región yugulodigástrica, parotídea o retroauricular. Infecciones del oído externo Furunculosis Ocurre en la porción cartilaginosa del CAE. Se acompaña de edema y eritema del CAE. Cuando el furúnculo está bien localizado, debe incidirse y sus bordes necróticos desbridados. Se recomiendan antibióticos contra estafilococos, que son el principal agente causal. Celulitis Es muy dolorosa y se caracteriza por enrojecimiento difuso, con edema generalizado. Los microorganismos causales son estreptococos o estafilococos. Tratamiento: antibioticoterapia y colocación de gasa impregnada con pomada antibiótica y antiinflamatoria, que sirve de sostén al conducto; se retira en 48 a 72 horas. Impétigo Es efecto de gérmenes grampositivos. Se reconoce por la presencia de costras amarillentas sobre la piel inflamada y un exudado purulento. Su tratamiento se basa en antibióticos y limpieza frecuente con agua oxigenada; también se puede dejar un soporte en el CAE mediante una gasa con vaselina e impregnada con antibiótico. Otitis externa difusa Por lo regular se presenta en el verano, cuando el clima es caluroso y húmedo. La piel del conducto está enrojecida, edematosa, con abundantes detritos epiteliales. Puede ocurrir edema periauricular. La luz del CAE se cierra por el edema y la infección se debe casi siempre a gérmenes gramnegativos. Debe descartarse la presencia de micosis. Tratamiento: 1. Toma de muestra para cultivo. 2. Limpieza del CAE con agua oxigenada o ácido acético. 3. Colocación de una gasa impregnada con antibiótico en el conducto; en caso de no haber infección por hongos, también pueden aplicarse corticoides. 4. A las 48 h se valora nuevo taponamiento del conducto con gasa. 5. Se administran antibióticos sistémicos. 6. Antiinflamatorios. 7. El uso de gotas óticas derivadas de las quinolonas (ciprofloxacina, ofloxacina) ha demostrado también ser de gran utilidad. Otitis externa maligna Consiste en una infección progresiva, que se inicia en el CAE, secundaria a Pseudomonas aeruginosa que se pre- ERRNVPHGLFRVRUJ Capítulo 4 ya que ello haría que el cuerpo (por lo general semillas) se hinchara y se impactara en el conducto. Cuando los cuerpos son más chicos que la luz del CAE, puede intentarse su extracción de manera mecánica mediante la utilización de ganchos colocados sobre la porción superior del cuerpo extraño, con la finalidad de conseguir una mejor palanca y evitar su impactación, o bien tomarlo con una pinza de Hartmann fina. Los objetos animados deben matarse antes de extraerse; en casi todos los casos es suficiente instilar gotas de glicerina líquida o un tapón de algodón humedecido. Con posterioridad se irriga el conducto o se toma el insecto con una pinza bajo visión directa, para tener la certeza de que el animal no se encuentra adherido a la membrana timpánica. La extracción de cuerpos extraños en niños, o pacientes con objetos alojados más allá del istmo del CAE, debe efectuarse bajo anestesia general para impedir lesiones traumáticas de la membrana timpánica o la cadena de huesecillos, por movimientos bruscos del individuo durante la extracción. 59 59 60 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 4 senta por lo general en pacientes de edad avanzada (sexto a octavo decenios de la vida) con diabetes mellitus dependiente de insulina. La infección progresa hasta afectar partes blandas, cartílago y al final hueso; es resistente a tratamiento médico conservador. Puede afectar pares craneales, en particular el nervio facial (VII) y los pares X a XII. Algunas de sus complicaciones son petrositis, meningitis, trombosis de los senos venosos y absceso cerebral. En 1881, Raynaud identificó esta alteración y la denominó otitis diabética. En este tipo de otitis externa se puede producir una osteomielitis real del hueso temporal. La mortalidad es alta: si no afecta estructuras profundas es de 23%; si afecta al nervio facial aumenta a 67%; y, si se encuentran afectados otros pares craneales o la vena yugular, se ha comunicado una mortalidad hasta de 80%. Tratamiento: 1. Control del trastorno metabólico subyacente (diabetes). 2. Antibioticoterapia (aminoglucósidos, ciprofloxacina, carbenicilina). 3. Desbridamiento quirúrgico del material necrótico del CAE; si el caso lo amerita se practica mastoidectomía radical, con o sin descompresión del nervio facial; en ocasiones puede realizarse una parotidectomía y limpieza de la rama ascendente de la mandíbula. 4. Oxígeno hiperbárico que provee el sustrato necesario a los leucocitos polimorfonucleares para una mejor actividad bactericida. 5. Corberand (1982) comunicó un caso en que la actividad migratoria de los leucocitos polimorfonucleares circulantes se encontraba alterada; el tratamiento con vitamina C (3 g diarios) normalizó la función y contribuyó a eliminar el proceso infeccioso. Se recomienda investigar esta función de los polimorfonucleares en pacientes con otitis externa maligna. Otitis externas de origen micótico Las micosis del oído externo se presentan en 10% de los casos y la infección por Aspergillus y Candida albicans (Monilia) es la más frecuente. Es común encontrar infecciones bacterianas agregadas. Estas infecciones tienden a ser crónicas y recurrentes, y los pacientes refieren prurito y sensación de plenitud en el oído. Es habitual que Aspergillus niger produzca un exudado grisáceo con detritos negruzcos amorfos. Kopstein (1984) ha recomendado la aplicación local de sulfonamidas en el CAE. En el caso de Candida albicans, es conveniente usar violeta de genciana al 2% en 95% de alcohol, y nistatina local y sistémica. Tanto la actinomicosis como la blastomicosis producen lesiones granulomatosas; en este caso, además de un adecuado desbridamiento quirúrgico que permita el drenaje del conducto, se recomiendan antimicóticos sistémicos. Dermatosis alérgicas del conducto auditivo externo Dermatitis atópica Aparece en sujetos con antecedente familiar o personal de alergia. El pabellón auricular se torna grueso y es posible el prurito. Dermatitis por contacto Los alergenos que se identifican con frecuencia son: cosméticos, tintes para el cabello, lociones, fármacos tópicos, materiales de caucho y níquel. La reacción puede ocurrir en cualquier parte del oído externo, según sea el punto donde se establezca el contacto. Tratamiento: evitar el alergeno y uso tópico de corticoesteroides. Dermatitis eccematoide Se acompaña de otorrea purulenta que infecta la piel del CAE o el pabellón auricular. Las lesiones son eritematosas con costras melicéricas. Se recomienda aseo con solución de ácido acético al 2% y tratar la infección que proviene del oído medio. Erupciones neurógenas Prurito de origen neurógeno Se presenta sin pruebas de lesión cutánea en individuos tensos e hiperactivos. Tirar y rascar de forma continua el pabellón auricular o el CAE producen fisuras y excoriaciones, que deben limpiarse y conservarse secas. El uso de corticoesteroides locales puede ser útil, así como la psicoterapia. Neurodermatitis Se caracteriza por la presencia de zonas secas en la piel, engrosadas, algunas veces eritematosas y muy pruriginosas. Por lo general se presentan en superficies de flexión. El prurito se controla con pomadas de hidrocortisona. La psicoterapia es esencial. Excoriaciones neurógenas Se observan en personas inestables, quienes de manera compulsiva se rascan hasta producir fisuras y laceraciones en los oídos. Lesiones idiopáticas Dermatitis seborreica Es muy común, y acompaña a la afección de otras regiones, como cuero cabelludo. Parece haber un factor hereditario. Las lesiones son amarillentas y presentan una producción excesiva de grasa (sebo). La piel del pabellón auricular tiene aspecto descamativo, que el sujeto interpreta como piel seca. Las regiones más afectadas son el CAE, la concha del pabellón auricular y la región retroauricular. Son de utilidad las pastas con ácido salicílico y pomadas de hidrocortisona. Debe explicarse al individuo que se trata de un padecimiento crónico que muestra exacerbaciones (figura 4-6). ERRNVPHGLFRVRUJ Oído externo 61 61 Figura 4–6. Dermatitis seborreica. Obsérvense las lesiones de aspecto descamativo, con presencia de sebo. Eccema infantil Aparece en la forma de excoriaciones eritematosas y vesiculares de la región retroauricular. Es bilateral y pruriginosa. Factores como el estrés pueden incrementarla. El tratamiento se basa en limpieza con solución de ácido acético al 2%. Psoriasis Se distingue por placas eritematosas circunscritas de diferentes tamaños. No son grasosas y pueden desarrollarse en áreas extensas del cuerpo. Tratamiento: corticoesteroides tópicos. Queratosis obliterante Es una enfermedad infrecuente. Se reconoce en personas jóvenes; se relaciona con sinusitis y bronquiectasias. También es efecto de osteomas, estenosis del conducto auditivo externo y masas duras de cerumen. Consiste en la formación de tapones de queratina que ocluyen el CAE, junto con una membrana timpánica engrosada y la presencia de granulaciones. Aunque esta alteración es asintomática, en ocasiones produce otalgia aguda e intensa. Casi siempre es bilateral y provoca hipoacusia de tipo conductivo, razón por la cual muchas veces se diagnostica durante el aseo del CAE. Esta enfermedad se puede controlar con limpieza periódica e irrigaciones del CAE con agua oxigenada, dos a tres veces a la semana. Aunque se ha utilizado también el sinónimo de colesteatoma del CAE, Piepergerdes (1980) considera que se trata de entidades diferentes. Los pacientes con colesteatoma del CAE sufren dolor crónico de moderada intensidad, unilateral y acompañado de otorrea. Tienen una membrana timpánica normal y las alteraciones consisten en una erosión localizada en la pared inferior del conducto, con periostitis y secuestros óseos. El tratamiento incluye la extirpación quirúrgica,para prevenir su avance y la mayor erosión ósea. Cambios seniles en el oído externo Se ha identificado degeneración de las fibras elásticas de la dermis durante la vejez, así como la disminución de la cantidad de colágena; estos cambios hacen que el tejido pierda elasticidad y fuerza, factores predisponentes para que la porción cartilaginosa del conducto se colapse total o parcialmente. Schow y Randolph (1979) señalan una frecuencia de colapso del CAE de 36% en personas de 70 a 80 años de edad. Esta oclusión parcial produce una disminución de la audición de tonos agudos. Los colapsos totales también interfieren con la audición de frecuencias graves. El tratamiento incluye la aplicación de moldes y algunas veces plastia de CAE, con eliminación de una porción cartilaginosa de la concha y la pared posterior del CAE. El autor ha obtenido buenos resultados en una serie de ocho casos. MEMBRANA TIMPÁNICA MIRINGITIS BULOSA Se relaciona con la presencia de infecciones de las vías respiratorias superiores. Algunos agentes son: Mycoplasma pneumoniae, parainfluenza I y II, influenza A, B y C, adenovirus, virus sincitial respiratorio, psitacosis, polio II y III, Echo 9 y 16, rubeola, coxsackie B6 y herpes simple. Los enfermos refieren otalgia intensa y el CAE puede mostrar unas bulas hemorrágicas que afectan a la membrana timpánica. En 60 a 70% de los casos se ha señalado la presencia de hipoacusia sensorineural relacionada con esta entidad, que mejora en 60% de los casos. El tratamiento consiste en drenaje de las vesículas hemorrágicas, con cuidado de no perforar la membrana timpánica. PERFORACIÓN TRAUMÁTICA DE LA MEMBRANA TIMPÁNICA La frecuencia de perforaciones traumáticas de la membrana timpánica es elevada. Entre las causas más comunes figuran la introducción de cuerpos extraños al CAE, traumatismos directos del pabellón auricular con la mano abierta, deportes acuáticos (buceo) y fracturas del hueso temporal. Durante la exploración es habitual encontrar pequeños coágulos de sangre a lo largo de la laceración. ERRNVPHGLFRVRUJ Capítulo 4 Hiperplasia angiolinfoide con eosinofilia es una enfermedad rara que se caracteriza por la presencia de lesiones proliferativas benignas compuestas de conductos vasculares e infiltrado subyacente con linfocitos y eosinófilos. Las lesiones suelen aparecer en la región periauricular. En 50% de los casos se reconocen lesiones múltiples; el término lo introdujeron Wells y Whimster (1969). El tratamiento se basa en operación con láser e inyecciones intralesionales de esteroides, interferón 2α o agentes citotóxicos. 62 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 4 Durante las primeras dos semanas de la perforación se recomienda realizar revisiones periódicas, sin introducir agua al oído externo mediante el uso de algodón al que, durante el baño, se le aplica un poco de vaselina sólida. La mayor parte de estas perforaciones, cuando son pequeñas y no se agrega algún proceso infeccioso, cierra de manera espontánea. Las perforaciones persistentes pueden requerir cauterización de los bordes con ácido tricloroacético, o nitrato de plata, y la colocación local de papel de arroz (como el de los cigarrillos), con la finalidad de crear un puente para la neoformación de la membrana timpánica. Si no se consiguen los resultados esperados, se indica una miringoplastia. MIRINGITIS CRÓNICA GRANULAR Es una inflamación crónica de la membrana timpánica, limitada a la capa epitelial. Es de causa desconocida y tiene un curso indoloro. Los síntomas referidos por los pacientes son prurito, otorrea e hipoacusia. La capa epitelial de la membrana timpánica se reemplaza con tejido de granulación. Tratamiento: gotas con antiinflamatorios y antibióticos, antibióticos sistémicos y cauterización local con ácido tricloroacético al 50%. Complicaciones: si no se trata esta entidad durante periodos prolongados puede producir estenosis del CAE, que exige medidas quirúrgicas. la lámina propia ocho a 10 veces mayor de lo normal; el subepitelio y la submucosa del tejido conectivo se engrosan de manera notable con láminas de calcio. La timpanoesclerosis se desarrolla durante muchos años. En casi 25% de los casos se limita a la membrana timpánica, en 30% al oído medio y la mastoides, y en 45% se presenta en ambos lugares. No se afecta la parte flácida de la membrana timpánica porque carece de lámina propia; no obstante, Lim ha referido que presenta cierta cantidad de tejido conectivo entre las dos capas de epitelio y, en teoría, al inflamarse podría desarrollar pequeñas placas de timpanoesclerosis. Según Schiff (1980), es probable que la timpanoesclerosis se deba a un bloqueo antigénico del mecanismo de control de la actividad fibroblástica por un proceso prolongado, el cual resulta de una producción excesiva o una menor destrucción de nueva colágena. El tratamiento temprano de los cuadros de otitis media supurativa evita la aparición de la timpanoesclerosis y la posible hipoacusia secundaria debida a afectación de la cadena osicular y los tendones del estribo y el tensor del tímpano. Cuando hay hipoacusia, el tratamiento es quirúrgico, y consiste en la eliminación de las placas que se encuentran en el oído medio. Si se altera la platina del estribo se recomienda tan sólo movilizarla y, en caso de aumentar la audición, practicar una estapedectomía en un segundo tiempo. Las placas de timpanoesclerosis en la membrana timpánica rara vez tienen importancia clínica y, si se encuentran durante una timpanoplastia, se recomienda extirparlas para reducir la posibilidad de falla en la integración del injerto, secundaria al deficiente riego que tienen estas placas. TIMPANOESCLEROSIS La inducción de timpanoesclerosis en animales de experimentación, posterior a una inflamación o infección del oído medio o de la membrana timpánica, sugiere que esta anomalía es secundaria a una reacción tisular inadecuada, aunada a una alteración inmunitaria en la respuesta del tejido local. En 1734, Cassebohm describió esta entidad por primera vez y von Troltsch (1869) realizó una semiología más amplia de esta afección, a la que dio el término de esclerosis. Zöllner (1956) introdujo la denominación timpanoesclerosis, tras indicar que existía una alteración en la lámina propia. En estos individuos hay invariablemente antecedentes de episodios de otitis medias, con aumento de la actividad de la capa fibrosa de la membrana timpánica y disminución de su adaptabilidad y elasticidad. Hay una mayor cantidad de colágena, con degeneración hialina subsecuente de la capa del estroma fibroso y reducción del número de glándulas, que hace que el epitelio de la mucosa sea cuboidal. Este proceso puede ocurrir en todas las superficies del oído medio (membrana timpánica, cadena de huesecillos, promontorio, otros). La timpanoesclerosis limitada a la membrana timpánica produce curvas aplanadas en la impedanciometría. La frecuencia de timpanoesclerosis secundaria a otitis media es de 5 a 10%. En 60 a 80% de los casos se relaciona con oídos secos y en 15 a 20% con colesteatoma. En esta alteración se observa un engrosamiento de TUMORES DEL OÍDO EXTERNO TUMORES BENIGNOS Seudoquiste endocondral auricular Engel (1966) ha utilizado el término seudoquiste auricular para describir una lesión quística endocondral, con la presencia de líquido de composición similar al plasma. Carece de cápsula epitelial. También se lo conoce como quiste idiopático benigno por condromalacia, predomina en la comunidad china y en el sexo masculino (4:1). Aparece entre los decenios tercero y cuarto de la vida y su origen se relaciona con antecedente de traumatismos crónicos y de bajo grado, así como con una displasia embrionaria congénita del cartílago auricular. Su tratamiento es quirúrgico e incluye el drenaje y compresión de la piel al cartílago a través de puntos transfictivos con seda 2-0. La simple aspiración con aguja se vincula con recurrencias. Se recomienda extirpar sólo la pared anterior, ya que la remoción de todo el seudoquiste cartilaginoso puede producir un pabellón auricular caído por pérdida del apoyo. El antecedente de traumatismos menores auriculares puede observarse hasta en 40 a 50% de los casos. Al pa- ERRNVPHGLFRVRUJ Oído externo recer, se liberan enzimas lisosómicas de los condrocitos o hay sobreproducción de glucosa–aminoglucanos. Diagnóstico diferencial: quistes sebáceos, quistes dermoides y hematoma auris. Quistes sebáceos Quistes incisionales Son casi siempre yatrógenos, posteriores a incisiones auriculares. Consisten en la introducción de epitelio escamoso en la región subcutánea. Las glándulas sebáceas o sudoríparas pueden llenar estos quistes de secreción. El tratamiento es quirúrgico. Quistes dermoides Son quistes congénitos, compuestos por una pared fibrosa cubierta por un epitelio escamoso estratificado que contiene folículos pilosos y glándulas sudoríparas y sebáceas. Con frecuencia se encuentran en la región retroauricular (figura 4–7). Figura 4–7. Quiste dermoide de la región retroauricular. Hemangiomas a) Capilar: posee una coloración rosácea a purpúrea; crece durante la infancia y se estabiliza en la adolescencia. Tratamiento: observación; en algunos casos se justifica el uso de dióxido de carbono o electrólisis. b) Cavernoso: se presenta como una lesión lobulada irregular, de color rojo tinto. La lesión crece con rapidez durante los primeros años de la vida y tiende a la regresión después del quinto año de vida. Para lesiones persistentes está indicada la extirpación quirúrgica, el uso de dióxido de carbono o el láser de argón. El empleo de bloqueadores β (propanolol) se vincula con disminución del tamaño de las lesiones. c) Hemangioma compacto: representa un crecimiento encapsulado de una masa alveolar firme dentro de los tejidos subcutáneos. Es una lesión rara y se reconoce en la concha del pabellón auricular (figura 4–8) o en regiones retroauriculares. Su tratamiento es la escisión quirúrgica. d) Linfangiomas: son similares a los hemangiomas, salvo porque sus conductos contienen linfa. El tratamiento es igual al de los hemangiomas. Figura 4–8. Hemangioma de tipo compacto que apareció en la concha del pabellón auricular. ERRNVPHGLFRVRUJ Capítulo 4 Son quistes de retención de las glándulas sebáceas. Las más de las veces son de consistencia blanda y móviles. Tratamiento: quirúrgico. 63 63 64 Oído, nariz, garganta y cirugía de cabeza y cuello Hiperplasia angiolinfoide con eosinofilia del conducto auditivo externo Capítulo 4 Kimura la describió en 1948. Es más frecuente en países asiáticos y 85% de los casos se presenta en adultos jóvenes. Consiste en numerosos nódulos subcutáneos, que predominan en la mejilla, axila y regiones antecubital e inguinal. En el plano histológico se distingue por la presencia de lesiones vasculares con predominio linfoide e infiltrado eosinófilo. Lesiona también la región periauricular y los nódulos son pruriginosos, eritematosos y tienden a presentar hemorragia por irritación. Causa: es efecto al parecer de un proceso inflamatorio de origen desconocido. Diagnóstico diferencial: sarcomas, granuloma eosinófilo, linfoma maligno, granuloma piogénico, hamartoma angiomatoso linfoide, angiosarcoma y reacción persistente a picadura de insectos. Tratamiento: escisión local mediante láser de CO2. en la región afectada. En el oído se localizan muchas veces en la zona retroauricular. En 30% de los casos, los sujetos pueden referir dolor. Estos tumores, que son encapsulados, surgen de las capas profundas de la dermis o el tejido subcutáneo. Algunos tumores muy superficiales pueden mostrar fibras musculares en los tejidos circundantes y están formados por fibras musculares planas distribuidas de modo aleatorio, que en algunas regiones son densas y contienen conductos vasculares (figura 4–10). El tratamiento es quirúrgico. Las recurrencias son aisladas y se deben a la falta de extirpación total de la tumoración. Papilomas Son raros. Por lo regular se relacionan con neurofibromatosis (enfermedad de von Recklinghausen). Tratamiento: resección quirúrgica (figura 4-9). Aparecen tanto en el pabellón auricular como en el CAE. Su origen es viral, relacionado con el grupo de los papovirus. Tienen un crecimiento en forma de coliflor. En términos histológicos muestran una hiperplasia de las capas basales y prurito dérmico. Puede haber degeneración maligna, aunque es rara y se reconoce por un mayor pleomorfismo, actividad micótica y afectación de la membrana basal. Tratamiento: escisión amplia, criocirugía o cirugía con láser de argón o CO2. Leiomiomas Mixomas Se presentan en forma ocasional; predominan en el sexo femenino (2:1) y las extremidades inferiores son el sitio preferencial. Su diagnóstico clínico es difícil debido a la falta de síntomas específicos. Algunos angioleiomiomas se han relacionado con el antecedente de traumatismo Son muy raros en el oído. Son neoplasias compuestas por mucinas y tejido conectivo que se desarrollan en tejidos subcutáneos. Son suaves, circunscritos y fluctuantes. Tratamiento: escisión quirúrgica amplia; puede presentarse degeneración maligna. Fibromas Tumores de origen glandular a) Adenoma ceruminoso: es una masa polipoide, cubierta por piel y de tamaño variable. Su estructura histológica es similar a la de las glándulas ceruminosas. Tratamiento: escisión amplia local. Figura 4–9. Fibroma del conducto auditivo externo. Figura 4–10. Micrografía que muestra la presencia de fibras musculares lisas distribuidas al azar y con conductos vasculares a lo largo (HE, 1 x 64) en un paciente con un angioleiomioma retroauricular. ERRNVPHGLFRVRUJ Oído externo Nevo de la piel Es una anomalía benigna que se identifica casi siempre en el oído externo, sobre todo en el pabellón auricular; por lo regular se presenta después de la pubertad. El más común es el intradérmico. Cuando existe duda acerca de su naturaleza benigna, por ejemplo cambio de coloración o presencia de ulceraciones en su superficie con hemorragia, se recomienda extirpación quirúrgica amplia y estudio histopatológico. Displasia fibrosa del hueso temporal La variante monoostótica de la displasia fibrosa tiene una frecuencia de afectación craneofacial de 10% y, en la forma poliostótica, de 100%. Las lesiones muestran una mayor tendencia a ser unilaterales. El hueso temporal se daña en 18% de los casos. Puede haber edema gradual y progresivo que afecta la mastoides o la porción escamosa con una protrusión preauricular que puede interferir con la movilidad de la articulación temporomandibular, o producir una progresiva obliteración de la luz del CAE. Se recomienda su valoración por medio de tomografía axial computarizada. En casi todos los casos el tratamiento es conservador. Osteomas y exostosis del conducto auditivo externo Los osteomas del CAE son lesiones pedunculadas que surgen de la sutura timpanoescamosa. Son benignos y de lento crecimiento. Pueden surgir en relación con algunos síndromes hereditarios, como el de Gardner. Desde el punto de vista histológico se distinguen por la presencia de conductos fibrovasculares, aunque Fenton (1996) señala que la presencia o ausencia de éstos no constituye un factor de diferenciación entre los osteomas y las exostosis, por lo que no pueden distinguirse mediante estudio histológico regular y se encuentran pocos osteocitos. Casi siempre son lesiones únicas que pueden ocluir el CAE. Tratamiento: resección. Las exostosis del CAE son de base ancha, por lo general múltiples, simétricas bilateralmente y afectan al hueso timpánico. Los sitios más frecuentes son las paredes anterior y posterior del CAE (figuras 4–11 y 4-12). Aunque las exostosis y osteomas del conducto se consideraban con anterioridad una misma entidad nosológica, se ha comprobado que se trata de dos alteraciones distintas. En el plano histológico, las exostosis contienen numerosos osteocitos y carecen de conductos fibrovasculares. Pueden producir hipoacusia conductiva, impactación de cerumen y otitis externas. En su etiología intervienen factores hereditarios y extrínsecos, como practicar deportes acuáticos en temperaturas inferiores a 17.5 °C, debido tal vez a la prolongada vasodilatación que sigue a la presencia de agua fría en el CAE. E MT Figura 4–11. Sitios de exostosis del conducto auditivo externo que reducen su luz en 70 a 80% cuando son múltiples; E, exostosis; MT, membrana timpánica. ERRNVPHGLFRVRUJ Capítulo 4 b) Adenoma pleomorfo (tumor mixto): rara vez se encuentra en oído externo. Es un tumor de crecimiento lento que se origina en la célula mioepitelial. Puede manifestarse en el CAE en la forma de hipoacusia conductiva y otitis externa. Las lesiones son sésiles o polipoideas, suaves, no ulcerosas, móviles y no adheridas a planos profundos. Tratamiento: resección local amplia. 65 65 66 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 4 1. De 8 mm para el cáncer basocelular primario menor de 3 cm de diámetro. 2. De 10 mm para el cáncer epidermoide menor de 3 cm de diámetro. 3. De 15 mm para lesiones recurrentes y primarias mayores de 3 cm de diámetro. Sin embargo, aun con este criterio, el porcentaje de recurrencias locales varía de 13 a 30%. Por lo tanto, se recomienda esta técnica en todos los casos de neoplasias auriculares malignas menores de 1 cm, en las que se espera obtener 87 a 90% de curación. En malformaciones múltiples o mayores de 1 cm se recomienda estudio histopatológico transoperatorio con cortes por congelamiento de los bordes de la pieza extirpada quirúrgicamente o, si es posible, eliminar la lesión mediante la técnica de Mohs, con lo que puede obtenerse una frecuencia de recurrencias locales de sólo 4%. Figura 4–12. Exostosis del conducto auditivo externo; nótese al fondo la membrana timpánica. Tratamiento: cuando las exostosis obstruyen más del 50% de la luz del CAE, o producen otitis externas frecuentes o impactación de cerumen, se recomienda el fresado quirúrgico, con cuidado de no lesionar la membrana timpánica. Tumores malignos Neoplasias malignas auriculares: constituyen 6% de todos los carcinomas de la piel. De todos los tumores que afectan al oído, el 60% se localiza en la zona auricular, 28% en CAE y 2% en oído medio. La morbididad y mortalidad de los tumores malignos auriculares aumentan en grado considerable cuando afectan CAE, mastoides, hueso temporal, parótida o mandíbula. Las áreas más afectadas son: a) Piel de la región posterosuperior del pabellón auricular. b) Hélix. c) Piel preauricular. d) Superficie posterior de la aurícula. El cáncer epidermoide es la variedad más frecuente y seis veces más común en el pabellón auricular que en el CAE; representa 55% de los casos. Lo siguen en frecuencia el cáncer basocelular (40%) y el resto se integra con melanomas, tumores de origen glandular, sarcomas, hemangioendoteliomas, y otros más. Tanto el cáncer epidermoide como el basocelular son tumores de crecimiento lento que emiten metástasis regionales y distales en forma tardía en un 5 a 10% de los casos. El tratamiento de estos tumores es quirúrgico. Los márgenes de resección recomendados son: Neoplasias malignas del conducto auditivo externo La mayor parte de estos tumores corresponde a carcinomas epidermoides y le siguen en frecuencia decreciente carcinoma basocelular, tumores de origen glandular, melanomas, paragangliomas y neurilemomas. La incidencia de carcinoma epidermoide del conducto auditivo externo es de cinco casos por millón. El pronóstico depende en general de la extensión de la lesión primaria. Su estadio se basa en hallazgos clínicos y tomográficos y, de acuerdo con el grupo de Pittsburg, consiste en: T1. Tumor limitado al conducto auditivo externo sin erosión ósea. T2. Tumor con incipiente erosión ósea, o con hallazgos radiográficos menores de 0.5 cm de afectación a partes blandas. T3. Presencia de erosión de la porción ósea del conducto auditivo externo, con afectación de partes blandas no mayor de 0.5 cm, con o sin presencia de invasión al oído medio y mastoides, y parálisis facial T4. Tumor que erosiona la cóclea, ápex petroso, conducto carotídeo, foramen yugular, duramadre o afectación de partes blandas mayor de 0.5 cm. Su tratamiento es la resección en bloque de las porciones ósea y cartilaginosa del CAE. Si se encuentra afectada la membrana timpánica, se recomienda también una mastoidectomía radical, tras valorar la resección del cóndilo mandibular y la glándula parótida. En 18 a 20% de los casos hay metástasis locorregionales; en estos casos es útil la disección radical de cuello. El porcentaje de sobrevivencia a cinco años es de 40 a 50%. La radioterapia (dosis de 60 Gy) es útil en sujetos con márgenes poco adecuados de resección o compromiso temporal profundo. Técnica de resección en bloque del CAE: 1. Incisión endoaural a lo largo de la concha del pabellón auricular y el trago para aislar el CAE del pabellón auricular. ERRNVPHGLFRVRUJ Oído externo Tumores malignos de origen glandular Las neoplasias glandulares representan 14% de los tumores primarios de oídos externo y medio. Carcinoma adenoquístico (cilindroma) Surge de las glándulas ceruminosas del conducto. Es la variedad más común de los tumores malignos glandulares, pero es raro en CAE. En una revisión de 61 pacientes con tumores malignos de CAE, efectuada por Conley y Schuller (1976), 19.6% correspondió a carcinomas adenoquísticos. La edad promedio de inicio de los síntomas es de 50 años; el tumor muestra un crecimiento lento y el síntoma cardinal es otalgia, que aparece en forma temprana. En términos histológicos, el patrón cribiforme se acompaña de mejor pronóstico. Es frecuente observar recurrencias locales después de extirparlo y metástasis a distancia, sobre todo en pulmón, tardías (cinco a 30 años después del diagnóstico clínico histopatológico). Tratamiento: operación (escisión en bloque del CAE, mastoidectomía radical, parotidectomía con o sin disección de cuello), seguida de radioterapia. Adenocarcinoma ceruminoso Puede aparecer entre los 30 y 80 años de edad. No hay predilección por sexo. El síntoma que más se refiere es la obstrucción del CAE. Su tratamiento es similar al del carcinoma adenoquístico (resección radical y radioterapia). Carcinoma trabecular (carcinoma de células de Merkel) Es un tumor cutáneo primario que se manifiesta en la forma de nódulos, en pacientes de 50 a 70 años de edad. Surge de las células de Merkel, que tienen origen ecto- dérmico. Las células se relacionan con folículos pilosos en la epidermis y dermis. El tumor es agresivo en forma local y puede proyectar metástasis por vía linfática. Se observa más en la cara que en oído externo. Tratamiento: escisión quirúrgica amplia; en casos diseminados o con afectación a partes profundas se puede administrar radioterapia. Melanoma maligno Puede desarrollarse tanto en el pabellón auricular como en el CAE. Es necesario sospechar su presencia en cualquier lesión pigmentada que inicie su crecimiento o experimente cambios de coloración, o ulceraciones en su superficie, con o sin tendencia hemorrágica. Siempre debe practicarse una escisión (biopsia amplia) con el objeto de reducir la posibilidad de diseminación local o sistémica de las células malignas. La evolución de estos tumores es impredecible. No está indicada la disección profiláctica de cuello, a menos que se identifiquen metástasis regionales. Es frecuente la aparición de metástasis a distancia durante el transcurso de esta enfermedad, en especial al pulmón, aunque también se presentan en forma tardía. Sarcomas Son tumores malignos de origen mesodérmico, compuestos de células de crecimiento rápido que se asemejan al tejido conectivo. En el oído externo se pueden presentar diferentes variedades de sarcomas, como fibrosarcoma, condrosarcoma, rabdomiosarcoma y linfosarcoma. Por fortuna, estos tumores son muy raros. Aparecen a cualquier edad, pero predominan entre los 30 y 50 años de edad. Crecen con gran rapidez y su pronóstico depende del tipo histológico de la tumoración y su grado de diferenciación. En general, tienen una evolución agresiva y emiten metástasis en forma temprana. Tratamiento: extirpación en bloque de la lesión; en algunos casos pueden estar indicadas la quimioterapia y la radioterapia. Tumores metastásicos Aunque son muy raros, con menos de 10 casos publicados, Vasileradis (2013) publicó una lesión polipoidea del conducto auditivo externo secundaria a una metástasis de un adenocarcinoma broncógeno en una mujer de 62 años de edad. BIBLIOGRAFÍA Adamson P, McGraw B, Tropper G: Otoplasty: critical review of clinical results. Laryngoscope 1991;101:883–888. Altmann F: Congenital atresia of the car in man and animals. Ann Otol Rhinol Laryngol 1955;64:824–827. Arriaga M, Curtin H, Takahashi H, Hirsch B: Staging proposal for external auditory meatus carcinoma based on preoperative clinical examination and computed tomographic findings. Ann Otol Rhinol Laryngol 1990;99:714–721. Austin J, Stewart K, Fawzi N: Squamous cell carcinoma of the external auditory canal. Ar Otolaryngol 1994;120:1228– 1232. Bailin PL, Levine HL, Wood BG, Tucker HM: Cutaneous carcinoma of the auricular and periauricular region. Ar Otolaryngol 1980;106:692–696. Bartlett RC, Otis RD: Multiple congenital neoplasms of soft tissues. Report of 4 cases in one family. Cancer 1961;14:913–920. ERRNVPHGLFRVRUJ Capítulo 4 2. Incisión retroauricular. 3. Aticomastoidectomía. 4. Timpanotomía posterior con exposición del trayecto del nervio facial. 5. Fracturas controladas a través de pequeñas perforaciones con la fresa de las paredes posterior, inferior y anterior del CAE, y empleo subsecuente de osteótomos de 2 mm. 6. Remoción de la pieza que contiene las porciones cartilaginosa y ósea de CAE, membrana timpánica y martillo. El defecto puede cubrirse con fascia temporal y un injerto libre de piel, o bien un colgajo cervical posterior miocutáneo. 67 67 68 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 4 Batson JM: Calcification of the ear cartilage associated with the hypercalcemia of sarcoidosis. N Eng J Med 1961;265:876–877. Bernstein L, Nelson R: Replanting the severed auricle. Ar Otolaryngol 1982;108:587–590. Bochdalek: Physiologische verknocherung der aurecula. Prag. Vierteljahrschr 1866;89:33–46. Brook I: Bacterial flora of stethoscopes’ ear pieces and external otitis. Ann Otol Rhinol Laryngol 1997;106:751–2. Brook I, Coolbaugh J: Flora of the ear canal. Laryngoscope 1984;94:963–965. Bumsted RM, Ceilley RI: Auricular malignant neoplasms. Ar Otolaryngol 1982;108:225–231. Bumsted RM, Ceilley RI, Panje W, Crumley RL: Auricular malignant neoplasms. Ar Otolaryngol 1981;107:721–724. Calhoun K: Branchiogenic cyst of the first branchial groove type II. Ar Otolaryngol 1987;113:780–782. Cassini A: Diffuse otitis extern. Ann Otol Rhinol Laryngol 1977;86(Sup. 39):1–16. Chandler JR: Partial occlusion of the external auditory meatus: its effect upon air and bone conduction acuity. Laryngoscope 1964;74:22–54. Chandler JR: Malignant external otitis. Further considerations. Ann Otol Rhinol Laryngol 1977;86:417–427. Choi S, Lam K, Chan K et al.: Endochondral pseudocyst of the auricle in Chinese. Ar Otolaryngol 1984;110:892–796. Cohen IK: Collagen synthesis in human keloid and hypertrophic scar. Surg Forum 1971;22:488–489. Condon VR, Allen RP: Congenital generalized fibromatosis. Radiology 1961;76:444–448. Conley J, Schuller DE: Malignancies of the ear. Laryngoscope 1976;86:1147–1163. Conley J: Management of the ear canal in head and neck surgery. Ar Otolaryngol 1985;111:90–92. Converse JM: Reconstruction of the auricle. Plast Reconstr Surg 1958;22:150–163. Corberand J, Nguyen F, Fraysse B, Enjalbert L: Malignant external otitis and polymorphonuclear leukocyte migration impairment. Ar Otolaryngol 1982;108:122–124. Daramola O, Chun R, Kerschner J: Surgical management of auricular infantile hemangiomas. Otolaryngol Head Neck Surg 2013;138(1):72-75. Debain J, Siarted J: Osteomas of the external auditory canal. Ann Otol Rhinol Laryngol 1979;88:566–573. Dehner LP, Chen KTK: Primary tumors of the external and middle ear. Ar Otolaryngol 1980;106:13–19. De la Cruz A, Linthicum FH, Luxford WM: Congenital atresia of the external auditory canal. Laryngoscope 1985;95:421–427. Denia A, Perez F: Extracanalicular osteomas of the temporal bone. Ar Otolaryngol 1979;105:706–709. DiBartolomeo JR: Exostoses of the external auditory canal. Ann Otol Rhinol Laryngol 1979:88(Sup. 61). DiBartolomeo JR: The petrified auricle: comments on ossification, calcification and exostoses of the external ear. Laryngoscope 1985;95:566–576. Driscoll PV, Ramachandrula A, Drezner DA et al.: Characteristics of cerumen in diabetic patients: a key to understanding malignant external otitis? Otolaryngol Head Neck Surg 1993;109:676–679. Duhig J, Ayer J: Vascular leioinyoma. A study of 61 cases. Ar Pathol 1959;68:424–430. Engel D: Pseudocysts of the auricle in Chinese. Ar Otolaryngol 1966;83:197–202. Escajadillo JR, Estrada PE, Fernández de Lara I, Alatorre G: Exostosis del conducto auditivo externo. Rev Méd La Salle 1980;1:122–133. Fenton JE, Turner J, Fason PA: A histopathologic review of temporal bone exostoses and osteomata. Laryngoscope 1996;106:624–628. Finn D, Buchalter I, Sarti E: First branchial cleft cysts: clinical update. Laryngoscope 1987;97:136–140. Flom G, Grepp D: First branchial groove anomaly type I. Ar Otolaryngol 1988;114:574–577. Flores TC, Ruggles RL: Ceruminous adenoma. Ar Otolaryngol 1980;106:306–308. Fujimori R: Sponge fixation method for treatment of early scars. Plast Reconst Surg 1968;42:322. Fukyda O: The microtic ear: survey of 180 cases in 10 years. Plast Reconstr Surg 1973;53:458–463. Ghanem T, Rasamny JK, Park S: Rethinking auricular trauma. Laryngoscope 2005;115:1251-1255. Giffin C: The wrestler’s ear (acute auricular hematoma). Ar Otolaryngol 1985;111:161–164. Giles W, Iverson, K, King J, Hill F, Woody T: Incision and drainage followed by mattress suture repair or auricular hematoma. Laryngoscope 2007;117:2097-2099. Glasscock ME III, Schwaber MK, Nissen AJ, Jackson CG: Management of congenital ear malformations. Ann Otol Rhinol Laryngol 1983;92:504–509. Goodwin WJ, Jesse RH: Malignant neoplasms of the external auditory canal and temporal bone. Ar Otolaryngol 1980;106:675–679. Graham MD: Osteomas and exostoses of the external auditory canal. Ann Otol Rhinol Laryngol 1979;88:566–572. Grundfast K, Camilon F: External auditory canal stenosis and partial atresia without associated anomalies. Ann Otol Rhinol Laryngol 1986;95:505–509. Guillespie M, Francis H, Chee N, Eisele D: Squamous cell carcinom of the temporal bone. Ar Otolaryngol 2001;127:803-807. Hagiwara H, Sugizaki LJ: Angioleiomyomas of the skin. J Dermatol Urol (Japan) 1933;34:126–133. Henderson J, Salama D, Blanchaert R: Management of auricular hematoma using a thermoplastic splint. Ar Otolaryngol 2000;126:888–890. Hernández M, Escajadillo JR, Rico F: Pericondritis aural. Presentación de un caso. An Soc Mex Otorrinolar 1981;26:24–27. Hicks G: Tumors arising from the glandular structures of the external auditory canal. Laryngoscope 1983;93:326–340. Hoffman R, Shepsma D: Bullous myringitis and sensorineural hearing loss. Laryngoscope 1983;93:1544–1545. Ishimoto S, Ito, Yamasuba T, Kondo K, Karino S: Correlation between microtia and temporal bone malformation evaluated using grading systems. Ar Otolaryngol 2005;131:326-329. Jahrsdeorfer R: Congenital malformations of the car. Ann Otol Rhinol Laryngol 1980;89:348–352. Jones R, Milazzo J, Serafin M: Ofloxacin otic solution for treatment of otitis external in children and adults. Ar Otolaryngol 1997;123:1193–1200. Kalciouslee M, Durmaz R, Ozturan O, Bayindir Y, Biolog S: Does cerumen have risk for transmission of hepatitis B. Laryngoscope 2004;114:577-580. ERRNVPHGLFRVRUJ Oído externo Saito R, Matsumura M, Takata N et al.: Histopathologic study of congenital aural atresia in the human embryo. Ar Otolaryngol 1981;107:215–220. Sando I, Harada T, Okano Y et al.: Temporal bone histopathology of necrotizing external otitis. Ann Otol Rhinol Laryngol 1981;90:109–115. Sandstrom J, Jacobson K, Wikland E, Ringertz S: Pseudomonas aeruginosa in external otitis. Ar Otolaryngol 1996;122:833– 836. Sapci T, Ugur G, Agrali N, Akbulut U: Giant cholesteatoma of the external auditory canal. Ann Otol Rhinol Laryngol 1997;106:471–473. Sayfield DL, Fraser DJ: Persistence of Pseudomonas aeruginosa in chlorinated swimming pools. Can J Microbiol 1980;76:350–355. Schiff M, Catanzaro A, Poliquin J, Ryan F: Tympanoesclerosis. Ann Otol Rhinol Laryngol 1980;89(Sup.70):1–16. Schiff M: Tympanosclerosis: clinical implications of the theory of pathogenesis. Ann Otol Rhinol Laryngol 1983;92:635–639. Schow RL, Randolph L: Prevalence of collapsible ear canals in an elderly population. J Acoust Soc Am 1979;66:61. Schwartzman JA, Pulec JL, Linthicum FH Jr.: Uncommon granulation of diseases of the ear. Differential diagnosis. Ann Otol Rhinol Laryngol 1972;81(3):389-93. Sércer A: Beitrag zur kenntnis der formanomalien des äusseren Ohres. Acta Otolaryngol 1934;20:59–62. Siegart R: Combined reconstruction of congenital auricular atresia and sever microtia. Laryngoscope 2003;113:20212027. Solares P, Chan J, Koltai P: Anatomical variations of the facial nerve in the first branchial cleft anomalies. Art Otolaryngol 2003;129:351-355. Stepehs S: Osteomas growing from the mastoid cortex. Ann Otol Rhinol Laryngol 1964;82:94–95. Store M, Fulghum R: Bactericidal activity of wet cerumen. Ann Otol Rhinol Laryngol 1984;93:183–186. Stout AP: Solitary cutaneous and subcutaneous leiomyoma. Am J Cancer 1937;29:435–442. Stout AP: The painful subcutaneous tubercle (tuberculum dolorosum). Am J Cancer 1939;36:25–30. Strauss M, Zohar Y, Turani H, Laurian N: Cutaneous leishmaniasis. Ar Otolaryngol 1983;109:492–494. Sugita R, Kawamura S, Ichikawa G et al.: Microorganisms isolated from infected aural fistulas. Laryngoscope 1984;94:1468–1471. Swartz J, Wolfson R, Malowe F et al.: External auditory canal dysplasia. CT evaluation. Laryngoscope 1985;95:841–845. Talmi Y et al.: Ossified auricle in Addison’s disease. Ann Otol Rhinol Laryngol 1990;99:499. Tanzer RC: Total reconstruction of the external ear. Plast Reconstr Surg 1958;23:1–15. Thompson JW, Colman M, Williamson C, Ward PH: Angiolymphoid hyperplasia with eosinophilia of the external ear canal. Ar Otolaryngol 1981;107:316–319. Triglia J, Nicollas R, Ducroz U et al.: First branchial cleft anomalies. Ar Otolaryngol 1998;124:291–295. Vasileiradis I, Kapetanakis S, Vaseleiaidis D, Petousis A: External auditory canal mass as the first manifestation of a bronchogenic carcinoma: report of a rare case. Ann Otol Rhinol Laryngol 2013;122:378 -381. ERRNVPHGLFRVRUJ Capítulo 4 Kemink JL, Graham MD, Dolezal RF: Congenital atresia of the external auditory canal. Ar Otolaryngol 1983;109:422–424. Ketchum LD: Hypertrophic scars and keloids. Plast Reconstr Surg 1984;53:140–154. Kikura M, Hashino T, Matsumoto M, Kikawada T: Auricular seroma. Ar Otolaryngol 2006;132:1143-1147. Kimura T, Yoshimu A, Ishikara E: Unusual granulation combined with hyperplastic change of lymphatic tissue. Trans Am Acad Ophtalmol Otolaryngol 1948;37:179. Kohut RI, Lindsay JR: Necrotizing (“malignant”) external otitis histopathologic processes. Ann Otol Rhinol Laryngol 1979;88:714–720. Koonin AJ: Pre aetiology of keloids: a review of the literature and a new hypothesis. S African MJ 1964;38:913–916. Kopstein E: Otitis external: unorthodox but effective treatments. Laryngoscope 1984;94:1248. Levenson M, Parisier S, Dolitsky J, Bindra G: Ciprofloxacin: drug of choice in the treatment of malignant external otitis. Laryngoscope 1991;101:831–824. Lim C, Goh Y, Chao S, Lynne L: Pseudocyst of the auricle. Laryngoscope 2002;112:2033-2036. Lin JJ, Svoboda DJ: Multiple congenital mesenchymal tumors. Cancer 1971;28:1046–1053. Lyle JP, Cannon R: Trabecular carcinoma (Merkel’s cell carcinoma). Ar Otolaryngol 1982;108:392–395. Mader JT, Love JT: Malignant external otitis. Ar Otolaryngol 1982;108:38–40. Mann DG, Pillsbury HR: Pathologic quiz case: cat–scratch lymphadenitis. Ar Otolaryngol 1980;106:306–309. Marshall L, Gossman MA: Management of ear–canal collapse. Ar Otolaryngol 1982;108:357–361. Meurman Y: Congenital microtia and meatal atresia. Ar Otolaryngol 1952;66:873. Muraoka M, Nakai Y, Ohashi Y et al.: Tape attachment therapy for correction of congenital malformations of the auricle. Laryngoscope 1985;95:167–176. Nager GT, Holliday MJ: Fibrous dysplasia of the temporal bone. Ann Otol Rhinol Laryngol 1984;93:630–633. Naiberg J, Berger G, Hauke M: The pathologic features of keratosis obturans and cholesteatoma of the external auditory canal. Ar Otolaryngol 1984;110:690–693. Nofsinger Y, Tom L, LaRossa D et al.: Periauricular cysts and sinuses. Laryngoscope 1997;107:883–997. Paaske P, Witten J, Schwer S, Hansen S: Results in treatment of carcinoma of the external auditory canal and middle ear. Cancer 1987;59:156–160. Piepergerdes JC, Kramer BM, Behnke EE: Keratosis obturans and external auditory canal cholesteatoma. Laryngoscope 1980;90:383–391. Plester D: Tympanosclerosis. J Otolaryngol Soc 1972;3:325–326. Portmann M: The ear and temporal bone. New York: Masson Publishing, 1979:371–381. Proceedings of a round table discussion: Diagnostic and treatment of acute otitis external. Ann Otol Rhinol Laryngol 1999;108:1–23. Romo T, Sclafani A, Shapiro A: Otoplasty using the postauricular skin flap technique. Ar Otolaryngol 1994;120:1146–1150. Rubin J, Stoehr G, Yu V et al.: Efficacy of oral cyprofloxacin and rifampin for treatment of malignant external otitis. Ar Otolaryngol 1989;115:1063–1069. 69 69 70 Oído, nariz, garganta y cirugía de cabeza y cuello Yao–Shi F, Perzin KH: Nonepithelial tumors of the nasal cavity, paranasal sinuses and nasopharynx. Cancer 1974;33:1275– 1288. Work WP: Newer concept of first branchial cleft defects. Laryngoscope 1972;9:1581–1593. Zolner F: Tympanosclerosis. J Laryngol Otol 1956;70:77–85. Capítulo 4 ERRNVPHGLFRVRUJ ANOMALÍAS CONGÉNITAS DEL OÍDO MEDIO Existen diferentes tipos de anomalías congénitas del oído medio. Sin embargo, una clasificación práctica basada en datos clínicos y quirúrgicos es la de Teunissen y Cremers (1993), quienes las dividen como sigue: Clase 1: anquilosis o fijación congénita del estribo debida a: a) Fijación en la platina del estribo. b) Adhesión de la cabeza del estribo al conducto facial óseo. c) Fijación del estribo por un ligamento estapedial osificado. Clase 2: anquilosis del estribo relacionada con otra malformación congénita de la cadena osicular. Clase 3: anomalía congénita de la cadena osicular vinculada con una platina del estribo móvil. Ésta puede ser con: a) Falta de continuidad de la cadena osicular. b) Fijación epitimpánica. Clase 4: aplasia congénita o displasia intensa de las ventanas oval o redonda. Los subtipos de ésta son: a) Aplasia. b) Displasia que afecta el curso del nervio facial o que se relaciona con una arteria estapedial persistente. Estas alteraciones se han vinculado con una herencia autosómica dominante, así como una herencia ligada al cromosoma X. Sin embargo, también ocurren casos en forma espontánea. TROMPA DE EUSTAQUIO La ventilación del oído medio a través de la trompa de Eustaquio (TE) es una función primordial para equilibrar la presión atmosférica en ambos lados de la membrana timpánica. Por lo general hay leve presión negativa como resultado del flujo de gas a través de las paredes de la mucosa del oído medio y la mastoides. Esta presión es de 0.5 a 4 mm Hg. La abertura de la trompa por actividad muscular se presenta cuando la presión diferencial es de 20 a 40 mm Hg. La TE también actúa como un tubo de drenaje fisiológico del oído medio. El músculo tensor del velo del paladar es el único que abre la TE. El músculo elevador del velo del paladar no tiene un efecto demostrable en esta actividad o en la presión del oído medio; sólo su masa, junto con la del músculo pterigoideo interno, ayuda a mantener cerrada la luz de la TE. La deglución, el bostezo y los estornudos la abren. Se ha sugerido que la porción superior de la trompa de Eustaquio tiene una función más ventilatoria y su porción inferior se relaciona más con limpieza. Además, la pared posterior posee más pliegues mucosos que la pared anterior y dichos pliegues funcionan, como los cornetes nasales, para proteger y limpiar la trompa. VALORACIÓN DE LA FUNCIÓN DE LA TROMPA DE EUSTAQUIO Maniobra de Valsalva Capítulo 5 Oído medio y mastoides Consiste en forzar la entrada de aire al oído cuando el paciente se suena con las narinas cerradas. Los niños pueden aprender con facilidad esta técnica. El examinador debe observar con un otoscopio la movilidad o inmovilidad de la membrana timpánica durante esta maniobra. Maniobra de Toynbee En esta maniobra se pide al paciente que degluta mientras mantiene cerradas las narinas. El examinador observa la membrana timpánica, que tiende a retraerse en sentido medial si la TE es permeable, debido a la ligera elevación de la presión negativa que se produce al cerrar las fosas nasales. La membrana timpánica regresa a su posición normal al solicitarle al sujeto que degluta otra vez, esta vez sin presionar las narinas. 71 ERRNVPHGLFRVRUJ 72 Oído, nariz, garganta y cirugía de cabeza y cuello Otoscopia neumática Capítulo 5 Consiste en aplicar aire directamente al conducto auditivo externo (CAE) mediante una perilla y verificar si hay o no movilidad de la membrana timpánica. En condiciones normales debe reconocerse una leve movilidad de ésta (hacia atrás). Las tres maniobras descritas, aunque orientan de forma clínica la valoración de la función de la TE, distan mucho de ser métodos exactos. Impedanciometría (timpanometría) Es un método objetivo para valorar la función tubaria. Se dispone de varias pruebas para determinar dicha función: 1. Prueba de insuflación y desinsuflación. Consiste en aplicar presión al oído medio con distintas maniobras y estudiar diferentes variables, como: a) Presión forzada de abertura de la TE. b) Presión de cierre de la TE. c) Presión positiva remanente en el oído medio, con deglución, sin obstruir las fosas nasales. d) Valorar presiones positivas residuales después de aplicar presiones de –200 mm H2O. e) Abertura pasiva de la TE. f) Cambios en la presión residual durante la deglución con las fosas nasales cerradas. 2. Cantekin (1979) creó una prueba de respuesta forzada en la que se determina la abertura tubaria al evaluar los cambios de presión y flujo producidos durante la deglución al aplicar una corriente o flujo de aire continuo a través de la trompa de Eustaquio. De esta prueba se obtienen dos medidas: una de resistencia tubaria pasiva y otra activa. 3. Presiones obtenidas durante la timpanometría de –100 mm H 2 O o menores se consideran patológicas. Asimismo, curvas de tipos C y B se relacionan con alteración tubaria. Cuando se obtienen en el preoperatorio presiones positivas, en 90% de los casos hay buena aireación del tímpano durante el posoperatorio. Cuando las presiones son negativas se sugiere evitar materiales artificiales para reconstrucción osicular, ya que los pacientes tienen alto riesgo de sufrir alguna extrusión o infección posoperatoria. TROMPA DE EUSTAQUIO PERMEABLE EN FORMA ANORMAL Esta alteración se presenta en pacientes con anomalías neuromusculares, como accidentes cerebrovasculares, esclerosis múltiple, poliomielitis o enfermedad de Parkinson, y en quienes han perdido mucho peso por enfermedades crónicas o artritis reumatoide. Una tercera parte de las mujeres con este problema tiene antecedentes de consumo de estrógenos; esta relación también se ha identificado en varones que reciben este tratamiento hormonal como parte de la terapéutica para el carcinoma prostático. Se observa disminución de los tejidos blandos alrededor del orificio tubario. Síntomas: egofonía (el paciente refiere que escucha su voz con un volumen más alto de lo normal); además, tiene sonidos extraños (tronidos) durante la respiración. Se puede obtener alivio temporal al ponerse en decúbito dorsal o flexionar el cuerpo y colocar la cabeza entre las rodillas. Cualquier trastorno que cause congestión nasal, como el catarro común, también produce alivio temporal. Durante la exploración otológica se advierte que la membrana timpánica se mueve hacia dentro y afuera en forma sincrónica con la respiración al pedir al paciente que ocluya una narina y respire con rapidez por la otra con la boca cerrada. Tratamiento 1. Aumento de peso. 2. Producir de modo artificial una reacción inflamatoria alrededor del orificio tubario, mediante irrigación con solución de ácido bórico y salicílico o cauterización con nitrato de plata, para lo cual se efectúa previamente cateterismo en el orificio tubario, procedimiento que se facilita con un endoscopio nasal de 25°. 3. Un tratamiento más definitivo consiste en la inyección local de teflón o silicona alrededor del orificio tubario. 4. La inyección de grasa alrededor del orificio tubario y la ligadura endoscópica del mismo con poliglactina 5-0 tambien son de utilidad con una mejoría subjetiva de la egofonía hasta en un 90%. OBSTRUCCIÓN DE LA TROMPA DE EUSTAQUIO La obstrucción de la TE puede ser parcial o total, funcional o anatómica, lenta o súbita. Todas producen aumento de la presión negativa en el oído medio, con o sin derrame. Algunas causas de obstrucción tubaria son: 1. Infecciosas (adenoamigdalitis, faringitis, sinusitis, catarro común). 2. Alérgicas (rinitis alérgica). 3. Traumáticas (fracturas del hueso temporal que provoquen obstrucciones anatómicas de la TE). 4. Neurógenas (parálisis de los músculos del paladar, accidentes cerebrovasculares, esclerosis múltiple). 5. Neoplásicas (hipertrofia adenoamigdalina, hiperplasia de las bandas faríngeas, papilomas, pólipos, angiofibromas, linfomas, carcinomas). 6. Iatrogénicas (adhesiones o estenosis de la nasofaringe secundarias al raspado de adenoides o extirpación de tumores). Las obstrucciones crónicas de la TE se acompañan de la acumulación de líquido con aumento de su viscosidad, que caracteriza a la otitis media secretoria. ERRNVPHGLFRVRUJ Oído medio y mastoides PALADAR HENDIDO Tratamiento 1. Reparación temprana del paladar hendido, con cuidado en las fracturas del hamulus pterygoideus o las incisiones sobre el tendón del músculo tensor del velo del paladar utilizadas para disminuir la tensión durante el cierre del paladar, ya que pueden afectar la función adecuada de la TE. 2. Colocación de cánulas de ventilación. BAROTRAUMA Ocurre cuando la presión interna del oído medio es menor que la presión atmosférica externa. Se presenta en pérdidas rápidas de altitud, por ejemplo al volar en avión o al bucear y, en general, en situaciones en que la presión diferencial es mayor de 90 mm Hg ya que, a estas presiones, la actividad muscular normal no puede abrir la TE. Edmonds y Thomas (1972) clasifican los cambios en el oído medio producidos por el barotrauma en cinco grados: 1. Inyección de la membrana timpánica. 2. Inyección con escasa hemorragia en la membrana timpánica. 3. Hemorragia aparente de la membrana timpánica. 4. Presencia de secreción en oído medio. 5. Perforación de la membrana timpánica, aunada a secreción, con o sin fracturas, y luxaciones de la cadena osicular. Se ha demostrado la presencia de hipoacusia neurosensorial en el barotrauma y entre las posibles causas que la explican se encuentran las siguientes: a) Distorsión y rotura del laberinto membranoso. b) Perforación de la ventana redonda. c) Hemorragia intralaberíntica. d) Formación de burbujas de aire. e) Hidropesía endolinfática secundaria. En un estudio de Axelsson (1979) en cobayos, los barotraumas por presiones positivas se relacionaron más con hemorragias perivasculares en la cóclea, acompañadas de hundimientos en la membrana basal. Por otro lado, las presiones negativas produjeron más perforaciones timpánicas y hemorragias en la escala vestibular del oído interno. El tratamiento con oxígeno hiperbárico en pacientes con ventilación mecánica se vincula con una elevada incidencia de complicaciones del oído medio, en especial de otitis medias serosas. Hay evidencia de que a mayor neumatización del oído medio y la mastoides se observa menor riesgo de barotrauma sintomático. Estudios de Uzun (2002) señalan que oídos con neumatización mayor de 34.7 cm 2 se relacionan con baja incidencia de barotrauma y con áreas de 13.6 cm 2 la incidencia aumenta de forma significativa entre los buceadores. Tratamiento Durante el periodo agudo se administran corticoesteroides sistémicos, descongestionantes y antihistamínicos. En caso de secreción en el oído medio, la timpanocentesis produce una mejoría rápida de los síntomas. No se requieren antibióticos, a menos que haya alguna infección secundaria. Asimismo, se recomienda al paciente que efectúe maniobras de Valsalva frecuentes. Profilaxis: cuando hay una infección de vías respiratorias superiores es preferible novolar, bucear o realizar alpinismo. OTITIS MEDIA GENERALIDADES La otitis media es una inflamación del oído medio que puede tener o no origen infeccioso. La secreción (derrame) es una colección de líquido en el oído medio, que puede ser serosa, mucoide, purulenta, hemorrágica o indeterminada. La otorrea consiste en la salida de líquido ERRNVPHGLFRVRUJ Capítulo 5 Los pacientes con paladar hendido tienen una frecuencia elevada de otitis media con derrame, que se inicia desde épocas tempranas en lactantes sin reparación del paladar. Las pruebas clínicas sugieren que la patogénesis está relacionada en forma directa con el defecto inherente que presentan estos enfermos en el mecanismo de abertura tubaria, debido a un colapso persistente de su luz, con poca elasticidad del cartílago. Bluestone (1972) denominó a este proceso obstrucción funcional de la TE. Mediante técnicas radiográficas, este autor demostró la presencia de una obstrucción retrógrada del flujo de líquido en pacientes no sometidos a plastia del paladar; este trastorno mejora en 50% sus síntomas después de la corrección quirúrgica del defecto del paladar. Fara y Dvork (1970) han demostrado, desde los puntos de vista histológico y electromiográfico, que en los músculos tensor y elevador del velo del paladar de recién nacidos con paladar hendido está disminuido el tejido contráctil y aumentado el conectivo. Holborow (1962) también señaló la presencia de una inserción anómala del músculo tensor del velo del paladar, que resulta en una disfunción del sistema de dilatación tubaria: esto se ha comprobado mediante observación directa con endoscopia flexible, en la que sólo 58.5% de los pacientes con paladar hendido presenta una abertura tubaria durante la deglución. Todo ello sugiere que el factor predisponente en la etiopatogénesis de la otitis media, con secreción en pacientes con paladar hendido, es una obstrucción funcional de la TE relacionada con una deficiente dilatación tubaria por el músculo tensor del velo del paladar durante la deglución. 73 73 74 Oído, nariz, garganta y cirugía de cabeza y cuello (secreción) a través de una membrana timpánica no intacta. novena semana de la enfermedad. Se caracteriza por un infiltrado en el que predominan células redondas (monocitos, linfocitos). Hay una extensa fibrosis, proliferación de la mucosa y aumento de la formación de glándulas. Estas otitis medias se clasifican también como sigue: CLASIFICACIÓN a) Otitis media sin secreción o perforación de la membrana timpánica. b) Con secreción y sin perforación de la membrana c) Con perforación de la membrana, con o sin secreción. Incluye tres fases: a) Inicio: por lo general es abrupto y corto; los síntomas pueden tener un desarrollo más lento e insidioso, o presentarse de modo repentino. b) Periodo sintomático. c) Periodo de resolución. OTITIS MEDIA SEROSA (OMS) De manera arbitraria se considera que el proceso agudo corresponde a las tres primeras semanas tras el inicio de la enfermedad. En este periodo hay infiltrado leucocitario extenso con edema de la submucosa. Es una enfermedad más común en niños y se relaciona con problemas de obstrucción tubaria, alergias, procesos infecciosos de las vías respiratorias superiores, anomalías anatómicas como paladar hendido y algunos trastornos inmunitarios. La escuela de Politzer había considerado la secreción de la otitis media serosa (OMS) como un trasudado. Sin embargo, Senturia (1958) mostró que contenía una cantidad considerable de proteínas unidas a carbohidratos, además de bacterias (a menudo muertas) y muchos leucocitos, lo que indicaba que se trataba de un verdadero exudado inflamatorio. Fisiopatogénesis: se observa una reacción inflamatoria universal e inespecífica; en los estadios tempranos son obvios la dilatación capilar, un leve infiltrado polimorfonuclear compuesto por neutrófilos y eosinófilos ocasionales, además de incremento de la permeabilidad vascular (figura 5–1). Los macrófagos, neutrófilos, linfocitos y células plasmáticas son elementos Otitis media subaguda Se encuentra entre el final de la fase aguda y el inicio del proceso crónico. Se presenta entre la cuarta y octava semanas del inicio de la enfermedad, por lo que dura un total de nueve semanas (de la tercera a la duodécima). En términos histológicos, tiene elementos celulares de las fases aguda y crónica. Otitis media crónica E Moderada Proliferación celular Grave Es aquella que persiste más allá del tiempo esperado para la resolución de los síntomas. Se inicia a partir de la D F H G A C B Mínima Capítulo 5 Otitis media aguda B A 1er. día G C D 3 días EF H 1a. 2a. 3a. 4a. sem. sem sem. sem. 8a. sem. Tiempo (posobstrucción) A = edema B = dilatación celular C = neutrófilos E = hiperplasia glandular F = linfocitos G = macrófagos Figura 5–1. Gráfica que muestra los diferentes fenómenos celulares que se presentan después de la obstrucción experimental del orificio tubario. ERRNVPHGLFRVRUJ Oído medio y mastoides 1. Sinusitis agudas y crónicas. 2. Hiperplasia linfoidea de la nasofaringe inducida por tabaquismo. 3. Hipertrofia adenoidea. 4. Hemotímpano postraumático. 5. Barotrauma. 6. Estado posterior a una otitis media aguda. 7. Posmaxilectomía radical o medial. 8. Uso de sondas nasogástricas. 9. Aspergilosis alérgica. 10. Posterior a operación del paladar. 11. Granulomatosis de Wegener. 12. Abscesos parafaríngeos. 13. Secundaria a anestesia general con óxido nitroso. 14. Enfermedades neoplásicas como: a) Tumores de nasofaringe. b) Tumores del espacio parafaríngeo. c) Tumores nasales. 15. Causa indeterminada. Diagnóstico Los pacientes con OMS presentan hipoacusia conductiva y sonidos extraños (tronidos) al bostezar y deglutir. Los padres notan a menudo que el niño aumenta el volumen de la televisión más de lo normal. Además, puede haber egofonía. En algunos pacientes se ha identificado vértigo moderado de tipo posicional. A la exploración (otoscopia) se reconoce una membrana timpánica opaca, retraída, con pérdida del reflejo luminoso y sin movilidad, o disminuida, en la otoscopia neumática. En otras ocasiones, la membrana timpánica presenta eritema con ingurgitación a su alrededor o, cuando hay hemosiderina en la secreción, puede tener coloración azul oscuro. En casos típicos se observan burbujas por detrás de la membrana timpánica, sobre todo al realizar la maniobra de Valsalva. Sin embargo, debe tenerse presente que la otoscopia no es siempre el método más indicado para detectar la OMS, ya que es posible que en 50 a 60% de los casos no se encuentren los datos característicos descritos. La timpanometría tiene valor diagnóstico: curvas de tipo C2 (–200 a –350 mm H2O) y tipo B (planas) son características de OMS. Por otro lado, la persistencia o ausencia del reflejo estapedial es poco específica en la OMS. El estudio audiológico muestra hipoacusia de tipo conductivo alrededor de los 30 dB, sobre todo en frecuencias graves. En todo paciente con OMS, y en particular si es adulto, se debe solicitar rinoscopia posterior o nasofaringoscopia. La radiografía lateral de cráneo ayuda en la valoración de esta región, en especial en niños con hipertrofia adenoidea. En pacientes con infecciones repetidas de las vías respiratorias superiores (nasofaringitis, otitis, sinusitis) debe buscarse alguna deficiencia de anticuerpos o un síndrome de cilio inmóvil; en niños que también presenten pólipos nasales, debe descartarse la posibilidad de fibrosis quística del páncreas. Sade (2003) ha descrito cuatro estadios de las otitis medias con secreción: Estadio I. Escasa secreción del oído medio que desaparece en días o no más de tres meses. No requiere tratamiento. Estadio II. Secreción del oído medio que persiste durante seis meses o más; a menudo requiere la colocación de cánulas de ventilación. Estadio III. Oídos con cuadros recurrentes de secreción en el oído medio, incluso posterior a la colocación de cánulas de ventilación. Se describe como una otitis media serosa o secretoria persistente. Estadio IV. Son oídos que necesitan en varias ocasiones colocación de cánulas de ventilación y representan una real otitis media secretoria crónica; muchas veces se vinculan con retracción de la membrana timpánica. Tratamiento Varía según sea la causa de la OMS. En infecciones recurrentes adenoamigdalinas, se recomienda el tratamiento quirúrgico. Los problemas alérgicos pueden tratarse con antihistamínicos, descongestionantes y, en casos difíci- ERRNVPHGLFRVRUJ Capítulo 5 importantes de las secreciones serosas y se encuentran en diferentes tipos de respuestas inmunitarias. La secreción de la otitis media serosa (OMS) contiene enzimas bactericidas y bacteriostáticas e inmunoglobulinas. En las secreciones de pacientes con OMS se ha observado activación del factor C3 del complemento, así como inhibidores de la proteasa en suero (antitripsina α1, antiquimiotripsina α1 y macroglobulina α2). Al parecer, el aumento de la permeabilidad vascular observada en la OMS se relaciona con la formación de bradicinina inducida por la calicreína y otras proteasas lisosómicas que se han identificado en estas otitis. De María (1984) encontró que en 81% de los pacientes con OMS estudiados el factor reumatoide era positivo. Estudios realizados mediante pruebas de aglutinación señalan que es muy probable que este factor se produzca localmente en el oído medio. Este hecho confirma la teoría de un posible fondo inmunitario en el desarrollo de las OMS. Casi en 80% de las secreciones serosas se ha detectado una actividad específica de anticuerpos; la IgG es la más frecuente, aunque también se encuentra IgA. Otros estudios han considerado el factor activador plaquetario (FAP), así como las prostaglandinas y las leucotrinas, en la producción de las otitis medias serosas. El FAP se libera de los neutrófilos, plaquetas, eosinófilos, macrófagos, mastocitos y las células endoteliales vasculares. Sus funciones incluyen la inducción de la permeabilidad microvascular, quimiotaxis, broncoconstricción, aumento de la secreción de moco en las vías respiratorias, e intervienen en la hipotensión y el estado de choque. En consecuencia, el FAP puede afectar la función de la trompa de Eustaquio al disminuir su microcirculación y elevar su presión de abertura, además de reducir en forma parcial o completa la actividad ciliar. La otitis media serosa también puede ser un signo de inflamación alérgica, ya que ésta se relaciona con un aumento de la concentración de eosinófilos y una liberación concomitante de proteínas catiónicas eosinofílicas en individuos con alergia. Algunas de las causas vinculadas con la producción de otitis medias serosas son: 75 75 76 Oído, nariz, garganta y cirugía de cabeza y cuello les, hiposensibilización. También es útil la maniobra frecuente de Valsalva. Sin embargo, la miringotomía con aspiración de la secreción y aplicación de cánulas de ventilación, introducida por Armstrong (1954), es lo que en muchos casos resuelve los problemas, sobre todo crónicos y resistentes al tratamiento conservador. Capítulo 5 OTITIS MEDIA SECRETORIA La otitis media secretoria (OSMe) se caracteriza por la presencia de una secreción crónica, casi siempre mucoide, del oído medio. La duración de esta enfermedad puede variar desde unos meses hasta varios años. En las publicaciones estadounidenses se conoce con el nombre de glue ear (oído pegajoso). Tiene además un inicio insidioso. Estadios clinicopatológicos Estadio inicial. En la lámina propia de la mucosa del oído medio existe vasodilatación vascular, neoformación de vasos e infiltración por células redondas. Aparece hiperplasia de las células basales en el epitelio con diferenciación de éstas en células de tipo caliciforme y células ciliadas. El proceso más importante en este estadio es la formación patológica de glándulas mucosas. Estadio secretor. El dato más importante en este estadio es la secreción de moco que proviene del aumento de las glándulas mucosas y células caliciformes. Esta secreción mucosa se acumula en el oído medio. La densidad de las glándulas varía de acuerdo con los diferentes segmentos del oído medio. Algunos autores consideran que el número total de glándulas es de 1 000 a 2 000 en un área mucosa de 300 mm2. Asimismo, se ha encontrado una densidad de 8 000 células caliciformes por mm2 en la región anterior al promontorio. Estadio de resorción de la secreción. La mucosa del oído medio tiene una capacidad de resorción que probablemente se incrementa cuando la mucosa presenta metaplasia. La secreción, que constituye una mezcla de exudado inflamatorio y moco, aumenta así su viscosidad debido a la absorción de su componente acuoso. Estadio degenerativo. En este periodo disminuyen tanto el exudado como la secreción mucosa. Se presenta degeneración de las glándulas, que permanecen activas sólo 10 a 15% de ellas, en comparación con el estadio secretor, en que el 90 a 95% de estas glándulas muestra actividad. Si durante este periodo se vuelven a formar glándulas del aparato respiratorio, de nueva cuenta se acumularía secreción en el oído medio y no se alcanzaría una recuperación total. De igual modo, durante este estadio, el epiteio metaplásico tiende a la normalización. Este proceso se inicia en cuanto desaparece o disminuye la intensidad del estímulo patológico que originó la OMS. Aquí es de fundamental importancia la ventilación del oído medio. Secuelas. Lo más común es que se presenten retracciones de la membrana timpánica (30%), aunque en 4% de los casos puede encontrarse resorción ósea de la pared superior del ático que predispone al desarrollo posterior de colesteatomas. La presión negativa permanente con retracción de la membrana timpánica contribuye a una posible atrofia. Pueden iniciarse placas de timpanoesclerosis, sobre todo en el periodo degenerativo, y tornarse clínicamente aparentes a los dos años o más a apartir de la desaparición de la secreción. Su frecuencia es de 30 a 35%. Otras características de las secreciones mucoides. Las secreciones mucoides tienen concentraciones altas de glucoproteínas e IgA secretoria. En general, las secreciones mucoides contienen mayor número de enzimas y son más activas que las serosas. Entre éstas se encuentran: galactosidasa β, fosfatasa ácida, manosidasa α, glucuronidasa β, glucosidasa α, fosfatasa alcalina y deshidrogenasa láctica. En el oído medio se han encontrado cultivos positivos de microorganismos diferentes a los del conducto auditivo externo en 30% de las secreciones mucoides, y 18 a 20% de las serosas. Otros autores han identificado hasta 44 y 42%, respectivamente. Formas atípicas morfológicas de las bacterias denominadas formas L parecen influir también en la cronicidad y recurrencia de esta entidad. El ácido siálico interviene de manera considerable en el control de las propiedades viscoelásticas de las secreciones mucoides. Al parecer, el sistema del complemento por la vía alterna tiene una actividad notoria en las OMS. El consumo de factores del complemento, sobre todo las fracciones 1 y 3, reduce el sistema local de defensa contra infecciones prolongadas en el oído, y sus productos de degradación contribuyen a conservar y prolongar el proceso inflamatorio. La hipersecreción de glucoproteínas se debe a los efectos biológicos que el factor de necrosis tumoral tipo a desempeña al aumentar la secreción de fosfolipasa A2, enzima que interfiere en la modulación de hipersecreción de las glucoproteínas en el moco y aumenta la liberación de ácido araquidónico. Las endotoxinas son potentes estimuladores de la secreción del factor de necrosis tumoral α, así como de citocinas, en particular las interleucinas 1 β, 2, 6 y 8. Estas últimas desempeñan un papel crucial en la regulación del proceso inflamatorio en las otitis medias con secreción. Frecuencia y diagnóstico. Estudios epidemiológicos han mostrado que 80% de los niños sanos ha padecido al menos un episodio de OMSe antes de iniciar la etapa escolar, y que 50% ha tenido cuando menos un episodio durante los primeros tres años de vida. La OMS se caracteriza por la presencia de una secreción mucosa, sin síntomas de inflamación aguda y con una membrana timpánica intacta. Debido a que esta secreción afecta la transmisión del sonido, los pacientes presentan a menudo hipoacusia conductiva de 25 a 35 dB. Los síntomas y signos son similares a los de las OMS. Con respecto al diagnóstico, son fundamentales la otoscopia neumática y la timpanometría (curvas de tipos B y C2); la miringotomía con aspiración del líquido mucoide (de alta viscosidad) confirma el diagnóstico. También una deficiente neumatización de la mastoides parece representar una ERRNVPHGLFRVRUJ Oído medio y mastoides condición anatómica que predispone al desarrollo de otitis medias secretorias en adultos normales y a cuadros crónicos y otitis medias adhesivas en adultos con episodios previos de otitis media secretoria. Tratamiento 1. Disminuyen el tejido linfoide peritubario. 2. Facilitan la producción del factor surfactante en la trompa de Eustaquio. 3. Merman la viscosidad de la secreción en el oído medio. 4. Disminuyen el edema alrededor del orificio tubario. 5. Ayudan en el proceso de reversión de la metaplasia de la mucosa del oído medio. Sin embargo, el tratamiento más eficaz hasta el momento para las OMS es el uso de cánulas de ventilación durante periodos prolongados, ya que la mayor parte de estas OMS no responde al tratamiento conservador. CÁNULAS DE VENTILACIÓN El tratamiento de las otitis medias con secreción a través de cánulas de ventilación lo introdujo Armstrong (1954). Este autor señala que dichos dispositivos de ventilación se diseñaron para el tratamiento de pacientes con otitis media crónica no supurativa, que no responde al tratamiento médico conservador, o cuando desde el inicio el paciente ha presentado un antecedente crónico de secreción ótica sin haber recibido tratamiento. Estudios en niños que han requerido la inserción de cánulas de ventilación han mostrado una frecuencia de enfermedad de senos paranasales (sinusitis) concurrente (hasta 60% de los casos), por lo que se recomienda solicitar continuamente radiografías de senos paranasales, incluso si se practicó una adenoidectomía previa. Según los estudios del patrón de migración del epitelio de la membrana timpánica (de los cuadrantes anteriores a los posteriores), se recomienda colocar las cánulas de ventilación en los cuadrantes anteriores (el ideal es el anterosuperior). Las cánulas de ventilación tienen algunas de las siguientes funciones: 1. Ayudan a la adecuada compensación de la presión atmosférica en ambos lados de la membrana timpánica. 2. Favorecen el proceso de normalización de la mucosa del oído medio. 3. En 60 a 80% de los casos, eliminan la hipoacusia conductiva que presentan los pacientes. 4. Favorecen el desarrollo del sistema de celdillas aéreas mastoideas. 5. Ayudan a la ventilación del oído mientras madura la función del músculo tensor del velo del paladar. En casos de otitis medias serosas o secretorias intratables relacionadas con una disfunción tubaria se suguiere el empleo de cánulas en T subanulares (colocados por debajo del anillo timpánico) en el cuadrante posteroinferior, a través de un colgajo timpanomeatal a 5 mm del anillo. Es una técnica de elección para casos en los que se requiere una ventilacion prolongada del oído medio. Complicaciones originadas por las cánulas de ventilación Otorrea posinserción: aparece en 12 al 20% de los casos. Es tres veces más frecuente en forma unilateral que bilateral. En inserciones repetidas de las cánulas de ventilación, la frecuencia de otorrea varía del 20 al 60%, además de incrementar el riesgo de timpanoesclerosis. En estos casos, la administración de gotas tópicas a base de ofloxacina al 0.3% ha mostrado buenos resultados. Perforación de la membrana timpánica: al retirar o expulsar en forma espontánea las cánulas. La frecuencia es menor del 5%. En estos casos, el uso de un parche de papel de arroz o bien de Gelfoam® sobre la perforación en oídos secos resuelve esta complicación en un 90%. Esta complicación es más frecuente cuando se emplean cánulas de ventilación en T (tipo Goode), ya que por lo general hay que retirarlas bajo anestesia local o sedación. Desarrollo de colesteatoma posinserción: es muy raro (1 a 2% de los casos). Luxación de la cadena osicular: por lo general se debe a una mala técnica quirúrgica, sobre todo al aplicar las cánulas en el cuadrante posterosuperior (en donde hay mayor riesgo de lesionar la articulación incudoestapedial). ERRNVPHGLFRVRUJ Capítulo 5 Debe enfocarse en la causa de la OMSe. En 40 a 45% de los casos, la adenoidectomía en pacientes con alteración adenoidea ha producido mejoría en el funcionamiento tubario. Las personas con hipertrofia adenoidea realizan una maniobra involuntaria de Toynbee al pasar la saliva, lo cual produce en combinación con el hábito de efectuar una inspiración forzada por la nariz para llevar secreciones hacia la rinofaringe un círculo vicioso que ayuda a perpetuar el proceso de OMS. Por otro lado, algunos autores recomiendan tratamiento a base de antibióticos (trimetoprim–sulfametoxazol, amoxicilina o eritromicina) cuando se aísla Haemophilus influenzae en cultivos de secreciones de los pacientes. Debe tenerse presente que el uso masivo de antibióticos puede bloquear el desarrollo funcional del sistema inmunológico en el oído medio, con disminución de la respuesta de IgM. El autor considera que es útil administrar antihistamínicos y descongestionantes. Asimismo, debe recomendarse al paciente que haga maniobras de Valsalva frecuentes. Para casos resistentes al tratamiento también se han sugerido esquemas cortos con corticoesteroides y antibióticos. Las dosis de prednisona recomendadas son: 1 mg/kg/día durante dos días, 0.75 mg/ kg/día por otros dos días y 5 a 10 mg como dosis única por las mañanas durante tres días. Acción de los corticoesteroides: 77 77 78 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 5 Hipoacusia neurosensorial: esta complicación es rara y puede relacionarse con la presencia de microfisuras sobre el nicho de las ventanas redonda u oval. Formación de tejido de granulación: en el conducto auditivo externo alrededor de la cánula de ventilación. Su frecuencia es menor de 1%. Desarrollo de granuloma de quetarina: con reacción a cuerpo extraño, debido a implantación del epitelio durante la miringotomía, con la aplicación de la cánula o secundaria a su extrusión. Esta complicación es muy rara. Timpanoesclerosis Se caracteriza por la presencia de placas blanquecinas en la membrana timpánica con depósitos nodulares en la capa submucosa del oído medio. El proceso patológico ocurre en la lámina propia; hay hialinización seguida por dépositos de calcio y cristales de fosfato. Puede afectar en forma parcial o total a la membrana timpánica, así como al oído medio y cadena de huecesillos. Técnica quirúrgica (figura 5–2) 1. Se recomienda la neuroleptoanestesia. En adultos puede realizarse bajo anestesia general, mediante iontoforesis o con inyección de xilocaína al 2% con adrenalina. 2. Aseo del conducto. 3. Práctica de una miringotomía en el cuadrante anterosuperior con uso de microscopio. 4. Aspiración de la secreción del oído y cultivos del líquido aspirado. 5. Colocación de la cánula de ventilación. Se cuenta con numerosas cánulas de ventilación en el mercado y todas deben ser útiles porque están diseñadas para la misma función; sin embargo, el autor ha obtenido buenos resultados con el tipo Armstrong (silicona). Por otro lado, cuando las cánulas se impregnan de óxido de plata, han demostrado una menor incidencia de otorrea. Para ventilación prolongada se recomienda el modelo en T. Casi 2% de las OM. Se requiere mastoidectomía. En numerosos casos se salen las cánulas de ventilación durante los primeros seis meses de su colocación. Si esto no ocurre y se ve una membrana timpánica de características normales y sin secreciones, se recomienda quitar las cánulas. Por último, estudios con diferentes protectores óticos han demostrado que los de material polimérico son mejores que los de algodón, ya que los primeros absorben menos agua. Además, se recomienda aplicar la vaselina. El empleo de estos protectores evita el desarrollo de infecciones óticas durante el baño y la natación en pacientes con cánulass de ventilación. Se requiere una presión de 12.8 a 22.8 cm H2O para que ésta pueda entrar al oído medio a través de una cánula de ventilación permeable, de tal manera que, en los niños que se sumergen a una profundidad de 1.80 m, aumenta seis veces el riesgo de otorrea en comparación con los que no lo hacen, por lo que se sugiere no sumergirse a más de 60 cm en el agua al nadar. OTITIS MEDIA Y DESARROLLO DEL NIÑO La otitis media con secreción es la causa más frecuente de disfunción auditiva en preescolares y escolares. Algunos factores predisponentes son: Figura 5–2. Colocación de la cánula de ventilación en el cuadrante anterosuperior de la membrana timpánica 1. Raciales: es más común en la raza mestiza, indios estadounidenses y esquimales. 2. Paladar hendido. 3. Pacientes con retraso mental (síndrome de Down). 4. Alergia. 5. Inmunodepresión. 6. Trastornos en los cilios de la mucosa del aparato respiratorio superior (síndrome de Kartagener). 7. Pacientes con pérdida neurosensorial auditiva previa. 8. Síndrome del niño maltratado. 9. Desnutrición. 10. Bajo nivel socioeconómico. ERRNVPHGLFRVRUJ Oído medio y mastoides OTITIS MEDIAS Y OTOMASTOIDITIS AGUDAS Introducción Estudios recientes han demostrado que durante el primer año de vida 11 a 20% de los lactantes presentan un cuadro de otitis media aguda (OMA), y 20% de ellos desarrolla más de un cuadro. El riesgo de OMA en los segundos seis meses de vida es alto: 22%; entre uno y cinco años varía del 10 al 19%; y después de los nueve años es de 2 a 7%. En 10% de los casos, un episodio de otitis media aguda puede persistir por más de tres meses. La OMA puede ser de origen bacteriano o viral, aunque también se ha uniformado un origen micótico, sobre todo en pacientes inmunosuprimidos. Con frecuencia se encuentran relacionadas con la miringitis bulosa, tratada en el capítulo anterior. Origen bacteriano de las otitis medias agudas Streptococcus pneumoniae es el más común de los agentes productores de OMA (30 a 35%) en todas las edades. Los ocho subtipos más usuales, en orden decreciente, son: 19, 3, 6, 23, 14, 18, 4 y 7; todos ellos están incluidos en la vacuna contra el neumococo introducida en 1978 y aprobada por la Food and Drug Administration de EUA en febrero de 2000. Esta vacuna consiste en un conjugado heptavalente de proteínas polisacáridas de neumococos. Haemophilus influenzae es el segundo agente más frecuente encontrado en OMA (20%). Aunque la mayor parte de las cepas aisladas no es tipificable, 10% de las OMA se relaciona con H. influenzae tipo B. Es más común durante la edad preescolar, si bien se llega a aislar también en escolares y adolescentes. Estreptococo B hemolítico grupo A: representa un 8% de los casos. Branhamella catarrhalis y Staphylacoccus aureus se encuentran en 5% de los casos. Bacilos entéricos gramnegativos: en el recién nacido y en el lactante pueden ocasionar OMA hasta en 20% de los casos, pero la estadística general indica que son poco frecuentes y representan 1 a 2% de los casos. El agente más usual es Pseudomonas aeruginosa. Estas infecciones se acompañan de una gran diversidad de complicaciones locales y sistémicas. Le siguen E. coli, Klebsiella y Proteus mirabilis. Bacterias anaeróbicas: debido al desarrollo de mejores métodos de aislamiento e identificación de las bacterias anaeróbicas, se reconoce que pueden causar OMA, con o sin relación con bacterias aeróbicas. Brook (1978) las ha identificado hasta en 28% de los pacientes con OMA. Los patógenos que más se aíslan son Peptococcus y Propionibacterium acnes. Virus: estudios epidemiológicos han mostrado que las infecciones virales se acompañan de OMA. Los microorganismos que se aíslan más son adenovirus, virus sincitial respiratorio, influenza A, parainfluenza tipo 3 y enterovirus. Éstos contribuyen en forma sinérgica a la producción de interleucina tipo 8 en el oído medio durante infecciones bacterianas. Se han encontrado en el 4% de las secreciones del oído medio. Otros agentes causales ocasionales son: 1. Mycobacterium tuberculosis. Produce otorrea persistente indolora que no responde al tratamiento convencional. Se reconocen abundante tejido de granulación, necrosis ósea y PPD positivo o se observan lesiones pulmonares en las radiografias. Se vincula más con otomastoiditis agudas (4%). 2. Micobacterias atípicas. De ellas, Mycobacterium avium y fortuitum son las más frecuentes. Presentan lesiones no diferenciables clínica e histológicamente de las de M. tuberculosis. Se caracterizan por ser cepas muy resistentes a los fármacos antituberculosos existentes. En casi todos los casos se sugiere tratamiento quirúrgico. 3. Mycoplasma pneumoniae. Aunque es raro encontrarlo, es posible que algunos individuos con infección de vías respiratorias inferiores por M. pneumoniae desarrollen otitis media de manera concomitante. 4. Chlamydia trachomatis es el patógeno causal de una neumonía moderada pero persistente en niños, que también puede provocar OMA. 5. Coccidioides immitis. Constituye una infección micótica endémica en regiones semidesérticas, como las de California, Arizona y Texas. Se ha informado una incidencia de 25 000 a 100 000 casos anuales en Estados Unidos y, aunque es muy raro encontrarla en el oído, se han notificado casos de otitis medias y otomastoiditis agudas debidas a este agente, el cual se relaciona con la producción de abundante tejido de granulación. Fisiopatogénesis El sistema del complemento (C) juega un papel importante en la defensa del organismo en contra de infecciones ERRNVPHGLFRVRUJ Capítulo 5 La frecuencia de otitis media en la edad escolar es de 20% y la pérdida conductiva secundaria a ésta fluctúa entre 15 y 40 dB. Esta hipoacusia tiene efectos en el desarrollo cognoscitivo de los pacientes: presentan mayor problema de discriminación y desarrollo de la lectura que los niños normales. En consecuencia, la otitis media puede causar alteraciones del lenguaje y un rendimiento escolar bajo. Después de los siete años, la frecuencia de otitis media tiende a disminuir en grado considerable. Estudios experimentales en ratones han detenido el desarrollo de las células globulares del núcleo coclear dorsal, cuando estos animales se someten a hipoacusias conductivas en etapas tempranas. Esto sugiere que pueden ocurrir defectos en las vías auditivas centrales en pacientes con otitis media adquirida durante los primeros meses de vida, cuando el sistema nervioso central es todavía inmaduro. 79 79 80 Oído, nariz, garganta y cirugía de cabeza y cuello bacterianas. Este sistema se activa a través de dos mecanismos: Capítulo 5 a) Vía común. Comprende 11 diferentes proteínas y se inicia por la formación de complejos antígeno– anticuerpo. Se activan así los factores del complemento de C1 a C9. La fracción C1 del complemento es dependiente de calcio y tiene tres diferentes subcomponentes: C1q, C1r y C1s. C1q puede unirse a la fracción Fc de la IgG e IgM y contener complejos inmunitarios que inician la activación de los subcomponentes C1r y C1s. La activación de C1 hace que se formen otras enzimas y ensamblen el complejo multimolecular C5–C9. b) Vía alternativa o de la properdina. La properdina y los factores B, D y C3 toman parte en la activación inicial de esta vía. Este mecanismo también induce la formación de enzimas que unen al complejo C5–C9. Esta vía se activa por efecto de sustancias como zimosán, endotoxinas y diversos polisacáridos de origen bacteriano. En personas con otitis media aguda (OMA) se ha encontrado un aumento de los complejos C1r, C1s, C1–1A que indica mayor activación del factor C1 del complemento, en ausencia de hipocomplementonemia manifiesta. Al parecer, los componentes bacterianos son capaces de unirse al C1q, activar al C1 y producir un desequilibrio del C1q unido a bacterias C1r–C1s circulantes, lo cual hace que se observe una reducción de casi 60% del subcomponente C1q en OMA. De igual modo, el subcomponente C3b desempeña una función importante en la opsonización del neumococo. Se requiere un factor C1 puro para la activación de la vía común que lleva a la generación de C3b. Las alteraciones en el componente C1, como las producidas durante la OMA de origen neumocócico, pueden afectar la importante función opsónica de la vía común y, como resultado, favorecer el desarrollo de otitis medias repetitivas o crónicas. Asimismo, el estreptococo Pneumoniae aumenta la síntesis de ácido araquidónico, así como de prostaglandinas y leucotrinas, que amplifican la reacción inflamatoria. Casi todos los casos de OMA surgen por disfunciones tubarias, sea secundarias a infecciones de vías respiratorias superiores, que pueden producir hiperemia y edema alrededor de la mucosa de la porción faríngea de la trompa de Eustaquio, con hiperplasia linfoide de la submucosa, o por una acción muscular defectuosa en la abertura de la trompa, situación que lleva a una insuficiencia tubaria, que tiene un periodo crítico de presentación, desde el nacimiento hasta los siete años. Esta alteración en la ventilación del oído medio produce la acumulación de secreción debido a fenómenos exudativos y a la contaminación bacteriana proveniente de la nasofaringe. Otra causa menos frecuente de OMA es la existencia previa de perforaciones de la membrana timpánica, que representan una vía de entrada libre a la contaminación bacteriana. Se han detectado concentraciones elevadas de enzimas, en especial neuraminidasa, en las secreciones de las OMA, por lo que se cree que desempeñan un papel importante en las infecciones de oído medio, así como el factor de necrosis tumoral, que inhibe la formación de anticuerpos y con ello afecta el proceso de limpieza de productos bacterianos en el oído medio. Además, tienen una función importante en la patogénesis de la hiperplasia-metaplasia de las células de la mucosa del oído medio que constituye la base patológica para la hiperproducción de moco en las otitis medias. También se encuentran grandes cantidades de citocinas, en especial la interleucina 8, sobre todo en secreciones purulentas del oído medio, las cuales intervienen en la regulación del proceso inflamatorio en las otitis medias. Por otro lado, también se ha encontrado un aumento significativo de radicales libres, que son moléculas altamente reactivas, capaces de producir daño tisular a través de la modificación química de los lípidos celulares, proteínas, carbohidratos y nucleótidos. La acción del espacio subepitelial en la patogénesis de la otitis media es fundamental y consiste en: a) Producción de secreción. b) Formación del tejido de granulación (fibroblastos, neoformación vascular, células inflamatorias). c) Intervención en la formación de placas de timpanoesclerosis (fibroblastos). d) Contribución a la formación de granulomas de colesterol. e) Participación en la osteogénesis y destrucción ósea. f) Influencia en las células epiteliales. Por lo general, en la OMA hay edema y prolapso del músculo tensor del tímpano, que se resuelven al remitir la infección; en caso de persistir, constituye un factor que ayuda a perpetuar el proceso inflamatorio y favorecer la cronicidad de la otitis media y la presencia de reflujo gastroesofágico. Esto se ha comprobado en estudios en los que se ha detectado la presencia de pepsina hasta en 50% de las otitis medias crónicas con secreción. Estadios clinicopatológicos Estadio de hiperemia: es el cambio patológico más temprano, tanto de la mucosa de TE como de la cavidad timpánica y las celdillas aéreas mastoideas. La membrana timpánica se inyecta a lo largo del mango del martillo y del annulus. A ello le sigue el exudado de un líquido serofibrinoso en oído medio, cuya cantidad aumenta de modo gradual hasta que se ejerce presión sobre la pared interna de la membrana timpánica. El paciente refiere sensación de oído tapado, que se convierte en otalgia. Otros síntomas son fiebre, malestar general e hipoacusia. En la otoscopia, al inicio, se reconoce una leve hiperemia sobre el mango del martillo; al progresar, se advierte una hiperemia generalizada con una membrana timpánica engrosada y abombada sobre la porción tensa, con pérdida del reflejo luminoso. ERRNVPHGLFRVRUJ Oído medio y mastoides Tratamiento 1. Para frenar el proceso en sus estadios iniciales se recomiendan antibióticos, previo cultivo y antibiograma de la secreción. Por lo general se sugiere penicilina o sus derivados por 10 días o más si la infección no ha cedido por completo. 2. Antihistamínicos y vasoconstrictores sistémicos. 3. Si la membrana timpánica está abombada y hay otalgia, se debe efectuar una miringotomía. 4. Cuando se observa mastoiditis coalescente, se recomienda realizar una mastoidectomía simple con colocación de tubos de ventilación. 5. En caso de complicaciones, se tratan en forma radical y de acuerdo con cada caso en particular. OTITIS MEDIA Y OTOMASTOIDITIS CRÓNICAS Factores causales de la cronicidad de la otitis media 1. Disfunción crónica de la trompa de Eustaquio. 2. Perforación persistente de la membrana timpánica. 3. Afección del oído medio con metaplasia escamosa. 4. Obstrucción persistente en la aireación del oído medio o la mastoides debido a una mucosa del oído engrosada, pólipos, tejido de granulación o timpanoesclerosis. 5. Áreas de secuestro óseo en la mastoides. 6. Factores constitucionales que alteren los mecanismos de defensa del hospedador. 7. Presencia de bacterias productoras de biopelícula en tejido adenoideo hipertrófico. Fisiopatología 1. Giebink (1985) ha propuesto un mecanismo en la inflamación crónica del oído. En este esquema, la producción de lisozimas proviene en esencia de las células epiteliales del oído medio y de la desgranulación de polimorfonucleares, que se mide por los valores de lactoferrina. La viabilidad de las bacterias en la secreción de la otitis media crónica parece acentuar la inflamación del oído medio al proveer de quimiotaxinas a los polimorfonucleares en la secreción. 2. Las prostaglandinas, la colagenasa y las enzimas lisosómicas son sustancias que actúan en la resorción ósea en la otitis media crónica. 3. Es probable que células mononucleares y fibroblastos sinteticen colagenasa; con esta enzima se inicia la resorción de colágeno, principal componente estructural del hueso. Por lo tanto, dicha enzima intracelular constituye el elemento orgánico de la destrucción ósea, y se encuentra muy concentrada en el tejido de granulación. 4. Asimismo, en el tejido de granulación se han aislado miofibroblastos, los cuales pueden producir una fuerza contráctil en las estructuras del oído medio. 5. La hipoacusia sensorineural descrita en pacientes con otitis media crónica se ha atribuido a procesos enzimáticos y polisacáridos bacterianos que pueden lesionar el oído interno, en su paso por las ventanas oval y redonda. 6. La neumatización de las celdillas periantrales se inicia inmediatamente después del nacimiento, de tal manera que éstas se pueden reconocer en 25% de los lactantes al mes de edad, en 43% a los tres meses y en 100% a los seis. Estudios sobre la neumatización de la mastoides han sugerido que la hipocelularidad se debe a procesos inflamatorios crónicos (teoría ambiental), no tanto a determinación genética. ERRNVPHGLFRVRUJ Capítulo 5 Estadio de supuración: se observa perforación de la membrana timpánica, producida en forma espontánea o artificial por el médico (se recomienda en los cuadrantes anteriores). La secreción es serohematopurulenta y cuando se evacua disminuyen en forma notoria la otalgia, el malestar general y la fiebre. Los cambios en la mucosa se acompañan de hipoacusia más notoria. El paciente puede referir dolor en la región retroauricular, lo cual indica en clínica la presencia de secreción mucopurulenta en las celdillas mastoideas. En las radiografías se identifica opacidad de la mastoides. Estadio de coalescencia: se presenta en menos del 5% de los pacientes, que continúan con supuración por el oído y engrosamiento del mucoperiostio que, a su vez, obstruye el drenaje de las secreciones mucopurulentas. Asimismo, hay una erosión osteoclástica del hueso, tanto de la tabla interna como de la externa de la mastoides, y es posible el desarrollo de abscesos subperiósticos. El paciente puede referir dolor en la región retroauricular, fiebre y, en la biometria hemática, tener leucocitosis. Las placas pueden mostrar zonas de descalcificación con destrucción de las celdillas aéreas mastoideas. Estadio de resolución: se abate la infección y, por ende, la otorrea. El engrosamiento de la mucosa y el edema disminuyen hasta que desaparecen, con mejoría gradual de la audición. Las perforaciones centrales de la membrana timpánica cierran con rapidez sin dejar cicatriz, aunque en algunos casos pueden hacerse evidentes pequeñas zonas de atrofia. Puede haber un poco de secreción estéril que persiste por años en áreas coalescentes de la mastoides sin causar síntomas. Estadio de complicación: en este periodo, la infección se extiende más allá de la cavidad timpánica y las celdillas mastoideas, así como a los senos venosos, meninges o el laberinto. La mastoides se llena con una mucosa edematosa granular y secreción mucopurulenta a presión. Este proceso da lugar a la absorción de las delgadas paredes óseas y, al progresar la infección, se extiende a lo largo de los conductos venosos y dehiscencias del periostio de la mastoides. Debe enfatizarse que las complicaciones son el resultado de una erosión ósea progresiva de una mastoiditis coalescente. 81 81 82 Oído, nariz, garganta y cirugía de cabeza y cuello Bacteriología Capítulo 5 En un estudio de Papastavros (1986) se encontró que 84% de los microorganismos productores de otitis media crónica correspondía a aeróbicos, 1.7% a anaeróbicos y 14.29% a flora mixta. Esta última se incrementa hasta en 39% en oídos con enfermedad aticoantral. Otros estudios han revelado también la presencia de hongos del tipo de Aspergillus y Candida albicans; la infección originada por éstos se facilita en mucosas con inflamación. Los microorganismos más frecuentes son bacilos gramnegativos, que en orden decreciente son los siguientes: a) Pseudomonas aeruginosa, 55%. b) Enterobacterias, 15% (Proteus, especies de Klebsiella, E. coli). c) Estafilococo dorado, 30%. d) Flora mixta, 15% (los anaeróbicos más aislados fueron Peptococcus, Bacteroides melaninogenicus y B. fragilis). Características clinicopatológicas La membrana timpánica sufre perforación central o subtotal. El epitelio escamoso tiende a crecer hacia dentro del oído medio a través de la perforación, lo que puede favorecer el desarrollo subsecuente de colesteatoma. Figura 5–3. Pólipo en el conducto auditivo externo proveniente de la cavidad del oído medio; paciente con otomastoiditis crónica. Durante los periodos de infección activa, la mucosa del oído medio se encuentra engrosada e hiperémica, y produce una secreción mucopurulenta. Este engrosamiento de la mucosa puede sellar el ático y la mastoides, lo cual ocasiona retención de exudado en estos espacios, y depósito de cristales de colesterol; esto produce un proceso irritativo y se crea tejido de granulación. La formación de pólipos, que protruyen a través de la perforación timpánica, favorece la obstrucción del drenaje de las secreciones, hasta ocasionar persistencia de la enfermedad, y se incrementa la posibilidad de desarrollar complicaciones secundarias a la otitis media crónica (figura 5–3). Osteólisis del oído medio y la mastoides: en un estudio de 203 casos de infección otomastoidea crónica realizado por Soda (1973) se encontró una cadena osicular íntegra en 25%, y en el 75% una zona de osteólisis aislada en un elemento óseo o varios. El porcentaje de casos de osteólisis del martillo y el yunque fue similar, 63 contra 63.2%; en el 38% se identificó en el estribo; l4% en el acueducto de Falopio; 3.5% en el vestíbulo; 5.9% en el conducto semicircular horizontal; 13% en el tegmen antri o timpani; y 3.5% en el seno lateral. En 11% de los casos se descubrió la ausencia de uno o más huesecillos. El predominio de las imágenes radiográficas fue de esclerosas y esclerodiploicas en un 80%. Colesteatoma: consiste en la presencia de un saco de tejido escamoso epitelial en oído medio, que contiene queratina, lípidos (colesterol, fosfolípidos) y bacterias. El contenido del colesteatoma tiene un pH de 4.35 y 6.85. Existen dos variedades de colesteatoma: congénito y adquirido. Colesteatoma congénito (CC): Es un quiste epitelial que puede presentarse en cualquiera de los huesos del cráneo (el temporal es el más común) y ocurrir en su porción escamosa, timpanomastoidea petrosa. Los colesteatomas congénitos del hueso temporal representan el 2% de los colesteatomas y son más comunes durante la infancia. Se considera que los CC en el oído medio se deben a migración del ectodermo del conducto auditivo externo durante el desarrollo del oído medio. Por lo general se encuentran en la unión entre el primero y segundo arcos branquiales, a nivel del istmo timpánico (región posterosuperior) y se cree que se originan durante la quinta semana de la gestación. Otra teoría que explica la formación del CC es la metaplasia escamosa de la mucosa del oído medio. Uno de los hechos que la apoyan es el hallazgo señalado por Sadé (1977); este autor encontró, en 60% de los oídos con infección crónica, metaplasia escamosa de la mucosa en diferentes grados. Abramson (1977) también ha confirmado la capacidad del epitelio de la membrana timpánica de desplazarse y formar colesteatomas, sin perforación alguna de la membrana. Al parecer, una inflamación persistente da lugar a que el epitelio migratorio de la membrana penetre la membrana basal y la lámina propia, de tal modo que se desarrolla un colesteatoma. ERRNVPHGLFRVRUJ Oído medio y mastoides Estadio I. Enfermedad confinada a un solo cuadrante de la memebrana timpánica. Estadio II. Presencia de colesteatoma en múltiples cuadrantes de la membrana timpánica, pero sin afectación osicular. Estadio III. Afectación osicular sin extensión a la mastoides. Estadio IV. Afectación de la mastoides. La relación entre estos estadios y enfermedad residual, posterior a tratamiento, representa 13% de riesgo para estadio I y 67% para estadio IV. Colesteatoma adquirido (CA) 1. La mayor parte surge de la porción flácida de la membrana timpánica (a través de bolsas de retracción) en el espacio de Prussak. 2. Crecimiento de epitelio queratinizante a través del margen de una perforación timpánica. 3. Metaplasia escamosa de la mucosa del oído medio. 4. Steinbach (1980) ha demostrado que la aplicación de sustancias no irritantes, como Gelfoam® o pegamento biológico, sobre la superficie de la membrana timpánica en conejos, puede producir hiperplasia de las células basales con crecimiento del epitelio hacia dentro y formación de colesteatomas sobre la porción flácida. La pérdida de la lámina basal estimula a las células basales para formar seudópodos, que crean conos epiteliales y microcolesteatomas (figura 5-4). Fisiopatogénesis 1. Un factor importante en la destrucción ósea producida por el colesteatoma son las enzimas lisosómicas que se encuentran en el tejido de granulación subepitelial, que también causan la rotura de colágeno, componente estructural fundamental del hueso. Algunas de estas enzimas son colagenasa y catepsina. La catepsina B interviene en la destrucción ósea y la catepsina D se vincula con la proliferación y diferenciación celular en el colesteatoma. Otros factores son el sistema de plasmina activador de plasminógeno y las citocinas, en especial Figura 5–4. Presencia de colesteatoma con tejido de granulación que ha destruido a la membrana timpánica. ERRNVPHGLFRVRUJ Capítulo 5 Mirko Tos (2000) propone una nueva patogénesis basada en el siguiente mecanismo de inclusión: Presencia de una retracción de la membrana timpánica, la cual hace que ésta se adhiera al cuello del martillo, al proceso largo del yunque o al promontorio. Cuando la membrana se libera, se produce un desgarro que deja un pequeño fragmento de epitelio con queratina adherido al huesecillo o al hueso como una pequeña perforación, la cual, al cerrar, hace que la porción del epitelio dejado se transforme en un colesteatoma de inclusión. En términos clínicos, los CC se manifiestan por la presencia de hipoacusia conductiva, sin traumatismo o infección ótica, y en la otoscopia es frecuente observar una masa blanca por detrás de la membrana timpánica. Su tratamiento consiste en la extirpación quirúrgica y, en un segundo tiempo, una reconstrucción osicular. Postic (2002) ha establecido cuatro estadios del colesteatoma congénito: 83 83 84 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 5 la interleucina 1α, que desempeña un papel importante en la destrucción ósea y el agravamiento de la inflamación y que se produce por queratinocitos de las capas celulares suprabasales del epitelio del colesteatoma. 2. La presión ejercida por el colesteatoma sobre las paredes óseas estimula la síntesis de prostaglandinas (prostaglandina E2) y enzimas lisosómicas, que son potentes estimuladores osteoclásticos. La erosión ósea en el colesteatoma resulta de una actividad osteoclástica adyacente al tejido subepitelial. 3. Los tejidos inflamatorios producen prostaglandinas y linfocinas; estas últimas son secretadas por monocitos o macrófagos en la contigüidad del colesteatoma y estimulan en forma directa la producción de osteoclastos. 4. Según Ruedi (1963), el crecimiento del colesteatoma se debe a la descamación de queratina dentro del saco del colesteatoma, secundaria a la destrucción osteoclástica del hueso. Más aún, la presencia de concentraciones aumentadas de factor de crecimiento epidérmico, así como de linfotoxinas e interleucinas 1a, presentes en el epitelio y tejido de granulación, señala un estado hiperproliferativo que favorece el crecimiento anormal del epitelio del colesteatoma. También se han encontrado en el epitelio del colesteatoma altas cifras de catelicidinas, las cuales incrementan la producción de quimiocinas y la respuesta proliferativa de linfocitos colaboradores T; esto estimula la apoptosis de macrófagos y la activación,de linfocitos, cuyo resultado es la eliminación potencial de células infectadas. 5. Se ha identificado en la matriz del colesteatoma un mayor número de células de Langerhans que en la membrana timpánica y la piel del conducto auditivo externo. Representan células centinelas del sistema inmunológico que pueden reconocer a los antígenos y presentarlos a los linfocitos T o los macrófagos. 6. La relación de microorganismos aeróbicos con anaeróbicos en el colesteatoma es alta y ello favorece una rápida esclerosis de la mastoides y aumenta el proceso osteolítico. 7. El colesteatoma adquirido se relaciona, por lo general, con un defecto en el ático, esclerosis intensa de la mastoides y una disfunción crónica de la trompa de Eustaquio. En 70 a 80% de los casos se observa destrucción de la cadena osicular, sobre todo de la rama larga del yunque. La evolución de esta enfermedad lleva a la destrucción de mastoides, oído medio y pared posterior del conducto auditivo externo, lo que crea una cavidad de automastoidectomía. En ocasiones, el colesteatoma tiende a permanecer estable, con periodos de poca actividad durante tiempo prolongado; también puede presentar periodos de agresividad con complicaciones otoneurológicas. 8. Por último, durante la consulta otológica no es raro observar colesteatomas adquiridos en forma iatrogénica, después de operaciones óticas sobre todo timpanoplastias y mastoidectomías. Diagnóstico 1. Es fundamental la otoscopia, con utilización del microscopio, en el diagnóstico de esta enferme- Figura 5–5. Radiografía de mastoides en proyección de Schüller que muestra la presencia de una cavidad de automastoidectomía por un colesteatoma adquirido. Nótese la amplia destrucción de la mastoides y los elementos del oído medio. ERRNVPHGLFRVRUJ Oído medio y mastoides TRATAMIENTO DE LA OTITIS MEDIA Y OTOMASTOIDITIS CRÓNICAS Valorar el estado de la función tubaria y controlar procesos infecciosos crónicos o alérgicos de nariz y faringe. Deben extraerse las adenoides residuales que produzcan obstrucción mecánica; asimismo, se tratan de forma quirúrgica las desviaciones septales, sobre todo de áreas posteriores. Tratamiento del proceso infeccioso ótico: se recomienda tomar cultivos de la secreción antes de administrar antibióticos. El esquema sugerido es: 1. Aseo frecuente del oído con aspiración de secreciones. 2. Aplicación de gotas óticas locales (antibiótico). 3. Antibióticos sistémicos de amplio espectro, en caso de infecciones sobreagregadas al proceso crónico. 4. Cauterizaciones de la mucosa o alrededor de la perforación timpánica, con ácido tricloroacético o nitrato de plata, en caso de haber tejido de granulación o pequeños pólipos, que deben retirarse previamente con unas pinzas otológicas de punta en copa. 5. En caso de haber un oído seco con la mucosa del oído medio de aspecto normal, se sugiere cerrar la perforación timpánica mediante timpanoplastia, tras valorar el estado funcional de la cadena osicular y aplicar las prótesis o injertos necesarios para su reconstrucción. 6. En oídos que han presentado infecciones recurrentes, con afectación de la mastoides (radiográfica), se recomienda tratar de secar el oído medio con el tratamiento médico habitual, seguido de mastoidectomía con timpanoplastia. 7. En caso de colesteatoma, el tratamiento debe orientarse a la eliminación total del epitelio escamoso del oído medio y la mastoides. El autor recomienda una mastoidectomía radical, con o sin obliteración de la cavidad, ya que este procedimiento es el que ofrece menor frecuencia de recidivas, con excepción de los colesteatomas limitados a la región del ático; en la mayor parte de los casos se elimina el problema con aticotomía y reconstrucción de la pared externa. En 15% de las veces persiste el colesteatoma después de la intervención, lo que exige más operaciones para su curación. Smith (1985) ha sugerido el control de algunos de estos casos mediante la aplicación tópica de 5–fluorouracilo (componente que inhibe la síntesis de DNA). Otitis media adhesiva Se caracteriza por disfunción tubaria crónica y es la secuela tardía de las otitis medias secretorias recurrentes y las supurativas que, si bien han recibido antibioticoterapia, ésta no ha prevenido los cambios inflamatorios que, si son repetitivos, llevan al desarrollo de esta anomalía. El lector debe tener presente que, si la audición en un paciente con otitis media aguda no se normaliza después de un tratamiento adecuado, está indicado practicar una miringotomía mediante la colocación de una cánula de ventilación, lo que casi siempre resuelve el problema y evita el desarrollo de secuelas tardías. La historia clínica muestra que, en casi todos los casos, la otitis media adhesiva se inicia durante la infancia, con periodos de otitis medias recurrentes tratadas en forma inadecuada o que no recibieron tratamiento alguno. Existe una predisposición hereditaria. A la exploración se encuentra una membrana timpánica íntegra, pero con cambios atróficos y retracción, sobre todo en los cuadrantes posteriores. El grado de colapso depende de la extensión de la atrofia; sin embargo, es frecuente encontrar la membrana timpánica adherida al promontorio (50% de los casos). Esta retracción de la membrana, con el tiempo, puede causar necrosis y erosión del yunque y el estribo. En los casos en que se bloquea la aireación en el ático, la retracción de la membrana timpánica que se produce puede propiciar el desarrollo de un colesteatoma. Al parecer, la atrofia de la membrana resulta de la activación de colagenasa y catepsinas, que da lugar a la rotura de la capa fibrosa de esa membrana; sólo se preservan las capas epitelial y mucosa. El proceso de ventilación obstructiva sobre el oído medio, mastoides y ático que existe en estos pacientes hace que estos espacios puedan llenarse de un moco anormal con depósitos de cristales de colesterol, con el desarrollo subsecuente de granulaciones o quistes de colesterol que provocan también mayor erosión ósea. En la otitis media adhesiva es rara la infección activa; sin embargo, la rotura de la membrana timpánica debido a una infección de la trompa de ERRNVPHGLFRVRUJ Capítulo 5 dad. También puede usarse la endoscopia transtimpánica, con endoscopios rígidos de 1.9 mm o flexibles de 1 mm, aunque estos últimos tienen una menor calidad de resolución. 2. Se busca de modo intencional la presencia de perforaciones o retracción en la parte flácida de la membrana timpánica. En caso de perforaciones timpánicas se valoran el estado de la mucosa del oído medio y la destrucción o erosión, sobre todo en la pared posterior del conducto auditivo externo 3. Estudio audiológico. Debe tenerse en cuenta que una perforación timpánica produce hipoacusia conductiva no mayor de 15 a 20 dB. Una afectación de la cadena osicular produce hipoacusias conductivas de 30 a 50 dB 4. Estudios radiográficos. Las proyecciones más utilizadas para valorar el estado de la mastoides y el oído medio son: Schüller, Stenvers y Owens. Por lo general se encuentran mastoides esclerosas o esclerodiploicas. La tomografía axial computarizada ofrece una gran capacidad de resolución y es ideal para valorar la destrucción ósea causada por el colesteatoma (figura 5–5). 85 85 86 Oído, nariz, garganta y cirugía de cabeza y cuello Eustaquio o posterior a nadar o bañarse, convierten este trastorno en una otitis media supurativa crónica. Tomasen (1996), después de estudios experimentales efectuados en ratas, delineó una hipótesis de seis estadios en la formación de las otitis medias adhesivas: Capítulo 5 1. Rotura localizada del epitelio de la membrana timpánica. 2. Prolapso del tejido subepitelial. 3. Epitelización del prolapso que produce un doblez con prominencia de aspecto polipoide. 4. Crecimiento y elongación de esta prominencia. 5. Fusión de esta prominencia con la mucosa. 6. Formación de la adhesión. Clasificación de la otitis media adhesiva: Tipo I. Membrana timpánica atrófica pero no adherente. Tipo II. Membrana timpánica adherida al promotorio. Tipo III. Membrana timpánica adherida al yunque o estribo. Tipo IV. Presencia de bolsa de retracción sin colesteatoma. Tipo V. Presencia de colesteatoma. El estudio audiológico muestra hipoacusia de tipo conductivo superficial a moderada. En ocasiones se encuentran hipoacusias de tipo mixto, debido a la lesión coclear que se produce por la activación de enzimas y el paso de éstas a través de la membrana redonda. El tratamiento debe seguir los lineamientos sugeridos para la otitis media crónica. El restablecimiento de la audición puede representar un verdadero problema; en general, se sugiere realizar un procedimiento timpanoplástico, con colocación de silástico en el oído medio, para impedir recurrencias de la adhesión de la membrana timpánica. Algunas veces se recomienda aplicar una cánula de ventilación. COMPLICACIONES DE LAS INFECCIONES DE OÍDO MEDIO Y MASTOIDES Las complicaciones por infección del oído medio se clasifican en otológicas e intracraneales. Complicaciones otológicas Absceso subperióstico: se debe a la acumulación de pus entre la corteza mastoidea y el periostio que la cubre. Se observa a menudo en lactantes, debido a que la secreción purulenta escapa a través de las suturas de unión del hueso temporal, o por los orificios vasculares comunicantes entre el oído medio y el subperiostio. En adultos, el absceso se forma por necrosis ósea y fistulización y, cuando ocurre en la punta de la mastoides con extensión hacia a la inserción del músculo esternocleidomastoideo, se denomina absceso de Bezold. Otras áreas que se pueden afectar son la raíz del cigoma y la porción superior del conducto auditivo externo. El tratamiento de esta complicación es quirúrgico: mastoidectomía simple con colocación de una cánula de ventilación, mediante una mastoidectomía radical, de acuerdo con los hallazgos durante la intervención. Parálisis facial: esta complicación se presenta en menos del 1% de los casos. Es efecto de la extensión directa del proceso inflamatorio al conducto de Falopio. Ocurre con más frecuencia en los niños y puede deberse a dehiscencias persistentes del conducto de Falopio o a la propagación de la infección por vías fisiológicas, como los orificios por donde salen la cuerda del tímpano y el nervio estapedial. En infecciones crónicas, el mecanismo habitual de la parálisis facial es la erosión del conducto de Falopio, con la subsecuente infección y compresión del nervio a través de la zona lítica, ya sea por colesteatoma o tejido de granulación o polipoideo. El mecanismo intrínseco de la parálisis facial, cuando es secundaria a un proceso agudo, es la neuritis aguda con hiperemia, infiltración celular, trombosis venosas y hemorragias, que producen edema del nervio con isquemia. Candela (1974) ha señalado que, en casos de infección del oído medio, la parálisis facial se produce por trastornos en la porción timpánica o piramidal del nervio. El tratamiento de esta complicación es quirúrgico. Los casos secundarios a otitis media aguda pueden tratarse mediante miringotomías, con o sin colocación de cánula de ventilación, y antibioticoterapia. Si las pruebas electrodiagnósticas sugieren un proceso de degeneración del nervio, o no hay respuesta al tratamiento, debe descomprimirse por medios quirúrgicos; lo mismo se recomienda en parálisis faciales secundarias a infecciones crónicas del oído. Fístula laberíntica: suele resultar de la erosión de alguno de los conductos semicirculares, sobre todo el horizontal. Los movimientos bruscos de la cabeza pueden inducir episodios de vértigo, casi siempre de corta duración, sensación de presión en el oído y disminución de la capacidad auditiva. Además, es frecuente observar un signo positivo de fístula (al aplicar aire alternando presiones positivas y negativas). Cuando la fístula es secundaria a un colesteatoma, se recomienda no resecar éste en su totalidad durante el procedimiento; puede dejarse un pequeño fragmento sobre el sitio de la fístula y retirarlo en un segundo tiempo quirúrgico y sellarla con fascia temporal, polvo de hueso cortical o periostio. Representa la complicación más frequente del colesteatoma con 7% de los casos y el 90% de éstos ocurre en el conducto semicircular lateral. Laberintitis serosa: consiste en una inflamación intralaberíntica difusa, sin formación de pus, la cual es reversible, en cuyo caso no deja déficit cocleovestibular. En infecciones agudas puede ser suficiente el tratamiento médico conservador (antibióticos, sedantes del laberinto, antihistamínicos); la operación está indicada en casos de infección crónica o renuente al tratamiento médico inicial y es necesario eliminar las áreas de osteítis, proteger el laberinto y evitar una meningitis secundaria. Laberintitis purulenta: esta complicación resulta de una extensión directa del proceso infeccioso supurativo del oído medio o de la mastoides en el laberinto; también puede deberse a la diseminación de una inflamación meníngea hacia el laberinto a través del conducto ERRNVPHGLFRVRUJ Oído medio y mastoides Complicaciones intracraneales Absceso epidural: la secreción purulenta se localiza entre la tabla interna del cráneo y la duramadre. Se ve más como complicación de una otitis media aguda. Puede ocurrir tanto en la fosa craneal media como en la posterior. El paciente puede referir cefalea de moderada intensidad, sobre todo posterior a operación de mastoides. A menudo, el diagnóstico de esta entidad se establece durante la intervención, ya que la eliminación progresiva de las celdillas afectadas lleva al cirujano a identificar el absceso epidural. La punción lumbar puede ser normal o mostrar sólo una leve linfocitosis con algunos polimorfonucleares. El tratamiento de esta complicación consiste en drenaje quirúrgico a través de una mastoidectomía radical y es necesariofresar el hueso hasta exponer por completo la cavidad del absceso y proteger la duramadre. La herida retroauricular puede dejarse abierta o con sondas de drenaje, además de antibioticoterapia sistémica. Meningitis otógena: consiste en la infección del espacio subaracnoideo resultante de la extensión del proceso inflamatorio ótico. Representa la complicación intracraneal más común. Los síntomas clínicos incluyen rigidez de nuca, cefalea, fiebre, náusea y vómito. En estados más avanzados se encuentran confusión mental, delirio o coma. Existe un signo de Kernig positivo. La punción lumbar muestra un líquido cefalorraquídeo bajo en glucosa, elevado en proteínas, con abundantes células purulentas y, en el caso de una meningitis generalizada, también microorganismos. Tratamiento a) Antibioticoterapia. b) Erradicación del proceso infeccioso del oído a través de: 1. Mastoidectomía simple, si la meningitis fue secundaria a una otomastoiditis aguda, sobre todo en menores de edad. 2. En caso de ser consecutiva a una otitis media crónica agudizada o recurrente, se sugiere mastoidectomía radical. Las meninges deben exponerse con fresa de diamante. No debe cortarse ni puncionarse la duramadre, ya que ello favorecería la diseminación de la infección. Absceso subdural: la secreción purulenta se acumula entre la duramadre y la aracnoides. Esta complicación es rara. El absceso puede desarrollarse por extensión directa con erosión ósea y de la dura o a través de una tromboflebitis venosa. En clínica, el paciente puede presentar crisis convulsivas, hemianopsia, hemiplejía o afasia. Durante el estadio agudo es frecuente identificar signos de irritación meníngea. Tratamiento: drenaje quirúrgico del absceso a través de pequeños trépanos craneales. Además del tratamiento médico conservador, se recomienda la erradicación total del problema del oído medio a través de una mastoidectomía radical. Absceso cerebral: el absceso cerebral otógeno incluye cualquier acumulación de pus en hemisferios cerebrales, cerebelo y tallo cerebral, secundaria a una infección aguda o crónica del oído medio. Después de la meningitis, el absceso cerebral es la complicación endocraneal más común de la otomastoiditis crónica y constituye la causa más frecuente de muerte en la otitis media. En 70% de los casos se localiza en la porción media o basal del lóbulo temporal y en 30% de ellos en el hemisferio cerebeloso. En 4 a 15% de los pacientes, estos abscesos son múltiples. La mayor frecuencia de este problema ocurre entre los 10 y 30 años. Afecta más al sexo masculino en relación de 2:1. La infección puede llegar al parénquima cerebral por dos vías: a) Tromboflebitis séptica de las venas emisarias comunicantes con las venas corticales, que puede originar un absceso adyacente al foco primario de infección. b) Por extensión directa a través de una osteítis del hueso adyacente, que progresa a una necrosis dural y formación de una vía fistulosa. La proliferación de células inflamatorias, fibroblastos y capilares forma una cápsula, que se engruesa en las primeras dos a tres semanas; además, se añade una capa de astroglia por fuera de la cápsula. Ésta se desarrolla por lo general mejor hacia la superficie cortical, lo cual explica la extensión del absceso hacia la línea media y la rotura intraventricular en los casos no tratados. En términos clínicos se diferencian tres estados: I. Encefalitis inicial: se observa fiebre, cefalea y rigidez de nuca ERRNVPHGLFRVRUJ Capítulo 5 auditivo interno o el acueducto coclear. Se observa daño permanente en la cóclea y el vestíbulo, con la subsecuente pérdida de las funciones vestibulares y auditivas del oído dañado. Los pacientes con laberintitis supurativa tienen náusea, vómito, vértigo intenso, nistagmo, tinnitus y sordera. Tratamiento: consiste en administración de antibióticos, sedantes vestibulares y drenaje quirúrgico del laberinto a través de una mastoidectomía radical y, en algunos casos, una laberintectomía amplia. Petrositis: en 1907, Gradenigo comunicó (en 57 pacientes con otitis media aguda supurativa) el desarrollo de paresia del VI par craneal, acompañada de dolor intenso en la distribución del nervio trigémino, debido a un proceso supurativo del vértice petroso. La afección del VI par se debe a la propagación del proceso infeccioso a través del conducto de Dorello, que discurre por debajo del ligamento petroclinoideo. En la actualidad, debido a la prescripción de antibióticos, esta complicación se presenta en forma aislada y no siempre con la triada común. Chole (1983) publicó ocho casos que confirmaban lo anterior. Debe sospecharse la presencia de petrositis cuando un proceso supurativo del oído se acompaña de dolor ipsolateral intenso y profundo. Se recomienda solicitar estudios radiográficos simples (placa de Stenvers, transorbitaria de Guillen y Towne), los que, en muchos casos, identifican el proceso supurativo del vértice petroso. La tomografía axial computarizada también es muy útil. El tratamiento de esta complicación es quirúrgico (mastoidectomía radical). 87 87 88 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 5 II. Latente: los síntomas son mínimos o no los hay en tanto se organiza el absceso y comienza a expandirse. Puede durar varias semanas. Hay cefalea, irritabilidad o letargo. III. Expansión del absceso: los síntomas y signos se deben a una elevación de la presión intracraneal. A la exploración del fondo de ojo puede encontrarse papiledema. Pueden presentarse crisis convulsivas; la ataxia, la adiodococinesia y el temblor orientan hacia una alteración cerebelosa. El cultivo de la secreción revela una flora mixta, con presencia de anaerobios y gérmenes gramnegativos. En el estudio del líquido cefalorraquídeo hay presión elevada, pleocitosis de 1 a 100 células y aumento de proteínas. En casos de rotura del absceso, el líquido se torna francamente purulento. El electroencefalograma muestra un foco de alto voltaje y baja actividad en la región del absceso. El estudio más fidedigno es la tomografía axial computarizada, que deja ver el sitio y tamaño del absceso y la deformación del sistema ventricular (figura 5–6). El diagnóstico radiográfico diferencial del absceso cerebral es el glioma con centro necrótico y muestra un anillo de márgenes irregulares que no se define tan bien como la cápsula de un absceso. Tratamiento: debe ser medicoquirúrgico. En caso de secreción purulenta a través del oído, se recomienda realizar un cultivo. Está indicada la administración prolongada de antibióticos; la penicilina sódica y el cloranfenicol o las cefalosporinas de tercera generación con aminoglucósidos ofrecen buen resultado. Con respecto al oído, se recomienda que un neurocirujano efectúe punción y aspiración de una mastoidectomía radical y absceso; con posterioridad se valora con una TAC la evolución del absceso y la necesidad de su morcelación. El absceso único, sin coma, tiene en estos días una mortalidad de 7 a 20%. En general, el absceso otógeno del lóbulo temporal evoluciona mejor con respecto a las secuelas neurológicas que los localizados en el lóbulo frontal o parietal y los secundarios a diseminación hematógena. Tromboflebitis del seno lateral: a menudo se desarrolla por una erosión de la lámina ósea del seno lateral debida a una mastoiditis coalescente o crónica. En un estudio efectuado por Samuel (1986) sobre 224 complicaciones intracraneales de origen otógeno, la trombosis del seno lateral representó 17% de los casos. El uso de antimicrobianos para tratar las otitis medias ha reducido en grado considerable la frecuencia de esta complicación. Los senos laterales llevan la mayor parte del drenaje venoso craneal al cuello. La porción sigmoidea del seno lateral recibe al seno petroso superior, que lleva la sangre proveniente del seno cavernoso. El bulbo de la yugular contiene al seno petroso inferior, el cual también lleva sangre del seno cavernoso; en consecuencia, la trombosis del seno lateral puede originar una trombosis del seno cavernoso, a lo largo del seno petroso superior. La trombosis del seno lateral debe considerarse en todo paciente con fiebre séptica o picos febriles acompañados de otitis media aguda o con fiebre intermitente y otorrea crónica. Con frecuencia hay cefalea, papiledema, afección del VI par, dolor en el cuello, opacidad en las celdillas mastoideas y anemia progresiva. Es común la presencia de flora mixta. La trombosis de la vena emisaria mastoidea produce edema en la región mastoidea Figura 5–6. Tomografía axial computarizada que muestra la presencia de un absceso cerebral en el lóbulo temporal, secundario a complicación de una otomastoiditis crónica agudizada. ERRNVPHGLFRVRUJ Oído medio y mastoides a) Arteriografía carotídea. b) Yugulografía retrógrada y, en especial, venografía con técnica de sustracción digital. Se recomienda el tratamiento médico usual, a base de antibióticos, esteroides, punciones lumbares repetidas y diuréticos. Si se deteriora el estado del paciente, sin respuesta al tratamiento conservador, se desarrolla afectación de otros pares craneales (IX, X, XI) o aparecen émbolos sépticos al pulmón o a otras venas, como la subclavia; se recomienda el tratamiento quirúrgico con mastoidectomía amplia y exposición del seno lateral. La porción ósea adyacente al seno se remueve con una fresa de diamante. En caso de periflebitis, el seno lateral adopta un aspecto granuloso rojizo, a menudo envuelto en una secreción purulenta. Este vaso es compresible y no tiene pulsación. En caso de tromboflebitis, el seno tiene por lo general una coloración parda ahumada y muestra pulsación. Debe puncionarse y aspirarse para averiguar si contiene sangre, pus o un trombo. Si se encuentra secreción purulenta, se recomienda abrir el seno lateral para exteriorizar el absceso, ligando previamente la vena yugular interna en el cuello. Una resección parcial de ésta, desde la región digástrica hasta la supraclavicular, representa una maniobra adicional para disminuir la posibilidad de desprendimiento de trombos y embolizaciones subsecuentes a otras estructuras, sobre todo si la afección se ha extendido hacia el agujero yugular. La tromboflebitis del seno lateral tiene una mortalidad del 20 al 30%. Hidrocéfalo ótico: consiste en la elevación de la presión intracraneal, con líquido cefalorraquídeo normal. Puede desarrollarse con una otitis media aguda o crónica. Por lo general, los pacientes refieren cefalea persistente, náusea, vómito, visión borrosa y, en ocasiones, diplopía. En el estudio clínico puede encontrarse papiledema. El tratamiento consiste en punciones lumbares repetidas; si persiste la infección ótica, debe practicarse mastoidectomía con exploración del seno lateral. Al parecer, esta complicación es secundaria a una falla de las granulaciones aracnoideas, que no absorben el líquido cefalorraquídeo que se forma. OTOSCLEROSIS GENERALIDADES La otosclerosis es una enfermedad primaria de la cápsula ósea laberíntica, consistente en la aparición de uno o varios focos localizados, en donde ocurre resorción y depósito de hueso. Es más común en personas de raza caucásica y más frecuente en mujeres (2:1). Al parecer existe una anomalía genética, se transmite por un gen autosómico dominante, y la enfermedad se manifiesta en 40% de los portadores. Weegenink (2011) notificó la presencia de otosclerosis familiar ligada al OTSC10 en el cromosoma 1q41-44. También hay casos espontáneos de otosclerosis que tienen un factor causal diferente, según los estudios de Gregariadis (1982). Por lo regular, el foco de otosclerosis se encuentra en el extremo anterior de la ventana oval; cuando invade al ligamento anular y al estribo ocasiona sordera de conducción. Si el proceso patológico incluye al endostio laberíntico, daña al neuroepitelio coclear y causa sordera de tipo sensorial. Browning (1984) ha demostrado que la otosclerosis estapedial se acompaña de una pequeña pero progresiva hipoacusia sensorial. Se reconoce desde hace muchos años la relación clínica entre otosclerosis y vértigo. Cuanto más extenso sea el foco de otosclerosis, mayores son las posibilidades de presentar hidropesía endolinfática. Paparella (1984) ha señalado una frecuencia de 6% y es secundaria a una deficiente absorción de endolinfa en el saco endolinfático. Gussen (1973) ha señalado que la hidropesía endolinfática que se presenta puede deberse a un drenaje venoso insuficiente de los órganos vestibulares por la vena del canalículo paravestibular. ETIOPATOGÉNESIS Aunque se conoce poco sobre el origen de la otosclerosis, se han descrito varios: puede ser secundaria a la presencia de restos de cartílago inestables e histiocitos en la cápsula laberíntica y fossula ante fenestram. Se cree que la actividad enzimática de los histiocitos origina los cambios otoespongióticos que se producen. Debido a que se ha encontrado de manera experimental que autoanticuerpos anticolágeno pueden producir otosclerosis, la teoría inmunitaria sostiene que ésta es una enfermedad autoinmunitaria, debida a una respuesta anormal por el organismo en contra del colágeno tipo II en la cápsula ótica, por lo que los pacientes deben tener títulos altos de autoanticuerpos contra colágeno. En este caso, el antígeno estimula a los linfocitos T y B. Estos últimos transmiten la información a las células plasmáticas para la producción de un anticuerpo anticolágeno tipo II, que activa al complemento, sobre todo a las fracciones C3a y C5a. Los linfocitos T producen linfocinas, que activan a macrófagos y células citotóxicas, capaces de atacar a los autoanticuerpos formados. Estos procesos tiene como resultado la activación de los osteoclastos, con resorción ósea y activación de fibroblastos, que producen fibrosis y nueva formación ósea (osteoblastos). Al parecer, los monocitos son precursores de los osteoclastos y éstos causan liberación de prostaglandinas. Otros autores han sugerido que la otosclerosis puede ser efecto de un error en la estructura base del tejido conectivo que efectúa el mecanismo de remodelación ósea, ya que se han encontrado grandes concentraciones de colagenasa en la perilinfa y de tripsina en la endolinfa de pacientes con esta entidad. ERRNVPHGLFRVRUJ Capítulo 5 (signo de Griesinger). La prueba de Queckensted o TobeyAyer, que consiste en una punción lumbar, es útil en el diagnóstico de esta complicación. La falta de aumento de la presión del líquido cefalorraquídeo posterior a la compresión de la vena yugular interna del lado afectado, con un incremento de ésta al comprimir la vena yugular interna opuesta, sugiere la presencia de trombosis del seno lateral. Otros estudios de utilidad son: 89 89 90 Oído, nariz, garganta y cirugía de cabeza y cuello También se ha considerado como una enfermedad inflamatoria causada por la persistencia de una infección viral (sarampión) en la cápsula otica, dado que se ha encontrado la nucleoproteína genómica de este virus en platinas anquilosadas. Capítulo 5 Relación entre osteogénesis imperfecta y otosclerosis La osteogénesis imperfecta se caracteriza por formación patológica de colágeno inmaduro, que afecta al sistema musculoesquelético, piel, córnea, oídos y aparato cardiovascular. Existen dos formas: 1. Congénita: se transmite por un gen autosómico dominante; es una forma grave de la enfermedad que, por lo general, provoca la muerte intrauterina del niño, o bien posterior al nacimiento debido a hemorragias cerebrales durante el parto. Los estudios de Berger (1985) no han mostrado pruebas de otosclerosis, sino de osificación anormal 2. Tardía: se transmite en forma autosómica recesiva Presenta el síndrome de van der Hoeve, que consiste en escleróticas azules, fragilidad ósea e hipoacusia conductiva que, si bien similar a la de los individuos con otosclerosis, constituye una entidad patológica diferente, como lo señalan los estudios de Altman y Kornfield (1967). En la osteogénesis imperfecta tardía (OIT), el tejido óseo es difuso, irregular e inmaduro, con más de 50% de áreas ocupadas por zonas de resorción. En la otosclerosis, el tejido óseo es más estructural y organizado, y las zonas de resorción menores de 30%. Con respecto a las enzimas, en OIT aumentan la deshidrogenasa láctica, la fosfohidrolasa y la fosfofructocinasa, mientras que en la otosclerosis sólo se ha detectado aumento de la fosfohidrolasa y de grupos sulfhidrilo libres. Aunque la pérdida auditiva en OIT se observa en 20 a 60% de los casos, y es similar a la registrada en la otosclerosis, su etiopatogénesis es diferente. Tratamiento: estapedectomía. Los focos de otosclerosis consisten en áreas irregulares de formación de nuevo hueso, con abundantes conductos vasculares que se originan en el denso tejido óseo del laberinto. La tinción con hematoxilina-eosina hace que algunas zonas óseas del foco otoscleroso se tiñan de azul; estas áreas se denominan mantos azules y son típicas de esta enfermedad. DIAGNÓSTICO La otosclerosis histopatológica es más común que la clínica. El síntoma cardinal es el desarrollo de hipoacusia de lenta progresión acompañada, algunas veces, de tinnitus y, en forma ocasional, de vértigo. La hipoacusia es casi siempre bilateral, aunque también puede ser unilateral. Es común que la enfermedad se inicie durante la etapa de adulto joven; cuando se presenta en pacientes menores de 20 años, se denomina otosclerosis juvenil. La hipoacusia es progresiva, de tipo conductivo, con periodos de actividad y latencia; con el desarrollo de la enfermedad, la hipoacusia muestra diferentes grados de componente sensorial. Carhart describe una depresión de la conducción ósea más aparente en 2 kHz, que se conoce con el nombre de nicho de Carhart y se observa con frecuencia en los estudios audiológicos. En algunos pacientes con focos de actividad notoria, puede reconocerse una mancha de coloración rojiza a través de la membrana timpánica, conocida como signo de Swartze. El tinnitus se presenta en 30 a 50% de los casos; algunas veces precede a la aparición de la hipoacusia, en especial si es de un solo oído. Prueba con diapasones. La prueba de Rinne es negativa y el Weber se lateraliza hacia el lado más afectado o indiferente; la prueba de Schwabach está alargada. Impedanciometría. Hay una disminución de la movilidad de la membrana timpánica por anquilosis de la articulación estapediovestibular. El tipo de curva habitual durante la timpanometría es la As (clasificación de Jerger); la prueba de Bornier (véase Diapasones en el capítulo 3) debe ser positiva. Estudio audiológico. Incluye los siguientes aspectos: 1. Cuando la platina empieza a fijarse al borde de la ventana oval, casi siempre en su parte anterior, la movilidad es parcial. La audiometría muestra una curva de rigidez que indica la dificultad que presenta la cadena para transmitir los tonos graves (otosclerosis de tipo Bezold). 2. A medida que la platina se anquilosa, se puede advertir que la curva se torna plana de modo gradual. La caída es de unos 60 dB. Si la lesión penetra de modo paulatino en el laberinto, produce trastornos en el oído interno y una caída de los agudos en la vía ósea (otosclerosis de tipo Lermoyes). 3. Cuando la otosclerosis invade desde el inicio las estructuras del oído interno, el resultado es hipoacusia de tipo sensorial, difícil de distinguir de las demás sorderas de percepción (otosclerosis de tipo Manasse). La hipoacusia de la otosclerosis puede ser de tipos conductivo, superficial a profunda, sensorial o mixta, y con o sin pruebas de reclutamiento. Estudios radiográficos. La tomografía axial computarizada representa el método radiográfico más util y que puede demostrar de una manera objetiva la presencia del o los focos de otosclerosis, ya que la fase espongiótica de esta enfernedad es susceptible de ser detectada. Cuando existe una extensa afectación pericoclear se observa el signo del doble anillo. ERRNVPHGLFRVRUJ Oído medio y mastoides DIAGNÓSTICO DIFERENCIAL TRATAMIENTO En general, el tratamiento de la otosclerosis es quirúrgico. La primera descripción de la técnica para remover y extirpar el estribo proviene de Kessel (1876). La era moderna de esta cirugía se inicia con Rosen (1952), quien redescubrió el método para resecar el estribo. Desde que Shea (1958) adoptó la técnica de eliminación del estribo, la estapedectomía se ha convertido en uno de los métodos quirúrgicos con resultados más confiables para pacientes con adecuada reserva coclear. La operación debe efectuarse en el oído con peor audición y, en caso de que la lesión sea bilateral y se hayan obtenido buenos resultados funcionales en la primera intervención, se recomienda operar el oído contralateral seis a 12 meses después para verificar y evaluar la presencia de complicaciones posoperatorias tardías. En la selección de pacientes quirúrgicos es útil la clasificación de Shambaugh de cuatro grupos, según sea la reserva coclear indicada por el estudio audiométrico. Estos grupos se obtienen del promedio aritmético de la percepción ósea en las frecuencias de la palabra (500–1 000–2 000 Hz). Al promedio aritmético se le suman 15 y si el resultado es menor de 30 se incluye en el grupo A; en el B si es de 30 a 45; en el C si es de 45 a 60; y en el D si es mayor de 60. Los casos ideales para estapedectomía son los grupos A y B, y no se recomienda operación para el D. La otosclerosis juvenil no es una contraindicación para el tratamiento quirúrgico, ya que estudios prospectivos no han demostrado una mayor frecuencia de complicaciones o desarrollo de hipoacusia sensorial. Glasscock (1996) sugiere que en casos de otosclerosis muy avanzada, en la que no pueden detectarse umbrales de conducción aérea u ósea, existe la posibilidad de una mejoría en la rehabilitación auditiva al realizar una estapedectomía, ya que al adaptarles un auxiliar auditivo eléctrico le permite a los pacientes oír más en comparación con un implante coclear y sobre todo a un costo menor. Dicho autor ha obtenido resultados favorables en nueve de 15 pacientes operados (60%). Técnica quirúrgica de la estapedectomía 1. Se efectúa por vía intrameatal, a menos que el paciente tenga una estenosis grave, agenesia u osteomas en el conducto auditivo externo; en tales casos son más adecuadas las vías endoaural y retroauricular. 2. Casi siempre es suficiente la anestesia local (xilocaína al 2% con adrenalina) aplicada sobre el tercio externo del conducto auditivo externo (CAE) bajo neuroleptoanestesia. 3. Se toma pericondrio tragal o grasa del lóbulo de la oreja para cerrar la ventana oval. 4. Se realizan dos incisiones verticales, a las 12 y las 6 horas, que partan del surco timpánico hacia la parte externa de CAE. A continuación se traza una incisión horizontal sobre la pared externa del conducto, a unos 8 mm del surco timpánico, que conecta las dos incisiones verticales (se usa el bisturí de Rosen). Las incisiones pueden completarse con microtijeras. 5. Elevación del colgajo timpanomeatal. 6. A nivel del surco se separan el ligamento de Gerlach y la membrana timpánica del hueso para abrir el oído medio. Se desinserta el annulus de las 12 a las 6 horas. 7. Con un gancho fino se identifica la cuerda del tímpano, que se separa de su unión ósea. 8. Se recomienda fresado y legrado del borde de la pared posterior del CAE con el objeto de obtener una mejor visibilidad del estribo y la eminencia piramidal. 9. Se sugiere efectuar todos estos pasos con el microscopio quirúrgico (a 10x y l6x), al trabajar en el estribo y la ventana oval. 10. Se identifica el foco de otosclerosis y se valora si la platina está fijada o no. 11. Luxación de la articulación incudoestapedial (en caso de utilizar la interposición del crus posterior del estribo se omite este paso). 12. Corte del tendón del músculo del estribo, con unas tijeras rectas de cocodrilo. 13. Corte de los crura anterior y posterior (se deja el crus posterior si se decide usar la interposición del estribo). 14. Sólo se divide cerca de la platina y se la fractura con un microgancho. 15. Trabajo sobre la platina del estribo. Se han descrito diferentes técnicas quirúrgicas; las más comunes son las siguientes: a) Cuando se considera eliminar totalmente la platina, se recomienda crear un pequeño orificio central, tratando después de fracturar la platina entre su tercio anterior y los dos tercios posteriores. Con un microgancho se remueve la porción posterior de la platina (puede o no dejarse la anterior). En seguida se coloca el pericondrio o la grasa para sellar la ventana oval, colocando la prótesis de alambre o teflón según sea la distancia que hay entre el yunque y la ventana oval (figura 5–7). b) En otras ocasiones, el cirujano puede decidir efectuar una estapedotomía, que consiste en eliminar sólo una porción de la platina (a menudo central), con el objeto de introducir una prótesis de teflón. La perforación de la platina se realiza con perforadores manuales de 0.4 a 0.6 mm, ERRNVPHGLFRVRUJ Capítulo 5 Debe realizarse con la enfermedad de Paget, síndrome de van der Hoeve, timpanosclerosis, otitis media secretoria, tumores del glomus timpánico, colesteatoma congénito, neurinoma, meningioma, malformaciones del oído medio, atrofia idiopática de la rama larga del yunque, y secuelas traumáticas de la cadena osicular, como dislocación incudoestapedial o incudomaleolar. 91 91 92 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 5 B A C Figura 5–7. Estapedectomía: la figura muestra la fractura y remoción de los fragmentos de la platina del estribo. P, platina del estribo; CT, cuerda del tímpano; Y, yunque; EP, eminencia piramidal; CAE, conducto auditivo externo (pared posterior). Figura 5–8. Colocación de una prótesis de estapedectomía (pistón de Fisch). Nótese el sello de la ventana oval. ERRNVPHGLFRVRUJ Oído medio y mastoides 93 93 Figura 5–9. Técnica de adiestramiento para la colocación de una prótesis de estapedectomía. Nótese que el yunque se ha pegado a una de las paredes de un tubo de ensayo para que la prótesis pueda aplicarse de forma repetida sobre el proceso largo del huesecillo. aunque también se puede utilizar el rayo láser, en especial el de argón o el KTP. Esta técnica resulta también útil en casos de otosclerosis obliterativa, en la cual hay que usar una microfresa para sobrepasar el foco otoscleroso. En tal caso, el sello de la ventana oval se realiza aplicando el material (pericondrio o grasa) alrededor de la prótesis de pistón. En la estapedotomía se coloca primero la prótesis, antes de efectuar las crurectomías y la luxación de la articulación incudoestapedial. El tendón del músculo del estribo puede o no cortarse. Silverstein (1998) sugiere preservarlo cuando sea posible, debido a que éste tiene una función protectora del oído interno en casos de traumatismo acústico, ya que atenúa la resonancia del oído medio. 16. Colocación de la prótesis. Este paso es fundamental y, para obtener mejores resultados, se recomienda seguir en forma previa la técnica de Complicaciones posoperatorias de la estapedectomía Infección: es rara y fácil de prevenir (no debe operarse cuando el paciente presente una infección de vías respiratorias superiores; se evita el contacto con pacientes encamados que tengan alguna infección). Su tratamiento consiste en reposo y antibióticos, de acuerdo con el cultivo. Vértigo: puede encontrarse en 30% de los casos. Por lo general se presenta durante los primeros días del posoperatorio, no es grave y dura una a dos semanas. Cuando el vértigo es intenso, puede ser secundario a una laberintitis que algunas veces afecta la audición. En estos pacientes se inicia tratamiento a base de vasodilatadores. En caso de persistencia del vértigo, se recomienda realizar una tomografía axial computarizada de alta resolución, ya que ésta puede descartar la presencia de un neumolaberinto. Sordera sensorial: es rara y se presenta en menos del 1% de los casos, con frecuencia durante la tercera semana del posoperatorio. Tinnitus: puede ser señal de afectación laberíntica. Tiende a mejorar en 70 a 80% de los casos. Disgeusia: se produce por haber cortado o lesionado la cuerda del tímpano y el paciente refiere un sabor metálico o salado. En apariencia es mejor cortar el nervio que alargarlo. La disgeusia tiende a mejorar con el tiempo y ocurre en menos del 20% de los casos. Granuloma reparativo posestapedectomía: su frecuencia es de 1 al 5%. Hay que sospecharlo cuando el paciente refiera disminución de la audición, oído tapado y vértigo entre el 7º y el 15º días del posoperatorio. Si no se trata el granuloma, produce una laberintitis serosa, tóxica o bioquímica. Su desarrollo parece relacionarse con el uso de solución de Ringer, o por la introducción en el vestíbulo de mucosa del oído medio durante la estapedectomía, aunque Miglets (1979) lo considera poco probable. Otra posible causa es la autoinmunotaria. Hipoacusia conductiva: se debe a necrosis de la rama larga del yunque, desplazamiento de la prótesis, formación de adherencias fibrosas que impiden la movilidad de la prótesis, o a la recurrencia del foco otosclerótico. ERRNVPHGLFRVRUJ Capítulo 5 adiestramiento y práctica descrita por Escajadillo (1986), que consiste en esencia en pegar el yunque a un tubo de ensayo y colocar la prótesis bajo el microscopio, fijándola en repetidas ocasiones (figuras 5–8 y 5–9). Esto da al cirujano el mínimo adiestramiento necesario para realizar este paso en forma satisfactoria. 17. Cierre del campo operatorio, colocando el colgajo timpanomeatal otra vez en su posición original. En caso de perforaciones de la membrana timpánica se pueden colocar pequeñas porciones de fascia temporal homóloga o autóloga. Se recomienda aplicar pedazos pequeños de Gelfoam® en el conducto y empacar éste con una gasa delgada impregnada con solución antibiótica y esteroide, la cual se retira entre el tercer y cuarto días del posoperatorio. 94 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 5 Estos problemas pueden requerir una revisión de la estapedectomía, la cual, en 50 a 80% de los casos, puede mejorar la audición, y en 10% empeorarla. En general, el cirujano debe tener presente que los resultados que se obtienen en la segunda intervención quirúrgica no son tan satisfactorios como los que pueden esperarse durante la operación inicial. Fístula perilinfática: se presenta en 2% de los casos en los que se realizan ventanas amplias o se retira la platina del estribo, y en 0.6% de los casos con ventanas pequeñas. También se puede manisfestar en la forma de un vértigo tardío. Asimismo, puede existir una comunicación anormal entre los espacios perilinfático y subracnoideo y el paciente presentar una profusa salida de líquido cefalorraquídeo al realizar la estapedotomía, y que puede llenar al oído medio en cuestión de segundos (los clínicos estadounidenses denominan a esto gusher estapedial); en estos casos se recomienda sellar la ventana oval con fascia y tejido celular. Después de la estapedectomía, los pacientes pueden presentar una disminución de la audición de unos 5.5 dB por cada decenio de vida, por lo que, en muchos casos, es necesario emplear auxiliares auditivos eléctricos; la técnica de eliminación subtotal o total de la platina se aplica en forma más temprana. Parálisis facial: ésta se puede presentar en forma inmediata a la operación, por traumatismo directo del nervio o bien aparecer durante los primeros días, a menudo antes del décimo día y ser de tipo Bell. Aquí se recomienda la administración de esteroides. Por lo general, la recuperación es completa, pero algunos pacientes pueden requerir descompresión del nervio facial. Causas de revisión de la estapedectomía o la estapedotomía Éstas se relacionan con el fracaso para corregir una hipoacusia conductiva o con el desarrollo de complicaciones. Los pacientes que se someten a una revisión quirúrgica de la estapedectomía presentan una mayor incidencia de hipoacusia sensorial posoperatoria. Entre las causas más frecuentes se encuentran las siguientes: 1. Desplazamiento de la prótesis (25 a 30%); a menudo se acompaña de obliteración de la ventana oval e incluye casos de desprendimiento del ojal de la prótesis. 2. Prótesis de tamaño inadecuado, demasiado corta o larga (15 a 20% de los casos). 3. Erosión del proceso largo del yunque (15%). 4. Adhesiones fibrosas (10 a 15%). 5. Obliteración masiva de la ventana oval (4%). 6. Fístulas de la ventana oval (2%). 7. Nervio facial dehiscente (1.6%). 8. Fijación maleolar (1 a 2%). En general, se puede obtener un 70% de resultados satisfactorios. Si se decide emplear el rayo láser durante la revisión de la estapedectomía, se sugiere el láser de CO2, ya que éste, en vestíbulos abiertos, no tiene una penetración considerable, ni efecto calórico sobre la perilinfa, en comparación con otros láseres. TRATAMIENTO MÉDICO DE LA OTOSCLEROSIS Consiste en administrar fluoruro de sodio. Este fármaco lo empezó a utilizar Albright en 1944. En 1964, Shambaugh y Petrovic condujeron estudios experimentales en animales y huesos con otosclerosis obtenidos durante la operación y encontraron que dosis de 40 a 60 mg diarios de fluoruro de sodio y calcio administrados por vía bucal, así como el uso de vitamina D para producir la fijación de calcio, reducían la actividad osteoclástica, incrementaban la osteoblástica y promovían la calcificación de focos de otosclerosis. Asimismo, se cree que este tratamiento inhibe la actividad enzimática citotóxica del foco otosclerótico, sobre todo a nivel de la tripsina. Está indicado de manera prioritaria en pacientes sin posibilidades quirúrgicas, con hipoacusia sensorial, algunos con otosclerosis juvenil, y como auxiliar terapéutico en el tercer trimestre del embarazo o posterior al parto. LUXACIONES TRAUMÁTICAS DE LA CADENA OSICULAR La hipoacusia conductiva secundaria a luxación de la cadena osicular se presenta en menos de 2% de todos los traumatismos de la cabeza y en un 35 a 40% de las fracturas del hueso temporal. Las lesiones osiculares postraumáticas más frecuentes son: a) Luxación de la articulación incudoestapedial. b) Luxación del yunque. c) Fracturas de los crura del estribo. d) Fijación de la cabeza del martillo por adherencias fibrosas. e) Fractura del mango del martillo. El martillo es el huesecillo que se lesiona con menos frecuencia. La presencia concomitante de hemotímpano (20% de las fracturas del hueso temporal) puede desarrollar fibrosis en el oído medio en relación con la lesión osicular. Diagnóstico Otoscopia neumática Se valora la movilidad de la membrana timpánica y la presencia o ausencia de movimientos anormales en el mango del martillo. Impedanciometría El timpanograma muestra un aumento de la adaptabilidad, con curva tipo Ad (Jerger). Asimismo, es común la ERRNVPHGLFRVRUJ Oído medio y mastoides ausencia del reflejo estapedial, aunque su presencia no descarta la posibilidad de lesión osicular. Tratamiento Se recomienda revisión quirúrgica del estado de la cadena osicular. Según sean la intensidad y el tipo de traumatismo, se emplea la vía endoaural con levantamiento de un colgajo timpanomeatal, o la vía transmastoidea, con aticotomía y timpanotomía posterior. Se debe limpiar y liberar de adherencias la cadena osicular y, en caso de lesión del yunque, se recomienda la interposición de éste (homóloga o autóloga), lo cual ha dado resultados funcionales satisfactorios. En caso de fractura del martillo o el yunque se puede usar un cemento para hueso a base de fosfato de calcio (Biopex®), que es biocompatible y facil de emplear, y al que se le puede agregar un sellador de fibrina. LESIONES DEL OÍDO POR RAYOS (QUERAUNOPATOLOGÍA DEL OÍDO) El término queraunopatología procede de la palabra en griego keraunos (rayo, relámpago), pathos (enfermedad) y logos (tratado o estudio). Alrededor del mundo, las muertes causadas por rayos varían de 0.2 a 1.7% por millón de habitantes. Es de interés considerar que, si bien los rayos generan un tremendo voltaje y amperaje, cerca del 75% de las víctimas sobrevive a este episodio. Las lesiones cutáneas por rayos se caracterizan por quemaduras lineales, con un patrón ceuranográfico, que se caracteriza por eritema superficial y lesiones arborescentes a las que se les denomina figuras de Lichtenberg y que representan la descarga de la energía estática a lo largo de la vasculatura superficial. La arborización se determina por la magnitud y polaridad de la descarga y, en forma secundaria, por las condiciones de la piel. Entre las lesiones óticas que se encuentran con mayor frecuencia figuran las perforaciones de la membrana timpánica. Se observan en 81% de las víctimas y pueden ser unilaterales o bilaterales, así como rotura de la membrana de Reissner, degeneración de la estría vascular y del órgano de Corti, lo que se vincula con hipoacusias sensoriales. También se puede presentar vértigo y desequilibrio. Es rara la presencia de luxaciones o fracturas de la cadena de huesecillos, así como de fracturas del hueso temporal, aunque éstas, cuando se presentan, son secundarias a caídas. La descarga de la energía estática origina quemaduras sobre los pequeños vasos de la membrana timpánica, además de generar calor por la resistencia eléctrica, situación que lleva a la producción de perforaciones amplias o subtotales. Por lo general, el annulus timpánico se conserva intacto. ARTRITIS REUMATOIDE Y CADENA OSICULAR Las articulaciones incudomaleolares e incudoestapediales son sinoviales y contienen discos articulares cartilaginosos, por lo que se pueden afectar por artritis reumatoide. Gussen (1977) ha señalado la existencia de artritis reumatoide de la cadena osicular en la necropsia de un paciente con artritis reumatoide. Esta entidad se denomina otoartritis. Estudios efectuados por Reiter (1980) han mostrado que los pacientes con artritis reumatoide tienen mayor pérdida auditiva conductiva o sensorial que el resto de la población. Al parecer, el uso de salicilatos explica por qué es frecuente encontrar pérdida auditiva de tipo sensorial. Por otro lado, se cree que la artritis reumatoide produce una disminución de la rigidez de las articulaciones osiculares como consecuencia de resorción anormal de colágeno. GRANULOMAS DEL OÍDO MEDIO GRANULOMATOSIS DE WEGENER Friedrich Wegener describió esta enfermedad en 1936 y consiste en una vasculitis que afecta el aparato respiratorio superior y, en casos típicos, se acompaña de glomerulonefritis. También se ha demostrado afectación de pequeñas arterias y venas. Se cree que se trata de una enfermedad de origen autoinmunitario. En 20 a 40% de los casos se reconocen manifestaciones otológicas, como otitis medias recurrentes, serosas o purulentas (estas últimas secundarias a Streptococcus aureus o Pseudomonas aeruginosa), parálisis faciales y destrucción de la porción petrosa del hueso temporal. En ocasiones es difícil confirmar su diagnóstico histopatológico por lo que se recomienda tomar biopsias de los bordes de las lesiones encontradas, sobre todo de la región nasal, en donde la enfermedad se manifiesta en cerca de 90% de los casos. Debe tenerse presente esta enfermedad en estados inflamatorios crónicos y atípicos del oído. Esta enfermedad puede afectar, además de los oídos, nariz y garganta, al pulmón y riñón, por lo que se ha creado un sistema de clasificación de ésta basada en las letras E (ear = oído), L (lung = pulmón), K (kidney = riñón). La letra E representa también la aparición de esta alteración en la nariz y la garganta. Davies (1982) describe la presencia de autoanticuerpos antineutrofílicos (ANCA), los cuales tienen dos subtipos, uno con patrón citoplásmico (C– ANCA) y otro con patrón perinuclear (P–ANCA). La presencia de C– ANCA es altamente específica de granulomatosis de Wegener, por lo que dicha prueba ha ayudado a la detec- ERRNVPHGLFRVRUJ Capítulo 5 Audiometría Se observa una diferencia entre los umbrales de conducción aéreos y óseos (hipoacusia conductiva). En ocasiones, el audiograma muestra la presencia de hipoacusia mixta, debido a la pérdida neurosensorial que es frecuente después de un traumatismo otológico (13 a 80% de los traumatismos de hueso temporal). 95 95 96 Oído, nariz, garganta y cirugía de cabeza y cuello ción más temprana de esta enfermedad. Su tratamiento consiste en el uso de citotóxicos (ciclofosfamida, a dosis de 75 a 100 mg/día). Estos fármacos pueden disminuirse según sea la respuesta clínica y después suspenderse. Capítulo 5 HISTIOCITOSIS X (HISTIOCITOSIS DE CÉLULAS DE LANGERHANS) Existen tres variedades: a) Histiocitosis diseminada aguda (enfermedad de Letterer–Siwe). b) Histiocitosis diseminada crónica (enfermedad de Hans–Schüller–Christian). c) Granuloma eosinófilo. La histiocitosis daña a un histiocito llamado célula de Langerhans, por lo que un término más apropiado para referirse a esta entidad, de acuerdo con la Sociedad Médica del Histiocito (1987), es el de histiocitosis de células de Langerhans, la cual representa una proliferación clonal de células; en realidad, se ha conjeturado que se trata de una enfermedad neoplásica. La cabeza y el cuello se encuentran afectados en un 80% de los casos. La enfermedad de Letterer–Siwe es más frecuente en lactantes y niños menores de tres años. Tiene una afectación multiorgánica y se caracteriza por fiebre, exantema, linfadenopatía, hepatoesplenomegalia, disemia y discrasia sanguínea. La enfermedad de Hans–Shüller–Christian predomina en niños de uno a cinco años. Se caracteriza por lesiones óseas multifocales, con una limitada afectación extraesquelética. En 25% de los casos se presenta diabetes insípida, lesiones craneales osteolíticas o exoftalmos. El granuloma eosinófilo incluye tan sólo a la enfermedad ósea, limitada con mayor frecuencia al cráneo (50% de los casos). Predomina en niños y jóvenes; en 75% de los casos, los pacientes son menores de 20 años. La histiocitosis X se caracteriza por tres patrones de reacción: a) Proliferativo. b) Granulomatoso. c) Xantomatoso. Cuando hay exantema, se sugiere realizar una biopsia de esta lesión, ya que ayuda a establecer el diagnóstico. Manifestaciones otológicas se presentan en 35% de los casos. Las lesiones del hueso temporal en la histiocitosis X progresan de manera asentomática y en algunos casos erosionan la pared posterior del conducto auditivo externo, la corteza mastoidea y el tegmen timpánico y mastoideo, de tal modo que se expone la dura de las fosas media y posterior. Es frecuente el desarrollo secundario de procesos infecciosos del oído y la presencia de complicaciones otógenas. Puede ser útil administrar citotóxicos y radioterapia. SEUDOTUMORES FIBROINFLAMATORIOS DEL OÍDO MEDIO Los seudotumores fibroinflamatorios constituyen lesiones destructivas locales, histológicamente benignas, compuestas por tejido fibrovascular con células inflamatorias crónicas. A menudo se confunden con granulomas de células plasmáticas o con histiocitomas fibrosos. Su patogénesis es incierta, pero se relaciona con una reacción inflamatoria inespecífica a diferentes estímulos, en especial a infección crónica. Hasta el momento existen casos aislados reportados que afectan al oído medio. Su diagnóstico se establece con tomografía de alta resolución, en la cual se observa una masa de partes blandas con destrucción ósea local, tanto del oído medio como del oído interno. Su tratamiento es quirúrgico. ANOMALÍAS VASCULARES DEL OÍDO MEDIO 1. Golfo de la yugular dehiscente. En el adulto normal, el golfo de la yugular se encuentra separado del hipotímpano por una delgada lámina ósea, que en 6% de los casos puede protruir por arriba del piso del conducto auditivo externo. La dehiscencia del golfo de la yugular es más frecuente en el oído derecho y se vincula con hipoacusias de tipo conductivo, debida a pérdida de la movilidad de la membrana timpánica, afectación de la cadena osicular u oclusión del nicho de la ventana redonda. También es frecuente que los pacientes se quejen de acúfeno. Puede ser causa de hemorragia masiva durante la realización de miringotomías, elaboración de colgajos timpanomeatales o durante operaciones del oído medio. La hemorragia puede controlarse con un taponamiento de Gelfoam® y tiras de gasa con vaselina. 2. Arteria carótida interna aberrante. Ésta se observa en la pared anterior de la cavidad del oído medio como una masa pulsátil de coloración rojiza azulada y que puede dirigirse hacia el hipotímpano. Su diagnóstico diferencial se establece con un tumor del glomus timpánico, un tumor del glomus yugular y hemangioma del hueso temporal. Los síntomas que produce son acúfeno pulsátil, hipoacusia conductiva y otalgia. En general, el diagnóstico de las lesiones vasculares del oído medio se establece con angiografía y resonancia magnética, venografía o tomografía axial computarizada con medio de contraste. 3. Persistencia de la arteria estapedial. Constituye una anomalía vascular congénita. Esta arteria proviene del segmento dorsal del segundo arco branquial y persiste durante un corto periodo embrionario, para degenerar hacia el tercer mes de vida fetal. La persistencia de esta arteria constituye la anomalía vascular congénita más común del oído medio, con una incidencia de 1:5 000 a 1:10 000. Dicha arteria tiene una rama dorsal que se incorpora ERRNVPHGLFRVRUJ Oído medio y mastoides TUMORES DEL OÍDO MEDIO Y LA MASTOIDES TUMORES BENIGNOS Tumores del glomus yugular Hallet (1957) describió el cuerpo carotídeo como una estructura anatómica de la bifurcación carotídea. Está constituido por células que no producen una reacción cromafín histológica y son estructuralmente similares a las células paraganglionares. Se han descrito tumoraciones con histología similar en otras áreas anatómicas de cabeza y cuello. El 98% de los paragangliomas extrasuprarrenales lo constituyen los tumores del cuerpo carotídeo, el glomus yugular y el glomus timpánico. El tumor del glomus yugular surge de la adventicia del bulbo de la yugular a lo largo de los nervios de Jacobson y Arnold, por dentro de la hendidura timpánica. En 1945, Rosenwasser fue el primero en describir la extirpación quirúrgica de un tumor del glomus en oído medio. El riego de este tumor es fundamentalmente a través de la arteria faríngea ascendente, y en forma adicional por la arteria auricular posterior, occipital, ramas de la maxialar interna y la carótida interna. Su drenaje venoso proviene de los senos sigmoideo y petrosos superior e inferior. Constituye el tumor benigno más frecuente del oído medio. Es de crecimiento lento y da lugar a síntomas a través de invasión local y destrucción. Rara vez es maligno y en el 2 a 4% de los casos puede emitir metástasis regionales o a distancia. Asimismo, existe una predisposición hereditaria. El locus del gen que origina los paragangliomas no cromafines se encuentra en el cromosoma 11q23, aunque también se han demostrado en el locus q13 del cromosoma 11, en paragangliomas hereditarios. El sistema paraganglionar está formado por numerosas colecciones de células neuroepiteliales distribuidas en todo el cuerpo. El miembro más conspicuo de este sistema es la médula suprarrenal, un sistema neuroefector conectado con el sistema ortosimpático. El sistema paraganglionar extrasuprarrenal se divide en: 1. El relacionado con el sistema parasimpático (pares craneales IX y X). 2. El conectado con el sistema ortosimpático. Los primeros no son cromafines, se concentran en cabeza, cuello y mediastino, y al parecer presentan una función quimiorreceptora. Los segundos son cromafines, a lo largo de las regiones paraórtica y toracolumbar, y probablemente representan restos homólogos de la médula adrenal. Los tumores que surgen de estas estructuras se denominan paragangliomas. En el plano histológico se caracterizan por nidos bien definidos de células cuboides, separadas por tabiques fibrosos muy vascularizados y enmarcados por fibras reticulares. Son células con citoplasma granular fino. Se observan mitosis ocasionales, que no deben interpretarse como signo de malignidad. Con la técnica de Del Río–Ortega pueden demostrarse células argentafines y argirófilas, rara vez identificadas con la técnica de Fontana– Masson. Las preparaciones tratadas con congelación y desecación o fijadas con formaldehído muestran una fluorescencia brillante, indicativa de catecolaminas. Cuadro clínico: 1. El tumor del glomus yugular es más frecuente entre los 50 y 60 años, aunque puede encontrarse desde la adolescencia. 2. Se presenta más en el sexo femenino en relación de 5:1. 3. El oído afectado más a menudo es el izquierdo. 4. Hay predisposición racial y genética (relación 2:1 entre razas blanca y negra). 5. El promedio de duración de los síntomas, desde su aparición hasta el diagnóstico, es de siete a nueve años. 6. Los síntomas más comunes son: a) Hipoacusia, casi siempre de tipo conductivo. b) Tinnitus de tipo pulsátil. c) Afectación de pares craneales en 25% de los casos; el VII par y los del orificio yugular (IX, X y XI) son los que se lesionan con mayor frecuencia. d) Vértigo, hemorragia y otalgia, que son menos comunes. 7. La exploración puede revelar la presencia de una masa de aspecto polipoide detrás de la membrana timpánica y, en ocasiones, en el conducto auditivo externo. La membrana timpánica muestra una coloración azulada o gris oscuro, lo que a menudo se confunde con hemotímpano. Del 1 al 4% de los tumores del glomus yugular secretan catecolaminas, junto con la presencia de cefalea, palpitaciones, aumento de la perspiración, palidez, temblor y ansiedad. Diagnóstico, estudios de laboratorio y gabinete: 1. Se ha señalado que la frecuencia de actividad funcional en los tumores del glomus yugular es de 1%. Sin embargo, se requiere un incremento de cuatro a cinco veces los valores normales de noradrenalina para producir síntomas clínicos. Para valorar si los tumores del glomus secretan o no catecolaminas en 24 h (valores normales, 20 a 100 mg) se determina el ácido vanililmandélico en orina (1.8 a 7.0 mg). ERRNVPHGLFRVRUJ Capítulo 5 a la rama anterior de la arteria meníngea media y una rama ventral cuyo tronco común forma el cabo proximal de la arteria meníngea media. La arteria estapedial es una rama de la arteria carótida interna. Su persistencia se relaciona a menudo con otras anomalías del oído medio que afectan al estribo y el nervio facial. Boscia (1990) informó un caso de tumor del glomus timpánico irrigado por una arteria estapedial persistente. 97 97 98 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 5 2. Hay marcadores neuroendocrinos tumorales para los paragangliomas, como la enolasa, que es una enzima glucolítica. 3. La angiografía carotídea con técnica de sustracción, que es el método radiográfico más útil, demuestra la existencia del tumor vascular. 4. La yugulografía retrógrada sirve para evaluar la afección mural de la vena yugular interna y el estado de los senos venosos. 5. La tomografía axial computarizada con medio de contraste contribuye a definir el grado de destrucción ósea e invasión intracraneal. 6. Resonancia magnética con gadolinio. Complementa los estudios anteriores y ayuda a definir la tumoración y su relación con la invasión vascular. 7. Es práctico usar radioisótopos radiactivos (tecnecio 99 [99TC]) en pacientes con tumoraciones mayores de 2 cm; las menores de 2 cm son difíciles de ver. Clasificación clínica de los paragangliomas que surgen del hueso temporal Clase A: tumores limitados al tímpano, que surgen en el promontorio y que no presentan destrucción ósea. Clase B: tumores que afectan al tímpano, con o sin extensión a la mastoides, pero que surgen de la región hipotimpánica; el hueso cortical sobre el bulbo de la yugular se encuentra intacto. Clase C: tumores que se extienden y destruyen el hueso de los compartimientos infralaberínticos, retrolaberínticos y apicales del hueso temporal. Hay erosión sobre el hueso cortical en el bulbo de la yugular, y se subclasifican en: C1: tumores que no afectan el conducto carotídeo o tan sólo envuelven parcialmente al foramen caroticum. C2: tumores que afectan la porción vertical del conducto carotídeo. C3: tumores que se extienden hacia las porciones horizontal y vertical del conducto carotídeo. C4: tumores con extensión hacia el foramen lacerum ipsolateral y el seno cavernoso. Clase D: tumores con extensión intracraneal i = intracraneal. e = extradural. De1 = tumores con extensión intracraneal extradural no mayor de 2 cm. De2 = tumores con extensión intracraneal extradural, mayor de 2 cm. Di1 = tumores con extensión intracraneal intradural, no mayor de 2 cm. Di2 = tumores con extensión intracraneal intradural, mayor de 2 cm. Di3 = tumores con extensión intracraneal, inoperables. Tratamiento El tratamiento ideal de estos tumores es quirúrgico, siempre y cuando las condiciones generales del paciente lo permitan: 1. Tumores de tipos A y B. Su tratamiento consiste en la extirpación radical por vía transmastoidea o transmeatal. 2. Los tumores de tipo C y D requieren abordarse a través de la fosa infratemporal, con transposición anterior del nervio facial. En caso de extensión intracraneal, el tumor puede resecarse en dos tiempos quirúrgicos (neurootológico y neuroquirúrgico). Descripción de la técnica quirúrgica en la vía infratemporal: a) Incisión retroauricular amplia en forma de S, trazada desde la región frontoparietal hasta la porción superior del cuello a nivel del músculo esternocleidomastoideo. b) Liberación del músculo esternocleidomastoideo de su inserción en la punta de la mastoides. c) Levantamiento del colgajo retroauricular con sección del conducto auditivo externo en su porción cartilaginosa. d) Identificación en cuello de vena yugular y arteria carotídea internas. e) Mastoidectomía radical amplia, con esqueletización del seno sigmoideo; se desarticula la cadena osicular, dejando sólo al estribo o su platina. f) Esqueletización del nervio facial, previo fresado de la punta de la mastoides; en este tiempo, según sea la malformación, se decide si se crea un puente por debajo del conducto del facial o se libera el nervio, llevándolo a una zona más anterior, previa exposición a nivel del agujero estilomastoideo y liberación del tejido fibroconectivo en esta área. g) Ligadura en cuello de la vena yugular interna. h) Ligadura en el seno sigmoideo. i) Disección del tumor sobre la arteria carótida interna. Este paso se facilita mediante retracción sobre el ángulo mandibular, luxando la articulación temporomandibular o, de modo ocasional, con una osteotomía mandibular. j) Colocación de fascia temporal sobre el defecto quirúrgico. La cavidad se oblitera con colgajos musculares locales. k) La embolización preoperatoria de las arterias faríngea ascendente y occipital con Gelfoam® ayuda a disminuir la hemorragia durante la operación; también se recomienda la hipotensión controlada durante el transoperatorio (figura 5–10). 3. La radioterapia se aplica cuando la intervención no esté indicada por edad avanzada o mal estado general del enfermo, y en quienes se efectúa una resección subtotal. Schwannomas del agujero yugular Son tumores raros de crecimiento más lento que los del glomus yugular y, por lo general, de una evolución menos agresiva. Estos tumores pueden aparecer en cualquier nervio craneal del cuello y en la cadena cervical simpáti- ERRNVPHGLFRVRUJ Oído medio y mastoides 99 99 quienes la audición es útil, la vía retrolaberíntica resulta ideal. Ambas pueden extenderse hacia la región suboccipital, en caso necesario. 2. Cuando el schwannoma presenta una extensión extracraneal hacia el cuello, la vía infratemporal ofrece una adecuada exposición. Neoplasias adenomatosas primarias del oído medio Debido a que estas neoplasias presentan infiltración e invasión de partes blandas, a menudo se clasifican como adenocarcinomas bien diferenciados. Sin embargo, no presentan otras características de malignidad, como pleomorfismo celular, núcleos caprichosos o metástasis regionales o distantes. El tratamiento consiste en escisión local. Las recurrencias son raras cuando el tumor se extirpa en su totalidad. La vía sugerida es la timpanotomía transmeatal. Meningioma intratimpánico Figura 5–10. Vía infratemporal: el nervio facial se ha esqueletizado, al igual que la vena yugular interna y la arteria carótida interna. Se identifica la cavidad de la mastoides, posterior a una mastoidectomía radical, y el conducto auditivo externo se ha seccionado y rechazado hacia delante. Nótense los nervios hipogloso, espinal accesorio y vago. NF, nervio facial; CM, cavidad de la mastoides; C, cóclea; ACI, arteria carótida interna; VYI, vena yugular interna; NV, nervio vago; MEF, músculo estilofaríngeo; MD, músculo digástrico (vientre posterior); NH, nervio hipogloso; NEA, nervio espinal accesorio; CO, cóndilo mandibular; CG, cavidad glenoidea. ca. El 25% de los schwannomas se presenta en cabeza y cuello. En los planos clínico y radiográfico pueden asemejarse a los tumores del glomus yugular. El cuadro clínico se caracteriza por hipoacusia (la más frecuente es la de tipo neumosensorial, es decir, compromiso del VIII par) y desarrollo de un síndrome del foramen yugular con lesión de los pares craneales IX, X y XI. Muchas veces, uno de los primeros síntomas que los pacientes refieren es el cambio de voz (disfonía). La tomografía axial computarizada ayuda a definir estos tumores, que presentan una cápsula bien definida con bordes regulares, a diferencia de los del glomus yugular, en los que se identifican una erosión ósea y márgenes intracraneales irregulares. Otro estudio útil es la angiografía carotídea y la vertebral, que revela la presencia de un tumor relativamente avascular. El tratamiento de estos tumores es quirúrgico: 1. Cuando los pacientes tienen una audición disfuncional, sin extensión cervical de la tumoración, se recomienda utilizar la vía translaberíntica, y en Es un tumor raro que se origina de las vellosidades aracnoideas y afecta al oído medio en forma ocasional. Este tumor es propenso a diseminarse a través de los conductos haversianos. La frecuencia de meningiomas extracraneales primarios es de 0.9% y la de los secundarios de 2%. Lo más común es encontrar una invasión o extensión secundaria a un tumor intracraneal. El origen de los meningiomas extracraneales es: a) Meningocitos a lo largo de las vainas de los nervios craneales. b) Células mesenquimatosas especializadas (fibroblásticas). Se reconocen cuatro variedades histopatológicas de meningiomas: 1. Sincitial. 2. Transicional. 3. Fibrosa. 4. Angioblástica. Las primeras dos son las más frecuentes en cabeza y cuello. Estos tumores se caracterizan por la presencia de cuerpos samomatosos (figura 5–11). De los meningiomas intratemporales, el 45% surge del oído medio y 30% del nervio facial. Los síntomas más comunes son: hipoacusia, tinnitus, cefalea y otalgia. Diagnóstico: tomografía axial computarizada y angiografía carotídea. El tratamiento de elección es quirúrgico y el mejor pronóstico se establece cuando el tumor es intratemporal respecto de cuando afecta por contigüidad. En casos de recurrencia o en tumores no resecables, la radioterapia es útil como tratamiento paliativo. ERRNVPHGLFRVRUJ Capítulo 5 La extirpación de neuromas que afectan al foramen yugular causa secuelas como parálisis de los pares craneales IX, X y XI. 100 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 5 moides, que muestran características de presentación similares a las de los dos grupos anteriores. Los papilomas schneiderianos del oído medio son muy raros, con no más de 10 casos informados en las publicaciones médicas y 50% de éstos se relaciona con antecedentes de papilomas nasosinusales o con recidivas extensas de éstos. Se vinculan con carcinomas epidermoides en 5 a 13%. Su causa se debe a una migración ectópica de la membrana ectodérmica schneideriana que cubre la cavidad nasosinusal, hacia la mucosa endodérmica del epitelio respiratorio superior, incluido el receso tubotimpánico que forma la cavidad timpánica y la trompa de Eustaquio. La tomografía axial computarizada muestra por lo regular una densidad de tejido blando en el oído medio, que cubre al hipotímpano y se extiende hacia el orificio tubario. El tratamiento de estos tumores es quirúrgico y depende de la extensión de la tumoración, pero casi siempre consiste en una mastoidectomía radical. TUMORES MALIGNOS Carcinoma epidermoide el oído medio y la mastoides Comprende el 70 a 90% de las neoplasias malignas de esta zona. Algunas características clínicas que deben hacer sospechar la presencia de estos tumores son: Figura 5–11. Radiografía lateral de cráneo que muestra la presencia de una tumoración intracraneal de la región frontotemporal (meningioma) y en la que se observa con claridad la existencia de cuerpos psamomatosos. Quistes dermoides Son formas simples de teratoma que se presentan en cualquier parte del cuerpo. Muchas veces se encuentran llenos de un material grasoso de consistencia gelatinosa, en el que puede encontrarse algo de pelo. Estos quistes, que son muy raros, se han presentado en la mastoides. Osteomas del oído medio. Los osteomas del hueso temporal aparecen por lo general en el conducto auditivo externo y el oído medio es su localización más rara. Éstos pueden interferir con la movilidad de la cadena osicular y provocar hipoacusias conductivas. Hasta el momento existen menos de 10 casos notificados en las publicaciones. Evans (2011) informó un osteoma que surgía del martillo y que se manifestó en la forma de una masa por detrás de la membrana timpánica. Papiloma schneideriano del oído medio. Los papilomas schneiderianos son neoplasias benignas de origen ectodérmico que se derivan de la mucosa del trayecto sinonasal y se clasifican en septales o fungiformes, invertidos y cilíndricos. Por lo general, los papilomas invertidos surgen de la pared lateral de la nariz, mientras que los fungiformes lo hacen del septum nasal y los cilíndricos contienen células columnares y escasas células epider- 1. Otitis externa rebelde, con presencia de tejido de granulación, o pólipos provenientes del oído medio. Se recomienda que cualquier pólipo acompañado de supuración crónica del oído se envíe a estudio histopatológico. 2. Lesiones timpánicas con hemorragia. 3. Parálisis facial en una otitis media crónica no agudizada. 4. Otalgia intensa. Es frecuente el antecedente de otitis media crónica supurativa que, por irritación del epitelio del oído medio, puede inducir cambios metaplásicos y ayudar al desarrollo de carcinoma. Por otro lado, es común que los carcinomas del oído medio hayan causado una destrucción ósea extensa antes de diagnosticarse, lo que hace que el pronóstico sea malo. El tratamiento de estos tumores consiste en resección y radioterapia. Cuando el estado del paciente lo permita, el tratamiento de elección es la petrosectomía subtotal (técnica de Conley y Lewis), siempre que no haya extensión extratemporal del carcinoma. En otras ocasiones es útil la mastoidectomía radical, seguida de radioterapia (57 Gy). Para evitar osteorradionecrosis posradioterapia con rayos X, se recomienda obliterar la cavidad con músculo. Técnica para extirpar hueso temporal (petrosectomía subtotal): a) Incisión en Y (por delante y atrás del pabellón auricular, uniendo estas incisiones por debajo del lóbulo). ERRNVPHGLFRVRUJ 101 101 Oído medio y mastoides Capítulo 5 b) Sección del conducto auditivo externo en su porción cartilaginosa, llevando el colgajo de piel con el pabellón auricular en dirección lo más anterior posible. c) Exposición de la fosa media, con fresado y extracción de una porción rectangular de la escama del temporal, que se reemplaza al final de la intervención. d) Fresado de la mastoides, con exposición del seno sigmoideo. e) Separación de la duramadre de la porción petrosa del hueso temporal y de una porción del ala mayor del esfenoides. El seno petroso superior se liga o coagula con un bipolar. f) Control de la hemorragia de la arteria meníngea media. A continuación se inicia el fresado de la pirámide petrosa del hueso del temporal, comenzando en su región posterosuperior, a través del denso hueso laberíntico por detrás del conducto auditivo externo. Debe tenerse sumo cuidado durante este tiempo quirúrgico para no lesionar la arteria carótida interna. A medida que la disección se acerca al conducto carotídeo, se recomienda usar fresas de diamante. g) Se divide la raíz del cigoma enfrente de la cavidad glenoidea y la apófisis estiloides se fractura y secciona. h) Liberación de la pieza del seno lateral, el bulbo de la yugular, la vena yugular interna y la arteria carótida. i) Liberación de sus uniones con los músculos del cuello (esternocleidomastoideo y vientre posterior del digástrico). j) Durante la operación se valora la necesidad de incluir en la pieza operatoria el cóndilo mandibular y la glándula parótida. En ocasiones, este procedimiento se lleva a cabo en conjunto con una disección radical de cuello. k) Si la duramadre está afectada por la tumoración, se reconstruye con tendón de la fascia lata. Luego se fija la escama del temporal a la porción de hueso previamente extraída, mediante hilo de alambre. l) Se oblitera la cavidad con colgajos musculares provenientes del cuello o el músculo temporal. m)Se cierran los bordes del conducto auditivo externo. n) El nervio facial, que se seccionó durante el procedimiento, puede reconstruirse con injertos de nervio (auricular mayor), o posteriormente con una anastomosis entre los pares VII y XII (figura 5–12). Este procedimiento tiene un 20% de mortalidad operatoria. El paciente presenta parálisis facial, aunada a paresia o parálisis de los pares craneales IX, X y XI. Entre las complicaciones posoperatorias se encuentran las siguientes: 1. Fístula de líquido cefalorraquídeo. 2. Accidentes cerebrovasculares, que puedan ocasionar hemiplejía o afasia. 3. Meningitis y encefalitis. 4. Hemorragia de la arteria carótida. 5. Herniación del cerebro. D AP CAE C ACI NF Figura 5–12. Técnica de remoción del hueso temporal: se ha eliminado una porción de hueso de la escama del temporal y completado una mastoidectomía con exposición del seno lateral y la vena yugular interna. Hacia delante se practicó osteotomía sobre la raíz del cigoma, exponiendo además el cóndilo mandibular. El nervio facial se encuentra seccionado y se fresa la pirámide petrosa del hueso temporal, previa retracción de la duramadre y el lóbulo temporal. D, duramadre; AP, ápex petroso; CAE, conducto auditivo externo; C, cigoma; ACI, arteria carótida interna; VYI, vena yugular interna; NF, nervio facial. Carcinoma verrugoso del oído medio El primero en publicarlo fue Woodson en 1981. Se trata de un tumor vegetante exofítico con invasión local y muy baja frecuencia de metástasis. Desde el punto de vista histológico existe proliferación papilomatosa del epitelio escamoso queratinizado, con acantosis, hiperqueratosis y paraqueratosis. En el diagnóstico diferencial de este padecimiento deben tenerse presentes el colesteatoma del oído medio, el carcinoma epidermoide, la hiperplasia seudoepiteliomatosa, la osteomielitis y la otitis externa maligna. El 50% de los casos se acompaña de otomastoiditis crónica. La frecuencia de parálisis facial es de 1%. Este tumor se describió por primera vez en la bucofaringe. Su tratamiento es quirúrgico. En casos de recidiva local, resección subtotal o comportamiento agresivo, se recomienda la radioterapia. ERRNVPHGLFRVRUJ 102 Oído, nariz, garganta y cirugía de cabeza y cuello Sarcoma granulocítico del oído medio (cloroma) Capítulo 5 Es una neoplasia maligna compuesta por células inmaduras de la serie granulocítica. Se relaciona con la leucemia mielocítica crónica o mieloblástica aguda, aunque puede preceder a la aparición de ésta por un año o más. Cuando el cloroma se presenta en oído medio, puede manifestarse como una otomastoiditis aguda. Este tumor se caracteriza por una coloración verdosa en algunos de sus nódulos. Es frecuente encontrarlo cerca de estructuras óseas, sobre vainas perineurales y estructuras epidurales. En 17% de los casos se presenta alteración mastoidea secundaria a enfermedad leucémica. Sarcomas del oído medio y la mastoides Cuando ocurren ataques transitorios y recurrentes de parálisis facial durante largos periodos debe sospecharse la presencia de neoplasias del oído. Otro signo importante es la manifestación de otalgia persistente en ausencia de infección ótica. Se recomienda, en general, tomar biopsia de todo tumor firme proveniente del conducto auditivo externo o el oído medio. Los sarcomas son tumores poco comunes del hueso temporal y algunas de las variedades que más se presentan son: Rabdomiosarcoma: en pacientes jóvenes es más frecuente la variedad embrionaria y aparece sobre todo en la cavidad mastoidea y la hendidura timpánica. Su presentación clínica es similar a la de una otitis media crónica, con otorrea purulenta, algunas veces sanguinolenta, otalgia, presencia de pólipos y tejido de granulación, que no responde al tratamiento con antimicrobianos. Provoca parálisis facial y de otros pares craneales como V, X, XI, y XII. Son tumores de comportamiento muy agresivo y, en general, el pronóstico es malo. Por lo tanto, se refiere a cabeza y cuello, es más común encontrarlos en la órbita y la región etmoidal. Se recomienda tratamiento combinado a base de operación (mastoidectomía o petrosectomía subtotal), radioterapia y quimioterapia preoperatoria y posoperatoria (esquema CI–VADIC: ciclofosfamida, vincristina, adriamicina y DTIC). Fibrosarcoma: se han publicado casos aislados. Es frecuente la erosión de la pared posterior del conducto auditivo externo. En el plano histológico, presentan áreas de celularidad marcada, con mitosis ocasionales. El tratamiento a base de resección, radioterapia y quimioterapia ha favorecido remisiones prolongadas. Al parecer, su pronóstico es más drástico en niños que en adultos. Hemangioendotelioma maligno: representa un tumor raro de origen vascular que afecta hueso y partes blandas. A este tumor también se lo denomina angiosarcoma, hemangiosarcoma o angioblastoma. Representa en general menos del 1% de las neoplasias malignas primarias del hueso. En la región de la cabeza y el cuello se abserva con mayor frecuencia en la cara y cuero cabelludo. Cuando se presenta en el oído, los pacientes refieren acúfeno; y la exploración del oído medio revela una masa pulsátil de color rojizo que puede propagarse a lo largo de nervio de Jacobson, con erosión ósea y extensión al seno timpánico y las ventanas oval y redonda, así como a la porción petrosa y mastoidea. Su tratamiento consiste en mastoidectomía, petrosectomía y radioterapia. Carcinoma adenoquístico Por lo general se presenta en las glándulas salivales y, en forma ocasional, en las glándulas mucosas del aparato respiratorio superior. Es un tumor de crecimiento lento y suele diseminarse a través de estructuras perineurales. Tiende a recurrir después de su extirpación quirúrgica y a largo plazo, por lo que el resultado a cinco años no es del todo satisfactorio. Con frecuencia emite metástasis pulmonares y óseas y los pacientes no sobreviven mucho tiempo. Lo más común es que este tumor se origine en la glándula parótida e invada, en forma secundaria, oído medio y mastoides. El tratamiento de elección es quirúrgico, que puede combinarse con radioterapia y quimioterapia en casos avanzados. Tumor carcinoide del oído medio Son tumores de origen gastrointestinal y se derivan de la primera bolsa faríngea. Es raro que aparezcan en el oído medio, con menos de 15 casos notificados en las publicaciones médicas. Se presentan entre el segundo y sexto decenios de la vida y los síntomas más comunes son sensación de oído tapado, hipoacusia conductiva, acúfeno y parálisis facial transitoria. Es poco frecuente que produzcan síntomas de tumor carcinoide, como erupciones cutáneas. Su diagnóstico se establece con microscopia electrónica y con tinción argirofílica. Su tratamiento es quirúrgico (mastoidectomía). Tiene una sobrevida a cinco años, cuando está localizado, de 96%. Los tumores que no pueden extirparse en forma completa o que se han extendido más allá del oído medio o la mastoides se tratan también con radioterapia. Tumores de la nasofaringe Los tumores de nasofaringe pueden diseminarse al oído medio y hueso temporal a través del orificio tubario, la pirámide petrosa y la región infratemporal. Los más frecuentes son carcinomas epidermoides moderadamente diferenciados. Tienen gran tendencia a proyectar metástasis regionales linfáticas y a distancia, sobre todo a pulmón, hígado y hueso. Cuando afectan la región infratemporal, con frecuencia producen un síndrome del foramen yugular, que puede depender del tumor mismo o un ganglio metastásico que ejerza presión. El tratamiento tradicional de estos tumores se basa en radioterapia. En algunos casos representativos con recidiva local en nasofaringe, Fisch ha propuesto abordarlos a través de la fosa infratemporal y ha obtenido resultados satisfactorios. Afectación del oído medio y la mastoides por tumores metastásicos Cuando en un paciente no hay antecedentes de infección crónica del oído y desarrolla un proceso que en un tiempo relativamente corto ha causado otalgia, parálisis facial transitoria o completa, alteraciones del V par cra- ERRNVPHGLFRVRUJ Oído medio y mastoides 1. 2. 3. 4. 5. Adenocarcinoma mamario. Carcinoma de riñón. Carcinoma broncógeno. Adenocarcinoma de próstata. Adenocarcinoma de páncreas. El tratamiento es paliativo, a base de radioterapia, quimioterapia y, en ciertos casos, tratamientos hormonales. BIBLIOGRAFÍA Abramson M, Gantz B, Asarch R, Litton W: Cholesteatoma pathogenesis: evidence for the migration theory. In: McCabe BF, Sadé J, Abramson M (eds.): Cholesteatoma: First International Conference. Birmingham, Alabama, Aesculapius Publishing Co., 1977:176–186. Aimi K: Role of the tympanic ring in the pathogenesis of congenital cholesteatoma. Laryngoscope 1983;93:1140–1146. Albera R, Canale A, Lacilla M, Cavalot A, Ferrero V: Delayed vertigo after stapes surgery. Laryngoscope 2004;114:860862. Alberstone C, Anson J: Preoperative evaluation and management of jugular foramen tumors. Op Techn Head Neck Surg 1996;7:106–112. Altman E, Kornfield M: Osteogenesis imperfecta: new investigations. Ann Otol Rhinol Laryngol 1967;76:89–104. Andreasson L, Bylander A, Ivorson A, Tjernstrom O: Treatment with sulfur hexaflouride in children with serius otitis media. Ar Otolaryngol 1983;109:358–359. Appelbaum E, Goldin A: Surgical management of isolated malleus handle fractures. Laryngoscope 2000;110:171–173. Armstrong BW: New treatment for chronic secretory otitis. Ar Otolaryngol 1954;59:653–654. Armstrong BW, Armstrong RB: Chronic nonsuppurative otitis media. Ann Otol Rhinol Laryngol 1981;90:533–535. Arola M, Ziegler T, Puhakka H: Rhinovirus in otitis media with effusion. Ann Otol Rhinol Laryngol 1990;91:451–453. Ataoglu H, Gorsu N, Femaloglu Y et al.: Preliminary report on L–forms: possible role in the infectious origin of secretory otitis media. Ann Otol Rhinol Laryngol 1994;103:434– 438. Axelsson A, Miller J, Silverman M: Anatomical effects of sudden middle ear pressure changes. Ann Otol Rhinol Laryngol 1979;88:368–376. Baggett H, Prazma J, Rose A et al.: The role of glucocorticoids in endotoxin–mediated otitis media with effusion. Ar Otolaryngol 1997;123:123. Bagot D ARC M, Daculsi G, Emam N: Biphasic Ceramic and fibrin sealant for boñe reconstruction in ear surgery. Ann Otol Rhinol Laryngol 2004;113:711-720. Baker SR: Glomus jugulare and heredity hemorrhagic telangiectasia. Ar Otolaryngol 1980;106:182–186. Ball S, Prazma J, Dais D et al.: Role of tumor necrosis factor and interleukin 1 in endotoxin induced middle ear effusions. Ann Otol Rhinol Laryngol 1997;106:633–639. Barfoed C, Rosborg J: Secretory otitis media. Ar Otolaryngol 1980;106:553–556. Batsakis J: Extracranial meningiomas. Ann Otol Rhinol Laryngol 1984;93:282–283. Bauer P, McDonald B, Domenowski G, Fulerhen S: Langerhans cell histiocytes (LCH) of the temporal bone. Ar Otolaryngol 1998;124:1395–1397. Becker GD, Parell GJ: Medical examination of the sport scuba diver. Otolaryngol. Head Neck Surg 1983;91:246–250. Berger G, Hawke M, Johnson A et al.: Histopathology of the temporal bone in osteogenesis imperfecta congenita: a report of 5 cases. Laryngoscope 1985;95:193–199. Bernstein JM, Boerst N, Hays ER: Mucosubstances in otitis media with effusion. Ann Otol Rhinol Laryngol 1979;88:334–338. Bernstein JM, Kano K: Heterophile antibodies in middle ear effusions. Ar Otolaryngol 1982;108:267–269. Bluestone C: Pneumococcal conjugate vaccine. Ar Otolaryngol 200l;127:464–467. Bluestone CD, Cantekin EI: Design factors in the characterization and identification of otitis media and certain related conditions. Ann Otol Rhinol Laryngol 1979;88(Sup. 60):13–28. Bluestone CD, Wittel RA, Paradise JL: Roentgenographic evaluation of the eustachian tube function in infants with cleft and normal palates. Cleft Palate J 1972;9:93–100. Bold E, Wanamaker H, Hughes G et al.: Magnetic resonance angiography of vascular anomalies of the middle ear. Laryngoscope 1994;104:1404–1411. Borgstein J, Gerritsma T, Wieringa M, Bruce J: Ther erasmus atelectasis classification: proposal of a new classification for atelectasis of the midole ear in children. Laryngoscope 2007;117:1255-1269. Boscia R, Knox R, Adking W, Holgate R: Persistent stapedial artery supplying a glomus tympanicum tumor. Ar Oto-laryngol 1990;116:852–854. Bretlau P, Sorensen C, Jorgensen M, Dabelsteen E: Bone resorption in human cholesteatomas. Ann Otol Rhinol Laryngol 1982;91:131–135. Brook I, Anthony BF, Finegold SM: Aerobic and anearobic bacteriology of acute otitis media in children. J Pediatr 1978;92:13–15. Brooks G: Bilateral middle ear carcinomas associated with Waldenstróm’s macroglobulinemia. Ann Otol Rhinol Laryngol 1982;91:299–303. Brooks DN: Otitis media and child development. Design factors in the identification and assessment of hearing loss. Ann Otol Rhinol Laryngol 1979;88(Sup. 60):29–47. Brown D, Litt M, Potsic W: A study of mucus glycoproteins in secretory otitis media. Ar Otolaryngol 1985;111:668–695. Brown J: Glomus jugulare tumors revisited. Laryngoscope 1985;95:284–288. ERRNVPHGLFRVRUJ Capítulo 5 neal, destrucción de la pirámide petrosa, la mastoides o la articulación temporomandibular, y que tiene una biopsia positiva a un adenocarcinoma, debe pensarse en la posibilidad de un tumor metastásico, por lo que es de suma importancia una valoración urológica en varones (próstata) y ginecológica en mujeres (mama). Las lesiones que emiten metástasis al hueso temporal con mayor frecuencia son: 103 103 104 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 5 Browning G, Gatehouse S: Sensorineural hearing loss in stapedial otosclerosis. Ann Otol Rhinol Laryngol 1984;93:13–16. Bujia J, Kim C, Boyle D et al.: Quantitative analysis of interleukin I alpha gene expression in middle ear cholesteatoma. Laryngoscope 1996;106:217–220. Bujia J, Schilling H, Negri B, Schulz P: Aberrant expression of epidermal growth factor receptor in aural cholesteatoma. Laryngoscope 1993;103:326–329. Busaba N: Clinical presentation and management of labyrinthine fistula caused by chronic otitis media. Ann Otol Rhinol Laryngol 1999;108:435–439. Califano J, Bhatti N, Hiporko J: Jugular bulb dehiscence. Ar Otolaryngol 1998;214:1047–1050. Candela FA Jr, Stewart TJ: The pathophysiology of otologic facial paralysis. Otolaryngol Clin N Am 1974;7:323–325. Cantekin EI, Saez CA, Bluestone CD, Bern S: Airflow through the Eustachian tube. Ann Otol Rhinol Laryngol 1979;88:603– 612. Cantekin EI, Bluestone CD, Fria TJ et al.: Identification of otitis media with effusion in children. Ann Otol Rhinol Laryngol 1980;89(Sup. 68):190–195. Cantekin EI, Doyle W, Bluestone CD: Effect of levator veli palatini muscle excision on eustachian tube function. Ar Otolaryngol 1983;109:281–284. Cantrell R, Kaplan M, Atur N et al.: Catecholamine–secreting infratemporal fossa paraganglioma. Ann Otol Rhinol Laryngol 1984;93:583–588. Carlsson B, Lundberg C, Ohlsson K: Protease inhibitors in middle ear effusions. Ann Otol Rhinol Laryngol 1981;90: 38–41. Carlsson B, Lundberg C, Ohlsson K: Granulocyte proteases in middle ear effusions. Ann Otol Rhinol Laryngol 1982;91:76–81. Chhetti D, Gajjar N, Bhuta S, Andrecus J: Schneiderian–type papilloma of the middle ear. Ar Otolaryngol 2001;127:79– 82. Chole R, Donald P: Petrous apicitis. Ann Otol Rhinol Laryngol 1983;92:544–551. Chole R: Cellular and subcellular events of bone resorption in human and experimental cholesteatoma: the role of osteoclasts. Laryngoscope 1984;94:76–95. Chole R, Hubbell R: Antimicrobial activity of silastic tympanostomy tubes impregnated with silver oxide. Ar Otolaryngol 1995;121:562–565. Chole R, Tinling S: Basal lamina breaks in the histogenesis of cholesteatoma. Laryngoscope 1985;95:270–275. Chole R, McGinn M, Tinling S: Pressure–induced bone resorption in the middle ear. Ann Otol Rhinol Laryngol 1985;94:165–170. Chonmaitree T, Patel J, Garofalo R et al.: Role of leukotriene B4 and interleukin 8 in acute bacterial and viral otitis media. Ann Otol Rhinol Laryngol 1996;105:968–974. Cody DT, McDonald T: Mastoidectomy for acquired cholesteatoma. Follow–up to 20 years. Laryngoscope 1984;94:1027– 1029. Cohn AM, Schwaber MK, Anthony LS et al.: Eustachian tube function and tympanoplasty. Ann Otol Rhinol Laryngol 1979;88:339–347. Coker NJ, Jenkins HA, Fisch U: Obliteration of the middle ear and mastoid cleft in subtotal petrosectomy. Ann Otol Rhinol Laryngol 1986;95:5–11. Cole A: Surgery for otosclerosis in children. Laryngoscope 1982;92:859–861. Conley J: Cancer of the middle ear. Ann Otol Rhinol Laryngol 1965;74:555–572. Crumley R, Wilson C: Schwannomas of the jugular foramen. Laryngoscope 1994;94:772–778. Cunningham M, Curtin H, Jaffe R: Otologic manifestations of Langerhans’ cell histiocytosis. Ar Otolaryngol 1989;115:807–813. Dagum P, Roberson J: Otologic Wegener’s granulomatosis with facial nerve palsy. Ann Otol Rhinol Laryngol 1998;107:555– 559. Dawson CR, Wood TR, Rose L et al.: Experimental inclusion conjunctivitis in man. III, keratitis and other complications. Ar Ophthalmol 1967;78:341–349. DeMaria T, McGhee R, Lim D: Rheumatoid factor in otitis media with effusion. Ar Otolaryngol 1984;110:279–280. Discolo CH, Byrd M, Bates T, Hazony D, Lewandowski J: Ultrasonic detection of middle ear effusion. Ar Otolaryngol 2004;130:1407-1410. Diven WF, Glew RH, Bluestone CD: Lysosomal hydrolases in middle ear effusions. Ann Otol Rhinol Laryngol 1981;90:148–153. Diven WF, Glew RH, LaMarco KL: Hydrolase activity in acute otitis media with effusion. Ann Otol Rhinol Laryngol 1985;94:415–418. Dobie RA, Berlin CI: Influence of otitis media on hearing and development. Ann Otol Rhinol Laryngol 1979;88(Sup. 60):48–53. Dohar J, Garner E, Nielsen R et al.: Topical ofloxacin treatment of otorrhea in children with tympanostomy tubes. Ar Otolaryngol 1999;125:537–545. Dommerby H, Tos M: Sensorineural hearing loss in posttraumatic incus dislocation. Ar Otolaryngol 1983;93:257–261. Donald P, Chole R: Transcervical transmastoid approach to lesions of the jugular bulb. Ar Otolaryngol 1984;110:309– 314. Doyle WJ, Cantekin EI, Bluestone CD: Eustachian tube function in cleft palate children. Ann Otol Rhinol Laryngol 1980;89(Sup. 68):34–40. Draf W, Schulz P: Insertion of ventilation tubes into the middle ear: results and complications. Ann Otol Rhinol Laryngol 1980;89(Sup. 68):303–307. Duncan RB: Bony auditory tube and otitis media with effusion. Ann Otol Rhinol Laryngol 1982;91:200–203. Durcher P, Brechmann D: Glomus tumor of the facial canal. Ar Otolaryngol 1986;112:986–987. Edelstein DR, Smouha E, Sacks SH et al.: Verrucous carcinoma of the temporal bone. Ann Otol Rhinol Laryngol 1986;95:447–453. Eden AR, Pincus RL, Parisier SC et al.: Primary adenomatous neoplasm of the middle ear. Laryngoscope 1984;94:63–67. Edmonds C, Thomas RL: Medical aspects of diving, part 3. Med J Aust 1972;2:1300–1304. Elverland HH, Mair IWS, Haugeto OK et al.: Influence of adenoid hypertrophy on secretory otitis media. Ann Otol Rhinol Laryngol 1981;90:7–11. Escajadillo JR, González J, Hurtado A et al.: Producción experimental de otitis medias serosas en conejos. An Soc Mex Otorrinolar 1982;27:55–64. ERRNVPHGLFRVRUJ Oído medio y mastoides Goepfert H, Cangir A, Lindher R et al.: Rhabdomyosarcoma of the temporal bone. Ar Otolaryngol 1979;105:310–313. Goldenberg R: Lateral sinus thrombosis. Ar Otolaryngol 1985:56–58. Goldstein W, Bowen B, Balkany T: Malignant hemangioendothelioma of the temporal bone maskerading as glomus tympanicum. Ann Otol Rhinol Laryngol 1994;103:156–159. González C, Arnold J, Woody E: Prevention of recurrent acute otitis media. Chemoprophylaxis vs. tympanostomy tubes. Laryngoscope 1986;96:1330–1334. Goodman RS, Cohen NL: Aberrant internal carotid artery in the middle ear. Ann Otol Rhinol Laryngol 1981;90:67–69. Gradenigo G: Ueber die paralyse des nervus abducens bei otitis. Arch Ohrenheileunde 1907;774:149–187. Graham M, Sataloff R, Kemink J: Total en bloc resection of the temporal bone and carotid artery for malignant tumors of the ear and temporal bone. Laryngoscope 1984;94:528–533. Gregoriadis S, Zervas J, Varletzidis E et al.: HLA antigens and otosclerosis. Ar Otolaryngol 1982;108:769–771. Gundersen T, Tonning FM, Kueberg K: Ventilating tubes in the middle ear. Ar Otolaryngol 1984;110:783–794. Gussen R: Otosclerosis and vestibular degeneration. Ar Otolaryngol 1973;97:484–487. Gussen R: Atypical ossicle joint lesions in rheumatoid arthritis with sicca syndrome (Sjórgren syndrome). Ar Otolaryngol 1977;103:281–283. Haddad J: Lipoperoxidation as a measure of free radical injury in otitis media. Laryngoscope 1998;108:524–530. Hamaguchi Y, Masima Y, Urai K et al.: Significance of kallikrein–kinin, system in otitis media with effusion. Ann Otol Rhinol Laryngol 1986;95:5–8. Hammerschlag P, Fishman A, Schur A: A review of 308 cases of revision stapedectomy. Laryngoscope 1998;108:1794–1800. Harley E, Berkowitz R: Osteoma of the middle ear. Ann Otol Rhinol Laryngol 1997;106:714–715. Harris MJ, Schlenker RA: Quantitative histology of the mucous membrane of the accessory nasal sinus and mastoid cavities. Ann Otol Rhinol Laryngol 1981;90:33–37. Harris A, Butler D: Malleushandle fracture in diagnosis of otologic trauma. Laryngoscope 1985;95:665–670. Hato N, Okada, M, Hukuba N, Hyodo M, Gyo K: Repair of a malleus-Handle fracture using calcium phosphate bone cement. Laryngoscope 2007;117-361-363. Haveikos HW, Caparosa R, Yul V, Kamerer D: Mexalatan therapy. Ar Otolaryngol 1982;108:329–333. Hawke M, Keene M: Artificial Eustachian tube–induced keratin foreign–body granuloma. Ar Otolaryngol 1981;107:581–583. Hawkins DB, Dru D, House JW, Clark RW: Acute mastoiditis in children. Laryngoscope 1983;93:568–572. Hawkins D: Lateral sinus thrombosis: a sometimes unexpected diagnosis. Laryngoscope 1985;95:674–677. Hayden G, Randall J, Randall S, Hendley JD: Topical phenylephrine for the treatment of middle ear effusion. Ar Otolaryngol 1984;110:512–514. Hebert R, King G, Bent J: Ar Otolaryngol 1998;124:1118–1121. Hemlin C, Carenfelt C, Paperziamas G: Single dose of betamethasone in combined medical treatment of secretory otitis media. Ann Otol Rhinol Laryngol 1997;106:359–363. Herzon FS: Tympanostomy tubes. Ar Otolaryngol 1980;106:645– 647. ERRNVPHGLFRVRUJ Capítulo 5 Escajadillo JR, Askren HA: An instruction method for placing the prosthesis around the incus in stapes surgery. Otolaryngol Head Neck Surg 1986;94:652–653. Estrada PE, Escajadillo JR: Otomastoiditis aguda. Presentación de un caso y revisión de su etiología, fisiopatología y tratamiento. Rev Méd La Salle 1981;2:27–34. Evans A, Sebreel A, Battr R, Hallamshire R. Osteoma of the malleus. JAMA Otolaryngol Head Neck Surg 2011;137:194– 196. Fara M, Dvork J: Abnormal anatomy of the muscles of palatopharyngeal closure in cleft palates. Plast Reconstr Surg 1970;46:488–497. Farrior JB: Infratemporal approach to skull base for glomus tumors. Ann Otol Rhinol Laryngol 1984;93:616–622. Farrior JB, Rophic S: Fenestration of the horizontal semicircular canal in congenital conductive deafness. Laryngoscope 1985;95:1029–1036. Farrior J, Sutherland A: Revision stapes surgery. Laryngoscope 1991;101:1155–1161. Fiellau–Nikolajsen M: Epidemiology of secretory otitis media. Ann Otol Rhinol Laryngol 1983;92:172–177. Finkelstein Y, Ophir D, Talmi Y et al.: Ar Otolaryngol 1994;120:517–527. Fisch U: Infratemporal fosa approach for glomus tumors of the temporal bone. Ann Otol Rhinol Laryngol 1982;91:474– 479. Fleischer A, Woosley J, Swanson S, Crosby D: Histiocytosis X, Letteret–Siwe variant. Ar Otolaryngol 1990;116:1448–1451. Force R, Meny P, Sally H et al.: Topical ciprofloxacin for otorrhea after tympanostomy tube placement. Ar Otolaryngol 1995;121:880–884. Fria TJ, Sabo DL: Auditory brainstem responses in children with otitis media with effusion. Ann Otol Rhinol Laryngol 1980;89(Sup. 68):200–206. Gacek R: Pathology of jugular foramen neurofibroma. Ann Otol Rhinol Laryngol 1983;92:128–133. Gantz BJ, Maynard J, Bumsted RM et al.: Bone resorption in chronic otitis media. Ann Otol Rhinol Laryngol 1979;88:693–700. Gantz BJ: Epidermal Langerhans cells in cholesteatoma. Ann Otol Rhinol Laryngol 1984;93:150–156. Gapany–Gapanavicius B, Chisin R, Weshler Z: Primary presentation of malignant lymphoma in middle ear cleft. Ann Otol Rhinol Laryngol 1980;89:180–183. Giebink GS, Berzins IK, Quie PG: Animal models for studying pneumococcal otitis media and pneumococcal vaccine efficacy. Ann Otol Rhinol Laryngol 1980;89 (Sup. 68): 339–343. Giebink GS, Heller K, Harford E: Tympanometric configurations and middle ear findings in experimental otitis media. Ann Otol Rhinol Laryngol 1982;91:20–24. Giebink GS, Le CT, Paparella MM: Epidemiology of otitis media with effusion in children. Ar Otolaryngol 1982;108:563– 566. Giebink GS, Carlson B, Hetherington S et al.: Bacterial and polymorphonuclear leukocyte contribution to middle ear inflammation in chronic otitis media with effusion. Ann Otol Rhinol Laryngol 1985;94:398–402. Glasscock M, Storper I, Haynes D et al.: Stapedectomy in profound cochlear loss. Laryngoscope 1996;106:831–833. 105 105 106 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 5 Hiraide F, Inouye T, Ishii F: Primary squamous cell carcinoma of the middle ear invading the cochlea. Ann Otol Rhinol Laryngol 1983;92:290–294. Hoffman–Lawless K, Keith RW, Cotton RT: Auditory processing abilities in children with previous middle ear effusion. Ann Otol Rhinol Laryngol 1981;90:543–545. Holborow CA: Deafness associated with cleft palate. J Laryn-gol Otol 1962;76:762–763. Holborow C: Eustachian tubal function: changes throughout childhood and neuro–muscular control. J Laryngol Otol 1975;89:47–55. Holmquist J, Jarlstedt J, TjeIlstrom A: Surgery of the mastoid in ears with middle ear effusion. Ann Otol Rhinol Laryngol 1980;89(Sup. 68):322–323. Honjo I, Ushiro K, Okazaki N et al.: Evaluation of Eustachian tube function by contrast roentgenography. Ar Otolaryngol 1981;107:350–352. Horn K, House W, Hitselberget W: Schwannomas of the jugular foramen. Laryngoscope 1985;95:761–765. Howie VM, Ploussard JH, Sloyer JL: Natural history of otitis media. Ann Otol Rhinol Laryngol 1976;85(Sup. 25):18–19. Hurst D: Association of otitis media with effusion and allergy as demonstrated by intradermal skin testing and eosinophil cationic protein levels in both middle ear effusions and mucosal biopsies. Laryngoscope 1996;106:1128–1137. Ibekwe D, Shareef Z, Benayam A: Anaerobes and fungi in chronic suppurative otitis media. Ann Otol Rhinol Laryngol 1997;106:649–652. Iino Y, Hoshino E, Tomioka S et al.: Organic acids and anaerobic microorganisms in the contents of the cholesteatoma sac. Ann Otol Rhinol Laryngol 1983;92:91–96. Ikeda R, Kobayashi T, Kawose T, Oshima T, Sato T. Risk factors for deterioration of bone conduction hearing in cases of labyrinthine fistula caused by middle ear cholesteatoma. Ann Otol Rhinol Laryngol 2012;121:162-167. Illum P, Thorling K: Otological manifestations of Wegener’s granulomatosis. Laryngoscope 1982;92:801–804. Inocochi G, Okumo T, Hata Y, Baba M, Sugiyama D. Congenital cholesteatoma: posterior lesions and the staging system. Ann Otol Rhinol Laryngol 2010;119:490–494. Isenberg SF, Tubergen LB: An unusual congenital middle ear ossicular anomaly. Ar Otolaryngol 1980;106:176–178. Iwanaga M, Yamamoto E, Kukumoto M: Cathepsin activity in cholesteatoma. Ann Otol Rhinol Laryngol 1985;94:309–312. Jenkins HA, Fisch U: Glomus tumors of the temporal region. Ar Otolaryngol 1981;107:209–214. Johnson DW, Maisel RH: Objective evaluation of ear–plugs for the control of water–borne infection. Ann Otol Rhinol Laryngol 1981;90:89–93. Johnson LJM, Brooks T, Hutton D et al.: Laryngoscope 1997;107:684–689. Jones D, Osren F, Roh L, Moore G: Lightning and its effects on the auditory system. Laryngoscope 1991;101:830–834. Jung H, Chae S, Jung S, Kim S, Lee H, Hwang S: Expression of a cathelicidin antimicrobial peptide is augmented in cholesteatoma. Laryncoscope 2003;113:432-435. Kacker SK, Shambaugh GE: Effect of fluoride on chymotrypsin. Ar Otolaryngol 1980;106:260–261. Kagoya R, Ho K, Kashio A, Karino S, Yamasoba T. Dislocation of stapes with footplate fracture caused by indirect trauma. Ann Otol Rhinol Laryngol 2010;119:628–630. Karma P, Luotonen J, Timonen M et al.: Efficacy of pneumococcal vaccination against recurrent otitis media. Ann Otol Rhinol Laryngol 1980;89(Sup. 68):357–362. Karosi T, Konya J, Szabo L, Pytel J, Jari J: Two subgroupss of stapes fixation: otoesclerosis and pseudo otosclerosis. Laryngocope 2005;115:1968-19753. Kawano H, Haruta A, Tsuboi Y, Kinn Y Schacherin P, Paprella M, Lim J: Induction of mucous cell metaplasia by tumor necrosis factor alpha in rat middle ear. Ann Otol Rhinol Laryngol 2002;111:415-422. Kenna M, Bluestone CD, Reilly J: Medical management of chronic suppurative otitis media without cholesteatoma in children. Laryngoscope 1986;96:146–151. Kenyon GS, Marks PV, Scholtz C, Dhillon R: Squamous cell carcinoma of the middle ear. Ann Otol Rhinol Laryngol 1985;94:273–277. Kim E, Calten M, Lalwant A: Detection of fungal DNA in effusion associated with acute and serous otitis media. Laryngoscope 2002;112:2037-2041. Klein JO: Microbiology of otitis media. Ann Otol Rhinol Laryngol 1980;89(Sup. 68):98–101. Klein JO, Henderson FW, Keller MD et al.: Recent advances in otitis media with effusion. I–B, Epidemiology and natural history. Ann Otol Rhinol Laryngol 1980;89(Sup. 69):9–10. Kornblut A, Wolff S, Fauci A: Ear disease in patients with Wegener’s granulomatosis. Laryngoscope 1982;92:713– 717. Krause J, Nadol J, Goodman M: Carcinoid tumors of the middle ear. Ann Otol Rhinol Laryngol 1990;99:547–552. Kreutzer E, DeBlanc B: Extraaural spread of acquired cholesteatoma. Ar Otolaryngol 1982;108:320–323. Krouchi L, Callonec F, Bouchetemble P, Tollard E: Preoperative computed tomography scan may fail to predict perilymphatic gusher. Ann Otol Rhinol Laryngol 2013;122:374–377. Kudrjavcev T, Schoenberg BS: Otitis media and developmental disability. Epidemiologic considerations. Ann Otol Rhinol Laryngol 1979;88(Sup. 60):88–98. Kunihara A, Toshima M, Yuasa R, Takasaka T: Bone destruction mechanisms in chronic otitis media with cholesteatoma tissue in culture of bone resorbing activity attributable to interleukin I alpha. Ann Otol Rhinol Laryngol 1991;100:989– 998. LaMarco KL, Diven WF, Glew RH et al.: Neuraminidase activity in middle ear effusions. Ann Otol Rhinol Laryngol 1984;93:76–84. LaMarco KL, Diven WF, Glew RH: Neuraminidase activity in the middle ear. Ann Otol Rhinol Laryngol 1986;95:304–308. Lambert P: Congenital absence of the oval window. Laryngoscope 1990;100:37–40. Langman A, Lindeman R: Revision stapedectomy. Laryngoscope 1993;103:954–958. Lee D, Yeo S, Chang K, Park S, Oh J, Seo J: Effect of infloximab on experimentally induced otitis media in rats. Ann Otol Rhinol Laryngol 2008;117:470-476. Lee D, Youk A, Goldstein N: A meta analysis of swimming and water precautions. Laryngoscope 1999;109:536–540. Lesinski S, Palmer A: Lasers for otosclerosis: CO2 vs. argon and KTP–532. Laryngoscope 1989;99:1–24. Levy R, Sarfaty SM, Schindel J et al.: Eosinophilic granuloma of the temporal bone. Ar Otolaryngol 1980;106:167–171. ERRNVPHGLFRVRUJ Oído medio y mastoides McPhee J, Gordon M, Ruben R, van de Water T: Evidence of abnormal stromelysin MRNA expression in suspected carriers of otosclerosis. Ar Otolaryngol 1993;119:1108–1116. Menyuk P: Development in children with chronic otitis medial Design factors in the assessment of language. Ann Otol Rhinol Laryngol 1979;88(Sup. 60):78–87. Meri S, Lehtinen T, Palva T: Complement in chronic secretory otitis media. Ar Otolaryngol 1984;110:774–778. Meyerhoff WL, Giebink GS, Shea D: Pneumococcal otitis media following middle ear deflation. Ann Otol Rhinol Laryngol 1981;90:72–76. Miglets AW, Coopey D: Fate of middle ear mucosa introduced into the vestibule. Ann Otol Rhinol Laryngol 1979;88:241–246. Miller JM, Axelsson A, Potter W: Chronic effects of phasic middle ear pressure changes. Ann Otol Rhinol Laryngol 1981;90:281–286. Minor L: Controversies in the management of glomus tumors of the temporal bone. Op Techn Head Neck Surg 1994;5:189– 202. Miyamoto R, Worth R: Otogenic cerebellar abscess. Ann Otol Rhinol Laryngol 1986;95:64–648. Mogi G, Maeda A: Recurrent otitis media in association with immunodeficiency. Ar Otolaryngol 1982;108:204–207. Monolidis S, Sholer J, Jackson G, Glasscock M: Malignant glomus tumors. Laryngoscope 1999;109:30–34. Moore G, Yarington GT, Mengham C: Vagal body tumors. Diagnosis and treatment. Laryngoscope 1986;96:533–536. Moriyama H, Huang C, Abramson M et al.: Effects of pressure on bone resorption in the middle ear of rats. Ann Otol Rhinol Laryngol 1985;94:60–64. Mulder J, Cremers C, Jousten F et al.: Fibroinflammatory pseudotumors of the ear. Ar Otolaryngol 1995;121:930–993. Murizono T, Giebink GS, Paparella MM, Shea D: Sensorineural hearing loss in experimental purulent otitis media due to Streptococcus pneumoniae. Ar Otolaryngol 1985;111:794– 798. Nadol J, Schuknecht H: Obliteration of the mastoid in the treatment of tumors of the temporal bone. Ann Otol Rhinol Laryngol 1984;93:6–12. Nassif P, Simpson S, Izzo A, Nicklaus P: Interleukin 8 concentration predicts the neutrophil count in middle ear effusion. Laryngoscope 1997;107:1223–1227. Naunton RF: Tympanostomy tubes; the conservative approach. Ann Otol Rhinol Laryngol 1981;90:529–532. Neely JG: Reversible compression neuropathy of the eighth cranial nerve from a large jugular foramen schwannoma. Ar Otolaryngol 1979;105:555–560. Neitch SM, Sydnor JB, Schleupner CJ: Mycobacterium fortuitum as a cause of mastoiditis and wound infection. Ar Otolaryngol 1982;108:11–14. Nohomura N, Giebink GS, Zelterman D, Harada T: Early biochemical events in pneumococcal otitis media: arachidonic acid metabolites in middle ear fluid. Ann Otol Rhinol Laryngol 1991;100:385–388. Ostfeld E, Rubinstein E: Acute Gram–negative bacillary infections of middle ear and mastoid. Ann Otol Rhinol Laryngol 1980;89:33–36. Osturk K, Snyderman C, Sando I. Do mucosal folds in the Eustachian tube function as microturbinates. Laryngoscope 2011;121:801–804. ERRNVPHGLFRVRUJ Capítulo 5 Lewis DM, Schram JL, Birck HG et al.: Antibody activity in otitis media with effusion. Ann Otol Rhinol Laryngol 1979;88:392–396. Lewis JS: Cancer of the ear. A report of 150 cases. Laryngoscope 1960;70:551–579. Lim DJ, Lewis DM, Schram JL et al.: Otitis media with effusion. Ar Otolaryngol 1979;105:404–412. Lim DJ, Lewis DM, Schram JL et al.: Antibiotic–resistant bacteria in otitis media with effusion. Ann Otol Rhinol Laryngol 1980;89(Sup. 68):278–280. Lim DJ, Friedman I, Carpenter AM et al.: Recent advances in otitis media with effusion. III. Anatomy, cell biology, and pathology. Ann Otol Rhinol Laryngol 1980;89 (Sup. 69):13–14. Lin J, Kim Y, Juhn S: Increase of mucous glycoprotein secretion by tumor necrosis factor alpha via a protein kinase C–dependent mechanism in cultures chinchilla middle ear epithelial cells. Ann Otol Rhinol Laryngol 1998;107:213– 219. Lipkin A, Coker N, Jenkins HA: Hereditary congenital cholesteatoma. Ar Otolaryngol 1986;112:1097–1100. Lippy W, Burkey J, Schuring A, Rizar F: Short– and long– term results of stapedectomy in children. Laryngoscope 1998;108:569–572. Liston S, Paparella MM, Mancini F, Anderson J: Otosclerosis and endolymphatic hydrops. Laryngoscope 1984;94:1003– 1007. Low W, Seid A, Pransky S, Kearns D: Coccidioides immitis subperiosteal abscess of the temporal bone in a child. Ar Otolaryngol 1996;122:189–192. Lowell SH, Juhn SK, Giebink GS: Experimental otitis media following middle ear inoculation of nonviable Streptotoccus pneumoniae. Ann Otol Rhinol Laryngol 1980;89:479–482. Macias J, Wackyn P, McCabe B: Early diagnosis of otologic Wegener’s granulomatosis using the serologic markc–anca. Ann Otol Rhinol Laryngol 1993;102:337–341. Marshak G, Cantekin EI, Doyle WJ et al.: Recurrent pneumococcal otitis media in the chinchilla. Ar Otolaryngol 1981;107:532–539. Matsume S, Sando I, Takahashi H: Abnormalities of lateral cartilaginous lamina and lumen of Eustachian tube in cases of cleft palate. Ann Otol Rhinol Laryngol 1991;100:909–913. Matsume S, Sando I, Takahashi H: Elastin at the hinge portion of the Eustachian tube cartilage in specimens from normal subjects and those with cleft palate. Ann Otol Rhinol Laryngol 1992;101:163–167. Matsume S, Sando I, Takahashi H: Insertion of the tensor veli palatine muscle into the Eustachian tube cartilage in cleft palate cases. Ann Otol Rhinol Laryngol 1991;100:439–446. Mc cbul E, Goldstein N, Koliskor B, Weedon J, Jackson A: A prospective study of the effect iof gastroesophageal reflux disease treatment on children with otitis media. JANA Otolaryngol Head Neck Surg 2011;137:35–41. McDermott J, Giebink GS, Le TC et al.: Children with persistent otitis media. Ar Otolaryngol 1983;109:360–363. McDonald T, Cody DT, Ryan R: Congenital cholesteatoma of the ear. Ann Otol Rhinol Laryngol 1984;93:637–640. McNicoll S: Eustachian tube dysfunction in submariners and divers. Ar Otolaryngol 1982;108:279–283. McNicoll WD: Tympanic membrane mobility on otoscopy as an indicator of Eustachian function. Laryngoscope 1983;93:630–634. 107 107 108 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 5 Palva T, Ylikoski J, Savolainen S et al.: The effect of vitamin A acid on the middle ear of the Guinea pig. Ar Otolaryngol 1981;107:230–232. Palva T, Tolvanen E, Konttinen YT et al.: Inflammatory cells in the middle ear mucosa in cases of chronic otitis media. Ar Otolaryngol 1981;107:528–531. Palva T, Mnkinen J: Why does middle ear cholesteatoma recur. Ar Otolaryngol 1983;109:513–518. Palva T, Virtanen H: Sonotubometry in chronic ear disease. Ar Otolaryngol 1984;110:596–599. Palva T, Lehto V, Johnsson LG et al.: Large cholesterol granuloma cysts in the mastoid. Ar Otolaryngol 1985;111:786–791. Paparella MM, Goycoolea MV, Meyerhoff WL: Inner ear pathology and otitis media. A review. Ann Otol Rhinol Laryngol 1980;89(Sup. 68):249–253. Paparella MM, Mancini F, Liston S: Otosclerosis and Méniére’s syndrome. Diagnosis and treatment. Laryngoscope 1984;94:1414–1417. Paparella MM, Sipila P, Juhn SK et al.: Subepithelial space in otitis media. Laryngoscope 1985;95:414–420. Paparella MM, Goycoolea MV, Bassiouni M et al.: Silent otitis media; clinical applications. Laryngoscope 1986;96:978– 985. Papastavros T, Giamarellou H, Varlejidas S: Role of aerobic and anaerobic microorganisms in chronic suppurative otitis media. Laryngoscope 1986;96:438–442. Pappas D, Pappas D, Sr, Hedlin G: Round window atresia in association with congenital stapes fixation. Laryngoscope 1998;108:1115–1118. Parahy C, Linthicum FH: Otosclerosis and otospongiosis. Laryngoscope 1984;94:508–512. Parkin JL: Familial multiple glomus tumors and pheochromocytomas. Ann Otol Rhinol Laryngol 1981;90:60–63. Pedersen BC, Olsen J: Danish approach to the treatment of secretory otitis media. Ann Otol Rhinol Laryngol 1990;99(146):1–28. Petropoulos A, Luetje C, Camarata P et al.: Genetic analysis in the diagnosis of familial paragangliomas. Laryngoscope 2000;110:1225–1229. Poe D: Laser–assisted endoscopic stapedectomy: a prospective study. Laryngoscope 2000;110(95):1–37. Poe D, Rebetz E, Pankratou M, Shopsay S: Transtympanic endoscopy of the middle ear. Laryngoscope 1992;102:993– 996. Portmann M: The surgery of deafness. In: The ear and temporal bone. New York, Masson Publishing USA, Inc., 1979:101– 138. Potsic W, Samadi D, Marsch R, Wetmore P: A staging system for congenital cholesteatoma. Ar otolaryngol 2002;128:10091012. Pratt L: Complications associated with the surgical treatment of cholesteatoma. Laryngoscope 1983;93:289–291. Prellner K, Nilsson NI, Johnson U, Laurell AB: Complement and Clq binding substances in otitis media. Ann Otol Rhinol Laryngol 1980;89(Sup. 68):129–132. Presswood G, Zamboni W, Stephenson L, Santos P: Effect of artificial airway on ear complications from hyperbaric oxygen. Laryngoscope 1994;104:1383–1384. Pribitkin E, Handler S, Tom L, Potsic W: Ventilation tube removal. Ar Otolaryngol 1992;118:495–497. Pulec JL: Abnormally patent eustachian tubes. Treatment with injection of polytetrafluoroethylene (Teflon) paste. Laryngoscope 1967;77:1542–1554. Pulec JL, Hahn FW Jr: The abnormally patulous Eustachian tube. Otolaryng Clin N Amer 1970;3:131–140. Quisling RW, Moore GR, Jahrsdoerfer RA et al.: Osteogenesis imperfecta. A study of 160 family members. Ar Otolaryngol 1979;105:207–211. Qvarnberg Y, Palva T: Active and conservative treatment of acute otitis media: Perspective studies. Ann Otol Rhinol Laryngol 1980;89(Sup. 68):269–270. Rapin I: Conductive hearing loss; effects on children’s language and scholastic skills. A review of the literature. Ann Otol Rhinol Laryngol 1979;88(Sup. 60):3–12. Readleaf M, McCabe B: Lightning injury of the tympanic membrane. Ann Otol Rhinol Laryngol 1993;102:867–869. Reiter D, Konkle DF, Myers AR et al.: Middle ear immittance in rheumatoid arthritis. Ar Otolaryngol 1980;106:114–117. Rhee C, Jeong P, Kim Y et al.: Effect of platelet activating factor and its antagonist on the mucociliary clearance of the Eustachian tube in guinea pigs. Ann Otol Rhinol Laryngol 1999;108:453–458. Riding KH, Bluestone CD, Michaels RH et al.: Microbiology of recurrent and chronic otitis media with effusion. J Pediatr 1978;93:739–743. Riedner ED, Levin S, Holliday MJ: Hearing patterns in dominant osteogenesis imperfecta. Ar Otolaryngol 1980;106:737– 740. Rietz DR, Ford CN, Kurtycz DF et al.: Significance of apparent intratympanic meningiomas. Laryngoscope 1983;93:1397– 1404. Roberts W, Dinges D, Hanly M: Inverted papilloma of the middle ear. Ann Otol Rhinol Laryngol 1993;102:890–892. Robinson M: Juvenile otosclerosis. Ann Otol Rhinol Laryngol 1983;92:561–565. Rosenwasser H: Carotid body tumor of the middle ear and mastoid. Ar Otolaryngol 1945;41:64–67. Rosito L, Da Costa S, Schachern P, Dornelles C, Cureosluu S: Contralateral ear in chronic otitis media. Larygoscope 2007;117:1809-1814. Rotenberg B, Bugato GM, Asrawal S. Endoscopic ligation of the patolous eustachian tuve as treatment for autophony. Laryngoscope 2013;123:239-243. Ruben RJ, Hanson DG: Summary of discussion and recommendations made during the workshop on otitis media and development. Ann Otol Rhinol Laryngol 1979;88 (Sup. 60):107–111. Rubin A, Wei W: Acute mastoiditis: a review of 34 patients. Laryngoscope 1985;95:963–965. Ruedi L: Acquired cholesteatoma. Ar Otolaryngol 1963;78:252– 261. Ryan AF, Cleveland PH, Hartmann MT et al.: Humoral and cell–mediated immunity in peripheral blood following introduction of antigen into the middle ear. Ann Otol Rhinol Laryngol 1982;91:70–75. Sade J, Berco E, Halevy A et al.: Bone resorption in chronic otitis media with and without cholesteatoma. In: McCabe BF, Sadé J, Abramson M (eds.). Cholesteatoma: First International Conference. Birmingham, Alabama, Aesculapius Publishing Co., 1977:128–135. ERRNVPHGLFRVRUJ Oído medio y mastoides Silverstein H, Hester O, Rosenberg S, Deems D: Preservation of the stapediu stapes surgery. Laryngoscope 1998;108:1453– 1458. Simpson GT, Konrad HR, Takahashi M et al.: Immediate post embolization excision of glomus jugulare tumors. Ar Otolaryngol 1979;105:639–643. Sims M, Tsai P, Hoffel M: Management of lateral sinus thrombosis. Laryngoscope 1999;109:1616–1620. Sloyer JL Jr, Ploussard JH, Karr LJ et al.: Immunologic response to pneumococcal polysaccharide vaccine in infants. Ann Otol Rhinol Laryngol 1980;89(Sup. 68):351–356. Smith M: Topical use of 5–fluorouracil in the ear for management oft cholesteatoma and excessive mucous secretion. Laryngoscope 1985;95:1202–1203. Smith MFW, Hopp ML: 1984 Santa Barbara state–of–the– art symposium on otosclerosis. Ann Otol Rhinol Laryngol 1986;95:1–4. Smyth GD, Hassard TH: Hearing aids poststapedectomy: incidence and timing. Laryngoscope 1986;96:385–388. Sobel SM, Reichert TJ, Faw KD et al.: Intramembranous and mesotympanic cholesteatomas associated with an intact tympanic membrane in children. Ann Otol Rhinol Laryngol 1980;89:312–317. Soda A: Correlación clínica y anatomopatológica de la infección otomastoidea. Rev Méd Hosp Gral 1973;36:381–398. Sooy D, Sooy FA: Transcanal management of benign middle ear lesions. Laryngoscope 1985;95:671–673. Stangerup SE, Tos M: Treatment of secretory otitis and pneumatization. Laryngoscope 1986;96:680–684. Steinbach E, Gruninger G: Experimental production cholesteatomas in rabbits by using non–irritants (Skin tolerants). J Laryngol Otol 1980;94:269–279. Supance JS, Marshak G, Doyle WJ et al.: Longitudinal study of the efficacy of ampicillin in the treatment of pneumococcal otitis media in a chinchilla animal model. Ann Otol Rhinol Laryngol 1982;91:256–260. Supance JS, Bluestone CD: Medical management of the chronic draining ear. Laryngoscope 1983;93:661–662. Surkin M, Green R, Kessler S, Leiconte F: Subclavian vein thrombosis secondary to chronic otitis media. Ann Otol Rhinol Laringol 1983;92:45–48. Swartz J, Varghese S: Pars flaccida cholesteatoma as demonstrated by computed tomography. Ar Otolaryngol 1984;110:515–517. Takoudes T, Haddad J: Hydrogen peroxide in acute otitis media in guinea pigs. Laryngoscope 1997;107:206–210. Teele DW, Healy GB, Tally FP: Persistent effusions of the middle ear cultures for anaerobic bacteria. Ann Otol Rhinol Laryngol 1980;89(Sup. 68):102–103. Teichgraeber JF, Peer–Lee J, Turner J: Lateral sinus thrombosis. Laryngoscope 1982;92:744–451. Teunissen E, Cremers C: Classification of congenital middle ear anomalies. Report on 144 cases. Anns tendon in laser Otol Rhinol Laryngol 1993;102:606–612. Thomasen PC, Hermansson A, Tos M, Prellner K: Pathogenesis of middle ear adhesions. Laryngoscope 1996;106:463–469. Thompson DH, Ross DG, Reid JW: Granulocytic sarcoma (chloroma) initially seen as acute mastoiditis. Ar Otolaryngol 1982;108:386–391. ERRNVPHGLFRVRUJ Capítulo 5 Sade J, Fuchs C: Secretory otitis media in adults: II: The role of mastoid pneumatization as a prognostic factor. Ann Otol Rhinol Laryngol 1997;106:37–40. Sade J, Fuchs C, Russo E, Cohen D: Is secretory otitis media a single disease entity. Ann Otol Rhinol Laryngol 2003;112:342347. Sak R, Ruben RJ: Recurrent middle ear effusion in childhood: implication of temporary auditory deprivation for language and learning. Ann Otol Rhinol Laringol 1981;90:546–551. Saliba I, Boutin T, Arcand P, Froehlich P, Abela A: Advantages of subannular tube vs repetitive transtympanic tube technique. JAMA Otolaryngol Head Neck Surg 2011;137:1210–1216. Samuel J, Fernández CM, Steinberg J: Intracranial otogenic complications. Laryngoscope 1986;96:272–278. Samuel J, Fernández CM: Tuberculous mastoiditis. Ann Otol Rhinol Laryngol 1986;95:264–266. Sando I, Myers D, Harada T et al.: Osteogenesis imperfecta tarda and otosclerosis. Ann Otol Rhinol Laryngol 1981;90:199– 203. Sasaki CT, Askenase P, Dwyer J et al.: Chronic ear infection in the immunodeficient patient. Ar Otolaryngol 1981;107:82– 86. Schünemonk M, Issing P, Erbnich B et al.: Expression pattern of the plasminogen activator plasmin system in human cholesteatoma. Ann Otol Rhinol Laryngol 1999;108:245–252. Schwaber M, Glasscock M, Nissen A: Diagnosis and management of catecholamine secreting glomus tumors. Laryngoscope 1984;94:1008–1015. Schwartz R, Rodríguez J, Khan WN, Ross S: Acute purulent otitis media in children older than 5 years. Incidence of Haemophilus as a causative organism. JAMA 1997;238:1032–1033. Schwartz R, Rodríguez WJ, Khan W et al.: Trimethoprim– sulfamethoxazole in the treatment of otitis media secondary to ampicillin–resistant strains of Haemophilus influenzae. Ann Otol Rhinol Laryngol 1980;89(Sup. 68):281–284. Schwartz RH, Puglese J, Schwartz DM: Use of a short course of prednisone for treating middle ear effusion. Ann Otol Rhinol Laryngol 1980;89(Sup. 68):296–300. Schwartz RH, Rodríguez WJ, Khan W: Otitis media secondary to ampicillin–resistant Haemophilus influenzae. Ann Otol Rhinol Laryngol 1982;91:328–329. Senturia BH, Gessert LF, Carr LD et al.: Studies concerned with tubotympanities. Ann Otol Rhinol Laryngol 1958;67:440– 467. Senturia BH, Bluestone CD, Klein JO et al.: Report of the ad hoc committee on definition and classification of otitis media and otitis media with effusion. Ann Otol Rhinol Laryngol 1980;89(Sup. 68):3–4. Senturia BH, Paparella MM, Lowery HW et al.: Recent advances in otitis media with effusion. I–A. Definition and classification. Ann Otol Rhinol Laryngol 1980;89(Sup. 69):4–8. Sesana W, Oliveira C: Internal carotid artery simulating a middle ear mass. Ann Otol Rhinol Laryngol 1993;102:71–73. Shapiro I, Canalis RF, Firemark R et al.: Ossicular discontinuity with intact acoustic reflex: Ar Otolaryngol 1981;107:576– 578. Shea J, Postma D: Findings and long–term surgical results in the hearing loss of osteogenesis imperfecta. Ar Otolaryngol 1982;108:467–470. 109 109 110 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 5 Tokuriki M, Noda I, Saito T, Narita N, Sunasa H, Tsuzuki H, Ohtsubo T, Fujeda S, Saito H: Laryngocope 2003;113:808-814. Torreta J, Drago L, Marchisio P, Gaffuri M: Topographic distribution of biofilm producing bacteria in adenoid subsites of children with chronic or recurrent middle ear infections. Annal Otol Rhinol Laryngol 2013;122:109–113. Tos M: A new pathogenesis of mesotympanic (congenital cholesteatoma). Laryngoscope 2000;110:1890–1897. Tos M: Production of mucus in the middle ear and eustachian tube. Ann Otol Rhinol Laryngol 1974;83:44–58. Tos M, Bak–Pedersen K: Goblet cell population in the pathological middle ear and eustachian tube of children and adults. Ann Otol Rhinol Laryngol 1977;86:209–218. Tos M, Poulsen G, Borch J: Etiologic factors in secretory otitis. Ar Otolaryngol 1979;105:582–588. Tos M: Middle ear epithelia in chronic secretary otitis. Ar Otolaryngol 1980;106:593–596. Tos M: Pathogenesis and pathology of chronic secretory otitis media. Ann Otol Rhinol Laryngol 1980;89(Sup. 68):91–97. Tos M, Jensen–Holm S, Sorensen C: Spontaneous course and frequency of secretary otitis in 4 year–old–children. Ar Otolaryngol 1982;108:4–10. Tos M, Stangerup SE, Holm–Jensen S, Sorensen S: Spontaneous course or secretory otitis and changes of the eardrum. Ar Otolaryngol 1984;110:281–289. Tos M, Stangerup SE, Hvind G: Mastoid pneumatization. Ar Otolaryngol 1984;110:502–507. Tos M, Stangerup S, Andreassen U: Size of the mastoid air cell and otitis media. Ann Otol Rhinol Laryngol 1985;94:386–392. Trujillo Martin Felix, Valdez Martinez E, Ramirez Jorge, Lozano Morales R: Surgical and medical treatment of hearing loss in mixed otoesclerosis. Annals Otol Rhinol Laryngol 2009;118:859–865. Tschiassay K: Is facial palsy, when complicating cases of acute otitis media, indication for immediate mastoid operation. Cincinnati J Med 1944;25:262. Uzun C, Adali M, Koten M, Yagiz R, Aydin S, Cafir B: Relationship between mastoid penumatization and middle ear barotrauma in divers. Laryngoscope 2002;112:287-291. Veldman JE, Mulder PHM, Ruijs SHJ et al.: Early defection of asymptomatic hereditary chemodectoma with radionuclide scintiangiography. Ar Otolaryngol 1980;106:547–552. Wardrop P, Pillsbury H: Mycobacterium avium acute mastoiditis. Ar Otolaryngol 1984;110:686–687. Warren F, Bennett M, Wiggins R, Saltzman K, Blevins K: Congenital cholesteatoma of the mastoid temporal bone. Laryngoscope 2007;117:1389-1394. Warren WH, Caldarelli DD, Javid H et al.: Neuroendocrine markers in paragangliomas. Ann Otol Rhinol Laryngol 1985;94:555–559. Webster DB, Webster M: Neonatal sound deprivation affects brain stern auditory nuclei. Ar Otolaryngol 1977;103:392– 396. Weegerink N, Schrauwen I, Huyjen P, Pennings R: Phenotype of the first otoesclerosis family linked to OTSC 10. Laryngoscope 2011;121:838–845. Wehrs R: Congenital absence of the long process of the incus. Laryngoscope 1999;109:192–197. Weidenbecher M: Vitamin A–induced ear malformations in rats as a model for analysis of atresia auris congenita. Ann Otol Rhinol Laryngol 1981;90(Sup. 81):3–12. Weit RJ: Patterns of ear disease in the Southwestern American Indian. Ar Otolaryngol 1979;105:381–385. Wetli C: Keraunopathology. Am J Forensic Med Path 1996;17:89– 98. Wiatrak B, Pensak M: Rhabdomyosarcoma of the ear and temporal bone. Laryngoscope 1998;99:1188–1192. Winkelstein J, Smith M, Shin, H: The role of C3 as an opsonin in the early stages of infection. Proc Soc Exp Biol Med 1975;149:397–401. Woodson GE, Jurco S, Alford BR et al.: Verrucous carcinoma of the middle ear. Ar Otolaryngol 1981;107:63–65. Wycherly B, Berkowitz F, Noone A, Kim H. Computed tomography and otoesclerosis: a practical method to correlate the sites affected to hearing loss. Ann Otol Rhinol Laryngol 2010;119:789–794. Yamaguchi T, Urasawa T, Kataura A: Secretory immunoglobulin. A antibodies to respiratory viruses in middle ear effusion of chronic otitis media with effusion. Ann Otol Rhinol Laryngol 1984;93:73–75. Yan S, Huang C: Lymphotoxin in human middle ear cholesteatoma. Laryngoscope 1991;101:411–415. Yamaguchi T, DeMaria T, Lim D: Antibody response in experimental Haemophilus influenzae otitis media Ar Otolaryngol 1986;112:554–557. Yellon R, Leonard G, Matucha P et al.: Demonstration of interleukin 6 in middle ear effusions. Ar Otolaryngol 1992;118:745–748. Yoo TJ: Etiopathogenesis of otosclerosis. A hypothesis. Ann Otol Rhinol Laringol 1984;93:28–33. Zahneisenl G, Kimmich T, Arnold W: Aberrant internal carotid artery of the right middle ear. Ar Otolaryngol 2004;130:1120-1124. ERRNVPHGLFRVRUJ Oído interno Casi 50% de las sorderas durante la infancia ocurre en el primer año de vida y 35 a 50% de ellas tienen origen congénito. Estudios acerca de la prevalencia señalan que 1 de 1 000 pacientes sufre sordera prelingual (antes del tercer año de vida) y 2.03/1 000 sordera prevocacional (antes de los 19 años). Los niños con hipoacusias moderadas son pacientes con alto riesgo en relación con el desarrollo adecuado del lenguaje, así como con otros aspectos del aprendizaje y desarrollo. Aunque puede haber un lapso prolongado entre la sospecha de una sordera y su confirmación, las pruebas de las respuestas auditivas del tallo cerebral han reducido este intervalo en el diagnóstico, sobre todo en lactantes y preescolares, en los que resultaba difícil obtener respuestas confiables cuando se recurría a otros métodos de estudio. TRASTORNOS DEL DESARROLLO DEL LABERINTO Entre las anomalías congénitas del laberinto, las de la cóclea son las más frecuentes, seguidas por las del vestíbulo y los conductos semicirculares. Hasta el momento se han publicado cerca de 170 anomalías del oído interno, por lo que autores como Suehiro y Sando (1979) han propuesto clasificaciones basadas en las estructuras anatómicas, con énfasis en la existencia de aplasia e hipoplasia, y en la naturaleza ósea, membranosa o combinada de tales estructuras. Sin embargo, el autor considera que la clasificación de Schucknecht (1967) es la más práctica. Clasificación de Schucknecht Malformación de tipo Michel (1863): es la falta completa de desarrollo del oído interno y, en ocasiones, de la porción petrosa del hueso temporal. Malformación de tipo Mondini (1791): consiste en un aplanamiento de la cápsula ósea coclear, falta de desarrollo de la estructura ósea de la porción apical de la cóclea, defectos en el tabique interescalar, el modiolo y la lámina espiral ósea, reducción del número de vueltas cocleares (hay sólo una vuelta y media), vestíbulo muy alargado y ductus reuniens grande y dilatación del saco endolinfático. Esta malformación puede aparecer en forma unilateral o bilateral, con o sin alteraciones de otros órganos. Algunos síndromes descritos acompañados de esta alteración son los siguientes: a) Síndrome de Klippel–Feil. b) Síndrome de Pendred. c) Síndrome de Down. d) Trisomías D y E. e) Síndrome de DiGeorge; en ocasiones se relaciona con fístula perilinfática. La pérdida de la función auditiva puede ser estática o progresiva y variar desde una audición normal hasta una hipoacusia profunda y, según Goin (1984), puede guardar relación con la dinámica endolinfática, por lo que puede ser útil una derivación del saco endolinfático en pacientes específicos. Gracias a la politomografía y el desarrollo de la tomografía axial computarizada, el diagnóstico clínico y radiográfico de esta displasia ha sido más frecuente. Malformación de tipo Scheibe (1892): el sáculo y el conducto coclear no se desarrollan y sólo se observan grupos de células no diferenciadas. El laberinto óseo es normal, así como el utrículo y los conductos semicirculares. La membrana tectorial se encuentra reducida y la escala media colapsada, con la membrana de Reissner colocada directamente sobre grupos de células indiferenciadas y sobre la estría vascular. El órgano de Corti puede mostrar cordones de tejido conectivo. En algunos pacientes se encuentran restos auditivos, sobre todo en frecuencias bajas; los auxiliares auditivos son de utilidad. Ésta es la malformación congénita del laberinto más frecuente y se transmite de manera autosómica recesiva. Malformación de tipo Alexander (1904): se caracteriza por aplasia del conducto coclear; el órgano de Capítulo 6 ENFERMEDADES CONGÉNITAS 111 ERRNVPHGLFRVRUJ 112 Oído, nariz, garganta y cirugía de cabeza y cuello Corti y las células ganglionares adyacentes de la vuelta basal de la cóclea son las más afectadas, con aparición de una hipoacusia limitada a las frecuencias altas; también es útil un auxiliar auditivo eléctrico. Clasificación de Jackler y House (1987) Capítulo 6 Estos autores han sugerido una clasificación de las anomalías del laberinto basada en las alteraciones detectadas por medios radiográficos e identificadas en 20% de los sujetos con hipoacusia neurosensorial congénita; incluyen las siguientes: Anomalías acompañadas de ausencia o malformación coclear: a) Aplasia completa del laberinto (tipo Michel), en la cual no hay desarrollo alguno del oído interno. b) Aplasia coclear con vestíbulo y conductos semicirculares normales o malformados. c) Hipoplasia coclear que consiste en el desarrollo de un botón coclear pequeño de 1 a 3 mm de diámetro, con vestíbulo y conductos semicirculares normales o malformados. d) Partición incompleta del tabique interescalar; la cóclea es menor de lo normal, con ausencia parcial o total del tabique interescalar; el vestíbulo y los conductos semicirculares son normales o malformados. e) Cavidad común; tanto la cóclea como el vestíbulo forman una cavidad común, con falta de desarrollo de su estructura interna, y los conductos semicirculares, aunque pueden ser normales, a menudo se encuentran malformados. f) En fecha reciente, Tian y Linthicum (2006) describieron otra malformación coclear que se caracteriza por una cóclea con tres vueltas completas. Anomalías con cóclea normal: a) Displasia del vestíbulo y conducto semicircular lateral: el vestíbulo se encuentra alargado con un conducto semicircular lateral corto y dilatado. b) Acueducto vestibular alargado: se acompaña de conductos semicirculares normales y en ocasiones alargamiento del vestíbulo. Esta clasificación también se relaciona con la embriogénesis del oído. La aplasia de tipo Michel ocurre durante la tercera semana de gestación; una pérdida de la diferenciación durante la cuarta semana tiene como resultado una cavidad común entre la cóclea y el vestíbulo; la aplasia coclear con preservación de los conductos semicirculares y el vestíbulo se presenta durante la quinta semana de vida embrionaria; la falta de desarrollo coclear en la sexta semana puede ser efecto de la formación de una cóclea rudimentaria; una alteración en el desarrollo durante la séptima semana produce una deformidad de tipo Mondini, con cóclea pequeña y partición intracoclear incompleta. Con respecto a la embriogénesis del laberinto, una falla en la formación de los repliegues epiteliales provenientes de las evaginaciones de la membra- na del apéndice vestibular durante la sexta semana de la gestación da lugar a la ausencia completa de uno o más conductos semicirculares. La porción central de la evaginación de la membrana tiene forma de medio disco y se resorbe y reemplaza por tejido mesenquimatoso para formar así el conducto semicircular. Una absorción incompleta de esta membrana central da origen al desarrollo de un conducto semicircular incompleto en forma de pera que es confluente con el vestíbulo. El conducto semicircular superior es el primero en formarse, seguido por el posterior y el lateral. Las anomalías del conducto semicircular superior se acompañan a menudo también de alteraciones del lateral, mientras que las del semicircular lateral aparecen muchas veces en forma aislada. El alargamiento del acueducto vestibular se debe a una falla en su estrechamiento gradual, que ocurre durante la quinta a octava semanas de la gestación y constituye la alteración congénita del oído interno que se detecta con mayor frecuencia mediante rayos X. El acueducto vestibular es el conducto óseo que contiene al saco y conducto endolinfático. Su diámetro es de 0.4 a 1.0 mm y tiene un área de 8 a 18 mm2. Los diámetros mayores de 2 mm se consideran anormales. Valvassori y Clemis describieron en 1978 su relación con hipoacusia sensorial, aunque una hipoacusia con componente conductivo se ha descrito en el 27% de los casos. Por lo general, la hipoacusia se presenta durante la infancia y de forma típica es progresiva, con presencia de curvas fluctuantes descendentes auditivas. Los niños con audición normal y un acueducto vestibular grande tienen un riesgo elevado de desarrollar hipoacusias súbitas. La hipoacusia es el resultado de incrementos fluctuantes de la presión del líquido cefalorraquídeo que se transmiten a través el saco y conducto endolinfático hacia el laberinto membranoso. En un tercio de los casos se agregan síntomas vestibulares, con vértigo episódico intenso e inestabilidad en los adultos, con paresia o ausencia de respuestas nistágmicas a la estimulación térmica. También puede existir acúfeno intermitente o constante. El diagnóstico se establece mediante tomografía axial computarizada o resonancia magnética. SORDERA CONGÉNITA NO INFECCIOSA En más de la mitad de los pacientes con sordera, ésta es atribuible a causas genéticas y ocurre en forma aislada o sindrómica. La mayor parte de los casos se transmite en forma autosómica recesiva y menos del 2% se debe a alteraciones genéticas en el cromosoma X. Hasta el momento se han informado 60 locus en el genoma humano vinculados con hipoacusia no sindrómica. En consecuencia, los primeros datos de genes relacionados con estas hipoacusias aparecieron en el año 1993, tras identificar la mutación mitocondrial del ribosoma 12–S en el RNA. Se han reconocido otras mutaciones que llevan al desarrollo de hipoacusia en otros genes mitocondriales, como el RNA–SER (VCN), y en el DNA mitocondrial. Este último contiene 16 569 pares de bases en una molécula circular cerrada y codifica a 13 genes esenciales en el proceso ERRNVPHGLFRVRUJ Oído interno gamento espiral, la lámina espiral ósea de la cóclea y el estroma macular del sáculo y utrículo, así como en las crestas de los conductos semicirculares. Hay un estrangulamiento y degeneración de las dendritas, seguido por una degeneración neuronal y grados variables de atrofia en los órganos sensoriales. El locus DFNA25 relacionado con el cromosoma 12q21-24 produce sordera para frecuencias agudas de tipo autosómico dominante no sindrómica y también se le ha atribuido una mayor susceptibilidad para el desarrollo de traumatismo acústico y presbiacusia en la población general. Síndrome de Down Es bien conocida la relación entre síndrome de Down y trastornos auditivos. Harada y Sando (1981) han encontrado que son más frecuentes las anomalías del oído medio que las del interno. No es raro encontrar un remanente de tejido mesenquimatoso en el nicho de la ventana redonda, así como un amplio genu faciale. Con respecto al oído interno, lo más común es la presencia de hidropesía endolinfática, así como un acortamiento del tamaño coclear con un número de vueltas normales. En el síndrome de Down se ha señalado la presencia de hipoacusias conductivas, sensoriales y mixtas. Trisomía 13–15 (D) Se caracteriza por implantación baja de orejas, anomalías del pabellón auricular e hipoplasia del conducto auditivo externo o de oído medio, labio y paladar hendidos, microftalmía y aplasia del nervio óptico. En el oído interno se puede encontrar degeneración quística de la estría vascular, modiolo incompleto e hipoplasia sacular. Trisomía 18 (E) Este síndrome puede incluir implantación baja de orejas, anomalías del pabellón auricular, micrognatia, occipucio prominente y flexión del dedo índice sobre el mediano contiguo. En oído medio, en algunos casos, es anormal el músculo tensor del tímpano con presencia de tejido fibroso mesenquimatoso. En oído interno, el modiolo puede estar desarrollado en forma incompleta y la cóclea aplanada; en ocasiones no hay división ósea entre las porciones medial y apical de la cóclea. El órgano de Corti tiene una estructura normal. Artrooftalmopatía progresiva de Stickler Se transmite con carácter autosómico dominante; consiste en la presencia de miopía progresiva con desprendimiento de retina acompañada de hipoacusia sensorial y neurosensorial. Además, desde la infancia hay degeneración de articulaciones con limitación de la flexión. Displasias ectodérmicas Se denominan así porque el tejido anormal se deriva del ectodermo embrionario. Incluyen hipoplasias de la piel ERRNVPHGLFRVRUJ Capítulo 6 de fosforilación oxidativa, además del RNA ribosómico estructural y de transferencia, que son necesarios para su expresión. Hay más de 400 enfermedades agrupadas en los trastornos mitocondriales, como son la encefalomiopatía mitocondrial con acidemia láctica, debilidad muscular neurogénica con ataxia y retinitis pigmentosa, deficiencia de citocromo oxidasa y síndrome de KernsSayne. Se han detectado cinco mutaciones mitocondriales relacionadas con sordera no sindrómica: a) A1555G, b) A7445 G, c) 7472 INS C, d) T 7510C, y e) LAT7511 C. La mutación mitocondrial de DNA A1555G se vincula con hipoacusia progresiva moderada para frecuencias agudas; los individuos con éste son altamente susceptibles a daño coclear grave, posterior a la administración de antibióticos aminoglucósidos. La mutación T 7511C se relaciona con una pérdida notoria de células del ganglio espiral en todas las vueltas de la cóclea, así como de filamentos neuronales en el canal de Rosenthal. Otros genes relacionados con hipoacusia no sindrómica son: miosina VI, miosina VII A, miosina XV (DFNB2, DFNB3, DFNA11), diáfanos y conexinas 26 y 31 (DFNA3, DFNB1, DFNA2); factores de transcripción POV 3 F4, POV 4 F3 (DFN3, DFNA15), proteína extracelular α tectorina (DFNA8, DFNA12) y la del canal de potasio KNCQ4. La conexina 26 (GJB2) contribuye en cerca de la mitad de las hipoacusias prelinguales recesivas, por lo que su presencia es importante en la consulta genética de hipoacusias hereditarias. El gen de la conexina 26 se localiza en el locus DFNB1 del cromosoma humano 13q 12; una de sus funciones en la cóclea es favorecer el regreso de iones de potasio a la endolinfa posterior a la estimulación de las células ciliadas. La mutación más común de la conexina 26 consiste en una deleción de la guanina en la posición 35 de la cadena de guaninas de ácido nucleico (25 del G), lo que da origen a un término prematuro de la cadena nuclear. En consecuencia, se observa acumulación del potasio en la endolinfa coclear que se vincula con alteración de las células ciliadas y sordera. Las hipoacusias sensoriales limitadas a frecuencias agudas, en combinación con la diabetes mellitus tipo 2, se han relacionado con sustitución de la adenina por guanina en el DNA mitocondrial en el nucleótido 3 243. Otras mutaciones del DNA mitocondrial causan la encefalomiopatía mitocondrial (MELAS) que se acompaña también de acidosis láctica y episodios parecidos de accidentes vasculares cerebrales e hipoacusia neurosensorial progresiva. Las sorderas vinculadas con locus DFN4 se caracterizan por una disfunción en la producción de distrofina, que es una proteína proveniente del gen localizado en el brazo corto del cromosoma X y que provee soporte estructural a las células durante situaciones de estrés mecánico, por lo que constituye una sordera no sindrómica vinculada con el cromosoma X. El locus DFN3 se ha relacionado con hipoacusias neurosensoriales progresivas con fístulas perilinfáticas y vinculadas con el cromosoma X. Hasta el momento se han descrito 11 genes relacionados con hipoacusias neurosensoriales de origen autosómico dominante, que se encuentran en los cromosomas 1P y 5Q y se caracterizan por el depósito de ácidos polimucosacáridos en áreas cribosas, en el li- 113 113 114 Oído, nariz, garganta y cirugía de cabeza y cuello y sus derivados y defectos de uñas, dientes, cristalino y sordera de tipo sensorial; esta última es más obvia en las de tipo hidrótico, que no incluyen problemas importantes de la sudación ni la temperatura. Casi todas se transmiten con carácter autosómico dominante. de los casos, la sordera es de tipo conductivo. Se cree que es efecto de un hematoma embrionario que afecta el desarrollo de los derivados del primer y segundo arcos branquiales. Capítulo 6 Mucopolisacaridosis tipo I–H (síndrome de Hurler) Síndrome de Klippel–Feil Representa la fusión anormal de las vértebras cervicales o torácicas superiores, por falta de diferenciación mesodérmica en el segundo mes de la gestación. Haller lo describió por primera vez en 1745. Es común encontrar alteraciones concurrentes, de oídos medio e interno, entre las que se encuentran ausencia de la cadena osicular, malformación del yunque con desarrollo nulo de platina y displasia de tipo Mondini. En la mayoría de los pacientes hay hipoacusia mixta de predominio neurosensorial, sobre todo en mujeres. Una variante de este padecimiento es el síndrome cervicooculoacústico (síndrome de Wilderbank, 1952), que se reconoce por la fusión de dos o más vértebras cervicales, parálisis del motor ocular externo, retracción de los globos oculares e hipoacusia neurosensorial o conductiva. Síndrome de Pendred Al parecer, es una de las causas más frecuentes de sordera autosómica recesiva. La hipoacusia es de tipo neurosensorial bilateral y a menudo profunda, y su inicio es posnatal. En 50% de los casos puede encontrarse una anomalía de Mondini. Estudios tomográficos han mostrado aplanamiento del promontorio, alargamiento del vestíbulo, adelgazamiento de la cápsula laberíntica y ensanchamiento del conducto semicircular lateral. Este síndrome se caracteriza también por la presencia de bocio tipo nodular, que puede ser congénito o desarrollarse en la infancia tardía o la adolescencia. Hay aumento de la hormona estimulante de la tiroides, con hiperplasia compensadora. Puede haber retraso mental concomitante, más frecuente cuando el bocio es congénito. Displasia braquiootorrenal En 1864, Heusinger describió este trastorno congénito caracterizado por la presencia de mamelones preauriculares, fístulas branquiales e hipoacusia. Desde 1976 se sabe que también puede acompañarse de alteraciones renales. En 20% de los casos, la hipoacusia es de tipo neurosensorial, acompañada de displasia de tipo Mondini; en 30%, la hipoacusia es de tipo conductivo y en 50% mixta. Displasia oculoauriculovertebral (síndrome de Goldenhar) Se cree que es de tipo autosómico recesivo. Los pacientes con este síndrome presentan hipoplasia malar, defecto ocular dermoide o lipodermoide epibulbar, malformaciones del pabellón auricular, del oído medio y el interno, así como del conducto auditivo interno. En 30 a 50% Se transmite con carácter autosómico recesivo. Consiste en una deficiencia de α-I–iduronidasa. Sus manifestaciones clínicas primarias consisten en facies tosca, opacidad corneal temprana, disostosis múltiples, deficiencia mental, excreción urinaria de sulfato de heparán y dermatán. En la mucopolisacaridosis existe un aumento notorio del almacenamiento de tejido mesenquimatoso que afecta estructuras perivasculares y meníngeas y, al parecer, ello produce también hipoacusias de tipo neurosensorial, cuando se afecta el hueso temporal. Se han detectado anomalías similares en la mucopolisacaridosis de tipo II (síndrome de Hunter). Ataxia de Friedreich Es una enfermedad autosómica recesiva caracterizada por atrofia espinocerebelosa. Otras alteraciones son ataxia en la marcha, afectación visual, disartria, psicosis, epilepsia, xifoescoliosis, anomalías cardiacas, diabetes mellitus, hipoacusia y daño vestibular. En promedio inicia a la edad de 10 años. La relación entre ataxia hereditaria y signos cocleovestibulares se reconoció desde principios del siglo pasado. Por lo general, la hipoacusia es neurosensorial, puede ser progresiva o estacionaria y afectar más frecuencias bajas y altas; se presentan en 10% de los casos. Existe lesión del núcleo coclear y del complejo olivar superior, pérdida de la población celular y gliosis. Síndrome de anemia de Fanconi Se presupone que este síndrome es autosómico recesivo; se caracteriza por pancitopenia, hiperpigmentación de la piel, hipoplasia del radio y el pulgar. Aparece en la infancia y casi siempre es letal. Se ha señalado su relación con sordera y alteraciones óticas, como hipodesarrollo de la porción superior del conducto coclear, fijación de la platina del estribo y la cabeza del martillo. Síndrome de Apert (acrocefalosindactilia) Es una enfermedad autosómica dominante. Pertenece al grupo de las craneosinostosis y se caracteriza por hipertelorismo, hipoplasia facial superior, paladar ojival, sindactilia del pulgar y primer ortejo ancho y grueso. Un estudio de Gould (1982) conducido en 19 pacientes demostró la elevada frecuencia de trastornos en oído medio, sobre todo el desarrollo de otitis medias serosas, con hipoacusia moderada de tipo conductivo. También se han encontrado bulbos de la yugular dehiscentes y fijación de platina del estribo. ERRNVPHGLFRVRUJ Oído interno Síndrome de Alport Acidosis tubular renal e hipoacusia sensorineural La acidosis tubular renal es un síndrome autosómico recesivo, que consiste en el desarrollo de acidosis metabólica acompañada de orina alcalina. Puede ser distal o proximal, primaria o secundaria. En la distal no pueden alcanzarse los requerimientos de hidrogeniones y en la proximal hay una alteración en la absorción de bicarbonato. En apariencia, también existe un defecto en la actividad de la β–anhidrasa carbónica de los glóbulos rojos. La hipoacusia neurosensorial en estos sujetos se presenta desde la niñez y es progresiva. sia mandibular y traqueobronquiomalacia. Es común encontrar una cóclea pequeña, con escala común. El vestíbulo y los conductos semicirculares pueden estar deformados. También hay alteraciones del oído medio, como estribo con un solo crus y ausencia de su tendón, anquilosis de las articulaciones de la cadena osicular y mastoides con tejido mesenquimatoso. Al parecer, se transmite con carácter autosómico recesivo. Síndrome de Waardenburg Es de transmisión autosómica dominante. Comprende de 1 al 7% de todas las sorderas congénitas. Características clínicas: desplazamiento lateral del canto interno y punto lacrimal, heterocromía del iris, puente nasal aplanado, hiperplasia de las cejas, albinismo parcial e hipoacusia neurosensorial (25% de los casos) moderada a profunda, sobre todo en frecuencias medias y bajas. Existe atrofia del órgano de Corti y la estría vascular con reducción del número de células nerviosas en el ganglio espiral. Albinismo Se transmite con carácter autosómico dominante, recesivo o ligado al sexo. Se reconoce por pelo fino, ausencia de pigmento en iris y esclerótica, estrabismo, fotofobia y nistagmo. La sordera que se presenta es bilateral de tipo neurosensorial y grave. Síndrome de Usher Es un trastorno autosómico recesivo. Su frecuencia es de 1.8 a 3.5/100 000. En esencia, consiste en retinitis pigmentosa con hipoacusia neurosensorial, progresiva o no. Se conocen cuatro tipos clínicos: 1. Retinitis pigmentosa de inicio antes de los 10 años de edad, hipoacusia neurosensorial profunda y ausencia de respuesta vestibular; constituye el 90% de los casos. 2. Retinitis pigmentosa que se desarrolla entre los 10 y 20 años, hipoacusia neurosensorial moderada a grave, con respuesta vestibular normal o ligeramente disminuida; representa el 10% de los casos. 3. Retinitis pigmentosa de inicio en la pubertad e hipoacusia neurosensorial progresiva; las pruebas vestibulares pueden ser normales o disminuidas. 4. Este tipo es similar al II, pero ligado al cromosoma X. Los tipos III y IV son raros (1% de los casos). Todo niño con hipoacusia neurosensorial bilateral debe someterse a valoración oftalmológica, ya que este síndrome llega a presentarse en el 3 al 10% de los niños con sordera. Síndrome campomélico Se caracteriza por enanismo, anomalías craneofaciales, alteraciones respiratorias, encorvamiento de tibias y fémur, facies pletórica, dorso nasal amplio, implantación baja de pabellones auriculares, paladar hendido, hipopla- Enfermedad de Paget (osteítis deformante) Se transmite con carácter autosómico dominante. Se distingue por anomalías en cráneo y huesos largos de las extremidades inferiores. Por lo regular se inicia durante la etapa de adulto joven. Puede afectarse el hueso temporal y algunas veces existe degeneración del órgano de Corti y la estría vascular. Fibrosis quística del páncreas y pérdida auditiva Es una enfermedad congénita, autosómica recesiva, que afecta las glándulas exocrinas y su funcionamiento acinotubular. Aumenta el sodio en el sudor, hay deficiencia de proteínas pancreáticas y se acompaña del desarrollo de pólipos nasales (5 a 28% de los casos). Forman (1979), en un estudio en 80 pacientes, encontró que hay con frecuencia hipoacusia conductiva o neurosensorial (15 a 20%). Enfermedad de Jerverll (1957) Se transmite con carácter autosómico recesivo. Consiste en una prolongación del intervalo Q–T, crisis de Stokes– Adams e hipoacusia neurosensorial bilateral grave. En algunos casos hay muerte súbita durante la infancia. Existe atrofia del órgano de Corti, estría vascular y disminución de la población celular del ganglio espiral. ERRNVPHGLFRVRUJ Capítulo 6 Consiste en una nefropatía hereditaria acompañada de hipoacusia neurosensorial progresiva y anomalías del cristalino. La muerte es consecuencia de enfermedad renal, a menudo antes de los 50 años de edad. Se sabe que existe una gran relación entre la estría vascular y las células epiteliales de los túbulos proximales, además de que estas dos estructuras se afectan de manera similar por antígenos y fármacos comunes. Desde el punto de vista otopatológico, se ha observado pérdida de células ciliadas y neuronas cocleares, y en ocasiones se ha reconocido hidropesía endolinfática moderada con disminución de la función vestibular. Al parecer, también existe una relación entre el grado de hiponatremia y el de hipoacusia. 115 115 116 Oído, nariz, garganta y cirugía de cabeza y cuello Síndrome de CHARGE Capítulo 6 La sigla CHARGE se conforma con las letras iniciales de diferentes anomalías congénitas: coloboma ocular (C), anomalías cardiacas (H), atresia coanal (A), retardo del crecimiento (R), hipoplasia genital (G) y alteraciones del oído (E). Entre estas últimas figuran la implantación baja del pabellón auricular, microtia, anomalías de la cadena de huesecillos, ausencia del músculo estapedial, problemas cocleares y displasia o hipoplasia vestibular. SORDERA CONGÉNITA DE ORIGEN INFECCIOSO Síndrome de rubeola congénita Los pacientes pueden presentar persistencia del conducto arteriovenoso, cataratas y sordera. En un estudio de 80 niños con este síndrome, Nishida (1983) encontró en 38% hipofunción vestibular demostrada en las pruebas térmicas y en 34% la imposibilidad de mantener el equilibrio con los ojos cerrados (prueba de Romberg). En estos individuos, la hipoacusia es de tipo neurosensorial moderada a profunda y, en algunos casos, progresiva. Infección congénita por citomegalovirus Algunos estudios han mostrado que cerca de 1% de los neonatos puede eliminar citomegalovirus por saliva u orina. El 10% desarrolla alteraciones neurológicas, entre las que se encuentran microcefalia, retardo psicomotor, coriorretinitis y sordera. El método más preciso para detectar esta infección es mediante radioinmunoensayo (IgM específica para citomegalovirus). Es la causa más común de infección viral congénita. La hipoacusia es de tipo neurosensorial, se presenta en 20 a 65% de los casos y por lo general es bilateral. La endolaberintitis se considera una característica fundamental de las infecciones del oído interno por citomegalovirus. Entre los cambios histopatológicos identificados hay formación de quistes o granulomas en la estría vascular, degeneración del órgano de Corti (pérdida de células ciliadas externas) y disminución de población celular en el ganglio espiral. Al parecer, la inmunidad sistémica (vacunas) desempeña un papel importante en el mecanismo de defensa de la cóclea contra esta infección. Citomegalovirus pertenece al síndrome TORCH (infección por toxoplasmosis, rubeola, citomegalovirus, herpes simple y sífilis). Todo paciente con este síndrome debe valorarse audiológicamente durante los primeros seis meses de vida, con estudios longitudinales de seguimiento, al menos hasta los cinco o seis años de edad. Otitis sifilítica congénita La sífilis congénita resulta de una infección transplacentaria después del cuarto mes de gestación. Los síntomas pueden manifestarse desde el nacimiento o en forma tardía, hasta los 50 años. La triada de Hutchinson puede aparecer durante el segundo decenio de la vida y se caracteriza por: hipoacusia neurosensorial, queratitis intersticial y alteraciones dentarias, sobre todo en los incisivos. Los signos de Hennebert y Tullio pueden ser positivos por desarrollo de una fístula laberíntica o adhesiones de la platina sobre el sáculo. Algunos hallazgos en el hueso temporal consisten en osteomielitis crónica y endarteritis obliterativa. La frecuencia de sordera, tanto en la sífilis congénita temprana como en la tardía, es de casi 18%. La sífilis, en general, tiene una prevalencia de 22.7/100 000. La identificación del treponema con microscopia de campo oscuro es útil para casos primarios tempranos en los que las pruebas serológicas son aún negativas. VDRL puede ser positiva en 70 a 90%. Hay positivas falsas agudas en hepatitis, mononucleosis infecciosa, neumonía viral, varicela y embarazo. En el lupus eritematoso sistémico se encuentran reacciones positivas falsas de tipo crónico. La identificación en anticuerpos antitreponema no es una prueba muy específica, ya que se encuentran en 6.5% de pacientes con hipoacusia neurosensorial no explicable y hasta en 7% de los casos con alteraciones cocleovestibulares atribuidas a la enfermedad de Ménière. Otras pruebas para identificar el treponema son la de microhemaglutinación y la de inmunofluorescencia del treponema. Los estudios han mostrado también que el grado de hipoacusia de estos pacientes es paralelo al de lesión vestibular unilateral o bilateral, cuando se desarrolla. Se ha detectado hidropesía endolinfática en 5 a 10%. El tratamiento consiste en penicilina G benzatínica, 2.4 millones de unidades intramusculares (IM) diarias durante tres semanas, seguidos de una dosis semanal similar por un total de tres meses. La prednisona se usa en dosis de 80 mg diarios por 10 días que se disminuyen de manera gradual hasta una dosis de mantenimiento de 10 mg, que se suspende en dos a cuatro semanas si no mejora la audición. PADECIMIENTOS INFLAMATORIOS INFECCIOSOS DEL LABERINTO TIPOS DE LABERINTITIS Laberintitis serosa Consiste en una inflamación no purulenta o irritación del oído interno, que puede deberse al paso de toxinas a través de la ventana oval o redonda, o a la extensión de una afección meningoencefálica. Este tipo de laberintitis también puede ocurrir después de operación otológica en la que, en forma intencional o inadvertida, se abre el laberinto. La laberintitis serosa es transitoria y, por lo general, no deja daño permanente. Cuando una infección del oído medio se acompaña de vértigo, se debe al desa- ERRNVPHGLFRVRUJ Oído interno cas, entre éstas las secundarias a implantes cocleares y resección de tumores. La osteoneogénesis y el tejido fibrótico se encuentran con mayor frecuencia en la escala timpánica coclear. La infección del espacio perilinfático lleva a la formación de tejido fibrótico residual y hueso en el conducto perilinfático, aunque se sabe que aproximadamente un 20% de los pacientes con meningitis o laberintitis desarrolla esta secuela. Las fracturas del hueso temporal se relacionan con la formación de nuevo hueso en la escala coclear en 26 y 39%, después de la resección de tumores. Laberintitis supurativa Se caracteriza por destrucción permanente de las estructuras sensoriales del laberinto, fibrosis y osificación secundarias al proceso infeccioso. El oído interno puede infectarse a través de tres vías principales: a) Oído medio (timpanógena). b) Meninges (meningógena). c) Hematógena. En este tipo de laberintitis, el espacio perilinfático es el más afectado; pero, debido a los procesos cicatrizales posinfecciosos, el paciente suele terminar con sordera profunda o anacusia. El vértigo que acompaña al proceso es, al inicio, de tipo irritativo, con aparición posterior de nistagmo con componente rápido hacia el lado contralateral (tipo paralítico); su evolución natural tiende a la fase de compensación. Laberintitis circunscrita Es una inflamación limitada a una porción del laberinto óseo, que no suele afectar al laberinto membranoso. El cuadro clínico se caracteriza por ataques recurrentes de vértigo, en los que aparece nistagmo espontáneo hacia el lado del oído afectado. El signo de la fístula es positivo (desviación ocular hacia el lado opuesto al aplicar presión neumática sobre el conducto auditivo externo con el otoscopio neumático). En este estadio no se acompaña de hipoacusia neurosensorial, pero si se presenta debe instituirse tratamiento medicoquirúrgico temprano para evitar el desarrollo de una laberintitis purulenta. Las causas más frecuentes son: 1. Erosión del laberinto en el conducto semicircular lateral, por colesteatoma aural secundario con infección crónica. 2. Sífilis congénita. 3. Procesos tumorales, como carcinomas y tumores del glomus yugular. Laberintitis osificante Consiste en la osificación de la escala coclear posterior a inflamación del oído interno. La causa más común es viral o bacteriana. Otras causas son secuelas de otitis media, otosclerosis avanzada, enfermedad autoinmunitaria del oído interno, traumatismos y causas iatrogéni- PADECIMIENTOS DE ORIGEN VIRAL Hipoacusia súbita Bing (1860) fue el primero en señalar este trastorno secundario a parotiditis. La hipoacusia súbita se define como una pérdida auditiva neurosensorial de 30 dB o mayor, en tres o más diferentes frecuencias, desarrollada en un lapso menor de tres días. Por lo general, la hipoacusia es unilateral y en el 2 al 10% de los casos bilateral. Su incidencia es de 5 a 20 casos por 100 000 habitantes. Entre los virus que pueden producir hipoacusia súbita se encuentran los que causan parotiditis infecciosa, sarampión, rubeola, influenza, herpes simple, citomegalovirus, herpes zoster, mononucleosis infecciosa, adenovirus tipo 3, virus rábico atenuado y el agente Eaton (Mycoplasma pneumoniae). La enfermedad de Lyme es una zoonosis producida por una espiroqueta gramnegativa. Borrelia burgdorferi se ha relacionado con el desarrollo de hipoacusia súbita, a causa de afectación de la porción coclear del VIII para craneal. Sin embargo, debe tenerse presente que, además de las infecciosas, son comunes otras causas, como defectos en el riego del laberinto secundarios a trombos, émbolos o hemorragias; enfermedad de Buerger; macroglobulinemia; enfermedades neoplásicas, como el neurinoma del acústico; enfermedades metabólicas; diabetes mellitus; hiperlipoproteinemias; traumatismos acústicos, quirúrgicos, directos; barotrauma; embarazo; y fístulas perilinfáticas que afecten la ventana oval o redonda. También se puede presentar en pacientes con sífilis, sarcoidosis, esclerosis múltiple, colitis ulcerosa, poliarteritis nodosa, síndrome de inmunodeficiencia adquirida, leucemia, linfomatosis maligna intravascular, carcinomatosis meníngea, anemia de células falciformes, síndrome de Cogan, enfermedad autoinmunitaria del oído interno, posoperatorio de una intervención de corazón, sobre todo en casos de revascularización coronaria; y efecto de anestesia general y bloqueo espinal. Asimismo, se ha descrito como consecuencia de la inyección intravenosa de cocaína. Otros casos son idiopáticos. Entre las lesiones histopatológicas características se encuentran: atrofia del órgano de Corti, la estría vascular y la membrana tectorial. Algunos experimentos también han demostrado que la membrana de Reissner puede presentar roturas que sellan de manera espontánea. En general, se sabe que cuando la hipoacusia súbita no se acompaña de vértigo, el ERRNVPHGLFRVRUJ Capítulo 6 rrollo de una laberintitis de este tipo; en caso que persista el agente causal, puede presentarse una laberintitis purulenta. Si existe nistagmo, es de tipo irritativo con su fase rápida dirigida hacia el oído afectado. Las pruebas vestibulares pueden mostrar paresia vestibular. La audición es normal, o posiblemente hay hipoacusia de tipo sensorial, a menudo superficial. En apariencia, la inflamación afecta el espacio perilinfático y no el endolinfático, lo que explica la conservación de la función neuroepitelial. 117 117 118 Oído, nariz, garganta y cirugía de cabeza y cuello pronóstico para la recuperación es mejor. El tratamiento sugerido es el esquema de Meyerhoff y Paparella: Capítulo 6 1. Reposo en cama. 2. Administración subcutánea de heparina (5 000 U cada 12 h). 3. 40 U diarias de ACTH, IM. 4. 150 mg de papaverina por vía oral cada 12 h. 5. Venoclisis de 500 mL de dextrano al 10% en cuatro horas, dos veces al día. El esquema se aplica durante cinco días. Estos autores encontraron recuperación total en 46% de los casos, parcial en 27% y nula en otro 27%. Otros especialistas proponen no administrar medicamentos, o sólo corticoides, o heparina e inhalación de carbógeno. En 1987, Joachims fuel el primero en informar el uso de sales de magnesio en pacientes con pérdidas auditivas, por lo que su relación con esteroides ha demostrado ser de utilidad. También está indicado el empleo de cinc, Shambaugh describió en 1985 la deficiencia de cinc en algunos pacientes con hipoacusia sensorineural progresiva y Yang (2011) notificó una mejor recuperación auditiva en personas con hipoacusia súbita idiopática. La administración intratimpánica de dexametasona (2 a 4 mg) durante una semana por tres ocasiones constituye un tratamiento opcional útil en individuos con hipoacusia súbita intensa a profunda; la mejoría auditiva es evidente en más de 50% de los casos. Hipoacusia neurosensorial secundaria a mononucleosis infecciosa La frecuencia de complicaciones neurológicas posteriores a la mononucleosis infecciosa es de 0.7 a 4.9%. Pueden afectarse todos los pares craneales y causar anosmia, neuritis óptica, parálisis de los músculos oculares y facial, alteración de los pares craneales V, VIII y XII y congestión vascular meningoencefálica. En 1969, Taylor y Parsons señalaron un caso de sordera y parálisis facial en el estadio subagudo de esta infección. También se han observado hemólisis graves acompañadas de hipoacusia, casi siempre unilateral, aunque puede ser bilateral, y se manifiesta desde una caída en las frecuencias agudas hasta anacusia. Herpes zoster ótico Las manifestaciones más comunes del herpes zoster ótico son: otalgia, dolor mastoideo intenso, erupción vesicular, parálisis facial y síntomas auditivos o vestibulares. Se observa inflamación arterial intensa que puede provocar isquemia. Es más frecuente esta infección en pacientes inmunodeprimidos. El estudio post mortem de un sujeto que desarrolló parálisis vestibular aguda secundaria a este virus mostró estenosis del conducto semicircular lateral, fibrosis perilinfática y ausencia de la cúpula y las células de soporte y sensoriales de la cresta. Infección por parvovirus B19 La infección por parvovirus B19 se ha vinculado con varias neuropatías y vasculitis. Su presencia se ha confirmado serológicamente en casos de púrpura no trombocitopénica, incluidos la púrpura de Henoch–Schönlein, arteritis temporal, granulomatosis de Wegener, eritema infeccioso y exantema cutáneo de la infancia. La enfermedad autoinmunitaria del oído también se ha relacionado con su presencia, además del desarrollo de hipoacusia sensorial y neurosensorial, y síntomas vestibulares. Este virus es moderadamente contagioso. La viremia se desarrolla al séptimo u octavo días posteriores a la inoculación y persiste por cuatro días. Este virus no es detectable durante el desarrollo de los síntomas, por lo que se ha sugerido que éstos guardan relación con una reacción antígeno–anticuerpo u otros mecanismos posinfecciosos. Su tratamiento se basa en metilprednisolona; en casos con escasa respuesta se agrega ciclofosfamida y metotrexato. PADECIMIENTOS DE ORIGEN BACTERIANO Meningitis y lesiones laberínticas Un 10% de los niños que sufre meningitis purulenta desarrolla algún grado de sordera. En 5 a 35% de los casos, la pérdida auditiva es de tipo neurosensorial y permanente. Los mecanismos de afectación otológica son de tres tipos diferentes: 1. Laberintitis purulenta. 2. Perineuritis del VIII par craneal. 3. Lesiones directas de los núcleos auditivos del tallo cerebral. La hipoacusia de tipo neurosensorial permanente se relaciona más con laberintitis purulentas. Las de tipo seroso tienen mayor relación con hipoacusias parciales y reversibles. La frecuencia de lesiones bilaterales y unilaterales es similar. Al parecer, las meningitis por Haemophilus influenzae se acompañan más de pérdidas auditivas que las causadas por agentes bacterianos. En la era preantibiótica era frecuente observar lesiones cocleares graves por meningococo. Por otro lado, la mayor parte de las hipoacusias secundarias a meningitis bacterianas presentan cierto grado de reversibilidad. Criptococcus neoformans tiene predilección por el sistema nervioso central. Se localiza primero en pulmón antes de su diseminación a meninges y cerebro; es más frecuente en individuos inmunodeprimidos. Harada (1979) publicó las siguientes alteraciones histopatológicas por este agente: pérdida de células del ganglio espiral y de las fibras del nervio coclear en el conducto de Rosenthal, pérdida de fibras del nervio coclear en el conducto auditivo interno y atrofia del órgano de Corti. Lewis y Rabinovich (1972) encontraron 27% de afecciones auditivas en personas con criptococo que afectaban al sistema nervioso central. ERRNVPHGLFRVRUJ Oído interno Fiebre tifoidea y lesiones cocleovestibulares Brucelosis e hipoacusia Cualquiera de las especies de Brucella puede causar hipoacusia, producida por una otitis media simple o supurativa, o por afectación directa del oído interno. Es frecuente identificar hipoacusias mixtas, no relacionadas con el cuadro febril y sintomático en general. La sordera tiende a ser insidiosa, paulatina y con recesos, y el enfermo no puede precisar su inicio. PÉRDIDA AUDITIVA NEUROSENSORIAL AUTOINMUNITARIA Estudios en animales de experimentación han mostrado que el oído interno tiene un sistema inmunitario independiente del que funciona en el líquido cefalorraquídeo. Asimismo, hay evidencia de la presencia de inmunoglobulinas en la perilinfa. Las enfermedades autoinmunitarias se caracterizan por vasculitis y depósitos de inmunoglobulinas y complemento en las paredes vasculares. Con respecto al oído, la cóclea es tal vez el órgano blanco de esta entidad. Se presenta más en pacientes entre el tercer y quinto decenios de la vida. Lo característico es el desarrollo de hipoacusia neurosensorial bilateral que progresa por semanas o meses. La función vestibular también puede afectarse en forma simétrica, por lo que rara vez aparece el vértigo; las pruebas térmicas revelan paresia bilateral. En algunos casos hay inestabilidad y ataxia en el cuarto oscuro. Muchas veces, los pacientes refieren síntomas como zumbido y presión en los oídos. Algunas pruebas diagnósticas son las siguientes: 1. Prueba de transformación de linfocitos; tiene una sensibilidad de 96% y especificidad de 93%. 2. Prueba de inhibición de la migración de linfocitos, en la que se utiliza como antígeno tejido del oído interno humano. McCabe introdujo esta prueba en 1979 y tiene baja especificidad. 3. Los pacientes presentan títulos altos de IgM. En 25% de los casos se presentan manifestaciones sistémicas de enfermedad autoinmunitaria. Debe determinarse el diagnóstico diferencial con: a) Hipoacusia súbita. b) Enfermedad de Ménière coclear. c) Otosclerosis coclear. d) Sordera progresiva crónica del adolescente. e) Presbiacusia presenil. f) Traumatismo acústico. g) Sordera hereditaria recesiva. h) Laberintitis luética. Tratamiento 1. Corticoides (dexametasona, 16 mg diarios en dosis divididas por dos meses, seguidos de un esquema de reducción y dosis de mantenimiento de 2 a 4 mg/día, durante dos meses). Algunos autores recomiendan prednisona, 80 mg/día, cinco días, seguidos de 60 mg por una semana y luego un esquema de reducción. 2. Ciclofosfamida, 5 mg/kg/día por dos semanas, descanso dos semanas y nuevo esquema por otro periodo similar. 3. Metotrexato, con dosis iniciales de 7.5 mg por semana, la cual se puede aumentar hasta 15 o 20 mg por semana por un periodo de cuatro a ocho semanas. Durante su administración hay que solicitar biometría hemática y pruebas de función hepática, aunque por lo general es bien tolerado por los pacientes, ya que las dosis de función son bajas. Enfermedades otológicas de causa o participación autoinmunitarias Existen diferentes pruebas para detectar trastornos inmunológicos: 1. Radioinmunoensayo. 2. Radioinmunoabsorbencia. 3. Antígenos de supresión inmunitaria ligados a enzimas (ELISA). 4. Factor de inhibición del linfocito. 5. Transformación del linfocito. Las enfermedades del oído con rasgos de participación inmunitaria son: a) b) c) d) e) f) g) h) i) j) k) l) m) Condritis auricular. Policondritis recidivante. Timpanosclerosis. Salpingitis autoinmunológica. Otitis media secretoria. Otitis media necrosante. Colesteatoma. Hipoacusia neurosensorial autoinmunitaria. Enfermedad de Ménière. Otosclerosis. Vasculitis coclear. Hipoacusia súbita relacionada con virus. Enfermedades autoinmunitarias del sistema nervioso central. Se cree que algunos casos de hipoacusia neurosensorial contralateral posterior a operación otológica pueden de- ERRNVPHGLFRVRUJ Capítulo 6 El bacilo tifoideo es capaz de producir lesiones cocleares. En un estudio de Escajadillo (1982) se encontró que prevalecen las lesiones vestibulares sobre las cocleares y que el riesgo de éstas se incrementa con cifras leucocitarias inferiores a 5 000. Al parecer, la isquemia desempeña una función importante en la etiopatogenia. La mayor parte de las lesiones otológicas se desarrolla durante la segunda y tercera semanas de la enfermedad. 119 119 120 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 6 berse a pequeñas porciones de tejido del oído interno, que se destruyen durante el curso de la enfermedad o la intervención y que funcionan como antígenos circulantes en el oído no afectado. Enfermedades del colágeno como el lupus eritematoso diseminado con el desarrollo de anticuerpos anticardiolipina pueden producir trombosis arteriales o venosas del sistema nervioso central, retina, corazón, pulmón, hígado, riñón, intestino y oído; en este último se ha observado hemorragia de la cóclea y el vestíbulo, y desarrollo de hipoacusia neurosensorial con participación autoinmunitaria. tiene relación con el desarrollo de lesiones otológicas, sobre todo cuando pasan de 60 procedimientos dialíticos. Se han encontrado depósitos intravasculares en la escala media, el ligamento espiral y la estría vascular. Otros estudios indican que el grado de anemia vinculado con la enfermedad renal se halla en relación directa con el trastorno de la función coclear y, en algunos sujetos, al elevarse las concentraciones de hemoglobina mejora también la función auditiva. AFECTACIÓN DEL OÍDO INTERNO EN LA ENFERMEDAD DE BEHÇET Síndrome de Cogan (1945) Se caracteriza por el desarrollo de queratitis intersticial no sifilítica y síntomas cocleovestibulares. Se inicia entre el segundo y quinto decenios de la vida. En el transcurso de esta enfermedad tienden a aparecer en forma temprana sordera, insuficiencia aórtica y vasculitis. La hipoacusia es de tipo neurosensorial, de aparición repentina y progresiva, unilateral o bilateral. Es común encontrar náusea, vómito, ataxia y nistagmo, que aparecen uno a seis meses después del inicio de los síntomas oftalmológicos. En pacientes no tratados, la sordera tiende a progresar hasta la anacusia. Se ha descrito la presencia de una reacción inmunitaria de tipo celular en contra de un antígeno corneal. La anemia, leucocitosis, trombocitosis y una sedimentación globular aumentada son hallazgos comunes, pero inespecíficos; los datos otohistopatológicos incluyen infiltración del ligamento espiral de la cóclea con linfocitos y células plasmáticas, disminución del número de núcleos celulares en el órgano de Corti, desmielinización y atrofia de la porción proximal del VIII par craneal y satelitosis de los ganglios vestibular y espiral. También se ha señalado la presencia de tejido de granulación en el nicho de la ventana redonda. El tratamiento consiste en corticosteroides (prednisona, 1 a 2 mg/ kg/ día); se debe valorar la respuesta en dos semanas. En caso de ser positiva, se continúa con dosis de mantenimiento previo esquema de reducción. Cuando la respuesta al tratamiento inicial es mínima, se prescriben citotóxicos inmunosupresores. TRASTORNOS DEL LABERINTO RELACIONADOS CON OTROS PADECIMIENTOS OÍDO Y ENFERMEDAD RENAL Hay hipoacusia neurosensorial hasta en 40% de los pacientes sometidos a hemodiálisis o trasplante renal. Se atribuye a la administración de ototóxicos, desequilibrio hidroelectrolítico y diálisis inadecuadas. Por otro lado, según Oda (1974), el número de hemodiálisis Afecta sobre todo a adultos jóvenes y se identifica por un proceso inflamatorio de causa desconocida. Los pacientes presentan úlceras bucales y genitales. Puede haber manifestaciones oculares, como iritis, y en 60% de los casos se encuentra compromiso del oído interno con hipoacusia neurosensorial progresiva, por lo general bilateral, que en ocasiones se acompaña de acúfeno y vértigo de origen vestibular. La lesión anatomopatológica típica es una vasculitis con infiltración perivascular por leucocitos mononucleares y que se caracteriza por ser multisistémica y afectar a un gran número de órganos. Su tratamiento se basa en metilprednisolona e inmunosupresores del tipo de la ciclosporina. AUDICIÓN Y ANEMIA DE CÉLULAS FALCIFORMES La anemia de células falciformes (drepanocitemia) es una hemoglobinopatía genética, en la cual la valina se sustituye por ácido glutámico en la sexta posición de la cadena β de la hemoglobina. Es común en el Mediterráneo, sur del Sahara y la India. En EUA, 8.5% de los individuos de raza negra tiene el genotipo heterocigoto (HbSA) y 0.3 a 1.3% el homocigoto (SS); estos últimos son los que desarrollan drepanocitemia. El inicio de la enfermedad se caracteriza por predisposición a infecciones y desarrollo de crisis vasooclusivas con dolor. La frecuencia de hipoacusia neurosensorial ha sido de 10 a 20%; predomina en las frecuencias agudas y se atribuye a hipoxemia y trombosis. Morgenstein (1969) describió los hallazgos histopatológicos en un niño de 10 años que padeció esta enfermedad y encontró disminución y anomalías de las células ciliadas internas y externas, edema y fijación de células falciformes en la estría vascular y el órgano de Corti con alteraciones isquémicas. SORDERA Y CRIOGLOBULINEMIA Los signos y síntomas característicos de la crioglobulinemia son: púrpura, artralgias y fenómeno de Raynaud en las extremidades inferiores, proteinuria, hematuria, ERRNVPHGLFRVRUJ Oído interno ALCOHOLISMO CRÓNICO Aunque el alcohol se ha considerado una droga ototóxica, a partir de informes clínicos de la presencia de hipoacusia, acúfenos y alucinaciones auditivas, no se ha comprobado de manera concluyente. Spitzer (1979) considera que la disfunción auditiva en el alcoholismo crónico puede relacionarse con un proceso degenerativo difuso de la corteza y el tallo cerebrales. ENFERMEDAD DE ALZHEIMER OÍDO Y SARCOIDOSIS La sarcoidosis es una enfermedad de tipo granulomatoso que afecta más a personas en el quinto decenio de la vida. El 20% de los casos desarrolla síntomas respiratorios, el 35% adenopatía hiliar o enfermedad pulmonar, el 25% eritema nudoso y el 10% uveítis. Las determinaciones en suero de la enzima convertidora de angiotensina I favorecen el diagnóstico diferencial de esta entidad con otros padecimientos granulomatosos. La sarcoidosis con manifestaciones neurológicas se presenta en 5% de los casos y se caracteriza por neuropatías periféricas, que se presentan con más frecuencia en casos con fiebre uveoparotídea. El VII par craneal es el más afectado; los pacientes pueden presentar parálisis faciales de aparición repentina, en ocasiones de tipo bilateral, que desaparecen en forma espontánea sin dejar secuelas. La cuarta manifestación más frecuente de sarcoidosis neurológica es la afección del VIII par, por infiltración perivascular intraneural de linfocitos. La hipoacusia es de tipo neurosensorial y en el 50% fluctuante; a menudo se acompaña de trastornos vestibulares (vértigo). Esta entidad debe tenerse presente en el diagnóstico diferencial de toda hipoacusia fluctuante. HIPOTIROIDISMO Se dispone de pruebas clínicas respecto de la relación de hipoacusia con hipotiroidismo congénito o adquirido. Asimismo, en algunos casos, la terapéutica sustituida es capaz de revertir el daño auditivo. En general, la hipoacusia por hipotiroidismo es de tipo neurosensorial y limitada a frecuencias agudas. Estudios en animales de experimentación, en los que se ha inducido un estado hipotiroideo, han mostrado diversas lesiones del oído interno, como: 1. Edema de las células ciliadas externas. 2. Vacuolización de las células de soporte del órgano de Corti. 3. Atrofia de la estría vascular. 4. Desplazamiento de la membrana tectorial. 5. Engrosamiento de la membrana basilar. Esta enfermedad se caracteriza por una pérdida progresiva de la memoria y la capacidad cognoscitiva. La afectación neuropatológica se extiende también hacia los sistemas sensoriales y puede afectar la corteza cerebral parietal y la occipital, las células ganglionares de la retina, el nervio óptico, así como el neuroepitelio olfatorio, el núcleo olfatorio anterior, y vincularse con hipoacusias neurosensoriales y neurodegeneración de los núcleos auditivos centrales y de la cóclea, sobre todo en la vuelta basal. DIABETES MELLITUS La diabetes mellitus del adulto tipo 2 afecta a una de cada 100 personas. Su nexo con hipoacusia se ha investigado desde 1857, cuando la describió por vez primera Jordao. Estudios experimentales en ratas con diabetes han mostrado una pérdida significativa de células ciliadas externas de la cóclea, en particular en la primera vuelta. La angiopatía y neuropatía periférica son complicaciones bien reconocidas de los pacientes con diabetes y éstas son capaces de dañar también al oído interno. PERCEPCIÓN AUDITIVA POSTERIOR A LA COMISUROTOMÍA Las lesiones de cualquier hemisferio cerebral reducen el patrón de respuestas auditivas correctas. Musiek (1980) estudió a tres pacientes con audición preoperatoria normal sometidos a sección completa del cuerpo calloso por convulsiones rebeldes. En el posoperatorio, los individuos tuvieron dificultad para distinguir estímulos sonoros a determinadas frecuencias, sobre todo en el oído derecho (los tres sujetos eran diestros). Se sabe, por ejemplo, que la música y las melodías se reconocen en el hemisferio derecho y que el hemisferio izquierdo depende del primero para suministrar una secuencia correcta de respuestas. En la comisurotomía, el paciente no puede verbalizar lo que oye. FÍSTULAS PERILINFÁTICAS Goodhill (1981) clasifica las fístulas laberínticas como sigue: ERRNVPHGLFRVRUJ Capítulo 6 oliguria y edema que pueden aparecer en forma espontánea, así como insuficiencia renal aguda, posiblemente letal. Barr (1950) fue el primero en señalar la presencia de acúfenos e hipoacusia neurosensorial en esta enfermedad. Algunos hallazgos histopatológicos son: vasculitis sistémica; en oído puede faltar el órgano de Corti o ser atrófico y también la estría vascular; puede estar lesionado el epitelio sensorial del vestíbulo y los conductos semicirculares. Autores como Nomura (1982) han notificado su ausencia. La hipoacusia puede ser gradual o súbita. 121 121 122 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 6 a) Internas: ocurren en los componentes membranosos de la endolinfa y perilinfa del sistema laberíntico. b) Externas: se presentan entre los componentes membranosos del laberinto y el oído medio o la mastoides. Es frecuente que se presenten desgarros de las uniones ligamentosas entre la platina del estribo y el hueso de la ventana oval, o bien observarlas en la ventana redonda. Las fístulas perilinfáticas son de tipo externo y se presentan por diferentes causas: después de procedimientos otológicos (estapedectomías, operación de oído crónico infectado), traumatismos craneoencefálicos, barotraumas, anomalías congénitas, efecto de ejercicio físico o en forma espontánea (idiopática). Seltzer (1986), en un estudio de 132 fístulas perilinfáticas en 91 pacientes, encontró como factores predisponentes la intervención otológica en 26%, antecedentes de ejercicio físico intenso o moderado en 11%, malformación congénita del oído de tipo Mondini en 8%, e idiopática en 24%. Por otro lado, 1 a 2% de los pacientes con traumatismos craneales puede desarrollar síntomas agudos cocleovestibulares secundarios a una fístula perilinfática. Simmons (1986) señala que, en la mayor parte de los casos, la hipoacusia tiende a estabilizarse sin progresar. Por último, McCabe (1984) establece el siguiente topodiagnóstico de las fístulas laberínticas, con base en los movimientos oculares (nistagmo): Fístulas del conducto semicircular lateral Producen movimientos nistágmicos horizontales con componente rápido hacia el oído contralateral (normal). Fístulas preampulares del conducto semicircular lateral Provocan nistagmo horizontal con componente rápido hacia el oído enfermo. Fístulas del vestíbulo Causan nistagmo horizontal con componente rotatorio hacia el oído afectado. Fístulas del conducto semicircular superior Nistagmo rotatorio hacia el oído contralateral (normal). Fístulas del conducto semicircular posterior Cuadro clínico 1. Hipoacusia neurosensorial súbita, fluctuante o progresiva. 2. Signo de Hennebert positivo (o signo de la fístula) en 70%. 3. Acúfenos, hasta en 50% de los casos. 4. Vértigo, en episodios repentinos y relacionado con movimientos bruscos de la cabeza (nistagmo posicional); en ocasiones, el paciente puede referir inestabilidad constante 5. Fenómeno de Tullio (movimientos nistágmicos originados por el ruido). 6. Sensación de plenitud en el oído. Las fístulas perilinfáticas pueden acompañarse de hidropesía endolinfática o colapso sacular. Aun así, es difícil establecer el diagnóstico preoperatorio y, cuando existe sospecha clínica de esta entidad, el autor recomienda una timpanotomía exploradora; lo mismo se sugiere cuando persistan los síntomas cocleovestibulares en forma aguda por un periodo de 10 días, después de un traumatismo craneal. Durante la operación se recomienda sellar las ventanas oval y redonda con tejido subcutáneo o con grasa perilobular. En caso de fístula postraumática está indicado también una antrotomía exploradora para valorar el estado del conducto semicircular lateral, sobre todo si no se encontraron alteraciones en las ventanas. Después de la intervención mejora el vértigo en casi todos los casos; el acúfeno puede desaparecer en 50% y mejorar en el resto. La audición mejora en 50% de los pacientes, se estabiliza en 25% y empeora en el resto. Causan nistagmo de tipo vertical, con movimientos rotatorios concurrentes. LABERINTOPATÍAS VASCULARES TROMBOSIS DE LA ARTERIA AUDITIVA INTERNA La oclusión vascular de esta arteria puede producir hipoacusia súbita y pérdida de la función vestibular. Tiene tres ramas principales: a) Vestibular. b) Vestibulococlear. c) Coclear. La trombosis de la primera produce síntomas vestibulares por afectación de la mácula utricular y las crestas de los conductos semicirculares posterior y horizontal. La obstrucción de la rama cocleovestibular produce hipoacusia neurosensorial con umbral tonal descendente, por lesión de la vuelta basal de la cóclea. El compromiso de la mácula sacular y la cresta del conducto semicircular posterior causa un síndrome laberíntico caracterizado por vértigo y nistagmo. La afectación de la rama coclear, que riega las vueltas media y apical de la cóclea, provoca hipoacusia sensorial subtotal o parcial con caída notable ERRNVPHGLFRVRUJ Oído interno de las frecuencias medias y graves, y curva audiométrica plana. No se observan síntomas vestibulares. LABERINTOPATÍA VASCULAR DIFUSA 1. Hipertensión arterial; casi 18% de estos pacientes desarrolla síntomas vestibulares caracterizados por la presencia de vértigo, y puede relacionarse con vasoespasmos arteriales, arteriosclerosis o trombosis arterial. 2. Diabetes mellitus; el daño que ocasiona al oído interno se debe al engrosamiento de las paredes de los vasos pequeños y las arterias de mediano calibre; asimismo, guarda relación directa con el tiempo de evolución del padecimiento. Los pacientes desarrollan hipoacusia neurosensorial, con caída en agudos, y regresión fonémica en la logoaudiometría; también hay disminución de las respuestas nistágmicas en las pruebas térmicas, con pérdida de un 20% de la función laberíntica. LESIONES TRAUMÁTICAS DEL LABERINTO Es bien conocido que las lesiones traumáticas de la cabeza pueden afectar las estructuras auditivas centrales y periféricas. Debido a que las fracturas de la base del cráneo se acompañan de una morbilidad elevada, es difícil precisar la frecuencia real de lesiones otológicas secundarias a ellas (figura 6–1). Las fracturas del hueso temporal representan entre el 18 y 22 % de todas las fracturas del cráneo y se dividen, según sea el eje del peñasco, como sigue: a) Longitudinales; el punto de aplicación del golpe son las regiones parietal y parietotemporal. b) Transversales; el golpe se recibe en la región occipital; parten del agujero rasgado posterior. c) Oblicuas; el golpe tiene lugar en la región occipitomastoidea. Existe otra clasificación, la anatomoclínica, que se basa en la relación que tiene la línea de fractura con el laberinto y los conductos auditivos interno y externo; se divide en: 1. Laberínticas: a) Puras (si no se lesiona el oído medio equivale a la fractura transversal). b) Timpanolaberínticas (lesión del oído medio), parecidas a la fractura oblicua. 2. Extralaberínticas: pueden afectar o no al oído medio; si lo lesionan equivalen a la fractura longitudinal, que es de las más frecuentes. Las extralaberínticas que no lesionan el oído medio son fracturas aisladas de la punta del peñasco, la mastoides o la pared anterior del conducto (figura 6-2). Figura 6–1. Fotografía que muestra una fractura transversal que abarca toda la porción petrosa del temporal izquierdo, secundaria a un accidente de tránsito. ERRNVPHGLFRVRUJ Capítulo 6 Es efecto de todos los padecimientos vasculares que afectan la red periférica en forma generalizada. Entre ellos se incluyen los siguientes: 123 123 124 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 6 Figura 6–2. La radiografía muestra un proyectil de arma de fuego que produjo una fractura de la porción mastoidea del hueso temporal, con herniación parcial de la glándula parótida. FRACTURAS LONGITUDINALES Son las más comunes; según Schucknecht (1956), representan 70 a 80% de las fracturas; discurren a lo largo del techo del oído medio entre la cápsula laberíntica y la porción neumática adyacente del hueso petroso. Entre las manifestaciones clínicas figuran las siguientes: a) Otorragia, algunas veces con salida de líquido cefalorraquídeo. b) Perforación timpánica. c) Trazo de fractura sobre la pared posterosuperior del conducto auditivo externo. d) Hipoacusia de tipo conductivo. e) En 20% de los casos hay parálisis facial; el nervio facial se lesiona distal al genu (figura 6–3). d) En 40% de los casos hay parálisis facial, sobre todo por lesión de la porción proximal laberíntica de este nervio. Estas fracturas también pueden producir hidropesía endolinfática por obstrucción del acueducto vestibular. FRACTURAS OBLICUAS Son fracturas mixtas que tienen características clínicas de los dos tipos de fracturas previas y que, las más de las veces, se vinculan con síntomas cocleovestibulares y afectación del nervio facial (20 a 40% de los casos). CONTUSIÓN CRANEAL FRACTURAS TRANSVERSALES Se extienden a lo largo de la cápsula laberíntica del hueso temporal y, por lo general, afectan el vestíbulo. Manifestaciones clínicas: a) Hemotímpano. b) Sordera neurosensorial. c) Pérdida de la función vestibular ipsolateral. Casi 40% de los pacientes con contusión craneal presenta síntomas cocleovestibulares. Los golpes en la cabeza que no producen fractura son capaces de causar daño neurológico de consideración por contusión cerebral, que es un trastorno difuso del tejido encefálico caracterizado por edema y hemorragias capilares. En estas lesiones, el cerebro se daña debido a que la inercia de la masa encefálica lo desplaza en relación con la caja ósea. La aceleración por el impacto hace que el cerebro se retrase ERRNVPHGLFRVRUJ Oído interno 125 125 Capítulo 6 Figura 6–3. Radiografía simple de cráneo en la que se reconoce la presencia de una fractura longitudinal del hueso temporal y otra de tipo transversal que afectan la región parietoocipital. y golpee las estructuras óseas; los lugares de mayor daño son los polos cerebrales, tanto frontales como temporales y occipitales. El movimiento de los hemisferios cerebrales produce tracción y flexión del tallo cerebral, sobre todo en la tienda del cerebelo y el agujero occipital. Se cree que este trastorno constituye la base anatómica de la llamada contusión cerebral, en la que el paciente pierde el conocimiento unos cuantos segundos. CUADRO CLÍNICO NEUROOTOLÓGICO Síntomas cocleares En 30 a 50% de los pacientes hay hipoacusia, casi siempre neurosensorial, y con caída de las frecuencias agudas. Cuando se presentan sorderas de conducción por interrupción de la cadena osicular, se vincula con las primeras. Howe y Miller (1975) han encontrado sorderas de origen central, con lesiones bilaterales del lemnisco lateral y el núcleo colicular inferior. En traumatismos craneoencefálicos graves se recomienda, además de un estudio audiológico, recurrir a las respuestas auditivas del tallo cerebral; cuando son anormales, se relacionan con un pronóstico neurológico malo. En casi 40% de los pacientes también puede haber acúfeno por lesión neurosensorial. Síntomas vestibulares Las lesiones vestibulares son más frecuentes que las cocleares y pueden ser periféricas o centrales. El sujeto con traumatismo se queja de vértigo o inestabilidad. En lesiones de tipo periférico se considera un desprendimiento de la membrana de las otoconias. El paciente tiene episodios cortos de vértigo rotatorio acompañado de nistagmo espontáneo. En cambio, las lesiones de los núcleos y fibras centrales no suelen causar vértigo rotatorio episódico y el vértigo no es tan intenso como el de origen periférico. El nistagmo espontáneo se presenta en 10 a 15% de los casos; el de tipo periférico es horizontal, rotatorio y de corta duración; en cambio, el central es vertical u oblicuo y prolongado. Se considera que la causa más frecuente del nistagmo postular paroxístico benigno es un traumatismo craneoencefálico. Durante la electronistagmografía debe tenerse presente que una paresia vestibular en las pruebas térmicas señala lesión periférica, mientras que la preponderancia direccional se considera manifestación de lesión vestibular central. HIPEREXTENSIÓN CERVICAL Se presenta cuando el cuerpo experimenta aceleración repentina y la inercia hace que la cabeza se retrase, de tal modo que se flexiona el cuello en forma brusca y extrema. Es común en accidentes automovilísticos. Este síndrome se caracteriza por dolor en el cuello y a la palpación de los músculos cervicales, parestesias de las extremidades superiores, cefalea occipital, trastornos visuales, acúfeno, mareo, alteraciones del equilibrio, disfagia, disfonía y dificultades de la memoria, la concentración, el sueño y el control de las emociones. Los síntomas neurootológicos suelen ocurrir varios días o semanas después del accidente. Es posible el vértigo de tipo postural, que puede desaparecer en unas semanas, o persistir más de un año; se debe a alteraciones vasculares (daño a las arterias vertebrales) o una reacción inflamatoria de los tejidos cervicales que ocasiona trastornos simpáticos intracraneales. ERRNVPHGLFRVRUJ 126 Oído, nariz, garganta y cirugía de cabeza y cuello HIPOACUSIA SECUNDARIA A EXPLOSIONES Capítulo 6 En una explosión, el material explosivo cambia de una manera repentina de una forma sólida a una gaseosa, lo que precipita un aumento súbito del volumen y un cambio rápido de la presión. Dichos cambios se propagan en todas direcciones a través del aire y a una velocidad mayor que la del sonido. Las explosiones presentan dos fases: 1. Una presión positiva corta. 2. Una presión negativa larga. En consecuencia, la hipoacusia se presenta como resultado de una estimulación excesiva del oído interno y los audiogramas de estos pacientes muestran una caída en agudos en un 45 a 50% de los casos, caídas en frecuencias de 4 kHz con recuperación en 8 kHz en un 40% y curvas planas en un 10 a 15%. TRAUMATISMO ACÚSTICO Se considera como traumatismo acústico toda lesión en el oído interno por exposición a ruido intenso. Por lo general, se necesitan más de 80 dB para producir un traumatismo, ya que hasta estas intensidades el oído tiene suficientes mecanismos de protección. Por lo regular, el daño al sistema auditivo producido por el ruido se divide en dos grupos: 1. Traumatismo acústico (TA) por exposición única y de alta intensidad al ruido. 2. Hipoacusia por exposición crónica al ruido (HECR), que es el efecto de exposiciones repetidas de moderada intensidad. El tiempo de exposición y la intensidad del ruido tienen una función importante en el desarrollo del daño auditivo. Por ejemplo, estudios experimentales en chinchillas han demostrado que una exposición por 30 min a un ruido de 123 dB induce la misma hipoacusia que una exposición por 2 h a 117 dB. Otros estudios preliminares sugieren que la exposición a un ruido de 112 dB de intensidad durante 3 h y 40 min es capaz de ocasionar la pérdida de 10% de células ciliadas externas. En el TA se han señalado laceraciones en la membrana coclear con perforaciones de la lámina reticular, colapso de los vasos de la pared externa de la cóclea y degeneración capilar, edema de la estría vascular y mayor daño a las células ciliadas externas. En la HECR se produce una disminución de la luz vascular en la pared lateral coclear, acumulación de glóbulos rojos en los capilares de la estría vascular, con el subsecuente edema de esta estructura, engrosamiento de las paredes capilares, procesos degenerativos de las células ciliadas externas del órgano de Corti y las células de soporte. En lesiones más graves se puede identificar degeneración tanto de las células ciliadas internas como de las externas, y aplanamiento o pérdida completa del órgano de Corti. Por otro lado, frecuencias de alta intensidad lesionan las estructuras de las porciones basal y media de la cóclea, mientras que las de baja intensidad afectan los elementos de la porción apical. El área afectada con más facilidad por el ruido se localiza a unos 10 mm de la ventana oval, en el espectro de los 4 000 Hz. Los estudios audiométricos en estos pacientes muestran diferentes tipos de hipoacusia. Larsen los clasifica en tres grados (figura 6–4): Primer grado: al inicio no se observan trastornos auditivos y se oye bien la palabra hablada, pero el audiograma muestra un decremento de 20 a 30 dB en el tono de 4 000 Hz, que se recupera en el extremo tonal agudo. I II III Figura 6–4. Grados de traumatismo acústico (Larsen). ERRNVPHGLFRVRUJ Oído interno FÓRMULA PARA DETERMINAR EL PORCENTAJE DE AFECTACIÓN AUDITIVA Se suman los resultados obtenidos en las frecuencias de 500, 1 000 y 2 000 y se dividen entre tres (se puede agregar la frecuencia de 3 000 y dividir el resultado entre cuatro). Al resultado se le restan 25 dB y se multiplica por 1.5 para obtener el porcentaje de afectación auditiva monoaural. Para conocer el porcentaje de lesión auditiva biaural, se multiplica por cinco el porcentaje de afectación auditiva obtenido en el mejor oído y se suma al porcentaje del oído más dañado, tras dividir el resultado entre seis. Este resultado representa una valoración biaural de la alteración auditiva y puede emplearse en comisiones legislativas para compensaciones obrero–patronales, que son habituales en medicina del trabajo. TRATAMIENTO DEL TRAUMATISMO ACÚSTICO Y DE HIPOACUSIA POR EXPOSICIÓN CRÓNICA AL RUIDO Hasta el momento no existe fármaco que produzca más que un efecto placebo, por lo que la mejor opción es la protección contra ruidos. El médico debe recomendar al paciente evitar la exposición a ruidos, usar protectores auditivos o cambiar de trabajo. En hipoacusias moderadas a graves, son de utilidad los auxiliares auditivos eléctricos con amplificación selectiva para frecuencias altas. El uso de bloqueadores de los conductos de calcio, como el verapamilo, produce vasodilatación y reduce la permeabilidad inducida por ruido. En un estudio de ratas se demostró la administración de ebselén, una sustancia que contiene 2-fenil-1,2-benzisoselenazol-3 (2H), protege contra la peroxidación lipoídica y por tanto contra la pérdida auditiva inducida por ruido. Este compuesto también es efectivo en ensayos clínicos con pacientes que desarrollan episodios cerebrales isquémicos agudos. ACÚFENO (TINNITUS) Se define como una sensación acústica anormal percibida en el oído, que se produce en el organismo y tiene cierto grado de continuidad. CLASIFICACIÓN El acúfeno se divide en dos grupos según sea su origen: a) Central. b) Periférico, que a su vez es objetivo o subjetivo. El primero puede oírlo el examinador bajo determinadas condiciones y es raro encontrarlo. El segundo es el más frecuente; el paciente tiene la sensación subjetiva de un ruido proveniente de la cabeza, que varía de intensidad y, en ocasiones, lo incapacita en forma notoria. CAUSAS El acúfeno es un síntoma, no una enfermedad. Acompaña a las hipoacusias conductivas y neurosensoriales. El enfermo suele compararlo con ruidos conocidos, como chorros de vapor, motores eléctricos, grillos o campanas. Por lo general es más frecuente por la noche, cuando hay más silencio, y aumenta con el estrés, la fatiga y el alcohol. Harris (1967) ha sugerido que el acúfeno coclear se debe a un aumento del nivel del ruido producido por un desacoplamiento parcial de las células ciliadas sobre la membrana tectorial. Moller (1984) considera que se debe a un incremento de la frecuencia de estímulo espontáneo ERRNVPHGLFRVRUJ Capítulo 6 Segundo grado: el audiograma revela mayor descenso del umbral, la hipoacusia es manifiesta, y la pérdida es de unos 40 dB; aunque existe cierta recuperación en tonos más agudos, ésta siempre es menor respecto del primer grado. Tercer grado: la caída de la curva es acentuada, hay acúfeno y reclutamiento intenso, el umbral decrece hasta 60 dB o más y se abarca una gran extensión de la zona tonal. En lesiones auditivas que acompañan al traumatismo acústico se observa por lo regular reclutamiento y acúfeno. El primero puede relacionarse con un acortamiento central de los estereocilios de las células ciliadas y el segundo con una disminución de su rigidez, debido a que la actina (sustancia que causa su rigidez) vuelve a su estado paracristalino. Ello tiene como consecuencia un desacoplamiento de las células ciliadas afectadas sobre la membrana tectorial y la producción de acúfeno coclear. Por otro lado, existe una gran variabilidad personal al traumatismo acústico; al principio, la disminución de la audición en la HECR es temporal y desaparece después de minutos u horas de descanso; puede deberse a trastornos metabólicos en las células ciliadas, las alteraciones vasculares ya descritas y cambios electrolíticos en los líquidos del oído interno. Cuando la exposición al ruido es más prolongada o de mayor intensidad, se alcanza un estadio en que la audición no regresa a sus umbrales normales y provoca daño permanente en el oído interno. En la evaluación de pacientes con traumatismo acústico se deben tener presentes otros estados que pueden acompañarlo, como presbiacusia, trastornos endocrinos (p. ej., hipotiroidismo y diabetes mellitus), alteraciones metabólicas (como la hiperlipoproteinemia relacionada también con hipoacusia neurosensorial con caída de frecuencias agudas). Por otro lado, la hipertensión arterial y la dieta (rica en sal y grasas) influyen de forma sinérgica en la susceptibilidad a desarrollar traumatismo acústico por ruido. Las bolsas de aire de los automóviles, que protegen a los pasajeros en accidentes, pueden alcanzar niveles auditivos de 170 dB, por lo que son capaces de producir lesiones del oído interno por ruido, con caídas auditivas entre los 3 y 6 kHz (es mayor a nivel de 4 kHz). 127 127 128 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 6 de las fibras primarias del nervio auditivo, por hiperactividad de las células ciliadas en la cóclea; según otras teorías, se debe a la actividad de los núcleos cocleares y de toda la vía auditiva que, al perder su receptor periférico, no es modulada de forma adecuada para conformar sonidos con significado y, por lo tanto, se percibe como ruido de fondo. El acúfeno de tipo objetivo se vincula casi siempre con alteraciones o lesiones de tipo vascular y el paciente lo puede referir como tipo pulsátil. Entre las causas de acúfeno pulsátil se encuentran: comunicaciones o cortocircuitos arteriovenosos, como la comunicación entre la arteria occipital o la auricular posterior con el seno transverso, malformaciones de las arterias carótida interna, vertebrales, y meníngea media, y del seno petroso superior, aneurismas de la porción infratemporal de la arteria carótida interna, dehiscencia del conducto carotídeo, persistencia de la arteria estapedial, displasia fibromuscular de la arteria carótida, soplos cardiacos, insuficiencia valvular aórtica, golfo de la yugular elevado, insuficiencia cardiaca, congestión venosa cervical, hipertensión arterial, ateroesclerosis, y compresión acústico-facial por venas anómalas cerebelosas. Una causa no vascular frecuente es la hipertensión intracraneal benigna, vinculada con un síndrome de la silla vacía y con ventrículos pequeños. Otra causa rara la constituye el acúfeno producido por la contracción del músculo estapedial, que se puede presentar luego de la recuperación de una parálisis facial, o bien por el mioclono del oído medio relacionado con exposición a ruido intenso. Estos pacientes pueden referir disminución del acúfeno posterior a la oclusión digital de la vena yugular interna ipsolateral con incremento de la audición para tonos graves. Entre las malformaciones tumorales se encuentran el neurinoma del acústico, tumores del glomus, meningiomas intracraneales y hemangioblastomas. La causa más frecuente de acúfeno es la hipoacusia neurosensorial secundaria a cambios vasculares por presbiacusia, exposición al ruido intenso y consumo de fármacos ototóxicos. El acúfeno de origen central se localiza entre el núcleo coclear y el colicular inferior. Es de interés señalar que ciertas formas de acúfeno y ruido pueden manipularse mediante la estimulación del sistema somatosensorial y también que el dolor somático es capaz de agravar el acúfeno. TRATAMIENTO El tratamiento ideal se enfoca en la causa específica que produjo el acúfeno. Infortunadamente, no siempre es posible debido a la irreversibilidad de las lesiones o su origen oscuro. En algunas lesiones del oído medio, como la otosclerosis, después de una estapedectomía el acúfeno desaparece en 40% de los pacientes, disminuye en 34%, no cambia en 20% y empeora en 3%. El acúfeno secundario a dehiscencia de la vena yugular por falta de techo óseo en el hipotímpano puede tratarse con buenos resultados mediante injertos homólogos de cartílago. Lo mismo se aplica a las neoplasias (tumores del glomus yugular o timpánico, otros) o al acúfeno fluctuante debido a una contracción sincrónica del músculo estapedial con el parpadeo, que casi siempre es secundario a lesión traumática del nervio facial; en estos casos, basta con seccionar el tendón del músculo del estribo para abolir el acúfeno. Médico En 1935, Barany describió la mejoría del acúfeno en pacientes a los que inyectaba un anestésico local (procainamida) en los cornetes nasales. Gejrot (1963) y Engelsson (1976) señalaron una buena respuesta, aunque transitoria, posterior a la inyección intravenosa de lidocaína. Los anestésicos locales tienen una acción bloqueadora sináptica y su máximo efecto se presenta en sistemas multisinápticos de actividad lenta. Los anticonvulsivos también pueden suprimir o mejorar el acúfeno, al bloquear los conductos de sodio en la membrana de la célula nerviosa, estabilizar los potenciales de la membrana y disminuir la posibilidad de actividad reverberante. Por otro lado, los individuos con mala respuesta a la administración de lidocaína (1.5 mg/kg de lidocaína al 2%) tampoco responden a los anticonvulsivos orales (carbamacepina, primidona, difenilhidantoína). Otra sustancia que ha probado ser útil es el ácido aminooxiacérico (50 mg cada 6 h); se trata de un inhibidor del catabolismo del ácido γ–aminobutírico. La melatonina, que es una neurohormona secretada por la glándula pineal durante la noche, tiene un papel en la regulación del ciclo del sueño. Rosenberg (1998) ha encontrado que es útil en el tratamiento del acúfeno de tipo subjetivo. El alprazolam (Tafil®) se ha referido en la reducción de la intensidad del acúfeno, así como el misoprostol, que es un inhibidor de las prostaglandinas. Tambien se ha sugerido el empleo de receptores agonistas de dopamina como el pramipexol, que se utiliza en el tratamiento del parkinson; este fármaco es capaz de ofrecer mejoría en forma significativa en un 35% de pacientes con acúfeno relacionado con presbiacusia. La estimulación eléctrica del oído, aplicada en forma transcutánea, ha mostrado resultados favorables en cuanto a la supresión del acúfeno. Se ha señalado abolición o supresión del acúfeno durante la estimulación del promontorio en 69% de los sujetos estudiados, antes de la colocación de implantes cocleares. La utilización de auxiliares auditivos o ruido para superponerse al acúfeno alivia este síntoma en 40 a 80% de los casos. Los antiepilépticos, como el ácido γ-aminobutírico (gabapentina) reducen la intensidad del tinnitus; las dosis recomendadas son de 1.9 a 3.6 mg/ día. Quirúrgico La estimulación eléctrica de la cóclea también puede aplicarse directamente sobre la ventana redonda. Los resultados han sido alentadores, sobre todo en pacientes intratables que no han respondido al tratamiento médico conservador. ERRNVPHGLFRVRUJ Oído interno PRESBIACUSIA NEURAL Consiste en la pérdida de neuronas en la vía auditiva y la cóclea. Esta atrofia neuronal puede iniciarse desde la primera etapa del adulto y avanzar lentamente durante la vida del paciente. PRESBIACUSIA ESTRIAL Es efecto de la atrofia de la estría vascular, identificada en forma típica sobre las vueltas media y apical de la cóclea; la pérdida de las células estriales es parcial o completa. PRESBIACUSIA METABÓLICA Se debe a alteraciones en los procesos físicos y químicos de la producción de energía requerida por los órganos sensoriales auditivos. Existe atrofia de la estría vascular; los pacientes registran audiogramas planos. PRESBIACUSIA Es el envejecimiento del oído. Representa la causa más común de afección auditiva después del quinto decenio de la vida. El 80% de los pacientes mayores de 85 años la presenta. El cuadro clínico se reconoce por pérdida auditiva gradual de las frecuencias agudas, acompañada a menudo de acúfeno. En casos graves también se alteran las frecuencias medias. El proceso de envejecimiento en general se acompaña de lo siguiente: a) Disminución de la concentración de agua celular. b) Cambios iónicos. c) Menor elasticidad de las membranas celulares; en lo que respecta al oído, se encuentra lo siguiente: 1. Reducción del flujo y plasticidad vascular. 2. Aumento de la permeabilidad vascular. 3. Disminución del oxígeno, el aporte de nutrientes y la eliminación de desechos celulares. 4. Menor población neuronal coclear. 5. Atenuación de la actividad regulatoria de las T-caderinas, que son moléculas de adhesión transmembranal dependientes del calcio. d) La N-acetiltransferasa y polimorfismos de enzimas antioxidantes también participan en la etiopatogénesis de la presbiacusia. Dichos cambios contribuyen al desarrollo de presbiacusia. Schucknecht (1964, 1993) ha establecido diferentes variedades de presbiacusia. PRESBIACUSIA MECÁNICA Se cree que es consecuencia de una alteración de la mecánica del conducto coclear, pero que no produce cambios citológicos visibles. Puede estar afectada la elasticidad de la membrana basilar. El audiograma muestra una curva típica con caída de agudos. También se considera como un factor relacionado con una disminución de la efectividad del sistema transductor del oído medio, que se ha observado con el incremento de la edad. En algunos pacientes, la exposición al ruido puede tener un efecto sinérgico con el desarrollo de presbiacusia; es difícil distinguir en el plano audiológico hasta qué grado hubo daño por exposición al ruido o por factores constitucionales relacionados con el envejecimiento. PRESBIACUSIA MIXTA Consiste en la combinación de algunas de las anteriores y muestra efectos aditivos en el patrón audiométrico. PRESBIACUSIA INDETERMINADA Es la que se presenta sin cambios histopatológicos identificables. Representa cerca del 25% de los casos. La audiometría muestra curvas planas o caída abrupta en tonos agudos y se cree que existe una afectación no estructural en el funcionamiento de las células ciliadas. PRESBIACUSIA SENSORIAL Tratamiento Existe atrofia del órgano de Corti y el nervio auditivo en su base coclear. Se inicia en la etapa adulta media y avanza de manera gradual. Se valora la lesión auditiva y se adapta un auxiliar auditivo adecuado. Se recomienda practicar estudios audio- ERRNVPHGLFRVRUJ Capítulo 6 Desafortunadamente, la sección del nervio vestibular, como lo ha informado House (1981), mejora el acúfeno sólo en 20% de los casos, por lo que no se considera de gran utilidad. La sección del nervio coclear con destrucción del laberinto es una alternativa en el tratamiento de pacientes con sordera subtotal o anacúsicos, que presenten un acúfeno incapacitante y que no hayan respondido a los tratamientos anteriores. Los resultados de esta intervención no siempre son del todo satisfactorios. La descompresión microvascular del VIII par puede mejorar algunas formas de acúfeno, en particular las debidas a compresión vascular de este par craneal o las relacionadas con una hiperactividad de los núcleos auditivos después de una lesión del oído interno. En fecha reciente, la estimulación eléctrica mediante el implante de electrodos intracerebrales se vincula con una reducción notoria del tinnitus. Por otro lado, Shim (2011) ha sugerido la inyección intratimpánica de esteroides y el uso del alprazolam como un tratamiento útil del acúfeno ideopático subjetivo. 129 129 130 Oído, nariz, garganta y cirugía de cabeza y cuello lógicos una o dos veces al año para detectar en etapa temprana cambios en el patrón auditivo del paciente. MEDICAMENTOS OTOTÓXICOS Capítulo 6 La hipoacusia, el acúfeno y el vértigo son síntomas cardinales que pueden relacionarse con daño en el oído interno secundario a efectos indeseables de fármacos y agentes químicos. ANTIBIÓTICOS Aminoglucósidos Estos antibióticos son ototóxicos y el daño puede ocurrir: a) En forma repentina, después de aplicar pocas dosis. b) Continuar incluso al suprimir el fármaco. c) Desarrollarse la ototoxicidad algunos meses después de suspender el tratamiento. Se ha señalado que los aminoglucósidos pueden producir reacciones ototóxicas en 2 a 25% de los adultos. Asimismo, existe una predisposición genética al desarrollo de sordera inducida por aminoglucósidos y se debe a una mutación del genoma mitocondrial en la posición a 1555 G del RNA en la unidad ribosómica 12S y predomina en familias del este asiático y árabes. La somatostatina y el empleo de antioxidantes proveen un efecto protector a las células ciliadas expuestas a aminoglucosidos. En forma reciente, Kraft (2013) informó que la terapia con genes representa una alternativa promisoria para el tratamiento de estas lesiones, ya que en forma experimental la aplicación perilinfática de Atho 1 es capaz de promover la transdiferenciación de células de soporte y restituir así las células ciliadas. Esto ha ocurrido en animales de experimentación (ratones) en los que se ha documentado una recuperación de las células ciliadas en frecuencias graves. Estreptomicina: este antibiótico afecta más el sistema vestibular y la dehidroestreptomicina a la cóclea. En el sistema vestibular se afectan más las crestas de los conductos semicirculares que las máculas utriculosaculares; al parecer, la cresta ampular posterior es todavía más sensible a este fármaco que las crestas superiores. Con respecto a la cóclea, el órgano de Corti y las células ciliadas externas son más susceptibles de presentar daño que las células ciliadas internas. Con la estreptomicina, los pacientes refieren como síntoma más frecuente el vértigo, que en ocasiones puede relacionarse con los cambios de posición. El acúfeno es menos común y, cuando disminuye la agudeza auditiva, suele ser bilateral y de tipo neurosensorial. La electronistagmografía puede revelar: 1. Nistagmo espontáneo al inicio del padecimiento. 2. Paresia vestibular bilateral. Gentamicina: estudios experimentales y clínicos han mostrado que la gentamicina afecta tanto al neuroepitelio coclear como al vestibular, aunque se cree que el daño vestibular es más grave y ocurre con mayor frecuencia. Datos otohistopatológicos: 1. Pérdida total de las células ciliadas en la porción inferior de la vuelta basal de la cóclea, y daño a las células ciliadas externas en su porción superior. 2. Las células ciliadas de las crestas de todos los conductos semicirculares pueden mostrar vacuolización, más grave en las bases. 3. Las máculas utricular y sacular también pueden tener vacuolización de las células sensoriales. La lesión de las células ciliadas está directamente relacionada con la dosis y tiempo de administración del fármaco. La gentamicina es el antibiótico que lesiona con mayor frecuencia al oído interno. Cuadro clínico: por lo general, el paciente se queja poco de vértigo debido a que la lesión del laberinto posterior es bilateral, simétrica e intensa; es más común la ataxia y cuando se afecta la audición progresa con rapidez y puede llegar a la anacusia en pocos días. La gentamicina es ototóxica por las vías sistémica e intratecal. Kanamicina: el efecto tóxico de este fármaco aparece con menos frecuencia en comparación con otros aminoglucósidos, pero las lesiones son más graves. Afecta sobre todo a las células ciliadas externas del órgano de Corti, hasta provocar hipoacusia de tipo neurosensorial con caída de agudos; algunas veces puede desarrollarse anacusia súbita. Es común observar la potencialización de su efecto ototóxico con el uso de otros fármacos, como diuréticos. La kanamicina y el resto de los aminoglucósidos dañan al principio la porción supranuclear de las células ciliadas; hay edema de las mitocondrias y formación de cuerpos eosinofílicos denominados figuras de mielina. En daños intensos se destruyen tanto las células ciliadas externas como las internas, y el órgano de Corti se colapsa por degeneración de las estructuras de las células de sostén. También se ha observado atrofia del ganglio espiral. Se recomienda practicar estudios cocleovestibulares frecuentes en pacientes que se tratan con aminoglucósidos sistémicos por periodos prolongados, o que presenten insuficiencia renal. Neomicina: se han señalado casos aislados de sordera por el uso tópico de este antibiótico en heridas de quemados, después de su administración bucal durante el tratamiento del coma hepático y cuando se usa en gotas como coadyuvante en el tratamiento de otitis medias supurativas. Sin embargo, las lesiones que produce en la piel por sensibilidad son al parecer mucho más frecuentes que las otológicas. Otros antibióticos Vancomicina: los casos aislados de sordera relacionados con el uso de este fármaco se han presentado en pacientes con insuficiencia renal o septicemia. Concentraciones elevadas en sangre de este medicamento pueden dañar de manera selectiva a las células ciliadas. ERRNVPHGLFRVRUJ Oído interno DIURÉTICOS Tanto el ácido etacrínico como la furosemida pueden producir daño cocleovestibular. Estos fármacos inhiben de manera selectiva la actividad de transporte del trifosfato de adenosina (ATP) que actúa en la resorción activa de sodio en el asa de Henle y los túbulos contorneados distales. Estudios experimentales han sugerido que tienen una acción similar en la estría vascular del oído interno, de tal modo que inhiben el transporte electrolítico en la estría; pueden provocar cambios en la endolinfa. Se ha reconocido un aumento de la concentración de sodio en la endolinfa posterior a la administración de estos diuréticos. Por otro lado, Rybak (1985) ha señalado cómo actúa la furosemida al bloquear el transporte activo de potasio en la estría vascular. Estos diuréticos producen reducciones reversibles de los potenciales endococleares, así como la amplitud del potencial de acción del VIII par. También se ha señalado destrucción total con ausencia de las células ciliadas externas de la vuelta basal de la cóclea, con irregularidades en la membrana tectorial. El cuadro clínico se caracteriza por daño auditivo transitorio o permanente, de tipo neurosensorial bilateral con caída en tonos agudos. El daño auditivo guarda relación directa con la dosis, tiempo de administración y concentración en sangre del diurético. CITOTÓXICOS Cisplatino es un compuesto inorgánico (metal pesado) muy útil como quimioterápico en pacientes con estadios avanzados de cáncer de cabeza y cuello. Actúa en especial al unirse a receptores negativos de DNA. Se ha comprobado bien su ototoxicidad. Puede causar hipoacusia neurosensorial limitada a frecuencias agudas, permanente o reversible, y depende directamente de la dosis administrada. El daño en las frecuencias agudas puede iniciarse con dosis acumulativas de 200 mg; las frecuencias medias suelen afectarse cuando las dosis son mayores de 400 mg. Estudios de huesos temporales han mostrado lesiones extensas de las células ciliadas externas con pérdida ocasional de las internas. Estudios en animales de experimentación han mostrado que al administrar fosfomicina de manera simultánea con este agente disminuye la lesión de las células ciliadas, por lo que se sugiere su uso en clínica. También se han observado otalgia y acúfeno relacionados con la administración de este medicamento y síntomas vestibulares poco frecuentes (10 a 20% de las lesiones tóxicas) y, por lo general, relacionados con cambios degenerativos neurosensoriales. Misonidazol: es un nitroimidazol que sensibiliza las células tumorales hipóxicas a la acción de la radioterapia. Este fármaco tiene efectos tóxicos neurológicos, en particular parestesias, acúfeno e hipoacusia; esta última tiende a presentarse durante la tercera a octava dosis y es neurosensorial bilateral. Las lesiones pueden ser reversibles. FÁRMACOS DIVERSOS Salicilatos Los salicilatos entran a la mitocondria celular y suprimen la síntesis aeróbica de ATP; se cree que interfieren en el oído con funciones celulares que requieren energía en las células ciliadas. En los líquidos cocleares se necesitan casi siempre concentraciones críticas de salicilatos para producir efectos auditivos (acúfeno e hipoacusia), aunque en algunos pacientes dosis mínimas pueden causar los mismos efectos. La hipoacusia es neurosensorial, limitada a frecuencias agudas, y puede ser transitoria o permanente. La concentración de salicilatos en la perilinfa está controlada por un transporte sanguíneo directo, más que a través del líquido cefalorraquídeo. Quinina Al parecer, la lesión otológica producida por este fármaco se encuentra en el ganglio espiral y, en menor grado, en el epitelio neurosensorial. Su administración durante el primer trimestre del embarazo se ha acompañado de sordera congénita e hipoplasia de la cóclea. El cuadro clínico se caracteriza por acúfeno, que desaparece con la suspensión del medicamento y, en casos aislados, hipoacusia neurosensorial. La cloroquina, fármaco antipalúdico, también es capaz de producir daños auditivos permanentes. Agentes químicos Monóxido de carbono, benceno, tetracloruro de carbono, disulfuro de carbono y plomo pueden causar lesiones cocleovestibulares por daño neurológico central en la sustancia reticular del tallo cerebral. Se ha notificado que el sildenafilo (Viagra®), que es un inhibidor de la fosfodiesterasa 5, y que se emplea en la ERRNVPHGLFRVRUJ Capítulo 6 Eritromicina: hasta el momento se han publicado cerca de 35 casos de hipoacusia neurosensorial bilateral con caída en frecuencias agudas, secundarios al uso de dosis altas de eritromicina intravenosa u oral. Es más frecuente observarla en pacientes mayores de 60 años, con daño hepático o insuficiencia renal. Las lesiones auditivas tienden a ser reversibles. Rara vez se presentan acúfenos y vértigo; cuando así es, aparecen por lo general a las 48 h de iniciado el tratamiento. Cloranfenicol: informes aislados en las publicaciones médicas relacionan el uso de dosis altas de cloranfenicol con el desarrollo de hipoacusia neurosensorial bilateral. Sin embargo, no hay suficientes pruebas clínicas para catalogarlo como ototóxico. En administración local (gotas óticas) puede lesionar las células ciliadas, si llega a penetrar al oído interno, como lo han demostrado los estudios de Wersall (1969). 131 131 132 Oído, nariz, garganta y cirugía de cabeza y cuello disfunción eréctil, es capaz de producir pérdida auditiva sensorial. Altas dosis se relacionan también con una disminución de las respuestas auditivas de tallo cerebral. Capítulo 6 VÉRTIGO Y MAREO INTRODUCCIÓN El vértigo (del latín vertigo, movimiento circular) es un trastorno de equilibrio caracterizado por una sensación de movimiento rotatorio del cuerpo o los objetos que lo rodean. Cawthorne (1963) lo ha definido como alucinación de movimiento. El vértigo es un síntoma de afección del sistema vestibular que puede encontrarse en los órganos periféricos del oído interno (crestas de los conductos semicirculares y máculas vestibulares), en el VIII par craneal (nervio estatoacústico), en los núcleos vestibulares, o en las vías de asociación de éstos con cerebelo, núcleos oculomotores o sustancia reticular. El mareo (del latín mar, mar) es una sensación de malestar general con náusea y vértigo. Puede presentarse en ausencia de enfermedades vestibulares, cuando los órganos periféricos vestibulares se someten a ciertos estímulos, como ocurre en vehículos en movimiento, o ser consecuencia del vértigo, si su intensidad y duración llegan a un límite, con aparición de turbación, sudación fría y palidez. FISIOPATOGENIA DEL VÉRTIGO LABERÍNTICO El sistema vestibular forma parte del sistema general del equilibrio, que se integra sobre todo con la información sensorial proveniente del laberinto, los receptores propioceptivos musculotendinosos y la visión. La alucinación de movimiento se presenta cuando existe información errática entre uno o varios de estos sistemas. El vestibular representa el centro del sentido del equilibrio y está formado por componentes centrales y periféricos; entre estos últimos se encuentran los conductos semicirculares, el utrículo, el sáculo y la porción vestibular del VIII par craneal; los componentes de tipo central son los núcleos vestibulares del tallo cerebral, el flóculo cerebeloso y la corteza parietocerebral. Además, tiene conexiones con cerebelo, núcleos oculomotores y vía vestibuloespinal descendente. La corteza cerebral interpreta la información proveniente del laberinto como el movimiento de la cabeza en una dirección y a una velocidad específica. Los núcleos oculomotores mueven los ojos en sentido opuesto para compensar el movimiento y conservar el campo visual, y el sistema propioceptivo puede actuar para soportar el cuerpo en la nueva posición percibida. Cuando una persona se encuentra en reposo, los dos laberintos periféricos presentan un tono (descargas espontáneas) en equilibrio; cuando aumenta o disminuye de uno u otro lado, produce efectos en los movimientos oculares y sensaciones subjetivas de movimiento; de igual manera, una información anormal de los sistemas visual o propioceptivo altera el sentido del equilibrio, por ejemplo cuando un niño aprende a andar en bicicleta o un adulto utiliza lentes bifocales por primera vez. El sistema vestibular tiene la capacidad de reajustarse a diversas condiciones cambiantes o ambientales, como ocurre en bailarines que efectúan giros intensos al patinar sobre hielo, marineros que navegan en aguas turbulentas, o pacientes que, después de una laberintectomía unilateral y un periodo inicial de adaptación, pueden trabajar sin desequilibrio o vértigo. FISIOPATOGÉNESIS DEL MAREO En la génesis del mareo intervienen los órganos vestibulares y los sistemas ópticos propioceptivos y viscerales. Con respecto al sistema nervioso central, la zona vestibular del cerebelo, la zona quimiorreceptora localizada en la región superficial del bulbo y el centro del vómito que se encuentra en la región del fascículo solitario y la sustancia reticular vecina, son otras estructuras fundamentales en su etiología. Teoría neurohumoral del mareo Se cree que existen dos sistemas neuroquímicos competitivos que intervienen en el mareo: uno activado por la noradrenalina y el otro por la acetilcolina. Las neuronas que participan en las reacciones vestibulares tienen la mediación de la acetilcolina, por lo que los anticolinérgicos y los fármacos de acción atropínica (como los antihistamínicos) mejoran el mareo; lo mismo ocurre con algunos simpatomiméticos (amfetaminas, efedrina). El sistema noradrenalínico se encuentra adyacente al acetilcolínico en la sustancia reticular y las zonas contiguas a los núcleos vestibulares y los centros del vómito. Estos dos sistemas pueden reaccionar ante una estimulación vestibular intensa y la noradrenalina activar la red neural en un intento por suprimir los efectos que ocasiona sobre el centro del vómito la activación del sistema colinérgico a través de los neuromediadores acetilcolínicos. El fenómeno de habituación al movimiento puede deberse al aumento de la respuesta de los sistemas mediados por la noradrenalina. En consecuencia, el mareo aparece cuando la activación acetilcolínica excede la capacidad del sistema noradrenalínico para bloquearla; si ocurre lo contrario, puede prevenirse el mareo. DIAGNÓSTICO DEL VÉRTIGO La representación del sistema vestibular en la superficie de la corteza cerebral es relativamente pequeña. El lenguaje para describir los síntomas vestibulares es muy limitado, por lo que, en ocasiones, el médico tiene problemas en la obtención de una adecuada historia clínica. En el interrogatorio es importante preguntar al paciente si el vértigo se presenta en alguna hora del día en especial, se relaciona con cambios de posición, ac- ERRNVPHGLFRVRUJ Oído interno Exploración física Se debe efectuar una exploración física completa, con especial atención en el fondo del ojo, oídos, aspecto de las membranas timpánicas, capacidad auditiva; lesión de pares craneales, presencia de soplos en cuello, frecuencia y ritmo cardiacos, presión arterial en posición sedente y acostada. Se recomienda realizar pruebas para valorar la función cerebelosa y el equilibrio, como la de Romberg, en la que el paciente se mantiene erguido con ambos pies juntos, para reducir el elemento propioceptivo. En esta posición, se le pide que cierre los ojos para suprimir la información visual. La prueba se considera positiva cuando el sujeto mantiene el equilibrio con los ojos abiertos, pero lo pierde tan pronto los cierra, lo cual indica un padecimiento vestibular. Por otro lado, si el individuo es incapaz de guardar el equilibrio con los ojos abiertos o cerrados, la alteración se localiza en el cerebelo o los aferentes que discurren por los cordones posteriores de la médula. La prueba de Romberg puede reemplazarse por la de Mann, en la que el paciente coloca un pie frente al otro; el significado de la prueba es el mismo que el de la primera. También es aconsejable la prueba de la marcha de Babinski, que consiste en hacer caminar al paciente hacia atrás y adelante con los ojos cerrados. Debe dar tres o cuatro pasos hacia delante y, sin abrir los ojos, caminar el mismo trayecto hacia atrás. En condiciones normales, es posible efectuar esta prueba cuatro a cinco veces sin desviarse de la línea recta; cuando hay alteración vestibular, al caminar hacia adelante hay desviación ipsolateral hacia el lado de la lesión y, al marchar hacia atrás, hay desviación al lado contralateral. Tanto la prueba como la marcha de Babinski resultan negativas en lesiones vestibulares compensa- Figura 6–5. Radiografía que muestra la presencia de lipiodol (medio de contraste) en conductos auditivos internos, ventrículos laterales y cisterna pontocerebelosa. ERRNVPHGLFRVRUJ Capítulo 6 tividad que lo provoca, duración, frecuencia, relación o no con síntomas neurovegetativos, y si ha existido lesión de algún par craneal. Se pregunta de modo específico sobre cambios en la visión, afecciones auditivas, presencia de acúfeno, náusea, vómito, desvanecimientos, cefalea y afecciones del estado de la conciencia. Debido a que las enfermedades cardiovasculares se acompañan de vértigo, es preciso obtener información sobre hipertensión arterial, fármacos antihipertensivos, presencia de arritmias cardiacas, afecciones vasculares y síntomas de tipo ortostático. Algunas enfermedades sistémicas, como alergias (rinitis alérgica, alergia alimentaría, etc.), disfunción endocrina (diabetes mellitus, hipotiroidismo o hipertiroidismo), padecimientos del colágeno y otros de tipo autoinmunitario, neuropatías periféricas, epilepsia, sífilis, traumatismos craneoencefálicos, enfermedades infecciosas y renales, también pueden causar vértigo. La mayor parte de los fármacos nefrotóxicos también son ototóxicos (aminoglucósidos, cisplatino), por lo que debe investigarse qué tipo de medicamentos ingiere el paciente y si con anterioridad se le ha aplicado (seis meses previos) algún esquema terapéutico con ototóxicos. También debe interrogarse acerca de tabaquismo, alcoholismo, consumo de drogas e ingestión de café (figura 6- 5). 133 133 134 Oído, nariz, garganta y cirugía de cabeza y cuello das. Durante la exploración es importante observar la incapacidad del paciente por vértigo y la presencia o ausencia de nistagmo espontáneo postural (maniobra de Hallpike). Estudios de laboratorio y gabinete Capítulo 6 Se recomienda realizar de manera sistemática las siguientes pruebas: a) Biometría hemática completa. b) Velocidad de sedimentación globular. c) Química sanguínea (glucosa, urea, creatinina); ante la menor sospecha de diabetes latente o sintomática se solicita una curva de tolerancia a la glucosa. d) Determinación de colesterol y triglicéridos en sangre. e) Pruebas de función tiroidea (T3, T4, TSH). f) VDRL. Entre los estudios de gabinete se recomiendan los siguientes: a) Electrocardiograma en caso de hipertensión o afecciones cardiovasculares. b) Evaluación neurootológica, que consiste en: 1. Estudio audiológico completo. 2. Electronistagmografía. 3. Valoración radiográfica. Se puede empezar con radiografías simples de cráneo en posición de Stenvers, transorbitaria de Guillen y Towne. En caso de sospecha de lesiones retrococleares, se solicita una tomografía axial computarizada con inyección de aire en el espacio subaracnoideo. La resonancia magnética también es útil en la valoración de estructuras blandas, por lo que tiene una aplicación práctica en neurootología. El autor considera que esta última y la tomografía son estudios complementarios. ALGUNOS PADECIMIENTOS QUE SE ACOMPAÑAN DE VÉRTIGO Y MAREO Lesiones de los oídos externo y medio Las impactaciones graves de cerumen o cuerpos extraños en el conducto auditivo externo pueden causar sensación de inestabilidad y acúfeno, sobre todo si están en contacto con la membrana timpánica. En ocasiones, la presencia de secreción serosa o purulenta en oído medio causa desequilibrio o cuadros fugaces de vértigo, acompañados de hipoacusia y otalgia. Cuando el vértigo se torna más intenso, debe pensarse en la posibilidad de una extensión del proceso inflamatorio al laberinto, con el desarrollo de laberintitis serosa o purulenta. Si estos síntomas se presentan en pacientes con otitis media crónica, aumenta la posibilidad de que el vértigo se relacione con una erosión del conducto semicircular lateral, sobre todo si hay un colesteatoma. Las personas con perforaciones timpánicas son más sensibles a los cambios de temperatura, sobre todo al viento helado, ya que su presencia en la mucosa del oído medio es capaz de producir un estímulo calórico. Por último, los traumatismos del oído son causas bien definidas de lesiones laberínticas, luxaciones osiculares y rotura de la membrana de la ventana redonda. Lesiones del oído interno Neuronitis vestibular: Ruttin fue el primero en describir clínicamente en 1909 esta enfermedad, caracterizada por pérdida repentina de la función vestibular sin el desarrollo de síntomas auditivos en pacientes aparentemente sanos. De los 100 casos publicados por Dix y Hallpike en 1952, 47 presentaron paresia canalicular bilateral y 53 tenían lesiones unilaterales. Existe la forma crónica de esta enfermedad, que puede manifestarse incluso por periodos mayores de siete años; el grado de cronicidad depende en parte de la magnitud de la atrofia de las neuronas vestibulares. En la atrofia total no se presentan episodios repentinos de vértigo, pero si existe atrofia parcial del nervio, puede haber episodios de vértigo recurrente y diversos grados de recuperación de la depresión calórica presentada. El padecimiento se presenta a cualquier edad y predomina entre los 30 y 45 años (edad media). Afecta por igual a ambos sexos. Etiopatogenia: la aparición de esta enfermedad suele coincidir con una infección en otra parte del cuerpo, en especial de vías respiratorias superiores. Debido a que los cambios anatomopatológicos son similares a los que ocurren en la infección por herpes zoster, se ha sugerido un origen de tipo viral; tanto esta causa como la autoinmunitaria se consideran las más probables. Otros virus neurotrópicos son el herpes simple, los citomegalovirus, el virus del Epstein-Barr y el de la seudorrabia. Entre las lesiones otohistopatológicas se han encontrado: degeneración de la rama ampular de la división superior del nervio vestibular, atrofia de las crestas ampulares y fibrosis de espacios perilinfáticos, así como gliosis de los nervios vestibular y coclear. Cuadro clínico: aparición súbita de vértigo, continuo y de diversa intensidad, rotatorio, y acompañado de síntomas vegetativos notorios. Puede aumentar con cambios posturales y el paciente refiere un desequilibrio permanente. El periodo de recuperación es lento y pueden presentarse crisis de vértigo de pocos segundos de duración y también inestabilidad. El paciente no desarrolla síntomas de afección coclear (hipoacusia, acúfeno). Este periodo dura casi tres a cuatro semanas. En la electronistagmografía pueden encontrarse las siguientes alteraciones: 1. Nistagmo espontáneo en el lado contralateral a la lesión, sobre todo al inicio del padecimiento. 2. Depresión del nistagmo optocinético, cuando el estímulo es contrario a la dirección del nistagmo espontáneo. 3. En las pruebas calóricas: depresión unilateral o bilateral de la respuesta y, algunas veces, preponderancia direccional. ERRNVPHGLFRVRUJ Oído interno a) Efectos de traumatismos craneoencefálicos. b) Infecciones y operación del oído medio que produzcan laberintitis. c) Trombosis de la arteria vestibular anterior. d) Vejez. e) Alguna posible relación con otros trastornos del oído interno, como la enfermedad de Ménière y la neuronitis vestibular. f) Traumatismos cervicales. g) Espondilosis cervical. h) Compresión de la arteria vertebral por osteofitos e insuficiencia vertebrobasilar. i) Enfermedad cerebelosa. Cuadro clínico: la maniobra de Hallpike es positiva; cuando el oído afectado se encuentra hacia abajo aparece vértigo posicional acompañado de nistagmo hacia arriba y al lado del oído estudiado, que es de tipo dextrógiro cuando es del lado izquierdo y levógiro en el derecho. Tiene un periodo de latencia aproximado de 1 a 4 seg y duración de 20 a 30 seg. Es fatigable al repetir pruebas posicionales y reaparece en dirección inversa al regresar a la posición sedente, a diferencia del de origen central (vermis cerebeloso) en el que el nistagmo aparece después de una latencia mayor (más de 50 seg) con dirección hacia abajo y mayor duración (30 a 180 seg). No se acompaña de vértigo y cambia de dirección con las diferentes posiciones de la cabeza. Las formas de VPPB manifestadas de modo primordial por nistagmo con movimientos verticales u horizontales tal vez no representan, como lo señala Gacek (1982), el síndrome causado por anomalías de tipo periférico, hecho que debe tenerse en cuenta al ofrecer un esquema de tratamiento al paciente; asimismo, el nistagmo posicional que ocurre sólo con los ojos cerrados no siempre representa alteración laberíntica y es preciso descartar trastornos del sistema nervioso central. Tanto el estudio audiológico como las pruebas térmicas en la electronistagmografía no presentan anomalías. En casi todos los casos, el VPPB desaparece después de varios meses y rara vez persiste más de un año. Tratamiento: puede incluir lo siguiente: a) Médico. A base de sedantes laberínticos y derivados de la ergocriptina. En ocasiones se puede aplicar fisioterapia y consiste en precipitar las crisis de vértigo a través de maniobras repetitivas de Hallpike, tanto de un lado como de otro, hasta que el vértigo disminuya y, al cabo de varios días, desaparezca. Brandt (1980) ha obtenido así resultados satisfactorios en un alto porcentaje de sus casos, con control de los síntomas entre los tres y 14 días. Se recomienda suspender los ejercicios cuando los pacientes no presentan vértigo dos días consecutivos. Semont (1988), basado en la teoría de la cupulolitiasis, describe una maniobra que consiste en: 1. El paciente se encuentra sentado. 2. La cabeza se gira hacia el oído no afectado y hacia atrás, levantando la punta nasal. 3. El cuerpo se deja caer hacia el lado afectado. 4. En seguida se lleva la cabeza hacia abajo, bajando así la punta nasal. 5. Se levanta al paciente para dejarlo caer hacia el lado no afectado, manteniendo la misma rotación de la cabeza. 6. Se lleva a la posición sedente. Se debe dejar un tiempo de 2 a 3 min entre cada uno de los cambios de posición. Epley (1992), basado en la teoría de la canalitiasis, describe la siguiente maniobra: t Se inicia con la rotación de la cabeza 45° hacia el sitio afectado y se realiza la maniobra de Dix–Hallpike. t A continuación se gira la cabeza hacia el sitio opuesto antes de volverse a sentar. t Posición sedente. Se deja un periodo de 6 a 13 seg entre los cambios de posición. Se sugiere dar a los pacientes supresores vestibulares antes de iniciar la maniobra, utilizar vibradores de la mastoides y repetir el procedimiento hasta que no se observe nistagmo. Otros autores sugieren esperar un tiempo de 4 min antes de mover la cabeza hacia el sitio contralateral en la posición de Dix–Hallpike, y que el movimiento de ésta ten- ERRNVPHGLFRVRUJ Capítulo 6 En lesiones con compensación central, el oído dañado no responde al estímulo térmico. Pequeños infartos del tallo cerebral sobre todo en la porción dorsolateral del puente, y o en el cerebelo, pueden similar una neuronitis vestibular. Vértigo postural paroxístico benigno (VPPB): Barany lo describió por primera en 1921 y se ha señalado como la causa más común de nistagmo posicional en la práctica otorrinolaringológica. Los huesos temporales de los pacientes con este trastorno han mostrado degeneración de la mácula utricular y depósitos de material basófilo en la cúpula de la cresta del conducto semicircular posterior, de donde surgió la teoría de que los otolitos que han sufrido degeneración se desprenden sobre la mácula utricular, estimulando al caer por gravedad el conducto semicircular posterior; es por ello que se ha empleado el término de cupulolitiasis para describir la fisiopatología de este padecimiento. También se ha sugerido que la cresta del conducto semicircular superior, los núcleos vestibulares y la sustancia reticular desempeñan un papel importante en la producción de VPPB. Evidencia reciente sugiere que detritos de otoconias que han sufrido degeneración y flotan libremente en la endolinfa son los que estimulan a los conductos semicirculares (canalitiasis) y que el conducto semicircular posterior es el afectado con mayor frecuencia. Las otoconias humanas miden 3 a 30 μm de largo y están compuestas de carbonato de calcio, con pequeñas cantidades de sodio, magnesio, fósforo, azufre, cloro y potasio; con el incremento en la edad, la capa gelatinosa de la membrana otolítica disminuye, lo cual favorece un desprendimiento espontáneo de fragmentos otoconiales que provienen del utrículo o el sáculo. Existen diversas causas del VPPB, pero la de tipo idiopático es la más común. Otras causas son: 135 135 136 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 6 ga un tiempo de 1 min, llevando el cuerpo hacia la posición contraria por otros 4 min antes de volverse a sentar. Con estas maniobras se puede alcanzar un control del vértigo en el 80 al 90% de los casos. b) Quirúrgico. Existe un reducido número de pacientes a quienes el VPPB incapacita y dificulta el buen desempeño de sus labores domésticas y profesionales; en ellos, la sección selectiva del nervio ampular posterior a través del oído medio es una alternativa terapéutica con baja morbilidad. En un estudio anatomoquirúrgico del hueso temporal, el autor (1988) localiza este nervio sobre el margen posteroinferior de la membrana de la ventana redonda, por lo que el nervio es quirúrgicamente accesible al cirujano en casi 60% de los casos. También la oclusión selectiva del conducto semicircular posterior, por la vía transmastoidea, ha dado resultados alentadores. En el resto, la sección del nervio vestibular a través de la fosa media o retrolaberíntica elimina el vértigo (figura 6–6). Otra variante del vértigo postural paroxístico es la que se produce por el conducto semicircular horizontal; por lo general es inducida por movimientos de rotación de la cabeza en el plano de dicho conducto, con el paciente en posición supina. Con menos frecuencia se observan por movimientos de flexión y extensión de la cabeza o al cambiar de la posición supina a la de pie. En estos casos, el nistagmo que se origina es geotrópico bilateral, inducido por el material otoconial que se desprende de la mácula utricular hacia la porción posterior del con- Figura 6–6. Microfotografía que muestra la articulación incudoestapedial y la eminencia piramidal del lado izquierdo. En el centro se puede identificar el nicho de la ventana redonda, el cual se ha fresado hasta exponer al nervio singular o ampular posterior, que discurre por la región posteroinferior. Al fondo se encuentra la membrana de esta ventana. ducto semicircular horizontal; una presentación menos común de nistagmo es la bilateral apogeotrópica que revierte su dirección en forma espontánea o luego de maniobras de reposición. En estos pacientes, la maniobra de Barbecue es de utilidad y en ella se mueve la cabeza del sujeto en incrementos de 90°, se efectúa una rotación de 360°: cada 90° de rotación, la cabeza del individuo permanece en dicha posición durante un periodo de 30 a 60 seg; cuando el tratamiento médico no es satisfactorio, se puede efectuar una oclusión del conducto semicircular o una sección del nervio ampular. Cinetosis: la cinetosis o enfermedad del movimiento aparece en sujetos susceptibles sometidos a ciertos movimientos. El inicio del mareo se caracteriza por la aparición de palidez facial y sudación fría; posteriormente hay aumento de la salivación, náusea y vómito. La causa primordial es la acumulación de estimulaciones que producen respuestas compensatorias (desviación tónica y lenta de los ojos, que se conserva en dirección opuesta al movimiento), motoras reflejas del laberinto ante aceleraciones; por otro lado, las de tipo anticompensatorio están representadas por la fase rápida del nistagmo y no producen mareo. Los movimientos que facilitan la aparición del mareo son los que combinan aceleraciones verticales (cabeceo) con angulares (rodamiento). Sin embargo, cuando la cabeza permanece fija, el mareo disminuye de forma considerable. El centro del vómito, localizado en la región del fascículo solitario, la sustancia reticular contigua y la zona quimiorreceptora situada en la región superficial del bulbo son fundamentales en la génesis del vómito en la cinetosis, y al parecer éste se debe a la acción de la acetilcolina en esta última (teoría neurohumoral). Factores visuales: durante la fijación espacial, el sujeto mira puntos inmóviles respecto a sí mismo, como la carretera en un automóvil o el horizonte en un barco; debido a que en cada movimiento del cuerpo los ojos ejecutan un movimiento compensador que tiene por fin impedir que la imagen del punto de fijación se desplace fuera de la fóvea, las condiciones para que aparezca el mareo son poco propicias. Cuando no hay fijación, los movimientos oculares ocurren como respuesta exclusiva a estímulos vestibulares, cuya magnitud no equivale a la del movimiento del sujeto, por lo que sólo lo compensan de modo parcial. Esta circunstancia produce mareo, que es aún más intenso en casos de fijación ambiental, en los que el individuo descansa la vista en puntos que se mueven con él, como sucede en el aposento interior de un barco, en el cual no hay ventanas. En tal caso, los ojos no se mueven, ya que permanecen fijos en una imagen cuyo movimiento angular es idéntico al del sujeto. Tratamiento: los anticolinérgicos pueden prevenir la cinetosis. También es pertinente aconsejar a los pacientes evitar, durante viajes en automóvil, barco u otro medio de transporte, la fijación ambiental y tratar de mantener fija la cabeza. Enfermedad de Ménière Introducción: el 8 de enero de 1861, Prosper Ménière presentó ante la Academia de Medicina de París una ERRNVPHGLFRVRUJ Oído interno a) Porción rugosa o intraósea. b) Porción lisa; Sjoback (1986) ha identificado cinco tipos morfológicos de células epiteliales en SE: t 5JQP*se encuentra en la porción intraósea y es de forma cilíndrica plana. t 5JQP ** es intraóseo y extraóseo, de forma cilíndrica. t 5JQP *** células cilíndricas de la porción intraósea que se tiñen de color oscuro. t 5JQP*7es extraóseo y de forma escamosa o cuboidal. t 5JQP7 extraóseo de forma cilíndrica plana. Se considera que los tipos I y II son células similares pero en diferente estadio de actividad metabólica. Arnold (1984) ha demostrado la presencia de inmunoglobulinas en SE, de manera específica IgG, IgM, IgA e IgA secretoria. Tanto IgA como IgG se han detectado en las mucoproteínas de la luz de SE, hecho que sugiere su producción local. Además, la porción intraósea del saco es más vascularizada que la extraósea. El conducto endolinfático se inicia en la confluencia de los conductos utricular y sacular y termina en el saco endolinfático. Está formado por una porción horizontal, que corresponde a la vestibular o sinusal de Zechner y Altmann (1969), y una vertical, que equivale a la región ístmica del conducto. En resumen, el sistema endolinfático del oído está formado por: a) El conducto. b) La porción rugosa del saco. c) La porción distal del saco endolinfático. Fisiopatogenia: se cree que los productos de desecho metabólico del órgano de Corti que circulan en la endolinfa se resorben en el saco endolinfático. La fibrosis perivascular de esta estructura que se encuentra hasta en 60% de pacientes con enfermedad de Ménière puede alterar esta función y favorecer así el desarrollo de la hidropesía endolinfática. Estudios experimentales confirman la presencia de un flujo longitudinal de endolinfa de la cóclea a SE y se presupone que cualquier interrupción de esta vía lleva a la producción de hidropesía en diversos segmentos del sistema endolinfático, con colapso de las paredes saculares en presencia de una estría vascular funcional. El análisis histopatológico de los huesos temporales en pacientes con enfermedad de Ménière ha mostrado las siguientes características: 1. La presencia de acueductos vestibulares pequeños se acompaña más del desarrollo de hidropesía endolinfática. 2. La mitad anterior del saco endolinfático parece desempeñar la función más importante en la fisiología del SE. 3. Existe una cantidad significativamente menor de vasos sanguíneos en SE de huesos con enfermedad de Ménière, tanto en su porción proximal como en el orificio craneal y en la porción rugosa. 4. El canalículo paravestibular sale de forma directa hacia la fosa craneal posterior, con mayor frecuencia en huesos temporales con hidropesía endolinfática que en testigos (67 y 41%). Sin embargo, este canalículo y su vena parecen no tener relevancia en la producción de hidropesía endolinfática. 5. La obliteración del ductus reuniens se relaciona más con una hidropesía limitada a la cóclea. 6. La degeneración del neuroepitelio sensorial es rara en pacientes con hidropesía endolinfática. 7. En la microscopia electrónica se han encontrado fibras del nervio vestibular con mielina hiperplásica y oclusión total del conducto axonal con dilatación del sistema reticuloendoplásmico, que formaba vesículas, por lo que se ha sugerido la presencia concomitante de una neuropatía primaria en la enfermedad de Ménière. Por otra parte, Brookes (1986) encontró hasta en 55% de los casos estudiados valores sanguíneos altos de complejos inmunitarios circulantes, sobre todo los factores C1q y C3c, y elevación de IgM (86%) e IgG (44%). Yoo (1982) demostró en cinco de 12 pacientes con esta enfermedad la presencia de anticuerpos anticolágeno tipo II; este colágeno se encuentra en el laberinto membranoso, la capa subepitelial del conducto endolinfático, el ligamento espiral y la cápsula ótica, por lo que puede haber en ciertos casos una participación autoinmunitaria en la fisiopatogenia de esta entidad. La presencia de autoanticuerpos en contra del saco endolinfático se ha detectado en el 10% de los casos y se ha sugerido una hipersensibilidad tipo III como uno de los mecanismos etiopatogénicos. En 65% de los casos, la enfermedad de Ménière se cataloga como idiopática. En 35% se identifican algunas entidades como causas: ERRNVPHGLFRVRUJ Capítulo 6 enfermedad caracterizada por acúfeno, hipoacusia y vértigo. En 1938, Hallpike y Cairns describen la histopatología de la enfermedad de Ménière consistente en hidropesía endolinfática. Afecta de manera primordial a la población adulta (30 a 60 años) y se puede clasificar en enfermedad de Ménière típica (85%) y atípica (15%). Esta última se subdivide en hidropesía coclear (12 a 13%) y vestibular (2 a 3%). Se inicia en forma unilateral, pero es bilateral en 25 a 30% de los pacientes después de dos a tres años de los síntomas iniciales. Se han descrito de una manera aislada informes de incidencia familiar de esta enfermedad, la cual se transmite de una forma autosómica dominante, sin diferir en su presentación de las formas espontáneas. Brown (1941, 1945) y Bernstein (1965) describieron a familias con enfermedad de Ménière y cefalea tipo migraña, un cuadro que se transmite también en forma autosómica dominante de expresividad variable y penetración incompleta. Alteraciones anatómicas: Cotugno describió en 1761 el saco endolinfático (SE) y por Boettcher lo redescubrió en 1869. La mayor parte se encuentra contenida en el conducto óseo del acueducto vestibular y otra parte es extraósea sobre la duramadre de la fosa craneal posterior. Bast y Anson (1949) introdujeron la división estructural del SE en: 137 137 138 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 6 a) Alergia. b) Sífilis. c) Insuficiencia suprarrenohipofisaria. d) Mixedema. e) Estenosis del conducto auditivo interno. f) Traumatismos craneoencefálicos o acústicos. g) Antecedentes de operación otológica. h) Relación con otosclerosis. i) Procesos infecciosos crónicos del oído con una mayor tendencia a producir hidropesía endolinfática limitada a la región del vértice. Arnold (1997) encontró anticuerpos en contra de herpes simple en la perilinfa, por lo que este virus puede desempeñar un papel en el desarrollo del trastorno. No se ha dilucidado la razón de la condición paroxística de la enfermedad de Ménière. El autor apoya la teoría de Lawrence y McCabe (1959) según la cual, durante el periodo agudo, la membrana endolinfática se rompe y la endolinfa, al mezclarse con la perilinfa, produce una súbita estimulación del epitelio sensorial del vestíbulo y al cicatrizar esta abertura todo vuelve a estabilizarse. Diagnóstico: la enfermedad de Ménière se caracteriza por: a) Presencia de vértigo grave acompañado de náusea y vómito, que puede durar minutos u horas, y desaparecer para reaparecer al cabo de un tiempo variable. La frecuencia de estos cuadros puede aumentar con el paso de los años para disminuir con lentitud a medida que el proceso va destruyendo al oído interno. Existe una gran variedad de episodios: algunos pacientes experimentan remisiones prolongadas, con o sin tratamiento, y en otros son más cortas y resistentes al tratamiento. La tensión y la ansiedad precipitan los síntomas. En 50 y 70% de los casos, las pruebas calóricas en la electronistagmografía muestran paresia vestibular; en 30 a 50% pueden ser normales y en un porcentaje bajo existe preponderancia direccional. Al parecer, la disminución de las respuestas laberínticas también se manifiesta en el nistagmo optocinético, ya que se ha reconocido una disminución de la velocidad promedio de éste en su fase pasiva, en comparación con la del nistagmo estudiado en personas normales. b) Acúfeno. Es de tipo subjetivo y no pulsátil, y puede constituir el primer síntoma de la enfermedad o aparecer por primera vez con la crisis vertiginosa. c) Hipoacusia. Es de tipo neurosensorial y fluctuante, sobre todo al inicio de la enfermedad, acompañada por intolerancia al ruido, menor discriminación al habla y variación en la magnitud de la regresión fonémica. Corvera (1978) señaló que las fluctuaciones son más evidentes en la logoaudiometría que en la audiometría tonal. Kumagani (1982) clasificó a los pacientes con hipoacusia secundaria a la enfermedad de Ménière en tres tipos: 1. Pacientes con hipoacusia superficial a moderada de tipo fluctuante, limitada a frecuencias graves y medias. La pérdida media aritmética es de 35 dB para frecuencias de 250 a 4 000 Hz. Al mejorar las condiciones del sujeto, el grado auditivo retorna a sus valores normales (restitutio at integrum). 2. Se caracteriza por audiogramas de tonos puros con curvas planas. La pérdida media aritmética es de 60 dB, en frecuencias de 250 a 4 000 Hz. La audición puede fluctuar, pero no regresa a sus cifras normales. 3. Curva audiométrica plana, con afectación auditiva moderada a profunda y mínima o nula fluctuación auditiva. Durante los estadios iniciales de la enfermedad es frecuente identificar audiogramas con caída de las frecuencias graves y alteración mínima de los tonos agudos; a medida que la enfermedad avanza, los audiogramas muestran curvas planas con una fluctuación mínima. Se sabe también que, a los 2 kHz, la afectación auditiva es menor. Asimismo, es común encontrar sensación de plenitud o presión en el oído, en particular antes o durante los episodios de vértigo. Prueba del glicerol: sirve para determinar si hay fluctuaciones en la audición; De Vicentiis en Italia y Klockhoff (1974) en Suecia la desarrollaron. En esencia, consiste en administrar 1.2 mL/k de glicerina por vía oral, mezclada con una cantidad similar de jugo natural; se efectúan audiogramas antes de la ingestión y una y tres horas después. Los criterios para considerar que esta prueba es positiva son los siguientes: 1. Mejoría de 15 dB en el umbral tonal en una o más frecuencias del audiograma (250 a 4 000 Hz). 2. Mejoría de 10 dB en el umbral tonal de dos o tres frecuencias (125 a 2 000 Hz). 3. Mejoría de un 12% en la discriminación al habla. Esta prueba ayuda a confirmar el diagnóstico clínico de enfermedad de Ménière. En un estudio de Snyder (1982) se encontró que en 157 de 265 oídos (60%) la prueba fue positiva. También se considera que tiene valor pronóstico, dado que se ha advertido que los individuos en quienes la audición fluctúa responden mejor al tratamiento médico quirúrgico. Debido a que la prueba del glicerol produce náusea y cefalea (efectos indeseables) en 30 a 40% de los casos, Juhn (1979) recomienda usar urea (2 g/kg), ya que se ha visto que también afecta el gradiente osmótico de la perilinfa, con resultados similares a los del glicerol, pero menos efectos indeseables. Potenciales de suma (electrococleografía): se considera que los potenciales de suma alargados representan una característica importante de la enfermedad de Ménière; se reconocen en 85% de los pacientes. Los potenciales de acción y los microgónicos cocleares también tienden a prolongarse, pero en grado menor. Radiología: en 1968, Clemis y Valvassori concluyeron que la falta de visualización radiográfica del acue- ERRNVPHGLFRVRUJ Oído interno a) Acueducto vestibular normal (forma tubular). b) Acueducto vestibular de tipo filiforme; es ligeramente más estrecho. c) Acueducto vestibular sin neumatización en derredor (más frecuente en la enfermedad de Ménière y otitis medias crónicas). d) Acueducto vestibular estrecho; tiene una abertura externa pequeña de casi 1 a 2 mm. e) Falta de visualización del acueducto. La tomografía axial computarizada de alta resolución facilita la valoración del acueducto. Tratamiento Médico: controla de manera satisfactoria 80 a 90% de los casos. Consiste básicamente en: 1. Dieta hiposódica. 2. Diuréticos sistémicos (hidroclorotiacida y triamtereno, inhibidores de la anhidrasa carbónica), complementados con aumento de la ingestión de potasio para contrarrestar algunos efectos indeseables. 3. Sedantes laberínticos (diacepam o glucopirrolatos). 4. Control de enfermedades sistémicas y posibles trastornos metabólicos relacionados. 5. Inyección intratimpánica de gentamicina, para lo cual se inyectan 0.75 mL (60 mg) de gentamicina a razón de 40 mg por mL, mediante una aguja No. 22, dejando al paciente en posición supina con el oído hacia arriba por espacio de 45 min y se indica tratar de deglutir lo menos posible. A esta solución también se le pueden agregar pequeños fragmentos de Gelfoam®. Otros autores aplican dosis de 26.7 mg/mL tres veces al día a través de un tubo de ventilación en T por cuatro días consecutivos, hasta alcanzar una dosis total de 208 mg. El tratamiento se suspende si se presenta nistagmo o disminución de la audición o mayor inestabilidad. La aplicación de gentamicina debe dirigirse hacia el nicho de la ventana redonda para facilitar su absorción y se busca destruir con ello las células oscuras del laberinto y producir una reducción de la producción de endolinfa. Se puede alcanzar un 80 a 85% de control en los episodios de vértigo. Sin embargo, es habitual observar una hipoacusia sensorial en las frecuencias de 6 y 8 kHz, con una pérdida promedio de 7.5 dB y una paresia vestibular en las pruebas calóricas en el 90% de los individuos. La aceptación de este procedimiento, ya que se puede realizar en el consultorio, aunado a su baja morbilidad, lo han convertido en el tratamiento de elección antes de recurrir a la operación. El autor ha obtenido resultados satisfactorios con la aplicación intratimpánica de amikacina mezclada con polvo de Gelfoam®, una vez por semana por dos a tres semanas. El tratamiento es bien tolerado y los resultados son similares a la aplicación de gentamicina. Las inyecciones intratimpánicas de esteroides, sobre todo de dexametasona, también han demostrado ser de utilidad en casos intratables de enfermedad de Ménière. Las crisis agudas de la enfermedad de Ménière pueden controlarse con: a) Anticolinérgicos (atropina, 0.8 mg subcutáneos). b) Vasodilatadores (histamina, 2.75 mg en 250 mL de glucosa al 5%, infundibles en una hora). c) Sedantes (del tipo del diacepam, 5 a 10 mg IV). Para el control posterior de estos pacientes también son útiles los fármacos con propiedades antihistamínicas y anticolinérgicas, y los vasodilatadores periféricos del tipo del ácido nicotínico. Quirúrgico: debe considerarse cuando ha fracasado el tratamiento médico (10 a 20%); se recomienda valoración por un mínimo de seis meses posteriores al inicio de la terapéutica. Existen dos tipos de tratamiento quirúrgico de esta enfermedad: 1. Procedimientos conservadores: para la valoración de los resultados se usa la siguiente clasificación (Comité Estadounidense de Audición y Equilibrio): Clase A: ausencia de vértigo y aumento de la audición. Clase B: ausencia de vértigo y audición sin cambios. Clase C: ausencia de vértigo y audición baja. Clase D: falla en el control del vértigo y empeoramiento auditivo. a) Operación del saco endolinfático: Portmann introdujo en 1927 la descompresión del saco endolinfático. Se recomienda en pacientes que se encuentran en los estadios tempranos de la enfermedad, que presentan fluctuaciones en la audición y que no tienen síntomas entre las crisis. También se utiliza en casos de afectación bilateral. Hay diferentes modificaciones a la técnica original, como las de House (1962), Graham (1984) y Arenberg (1977). Con todas ellas se controla el vértigo en 70 a 80% de los casos. El acúfeno mejora en 25 a 30%, lo mismo que la audición. Algunas causas frecuentes de fracaso son el desarrollo de fibrosis intrasacular o extrasacular y la proliferación de tejido glial (figura 6–7). Debido a lo anterior, el autor se inclina por los procedimientos de tipo descompresivo amplios, sin cortar o derivar el saco endolinfático. ERRNVPHGLFRVRUJ Capítulo 6 ducto vestibular se correlaciona en clínica con la presencia de enfermedades de Ménière. Hall (1983) identificó una falta de neumatización periacueductal en 74% de los oídos afectados por esta anomalía, contra 46% en un grupo control. El estrechamiento o la falta de visualización radiográfica del acueducto vestibular representan un signo radiográfico inespecífico. En términos radiográficos , el acueducto vestibular se subdivide en cinco tipos: 139 139 140 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 6 La técnica de descompresión del saco endolinfático consiste en: t Incisión retroauricular. t Corte del periostio alrededor del conducto auditivo externo. t Mastoidectomía simple. t Resección ósea con exposición de la duramadre de la fosa craneal posterior desde el ángulo senodural y el seno petroso superior hasta el bulbo de la yugular en forma inferior. El límite posterior es el seno sigmoideo y el anterior el conducto semicircular posterior. t Se remueve el sistema de celdillas retrofaciales y se expone todo lo posible la dura. t El saco endolinfático se encuentra enfrente del seno lateral y por detrás del conducto semicircular posterior. t El saco puede sólo exponerse o cortarse, aplicando tubos de silástico hacia la cavidad de la mastoides o el espacio subaracnoideo (figura 6–8). b) Cocleosaculotomía: Schucknecht (1982) modifica la técnica de derivación ótica–perótica de House y Pulec (1968) para pacientes con o sin fluctuación de la audición. El procedimiento se Figura 6–7. Presencia de fibrosis alrededor de la prótesis aplicada para descomprimir el saco endolinfático. Había, además, una gran fibrosis intrasacular. EH CSP SE SL Figura 6–8. Descompresión del saco endolinfático: se ha efectuado una mastoidectomía simple, con exposición del conducto semicircular posterior, así como del seno lateral. El fresado se realiza entre estas dos estructuras hasta descubrir la duramadre de la fosa posterior y, con ella, el saco endolinfático. EH, espina de Henle; CSP, conducto semicircular posterior; SE, saco endolinfático; SL, seno lateral. practica bajo anestesia local con sedación y se introduce un pico de ángulo derecho de 3 mm a través de la membrana de la ventana redonda y en dirección de la ventana oval. Se debe sentir una pequeña resistencia a medida que el pico atraviesa la lámina espiral ósea y perfora al sáculo dilatado en el vestíbulo. El orificio producido en la ventana redonda se cubre con pericondrio o tejido adiposo. Este procedimiento consiste en una minilaberintectomía. El vértigo se controla hasta en 70% de los casos. Se cuenta con otros procedimientos descompresivos locales, como la colocación de una tachuela en el centro de la platina, que produce una rotura del laberinto membranoso durante los periodos de máxima dilatación del saco; esta técnica se usa cada vez menos. 2. Procedimientos destructivos. a) Sección del nervio vestibular: se recomienda cuando ha fracasado la descompresión del saco endolinfático y la audición del paciente es útil (curva audiométrica con pérdida no mayor de 50 dB y 80% de discriminación al habla). La vía de acceso puede ser la fosa media, difundida por House (1962) o retrolaberíntica. Con este método mejora el vértigo en 96%. b) Laberintectomía: se recomienda cuando la hipoacusia es profunda y la enfermedad unilateral. Controla el vértigo en 90 a 95% de los casos. Se pueden utilizar diferentes vías de acceso, como la transmastoidea, con la que se obtiene una exposición por vía translaberíntica del VIII par, o la transmeatal, con exposición del nervio por vía transcoclear. El propósito primordial de ERRNVPHGLFRVRUJ Oído interno estas vías es extirpar el neuroepitelio del órgano vestibular terminal (conductos semicirculares, utrículo y sáculo). Laberintectomía por vía transmastoidea: b) Inferior, por la que avanzan el nervio coclear enfrente y la división inferior del nervio vestibular detrás. Con el objeto de exponer mejor los nervios vestibulares se recomienda fresado de la cresta falciforme. 10. La abertura del conducto auditivo interno da salida de líquido cefalorraquídeo a presión, el cual debe aspirarse de forma paciente para continuar con la intervención. 11. Es vital identificar las ramas superior e inferior del nervio vestibular para efectuar una neurectomía completa. 12. Se sella el conducto auditivo interno, aplicando músculo y fascia temporal (figura 6–9). Vértigo crónico subjetivo Se presenta en pacientes con síntomas inespecíficos y vagos que no corresponden a una enfermedad física activa. Los enfermos refieren presión en la cabeza, desequilibrio subjetivo, inestabilidad con hipersensibilidad a estímulos motores, sin vértigo rotatorio, desequilibrio objetivo o ataxia. Este síndrome es común y representa al menos el 10% de los sujetos con vértigo en la consulta neurootológica. Se lo conoce también como vértigo, vértigo fóbico postural o afección espaciomotora. Este trastorno puede desencadenarse por enfermedades neurootológicas transitorias o por alteraciones de origen psiquiátrico. En estos pacientes, los inhibidores selectivos de la recaptación de serotonina (p. ej., fluoxetina, sertralina, M Y M CAE NF Y CSL CSS SL CSP A SL B Figura 6–9. Laberintectomía por vía transmastoidea: A. Muestra el fresado sobre los conductos semicirculares, una vez que se ha efectuado la mastoidectomía con aticotomía. B. Con ayuda de una fresa de diamante se alcanza el conducto auditivo interno, cortando la duramadre, con el objeto de exponer el nervio vestibular con sus ramas superior e inferior. En el campo se reconoce la nervio facial, que se encuentra en la parte superior del conducto. El nervio coclear se localiza por detrás de estas estructuras nerviosas. CAE, conducto auditivo externo; M, martillo; Y, yunque; CSL, conducto semicircular lateral; CSP, conducto semicircular posterior; CSS, conducto semicircular superior; SL, seno lateral; NF, nervio facial; NVS, nervio vestibular (rama superior); NVI, nervio vestibular (rama inferior). ERRNVPHGLFRVRUJ Capítulo 6 1. Incisión retroauricular. 2. Incisión del periostio alrededor del conducto externo. 3. Mastoidectomía simple. 4. Aticotomía. 5. Esqueletización del laberinto vestibular (conductos semicirculares); durante esta maniobra puede el yunque. 6. Abertura de la luz de los conductos semicirculares, con exposición amplia del vestíbulo. 7. Resección del neuroepitelio sensorial, en las ámpulas de los conductos, así como las máculas utricular y sacular. 8. Con el mayor aumento del microscopio (16x) se inicia el fresado sobre el resto del laberinto hasta abordar la primera porción del nervio facial. Se recomienda realizar este paso con fresa de diamante y aspiración, y riego continuo. 9. En seguida se delinea el conducto auditivo interno de atrás hacia delante, identificando la cresta falciforme, que discurre en sentido horizontal, y dividiendo el conducto interno en dos porciones: a) Superior, por donde pasan el nervio facial y la división superior del nervio vestibular, que discurre en un plano más posterior e inferior. 141 141 142 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 6 paroxetina y citalopram) son eficaces para atenuar los síntomas de manera significativa, al afectar las vías vestibulares centrales y de la amígdala que tienen una función crucial en el procesamiento del estímulo motor. Regímenes terapéuticos a base de meclizina y benzodiacepinas resultan ineficaces. Vértigo sinugénico. Se presenta en relación con rinosinusitis. Watson y Williams lo describieron por primera vez en 1924 en un paciente de 45 años de edad con episodios de vértigo recurrente que se resolvieron después de operación sinusal por sinusitis. Al parecer se debe al sistema somatosensorial en el que los senos paranasales pueden desempeñar un papel en la fisiopatología del vértigo. El autor también lo relaciona con obstrucción del orificio tubario por el paso de secreciones que pueden ocasionar tubaritis y trastornos de la ventilación del oído medio, aunque la etiología hasta el momento actual es incierta. Dehiscencia del conducto semicircular superior Se caracteriza por la presencia de vértigo y oscilopsia debido a exposición a ruido o por estímulos que cambian la presión en el oído medio o intracraneal. Minor la describió en 1998. Se observa el fenómeno de Tullio (nistagmo inducido por el ruido) y el signo de Hennerbert (nistagmo causado por la oclusión o presión del conducto auditivo externo). En algunos pacientes, la maniobra de Valsalva también puede producir síntomas vestibulares. Se caracteriza por hipersensibilidad al sonido conducido por la vía ósea con autofonía y hay hipoacusia para frecuencias graves con un intervalo entre las vías aérea y ósea, acúfeno pulsátil y desequilibrio crónico. El umbral de la conducción ósea puede ser supranormal (mejor que cero), lo cual se conoce como hiperacusia conductiva. El diagnóstico se establece con la tomografía axial computarizada de alta resolución y el empleo de potenciales vestibulares miogénicos evocados. El diagnóstico diferencial se establece con otosclerosis, disfunción tubaria y fístula perilinfática. El tratamiento es quirúrgico a través de la fosa media o transmastoideo y consiste en la oclusión del conducto semicircular superior con cera de hueso a través de la fosa media, o bien con el empleo de fascia y polvo de hueso autólogos y sello con fibrinógeno. Luego del procedimiento, el desequilibrio mejora o desaparece durante las primeras seis semanas. Hipotensión intracraneal espontánea Es una rara entidad que Scheltenbrand describió por vez primera en 1938; se caracteriza por una cefalea ortostativa profunda inducida por el cambio de posición, al pararse o sentarse, y mejora al recostarse en posición supina; entre los síntomas comunes figuran tinnitus postural, vértigo, náusea y rigidez moderada del cuello. La resonancia magnética muestra colecciones difusas bilaterales en T2 y reforzamiento meníngeo en T1 al aplicar gadolinio. Se ha informado también la presencia de parálisis de VI par. Presiones de líquido cefalorraquídeo menores de 60 mm en ausencia de punción dural u operación pueden producir depresión perilinfática con expansión compensatoria del espacio endolinfático. Tumores intralaberínticos Schwannomas primarios intralaberínticos: Mayer (1917) fue el primero en señalar estos tumores en el laberinto. Son tumores raros que tienden a localizarse más en las porciones basales de la cóclea. Debe sospecharse su presencia en el diagnóstico diferencial de una enfermedad de Ménière atípica. Muchas veces, el diagnóstico se determina durante laberintectomías destructivas. El cuadro clínico se caracteriza por hipoacusia neurosensorial (100% de los casos), episodios de vértigo paroxístico (80%), acúfeno (67%) e inestabilidad (67%). La hipoacusia es de tipo no fluctuante, de lenta progresión y, sobre todo, en frecuencias agudas. Está disminuida la discriminación al hablar y en 25% de los casos existe reclutamiento por probable degeneración del órgano de Corti por oclusión vascular. La electronistagmografía muestra paresia vestibular durante las pruebas calóricas. A menudo, los estudios radiográficos (politomografía y TAC) no distinguen este tipo de tumoraciones debido a su tamaño tan pequeño. Neoplasias papilares (tumores de Heffner) del saco endolinfático. Son malformaciones poco frecuentes que se originan en la porción rugosa del saco endolinfático. Predominan en el sexo femenino. Aparecen entre el segundo y quinto decenios de la vida. Su cuadro clínico consiste en hipoacusia neurosensorial, vértigo, acúfeno y sensación de presión en el oído. Cuando el tumor crece, se puede acompañar de paresia o parálisis facial y aparecer una masa vascular en el oído medio. Los pacientes con la enfermedad de von Hippel–Lindau tienen mayor predisposición para el desarrollo de tumores papilares del hueso temporal. Éstos inician de manera asintomática en el saco endolinfático y crecen hacia la duramadre de la fosa posterior y el conducto endolinfático. Ganan acceso al vestíbulo, erosionan los conductos semicirculares y se expanden hacia la mastoides por debajo del conducto semicircular posterior y a lo largo de las celdillas retrofaciales, por donde afectan al nervio facial. Su continuo crecimiento puede destruir la cápsula ótica e invadir el oído medio, así como la fosa posterior y la base del cráneo. Su tratamiento es quirúrgico. Tumores metastásicos del oído interno: son raros y, cuando se presentan, por lo general afectan otras porciones del hueso temporal. Igarashi (1979) publicó un caso en que un adenocarcinoma de páncreas proyectó metástasis al oído interno, con daño particular de las crestas ampulares de los conductos semicirculares y el ganglio espiral en su porción basal. Otros tumores que pueden causar este tipo de metástasis son los de mama, riñón, bronquio, pulmón y estómago. Se caracterizan por producir hipoacusia súbita neurosensorial, con escasa discriminación, acúfeno y pérdida de la función vestibular, en especial inestabilidad más que vértigo. El desarrollo de parálisis facial no es raro. El diagnóstico se establece con punción lumbar y análisis citológico, así como con resonancia magnética ERRNVPHGLFRVRUJ Oído interno a) Defectos de refracción. b) Desequilibrio de los músculos oculares. c) Glaucoma. Los estímulos visuales en movimiento constante que no pueden seguirse por los ojos se acompañan de la sensación subjetiva de inestabilidad, mecanismo ya descrito en la cinetosis. Trastornos del sistema propioceptivo: las alteraciones del sistema propioceptivo o de las vías vestibuloespinales producen desequilibrio; también se acompañan de deformación del sentido de la posición, por lo que pueden causar ataxia. Los trastornos que provocan vértigo por cambios periféricos en los nervios se presentan en el alcoholismo crónico, anemia perniciosa y tabes dorsal. Una fuente importante de afectación del sistema propioceptivo es el vértigo originado por estímulos anormales provenientes de la musculatura cervical, como ocurre en trastornos degenerativos secundarios a artritis cervical y después de traumatismos. En ocasiones puede establecerse el diagnóstico al demostrar la aparición de nistagmo con algunos movimientos de la cabeza y el cuello, pero no cuando el resto del cuerpo se voltea en la misma dirección. Enfermedades del sistema nervioso central: cualquier enfermedad del sistema nervioso central puede irritar o bloquear parcialmente las vías neurales que conservan el equilibrio. Los tumores cerebrales, sobre todo los del ángulo pontocerebeloso (neurinomas, meningiomas, colesteatomas congénitos, hemangiomas), la epilepsia del lóbulo temporal y la migraña pueden causar vértigo temprano. Se sabe que en un número significativo de pacientes con migraña común hay disfunción del laberinto, tal vez por un trastorno metabólico primario de la serotonina en el sistema nervioso central. En personas con migraña vertiginosa también se recomienda angiografía carotídea para descartar la posibilidad de coexistencia de un aneurisma. La función de la anoxia cerebral en la producción del vértigo es todavía incierta. En el plano anatómico es difícil creer que durante la vejez haya lesiones vasculares vestibulares aisladas por arterioesclerosis, que no produzcan también alteraciones o daño en otros núcleos del tallo cerebral. Los accidentes vasculares cerebrales afectan múltiples pares craneales, por ejemplo en el síndrome de Wallenberg. Pueden presentarse crisis súbitas de disminución del riego cerebral en pacientes, a menudo de edad mayor, con hipotensión ortostática, acompañadas de sensación de vértigo, que puede tener una duración corta (segundos) o progresar hasta un estado de inconciencia. Este periodo de desequilibrio se acompaña de otros síntomas, como alteraciones visuales o alteración de la memoria. Los trastornos cardiovasculares que pueden originar estos síntomas son: arterioesclerosis, enfermedad hipertensiva cardiovascular, anemia, fibrilación auricular, estenosis aórtica, bloqueos de conducción y síndrome del seno carotídeo. El síndrome poscontusional suele vincularse con crisis repetitivas de vértigo, moderado, poco intenso y con inestabilidad o debilidad. Otros síntomas que se presentan con este síndrome son cefalea, fatiga y dificultad para la concentración. Fármacos e intoxicación: en dosis suficientes, casi cualquier compuesto puede causar vértigo. Hay que tener especial cuidado cuando el paciente consuma antihipertensivos, antidepresivos, anticonvulsivos, aminoglucósidos y salicilatos. La neuropatía alcohólica por deficiencia de tiamina produce vértigo frecuente. Farmacoterapia del vértigo Antihistamínicos: estas sustancias son capaces de inhibir diferentes formas de estimulación vestibular, incluido el nistagmo inducido por las pruebas calóricas y el posrotatorio. Se desconoce su mecanismo de acción, pero su efecto vestibular es mucho menor que su actividad antihistamínica. En apariencia tiene alguna actividad de tipo anticolinérgico sobre los núcleos vestibulares. Los tres grupos empleados para controlar el vértigo son: a) Etanolaminas. b) Piperacinas. c) Fenotiacinas. Las piperacinas ofrecen mayores ventajas sobre los otros grupos porque tienen poco efecto sedante y actúan más tiempo. Se sugieren en el vértigo de origen vestibular y en la cinetosis. Sus efectos indeseables son resequedad bucal, diplopía y visión borrosa. Anticolinérgicos: la escopolamina se considera el mejor agente en la prevención de la cinetosis. Se cree ERRNVPHGLFRVRUJ Capítulo 6 y gadolinio; el diagnóstico diferencial debe considerar el neurinoma del acústico. Lesiones retrococleares: se tratan con detalle en el capítulo 8. Lo más común es que se deban a neurinomas del acústico. Los pacientes refieren hipoacusia de tipo sensorineural, que puede ser superficial moderada o profunda. En estadios avanzados se afecta de manera considerable la discriminación al habla. Debido al crecimiento lento de la tumoración y los mecanismos de adaptación que ocurren, el vértigo, cuando se presenta, no es muy intenso. Es habitual encontrar paresia vestibular durante las pruebas calóricas. El nervio trigémino se afecta con frecuencia, incluso más que el facial por la compresión de la tumoración del ángulo pontocerebeloso sobre la porción lateral del núcleo descendente del nervio trigémino en el tallo cerebral; en clínica, esta lesión se manifiesta por pérdida del reflejo corneal. En estudios avanzados, el neurinoma del acústico afecta al nervio facial y produce hidrocefalia. El diagnóstico de tumoraciones del ángulo pontocerebeloso se determina mediante respuestas auditivas del tallo cerebral, tomografía axial computarizada de alta resolución con aplicación de aire intratecal y resonancia magnética. El tratamiento, por lo general, es quirúrgico. Trastornos visuales acompañados de vértigo: para conservar una relación normal entre el cuerpo y el medio, son necesarias la visión y función ocular normales. Algunas causas oculares que pueden relacionarse con vértigo son: 143 143 144 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 6 que bloquea los centros colinérgicos, tanto centrales como periféricos. Los efectos indeseables son somnolencia, resequedad bucal y cefalea. Las dosis repetidas producen efectos acumulativos con el desarrollo de signos piramidales y ataxia. En la actualidad existe la forma transdérmica, en la cual es posible aplicar dosis continuas, pero pequeñas, de este fármaco con menores efectos indeseables. Babin (1984) encontró que, aparte de bloquear las uniones mioneuronales parasimpáticas posganglionares, inhibe al núcleo vestibular lateral. Es útil en el tratamiento de trastornos vestibulares periféricos, y su efectividad se compara con la de la vía oral (anticolinérgico y antihistamínico). Sedantes: el diacepam tiene efecto supresor vestibular y sedante. Pueden administrarse dosis pequeñas de este fármaco como auxiliares en el tratamiento del vértigo, sobre todo cuando se relaciona con trastornos vestibulares. McCabe (1979) ha demostrado que disminuye la actividad neuronal en el núcleo vestibular lateral y actúa sobre la sustancia reticular del tallo cerebral. Las fenotiacinas son eficaces en el control del vértigo por causas sistémicas, como uremia, gastroenteritis, carcinomatosis o posradioterapia. Sin embargo, su efecto en el vértigo por enfermedades laberínticas periféricas no es del todo satisfactorio. La combinación de droperidol y citrato de fentanilo, en dosis pequeñas, inhibe de manera eficaz al sistema vestibular, por lo que puede estar indicado en el tratamiento de laberintitis agudas en el hospital, con cuidado por su efecto depresor respiratorio. BIBLIOGRAFÍA Alleman A, Dornhofler J, Arenberg K, Wolker P: Demonstration of autoantibodies to the endolymphatic sac in Ménière’s disease. Laryngoscope 1997;107:211–215. Amoudi H, Makki F, McNeil M, Bance M: Transmastoid resurfacing of superior semicircular canal dehiscence. Laryngoscope 2011;121:1117–1123. Anniko M, Rosenkuist U: Tectorial and basal membranes in experimental hypothyroidism. Ar Otolaryngol 1982;108:218– 220. Antunez JCM, Galey FR, Linthicum FH, McCann GD: Computer–aided and graphic reconstruction of the human endolymphatic duct and sac: a method for comparing Ménière’s and non–Ménière’s disease cases. Ann Otol Rhinol Laryngol 1980;89(supl. 76):23–32. "SFOCFSH*, #BZFS3 Therapeutic options in Ménière’s disease. Arch Otolaryngol 1977;103:589–593. "SFOCFSH *, /PSCBDL %) 4IBNCBVHI (& Ultrastructural analysis of endolymphatic sac biopsies. Arch Otolaryngol 1982;108:292–298. "SFOCFSH *, %V1BUSPDJOJP * %SFJTCBDI + 4FJCFSU $ Radiographic classification of the vestibular and cochlear aqueducts: the paired correlation between normal and abnormal vestibular aqueduct and cochlear aqueduct anatomy. Laryngoscope 1984;94:1325–1333. Arnold W, Niedermeyer H: Herpes simplex virus antibodies in the perilymph of patients with Ménière’s disease. Ar Otolaryngol 1997;123:53–56. Arnold W, Altermatt HJ, Gebbers JO: Qualitativer nachweis von immunoglobulinen im menschlichen saccus endolymphaticus. Laryngol Rhinol Otol 1984;63:464–467. Babin RW: Positional nystagmus in Ménière’s disease. Ann Otol Rhinol Laryngol 1979;88:293–295. #BCJO 38 #BMLFOZ 5 'FF 8 Transdermal scopolamine in the treatment of acute vertigo. Ann Otol Rhinol Laryngol 1984;93:25–27. Babin RW, Liu C, Aschengrener C: Histopathology of neurosensory deafness in sarcoidosis Ann Otol Rhinol Laryngol 1984;93:389–393. #BMEXJO3 4XFJU[FS3 'SFJOE% Meningitis and sensorineural hearing loss. Laryngoscope 1985;95:802–805. Barany R: Diagnose von krankheitsercheinungen im bdes otolithenapparates. Acta Otolaryngol (Stockh) 1921;2:434–437. Barr DP, Reader GG, Wheeler CH: Cryoglobulinemia. I. Report of two cases with discussion of clinical manifestations, incidence and significance. Ann Intern Med 1950;32:6–29. #BSST% ,FZTFS+ 4UBMMXPSUI$) .D&MWFFO+ Intratympanic steroid injections por intratable Ménière’s diseas. Laryngoscope 2001;111:2100-2104. #BTU5) "OTPO#+ The temporal bone and the ear. Springfield, Ill: Charles Thomas Publ. 1949:30–100. #BUTBLJT + &Mo/BHHBS " Papillary neoplasms (Heffner’s tumors) of the endolymphatic sac. Ann Otol Rhinol Laryngol 1993;102:648–651. Bauer C, Brazoski JU: Effect of gabapentin on the sensation and impact of tinnitus. Laryngoscope 2006;116:675-681. #BVFS 1 1BSJ[J3PCJOTPO . 3PMBOE 1 :FHBQQBOT 4 Cytomegalovirus in the perylymphatic fluid. Laryngoscope 2005;115:223-225. #FBVHBSE.& "TBLVNB4 4IPX+# Comparative ototoxicity of chloramphenicol and kanamycin with ethacrynic acid. Ar Otolaryngol 1981;107:104–109. Beg JA: Bilateral sensorineural hearing loss as a complications of infectious mononucleosis. Arch Otolaryngol 1981;107: 620–622. #FSHFS 1 )JMMNBO . 5BCBL . 7PMMSBUI . The lymphocyte transformation test with type II collagen as a diagnostic tool of autoimmune sensorineural hearing loss. Laryngoscope 1991;101:895–899. Bergstrom L: Pendred’s syndrome with atypical features. Ann Otol Rhinol Laryngol 1980;89:135–139. Bergstrom L, 5IPNQTPO 1 4BOEP * 8PPE 31 ** Renal disease: its pathology, treatment, and effects on the ear. Arch Otolaryngol 1980;106:567–572. Beyea J, Agrawol j, Parnes L: Transmastoid semicircular canal occlusion: a rare and highly effective treatment for benign paroxysmal positional vertigo and superior canalo dehiscence. Laryngoscope 2012;122:1862–1866. Bing A, Ballenger WL: Diseases of the nose, throat and ear. medical and surgical. Philadelphia: Lea and Febiger, 1914:1015. ERRNVPHGLFRVRUJ Oído interno $PMMBSE. 8BHOFS$ 5JOHXPME' Conditioned middle ear tinnitus. Ann Otol Rhinol Laryngol 1982;91:330–331. $PUUFS $ 4JOHMFUPO ( $PSNBO - Immune–mediated inner ear disease and parvovirus B19. Laryngoscope 1994;104:1235– 1239. Cotugno D: De aquaeductibus auris humanae internae. Nápoles: Ex Typographia Simoniana, 1761. $SFNFST $83+ .POOFOT -") .BSSFT &)." Renal tubular acidosis and sensorineural deafness. Arch Otolaryngol 1980;106:287–289. Cremers CWRJ, Hoogland GA, Kuypers W: Hearing loss in the cervico–oculo–acoustic (Wildervanck) syndrome. Arch Otolaryngol 1984;110:54–57. %BWJT-& +BNFT$( 'JCFS' .D-BSFO-$ Cytomegalovirus isolation from a human inner ear. Ann Otol Rhinol Laryngol 1979;88:424–426. %F-P[JFS )- (BDFL 33 %BOB 45 Intralabyrinthine schwannoma. Ann Otol Rhinol Laryngol 1979;88:187–191. %FSFCFSZ+ 3BP4 (JHMPDL5et al.: Ménière’s disease: an immune complex–mediated illness. Laryngoscope 1991;101:225–229. %IPPTF* -FNNFSMJOH. -BHBDIF.et al.: Otological manifestations of charge association. Ann Otol Rhinol Laryngol 1998;107:935–941. Dix M, Hallpike C: The pathology, symptomatology and diagnosis of certain common disorders of the vestibular system. Ann Otol Rhinol Laryngol 1952;61:987–1016. Donaldson JA: Heparin therapy for sudden sensorineural hearing loss. Arch Otolaryngol 1979;105:351–352. %POPWBO 5 Mitochondrial encephalomyopathy. Ann Otol Rhinol Laryngol 1995;104:786–792. Driscoll C, Kasperbauer J, Facer G et al.: Low dose intratympanic gentamicin and the treatment of Ménière’s disease. Preliminary results. Laryngoscope 1997;107:83–89. %VWJMMBSE$) #BMMFTUFS. 3FEPO& 3PNBOFU1) Pulsatile tinnitus cured by mastoidectomy. Ann Otol Rhinol Laryngol 2004;113:730-733. &ENPOET + ,JSTF % ,FBSOT % %FVUDI 3 4QSVJKU - The otolaryngological manifestations of mitochondrial disease and the risk of neurodegeneration with infection. Ar Otolaryngol 2002;128-355-362. &OHFMCFSH . #BVFS 8 Transcutaneous electrical stimulation for tinnitus. Laryngoscope 1985;95:1167–1173. &OHFMTTPO4 -BSTTPO# -JOERVJTU/(et al.: Accumulation of 14 C–lidocaine in the inner ear. Acta Otolaryngol (Stockh) 1976;82:297–300. &OTJOL3 7FSIPFWFO, .BSSFT)et al.: Early–onset sensorineural hearing loss and late–onset neurologic complaints caused by a mitochondrial mutation at position 7,472. Ar Otolaryngol 1998;124:886–891. &QMFZ +. The canalith repositioning procedure for treatment of benign paroxysmal positional vertigo. Otolaryngol Head Neck Surg 1992;107:399–404. &SCF$I )BSSJT, 3VOHF4BNVFMTPO$I 'MBOBSZ7 Connexin 26 and connexion 30 mutations in children with monsyndormic hearing loss. Laryngoscope 2004;114:607-611. &TDBKBEJMMP +3 "MBUPSSF ( ;BSBUF " Typhoid fever and cochleovestibular lesions. Ann Otol Rhinol Laryngol 1982;91:220–224. &TDBKBEJMMP+3 Estudio anatomo–quirúrgico sobre la sección del nervio ampular posterior. Anales de la SMORL 1985;30:74–79. ERRNVPHGLFRVRUJ Capítulo 6 #MBDL ' .ZFST & 4DISBN 6 Cisplatin vestibular ototoxicity: preliminary report. Laryngoscope 1982;92:1363–1368. #MBJS 4. (BWJO . Modifications of vestibulo–ocular reflex induced by Diazepam. Arch Otolaryngol 1979;105:698– 701. Blakley B: Update on intratympanic gentamic in for Ménière’s disease. Laryngoscope 2000;110:236–240. #MBOL% %BWJT( WBOEF8BUFS5 3VCFO3 Acute Streptococcus pneumoniae meningogenic labyrinthitis. Ar Otolaryngol 1994;120:1342–1346. Boettcher A: Uber den aqueductus vestibuli bei katzen und menchen. Arch Anat Physiol 1869;936:372–380. #SBNB* 'BJOBSV. Inner ear involvement in Behçet’s disease. Arch Otolaryngol 1980;106:215–217. #SBOEU5 %BSPGG 3# Physical therapy for benign paroxysmal positional vertigo. Arch Otolaryngol 1980;106:484–485. Briner W, House J, O’Leary M: Synthetic prostaglandin E1, misoprostal as a treatment for tinnitus. Ar Otolaryngol 1993;119:652–654. Brookes G: Circulating immune complexes in Ménière’s disease. Arch Otolaryngol 1986;112:536–540. #SPXO++ #SVNNFUU3& 'PY,& #FOESJDL58 Combined effects of noise and Kanamycin. Arch Otolaryngol 1980;106:744–750. #SVNNFUU3& #SPXO35 )JNFT%- Quantitative relationships of the ototoxic interaction of kanamycin and ethacrynic acid. Arch Otolaryngol 1979;105:240–246. Byl F: Sudden hearing loss. 8 year’s experience and suggested prognostic table. Laryngoscope 1984;94:647–661. Caelers A, Monge A, Brand Y, Bodmer D: Somastotatin and gentamicin induced auditory hearing loss. Laryngoscope 2009;119:933–937. $BMIPVO , 4USVOL $ Perilymph fistula. Ar Otolaryngol 1992;118:693–694. $BEPOJ( "HVTUJOP4 .BOOB3 4F4BOUJT" Clinial associations of serum antiendothelial cell antibodies in patients with sudden sensorineural hearing loss. Laryngoscope 2003;113:797-801. $BUMJO& Prevention of hearing impairment from infection and ototoxic drugs. Arch Otolaryngol 1985;111:377–384. $IBOH5 8P: A tiny infarct on the dorsolateral pons mimicking vestibular neuritis. Laryngoscope 2010;120:2336–2338. $IBV+ -JO+ "UBTICBOBM4 *SWJOF3 8FTUFSCFSH#Systematic review of the evidence for the etiology of adult sudden sensorineural hearing loss. Laryngoscope 2010;120:1011–1021. $BTBOJ" 7BOOVDDJ( 'BUUPSJ# #FSSFUJOF4 The treatment of horizontal canal positional vertigo: our experience with 66 cases. Laryngoscope 2002;112:172-178. Coats AC, McCrary JA: Voluntary nystagmus masquerading as Tullio’s phenomenon. Arch Otolaryngol 1979;105:288–289. Coats AC: Ménière’s disease and the summating potential. I. Summating potential amplitude in Ménière’s and non Ménière’s ears. Arch Otolaryngol 1981;107:199–208. Coats AC: Ménière’s disease and the summating potential. II. Vestibular test results. Arch Otolaryngol 1981;107:263–270. Coats AC: Ménière’s disease and the summating potential. III. Effect of glycerol administration. Arch Otolaryngol 1981;107:469–474. Cohen H, Jerobek J: Efficacy of treatments for posterior canal benign paroxysmal positional vertigo. Laryngoscope 1999;109:584–590. 145 145 146 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 6 &WBO, 5BWJMM. (PMECFSH" 4JMWFSTUFJO) Sudden sensorineural hearing loss after general anesthesia for nonotologic surgery. Laryngoscope 1997;107:747–752. 'FUUFSNBO # -VYGPSE 8 4BVOEFST + Sudden bilateral sensorineural hearing loss. Laryngoscope 1996;106:1347– 1350. Fitzgerald D, Getson P, Brasseux C: Perilymphatic fistula: a Washington D.C. experience. Ann Otol Rhinol Laryngol 1997;106:830–837. 'PSNBOo'SBODP# "CSBNTPO"- (PSWPZ+% Cystic fibrosis and hearing loss. Arch Otolaryngol 1979;105:338–342. 'PY,& #SVNNFUU3& #SPXO3 )JNFT% A comparative study of the ototoxicity of Gentamicin and Gentamicin C. Arch Otolaryngol 1980;106:44–49. 'SBEJT . 1PEPTIJO - #FOo%BWJE + 3FJOFS # Treatment of Ménière’s disease by intratympanic injection with lidocaine. Arch Otolaryngol 1985;111:491–493. Fraysse BG, Alonso A, House WF: Ménière’s disease and endolymphatic hydrops: clinical–histopathological correlations. Ann Otol Rhinol Laryngol 1980;89(Sup. 76):2–22. 'SJFENBO&. )FSFS(3 -VCBO/-$ 8JMMJBNT* Sicke cell anemia and hearing. Ann Otol Rhinol Laryngol 1980;89:342– 347. 'SJFENBO 3 #ZLIPVTLFZB ( 5V ( et al.: Ann Otol Rhinol Laryngol 1997;106:320–325. 'SZENBO . 6OFVTEF 4 /PHFOJT # et al.: Clinical characterization of genetic hearing loss caused by a mutation. Ar Otolaryngol 2000;126:633–637. 'VOEBLPXTLJ$I "OEFSTPO+ "OHFMJ4 Cross sectional vestibular nerve analysis in vestibular neuritis. Ann Otol Rhinol Laryngol 2012;121:466–470. Gacek RR: Transection of the posterior ampullary nerve for the relief of benign paryxysmal positional vertigo. Ann Otol Rhinol Laryngol 1974;83:596–605. Gacek RR: Further observations on posterior ampullary nerve transection for positional vertigo. Ann Otol Rhinol Laryngol 1978;87:300–305. Gacek RR: Singular neurectomy update. Ann Otol Rhinol Laryngol 1982;91:469–473. Gacek RR: Cupulolithiasis and posterior ampullary nerve transection. Ann Otol Rhinol Laryngol 1984;93(Sup. 112):25–29. Gacek R, Gacek M: The three faces of vestibular ganglionitis. Ann Otol Rhinol Laryngol 2002;111:103-114. (BVSJFM/ 4DIMBOLPWJDI/ ,FJTMFS" &WJBUBS& Role of computerized dynamic posturograophy in evaluating sinugenic vertigo. Ann Otol Rhinol Laryngol 2013;122:263– 268. (FKSPU5 Intravenous xylocaine in the treatment of attacks off Ménière’s disease. Acta Otolaryngol (Stockh) 1963;(Sup. 188):190–195. (FNJHOBOJ( #FSSFUJOJ4 #SVTDIJOJ1et al.: Hearing and vestibular disturbances in Behcet’s syndrome. Ann Otol Rhinol Laryngol 1991;100:459–463. (JNTJOH4 %ZSNPTF+ Brachiooto–renal dysplasia in three families. Ann Otol Rhinol Laryngol 1986;95:421–426. (JOTCFSH*" 3VEOJDL.% )VCFS14 Aminoglycoside ototoxicity following middle ear injection. III. Comparative quantitative analysis. Ann Otol Rhinol Laryngol 1980;89(Sup. 77):1724. Glass L, Gorlin RJ: Congenital profound sensorineural deafness and oligodontia. Arch Otolaryngol 1979;105:621–622. (MBTTDPDL .& *** )VHIFT (# %BWJT 8& +BDLTPO $( Labyrinthectomy versus middle fossa vestibular nerve section in Ménière’s disease. A critical evaluation of relief of vertigo. Ann Otol Rhinol Laryngol 1980;89:318–324. Goin D, Rasbond R, Mischke R: Endolymphatic sac surgery in Mondini’s dysplasia. Laryngoscope 1984;94:343–347. Goldwyn B, Quirk W: Calcium channel blockade reduces noise induced vascular permeability in cochlear stria vascularis. Laryngoscope 1997;107:1112–1116. Golz A, Fradis M, Martzu D, Netzaer A, Joachin H: Stapedius muscle myoclonus. Ann Otol Rhinol Laryngol 2003;112:522-524. Goodhill V: Leaking labyrinth lesions, deafness, tinnitus and dizziness. Ann Otol Rhinol Laryngol 1981;90:99–106. (PSMJO3+ 5JMTOFS5+ 'FJOTUFJO4 %VWBMM"+*** Usher’s syndrome type III. Arch Otolaryngol 1979;105:353–354. Gould HJ, Caldarelli DD: Hearing and otopathology in Apert syndrome. Arch Otolaryngol 1982;108:347–349. Graham M, Kemink J: Surgical management of Ménière’s disease with endolymphatic sac decompression by wide bony decompression of the posterior fossa dura: technique and results. Laryngoscope 1984;94:680–683. Griffith D, Arts A, Downs C et al.: Familial large vestibular aqueduct syndrome. Laryngoscope 1996;106:960–965. (SPTT & 3PTT # 7JJUSF & et al.: Intractable benign paroxysmal positional vertigo in patients with Ménière’s disease. Laryngoscope 2000;110:655–659. (VBO .JOO ) )VOH$IJO - .JO5TBO + $IFOH$IJFO : Effectiveness of intratympanic dexamethasone injection in sudden deafness patients as salvage treatment. Layrngocope 2004;114:1185-1189. (VQUB3 4BUBMPGG3Noise-induced autoimmune sensorineural hearing loss. Ann Otol Rhinol Laryngol 2003;112:569-573. Gussen R: Saccule otoconia displacement into cochlea in cochleosaccular degeneration. Arch Otolaryngol 1980;106: 161–166. Gussen R: Endolymphatic hydrops with absence of vein in paravestibular canaliculus. Ann Otol Rhinol Laryngol 1980;89:157–161. Gussen R: Sudden hearing loss associated with cochlear membrane rupture. Arch Otolaryngol 1981;107:598–600. Gussen R: Vascular mechanisms in Ménière’s disease. Arch Otolaryngol 1982;108:544–549. (VUJÏSSF[' .PSFOP%. 4BJO[. Relationship between immune complex and total hemolytic complement in endolymphatic hydrops. Laryngoscope 1994;104:1495–1498. )BMM+ )VBOHo'V. (FOOBSFMMJ5 Auditory function in acute severe head injury. Laryngoscope 1982;92;883–890. )BMM4 0$POOPS' 5IBLLBS3et al.: Significance of tomography in Ménière’s disease. Periaqueductal pneumatization. Laryngoscope 1983;93:1551–1553. )BMMQJLF$4 $BJSOT) Observation on the pathology of Ménière’s syndrome. Proc R Soc Med 1938;31:1317–1336. )BNNFSTDIMBH1& 4DIVDLOFDIU)' Transcanal labyrinthectomy for intractable vertigo. Arch Otolaryngol 1981;107:152–156. )BSBEB5 4BOEP* .ZFST&/ Temporal bone histopathology in deafness due to cryptococcal meningitis. Ann Otol Rhinol Laryngol 1979;88:630–636. )BSBEB5 4BOEP* 4UPPM4& .ZFST&/ Temporal bone histopathologic features in Fanconi’s anemia syndrome. Arch Otolaryngol 1980;106:275–279. ERRNVPHGLFRVRUJ Oído interno *HBSBTIJ. 5BLBIBTIJ. "MGPSE#3et al.: Inner ear morphology in Down’s syndrome. Acta Otolaryngol 1977;83:175–181. *HBSBTIJ. $BSE(( +PIOTPO1& "MGPSE#3 Bilateral sudden hearing loss and metastatic pancreatic adenocarcinoma. Arch Otolaryngol 1979;105:196–199. *TIJLBXB , 5BNBZBXB: 5BLBIBTIJ , ,JNVSB ) ,VTBLBSJ + Nonsyndromic hearing loss caused by a mitochondiral T7511C mutation. Laryngoscope 2002;112:1494-1499. *TIJLBXB , 5BNBTBXB : 5BLBIBTIJ , -JOP : .VSBLBNJ : Temporal bone histopathologic abnormalities associated with mitochondrial mutatiol T7511 C. Laryngoscope 2006;116:1982-1986. *TIJZBNB " *TIJZBNB ( -PQF[ * et al.: Histopathology of idiopathic chronic recurrent vertigo. Laryngoscope 1996;106:1340–1346. *TSBFM + $POOFMMZ + .D5JHVF 4 #SVNNFUU 3& Lidocaine in the treatment of tinnitus avium. Arch Otolaryngol 1982;108:471–473. Jackler RK, Luxford WM, House WF: Congenital malformations of the inner ear: a classification based on embryogenesis. Laryngoscope 1987;97(Sup. 40):2–14. +BDLTPO $( (MBTTDPDL .& *** %BWJT8& et al.: Medical management of Ménière’s disease. Ann Otol Rhinol Laryngol 1981;90:142–147. +BISTEPFSGFS 3" 5IPNQTPO &( +PIOT ..& $BOUSFMM 38 Sarcoidosis and fluctuating hearing loss. Ann Otol Rhinol Laryngol 1981;90:161–163. +BISTEPFSGFS 3" $BJM 84 $BOUSFMM 38 Endolymphatic duct obstruction from a jugular bulb diverticulum. Ann Otol Rhinol Laryngol 1981;90:619–623. +BOLZ, ;V×JHB( $BSFZ+ 4DVCCFSU. Balance dysfunction and recovery after surgery for superior canal dehiscence síndrome. JAMA Otolaryngol Head Neck Surg 2012;138:723– 730. +BOVT4 %KBMJMJBO) -FWJOF4 ,FFM( Otitia interna carcinomatosa (metastasis to the internal auditory meatus via the cerebrospinal fluid. Ar Otolaryngol 2002;128:1213-1215. +BTUSFCPGG1+ )BOTFO3 4BTBLJ1( 4BTBLJ$5 Differential uptake of salicylate in serum, cerebrospinal fluid, and perilymph. Arch Otolaryngol 1986;112:1050–1053. JPIOTTPO -( "SFOCFSH *, Cochlear abnormalities in Alport’s syndrome. Arch Otolaryngol 1981;107:340–349. +PIOTTPO -( ,JOHTMFZ5$ Asymptomatic intracochlear neurinoma. Arch Otolaryngol 1981;107:377–381. +PIOTPO3 #SVNNFUU3 4DIMFVOJOH" Use of alprozolam for relief of tinnitus. Ar Otolaryngol 1993;119:842–845. +VIO4, 1SBEP4 3ZCBL- Effect of urea on osmolality of perilymph. Arch Otolaryngol 1979;105:538–541. ,BMMJOFO+ -BVSJLBJOFO& -BJQQBMB1 (SFONBO3 Sudden deafness a comparison of anticoagulant therapy and carbogen inhalation therapy. Ann Otol Rhinol Laryngol 1997;106:22– 26. ,BQMBO % /FE[FMTLJ + $IFO + 4IJQQ % Intratympanic gentamicin for the treatment of unilateral Ménière’s disease. Laryngoscope 2000;110:1298–1305. Katsarkas A, Outerbridge JJ: Nistagmus of pararxysmal positional vertigo. Ann Otol Rhinol Laryngol 1983;93:146–150. ,FJUIMFZ& $IBO. -JOUIFBV' Clinical diagnoses associated with histologic findings of fibrotic tissue and new bone in the inner ear. Laryngoscope 1998;108:87–91. ERRNVPHGLFRVRUJ Capítulo 6 )BSBEB5 4BOEP* Temporal bone histopathologic findings in Down’s syndrome. Arch Otolaryngol 1981;107:96–103. )BSBEB5 4BOEP* .ZFST&/ Microfissure in the oval window area. Ann Otol Rhinol Laryngol 1981;90:174–180. )BSSFU4 ,BTQFSCBVFS+ 'BDFS( #FBUUZ$ Transtympanic gentamicin for Ménière’s disease. Laryngoscope 1998;108:1446– 1449. Harris GG: Brownian motion in the cochlear partition. J Acoust Soc Am 1967;44:176–186. Harris J: Immunology of the inner ear: evidence of local antibody production. Ann Otol Rhinol Laryngol 1984;93:157–162. Harris J, Woolf N, Ryan A: Type II collagen autoimmunity. Ann Otol Rhinol Laryngol 1986;95:176–180. Harris K, Frbe Ch, Firszt J, Flanary V: A novel connexin 26 compund heterzygous mutation result in deafiness. Laryngoscope 2002;112:1159-1162. )BWJB . ,FOUBMB & Progression of symptoms of dizziness in menieres diseases. Ar Otolaryngol 2004;130:431-435. Herberts G: Post–infectious meningo–encephalitis as etiological factor in certain cases of vertigo. Acta Otolaryngol (Stockh) 1954;118:109–113. )FSENBO4 5VTB3 Complications of the canalith repositioning procedure. Ar Otolaryngol 1996;122:281–286. Hirsch B, Weissman J, Curtin H, Kamerer D: Magnetic resonance imaging of the large vestibular aqueduct. Ar Otolaryngol 1992;118:1124–1127. )P + 4BLBLJIBSB + Tinnitus suppression by electrical stimulation of the cochlear wall and by cochlear implantation. Laryngoscope 1994;104:752–754. Honeder C, Gstoettner W, Matula Ch, Czerny Ch: Endolymphatic sac tumor and angiomatous lesions of the nasal and pharyngeal mucosa as a first manifestation of von- Hippel Lindau disease. Laryngoscope 2012;122:2300–2303. House WF: Subarachnoid shunt for drainage of endolymphatic hydrops. A preliminary report. Laryngoscope 1962;72:713– 729. House J: Management of the tinnitus patient. Ann Otol Rhinol Laryngol 1981;90:597–601. Howe JF, Miller CA: Midbrain deafness following head injury. Neurology 1975;25:286–289. )VBOH5 -JO $ Endolymphatic sac surgery for Ménière’s disease. A study of 339 cases. Laryngoscope 1985;95:1082– 1086. )VBOH5 Primary intralabyrinthine swannoma. Ann Otol Rhinol Laryngol 1986;95:190–192. Hughes CD, Proctor L: Benign paroxysmal positional vertigo. Laryngoscope 1997;107:607–613. )VHIFT( ,JOOFZ4 #BSOB# $BMBCSFTF- Autoimmune reactivity in Ménière’s disease. Laryngoscope 1983;93:410–417. )VHIFT( ,JOOFZ4 #BSOB# $BMBCSFTF-Practical vs. theoretical management of autoimmune inner ear disease. Laryngoscope 1984;94:758–766. )VHIFT( ,JOOFZ4 )BNJE.et al.: Autoimmune vestibular dysfunction. Laryngoscope 1985;95:893–897. )VHIFT ( #BSOB # ,JOOFZ 4 Predictive value of laboratory test in autoimmune inner ear disease. Laryngoscope 1986;96:502–505. )VHIFT ( 3VUIFSGPSE * Predictive value of serologic tests in syphilis in otology. Ann Otol Rhinol Laryngol 1986;95:250– 259. 147 147 148 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 6 Kenna M, Wu B, Cotanche D, Karf B, Relim H: Connexin 26 studies in patients with sesnsorineural hearing loss. Ar Otolaryngol 2001;127:1037-1042. Kerne M, Hawke M, Baber H: Histopathological findings in clinical Gentamicin ototoxicity. Arch Otolaryngol 1982;108:65–70. ,IBO" -FWJOF4 /BEPM+ The widely patent cochleovestibular communication of eduard cock is a distinct inner ear malformation. Implications for cochlear implantation. Annals of Otol Rhinol Laryngol 2006;115:596-606. ,IBO " 4IFJLI ; ,IBO 4 %XJWFEJ 3 Viagra deafness. Sensorineural hearing loss and phosphodiesterase 5 inhibitors. Laryngoscope 2011;121:1049–1054. ,IFUBSQPM6 4DIVDLOFDIU) (BDFL3 )PMNFT- Autosomal dominant sensorineural hearing loss. Ar Otolaryngol 1991;117:1032–1042. ,IFUBSQPM6 4DIVDLOFDIU) In search of pathologic correlates for hearing loss and vertigo in Paget’s disease. Ann Otol Rhinol Laryngol 1990;99(145):1–16. ,JNVSB 34 4DIVDLOFDIU )' 0UB $: +POFT %% Obliteration of the ductus reuniens. Acta Otolaryngol (Stockh) 1980;98:295–309. ,JOOFZ8 /PMFQB/ )VHIFT( ,JOOFZ4 Cochleosacculotomy for the treatment of Ménière’s disease in the elderly patient. Laryngoscope 1995;105:934–937. ,JUBNVSB, 4DIVDLOFDIU) ,JNVSB34 Cochlear hydrops in association with collapsed saccule and ductus reuniens. Ann Otol Rhinol Laryngol 1982;91:5–13. ,MPDLIPGG * Diuretic treatment of Ménière’s disease. Arch Otolaryngol 1974;100:262–264. ,PIVU 3* 8BMEPSG 3" )BFOFM +- 5IPNQTPO +/ Minute perilymph fistulas: vertigo and Hennebert’s sign without hearing loss. Ann Otol Rhinol Laryngol 1979;88:153–159. ,PIVU3* )JOPKPTB3 #VEFSO+ Perilymphatic fistula. A histopathologic study. Ann Otol Rhinol Laryngol 1986;95:466– 471. ,PNVOF4 4OPX+# Potentiating effects of cisplatin and ethacrynic acid in ototoxicity. Arch Otolaryngol 1981;107:594–597. ,PNVOF4 4OPX+# Nature of the endocochlear dc potential in Kanamycin poisoned Guinea pigs. Arch Otolaryngol 1982;108:334–338. ,SBGU 4 #SPVHI % 4UBFDLFS ) Atoh 1 induces auditory hair cell recovery in mice after ototoxic injury. Laryngoscope 2013;123:992–999. ,SPOFOCFSH+ .BUUPY%& Vertigo: practical steps in a confusing differential. J Resp Diseases 1985;6:64–80. Kumagami H, Nishida H, Baba M: Electrocochleographic study of Ménière’s disease. Arch Otolaryngol 1982;108:284– 288. ,VNBS" 'JTINBO ( 5PSPL / Vestibular and auditory function in Usher’s syndrome. Ann Otol Rhinol Laryngol 1984;93:600–608. ,VU[ + 4JNPO - $IFOOVQBUJ 4 (JBOOPOJ $ .POPMJEFT 4 Clinical predictors for hearing loss in children with bacterial meningitis. Ar Otolaryngol 2006;132:941-945. Lange G, Mauer J, Mann W: Long-term results after interval therapy with intratympanic gentamicin for Ménière’s disease. Laryngoscope 2004;114:102-105. Lawrence M, McCabe BF: Inner ear mechanics and deafness. JAMA 1959;171:1929–1934. Lehrer J, Poole D: Onset and duration of positive responses to the glycerin test in patients with Ménière’s disease. Am J Otolaryngol 1982;3:262–263. -FNJT+% 7BMWBTTPSJ(& Recent radiographic and clinical observations on the vestibular aqueduct. Otolaryngol Clin N Am 1968;1:339–346. Lescouflair G, Philion Y, Morissette J: Hearing loss among miners claiming compensation. Arch Otolaryngol 1980;106:602– 609. -FTQFSBODF. )BMM+ 4BO"HVTUJO5) -FBM4 Mutations in the Wolfram syndrome type 1 gene (WFS1), define a clinical entity of dominant low frequencey sensorineural hearing loss. Ar Otolaryngol 2003;129:411-420. -FWFOTPO. 1BSJTJFS4 +BDPCT. &EFMTUFJO% The large vestibular aqueduct syndrome in children. Ar Otolaryngol 1989;115:54–58. -FWJOF4 4OPX+ Pulsatile tinnitus. Laryngoscope 1987;97:401– 406. -FXJT+- 3BCJOPWJDI4 The wide spectrum of cryptococcal infections. Am J Med 1972;53:315–322. Linthicum FH, Alonso A, Denia A: Traumatic neuroma. Arch Otolaryngol 1979;105:654–655. -JTUSP" #SBOEZ: 4FU[$I 3PEFKFWJW7 3FTJOL5IT- cadherin in the mammalian cochlea. Laryngoscope 2011;121:2228– 2233. -PSFO[J.$ #JUUBS3 &MJTBCFUF. ;FSBUJ' :BTIJOBSJ/ Sudden deafness and lyme disease. Laryngoscope 2003;113:312315. Lustig L, Lin D, Verick H, Larky J, Yeagle J, Chinnici J: GJB2 gene mutations in cochlear implant recipients. Ar Otolaryngol 2004;130:541-546. -ZODI & (6 3 1JFSDF 0 ,JM + Ebselen-meadiated protection from single and repeated noise exposure in ratos. Laryngoscope 2004;114:333-337. Malinvaud D, Lecanu JB, Halimi PH, Avan P, Bonfils P: Tinnitu and cerebellar developmental venous anomaly. Ar Otolaryngol 2006;132:550-553. .BSDIBOU 4 /BLBKJNB ) )BMQJO $ /BEPM + -FF % Clinical investigation and mechanism of air bone gaps in large vestibular aqueduct syndrome. Annals of Otol Rhinol Laryngol 2007;116:532-541. .BSSFT) &XJKL. )VZHFO1et al.: Inherited nonsyndromic hearing loss. Ar Otolaryngol 1997;123:573–577. .BUUFTPO & 5JO[BNFO 0 'BDFS ( et al.: Ann Otol Rhinol Laryngol 2000;109:710–714. .BUUPY%& 4JNNPOT'# Natural history of sudden sensorineural hearing loss. Ann Otol Rhinol Laryngol 1977;86:463– 480. Mayer O: Ein Fall von Multiplen Tumoren in den Endausbreitugen des Akustikus. Monatsschr Ohrenheilkd 1917;75:95– 113. McCabe BF: Labyrinthine fistula in chronic mastoiditis. Ann Otol Rhinol Laryngol 1984;93(Sup. 112):138–139. McCabe BF: Autoimmune sensorineural hearing loss. Ann Otol Rhinol Laryngol 1979;88:585–589. .D%POBME5+ 7PMMFSUTFO 34 :PVORVF #3 Cogan’s syndrome: audiovestibular involvement and prognosis in 18 patients. Laryngoscope 1985;95:650–654. ERRNVPHGLFRVRUJ Oído interno 0MJWFJSB$ .FTTJBT$ 'FSSBSJ* Ocurrence of familial Ménière’s syndrome and migraine in brasilia. Ann Otol Rhinol Laryngol 2002;111:229-236. Olson J, Wolfe JW: Comparison of subjective symptomatology and responses to harmonic acceleration in patients with Ménière’s disease. Ann Otol Rhinol Laryngol 1981;90(Sup. 86):15–17. 0TIJNB5 7FEB/ *LFEB,et al.: Bilateral sensorineural hearing loss associated with the point mutation in mitochondrial genome. Laryngoscope 1996;106:43. 1BLBSJOFO- ,FOKBMBJOFO4 -BJQQBMB1 ,BJUBMP) Usher’s syndrome type 3 in Finland. Laryngoscope 1995;105:613–617. 1BMWB5 Treatment of ears with labyrinth fistula. Laryngoscope 1983;93:1617–1619. 1BQBSFMMB .. 4IVNSJDL %" Otolaryngology. Vol. II. Ear. Philadelphia: W. B. Saunders Co., 1973. Paparella MM, Goycoolea M: Endolymphatic sac enhancement surgery for Ménière’s disease. Ann Otol Rhinol Laryngol 1981;90:610–615. 1BQBSFMMB .. .D%FSNPUU + 4PVTB - Ménière’s disease and the peak audiogram. Arch Otolaryngol 1982;108:555–559. Paparella MM, Mancini K: Trauma and Ménière’s syndrome. Laryngoscope 1983;93:1004–1012. 1BQBSFMMB .. EF 4PVTB -$ .BODJOJ ' Ménière’s syndrome and otitis media. Laryngoscope 1983;93:1408–1417. Pappas DG: Hearing impairments and vestibular abnormalities among children with subclinical cytomegalovirus. Ann Otol Rhinol Laryngol 1983;92:552–557. 1BSL+ 8IJUF" &SOTU& Efficacy of acupuncture as a treatment for tinnitus. Ar Otolaryngol 2000;126:489–492. Parnes L, McClure J: Free–floating endolymph particles: a new operative finding during posterior semicircular canal occlusion. Laryngoscope 1992;102:988–992. Parnes L, McClure J: Posterior semicircular canal occlusion for intractable benign paroxysmal positional vertigo. Ann Otol Rhinol Laryngol 1990;99:330–334. 1BSOFT - 1SJDFo+POFT ( Particle repositioning maneuver for benign paroxysmal positional vertigo. Ann Otol Rhinol Laryngol 1993;102:325–331. 1BSSJTI ,- 5BDIJCBOB . %PNFS '3 et al.: Ototoxicity of intracisternal gentamicin in cats. Ann Otol Rhinol Laryngol 1981;90:255–260. Parving A, Ostri B, Bretlau P: Audilogical and temporal bone findings in myxedema. Ann Otol Rhinol Laryngol 1986;95:278–283. Peeters GJ, Cremers CW, Pinckrens AJ: Atypical Cogan’s syndrome: an autoimmune disease. Ann Otol Rhinol Laryngol 1986;95:173–175. Pérez R, Gatt N, Cohen D: Audiometric configurations following exposure to explosions. Ar Otolaryngol 2000;126:1249– 1252. 1FUSPGG. 4JNNPOT'# 8JO[FMCFSH+ Perilymph fistula “syndromes” in children. Laryngoscope 1986;96:498–501. 1åTUFS. "CSZEJO' 5VSBO0et al.: Clinical evidence for dysmophin dysfunction as a cause of hearing loss. Laryngoscope 1999;109:730–735. Piccirillo J, Finnet J, Vlabiotis A, Chole R: Relief of idiophatic subjective tinnitus. Ar Otolaryngol 2007;133:390-397. Pillsbury H: Hypertension, hyperlipoproteinemia, chronic noise exposure. Is there synergism in cochlear pathology. Laryngoscope 1986;96:1112–1138. ERRNVPHGLFRVRUJ Capítulo 6 Meinyk A, Weiss L: Mesodermal induction defect as possible cause of ear malformations. Ann Otol Rhinol Laryngol 1983;92:160–164. Ménière P: Maladies de I’oreille interne offrant les symptoms de la congestion cerebrale apoplectiforme. 1961;16:239–240. Messerian C: Diameter of the cochlear nerve in endolymphatic hydrops: implications for the etiology of hearing loss in Ménière disease. Laryngoscope 2005;115:1525-1535. Mikulec A, Poe D, McKenna M: Operative management of superior semicircular canal dehiscence. Laryngoscope 2005;115:501-507. Minor LL: Clinical manifestions of superior semicircular canal dehiscence. Laryngoscope 2005;115:1717-1727. Mogi G, Lim DJ, Watanabe N: Immunologic study on the inner ear. Arch Otolaryngol 1982;108:270–275. Møller A: Pathophysiology of tinnitus. Ann Otol Rhinol Laryngol 1984;93:39–44. .PMMFS $ ,JNCFSMJOH 8 %BWFOQPSU 4 Usher Syndrome: An otoneurologic study. Laryngoscope 1989;99:73–79. Moller D, Moller M, Yokota M: Some forms of tinnitus may involve the extralemniscal auditory pathway. Laryngoscope 1992;102:1165–1171. .PSB3 #BSCJFSJ. .PSB' .PSB. :PP54 Intravenous infusion of recombinant tissue plasminogen activator for the treatment of patients with sudden AMD or chronic hearing loss. Ann Otol Rhinol Laryngol 2003;112:665-670. .PSHFOTUFJO , .BOBDF & Temporal bone histopathology in sickle cell disease. Laryngoscope 1969;79:2172–2180. Morris M, Borja L: Air bag deployment and hearing loss. Ar Otolaryngol 1998;124:507. .PTLPXJU[% -FF, 4NJUI" Steroid use in idiopathic sudden sensorineural hearing loss. Laryngoscope 1984;94:664– 666. .V×P[0 #FOÓUF[o%ÓB[- .BSUJOF[. (VJTDPMF) Hearing loss after Haemophilus influenzae meningitis. Ann Otol Rhinol Laryngol 1983;93:272–275. .VTJFL'& 1JOIFJSP.- 8JMTPO%) Auditory pattern perception in “split brain” patients. Arch Otolaryngol 1980;106:610–612. Nageris B, Ulannouski D, Attias J: Magnesium treatment for sudden hearing loss. Ann Otol Rhinol Laryngol 2004;113:672675. Nishida Y, Ueda K, Fung KC: Congenital rubella syndrome: function of equilibrium of 80 cases with deafness. Laryngoscope 1983;93:938–940. /JYPO+$ (MPSJH" )JHI84 Changes in air and bone conduction thresholds as a function of age. J Laryng 1962;76:288– 290. /PHVTIJ: /JTIJEB ) 5PLBOP ) ,BXBTIJNB: ,JUBNVSB , Comparison of acute low tone sensorineural hearing loss vs disease by electrocochleography. Ann otol rhinol Laryngol 2004;113:194-199. /PNVSB: 5TVDIJEB8 .PSJ4 4BLVSBJ5 Deafness in cryoglobulinemia. Ann Otol Rhinol Laryngol 1982;92:250–255. Oda M, Preciado MC, Quick CA et al.: Labyrinthine pathology of chronic renal failure patients treated with hemodialysis and kidney transplantation. Laryngoscope 1974;84:1489– 1506. Oliveira C, Braga A: Ménière’s syndrome inherited as an autosomal dominant trait. Ann Otol Rhinol Laryngol 1992;101:590–594. 149 149 150 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 6 Plantenga KF, Browning GG: The vestibular aqueduct and endolymphatic sac and duct in endolymphatic hydrops. Arch Otolaryngol 1979;105:546–552. 1PSJFS ' .JOUFHVJBHB $ 3PDB & #BIVZ 1 )FSNBO 1) Spontaneous intracraneal hypotension; a rare cause of labyrinthine hydrops. Ann Otol Rhinol Laryngol 2001;111:817820. Portmann M, Negrevergne M, Aron J, Cazals Y: Clinical applications of electrical stimulation of the ear. Ann Otol Rhinol Laryngol 1983;92:621–622. Poshley N: Simultaneous round and oval window fistule in a child. Ann Otol Rhinol Laryngol 1982;91:332–335. Proctor L, Perlman H, Lindsay J, Matz G: Acute vestibular paralysis in Herpes zoster oticus. Ann Otol Rhinol Laryngol 1979;88:303–310. Proctor B, Proctor C: Metabolic management in Ménière’s disease. Ann Otol Rhinol Laryngol 1981;90:615–617. 1SPQTU & #MBTFS 4 4UPDLMFZ 5 )BSSJTPO 3 (PSTPO , Temporal bone imaging in GJB2 deafness. Laryngoscope 2006;116:2178-2186. Pulec JL: The otic–periotic shunt. Otolaryngol Clin N Am 1968;1:643–648. Pulec JL: Ménière’s disease: Results of two and one half year study of etiology, natural history and results of treatment. Laryngoscope 1972;82:1703–1715. 1VMFD+ )PEFMM4 "OUIPOZ1 Tinnitus: diagnosis and treatment. Ann Otol Rhinol Laryngol 1978;87:821–833. Reed H, Meltzer J, Crews P et al.: Amino–oxyacetic acid as a palliative in tinnitus. Arch Otolaryngol 1985;111:803–805. 3JDIUFS& Quantitative study of scarpa’s ganglion and vestibular sense organs in endolymphatic hydrops. Ann Otol Rhinol Laryngol 1981;90:121–125. Riko K, Hyde M: Hearing loss in early infancy: incidence, detection and assessment. Laryngoscope 1985;95:137–144. 3J[WJ44 (JCCJO,1 Effect of transverse temporal bone fracture on the fluid compartment of the inner ear. Ann Otol Rhinol Laryngol 1979;88:741–748. 3J[WJ44 4NJUI-& Idiopathic endolymphatic hydrops and the vestibular aqueduct. Ann Otol Rhinol Laryngol 1981;90:77–79. 3J[WJ 44 Canal paresia in Ménière’s disease. Laryngoscope 1986;96:1258–1271. 3PTFOCFSH4 4JMWFSTUFJO) 3PXBO5 0MET. Effect of melatonin on tinnitus. Laryngoscope 1998;108:305–310. Rothstein J, Hilger P, Bores L: Venous hum as a cause of reversible factitious sensorineural hearing loss. Ann Otol Rhinol Laryngol 1985;94:267–268. 3PVJMMBSE3 -F$MFSD+ 4BWPSZ1 Pulsatile tinnitus: a dehiscent jugular vein. Laryngoscope 1985;95:188–189. 3VEOJDL.% (JOTCFSH*" )VCFS14 Aminoglycoside ototoxicity following middle ear injection. I. Experimental approach and histological criteria for evaluating drug effects. Ann Otol Rhinol Laryngol 1980;89(Sup. 77):1–9. Rupa V: Persistent vertigo following particle repositioning maneuvers. Ar Otolaryngol 2004;130:436-439. Ruttin B: Zur Differentialdiagnose der labyrinthu. Hornerverkrankungen Z. Ohrenheilkd. 1909;57:327–331. Rybak L: Furosemide ototoxicity: clinical and experimental results. Laryngoscope 1985;95(Sup. 38):1–14. 4BBE + Pars superioris in endolymphatic hydrops. Arch Otolaryngol 1984;110:679–681. 4BLBJ. .JZBLF) 4IJOLBXB" ,PNBUTV/ Klippel–Feil syndrome with conductive deafness and histological findings of removed stapes. Ann Otol Rhinol Laryngol 1983;93:202– 206. 4BNJ1 .PVCBZFE 4BMJCB* Laryngocope 2009;119:2071–2076. 4BOEP* 0HBXB" Inner ear pathology following injury to the eighth cranial nerve and the labyrinthine artery. Ann Otol Rhinol Laryngol 1982;92:136–141. 4BOEP * *LFEB . Histopathological studies in Ménière’s disease. Ann Otol Rhinol Laryngol 1985;94(Sup. 118):1–16. 4BOEP* *LFEB. Oculoauriculovertebral dysplasia. Ann Otol Rhinol Laryngol 1986;95:396–400. 4BXBEB. Electrocochleography of ears with mumps deafness. Arch Otolaryngol 1979;105:475–478. 4DIBDIFSO1" 4IFB% 1BQBSFMMB.. Mucopolisaccharidosis I–H (Hurler’s syndrome) and human temporal bone histopathology. Ann Otol Rhinol Laryngol 1984;93:65–69. 4DIBFGFS4% 1PTU+% $MPTF-( 8SJHIU$( Ototoxicity of low and moderate–dose cisplatin. Cancer 1985;56:1934–1939. 4DIJGG. :PP5+ Immunologic aspects of otologic disease: an overview. Laryngoscope 1985;95:259–269. 4DIVDLOFDIU )' Further observations on presbycusis. Arch Otolaryngol 1964;80:369–372. 4DIVDLnecht HF: Cupulolithiasis. Arch Otolaryngol 1969;90: 765–778. 4DIVDLOFDIU)' Mondini dysplasia: A clinical and pathological study. Ann Otol Rhinol Laryngol 1980:89(Sup. 65). 4DIVDLOFDIU) (BDFL. Cochlear pathology in presbycusis. Ann Otol Rhinol Laryngol 1993;102(158):1–16. 4DIVDLOFDIU )' ,JUBNVSB , Vestibular neuritis. Ann Otol Rhinol Laryngol 1981;90(Sup. 78):1–19. 4DIVDLOFDIU )' Cochleosaculotomy for Ménière’s disease: theory; technique and results. Laryngoscope 1982;92:853– 858. 4DIVDLOFDIU) /PEPM+ Temporal bone pathology in a case of Cogen’s syndrome. Laryngoscope 1994;104:1135–1142. 4DIXFJU[FS7 0MTPO/ Ototoxic effect of erythromycin therapy. Arch Otolaryngol 1984;110:258–260. 4DIXFJU[FS7 %PMBO% "CSBNT(et al.: Amelioration of cisplatin–induced ototoxicity by fosfomycin. Laryngoscope 1986;96:948–958. 4FJENBO. %F3JEEFS% &MJTFWJDI, #PXZFS4 %BSSFS* %SJB + 4UBDI# Direct electrical stimulation of heschl-S gyrus for tinnitus treatment. Laryngoscope 2008;118:491-500. 4FJENBO . ,IFO . %PMBO % 2VJSL8 Age related differences in cochlear microcirculation and auditory brain stem response. Ar Otolaryngol 1996;122:1221–1226. 4FMU[FS4 .D$BCF#' Perilymph fistula: the Iowa experience. Laryngoscope 1986;96:37–49. 4FNPOU" 'SFZFTT( 7JUUF& Curing de BPPV with a liberatory maneuver. Adv Otol Rhinol Laryngol 1988;42:290–293. 4FOOBSPVTMFF- 4BBUFJ* A new classification for cochleovestibular malformations. Laryngoscope 2002;112:2230. 4IBIVO ' .BOTVSJ / "Mo4IBJLI % et al.: Reversible uremic deafness: Is it correlated with the degree of anemia. Ann Otol Rhinol Laryngol 1997;106:391–393. 4IBOPO & )JNFMGBSC .; (PME 4 Auditory function in Friedreich’s ataxia. Arch Otolaryngol 1981;107:254–256. 4IBOPO& ;JL% 3FEJBOV$ &ZMBO& Sudden deafness due to infection by Mycoplasma pneumoniae. Ann Otol Rhinol Laryngol 1982;91:163–165. ERRNVPHGLFRVRUJ Oído interno 4VO ( 4IPNBO / 4BNZ 3 $PSOFMJVT 3 Do contemporary temporal bone fracture classification systems reflect concurrent intracranial and cervical spine injuries. Laryngoscope 2011;121:929–932. 4VTVLJ) )BTIJEB, /HVZFO, )PCDIJ/ Efficacy of intratympanic steroid administration on ideopathic sudden sensorineural hearing loss in comparisson with hyperbaric oxygen therapy. Laryngoscope 2012;122:1154–1157. 4[JLMBJ* 4[JMWBTTZ+ 4[JMWBTTZ; Laryngoscope 2011;121:888– 893. 5BZMPS- 1BSTPOTo4NJUI( Infectious mononucleosis, deafness and facial paralysis. J Laryngol Otol 1969;83:613–616. 5IFEJOHFS # ,BSMTFO & 4DIBDL 4 Treatment of tinnitus with electrical stimulation: an evaluation of the audimax theraband. Laryngoscope 1987;97:33–37. 5IJSMXBMM" #SPXO% .D.JMMBO1 -FTQFSBODF.Phenotipic characterization of hereditary hearing impairment linked to dena 25. Ar Otolaryngl 2001;129:830-835. 5IPNTFO + #SFUMBV 1 5PT . +PIOTFO /+ Placebo effect in surgery for Ménière’s disease. Arch Otolaryngol 1981;107:271–277. 5JBO 2 -JOUIJDVN ' 'BZBE + Human cochlease with three turns an unreported malformation. Laryngoscope 2006;116:800-803. 5JSFMMJ( %0SMBOEP& ;BSDPOF0et al.: Modified particle repositioning procedure. Laryngoscope 2000;110:462–468. 5PHMJB+6 5IPNBT% ,VSJU[LZ" Common migraine and vestibular function. Electronystagmographic study and pathogenesis. Ann Otol Rhinol Laryngol 1981;90:267–271. 5PLJUB/ $IBOESBo4FLIBS), %BMZ+'et al.: The campomelic syndrome. Arch Otolaryngol 1979;105:449–454. 5POOEPSG+ Acute cochlear disorders: The combination of hearing loss, recruitment, poor speech discrimination and tinnitus. Ann Otol Rhinol Laryngol 1980;89:353–358. 5PPOF&$+S )BZEFO(% &MMNBOO). Deafness from chloroquine. Arthritis Rheum (N. Y.) 1965;8:475–478. 5SJBOB3 4VJUT( (BSSJTPO4et al.: Inner ear damage secondary to diabetes mellitus. Ar Otolaryngol 1991;117:635– 640. 5SPOF % ,FNQUPO # ,FTTJ . Aldosterone (mineralocorticoid) equivalent to prednisolone (glucocorticoid) in reversing hearing loss in MRL/MPS–FAS autoimmune mice. Laryngoscope 2000;110:1902–1906. 6MTP$ )FOU[FS& Surgical treatment of recurrent perilymph fistula with anacusis. Ann Otol Rhinol Laryngol 1980;89:121–123. 6OBM .VSBU 5BNFS -VMVLFS /JMM %JHOWFS ; :JMEJSJN ) N-acetyltransferase 2 gene polymorphism and presbyacusis. Laryngoscope 2005;115:2238-2241. Urabec J: Benign paroxysmal positional vertigo and otolith repositioning. Ar Otol Rhinol Laryngol 1997;124:223–225. 6TBNJ4 "CF4 ,BTBJ.et al.: Genetic and clinical features of sensorineural hearing loss associated with the 1,555 mitochondrial mutation. Laryngoscope 1997;107:483–490. 6[VN- #BMCFMPHMV& "LJODJ) Garlic supplemented diet attenuates gentamicin induced ototoxicity: an experimental study. Ann Otol Rhinol Laryngol 2012;121:139–143. 7BSF" $IBOH& )PQQF+ #VUMFS. 'PSSFTUFS4 4DIFJEFS. Deletion of and novel missense mutation in POV 3F4 in 2 families segregating X-linked nonsyndromic defness. Ar Otolaryngol 2005;131:1057-1063. ERRNVPHGLFRVRUJ Capítulo 6 4IFB+ &NNFUU+ 0SDIJL%et al.: Medical treatment of tinnitus. Ann Otol Rhinol Laryngol 1981;90:601–607. 4IFFIZ+- 3PCJOTPO+7 #VTI+& Intravenous histamine in otologic practice. Arch Otolaryngol 1980;106:159–160. 4IJN ) 4POH 4 $IPJ: -FF 3 :PPO 4 Comparison of various treatment modalities for acute tinnitus. Laryngocope 2011;121:2619–2625. 4IVNBO" 3J[VJ 4 1JSPWFU $I )FJEFISJDI , Laryngoscope 2012;122:412–414. 4JHNBOJT " #VUUT ' )VHIFT ( Objective tinnitus in benign intracranial hypertension. An Update. Laryngoscope 1990;100:33–36. 4JHNBOJT" 1PMJTBS *" 3VGGZ .- -BNCFSU +$ Rare congenital syndrome associated with profound hearing loss. Arch Otolaryngol 1979;105:222–224. 4JHNBOJT " 4NPLFS 8 Pulsatile tinnitus. Laryngoscope 1994;104:681–688. 4JHNBOJT% 5IPNQTPO5 8JMMJT) Methotrexate therapy for autoimmune hearing loss: a preliminary report. Laryngoscope 1994;104:932–934. 4JOIB6 4BBEBU% -JOUIJDVN'et al.: Temporal bone findings in Alzheimer’s disease. Laryngoscope 1996;106:1–5. 4KÚCBDL % 'SJCFSH 7 3BTLo"OEFSTFO ) The human endolymphatic sac. Arch Otolaryngol 1996;112:398–409. 4NJUI3 4UFFM, #PSLXBZ$et al.: A histologic study of non– morphogenetic forms of hereditary hearing impairment. Ar Otolaryngol 1992;118:1085–1094. 4NPVIB & Time course of recovery after Epley maneuvers for benign paroxysmal positional vertigo. Laryngoscope 1997;107:187–191. 4OZEFS+ Predictability of the glycerin test in the diagnosis of Ménière’s disease. Clin Otolaryngol 1982;7:389–397. 4QJU[FS +# 7FOUSZ *. Central auditory dysfunction among chronic alcoholics. Arch Otolaryngol 1980;106:224–229. 4UBBC + 3VDLFOTUFJO . "NTUFSEBN + A prospective trial of sertraline for chronic subjective dizziness. Laryngoscope 2004;114:1637-1641. 4UFOOFS . 4UVSNFS , #FVUOFS % ,MVTTNBOO + Sudden bilateral sensorineural hearing loss after intravenous cocaine injection: a case report and review of the literature. Laryngoscope 2009;119:2441–2443. 4USBVTT . 'BXåHIJ + -PSE 4 et al.: Cisplatinum ototoxicity: clinical experience and temporal bone histopathology. Laryngoscope 1983;93:1554–1559. 4USBVTT. A clinical pathological study of hearing loss in congenital cytomegalovirus infection. Laryngoscope 1985;95: 951–962. 4VFIJSP 4 4BOEP * Congenital anomalies of the inner ear. Introducing a new classification of labyrinthine anomalies. Ann Otol Rhinol Laryngol 1979;88(Sup. 59):2–24. 4VHJVSB. /BHBOBXB4 5FSBOJTIJ. 4BUP& ,BKJNB4Inner ear hemorrhage in systemic lupus erythematosus: Laryngoscope 2006;116:826-828. 4VHVJSB4 :PTIJLBXB5 /JTIJZBNB: .PSJTIJUB: Detection of herpes virus DNA as in perillymph obstained from patients with sensorineural hearing loss by real-time polymerase chin reactin. Laryngoscope 2004;114:2235-2238. 4VO" 1BSOFT- 'SFFNBO% Comparative perilymph permeability of cephalosporins and its significance in the treatment and prevention of suppurative labyrinthitis. Ann Otol Rhinol Laryngol 1996;105:54–57. 151 151 152 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 6 Vasama J, Linthicum F: Idiopathic sudden sensorineural hearing loss: temporal bone histopathologic study. Ann Otol Rhinol Laryngol 2000;109:527–532. 7FMENBO+& 3PPSE++ 0$POOPS"' 4IFB++ Autoimmunity and inner ear disorders: an immune–complex mediated sensorineural hearing loss. Laryngoscope 1984;94:501–507. 7FMENBO+& Cochlear and retrocochlear immune–mediated inner ear disorders. Ann Otol Rhinol Laryngol 1986;95:535– 540. Vertes D, Axelsson A, Hennstrand C, Nilsson P: The effect of impulse noise on cochlear vessels. Arch Otolaryngol 1984;110:111–115. Vibert D, Kompis M, Hausler R: Benign paroxysmal positional vergio in older women may be related to osteoporosis and osteopenia. Ann Otol Rhinol Layungol 2003;112:885-889. 7JJSSF& 1PSDFMM* #BMDI3 The dix-hallpike test and the canalith repositioning maneuver. Lalryngoscope 2005;115:184187. 7PMMFSUTFO34 .D%POBME5+ :PVOHF#3et al.: Cogan’s syndrome: 18 caves and a review of the literature. Mayo Clin Proc 1986;61:344–361. 8BMU[NBO4# $PPQFS+4 Nature and incidence of misonidazole–produced ototoxicity. Arch Otolaryngol 1981;107:52–54. 8BSE1 4BOO1 %VWBMM"*** 5VSOFS$ Total energy and critical intensity concepts in noise damage. Ann Otol Rhinol Laryngol 1981;90:584–590. Welling D, Parnes L, O’Brien B et al.: Particulate matter in the posterior semicircular canal. Laryngoscope 1997;107:90–94. 8FSTÊM+ -VOERVJTU1( #KPSLSPUI# Ototoxicity of gentamicin. J Infect Dis 1969;119:4–5. 8FTUNPSF (" &WFSTEFO *% Noise–induced hearing loss and orchestral musicians. Arch Otolaryngol 1981;107:761– 764. Williams JD: Unusual but treatable cause of fluctuating tinnitus. Ann Otol Rhinol Laryngol 1980;89:239–240. Wilson WR, Byl FM, Laird N: The efficacy of steroids in the treatment of idiopathic sudden hearing loss. Arch Otolaryngol 1980;106:772–776. 8JMTPO 83 ;PMMFS . Electronystagmography in congenital and acquired syphilitic otitis. Ann Otol Rhinol Laryngol 1981;90:21–24. Wilson WR: The relationship of the Herpes virus family to sudden hearing loss. Laryngoscope 1986;96:870–877. 8JOEMFo5BZMPS 1$ &NFSZ 15 1IFMQT 1% Ear deformities associated with the Klippel–Feil syndrome. Ann Otol Rhinol Laryngol 1981;90:210–216. Winslow C, Lepone M: Bilateral agenesis of lateral semicircular canals with hypoplasia of the left internal auditory canal. Ar Otolaryngol 1997;123:1236–2138. Wolf J, Boyev K, Manokey B, Mattox D: Success of the modified Epley maneuver in treating benign paroxysmal positional vertigo. Laryngoscope 1999;109:900–903. Wood CD, Graybiel A: A theory of motion sickness based on pharmacological reactions. Clin Pharmacol Ther 1970;11:621–625. Woolf N, Harris J, Ryan A et al.: Hearing loss in experimental cytomegalovirus infection of the Guinea pig inner ear. Prevention by systemic immunity. Ann Otol Rhinol Laryngol 1985;94:350–356. :BNBTIJUB5 4DIVDLOFDIU)' Apical endolymphatic hydrops. Arch Otolaryngol 1982;108:463–466. :BOJW & )BDLJOH % ;JWo&M - Perilymphatic fistulas: are they exclusive to the round and oval windows. Laryngoscope 1986;96:360–362. :BTTJO" #BESZ" 'BUUo)J" The relationship between electrolyte balance and cochlear disturbances in cases of renal failure. J Laryngol Otol 1976;84:429–435. :MJLPTLJ + $PMMBO: 1BMWB5 Vestibular sensory epithelium in Ménière’s disease. Arch Otolaryngol 1979;105:486–491. :MJLPTLJ+ $PMMBO: 1BMWB5 Vestibular nerve in Ménière’s disease. Arch Otolaryngol 1980;106:477–483. Yong Ch, Ko M, Hwuang Ch: Zinc in the treatment of idiopathic sudden sensorineural hearing loss. Laryngoscope 2011;121:617–621. :PP5+ 4UVBSU +. ,BOH ") et al.: Type II collagen autoimmunity in otosclerosis and Ménière’s disease. Science 1982;217:1153–1154. ;BM[BM( 5PNBTLJ4 7F[JOB*et al.: Enlarged vestibular aqueduct and sensorineural hearing loss in childhood. Ar Otolaryngol 1995;121:23–28. ;CBS3 .FHFSJBO$ ,IBO" 3VCJOTUFJO* Invisible culprit: intralabyrinthine schwannomas that do not appear on enhanced magnetic resonance imaging. Ann Otol Rhinol Laryngol 1997;106:739–742. ;FDIOFS ( "MUNBOO ' Histological studies on the human endolymphatic duct and sac. Pract Otol Rhinol Laryngol 1969;31:65–83. ;FF % Perspectives on the pharmacotherapy of vertigo. Arch Otolaryngol 1985;111:609–612 ;FJUPVO) #FDLNBO" "SUT" -BOTGPSE$Corticosteroid response and supporting cell antibody in autoimmune hearting loss. Ar Otolaryngol 2005;131:665-672. ERRNVPHGLFRVRUJ ANATOMÍA Y EMBRIOLOGÍA DEL NERVIO FACIAL EMBRIOLOGÍA El desarrollo embrionario del nervio facial se relaciona con el segundo arco branquial o arco hioideo. Surge del primordio fascioacústico y, al medir éste entre 8 y 10 mm, el nervio facial se separa de la división acústica. El nervio intermediario también surge de este nervio, el cual emite las fibras sensoriales de la cuerda del tímpano. Entre las 14 y 20 semanas de gestación, la cuerda del tímpano se une al nervio lingual. En su porción intratemporal, el nervio facial se encuentra cubierto por un conducto óseo (conducto de Falopio); la relación entre el tamaño del nervio facial y el conducto de Falopio a las 20 semanas de gestación es de 1:5; a las 25 semanas de 1:3.9; a las 30 de 1:2.9; y a las 35 de 1:1.9; esta última puede permanecer en el adulto o ser de 1:1. La osificación del conducto de Falopio se inicia hacia las 20 semanas. El ganglio geniculado crece durante las primeras 15 semanas de edad gestacional; luego su crecimiento es mínimo hasta las 35 a 40 semanas. La distancia que lo separa del epitímpano es de casi 1 mm. La porción más estrecha del nervio facial es la laberíntica (cercana al fundus del conducto auditivo interno). En el feto y el recién nacido, este segmento mide en promedio 1.67 mm y en el adulto es de 2.82 mm con una anchura de 0.7 mm. El riego del nervio facial proviene de la arteria auditiva interna y las ramas petrosas de la arteria meníngea media. ORDEN CRONOLÓGICO DEL DESARROLLO EMBRIONARIO DEL NERVIO FACIAL 1. Tercera semana de gestación: aparece el primordio fascioacústico. 2. Cuarta semana de gestación: el nervio facial se separa de la división acústica. 3. Quinta semana de gestación: aparecen el ganglio geniculado y el nervio intermediario. El nervio petroso superficial mayor está ya presente. El nervio facial proyecta pequeñas ramas hacia la masa premuscular digástrica posterior. 4. Sexta semana de gestación: el nervio de la cuerda timpánica y el nervio lingual terminan cerca del desarrollo del ganglio submandibular. 5. Séptima semana de gestación: se identifica el nervio auricular posterior. Se desarrollan el vientre posterior del músculo digástrico, el músculo estapedial y el estilohioideo. 6. Séptima y octava semanas de gestación: aparecen combinadas las ramas marginal y mandibulocervical del nervio. 7. Octava semana de gestación: se desarrolla una hendidura alrededor del nervio facial, que forma el canal del Falopio. 8. Novena semana de gestación: aparecen los músculos auricular anterior, occipital, platisma mandibular y elevador superior del labio. 9. Décima semana de gestación: inicia el curso vertical mastoideo del nervio facial. 10. Undécima semana de gestación: surge el nervio petroso externo del nervio facial, distal al ganglio geniculado. 11. Decimocuarta y decimoquinta semanas de gestación: termina el desarrollo del ganglio geniculado. 12. La relación del nervio facial con las estructuras del oído medio se encuentra más desarrollada. 13. Decimosexta semana de gestación: las comunicaciones definitivas del nervio facial se han establecido. 14. Vigésima primera semana de gestación: se inicia el proceso de osificación, sobre la porción anterior de la región apical de la cóclea, cerca del futuro proceso cocleariforme. 15. Vigésima cuarta semana de gestación: la porción anterior del canal de Falopio se encuentra formada y se inicia el proceso de osificación en dirección anteroposterior en la porción timpánica del nervio facial. Capítulo 7 Nervio facial 153 ERRNVPHGLFRVRUJ 154 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 7 16. Vigésima sexta semana de gestación: existe un cierre parcial de la hendidura que forma al canal de Falopio. 17. Trigésima cuarta a trigésima quinta semanas de gestación: el canal de Falopio se encuentra formado y en el 25% de los casos hay dehiscencias de éste. ANATOMÍA El nervio facial consta de dos ramas: 1. Una motora, que es la más grande, inerva los músculos de la cara. 2. La otra más pequeña es el nervio intermediario de Wrisberg que contiene fibras sensoriales del gusto y secretomotoras parasimpáticas provenientes de las glándulas salivales submandibular y sublingual y de las lagrimales. Asimismo, el nervio facial porta fibras eferentes somáticas y viscerales; algunas de ellas se unen con la rama auricular del vago para inervar el conducto auditivo externo. Los cuerpos celulares de estas fibras se hallan en el ganglio geniculado y terminan en forma central con conexiones con el V par craneal. Las eferentes viscerales inervan la mucosa de nariz, paladar y faringe a través del nervio petroso superficial mayor; sus cuerpos celulares también se encuentran en el ganglio geniculado y tienen conexiones centrales con el tracto solitario. El núcleo motor del VII par craneal (nervio facial) se localiza en un plano profundo de la sustancia reticular del puente, rostral al núcleo ambiguo del X par craneal. Sus axones tienen dirección dorsomedial, pasan a lo largo del piso del IV ventrículo, a continuación sufren una rotación aguda (a manera del mango de un bastón), para adoptar por una corta distancia una dirección rostral dorsal sobre el fascículo longitudinal medio y el nucleus abducens. La elevación que las fibras del facial producen sobre este último núcleo en el piso del IV ventrículo se denomina colículo facial. El nervio emerge del tallo cerebral en el borde caudal del puente en un receso entre las olivas bulbares y el pedúnculo cerebeloso inferior. Las conexiones centrales primarias de las células motoras del núcleo del facial se establecen a través de fibras corticobulbares del tracto piramidal. Las fibras corticobulbares que llegan al núcleo motor, que lleva axones de la porción inferior de la cara, son de tipo cruzado; sin embargo, las fibras que se conectan con la porción superior de la cara son mixtas (cruzadas y no cruzadas); por ello, en lesiones supranucleares del nervio facial, no se afectan los movimientos de la frente pero sí los del resto de la cara. Las fibras secretorias parasimpáticas del nervio intermediario surgen de los cuerpos celulares del núcleo salival superior. Son preganglionares y se distribuyen hacia el ganglio submandibular a través de la cuerda del tímpano, para inervar las glándulas submandibulares y sublinguales, y en dirección del ganglio esfenopalatino por el nervio petroso superficial mayor para inervar las glándulas lagrimales. Las fibras del gusto de las dos terceras partes anteriores de la lengua llegan a sus cuerpos celulares en el ganglio geniculado por la vía de la cuerda del tímpano y se conectan en forma central con el núcleo del tracto solitario. En el conducto auditivo interno (CAI), las fibras motoras faciales son más superficiales y mediales, y las del nervio estatoacústico más laterales; las fibras del nervio intermediario pasan entre estas dos. En la porción terminal del CAI, las fibras ingresan al conducto de Falopio, entre la cóclea y los conductos semicirculares (porción laberíntica), a unos 5 mm del ganglio geniculado. En este punto surge la primera rama del nervio facial, que es el nervio petroso superficial mayor, que proyecta fibras motoras secretorias a la glándula lagrimal. Además, puede haber fibras del nervio petroso superficial menor, que es parte del plexo timpánico, y que lleva fibras secretorias a la glándula parótida (figuras 7–1 y 7-2). En seguida, el nervio alcanza la región anterosuperior de la pared media de la caja timpánica (porción timpánica). Discurre en forma horizontal y por encima de la ventana oval. La pared timpánica del conducto de Falopio es delgada y se fractura con facilidad. Asimismo, es frecuente observar dehiscencias del nervio en su trayecto. El proceso cocleariforme marca la porción terminal anterior del segmento timpánico del nervio facial, en tanto que la eminencia piramidal indica su extremo posterior. En este plano surge otra rama motora del VII par que inerva al músculo del estribo. E continuación, el conducto del facial toma un curso vertical y hacia abajo sobre la pared anterior de la apófisis mastoides, para salir por el agujero estilomastoideo. La distancia del nervio desde su porción laberíntica hasta el agujero es de 21 mm. A la mitad del trayecto de la porción vertical o mastoidea del nervio facial sale la cuerda del tímpano que sigue hacia arriba y atrás, pasa sobre la superficie interna de la membrana timpánica, entre el yunque y el cuello del martillo, y abandona la cavidad timpánica a través de la fisura petrotimpánica, luego de atravesar la fosa temporomandibular para unirse así con el nervio lingual (figura 7–3). Las ramas restantes del nervio facial se encuentran detrás de su salida a través del agujero estilomastoideo y son: Nervio auricular posterior Inerva los músculos auricular posterior y occipital. Traza un curso ascendente, entre el conducto auditivo externo y la punta de la mastoides. Rama digástrica Surge cerca del agujero estilomastoideo e inerva al vientre posterior del digástrico. Rama estilohioidea Inerva al músculo estilohioideo y surge cerca o en conjunto con la rama digástrica. Puede cortarse sin causar trastornos al paciente. ERRNVPHGLFRVRUJ Nervio facial 155 155 Capítulo 7 Figura 7–1. Fotografía que muestra la primera porción del nervio facial, para lo cual se ha fresado el techo del conducto auditivo interno. En el centro se reconoce el ganglio geniculado y, hacia la derecha, la rama del nervio petroso superficial mayor. Nótese que también se ha fresado la eminencia arqueada para exponer el conducto semicircular superior y la porción laberíntica del nervio facial. Figura 7–2. Nótese la entrada del nervio facial al conducto auditivo interno; por debajo de éste se encuentra el VIII par, y emergen del agujero rasgado posterior el IX,X y XI pares craneales. ERRNVPHGLFRVRUJ 156 Oído, nariz, garganta y cirugía de cabeza y cuello A Capítulo 7 B 1 2 VYI C AC Figura 7–3. Anatomía del nervio facial (porción intratemporal): A. Porción laberíntica; B. Porción timpánica; C. Porción mastoidea; 1. Nervio estapedial; 2 Nervio de la cuerda del tímpano. AC= arteria carótida; VYI= vena yugular interna. Plexo parotídeo El tronco principal del nervio pasa sobre la región posterior de la apófisis estiloides, para avanzar después en forma lateral y anterior hacia el lóbulo superficial de la glándula parótida, en donde se divide en dos ramas principales: Temporofacial, que inerva la frente, el músculo orbicular de los ojos y la porción superior de la cara. Cervicofacial, que inerva los músculos del ángulo de la boca, el orbicular de los labios, el mentón y el músculo cutáneo del cuello. Las divisiones específicas de estas dos ramas principales son las siguientes: Temporal: es la más superior; cruza el arco cigomático e inerva la porción anterosuperior de los músculos auriculares, el músculo frontal, el orbicular de los ojos y el piramidal de la nariz. Cigomático: se origina en la división temporofacial y discurre paralela para inervar al músculo orbicular de los ojos. A menudo sus fibras inferiores se juntan con las ramas bucales para formar el plexo infraorbitario e inervan los músculos de la parte media de la cara. Bucal: puede surgir de manera indistinta de la rama temporofacial o la cervicofacial. En los estudios de McCormack y Davis hay una ligera predisposición por la primera (60 contra 40%). Las ramas de esta división se conectan libremente con las cigomáticas y mandi- bulares, de tal modo que se inervan los músculos de la porción media de la cara: piramidal de la nariz, orbicular de los ojos, cigomático, elevador del ángulo de la boca, elevador del labio superior, bucinador, orbicular de los labios y músculos nasales. Mandibular: se ha encontrado que en 80% de los casos, esta rama pasa por arriba del borde inferior de la mandíbula e inerva los músculos depresor del ángulo bucal, orbicular de los labios, depresor del labio inferior, mentoniano y risorio. Cervical: es la más inferior de la división cervicofacial y se proyecta en lo profundo del músculo cutáneo del cuello, al cual inerva (figura 7–4). PARÁLISIS DEL NERVIO FACIAL FISIOPATOGÉNESIS Los impulsos nerviosos se transmiten por los axones, que corresponden a extensiones del citoplasma de las neuronas. Estos axones están cubiertos por células de Schwann, que forman un túnel simple, en caso de fibras amielínicas; los nervios mielinizados están cubiertos por mielina. La vaina de mielina se interrumpe en segmentos de aproximadamente 1 mm para formar los nódulos de Ranvier, que representan la porción terminal de una cé- ERRNVPHGLFRVRUJ Nervio facial 157 157 Capítulo 7 A B C D E Figura 7–4. Anatomía del nervio facial (ramas extratemporales): A. Rama temporal; B. Rama cigomática; C. Rama bucal; D. Rama mandibular; E. Rama cervical. lula de Schwann y el inicio de otra. A lo largo de los nódulos y sobre las células de Schwann hay una membrana basal que es continua y no permite que el axón entre en contacto con el espacio extracelular. De esa manera, los axones reciben oxígeno y aislamiento a través de las células de Schwann; los nutrimentos se obtienen del axoplasma, que se cataboliza en forma gradual; el flujo de éste a partir de la neurona madre es de 1 mm cada 24 h, lo que representa la velocidad de regeneración del axón cuando el nervio se corta. la lesión. Los axones aislados de sus neuronas madre mueren de modo gradual por falta de nutrimentos. Las células de Schwann se tornan edematosas a las 48 h de la sección y en las vainas de mielina se inicia un proceso fagocitario. La neurona madre también se priva de algunos nutrimentos que circulaban de regreso a través del axón y sufre cromatólisis. En este estadio, la lesión es irreversible y las consecuencia son secuelas funcionales. Grados de lesión del nervio DIAGNÓSTICO Neuropraxia: consiste en la pérdida reversible de la conductibilidad del nervio, secundaria a diferentes tipos de presión sobre el nervio. La recuperación es completa y no deja secuelas. Axonotmesis: consiste en la muerte del axón, por alguna lesión que bloquea al axoplasma; requiere varios días para producirse. La lesión es reversible y durante el proceso de regeneración quizá no queden secuelas o se presenten sincinesias (movimientos por inervación de músculos separados). Neurotmesis: es la muerte total del tronco nervioso por presión excesiva sobre el nervio (sección fisiológica) o su corte anatómico. Existe un proceso denominado degeneración walleriana, en el cual los axones del segmento periférico del nervio pierden axoplasma y viven varios días (tres) con excitabilidad eléctrica, pero sin impulsos de conducción a través del sitio de La valoración inicial de cualquier paciente con parálisis facial debe incluir una historia clínica completa. Es importante investigar antecedentes otológicos, traumáticos, endocrinos, cardiovasculares y neuropsiquiátricos. Se interroga de manera intencionada sobre la presencia de resequedad ocular, alteraciones del gusto, dolor o cambios en la audición o alteraciones del equilibrio. Durante la exploración otológica se valora la presencia de vesículas en el pabellón auricular y en el resto de la cara o el paladar blando, ya que se pueden encontrar en infecciones áticas por herpes; también se observa la membrana timpánica para descartar una posible otitis media coexistente. Debe anotarse cualquier hallazgo facial anormal, a fin de descartar lesiones congénitas que acompañen al cuadro, sobre todo en niños. Se palpan la cara (región parotídea) y el cuello en busca de masas tumorales o crecimientos ganglionares. ERRNVPHGLFRVRUJ 158 Oído, nariz, garganta y cirugía de cabeza y cuello Lesiones centrales Capítulo 7 La parálisis facial es contralateral al sitio de la lesión. Cuando ésta es supranuclear, hay parálisis de la porción inferior y media de la cara, pero sin afectarse la rama frontal del nervio, debido a su inervación contralateral en el tallo cerebral. Hay pérdida del control voluntario de los músculos de la cara, pero no en las respuestas emocionales, como sucede al reír. No existe fenómeno de Bell. A menudo se encuentran lesiones de otros pares craneales (VI, XI, XII). Lesiones periféricas Son ipsolaterales a la lesión y pueden ser completas o parciales. Para su estudio se recomienda la clasificación de House (1983), que divide las lesiones en seis grados clínicos: 1. Normal: la función facial es normal en todas las áreas. 2. Disfunción superficial: existe leve debilidad, sólo perceptible en la inspección cercana. En reposo se advierte una buena simetría y tono muscular. Puede haber una ligera debilidad en el movimiento de la frente; el cierre ocular se realiza con un esfuerzo mínimo y asimetría perceptible discreta; lo mismo ocurre con la comisura bucal. No hay sincinesias, contracturas ni hemiespasmos faciales. 3. Disfunción moderada: existe una diferencia obvia, pero no desfigurante, entre ambos lados de la cara. No hay afectación funcional y, en algunos pacientes, se encuentra sincinesia o hemiespasmo poco aparente del facial. En reposo hay simetría facial y conservación del tono. En el movimiento se reconoce ausencia o disminución de la movilidad de la frente; capacidad para cerrar el ojo, pero con un esfuerzo máximo, y asimetría aparente; lo mismo ocurre con la comisura bucal. Los pacientes con sincinesia obvia pero no desfigurante son de grado III, cualquiera que sea el grado de actividad motora. 4. Lesión moderada a grave: paresia obvia, con asimetría en reposo; no hay movimiento de la frente; incapacidad para cerrar por completo el ojo, después de un esfuerzo máximo; movimientos asimétricos de la comisura bucal, también con un esfuerzo máximo. Es frecuente encontrar sincinesia o hemiespasmo facial lo bastante grave para interferir con la función; cuando se presenta, la lesión se considera de grado IV. 5. Disfunción grave: el paciente presenta movimientos faciales apenas perceptibles. En reposo puede haber asimetría, con caída de la comisura bucal, y ausencia del surco nasogeniano. En la valoración motora no hay movimiento de la frente, el cierre del ojo es incompleto, con movimiento muy ligero del párpado y se observa mínimo movimiento de la comisura bucal. Por lo general, no hay sincinesias ni hemiespasmos faciales. 6. Parálisis total: existe asimetría muy aparente, pérdida del tono, sin movimientos faciales ni sincinesias, contracturas o hemiespasmos faciales. Diagnóstico topográfico Consiste en localizar el sitio de la lesión del nervio al estudiar la función de sus diferentes ramas. Este diagnóstico sólo es útil cuando las parálisis faciales son completas. Prueba de lagrimeo de Schirmer: estudia la cuantía de la secreción lagrimal tras cuantificar de forma comparativa la longitud del papel filtro humedecido en el lado afectado y en el sano. Se recomienda el papel de 50 mm de longitud, 5 de ancho y 0.1 de grosor. Uno de sus extremos se dobla 5 mm y se aplica sobre la región conjuntival inferior. Es importante señalar que durante la prueba, el paciente no debe recibir colirios ya que su uso la invalida. La introducción de este papel en el saco conjuntival no anestesiado es un estímulo suficiente para producir secreción lagrimal. El tiempo de duración de la prueba es de 5 min (figura 7–5). Los análisis estadísticos han mostrado una diferencia significativa (p < 0.05) cuando: a) Existe una disminución unilateral del lagrimeo del 30% o más sobre la cantidad total de lagrimeo en ambos ojos, durante 5 min. b) Hay reducción bilateral del lagrimeo, con suma de ambos ojos de 25 mm o menos. Según Montgomery (1973), cuando el papel filtro se humedece 15 mm o más, indica función normal y anormal Figura 7–5. Prueba de lagrimeo de Schirmer: al comparar los valores obtenidos en ambos ojos resulta obvio que hay una disminución del lagrimeo mayor de 30% en A (ojo derecho) con respecto a B (ojo izquierdo). Así: ERRNVPHGLFRVRUJ A – B – 100 = 30% A+B Nervio facial Electrodiagnóstico En personas con parálisis facial de reciente aparición, el problema estriba en determinar si el nervio sufre neuropraxia, que se recupera de forma espontánea a medida que disminuye el mecanismo que la produjo (presión), o se trata de una axonotmesis inicial y si no se alivia la presión que la originó se produce una neurotmesis de todo el tronco nervioso. Una corriente farádica o alterna aplicada al músculo o el nervio provoca contracción muscular en tanto se encuentre intacto el nervio, y por dos a tres días después de seccionarlo. La respuesta a este estímulo desaparece por completo a los 15 días de la sección, en tanto que las fibras musculares pueden aún contraerse al aplicar una corriente galvánica. La presencia de respuesta muscular galvánica con ausencia de respuesta en el nervio se denomina reacción de degeneración. Prueba de excitabilidad del nervio: en esta prueba se aplican electrodos en el sitio de salida del nervio facial en el agujero estilomastoideo y se estimulan sus diferentes ramas, con emisión de estímulos intermitentes de 1 mseg de duración y una intensidad que varía de 1 a 10 mA. Si la excitabilidad del nervio es igual en el lado normal y en el afectado, se considera que la parálisis se debe a neuropraxia, lo que indica un pronóstico favorable. En caso de sección del nervio, su excitabilidad persiste dos a tres días, lapso después del cual desaparece en forma gradual, por lo que esta prueba precede a la reacción de degeneración una semana a 10 días. La respuesta ante el estímulo que se aplica lo valora el examinador de manera visual (mínima respuesta necesaria para producir contracción); en general, las diferencias de 3.5 mA o mayores entre el lado sano y el afectado durante las primeras tres semanas indican un pronóstico inadecuado en cuanto a la recuperación funcional del nervio. Las diferencias menores de 3.5 mA se acompañan de pronósticos funcionales favorables. Esta prueba tiene una elevada frecuencia de resultados positivos y negativos falsos. Prueba de estimulación máxima del nervio: en esta prueba se aplica un estímulo máximo con el estimulador de nervios tipo Hilger, de tal manera que produzca una activación de todas las fibras musculares excitables; la fuerza de esta respuesta se correlaciona con el número de unidades motoras funcionales y el pronóstico. La prueba arroja 12% de resultados falsos negativos y 27% de falsos positivos. Interpretación de la prueba: si la respuesta entre el lado afectado y el normal es similar a los 10 días, existe 88% de retorno completo de la función facial y 12% de regresión parcial. Si, por el contrario, la respuesta está marcadamente disminuida, pero existe, hay 73% de casos con restitución incompleta de la función. Si no hay respuesta, la regeneración es incompleta y tardía, o nula. Electroneuronografía: esta prueba permite obtener información cuantitativa sobre la cantidad de fibras degeneradas en forma distal al sitio de la lesión. Se utilizan electrodos bipolares para estimulación y registro de la actividad. La estimulación se lleva a cabo fuera del agujero estilomastoideo y enfrente del trago, y el registro de los potenciales de suma de los músculos peribucales se ERRNVPHGLFRVRUJ Capítulo 7 si es de 10 mm o menos. En caso de reducción del lagrimeo, se registra como prueba de Schirmer positiva. Las alteraciones en esta prueba implican lesiones del nervio facial en los planos suprageniculado o transgeniculado. Las lesiones infrageniculadas no afectan el lagrimeo. Las unilaterales transgeniculadas pueden causar una reducción bilateral simétrica del lagrimeo; este fenómeno también se observa en individuos sometidos a la sección quirúrgica del ganglio geniculado por neuralgia del nervio petroso superficial. Prueba del reflejo estapedial: el músculo del estribo, inervado por la rama estapedial del nervio facial, se contrae durante la aplicación de estímulos sonoros. Cuando la lesión se encuentra arriba de esta rama no hay reflejo estapedial y se valora mediante impedanciometría. Otra manera de explorar en clínica este reflejo emplea diapasones: primero se usa uno de frecuencia grave para valorar la audición en ambos oídos; si es normal, se utiliza uno de frecuencia aguda y, si se escucha con más intensidad en el sitio de la parálisis, revela lesión del nervio en la rama estapedial o proximal a ésta. Los individuos con lesión del nervio facial en este punto experimentan menor tolerancia al ruido y a la discriminación de la palabra (logoaudiometría). La aparición del reflejo estapedial en la impedanciometría predice una futura recuperación de la función muscular facial. Prueba del gusto (cuerda del tímpano): esta prueba valora los umbrales a la sensación de sabor en diferentes lados de la lengua (aproximadamente a 1 cm de la punta) mediante la estimulación galvánica (electrogustometría). Es una prueba subjetiva, por lo que existe una gran variación. La mayoría de los pacientes presenta umbrales menores de 50 microamperios. Prueba de salivación: tanto las lesiones proximales a la cuerda del tímpano como las directas en ésta alteran la producción y características de la saliva de las glándulas submandibulares. Puesto que esta prueba es poco agradable para el sujeto y técnicamente difícil, su uso no se ha extendido en grado considerable. Existe una atenuación de la secreción salival del lado lesionado y la saliva no sólo es más escasa sino también más espesa. Algunos autores consideran que si la secreción submandibular es menor de 40%, en relación con el lado contralateral, el pronóstico es más grave y el enfermo requiere medidas quirúrgicas. Cuando la secreción salival es mayor de 40% cabe esperar una recuperación espontánea. La función de la glándula submandibular también se valora mediante gammagrafía con tecnecio 99 (4 mCi). Antes de administrarlo se ofrece ácido ascórbico, con el objeto de estimular la secreción salival. Cuando en los primeros 10 días tras el inicio de la parálisis facial los sujetos presentan valores similares en el radio de estimulación secretoria entre ambas glándulas, o mayor secreción en el lado afectado, el pronóstico es favorable y se recomienda un tratamiento conservador de la lesión. Si, por el contrario, se encuentra una falta de respuesta al estímulo secretorio, se considera la posibilidad de instituir tratamiento quirúrgico, y si hay secreción, pero disminuida, puede continuarse con un tratamiento conservador y efectuarse una segunda prueba tres o cuatro semanas después. La especificidad de esta prueba es de 66%. 159 159 160 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 7 efectúa a través de electrodos que se aplican en el surco nasogeniano (electrodos de registro), los cuales transmiten la información a un osciloscopio y la actividad se imprime en un papel de tipo fotográfico. Las amplitudes de los potenciales de sumación, tanto del lado afectado como del sano, se miden de punta a punta (cresta a valle), y la diferencia de amplitud entre éstos corresponde al porcentaje de fibras del nervio que han sufrido degeneración. Para el pronóstico de las lesiones deben tomarse en consideración el porcentaje de degeneración de las fibras y el tiempo transcurrido entre el inicio de la parálisis y la prueba. Interpretación de resultados: 1. Cuando, después de un traumatismo craneoencefálico se presenta más de 90% de degeneración en los primeros seis días, se recomienda una exploración quirúrgica del nervio; en el caso de parálisis faciales inmediatas que alcanzan 90% de degeneración después del sexto día, el pronóstico es favorable y se recomienda tratamiento conservador. 2. En la parálisis facial de tipo Bell, más de 95% de degeneración en los primeros 14 días indica mal pronóstico (figura 7–6). También se debe tener presente que, en individuos en quienes la función facial retorna a la normalidad se puede encontrar actividad electroneuronográfica anormal. Evidencia reciente sugiere que esta prueba no debe tomarse como único criterio para la descompresión quirúrgica, ya que se vincula con una amplia desviación estándar y sólo cuando se combina con el criterio clínico se establece un pronóstico más confiable. Electromiografía: consiste en el registro de potenciales de acción provenientes de fibras musculares activadas en forma eléctrica mediante la colocación de electrodos intramusculares. Tiene una utilidad limitada y los potenciales de desnervación aparecen 14 a 21 días después de la lesión. Interpretación: en la parálisis facial de tipo Bell, la presencia de potenciales de fibrilación, la ausencia de potenciales de acción o la presencia de sólo un grupo muscular activo sugiere mal pronóstico; por otro lado, potenciales motores en cuatro o más grupos musculares son buen indicio. Tiempo de latencia distal: consiste en medir el tiempo para que un estímulo aplicado detrás del ángulo de la mandíbula produzca un potencial de acción en el músculo orbicular de los párpados. Cuando la lesión es más grave, la conducción es más lenta y, por ende, el tiempo de latencia es mayor. Interpretación: cuando el tiempo de latencia es menor de 6 mseg hay recuperación completa del nervio en 92% de los casos. Si es mayor de 10 mseg, la recuperación es incompleta en 77%. Electromiografía evocada intraoperatoria: se utiliza en cirugía para la localización objetiva del sitio de lesión, una vez expuesto el nervio. Esta prueba tiene valor cuando el nervio no ha sufrido degeneración completa y permanecen con bloqueo en la conducción cuando menos 3 a 5% de las fibras nerviosas motoras. Estos potenciales se registran con el mismo equipo utilizado para la electroneuronografía. Cuando el electrodo estimulador llega al sitio de la lesión, desaparecen los potenciales evocados. CAUSAS Existe un gran número de causas que pueden producir parálisis faciales; entre ellas se encuentran los siguientes grupos: Traumáticas 1. Por presión del nervio, con objetos no punzocortantes. 2. Heridas penetrantes (por arma de fuego, cuchillos); producen laceraciones del nervio facial. 3. Fracturas del hueso temporal y mandibulofaciales. 4. Lesiones quirúrgicas (otológicas, neuroquirúrgicas, por operaciones parotídeas y bucofaciales). 5. Traumatismos al nacer. 6. Barotrauma. 7. Bloqueo anestésico del nervio. 8. Daño térmico. Neoplásicas Figura 7–6. Electroneuronografía: se presentan diferentes porcentajes de fibras nerviosas degeneradas, según el valor normal (N) obtenido en el lado de la cara no afectado. Tumores: 1. Parotídeos. 2. Del conducto auditivo externo y oído medio. ERRNVPHGLFRVRUJ Nervio facial Infecciosas 1. Bacterias (otitis medias, agudas, crónicas, otitis externa maligna, petrositis, toxinas tetánicas, sífilis, enfermedad de Lyme, lepra, meningitis y encefalitis). 2. Agentes atípicos: Mycoplasma pneumoniae. 3. Virus (herpes zoster ótico, citomegalovirus, varicela, mononucleosis infecciosa, herpes simple, virus coxsackie, rubeola, influenza, poliomielitis tipo 1, encefalitis y parotiditis; es probable que en este grupo se encuentre la parálisis de tipo Bell). 4. Parásitos (paludismo, mordedura de garrapata). 5. Enfermedades granulomatosas (tuberculosis, sarcoidosis). Congénitas 1. Ausencia de la musculatura facial o distrofia miotónica. 2. Falta de unidades neuromotoras. 3. Osteopetrosis. 4. Síndrome de Mobius. 5. Parálisis facial familiar genética. 6. Parálisis congénita unilateral del labio inferior. Neurológicas 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. Síndrome de Guillain–Barré (parálisis ascendente). Esclerosis múltiple. Miastenia grave. Síndrome del opérculo (lesión cortical en la región facial motora). Enfermedad de Parkinson. Síndrome de Millard–Gubler (lesión mesencefálica que afecta también al tubo corticoespinal y produce parálisis del VI par con hemiplejía contralateral). Síndrome de Bannworth (meningorradiculitis linfocítica). Hipertensión intracraneal. Esclerosis lateral amiotrófica. Hipercinesia facial. Metabólicas 1. Diabetes mellitus B. 2. Hipertiroidismo o hipotiroidismo. Vasculares 1. Accidentes cerebrovasculares. 2. Fístulas del seno cavernoso a la carótida. 3. Periodo posterior a la embolización arterial en el tratamiento de la epistaxis. 4. Seno sigmoideo anómalo. 5. Aneurismas de la arteria carótida interna. Enfermedades del colágeno Vasculares, alérgicas o tóxicas: 1. Policondritis recidivante. 2. Enfermedad mixta del tejido conectivo. 3. Polimiositis. 4. Reticulosis pleomorfa. 5. Granulomatosis de Wegener. 6. Amiloidosis. 7. Periarteritis nudosa. 8. Síndrome de Stevens–Johnson. 9. Intoxicación por plomo. 10. Tétanos de tipo cefálico. 11. Difteria. 12. Parálisis posvacunal (poliomielitis, rabia). 13. Posterior a la aplicación de suero antitetánico. Idiopáticas 1. Parálisis de tipo Bell (probable origen viral). 2. Síndrome de Melkersson–Rosenthal. 3. Síndrome mucocutáneo ganglionar (enfermedad de Kawasaki). CLASIFICACIÓN DE LAS PARÁLISIS FACIALES Spector (1985) propuso una clasificación práctica de las lesiones del nervio facial que considera los siguientes parámetros: 1. Localización anatómica: a) Intracraneal. b) Intratemporal. c) Extracraneal. 2. Causa (cualquiera de los nueve grupos mencionados). 3. Duración de la parálisis: a) Aguda: de uno a 15 días. b) Subaguda: dos a cuatro semanas. c) Crónica: más de cuatro semanas. 4. Función fisiológica: a) Lesiones patéticas. b) Hipercinéticas. 5. Estado de la parálisis: a) Completa. b) Incompleta. 6. Sitio: a) Derecho. b) Izquierdo. c) Bilateral. Este sistema describe el cuadro clínico total que el paciente presenta durante la parálisis. Su uso, junto con el resultado de las pruebas topográficas y electrodiagnósticas, facilita el registro y valoración de las lesiones faciales. Las siguientes constituyen algunas lesiones específicas del nervio facial: ERRNVPHGLFRVRUJ Capítulo 7 3. Del nervio facial (neuromas, cilindromas, schwannomas). 4. De origen otoneurológico (neurinomas del acústico, quistes aracnoideos, meningiomas, gliomas, colesteatomas congénitos, hemangiomas). 5. Varios (tumores metastásicos, higromas quísticos, sarcomas, tumores nasofaríngeos invasivos, teratomas, rabdomiosarcomas, osteopetrosis, histiocitosis H). 161 161 162 Oído, nariz, garganta y cirugía de cabeza y cuello Se cree que la fibrosis que resulta de los hematomas intraneurales no tratados afecta la regeneración correcta de las fibras motoras nerviosas que se dirigen al oído medio, con desviación de algunas de ellas hacia el nervio petroso superficial mayor. Capítulo 7 Fracturas transversales Por lo general, se extienden a través de la cápsula laberíntica del hueso temporal y afectan el vestíbulo. Puede lesionarse el conducto de Falopio en su segmento laberíntico proximal o a lo largo de la pared interna del oído medio. Cuadro clínico: es común identificar hemotímpano, sordera neurosensorial y alteración de la función vestibular ipsolateral a la lesión. El nervio facial se lesiona en 80% de los casos en su porción laberíntica y 20% en la timpánica. Los estudios radiográficos simples, con proyecciones de Stenvers, Towne y Runstrom II, así como la politomografía y la tomografía axial computarizada de alta resolución, pueden detectar las lesiones en el conducto de Falopio en 50 a 60% de las fracturas transversales, pero en un porcentaje bajo de las longitudinalesdebido al curso irregular de sus trazos. Atención de las fracturas Figura 7–7. Fracturas del hueso temporal, transversales y longitudinales. Nótese que el trazo de fractura corre a lo largo de toda la base del cráneo, en forma bilateral (fractura transversal transpetrosa transclinoidea bilateral). FRACTURAS DEL HUESO TEMPORAL La parálisis facial se presenta en 40% de las fracturas transversales y en 20% de las longitudinales que afectan la pirámide petrosa del hueso temporal (figura 7–7). La causa más frecuente de éstas son los accidentes automovilísticos. Las fracturas longitudinales son más comunes que las transversales y los sujetos con parálisis faciales secundarias a fracturas longitudinales ocurren en proporción de 6:1 respecto de las fracturas transversales. Fracturas longitudinales Estas fracturas cruzan sobre el techo del oído medio, entre la cápsula laberíntica y el tejido óseo neumático adyacente. En clínica se caracterizan por la presencia de otorragia, en ocasiones con salida de líquido cefalorraquídeo, fractura de la pared posterosuperior del conducto auditivo externo y sordera de tipo conductivo. La lesión del nervio facial, por lo general, es distal al ganglio geniculado o en éste. Fisch (1979) ha señalado que, en 53% de los casos, la lesión se debe a un hematoma intraneural, en 28% a una sección completa del nervio facial, y en 18% a compresión del nervio por la presencia de espículas o fragmentos óseos. Las parálisis faciales postraumáticas incompletas tienen buen pronóstico y su tratamiento es conservador. Cuando la parálisis es completa, deben solicitarse pruebas electrodiagnósticas y topográficas, así como estudios radiográficos que ayudan a determinar si se requiere o no exploración quirúrgica, y la vía indicada para la descompresión. En caso de que el individuo requiera medidas quirúrgicas, deben efectuarse hasta que sus condiciones generales médicas lo permitan. En algunos casos, la operación tardía (meses después de la lesión) es útil por la posibilidad que ofrece de descomprimir el nervio, eliminar espículas óseas y, en casos más graves, aplicar injertos de nervio auricular mayor o sural, si bien no es lo ideal. Debe tenerse presente que la intervención temprana siempre ofrece mejores resultados funcionales, sobre todo cuando el nervio ha alcanzado 90% o más de degeneración durante los primeros seis días tras el inicio de la parálisis. En fracturas longitudinales, la vía quirúrgica recomendada es la fosa media; es necesario remover los fragmentos de hueso, con incisión sobre el epineurio; en otras ocasiones es preciso extirpar el ganglio geniculado y realizar una anastomosis terminoterminal o un injerto de nervio. Se sugiere aplicar una grapa sobre el nervio petroso superficial mayor para reducir las posibilidades de que se forme una falsa vía durante la regeneración del nervio. En fracturas transversales se puede exponer el curso intratemporal del nervio facial a través de la vía translaberíntica o transmastoidea. Se libera el nervio del conducto de Falopio, con remoción de la porción dañada, y se aplica un injerto de nervio (para las suturas se recomienda nailon 10–0). A continuación se recanaliza el nervio, para lo cual se crea un nuevo conducto óseo entre el agujero estilomastoideo y el conducto auditivo interno. ERRNVPHGLFRVRUJ Nervio facial LESIONES TRAUMÁTICAS POSQUIRÚRGICAS BAROTRAUMA Las parálisis faciales secundarias a barotrauma son raras y se deben a la dificultad para equilibrar las presiones del oído medio durante el descenso, en el caso de buceadores, o el ascenso, en vuelos aéreos. Cuando las presiones en oído medio sobrepasan los 60 mm H2O, pueden comprimir al nervio facial sobre porciones dehiscentes del conducto de Falopio y causar así neuropatía isquémica. Las lesiones aparecen después de llegar a la superficie y se resuelven de forma espontánea al equilibrar la presión en el oído medio. Profilaxis: uso de maniobras de politzerización (insuflación de la trompa de Eustaquio); algunos casos requieren miringotomía, con o sin aplicación de cánulas de ventilación. NEUROPATÍA HIPERTRÓFICA DEL NERVIO FACIAL Consiste en un engrosamiento del nervio, que en términos histológicos se caracteriza por la formación de bul- bos en forma de cebolla, que resulta de la proliferación concéntrica de las células de Schwann alrededor de los axones. Por lo general, la neuropatía hipertrófica es difusa y puede presentarse en neuropatías desmielinizantes, como las sensorimotoras hereditarias (enfermedad de Charcot–Marie–Tooth, enfermedad de Déjérine–Sottas), neuropatías desmielinizantes adquiridas; y neuropatías diabética y leprosa. Otras causas son de origen traumático, además de compresión local, atrapamiento del nervio, inflamaciones, defectos focales en la barrera perineural y disgregaciones focales de la barrera vasonerviosa. Se cree que la formación de bulbos en forma de cebolla es secundaria a un proceso de remielinización. El uso de esteroides sistémicos es exitoso algunas veces para inducir remisión y la simple descompresión del nervio mejora casi siempre el estado del paciente. Esta enfermedad debe incluirse en el diagnóstico diferencial de tumores primarios del nervio facial, sobre todo cuando se detectan bulbos en un estudio histopatológico. TUMORES DEL NERVIO FACIAL La malformación tumoral, primaria o secundaria, causa el 5% de los casos de parálisis facial periférica. Entre los tumores primarios más frecuentes se encuentran: a) Neuromas faciales: representan menos del 1% de los tumores intrapetrosos del nervio facial. b) Hemangiomas: pueden ser capilares, cavernosos y mixtos. c) Lipomas: son muy raros; se presentan en la cavidad mastoidea y se describen como masas ovoides a lo largo del segmento vertical del nervio facial. d) Paragangliomas (glomus facial): surgen en el canal de Falopio y aparecen en la forma de masas retrotimpánicas y en ocasiones en el conducto auditivo externo; producen parálisis facial y acúfeno pulsátil. Muchas veces, los tumores primarios benignos del nervio facial se confunden con parálisis facial idiopática y se caracterizan por paresia facial progresiva de varias semanas o meses de evolución, originada por compresión gradual del nervio por la tumoración; en otras ocasiones, la parálisis facial es recurrente y se cree que mejora porque el tumor se extiende a través del conducto óseo de Falopio erosionado, lo cual abate la presión del nervio intraductal. Se dice que una parálisis de Bell que no muestra signos de recuperación en las primeras 14 a 20 semanas no es en realidad parálisis de Bell. Por otro lado, los tumores pequeños también pueden permanecer asintomáticos por periodos prolongados. Cuando se originan en la porción mastoidea del nervio, algunas veces se acompañan de pólipos aurales. Otros signos de posible invasión neoplásica son: presencia de dolor, hemiespasmo facial u otras neuropatías craneales relacionadas. Babin (1981) señala la importancia de solicitar estudios radiográficos (politomografía) en todos los casos atípicos de parálisis de Bell, así como tomografía axial compu- ERRNVPHGLFRVRUJ Capítulo 7 Es posible que ocurran de manera inadvertida durante la operación otológica en 0.6 a 3.7% de los pacientes. Los sitios más frecuentes de lesión iatrogénica son los segmentos timpánico y mastoideo del nervio facial, sobre todo en la región del nicho de la ventana oval; en oídos con agenesia es más común lesionar la porción distal del segmento mastoideo. En timpanoplastias o estapedectomías es más probable la lesión del segmento timpánico, sobre todo si existen dehiscencias del conducto de Falopio. Al abordar una fosa media, el nervio es más susceptible de lesionarse en su porción laberíntica. En parálisis completas con más de 90% de degeneración (electroneuronografía), o respuesta mínima en la prueba de estimulación máxima del nervio con 10 mA, durante los primeros seis días, se sugiere una revisión quirúrgica inmediata. Por lo general se retira el segmento traumatizado y se aplica un injerto libre de nervio auricular mayor o sural que puede vascularizarse, aunque en ocasiones según sean los hallazgos, la descompresión del nervio mediante una incisión epineural es un tratamiento adecuado. También puede aparecer parálisis facial días después de una intervención quirúrgica de oído. Se presenta con una incidencia de 1:1 000 casos y existe evidencia que orienta hacia una posible reactivación del virus del herpes simple tipo 1 (VHS–1), ya que ésta se encuentra bien documentada después de la descompresión del nervio trigémino. Por lo general aparece a las 48 h luego de la operación y Bonkowsky (1998) ha señalado la presencia del genoma del VHS–1 en cuatro de cinco individuos con esta complicación. El tratamiento consiste en la administración de antivirales (aciclovir, 20 mg/kg/día por cinco días y tratamiento esteroideo a base de prednisona). 163 163 164 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 7 tarizada de alta resolución y resonancia magnética con inyección de gadolinio. Jackson (1980) ha recomendado la exploración quirúrgica del nervio, con base en la historia clínica, y cuando todas las pruebas diagnósticas no han mostrado la presencia de tumor. El tratamiento de los tumores primarios del nervio facial consiste en su extirpación quirúrgica, con reconstrucción del nervio con anastomosis terminoterminales o bien con injertos autógenos de nervio auricular mayor o sural. Cuando no es posible identificar el nervio en un plano intracraneal, se recomienda una anastomosis hipoglosofacial. Un estudio transoperatorio, mediante cortes congelados de la porción del tumor extirpada, reduce al mínimo las recurrencias. En forma reciente Wilkinson (2011) sugirió un algoritmo para su tratamiento: 1. Tumor estable con parálisis facial menor de grado 3 de la clasificación de House–Brackman: mantener en observación. 2. Tumor que aumenta de tamaño confinado a un área ósea y que empeora la parálisis facial: realizar descompresión ósea. 3. Tumor que aumenta de tamaño sin confinarse al hueso en el ángulo pontocerebeloso o la fosa media: aplicar radiación estereotáctica. 4. Tumor que aumenta de tamaño con parálisis facial de grado 4 o mayor, con síntomas compresivos o radiación estereotáctica fallida: practicar resección con injerto de nervio. OTITIS MEDIAS AGUDAS Y CRÓNICAS Representan 5.5% de las parálisis faciales intratemporales. El mecanismo mediante el cual las otitis medias pueden causar parálisis facial tiene la siguiente secuencia: a) Afectación directa del nervio facial por el proceso infeccioso. b) Desmielinización del nervio facial secundaria a la presencia de toxinas. c) Isquemia del nervio por trombosis secundaria. Las lesiones secundarias a una otitis media aguda ocurren sobre todo en niños y su tratamiento se basa en miringotomía para descomprimir el oído medio, antibióticos y esteroides. En caso de observarse más de 90% de degeneración de las fibras nerviosas motora en la electroneuronografía, o una respuesta mínima en la prueba de estimulación máxima del nervio, se recomienda su descompresión quirúrgica por vía transmastoidea. En otitis medias crónicas, sobre todo con la presencia de colesteatoma, se descomprime el nervio facial por la misma vía, tan pronto sea obvia la parálisis. SÍFILIS Tanto la sífilis primaria como la secundaria pueden acompañarse de parálisis facial y lesiones cocleovestibulares. Miehlke (1973), al practicar una craneotomía en un paciente con parálisis facial por sífilis secundaria, encontró a lo largo de todo el segmento meatal del nervio edema con ingurgitación vascular y extensas zonas de adherencias aracnoideas. En general, el pronóstico de estas lesiones es bueno después del tratamiento médico (penicilina benzatínica, con o sin esteroides). ENFERMEDAD DE LYME Es un síndrome clínico de infección por espiroquetas (Borrelia burgdorferi) que se transmite por la picadura del insecto Ixodes dammini. Lyme es un pueblo del estado de Connecticut, EUA, en donde se detectó por primera vez esta enfermedad. En un estudio de 314 pacientes, Steere (1983) encontró como característica de este proceso, la presencia de un eritema crónico migratorio, acompañado de síntomas generales (fiebre, astenia, adinamia), mialgias y linfadenopatía. Otros síntomas descritos son dolor faríngeo, 17%; vértigo, 5%; otalgia, 4%; asimismo; en forma tardía pueden presentarse lesiones neurológicas (meningitis aséptica, radiculitis, ataxia cerebelosa, mielopatías, afectación de nervios craneales, entre ellos el VII par), cardiacas y artríticas. Las lesiones del nervio facial son unilaterales o bilaterales y se presentan en 4.5% de los pacientes. Esta entidad se diagnostica mediante pruebas de inmunoabsorbencia (ELISA); hasta 90% de los individuos tiene títulos elevados de IgM e IgG. Se trata con antibióticos. Las tetraciclinas son el antibiótico de elección para la terapéutica temprana de esta enfermedad, ya que reducen el riesgo de complicaciones tardías (250 mg cuatro veces al día por 20 días). Otros antibióticos que pueden administrarse son la penicilina y la eritromicina. El pronóstico de las lesiones del nervio facial es bueno, con la recuperación total de la función después del tratamiento. HERPES ZOSTER ÓTICO (SÍNDROME DE RAMSAY–HUNT) Representa 6.8% de las causas de parálisis faciales intratemporales. La enfermedad se presenta en adultos de 20 a 30 años y de 50 a 70 años de edad. Tiene una incidencia de 5 casos por 100 000 habitantes por año y representa la segunda causa más frecuente de parálisis facial aguda. Se caracteriza por la presencia de vesículas herpéticas en pabellón auricular, conducto auditivo externo y, con menor frecuencia, paladar blando y cara. Por lo general se inicia con otalgia intensa seguida en pocos días de erupción vesicular y la parálisis facial; además, puede haber hipoacusia, acúfeno y vértigo; la presencia de este último síntoma se relaciona con un pronóstico malo en cuanto a la recuperación funcional del nervio. La degeneración de las fibras nerviosas producida por el herpes zoster es mucho más grave que la observada en la parálisis de Bell. Según Fisch (1972), se encuentra con más frecuencia entre el ganglio geniculado y el agujero meatal del conducto de Falopio. Furuta (2012) ha detectado en ERRNVPHGLFRVRUJ Nervio facial ALTERACIONES CONGÉNITAS Las anomalías del desarrollo del nervio facial se relacionan con alteraciones de la ventana oval y el estribo, dado que estas estructuras provienen del segundo arco branquial. Cuando hay múltiples defectos congénitos, como microtia, microdomía hemifacial y sindactilia, el diagnóstico de parálisis facial congénita es obvio y tan sólo necesita confirmarse. Por otro lado, en recién nacidos con equimosis periauriculares, hemotímpano y parálisis facial es obvio el diagnóstico de una lesión adquirida del VII par. En general, la frecuencia de parálisis facial en el recién nacido es de 0.23% (figura 7–8). Síndrome de Möbius Es una anomalía congénita no progresiva consistente en parálisis facial bilateral y lesión unilateral o bilateral del motor ocular externo (VI par). Su causa es imprecisa; se han sugerido una hipoplasia en el sistema nervioso central y un defecto primario del músculo con degeneración secundaria del nervio. Debe establecerse el diagnóstico diferencial con la parálisis facial congénita secundaria al efecto de fármacos teratógenos ingeridos durante el embarazo. Los estudios histopatológicos del hueso temporal en estos pacientes han mostrado un tamaño y trayecto normales del nervio en el conducto auditivo interno, con disminución notoria de las fibras nerviosas en su porción horizontal y abundante tejido conectivo, y reaparición de más fibras en su porción vertical. En el estudio de lesiones del facial en el periodo neonatal hay que determinar si: a) El nervio es estimulable. b) Existe degeneración por traumatismo o hipodesarrollo de las fibras motoras. c) La lesión es o no progresiva; en caso afirmativo debe presuponerse una causa de tipo adquirida (traumática), por lo que se recomienda un estudio electrodiagnóstico y topográfico del nervio facial y respuestas auditivas del tallo cerebral, en las que se han descrito una disminución de la latencia y amplitud de las ondas del complejo I–V. PARÁLISIS CONGÉNITA UNILATERAL DEL LABIO INFERIOR Se cree que es de origen viral y se acompaña de defectos cardiacos. Existe una deficiencia del músculo depresor del labio inferior relacionada con una lesión en el tallo cerebral. Cuando esté indicada la operación, se recomiendan los injertos libres de nervio (auricular mayor o sural). Figura 7–8. Parálisis facial postraumática (izquierda) en un recién nacido. ERRNVPHGLFRVRUJ Capítulo 7 estos pacientes grandes concentraciones de defensinas α, que son péptidos que se expresan tanto en neutrófilos como en linfocitos y monocitos y que tienen una actividad en contra de estos virus. El tratamiento puede ser médico o quirúrgico. La operación está indicada cuando el nervio alcanza 90 a 94% de degeneración (electroneuronografía) o hay una respuesta apenas perceptible durante la estimulación máxima (10 mA). Algunos medicamentos nuevos, como el aciclovir, son eficaces para reducir el tiempo de evolución de esta enfermedad. 165 165 166 Oído, nariz, garganta y cirugía de cabeza y cuello Hipercinesia facial Es la presencia unilateral o bilateral de contracciones incontrolables e involuntarias de la musculatura facial. Estos espasmos pueden persistir incluso durante el sueño. Las formas más comunes son las siguientes: Capítulo 7 a) Hemiespasmo del facial. b) Blefaroespasmo. c) Movimientos relacionados con una parálisis facial anterior. d) Síndrome de Parkinson. e) Mioquimia facial. Se han descrito diversas técnicas quirúrgicas para el tratamiento de estas lesiones. En el hemiespasmo del facial y el blefaroespasmo se ha sugerido extirpar todas las fibras que inervan el músculo orbicular de los párpados y las ramas superiores bucales, con obtención de resultados satisfactorios a largo plazo, alivio del 50% o mayor, 80% de los pacientes con hemiespasmo del facial y 67% con blefaroespasmo. Sin embargo, los resultados no han sido del todo satisfactorios en casos con atetosis, enfermedad de Parkinson y mioquimia facial (trastorno relacionado con esclerosis múltiple y tumores pónticos). Otro tratamiento que ha arrojado resultados excelentes en el control del hemiespasmo del facial es la descompresión microvascular de nervio facial, en la que se aplica un pedazo de músculo o silicona entre el nervio y una de las arterias cerebelosas que a menudo lo comprimen. Los resultados han proporcionado hasta un 88% de mejoría clínica. Otros autores dividen la raíz del nervio facial en forma longitudinal. Otro tratamiento consiste en administrar toxina botulínica con dosis iniciales para el tratamiento del blefaroespasmo de 25 a 30 unidades. En la región peribucal se pueden administrar 2.5 U de toxina. Puede existir un intervalo entre la aplicación de la toxina y el alivio del espasmo de dos días. Los individuos que reciben dosis mayores de 50 U desarrollan blefaroptosis y diplopía transitorias. La toxina botulínica se une a la porción extracelular de la placa terminal del nervio, de tal modo que se inhibe la transmisión en la unión neuromuscular. Parálisis facial de origen metabólico Se han descrito varios casos de parálisis facial relacionada con hipovitaminosis A y seudotumor cerebral. Quincke describió este último o por primera vez en 1893 y consiste en una elevación de la presión intracraneal sin la presencia de un proceso focal o edema agudo secundario a meningitis o encefalitis. Se han relacionado con este padecimiento diversos trastornos de tipos endocrino, metabólico, alérgico, traumático e idiopático, con identificación de edemas cerebrales intracelular e intercelular generalizados. ANEURISMAS DE LA ARTERIA CARÓTIDA INTERNA Los aneurismas de la porción intrapetrosa de la carótida interna pueden producir parálisis faciales aisladas. Se han publicado alrededor de 35 casos en las publicaciones médicas. En 25% de los sujetos puede encontrarse una masa vascular en oído medio que puede ocasionar también epistaxis, a través de la arteria caroticotimpánica por la trompa de Eustaquio. Al parecer, estos aneurismas son congénitos. Siempre que se sospeche una masa vascular, debe solicitarse angiografía carotídea. SARCOIDOSIS (SÍNDROME DE HEERFORDT) Una variante de ésta es la fiebre uveoparotídea, que se distingue por parotiditis, uveítis y parálisis de nervios craneales, sobre todo el facial. La parotiditis es bilateral, no supurativa, indolora y de curación espontánea; se presenta en 6% de las personas con sarcoidosis comprobada. La uveítis suele ser bilateral (33% de los casos). En 5% de los pacientes puede haber afectación neurológica, con parálisis facial secundaria a infiltración granulomatosa del tejido nervioso. Diagnóstico: hay datos de títulos altos de enzima convertidora de angiotensina, eosinofilia en 20% de los casos, hipercalcemia, e hiperglobulinemia (50 a 75%). PPD es negativo y la reacción de Kveim es positiva en 50 a 80% de los pacientes; sin embargo, esta prueba se utiliza más con fines de investigación. Se trata con esteroides (prednisona, 1 a 2 mg/kg en dosis iniciales, con reducción gradual). AMILOIDOSIS DEL NERVIO FACIAL Se han notificado casos de amiloidosis primaria localizada en el nervio facial en individuos con sialoadenitis crónica de la glándula parótida. La resonancia magnética con técnica de supresión de grasa ayuda a detectar anomalías de este nervio. SÍNDROME DE MELKERSSON–ROSENTHAL Melkersson describió este trastorno en 1928 y consiste en crisis recurrentes de parálisis facial unilateral o bilateral acompañadas de edema angioneurótico, sobre todo alrededor de los labios y con lengua plegada. Se observan formas incompletas de este síndrome; cuando se presenta sin parálisis facial se denomina queilitis granulomatosa. La lengua plegada se transmite con carácter autosómico dominante de penetrancia variable. Lo más común es que este síndrome se presente en niños y jóvenes menores de 20 años. Su causa es incierta: existe una alteración parasimpática a lo largo de la distribución del nervio facial. El tratamiento de este trastorno es similar al de la parálisis tipo Bell. Kettle (1957) ha señalado resultados satisfactorios en 11 de 13 casos con la descompresión del nervio facial. ERRNVPHGLFRVRUJ Nervio facial 167 167 PARÁLISIS FACIAL BILATERAL Diagnóstico Es una entidad clínica rara. Entre sus causas figuran las siguientes: El estudio de estos pacientes debe incluir lo siguiente: PARÁLISIS IDIOPÁTICA DEL FACIAL (PARÁLISIS DE BELL) Representa la causa más frecuente de parálisis facial intratemporal (40% de los casos). Tiene una incidencia de 20 a 30 casos por 100 000 habitantes. Charles Bell la describió por primera vez en 1829. Se presenta en forma súbita y ocurre a cualquier edad; no obstante, tiende a ser más frecuente entre el tercer y quinto decenios de la vida. Aunque hasta el momento se desconoce su origen, pruebas crecientes indican que puede tratarse de una neuritis de origen viral. Se han encontrado títulos elevados de anticuerpos antivirales, en especial contra herpes simple tipo 1, Epstein–Barr, citomegalovirus, influenza A–B y adenovirus. El diagnóstico de esta entidad se establece por exclusión. También se ha relacionado con la reactivación posterior a una infección en las vías respiratorias superiores, a un estado de estrés o a enfriamientos súbitos, del virus herpes simple y zoster que pueden encontrarse en un estado latente en el ganglio geniculado. En el plano histopatológico se encuentra en los estadios tempranos una reacción inflamatoria aguda, con desmielinización a través del nervio sin afectación axonal. En forma experimental se han producido en conejos y ratones lesiones parecidas en la raíz del nervio trigémino, después de la inoculación intranasal del herpes simple. La endotelina, que es un péptido formado por 21 aminoácidos y que tiene un gran poder vasoconstrictor, se ha encontrado incrementada en personas con parálisis de Bell y se cree que contribuye a la patogénesis al afectar la microcirculación en el nervio y promover una isquemia secundaria. 1. Audiometría completa. 2. Electronistagmografía (sobre todo si hay antecedentes de vértigo o inestabilidad) 3. Radiografías de hueso temporal (Schüller, Stenvers y transorbitaria de Guillén) 4. Tomografía axial computarizada, con aplicación intratecal de aire, si la parálisis fue gradual y no súbita, o se acompaña de espasmos faciales, para valorar los conductos auditivos internos y la región pontocerebelosa. 5. Respuestas evocadas de tallo cerebral en quienes se sospeche una afectación central concomitante a la parálisis facial periférica. Shanon (1985) detectó alteraciones en seis de 27 casos estudiados consistentes en: a) Prolongación del tiempo de transmisión (onda I–V), en forma unilateral o bilateral b) Disminución de la amplitud de la onda II en el lado afectado. Ambos hallazgos desaparecen con la recuperación clínica de la parálisis 6. Determinación de anticuerpos antivirales (herpes simple y zoster, citomegalovirus), en especial en casos de investigación. 7. Topodiagnóstico de la lesión. Este estudio es fundamental (prueba de Schirmer, impedanciometría, gustometría, cantidad de la secreción salival submandibular, con análisis de electrólitos y pH o gammagrafía de la misma con 99Tc). Fisch (1981) observó, en casi todos los pacientes con parálisis de Bell, que la lesión del nervio facial se encontraba en el agujero meatal (94%), junto al conducto auditivo interno, y es análogo al agujero estilomastoideo. Al parecer, en condiciones normales las fibras del nervio están comprimidas en este sitio por un ligamento fibroso; este lugar representa el punto más estrecho del conducto de Falopio (mide 0.61 mm). El edema de las fibras del facial y sus vasos lo estrangula a menudo en el agujero meatal. 8. Pruebas electrodiagnósticas. Se recomienda efectuarlas cada tercer día durante las dos primeras semanas de iniciada la parálisis. Sus resultados (diferencia mayor de 3.5 mA en la prueba de estimulación del nervio, mínima respuesta ante la estimulación máxima de éste con 10 mA, o 90 a 95% de degeneración de las fibras en las primeras dos semanas, medida por electroneuronografía) norman la conducta a seguir en cuanto al tratamiento quirúrgico, en caso de presentarse las alteraciones descritas. Cuadro clínico y pronóstico En general, en sujetos con parálisis facial incompleta la recuperación es total, sin deficiencias funcionales. Los siguientes factores se relacionan con un mal pronóstico: ERRNVPHGLFRVRUJ Capítulo 7 1. Congénitas: síndrome de Möbius, síndrome de Poland, administración de talidomida durante el embarazo, distrofia fascioescapulohumeral. 2. Traumáticas. 3. Infecciosas: enfermedad de Lyme, otitis medias, infección por virus de Epstein–Barr, citomegalovirus, poliomielitis, Mycoplasma pneumoniae, botulismo, tétanos, meningitis, encefalitis viral, síndrome de inmunodeficiencia adquirida. 4. Neurológicas: encefalomielitis, esclerosis múltiple, hipertensión intracraneal, síndrome de Guillain–Barré. 5. Metabólicas: diabetes, porfiria. 6. Neoplásicas: leucemias, linfomas, neurofibromatosis tipo II. 7. Iatrogénicas: embolización. 8. Otras: síndrome de Stevens–Johnson, síndrome de Melkerson–Rosenthal, toxicidad a etilenglicol. 9. Idiopáticas (Smith, 1998). 168 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 7 1. Falta de datos de recuperación en los primeros dos a cuatro meses. 2. pH salival igual o menor de 6.2. 3. Más de 60 años de edad. 4. Enfermedades vasculares concurrentes (hipertensión, vasculopatía periférica). 5. Presencia de diabetes mellitus. 6. Enfermedades neuropsiquiátricas. 7. Embarazo. 8. Parálisis recurrentes. 9. Presencia de otalgia intensa. 10. Intolerancia al ruido. 11. Inicio lento (sospechar otras causas) Existen diferentes tipos clínicos de parálisis de Bell: recurrente, familiar y relacionada con el embarazo; Yanagihara (1984) elaboró los siguientes grupos clínicos: 1. Parálisis unilateral no recurrente (94% de los casos). 2. Unilateral recurrente (2.1%). 3. Parálisis bilateral simultánea (1.0%). 4. Bilateral no simultánea (menos del 1%). 5. Bilateral alternante (2.7%). 6. Bilateral recurrente (0. 1). Se ha observado que las parálisis simultáneas de tipo bilateral afectan más a los varones, en tanto que la recurrente unilateral es más frecuente en mujeres. En el resto de los tipos no se ha encontrado predilección por algún género. La incidencia de parálisis familiar tipo Bell es baja, representa 4% de los casos y se vincula con una herencia autosómica dominante de baja penetrancia, posiblemente en relación con genes en el brazo corto del cromosoma 6. Tratamiento Casi 85% de los individuos con parálisis facial de Bell experimenta una recuperación completa de la función; el resto presenta secuelas por la degeneración parcial o total de las fibras nerviosas, ya que el edema alrededor del axón impide la adecuada nutrición de las porciones más distales del nervio. Hasta el momento, las pruebas electrodiagnósticas ayudan a determinar si la lesión del nervio es o no una neuropraxia; infortunadamente, no existe tal información en axonotmesis o neurotmesis. Esta situación ha creado esquemas de tratamiento controvertidos. En un estudio de 1 011 pacientes con parálisis de Bell no tratados, Pettersen (1980) encontró que 84% tuvo una recuperación funcional adecuada, con función normal en 71% y secuelas mínimas en 13%. Sólo 4% de los casos tuvo secuelas graves con asimetría facial y sincinesia. El autor considera que el tratamiento depende de los resultados del topodiagnóstico y el electrodiagnóstico; en la fase aguda de la enfermedad se sugiere la administración de esteroides y antivirales como el aciclovir, ya que éstos acortan el periodo de recuperación del nervio. El esquema recomendado incluye lo siguiente: Parálisis faciales incompletas: se aconseja vigilar de modo estrecho al paciente bajo tratamiento corto con esteroides (prednisona, 1 mg/kg/día durante cinco días, mediante un esquema de reducción durante otros cinco días, junto con el suministro de aciclovir). Parálisis faciales completas: si las pruebas electrodiagnósticas sugieren sólo la existencia de neuropraxia, hay que recordar que éstas deben efectuarse cada tercer día durante las primeras dos a tres semanas. Se pueden administrar esteroides como la prednisona (1 mg/kg/día durante 10 días), con institución posterior de un esquema de reducción; en lugar de prednisona pueden suministrarse dexametasona (4 mg cada 6 h durante siete días, seguido de un esquema de reducción) o prednisolona (50 mg). Los fármacos que pueden administrarse de forma simultánea son: ácido nicotínico, pentoxifilina (derivado de las xantinas) y soluciones hiperosmolares de tipo dextrán, así como antivirales como aciclovir, famciclovir y ribavirina. El uso de lipoprostaglandinas como la E1 ha demostrado mejorar la circulación del nervio facial, por lo que su efecto terapéutico es comparable con el de esteroides. Si las pruebas electrodiagnósticas detectan grados críticos de degeneración del nervio, se sugiere su descompresión quirúrgica a la brevedad posible. Cuando la prueba de lagrimeo está intacta (lesión distal al ganglio geniculado) y la audición es útil, se descomprime el nervio del proceso cocleariforme al agujero estilomastoideo por vía transmastoidea. Cuando se advierte durante el procedimiento que también existe edema proximal al proceso cocleariforme, se descomprime el resto del nervio a través de la fosa media. Una prueba de Schirmer alterada (disminución del lagrimeo) indica que la lesión es proximal al ganglio geniculado o transgeniculada; por lo tanto, descompresión del nervio debe efectuarse por vía translaberíntica, cuando el laberinto no es funcional; o combinada (transmastoidea y por la fosa media) si la audición es útil. Algunas complicaciones de la descompresión quirúrgica del nervio incluyen: a) Mayor daño al nervio por traumatismo quirúrgico inadvertido. b) Fístulas con escape de líquido cefalorraquídeo. c) Daño del oído medio (cadena osicular). d) Lesión a estructuras del oído interno. Hay que mencionar que, en general, cada vez suscita menos optimismo la descompresión total del nervio facial, debido a la morbilidad inherente del procedimiento y los resultados obtenidos de escasa relevancia estadística, en comparación con tratamientos más conservadores; sin embargo, la descompresión quirúrgica también ha reducido la cifra de pacientes con secuelas por degeneración del nervio; el autor considera que la descompre- ERRNVPHGLFRVRUJ Nervio facial TÉCNICA DE DESCOMPRESIÓN DEL NERVIO FACIAL colocación del retractor de Urban–House o de Fisch. 9. Identificación del nervio petroso superficial mayor y la arteria meníngea media que emerge a través del agujero espinoso en la región anterior de la fosa media. 10. Mediante el microscopio quirúrgico se fresa el hueso que cubre al nervio petroso superficial mayor (estudios anatómicos realizados por el autor han demostrado que es necesario fresar, en promedio, 0.5 a 1 mm para llegar al ganglio geniculado, que en 14% de los casos es superficial). 11. Una vez identificado el ganglio geniculado, se fresa el conducto auditivo interno para descubrir así la primera porción del nervio facial. Se expone además la porción laberíntica del nervio, con el cuidado de no lesionar la cóclea (que se encuentra anteromedial) o el conducto semicircular superior, que se halla detrás. En la porción más externa del campo se ubica el tegmen timpani (figura 7–9); una vez expuesto el nervio se abre su vaina perineural mediante una incisión longitudinal, para lo cual deben utilizarse bisturíes muy finos, como los que se usan en queratotomías. Una vez realizado lo anterior, se coloca un pedazo de fascia temporal sobre el nervio. 1. En caso de sección o tumoración del nervio, se extirpa la porción afectada y se aplica un injerto VÍA DE LA FOSA MEDIA (PRIMERA PORCIÓN DEL FACIAL) 1. Afeitar el cabello. 2. Anestesia general con ventilación controlada. 3. Paciente en decúbito supino, con el oído por operar hacia arriba. 4. El cirujano se sienta a la cabecera del paciente, de tal manera que pueda emplear el microscopio quirúrgico durante la intervención. 5. Incisión de piel y músculo temporal en forma de U, con base inferior en la raíz del cigoma. La porción horizontal de la incisión en dirección anteroposterior se localiza 5 cm arriba del cigoma (técnica de Clerc y Batisse). House (1961) describe una incisión vertical de 8 cm de longitud, 1 cm enfrente del trago y los últimos 3 cm de la incisión con una ligera inclinación posterior; el músculo temporal se corta de la misma manera. 6. Aplicación de retractores de garra tipo Weitlander. 7. Fresado sobre un área rectangular de 5 por 6 cm inmediatamente encima del cigoma, de tal manera que la línea vertical posterior de éste se encuentre a nivel de la pared posterior del conducto auditivo externo. Este fragmento de hueso se retira para aplicarlo de nueva cuenta al final de la operación como injerto óseo libre. 8. Se levanta la duramadre con mucho cuidado sobre la superficie interna de la escama del hueso temporal y el techo de su porción petrosa, previa Figura 7–9. Dibujo que muestra la descompresión del nervio facial en sus tres porciones. La primera se descomprime a través de la fosa media y la segunda y tercera por vía transmastoidea. Se ha logrado el nervio petroso superficial mayor (NPSM). ERRNVPHGLFRVRUJ Capítulo 7 sión segmentaria o total es útil en el tratamiento de estos enfermos. En la parálisis facial es muy importante el cuidado de los ojos. Deben aplicarse pomadas oftálmicas inertes o lágrimas artificiales para protegerlos contra la resequedad. El autor ha obtenido resultados satisfactorios con la aplicación de tela adhesiva delgada en los párpados, superior e inferior, tratando de acercarlos entre sí lo más posible; pese a ello, en queratitis por exposición se recomienda conservar el ojo cerrado mediante un parche externo y aplicar soluciones oftálmicas para mantener húmedo el globo ocular. En fecha reciente, para la prevención de sincinesias, se ha sugerido la vincristina (planta alcaloide) que es un agente quimioterapéutico capaz de detener la mitosis en la división celular en la metafase. Posterior al daño del nervio facial, se puede inyectar vincristina con la intención de bloquear en forma parcial la reinervación de los músculos faciales de la porción media de la cara y el músculo platisma, con el fin de incrementar las posibilidades de recuperación del cierre del globo ocular con el párpado y disminuir los movimientos sincinéticos no deseados de los músculos faciales. 169 169 170 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 7 libre tomado del nervio auricular mayor o el safeno externo. 2. Se recomienda seccionar y ligar el nervio petroso superficial mayor. 3. El conducto auditivo interno se cierra aplicando músculo temporal tomado del campo operatorio. 4. Se coloca otra vez la escama del temporal retirada al inicio de la intervención, a modo de injerto libre. 5. La herida se cierra por planos, dejando un drenaje de Penrose sobre la porción inferior de la herida quirúrgica. 6. Puede o no colocarse vendaje compresivo en la cabeza durante dos días, después de los cuales también se retira el drenaje (Penrose). VÍA TRANSLABERÍNTICA A través de esta vía se pueden exponer el ángulo pontocerebeloso, el conducto auditivo interno y la primera porción del nervio facial. Es la elección en pacientes con hipoacusias graves. Técnica 1. Incisión retroauricular. 2. Corte del periostio alrededor del conducto auditivo externo. 3. Elevación del periostio. 4. Colocación de retractores. 5. Mastoidectomía. 6. Esqueletonización del seno lateral. 7. Aticotomía. 8. Fresado sobre el denso hueso laberíntico (conductos semicirculares posterior, superior y lateral). Durante este paso debe tenerse especial cuidado de no lesionar el nervio facial. 9. Abertura del vestíbulo. 10. Mediante una fresa de diamante se expone al conducto auditivo interno y, con ello, la primera porción del conducto del facial. 11. Se corta la duramadre y se deja salir el líquido cefalorraquídeo. 12. Se identifica el nervio facial, que se encuentra en la porción superior del conducto y discurre en forma oblicua hacia delante y fuera. Por debajo y detrás de éste se hallan las dos divisiones del nervio vestibular; el nervio coclear también se encuentra debajo del facial, proyectado en forma oblicua y externa. 13. El resto del nervio facial (segunda y tercera porciones) también pueden descomprimirse hasta su salida a través del agujero estilomastoideo. 14. La operación en el nervio facial depende del tipo de lesión que se encuentre; en la descompresión sólo se corta la vaina perineural. 15. Para evitar fístulas de líquido cefalorraquídeo, se cierra el conducto auditivo interno mediante aplicación de una porción de músculo temporal y Gelfoam®. 16. La cavidad de la mastoides puede obliterarse asimismo con un colgajo del músculo superior, de base superior. 17. La herida se cierra por capas hasta la piel. DESCOMPRESIÓN DEL NERVIO FACIAL POR VÍA TRANSMASTOIDEA La descompresión del nervio facial por vía transmastoidea (exposición de la segunda y tercera porciones intratemporales del facial) se practica con la siguiente técnica: 1. Incisión retroauricular. 2. Corte del periostio alrededor del conducto auditivo externo. 3. Elevación del periostio. 4. Colocación de retractores. 5. Fresado de un área triangular, limitada al frente por la pared posterior del conducto auditivo externo, arriba por la línea temporal y atrás por la inserción de los músculos cervicales. 6. Antrotomía. 7. Mastoidectomía. 8. Aticotomía. 9. Timpanotomía posterior. 10. Exposición del conducto del facial; en ocasiones es necesario desarticular el yunque para obtener una exposición adecuada. 11. Una vez expuesto el conducto de Falopio, se esqueletiza con fresas de diamante. 12. Por esta vía se expone el nervio desde la apófisis cocleariforme hasta el agujero estilomastoideo. 13. Descompresión del nervio mediante incisión longitudinal de la vaina perineural con un queratótomo desechable (a manera de bisturí); si está seccionado el nervio, se expone y se sustrae de su conducto óseo para practicar una anastomosis terminoterminal con nailon 10–0 (tres a cuatro puntos son suficientes), sin tensión; en caso de tensión o extirpación de un segmento del nervio, se efectúa un injerto libre del nervio auricular mayor, que ofrece mejores resultados que la interposición de nervio safeno externo. 14. Cierre de la herida por planos hasta la piel. 15. Una de las complicaciones más comunes con el uso de esta vía es el desarrollo de hipoacusia neurosensorial, que se encuentra hasta en 51% de los casos. FISIOTERAPIA EN PARÁLISIS FACIALES La fisioterapia es aplicable a todas las formas de parálisis facial periférica, tanto primaria como secundaria. Antes de iniciarse, siempre debe investigarse el estado de los músculos en la zona afectada de la cara. Se comienza con sesiones diarias, hasta que el paciente aprenda los ejercicios de rehabilitación. Uno de los objetivos de las ERRNVPHGLFRVRUJ Nervio facial 1. 2. 3. 4. 5. 6. Arrugar la frente. Fruncir las cejas. Arrugar la nariz. Tratar de expandir las alas nasales. Arrugar el mentón. Cerrar los labios. Cada uno de estos movimientos debe efectuarse cinco a seis veces, con relajación total entre cada ejercicio. Antes de comenzar se recomienda aplicar rayos infrarrojos durante 10 min (protegiendo ambos ojos), que produce hiperemia local y relajación muscular adecuada. Los ejercicios deben practicarse diariamente 15 min; tiempos prolongados pueden promover el desarrollo de hemiespasmo facial. REHABILITACIÓN QUIRÚRGICA DE LA CARA PARALIZADA ANASTOMOSIS DEL HIPOGLOSO CON EL FACIAL (XII–VII) Este método debe considerarse cuando hay un buen tono muscular, respuestas durante la electromiografía (fibrilación) y estímulos con corriente galvánica. Lo anterior indica que el músculo todavía trabaja de forma adecuada. Este procedimiento está indicado para lesiones del VII par craneal entre el tallo cerebral y el conducto auditivo interno, por ejemplo después de la extirpación de grandes tumores del ángulo pontocerebeloso en los que no puede identificarse el cabo proximal del nervio facial y, por ende, no tiene sentido aplicar un injerto libre de nervio. Es la mejor opción para la rehabilitación de la cara paralizada. La técnica quirúrgica es relativamente sencilla; la simetría facial se presenta entre cuatro y seis meses después de la anastomosis y la mayor parte de la recuperación se observa en los primeros 18 meses, aunque algunos autores han reconocido mejoría hasta dos o tres años después. La contracción de la musculatura facial puede verse al principio cuando el paciente presiona la punta de la lengua contra el paladar duro. El sujeto debe educar la musculatura facial para que se contraiga de manera voluntaria. En la mayor parte de los casos, la atrofia de la lengua que resulta por este procedimiento es mínima; asimismo, los individuos pueden presentar cierta dificul- tad al masticar y articular algunas palabras, situación que mejora después de unas semanas. Al principio hay movimientos faciales en masa durante la alimentación. En 25% de los casos se ha señalado hemiatrofia grave. Técnica 1. Incisión en forma de Y o Z, de manera inicial desde la región anterior del trago y después hacia la región retroauricular para extenderse inferiormente entre el borde anterior del músculo esternocleidomastoideo y el triángulo submandibular. 2. Identificación del nervio facial. Se separa la superficie posterior de la glándula parótida del hueso mastoideo hasta exponer el piso del conducto auditivo externo y la superficie anterior de la apófisis mastoides. El tronco del nervio facial aparece en el ángulo que forman estas dos estructuras, inmediatamente delante del origen mastoideo del vientre posterior del músculo digástrico. A menudo se encuentra cubierto por tejido fibroso, que se remueve. Debe seccionarse lo más próximo al agujero estilomastoideo. En ocasiones es necesario movilizar la porción infratemporal del nervio a través de una mastoidectomía con la intención de liberarlo y favorecer la anastomosis. 3. Identificación del nervio hipogloso. Se localizan la vena yugular interna y las venas del tronco tirolinguofacial; el nervio hipogloso presenta un curso oblicuo hacia delante y abajo, cruzando la superficie externa de la arteria carótida en el ángulo formado por las venas descritas. Una vez identificado, se sigue su curso y se secciona lo más cerca posible de la lengua. 4. Se localiza el asa del hipogloso, se corta o anastomosa con el cabo distal del facial; esto último no siempre ofrece mejores resultados funcionales. 5. La anastomosis entre el hipogloso y el facial se realiza con nailon 8 o 10–0; por lo general bastan tres a cuatro puntos. Una vez terminada la anastomosis, se puede aplicar pegamento biológico, como fibrina antóloga o férulas de colágeno. 6. Cierre de la herida por planos hasta la piel (figura 7–10). Anastomosis del nervio espinal accesorio con el facial (XI–VII) Esta técnica ofrece resultados funcionales poco satisfactorios respecto de cuando se utiliza el nervio hipogloso. Además, el defecto funcional que experimenta el paciente (síndrome del hombro caído) es más notorio. COLGAJOS MUSCULARES PARA REANIMACIÓN FACIAL Se pueden utilizar los músculos temporal, masetero y digástrico para reanimación facial. Las indicaciones para estos procedimientos son: ERRNVPHGLFRVRUJ Capítulo 7 sesiones es enseñarle a ejercer un control consciente de las áreas de la cara que previamente se encontraban fuera de la mente consciente. Por ejemplo, si hay asimetría de la fisura nasolabial, el problema mejora al inflar las mejillas como si tuviera una trompeta; en asimetría en la sonrisa, se pide al sujeto que trate de inflar y desinflar los músculos dañados de la hemicara frente a un espejo; para aprender a cerrar los párpados, se colocan sobre éstos unos electrodos de tal manera que si el individuo los mueve se envía una señal acústica que lo indica. Otros ejercicios practicados frente al espejo son los siguientes: 171 171 172 Oído, nariz, garganta y cirugía de cabeza y cuello que son ramas de la división mandibular del nervio trigémino. Capítulo 7 Figura 7–10. Anastomosis del nervio hipogloso (XII par craneal) con el facial (VII). Fotografía en la que se identifica la anastomosis entre el nervio hipogloso y el tronco principal del nervio facial. Nótese el tejido glandular parotídeo alrededor del VII par. 1. Parálisis faciales prolongadas. 2. Defectos craneofaciales. 3. Destrucción de las porciones periféricas del nervio facial. 4. Pacientes con múltiples neuropatías y alteraciones en la deglución y el habla. 5. Enfermos sin respuesta en la electromiografía o la aplicación de estímulos galvánicos. 6. Falla de otros métodos de rehabilitación. Transferencia de un colgajo muscular del temporal Guillies y Eden describieron este procedimiento de manera original en 1911. Con el objeto de abarcar más regiones de la cara, esta técnica se ha modificado mediante el uso adicional de la fascia del músculo o de pericráneo. El músculo temporal tiene forma de abanico y se inserta en el proceso coronoide y la rama ascendente de la mandíbula, para dirigirse hacia la fosa del hueso temporal (porción escamosa). Su riego principal proviene de las ramas anterior y posterior de la arteria temporal profunda, ramas de la maxilar interna; por otro lado, la galea aponeurótica recibe su riego de las arterias temporal superficial y auricular posterior. La inervación depende de los nervios temporales profundos anterior y posterior, Técnica 1. Incisión preauricular parecida a la practicada en la ritidectomía; por arriba se continúa hacia la región temporal y abajo pasa por debajo del lóbulo, hacia las regiones mastoidea y occipital. 2. Se efectúa disección subcutánea de la piel hasta exponer la mejilla con el surco nasogeniano, para llegar así al músculo orbicular de los labios, además de una incisión externa en la línea mucocutánea del labio. 3. Exposición del músculo orbicular de los párpados. 4. Se expone el músculo temporal y se lo diseca por encima o debajo del pericráneo, según sean las necesidades del paciente y el uso o no de segmentos de fascia temporal. 5. En caso de que el abultamiento en el cigoma sea excesivo, pueden desinsertarse a partir de éste los músculos temporal y masetero, y removerse la porción central del arco cigomático. 6. De esta manera, la rotación del colgajo puede cubrir la hemicara lesionada. 7. La porción de la galea aponeurótica se divide en varios compartimientos, que se suturan a los músculos previamente expuestos mediante Vicryl® 3 o 4–0. 8. La herida se cierra por planos, con especial cuidado de efectuar una hemostasia adecuada. La piel se cierra con puntos cuticulares de catgut crómico 6–0. 9. Los resultados del procedimiento se observan 45 días después. Es importante enfatizar que, por lo que respecta al labio, para obtener una sonrisa satisfactoria deben corregirse las suturas efectuadas en la línea mucocutánea y la aponeurosis o fascia del músculo. Esta técnica de transposición del músculo temporal tiene éxito en 75 a 80% de los casos (figura 7–11). Transposición del músculo masetero Se utiliza para la rehabilitación de parálisis faciales en el tercio inferior de la cara (región peribucal). En 1867, Lexer fue el primero en llevar a cabo una transferencia de este músculo por vía intrabucal. Técnica 1. Se trazan dos incisiones externas de casi 1 cm; la primera en la porción lateroinferior del labio, sobre la comisura bucal, y la otra entre la línea melolabial que se pretende hacer y el labio superior en la comisura. 2. Incisión intrabucal en la cara anterolateral de la mandíbula, desde su rama ascendente hasta la región posterior del agujero mentoniano. 3. Se identifica y diseca el músculo hasta la apófisis coronoides, de modo tal que se exponen sus porciones anterior y medial, divididas para formar dos cordones musculares y llevadas hacia el sitio de las incisiones externas a través de un túnel intrabucal. ERRNVPHGLFRVRUJ Nervio facial 173 173 3. El defecto labial debe corregirse de manera adicional al aplicar los puntos de sutura, con el objeto de obtener una mejor función esfintérica y estética. 4. Cierre por planos hasta la piel. Tarsorrafia externa Figura 7–11. Figura que muestra la técnica de transferencia de un colgajo muscular de temporal adherido a su fascia. Obsérvese cómo el colgajo se ha llevado hacia la región de los labios para medir su longitud y crear después un túnel subdérmico para efectuar la sutura a nivel de la comisura bucal. MT, músculo temporal; CMT, colgajo de músculo temporal. Técnica 1. Aplicación de solución anestésica tópica en el globo ocular. 2. Infiltración con xilocaína al lado del canto externo y sobre el borde del párpado superior. 3. Escisión de la dermis sobre una porción del tercio externo de los párpados superior e inferior. 4. Este procedimiento no lesiona el canto externo. 5. Se usa dermalón 5–0, uniendo ambos párpados a nivel de la dermis extirpada; se recomienda aplicar unos tubos de polietileno por donde pase el hilo de sutura, tanto en el párpado inferior como en el superior, para no lacerar la piel de estos últimos. 6. El procedimiento es reversible, al cortar con la tijera sobre el sitio de la sutura (figura 7–12). Transposición del conducto parotídeo Esta técnica se emplea para el manejo del xeroftalmos y la describió por primera vez Filatov en 1950. La secre- 4. Para las suturas de la unión mucocutánea se emplea seda blanca 4–0. 5. Se recomienda que el paciente no ingiera alimentos durante cuatro a cinco días. OTROS MÉTODOS DE REHABILITACIÓN Queiloplastia Es el método de rehabilitación más antiguo, dado que se utilizaba ya en la India en el año 1 000 años a.C.; desde entonces se han desarrollado cerca de 300 diferentes técnicas, una de las cuales es la siguiente: 1. Se delinean a manera de V (acostada, girada 90°) los músculos orbicular de los labios, elevador del labio superior y depresor del labio inferior, que se extirpan junto con piel, mucosa, músculo risorio y comisura bucal, lo cual representa alrededor del tercio externo de los labios superior e inferior. 2. El procedimiento puede acompañarse de la aplicación de fascia lata a manera de soporte o, mejor aún, de la transferencia de músculos masetero o temporal. Figura 7–12. Tarsorrafia lateral. A. Se ha extirpado una pequeña porción del borde de los párpados para exponer su mucosa, tanto superior como inferior. A continuación se coloca un punto con nailon 5–0, por el que se pasan unos pequeños tubos de polietileno. B. Dibujo que muestra cómo se completa la tarsorrafia lateral; nótese que no se ha lesionado el canto interno del ojo. ERRNVPHGLFRVRUJ Capítulo 7 Puede estar indicada cuando el paciente tiene parálisis facial completa con degeneración del nervio. Este procedimiento se efectúa con anestesia local y, en caso de disfunción del trigémino, puede agregarse una tarsorrafia medial, en cuyo caso se requiere anestesia corneal. 174 Oído, nariz, garganta y cirugía de cabeza y cuello ción parotídea y las lágrimas tienen una composición similar. Cuando la longitud del conducto parotídeo no es suficiente para alcanzar el saco conjuntival, se puede colocar un injerto de vena. La técnica quirúrgica consiste en: Capítulo 7 1. Incisión en la región parotídea por delante del trago. 2. Localización del conducto parotídeo, el cual discurre 1.5 cm por debajo del arco cigomático y en un plano profundo del sistema musculoaponeurótico superficial. La rama bucal del nervio facial se encuentra próxima a éste. 3. Colocación en caso necesario del injerto de vena, casi siempre obtenido de la región dorsal de la mano o la cara anterior del antebrazo, para lo que se utiliza sutura de etilón 8–0. 4. Sutura del ducto parotídeo al saco conjuntival. Se deja un catéter de colangiografía del número 19 como soporte y el extremo terminal de la vena se sutura a la incisión conjuntival con vicril siete ceros. Cuando la transposición es exitosa se puede presentar epífora al comer, situación que debe anticiparse al paciente. BIBLIOGRAFÍA Adour KK: Current concepts in neurology: diagnosis and management official paralysis. N Engl J Med 1982;307:348–351. Adour K, Ruboyiares J, von Dorstein P et al.: Bell’s palsy treatment with acyclovir and prednisone compared with prednisone alone. Ann Otol Rhinol Laryngol 1996;105:371–378. Atlas M, Lawinger D: A new technique for hypoglossal–facial nerve repair. Laryngoscope 1997;107:984–991. Austin J, Peskind S, Austin S, Rice D: Idiopathic facial nerve paralysis: a randomized double blind controlled study of placebo vs. prednisone. Laryngoscope 1993;103:1326–1333. Babin RW, Fratkin J, Harker LA: Traumatic neuromas of the facial nerve. Arch Otolaryngol 1981;107:55–58. Baker DC, Conley J: Regional muscle transposition for rehabilitation of the paralyzed face. Clin Plast Surg 1979;6:317–331. Balle V, Greisen O: Neurilemmomas of the facial nerve presenting as parotid tumors. Ann Otol Rhinol Laryngol 1984;93:70–72. Becker GD: Recurrent altemobaric facial paralysis resulting from scuba diving. Laryngoscope 1983;93:596–597. Bernstein L, Nelson R: Surgical anatomy of the extraparotid distribution of the facial nerve. Arch Otolaryngol 1984;110:177–183. Biglan A, May M, Bowers R: Management of facial spasm with Clostridium botulinum toxin type A. Ar Otolaryngol 1998;114:1407–1412. Bonkowsky U, Kochanowski B, Strutz J et al.: Delayed facial nerve following uneventful middle ear surgery. Ann Otol Rhinol Laryngol 1998;107:901–905. Braganza R, Tien R, Hoffman H, Haghighi P: Amyloid of the facial nerve. Laryngoscope 1992;102:1372–1376. Brandt T, Jenkins H, Coker N: Facial paralysis as the initial presentation of an internal carotid artery aneurysm. Arch Otolaryngol 1986;112:198–202. Brown J: Bell’s palsy: a 5 year review of 174 consecutive cases. Laryngoscope 1982;92:1369–1371. Burgess R, Bale J, Michaels L, Smith R: Polymerase chain reaction amplification of herpes simplex viral DNA from the geniculate ganglion of a patient with Bell’s palsy. Ann Otol Rhinol Laryngol 1994;103:775–779. Burgess L, Yim D, Lepere M: The steroid controversy revisited. Laryngoscope 1984;94:1472–1476. Cohen JP, Lachman LJ, Hammerschlag PE: Reversible facial paralysis in sarcoidosis. Arch Otolaryngol 1983;109:832–835. Conley J: Cheiloplasty in the treatment of facial paralysis. Laryngoscope 1986;96:140–145. Corral–Romero MA, Bustamante–Balcarcel A: Biofeedback rehabilitation in seventh nerve paralysis. Ann Otol Rhinol Laryngol 1982;91:166–168. Crumley RL: Interfascicular nerve repair. Arch Otolaryngol 1980;106:313–316. Dobie R, Fisch U: Primary and revision surgery (selective neurectomy) for facial hyperkinesia. Arch Otolaryngol 1986;112:154–163. Dort J, Fisch U: Facial nerve schwannomas. Skull Base Surg 1991;1:51–56. Dresner H, King T, Clark B, Juhn S, Levine S: Peripheral facial nerve regeneration using collagen conduit entubation in-a cat model. Ann Otol Rhinol Larygol 2006;115:631-642. Elliot C, Zalzal G, Gottlieb W: Acute otitis media and facial paralysis in children. Ann Otol Rhinol Laryngol 1996;105:58–62. Fisch U: Total facial nerve decompression and electroneuronography. In: Silverstein H, Norrell H (eds.): Neurological surgery of the ear. Birmingham, Alabama: Aesculapius Pub. Co., 1977:21–33. Fisch U: Facial paralysis in fractures of the petrous bone. Laryngoscope 1974;84:2141–2154. Fisch U: Surgery for Bell’s palsy. Arch Otolaryngol 1981;107:1–11. Fisch U: Current surgical treatment of intratemporal facial palsy. Clin Plast Surg 1979;6:377–388. Furuta Y, Aizawa H, Ohtani F, Sawa H, Furuka S: Varicellazoster. Virus DNA level and facial paralysis in ramsay-hunt syndrome. Ann Otol Rhinol Laryngol 2004;113:700-705. Fon Z: Intracranial longitudinal splitting of facial nerve: a new approach for hemifacial spasms. Ann Otol Rhinol Laryngol 1993;102:108–109. Furuta Y, Oridate N, Takeichi N, Fukoda S, Jawa H: Alpha defensin overexpression in patients with bell´s palsy and Ramsay hunt syndrome. Ann Otol Rhinol Laryngol 2012;121:419–425. Gacek R: Comment of Bell’s palsy. Ann Otol Rhinol Laryngol 1981;90:581–583. Gantz B, Rubinstein J, Gidley P, Woodworth G: Surgical management of Bell’s palsy. Laryngoscope 1999;109:1177– 1188. Gantz BJ, Gmuer AA, Holliday M, Fisch U: Electroneurographic evaluation of the facial nerve. Ann Otol Rhinol Laryngol 1984;93:394–398. ERRNVPHGLFRVRUJ Nervio facial Kimata Y, Sakuroba M, Hishinuma S, Ebihara S: Free vasculkarized nerve grafting for inmmediate facial nerve reconstruction. Laryngoscope 2005;115:331-336. Knox GI: Treatment controversies in Bell palsy. Ar Otolaryngol 1998;124:821–823. Kodama A, Sando I, Myers E, Hashida Y: Severe middle ear anomaly with underdeveloped facial nerve. Arch Otolaryngol 1982;108:93–98. Koriyama T, Inafuku J, Kimata K, Banno T, Ishigami H: Recent, onsent Bell’s-palsy complicated by diabetes ar. Otolaryngol 2001;127:1338-1340. Lambert P, Brackmann D: Facial paralysis in longitudinal temporal bone fractures. Laryngoscope 1984;94:1022–1026. Laumann EPJ, Jongkees LBW: On the prognosis of peripheral facial paralysis of endotemporal origin. Ann Otol Rhinol Laryngol 1963;72:307–319. Levenson M, Ingerman M, Grimas C, Anand V: Melkerson– Rosenthal syndrome. Arch Otolaryngol 1984;110:540–542. Lexer E, Eden R: Uber die chirurgische Behandlung der per pheren Facialislahmung. Beitr Klin Chir 1911;73:116. Liston S: The relationship of the facial new and first branchial cleft anomalies. Embryologic considerations. Laryngoscope 1982;92:1308–1310. Lo WW, Brackmann D, Shelton C: Facial nerve hemangioma. Ann Otol Rhinol Laryngol 1989;98:160–161. Luetje C, Millbrath M, Linthicum F: Juxtaposition lipoma to the mastoid seventh nerve. Laryngoscope 1994;104:135–139. Mathog R, Ragab A: Temporalis muscle galea flap in facial reanimation. Arch Otolaryngol 1985;111:168–173. May M: Maximal excitability test. In: Fisch U (ed.): Facial nerve surgery. Birmingham, Alabama: Aesculapius Pub. Co., 1977. May M: Muscle transposition for facial reanimation. Arch Otolaryngol 1984;110:184–189. May M, Kay S, Weinstein G: Parotid duct transposition for xerophthalmia and facial paralysis. Laryngoscope 1995;105:80–82. May M, Klein S: Facial nerve decompression complications. Laryngoscope 1983;93:299–305. May M, Klein SR, Blumenthal F: Evoked electromyography and idiopathic facial paralysis. Otolaryngol Head Neck Surg 1983;91:678–685. May M, Klein SR, Taylor F: Idiopathic (Bell’s) facial palsy: natural history defies steroid or surgical treatment. Laryngoscope 1985;95:406–409. McCandless GA, Schumacher MH: Auditory dysfunction with facial paralysis. Arch Otolaryngol 1979;105:271–274. Mellon DL: Current concepts in facial nerve paralysis. Entechnology 1986:5–24. Miehlke A: Surgery of the facial nerve. Munich: Urban and Schwarzenberg, 1973:191. Moscatello A, Worden D, Nadelman R et al.: Otolaryngologic aspects of Lyme disease. Laryngoscope 1991;101:592–595. Nakatani H, Iwai M, Takeda T, Hamada M, Karigi A: Waveform changes in antidromic facial nerve responses in patients with Bell’s palsy. Ann Otol Rhinol Laryngol 2002;111:128-134. Ogawa A, Sando I: Spatial occupancy of vessels and facial nerve in the facial canal. Ann Otol Rhinol Laryngol 1982;91:14–19. Orlando M, Atkins J: Melkerson–Rosenthal syndrome. Ar Otolaryngol 1990;116:728–729. Ornhagen H, Tallberg P: Pressure equalibration of the middle ear during ascent. Undersea Biomed Res 1981;8:219–227. ERRNVPHGLFRVRUJ Capítulo 7 García–Ibáñez L: Cirugía de las parálisis traumáticas del nervio facial intratemporal. En: Poch–Viñals R (ed.): Progresos en otorrinolaringología. Barcelona: Salvat , 1978:75–81. Gavron J, Clemis J: Hypoglosal–facial nerve anastomosis: a review of 40 cases caused by facial nerve injuries in the posterior fossa. Laryngoscope 1984;94:1447–1450. Ge XX, Spector GJ: Labyrinthine segment and geniculate ganglion of facial nerve in fetal and adult human temporal bones. Ann Otol Rhinol Laryngol 1981;90(Sup. 85):1–12. Glasscock M III, Pensak M, Gulya AJ, Baker D: Lyme disease. Arch Otolaryngol 1985;111:47–49. Gulya J, Stern N: Facial nerve neuroma. Ann Otol Rhinol Laryngol 1993;102:478–480. Haller J, Shelton C: Medial antebrachial cutaneous nerve: a new donor graft for repair of facial nerve defects at the skull base. Laryngoscope 1997;107:1048–1052. Harris J, Davidson T, May M, Fria T: Evaluation and treatment of congenital facial paralysis. Arch Otolaryngol 1983;109:145–151. Hoffman M, Shelton C, Hornsberger R: Facial nerve hemangioma. Ar Otolaryngol 1997;123:763–766. House JW: Facial nerve grading systems. Laryngoscope 1983;93:1056–1069. Hughes GB: Current concepts in Bell’s palsy. Ear Nose Throat J 1983;62:507–511. Ikeda M, Lijima M, Kukimoto N, Fuga M: Plasma endothelin level in the acute stage of Bell palsy. Ar Otolaryngol 1996;122:849–852. Iwanaga M, Yamamoto E, Yamaguchi M et al.: Facial nerve neurinoma. Two cases located in the horizontal portion. Laryngoscope 1984;94:938–941. Jackson CG, Glasscock ME, Hughes G et al.: Facial Paralysis of neoplastic origin: diagnosis and management. Laryngoscope 1980;90:1581–1598. Jannetta PJ: Microvascular decompression in trigeminal neuralgia and hemifacial spasm. In: Brackmann DE (ed.): Neurological surgery of ear and skull base. New York: Raven Press, 1982. Jenkins H, Herzog J, Coker N: Bell’s palsy in children. Ann Otol Rhinol Laryngol 1985;94:331–336. Jung T, Byung–Hoon J, Shea D, Paparella MM: Primary and secondary tumors of the facial nerve. Arch Otolaryngol 1986;112:1269–1273. Jungehuelsing M, Sittel C, Fischbach R et al.: Limitations of magnetic resonance imaging in the evaluation of perineural tumor spread causing facial nerve paralysis. Ar Otolaryngol 2000;126:506–510. Kania R, Cazals–Hatem D, Bouccara D, Cyna–Gorse F: Hypertrophic neuropathy of the facial nerve. Ann Otol Rhinol Laryngol 2001;110:257–262. Kanon N, Nomura J, Satomi F: Nocturnal onset and development of bell-s palsy. Laryngoscope 2005;115:99-100. Kay P, Kinney S, Levine H, Tucker H: Rehabilitation of facial paralysis in children. Arch Otolaryngol 1983;109:642–647. Katz A, Sersienka R, Dior U, Witnitzae A, Kaplan D: Bell´s palsy during pregnancy is it associated with adverse perinatal outcome. Laryngoscope 2011;121:1395–1398. Kettle K: Peripheral facial palsy pathology and surgery: facial palsy in Melkersson’s syndrome. Springfield, Ill: Charles C. Thomas Publ., 1957:142–159. 175 175 176 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 7 Parnes L, Lee D, Peerless S: Magnetic resonance imaging of facial nerve neuromas. Laryngoscope 1991;101:31–35. Parosian M, Wayman J, Dutcher P: Facial nerve paralysis from slug injury to the ear. Ar Otolaryngol 1993;119:548–550. Pettersen I: Natural history of 1,011 cases of Bell’s palsy. Collegium Otorhinolaryngol. Acad. Science, San Francisco, Ca., Sept. 1980. Pillsbury HC, Fisch U: Extratemporal facial nerve grafting and radiotherapy. Arch Otolaryngol 1979;105:441–446. Pillsbury HC, Price HC, Gardiner L: Primary tumors of the facial nerve: diagnosis and management. Laryngoscope 1983;93:1045–1048. Proctor B, Corgill DA, Proud G: The pathology of Bell’s palsy. Trans Am Acad Ophthalmol Otolaryngol 1976;82:70–80. Pulec JL: Panel on treatment of Bell’s palsy: early decompression of the facial nerve in Bell’s palsy. Ann Otol Rhinol Laryngol 1981;90:570–577. Qiu W, Shinygucha Y, Stuker F et al.: Time course of Bell palsy. Ar Otolaryngol 1996;122:967–972. Ramsey M, De Simonian R, Holtel M, Burgess L: Corticosteroid treatment for idiopathic facial nerve paralysis. Laryngoscope 2000;110:335–341. Raymond W, Koh A, Ho W: Endoscopic surac nerve harvesting for facial nerve reconstruction. Laryngoscope 2005;115:925-927. Rubin L: Reanimation of the paralyzed face. St. Louis: C. V. Mosby Co., 1977. Sachs M, Conley J: Dual simultaneous systems for facial reanimation. Arch Otolaryngol 1983;109:137–139. Sachs M, Conley J: Intraoral masseter muscle transposition. Arch Otolaryngol 1982;108:397–400. Saito H, Kishitnoto S, Furuta M: Temporal bone findings in a patient with Möbius syndrome. Ann Otol Rhinol Laryngol 1981;90:80–84. Sanchez Cuaddrado I, Lassaletta L, Gonzalez Otero T, Frutos R: Glomus facialis paraganglioma. JAMA Otolaryngol Head Neck Surg 2013;139:93–94. Sataloff R: Embriology of the facial nerve and its clinical applications. Laryngoscope 1990;100:969–984. Scharpf J, Meiner R, Zielinsky M, Unsal M, Raminemi P: A novel technique for perifepheral nerve repair. Laryngoscope 2003;113:95-101. Shanon E, Himelfarb M, Zifk D: Measurement of auditory brain stern potentials in Bell’s palsy. Laryngoscope 1985;95:206–209. Siedentop KH, Loewy A: Facial nerve repair with tissue adhesive. Arch Otolaryngol 1979;105:423–426. Sillman AM, Eavey R, Reardon E, Thorton A: Metabolic facial paralysis in an infant. Arch Otolaryngol 1985;111:822–825. Sittel C, Gurtinas O, Streppel M, Stennert E: Variability of repeated facial nerve electroneurography for healthy subjects. Laryngoscope 1998;108:1177–1180. Smith V, Traquina D: Pediatric bilateral facial paralysis. Laryngoscope 1998;108:519–523. Smouba E, Toh E, Schaitkin B: Surgical treatment of Bell´s palsy: current attitudes. Laryngoscope 2011;121:1965–1970. Spector JG: Classification of facial nerve disorders. Laryngoscope 1985;95:100–103. Spector JG: Mimetic surgery for the paralyzed face Laryngoscope 1985;95:1494–1522. Spector GJ, Thomas JR: Slings for static and dynamic facial reanimation. Laryngoscope 1986;96:217–221. Spector GJ, Ge X: Ossification patterns of the tympanic facial canal in the human fetus and neonate. Laryngoscope 1993;103:1052–1065. Steere AC, Grodzicki RL, Kornblatt AN et al.: The spirochetal etiology of Lyme disease. N Engl J Med 1983;308:733–740. Stennert E: Pathomechamisms in cell metabolism: a key to treatment of Bell’s palsy. Ann Otol Rhinol Laryngol 1981;90:577–581. Stjernquist A, Skoog E, Aurelius E: Detection of herpex simplex and varicella-zoster viruses in patients with Bell’s palsy by the polymerase chain reaction technique. Ann Otol Rhinol Laryngol 2006;115-306-311. Vahlne A, Edstrom S, Arstila P et al.: Bell’s palsy and Herpes simplex virus. Arch Otolaryngol 1981;107:79–81. Verduijin P, Bleeker JD: Secondary syphilis of the facial nerve. Arch Otolaryngol 1982;108:382-384. Wackym P: Molecular temporal bone pathology. Laryngoscope 1997;107:1165–1175. Wiet R, Lotan A, Shambaugh G: Tumor involvement of the facial nerve. Laryngoscope 1983;93:1301–1309. Wilkinson E, Hoa M, Slattery W, Fayad J, Friedman R: Evalution in the management of facial nerve schwannoma. Laryngoscope 2011;121:2065–2074. Yagi N, Nakatani H: Evaluation of the thread test of lacrimation. III. Crocodile tears and thread test of lacrimation. Ann Otol Rhinol Laryngol 1986;95(Sup. 122):13–16. Yamashita T, Ino C, Tomoda K: Prognostic determination and submandibular function in Bell’s palsy. Arch Otolaryngol 1985;111:244–248. Yanagihara N: Etiology and pathophysiology of Bell’s palsy. Ann Otol Rhinol Laryngol 1988;97(137):1–27. Yanagihara N, Gyo K, Yumoto E, Tamaki M: Transmastoid decompression of the facial nerve in Bell’s palsy. Arch Otolaryngol 1979;105:530–534. Yanagihara N, Mori H, Kozawa T et al.: Bell’s palsy. Arch Otolaryngol 1984;110:374–377. Yian C, Paniello R, Spector G: Inhibition of motor nerve regeneration in a rabbit facial nerve model. Laryngoscope 2001;111:786–791. Zappia J, Wiet R, Chouhan A, Zhao J: Pitfalls in the diagnosis of hemifacial spasm. Laryngoscope 1997;107:461–465. ERRNVPHGLFRVRUJ Lesiones otoneurológicas ENCEFALOCELE DEL HUESO TEMPORAL Es la presencia de tejido cerebral dentro del hueso temporal. Kline describió los defectos congénitos en el tegmen del hueso temporal acompañados de herniación del tejido neural, con complicaciones subsecuentes del sistema nervioso central (SNC). En términos etiológicos, los encefaloceles se dividen en tres tipos: a) Secundarios a infección otológica. b) Por anomalías óseas congénitas del hueso temporal (los más comunes en el tegmen y, con menor frecuencia, en la fosa posterior). c) Postraumáticos. De estos grupos, los infecciosos y los secundarios a operación otológica representan las causas primordiales. El síntoma cardinal de los encefaloceles congénitos es el desarrollo de otorrea o rinorrea de líquido cefalorraquídeo, seguido de hipoacusia progresiva neurosensorial y, en ocasiones, cuadros repetitivos de meningitis. La tomografía axial computarizada de alta resolución y la resonancia magnética pueden delinear las dehiscencias óseas del tegmen timpánico o mastoideo. El tratamiento es casi siempre quirúrgico; los encefaloceles de la fosa posterior o la región lateral del mastoides pueden abordarse por vía transmastoidea, mientras que los situados en forma más medial y anterior (tegmen timpani) es preferible abordarlos a través de la fosa media o en forma mixta con la vía transmastoidea. El tejido cerebral herniado sufre isquemia y edema por estrangulamiento y, en consecuencia, ya no es tejido funcional; por lo tanto, puede extirparse sin problemas. Si el defecto óseo del tegmen es pequeño (menor de 1 cm), puede sellarse con fascia y músculo temporal; las alteraciones mayores requieren injertos LESIONES FIBROSAS CONGÉNITAS DEL HUESO TEMPORAL A menudo se relacionan con fibromatosis congénita generalizada. Entre los síntomas pueden aparecer edema retroauricular, otorrea purulenta y parálisis facial. Los estudios radiográficos revelan destrucción de la porción petrosa y mastoidea del temporal, así como lesiones osteolíticas en huesos planos y largos, como pelvis, tibia, fémur y radio. En algunos casos se han presentado regresiones espontáneas con curación aparente de estas lesiones. El diagnóstico diferencial debe incluir reticuloendoteliosis, hemangiomatosis, fibroxantomatosis e histiocitoma fibroso maligno. OSTEOPETROSIS (ENFERMEDAD DE ALBERS–SCHONBERG) La osteopetrosis es una rara enfermedad ósea hereditaria caracterizada por un defecto en el mecanismo de remodelación ósea. Hay formación excesiva de hueso inmaduro que produce ensanchamiento de la corteza ósea, con obliteración de la cavidad medular. Existen dos formas clínicas de la enfermedad: Capítulo 8 LESIONES CONGÉNITAS óseos o materiales sintéticos para conferir soporte al tejido cerebral. a) Una de transmisión autosómica dominante de curso benigno. b) Otra maligna que se transmite de manera autosómica recesiva y se manifiesta en homocigotos. El diagnóstico de esta entidad es radiográfico. En la forma maligna, los pacientes fallecen durante la infancia tardía, por anemia mieloptísica o granulocitopenia secundaria. La forma benigna (autosómica dominante) ocurre en adolescentes y adultos; al 177 ERRNVPHGLFRVRUJ 178 Oído, nariz, garganta y cirugía de cabeza y cuello parecer, la causa principal en esta enfermedad es el osteoclasto y se ha informado mejoría clínica después de trasplantes de médula ósea. Síntomas Capítulo 8 1. Afectación de pares craneales; los más frecuentes son III, VII y VIII. Se debe a inclusión del conducto óptico o estrechez subsecuente de los conductos auditivo interno y de Falopio, lo cual puede causar parálisis faciales recurrentes, hipoacusia súbita de tipo neurosensorial por compresión vascular y paresia vestibular. 2. Hidrocefalia. 3. Sordera de tipo conductivo; es más frecuente que la neurosensorial, pueden encontrarse tejido fibroso embrionario mesenquimatoso y cuadros infecciosos de oído medio. 4. Deformidades odontológicas. 5. Anemia. 6. Trombocitopenia. 7. Hematopoyesis extramedular. NEUROFIBROMATOSIS Es una enfermedad generalizada que puede afectar el hueso temporal, la cavidad bucal, las vías respiratorias superiores y los tejidos blandos de cabeza y cuello. Se transmite por un gen autosómico dominante con 80% de penetrancia. Su frecuencia es de 1 por 3 000 nacidos vivos. En 50% de los casos no hay antecedentes familiares. Desde el punto de vista biológico molecular, se han diferenciado dos tipos de neurofibromatosis: la neurofibromatosis de tipo I se conoce como enfermedad de von Recklinghausen, neurofibromatosis periférica, neurofibromatosis múltiple o enfermedad del hombre elefante; es secundaria a una anomalía en el brazo largo del cromosoma 17; la neurofibromatosis de tipo II se denomina también como neurofibromatosis craneal, neurofibromatosis acústica bilateral, neuromatosis craneal o síndrome de Wishart–Gardner–Eldridge; su gen productor se encuentra en el cromosoma 22. El diagnóstico se establece con la presencia de neurofibromatosis acústica bilateral, unilateral, o bien con la aparición de dos de las siguientes entidades: neurofibroma, meningioma, glioma, schwannoma u opacidad juvenil lenticular subcapsular posterior. Estos dos tipos de enfermedades comparten algunas manifestaciones clínicas sin ser la representación de un espectro clínico de la misma enfermedad. Tiselius describió por primera vez en 1793 la neurofibromatosis múltiple; Virchow (1847) señaló su naturaleza familiar y von Recklinghausen (1882) acuñó el término de neurofibroma; se cree que lo origina la célula de Schwann. Los schwannomas tienen ramas compactas en empalizada con un núcleo espinoso o fusocelular y un área central clara (cuerpos de Verocay) denominadas células de Antoni de tipo A. También existen células de Antoni de tipo B, menos organizadas. Estos tumores poseen una matriz mixomatosa, con grupos pequeños de colágeno. El síndrome de von Recklinghausen consiste en múltiples malformaciones de las vainas nerviosas y estructuras internas, manchas café con leche y displasia mesenquimatosa de vasos sanguíneos y huesos. Se cree que existe un defecto embrionario primario del neuroectodermo, en especial la cresta neural, que puede por tanto afectar meninges, médula suprarrenal, melanocitos, neuronas autónomas motoras y células de Schwann. Las alteraciones en vasos forman microaneurismas al romperse las capas muscular y elástica. En ocasiones, los neurofibromas alcanzan un tamaño muy grande y provocan elefantiasis neuromatosa. Existe un elevado índice de epilepsia y retraso mental. Asimismo, se identifican tumores bilaterales del acústico y neoplasias del vértice petroso originadas en los nervios petroso superficial mayor y el profundo. De 4 a 7% de los pacientes tiene afectación de la cavidad bucal, en especial la lengua. Otras lesiones simulan tumores del cuerpo carotídeo o producen disfonía por lesión del nervio laríngeo recurrente. En 33% de los casos se ha detectado daño del parénquina pulmonar (alveolitis fibrosante). También hay un alto riesgo de neoplasias malignas a partir de los neurofibromas u otros sitios; suelen aparecer en el tercer decenio de la vida, con desarrollo de schwannomas malignos y fibrosarcomas. La anomalía esquelética más común es la xifoscoliosis. Los tumores del ángulo pontocerebeloso, así como de los conductos de Falopio y auditivo interno, se tratan de manera quirúrgica, a través de la fosa media o por las vías retrolaberíntica, translaberíntica o por la fosa posterior (vía suboccipital). Los neurofibromas del bulbo de la yugular se remueven con operación de la base del cráneo por vía lateral o infratemporal. IMPRESIÓN BASILAR Es la combinación de malformaciones neurales, vasculares y óseas de la región craneocervical. Puede tener dos formas: congénita (primaria) y adquirida; la primera es la más común. Algunas de las alteraciones son las siguientes: a) Elevación de la apófisis odontoides. b) Acortamiento del clivus. c) Hipoplasia de la base del hueso occipital. d) Hipoplasia del arco superior del atlas. e) Elevación de las pirámides óseas petrosas. Lo anterior puede producir compresión del bulbo raquídeo, las amígdalas cerebelosas y vasos adyacentes, signos del tubo espinal, alteraciones del VIII al XII pares craneales, adhesiones aracnoideas con alteración de la circulación del líquido cefalorraquídeo e hidrocefalia subsecuente. En el plano neurootológico se ha observado hipoacusia neurosensorial y vértigo por afectación de la rama vestibular del VIII par. El diagnóstico de este trastorno es radiográfico. Cuando la punta de la odontoides se halla 2.5 mm encima de la línea de Chamberlain (la cual se proyecta desde el borde posterior del paladar duro hasta el borde posterior del agujero occipital) es probable ERRNVPHGLFRVRUJ Lesiones otoneurológicas PADECIMIENTOS INFECCIOSOS MENINGITIS Es la causa más común de sordera adquirida de tipo neurosensorial en preescolares. Alrededor de 35% de las sorderas en sujetos que acuden a programas de educación especial se atribuye a meningitis y la frecuencia de afectación auditiva en esta enfermedad varía de 6 a 22%. Los gérmenes aislados con mayor frecuencia son Haemophilus influenzae, Streptococcus pneumoniae, Neisseria meningitidis, Staphylococcus aureus y Streptococcus β hemolítico. Los dos primeros gérmenes representan casi 80% de los casos. En 20% se han observado anomalías en las respuestas auditivas del tallo cerebral, que sugieren la presencia de hipoacusia neurosensorial. La meningitis de origen tuberculoso se acompaña con mayor frecuencia de alteraciones cocleovestibulares, casi todas ellas originadas en un foco infeccioso previo en oído medio secundario a infección pulmonar activa o enfermedad diseminada. Una alteración tubaria, sobre todo en lactantes y niños, puede ser una vía importante de infección primaria al beber leche contaminada. PAQUIMENINGITIS CRANEAL HIPERTRÓFICA Consiste en una enfermedad inflamatoria crónica y progresiva que produce un engrosamiento difuso de la duramadre. Por lo general se relaciona con cefalea y parálisis de pares craneales debido a un atrapamiento del nervio por fibrosis o daño isquémico. La causa es incierta. El diagnóstico se establece con la ayuda de la resonancia magnética. En clínica puede producir sordera neurosensorial progresiva y vértigo secundario a compresión del VIII par por fibrosis dural, así como parálisis subsecuente de los pares craneales IX, X y XI. Charcot y Joffnoy describieron esta entidad por vez primera en 1869. En meninges espinales se ha vinculado con sífilis y tuberculosis, así como con enfermedades autoinmunitarias como artritis reumatoide, poliarteritis nodosa, granulomatosis de Wegener y fibroesclerosis multifocal. El tratamiento consiste en esteroides y fármacos inmunosupresores como la azatioprina y la ciclofosfamida. ABSCESO CEREBRAL Puede desarrollarse a partir de una infección epidural o subdural, por trombosis venosa retrógrada o diseminación directa a través del sistema arterial. Por lo regular aparece como complicación de otitis medias o sinusitis. Su inicio es insidioso, sólo con síntomas inespecíficos, como cefalea y adinamia. Cuando se establece el absceso se presentan síntomas relacionados con un proceso ocupativo cerebral, como elevación de la presión intracraneal con náusea, vómito, convulsiones y edema de la papila óptica (50% de los casos). Según sea su sitio, se presentan signos de focalización. Cuando las lesiones se hallan en el lóbulo frontal puede haber confusión mental, con afectación de la corteza motora y paresias; las del lóbulo temporal se acompañan de afasias sensoriales y trastornos de los campos visuales (cuadrantanopsias, hemianopsias homónimas); esto último ocurre sobre todo cuando el aumento de volumen del lóbulo temporal provoca hernia del uncus a través de la tienda del cerebelo y la presión del tejido nervioso contra el borde de dicha tienda obstruye la arteria cerebral posterior, lo que produce infarto del lóbulo temporal. Los abscesos cerebelosos se acompañan de nistagmo de reojo o de dirección única hacia el lado afectado, hipotonía muscular, ataxia y disdiadococinesia en brazo y pierna del lado de la lesión. Para el diagnóstico se recurre a tomografía axial computarizada de alta resolución (figura 8–1); otros estudios accesorios de utilidad son angiografía y gammagrafía cerebrales. Su tratamiento consiste en lo siguiente: 1. Administración de antibióticos, por lo general de amplio espectro; la combinación de penicilina sódica con cloranfenicol ha mostrado buenos resultados; otros esquemas eficaces son los aminoglucósidos con derivados penicilínicos, como las cefalosporinas. 2. Atención del edema cerebral con esteroides; si hay aumento de la presión intracraneal se sugieren venoclisis de manitol. 3. Anticonvulsivos profilácticos. 4. TAC o resonancia magnética cerebrales cada 10 a 15 días para valorar la respuesta al tratamiento y dar tiempo a que el absceso madure. Se ha advertido que algunos abscesos, los pequeños, pueden tratarse de manera satisfactoria en forma ERRNVPHGLFRVRUJ Capítulo 8 la presencia de impresión basilar. En 75% de los pacientes se presentan vértigo, hipoacusia y acúfeno. El vértigo se relaciona con movimientos de la cabeza, esfuerzos físicos y cambios posturales. La hipoacusia es neurosensorial, unilateral o bilateral, fluctuante y progresiva. El diagnóstico diferencial debe incluir la enfermedad de Ménière. La inducción del vértigo por movimientos extremos de la cabeza contribuye al diagnóstico clínico. La presencia de nistagmo también es un signo frecuente y tiende a presentarse en dirección vertical cuando se mira hacia arriba y abajo, y en sentido oblicuo al mirar hacia los lados. En posición primaria de la mirada suele haber nistagmo en dirección podálica. Cuando sólo se reconocen defectos vertebrales también se conoce como malformación o síndrome de Klippel–Feil y, si se acompaña de malformaciones del tejido nervioso, como síndrome de Arnold–Chiari, cuyo común denominador consiste en alargamiento de partes del cerebelo que salen del cráneo a través del agujero occipital y se alojan en el conducto raquídeo. El tratamiento de esta entidad es quirúrgico y, según sea el caso, se resecan el arco del atlas y el borde posterior del agujero occipital, con sección de los ligamentos dentarios. 179 179 180 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 8 Figura 8–1. Tomografía axial computarizada de cráneo que muestra un gran absceso cerebral en el lóbulo temporal, de origen otógeno. Nótese la homogeneidad del tejido entre la masa encefálica y el absceso. conservadora sin incrementar la morbilidad ni la mortalidad. 5. Drenaje del absceso, si no hay respuesta al tratamiento conservador. a) Procesos infecciosos crónicos del oído. b) La vía meníngea posterior a una extensión intracraneal, con invasión a través del conducto auditivo interno. c) Por la nasofaringe, a través de la trompa de Eustaquio y el músculo tensor del tímpano. PETROSITIS CRÓNICA Es una infección rara que se manifiesta por otorrea crónica a pesar de practicarse timpanomastoidectomía radical y administrarse antibióticos. Cuando se agudiza, el padecimiento se presenta con paresia del VI par y dolor a lo largo de la distribución del trigémino (V par craneal), lo cual establece el síndrome de Gradenigo. El tratamiento es quirúrgico y consiste en mastoidectomía radical amplia, tratando de encontrar y sellar con músculo y fascia, si es el caso, trayectos fistulosos en el ángulo sinodural, a nivel de la eminencia arcuata y la porción inferior del conducto semicircular posterior. En ocasiones, con objeto de exponer de forma adecuada la porción anterior del vértigo petroso, se aborda a través de la fosa media. MUCORMICOSIS DEL HUESO TEMPORAL Huckel describió en 1886 la mucormicosis ótica; casi siempre se presenta en individuos inmunodeprimidos o con diabetes mellitus. Este hongo pertenece al género de los ficomicetos, se cultiva en medio de Sabourad y aparece en forma de ramas de hifas no tabicadas. La infección se caracteriza por diseminarse a través de paredes vasculares o las vainas de fibras nerviosas. Los mecanismos de infección son: AMIBIASIS CEREBRAL Las amibas llegan al encéfalo por diseminación hematógena. En términos histológicos se presenta destrucción tisular de límites poco precisos con eritrocitos y células inflamatorias en la periferia. Las lesiones antiguas muestran gliosis del tejido que las rodea, con formación de seudocápsulas. Los síntomas neurológicos son muy variables y dependen tanto de la localización como de las dimensiones de las lesiones, las cuales pueden ser únicas o múltiples. Puede haber convulsiones, hemiplejía, monoplejía, afectación de pares craneales y signos meníngeos. Debe descartarse su presencia ante signos neurológicos vagos en un sujeto con pruebas de amibiasis intestinal aguda, hepática o pulmonar. El diagnóstico diferencial incluye meningitis y abscesos piógenos. NEUROSÍFILIS En la forma meníngea de esta infección pueden aparecer exudados en los pares craneales VII y VIII, con posible degeneración ascendente y descendente de las fibras nerviosas; cuando esta forma se complica con endarteritis de los vasos que irrigan al tallo cerebral, puede ERRNVPHGLFRVRUJ Lesiones otoneurológicas sis moderada con eosinofilia. La prueba de fijación del complemento es positiva en 60 a 80% de los casos. OTORREA CEREBROESPINAL Existen dos tipos de otorrea cerebroespinal: CISTICERCOSIS CEREBRAL En México es la causa más frecuente de hipertensión intracraneal en adultos. Esta enfermedad se desarrolla por la ingestión de huevecillos de Taenia solium y no de las larvas que se encuentran en la carne de cerdo. El hombre sirve como hospedador definitivo o intermediario. El 26% de los pacientes alberga la forma madura de la Taenia en el intestino. Representa 13 a 34% de todas las tumoraciones intracraneales. Se han descrito dos tipos morfológicos de cisticerco: celuloso y racemoso. El cisticerco celuloso se presenta como una vesícula pequeña, de paredes gruesas, que se puede localizar en la convexidad del cerebro y el parénquima encefálico. La forma racemosa es más grande, de pared delgada y, en ocasiones, aspecto multilobulado; se halla con mayor frecuencia en los ventrículos y las cisternas de la base. En 60% de los casos hay parasitosis múltiple y ambos tipos morfológicos coexisten. El parásito puede encontrarse en tres diferentes sitios: a) Subaracnoideo, sobre todo en la base del cráneo (51% de los casos). Produce un cuadro de meningitis basal crónica; se presenta desarrollo lento de un síndrome craneohipertensivo sin datos de localización. Puede haber afectación de los troncos nerviosos cocleovestibulares en la base del cráneo. b) Ventricular; se presenta en 25% de los casos y es más frecuente en el IV ventrículo y el acueducto de Silvio. Si el parásito bloquea la circulación del líquido cefalorraquídeo, se desarrolla un síndrome craneohipertensivo. Cuando los cisticercos se localizan en el IV ventrículo pueden provocar el síndrome de Bruns, que se caracteriza por cefalea, vértigo y vómito que aparecen con determinadas posiciones de la cabeza. Las pruebas posturales ocasionan estos síntomas, no proporcionales a la intensidad del nistagmo, que puede ser muy moderado o nulo. c) Parenquimatoso; se presenta en 50% de los casos. Puede ser asintomático cuando los parásitos se encuentran en poca entidad, son de tamaño reducido y están alojados en zonas silenciosas del parénquima encefálico. En algunas ocasiones causan síntomas de masa ocupativa. El diagnóstico de esta entidad se basa en sus manifestaciones clínicas y estudios de tomografía axial computarizada. El estudio del líquido cefalorraquídeo revela cifras de proteínas incrementadas, glucosa disminuida y pleocito- 1. Adquirida. Es la más frecuente y la causa más común; son fracturas de la base del cráneo, seguidas de las de origen iatrogénico consecutivas a procedimientos otoneuroquirúrgicos. Otras causas poco frecuentes son las neoplásicas, entre las que figura los tumores del glomus yugular, meningiomas, carcinomas espinocelulares, tumores indiferenciados del mesénquima y procesos infecciosos. 2. Congénita. Se han identificado cuatro sitios en el laberinto a través de los cuales pueden ocurrir fístulas: a) El conducto petromastoideo. b) La ventana oval por un conducto coclear amplio. c) El conducto del facial. d) La fisura de Hyrtl, que se encuentra entre el laberinto óseo y el bulbo de la yugular; se sitúa en la parte inferior de la ventana redonda. 3. Espontánea. Es secundaria a defectos que ocurren en el tegmen del hueso temporal en 15 al 34% de los pacientes. Se debe sospechar en cualquier paciente mayor de 50 años con otitis media serosa recurrente, sin causa aparente. Puede ser secundaria, a granulaciones aracnoideas que no presentan una terminación venosa durante el desarrollo embrionario, y terminan en un fondo de saco ciego sobre la superficie interna del cráneo. Si esta fisura no se cierra por osificación, es probable que produzca herniación de la duramadre de la fosa posterior al oído medio. El cuadro clínico se caracteriza por la presencia de meningitis, a menudo recurrentes, acompañadas por líquido cefalorraquídeo (LCR) en el oído medio, lo cual semeja una otitis media serosa. En 14 de 33 casos estudiados (42%) con defectos en el tegmen y la fosa posterior, Ferguson (1986) encontró que la manifestación inicial fue la aparición de otorrea a través de perforaciones timpánicas. En otros casos, sale el líquido cefalorraquídeo (LCR) a través del orificio tubario y causa así rinorrea. Otros síntomas que pueden identificarse son episodios frecuentes de vértigo y diversos grados de hipoacusia (súbita o fluctuante). El diagnóstico incluye lo siguiente: a) Determinación de glucosa en las secreciones óticas o nasales (en caso de rinorrea), ya que sus valores en el LCR son menores que los del plasma. b) Prueba de inmunofijación, la cual consiste en la aparición de dos bandas diferentes de transferrina durante la electroforesis de LCR (método de Ritchie y Smith); esta prueba es más confiable que la primera. ERRNVPHGLFRVRUJ Capítulo 8 presentarse lesión de estos pares craneales, acompañada de signos cerebelosos homolaterales. Las gomas sifilíticas son la variedad más rara de esta infección y, aunque producen lesiones del sistema nervioso central, también pueden afectar el oído interno en forma directa. Se trata con antibióticos (penicilina) y esteroides para aumentar la audición en caso de afectarse; algunas lesiones granulomatosas se eliminan de forma quirúrgica. 181 181 182 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 8 c) Prueba de la fluoresceína, que consiste en diluir 5 cm3 de fluoresceína al 10% en 10 cm3 de LCR, aplicados de manera intratecal. Este colorante se relaciona con el desarrollo de epilepsia de tipo gran mal y parálisis temporal de las extremidades pélvicas, por lo que debe tenerse cuidado con su uso. d) Aplicación intratecal de isótopos radiactivos; los más utilizados son tecnecio 99 (99mTc) e indio 111 (IIIIn). e) Se sugiere solicitar siempre una tomografía axial computarizada para descartar enfermedad intracraneal concurrente. Otros estudios que pueden realizarse son la cisternografía con indio 111 o fluorosceína al 5% intratecal. El tratamiento depende de la causa de la otorrea del LCR. Existe la tendencia de iniciar el tratamiento de estas otorreas en forma conservadora, sobre todo en las secundarias a procedimientos otoneuroquirúrgicos, a través de drenaje controlado de LCR mediante una punción lumbar con aplicación de un catéter intratecal. La pro3 ducción normal de LCR es de casi 18 cm /h en adultos y por tanto se recomienda que el drenaje de LCR sea 3 ligeramente inferior (12 a 15 cm /h). Aunque el método es satisfactorio, puede implicar complicaciones, como el desarrollo de neumocéfalo a tensión. Se agregan antibióticos profilácticos. Si el tratamiento conservador no tiene éxito, se recurre a la operación. Las vías más comunes para tratar las fístulas son: a) Transmastoidea. b) Fosa media. Los defectos en el tegmen menores de 2 a 4 mm pueden repararse con aplicación de fascia y músculo temporal, o hidroxiapatita. En defectos mayores se puede utilizar cartílago de la concha auricular, septal o costal, que se aplica a través de un procedimiento extradural por la fosa media para conferir mayor soporte al tegmen timpánico o mastoideo. En caso de resección de tumores de la base de cráneo vinculados con grandes defectos durales, la reconstrucción se puede realizar con colgajos miocutáneos regionales, como el de trapecio, latissimus dorsi y pectoral o emplear colgajos libres microvasculares, como el del músculo recto del abdomen o el antecubital. SÍNDROME DE LA CELDILLA APICAL GIGANTE Kraus y McCabe lo describieron en 1982; se caracteriza por tener: 1. Celdillas gigantes en el vértice petroso del hueso temporal. 2. Rinorrea por salida no traumática de líquido cefalorraquídeo. 3. Meningitis recurrentes. La manera más eficaz de eliminar las infecciones recurrentes de las meninges en estos casos consiste en separar el espacio subaracnoideo de la nasofaringe, obliterando el orificio tubario, el oído medio y la mastoides. Heridas por arma de fuego del hueso temporal. Las heridas por proyectiles de arma de fuego en la cabeza afectan al hueso temporal en 20 a 50% de los casos y con frecuencia resultan en muerte instantánea. El orificio de entrada más común es la región periauricular (75% de los casos) y por lo general estos traumatismos se relacionan con asaltos o suicidios. Las lesiones que se encuentran con mayor frecuencia en casos de sobrevivencia son la parálisis facial (75%), hipoacusias de tipo neurosensorial, conductivas o mixtas (60 a 65%), lesiones de estructuras vasculares, como trombosis de la arteria carótida interna, laceración y trombosis del seno sigmoideo (30 a 35%), síntomas vestibulares (25 a 30%), y parálisis de los pares craneales IX al XII (15 a 20%). El diagnóstico se confirma con tomografía axial computarizada y angiografía carotídea. Las indicaciones de exploración quirúrgica son: 1. 2. 3. 4. Parálisis facial. Reparación de las estructuras vasculares. Desarrollo de fístulas cerebroespinales. Afectación del conducto auditivo externo y estructuras del oído medio. 5. Lesiones intracraneales, como hemorragias y hematomas. Enfermedad de Gorham–Stoot. Se describió por primera vez en 1950 y consiste en una osteólisis masiva, que desaparece en forma gradual al hueso (enfermedad del hueso fantasma). Hasta el momento se han comunicado menos de 200 casos; por lo general afecta a huesos largos pero también puede aparecer en cabeza y cuello, sobre todo en el hueso temporal. Su tratamiento se basa en radioterapia (30 a 50 Gy), así como el empleo de bifosfonastos que pueden estabilizar la destrucción ósea. TUMORES DEL ÁNGULO PONTOCEREBELOSO Por ángulo pontocerebeloso se entiende la parte de la fosa craneal posterior delimitada arriba y en su parte media por el tentorio; abajo por la cara lateral de la protuberancia y el cerebelo; lateralmente por la cara posterosuperior del peñasco. La aracnoides transforma este espacio en una cisterna, que se denomina pontocerebelosa y la atraviesan diferentes pares craneales: trigémino, motor ocular externo, estatoacústico, facial y nervios mixtos. Las lesiones expansivas de este ángulo pueden originarse en los haces nerviosos y vasos que lo atraviesan, las meninges que lo delimitan o las estructuras nerviosas contiguas. En su parte distal, el nervio estatoacústico tiene una estructura similar a la de los nervios periféricos, es decir, está dotado de células de Schwann, perineurio y ERRNVPHGLFRVRUJ Lesiones otoneurológicas NEURINOMAS (SCHWANNOMAS) DEL ACÚSTICO La frecuencia de estas tumoraciones en la población general es de casi 1:100 000. Predominan entre el quinto y séptimo decenios de la vida y se caracterizan por ser tumores de crecimiento lento (aumentan 1 a 2 mm por año); por lo tanto, el tiempo de duración de los síntomas a menudo es prolongado. La presencia de tumores bilaterales se observa en 5% de los casos. Anatomopatología Los métodos inmunohistoquímicos han demostrado la presencia de antígenos que participan en la proliferación celular, como el antígeno nuclear Ki 67, el cual se expresa en forma primordial durante las fases G1–S1–G2 y M del ciclo celular; su presencia se ha relacionado con un alto o moderado crecimiento celular y un rápido desarrollo de síntomas clínicos. Este tumor se origina casi siempre en la porción vestibular del nervio, en la región del ganglio de Scarpa, al parecer cerca de la terminación de las leptomeninges a lo largo del curso del VIII par. Por lo general es unilateral; las lesiones bilaterales se relacionan con la enfermedad de von Recklinghausen. La superficie externa del tumor es irregular y está constituida por nódulos firmes y paredes quísticas delgadas. Desde el punto de vista histológico, procede de la célula de Schwann y, a diferencia del neurofibroma (véase Neurofibromatosis), tiene una cápsula, con estructura histológica más o menos ordenada, es rico en reticulina pero no en colágeno, y las fibras del nervio en que se origina a menudo se desplazan hacia la periferia, cruzando por la cápsula. Los schwannomas tienen ramas compactas en empalizada, con un núcleo espinoso o fusocelular y un área central clara (cuerpos de Verocay), las denominadas células de Antoni de tipo A. También contienen células de Antoni de tipo B, que son menos organizadas. Asimismo, pueden encontrarse focos de degeneración, relacionados con alteraciones del riego del nervio por el crecimiento tumoral. Manifestaciones clínicas Al considerar que, en la mayor parte de los casos, el neurinoma se encuentra dentro del conducto auditivo interno, los síntomas son al principio sobre todo otológicos. El acúfeno y la hipoacusia unilaterales, además de inestabilidad leve, dominan el cuadro en la fase inicial. El acúfeno puede referirse como tonos agudos o chorro de vapor, es constante o intermitente y no tiene carácter distintivo. La hipoacusia, por lo general, progresa con lentitud y frecuencia menudo la descubre el paciente hasta que existe una mala discriminación de palabras. El estudio audiológico muestra 60% en una disminución de la audición para tonos agudos; en 20% esta curva es plana; en 6% puede encontrarse atenuada en tonos graves y, en el resto de los casos (15%) las hipoacusias se presentan con reducción de todas las frecuencias, con predominio de las agudas. Corvera señaló que lo más común es la presencia de anacusia del lado afectado hasta en 80% de los casos. Este autor considera que se relaciona de forma directa con el estadio en que se identifique la tumoración. Respecto de la logoaudiometría, en un estudio de Pensak en 506 pacientes con tumores quirúrgicamente comprobados (1985) se encontró que el porcentaje medio de discriminación del habla fue de 47.2% con desviación estándar de 35.1. En 15% de los casos se desarrollan hipoacusias súbitas secundarias a compresión de la arteria auditiva interna por efecto de la masa tumoral o por hemorragia intratumoral. Todo paciente con hipoacusia unilateral de tipo neurosensorial, cualesquiera que sean su inicio y duración, debe valorarse para descartar la posibilidad de un neurinoma del acústico. Por lo general, estas hipoacusias presentan un reclutamiento negativo con adaptación patológica. Durante los estadios tempranos es común la inestabilidad y ocurre hasta en 80% de los casos; en ocasiones es tan lenta la inclusión de fibras vestibulares que el paciente no refiere síntomas vertiginosos; en otros casos se presentan crisis de vértigo que simulan enfermedad de ERRNVPHGLFRVRUJ Capítulo 8 endoneurio, a diferencia de su porción proximal cuya estructuraes de prevalencia glial. El trayecto de este nervio desde su salida por el tallo cerebral hasta su entrada al conducto auditivo interno es ligeramente menor a 1 cm y por tanto es fácil que los tumores que se originan en este nervio afecten estructuras próximas, como nervio facial, arterias auditivas y cerebelosas, borde lateral del tallo cerebral, en los planos bulbar y protuberancial, pedúnculos cerebelosos medio e inferior y flóculo cerebeloso. La compresión de los núcleos más laterales del bulbo (vestibulares y núcleo descendente del trigémino) puede causar nistagmo espontáneo hacia el lado opuesto a la lesión y pérdida de la sensibilidad en la hemicara superior, aunque al principio, clínicamente, se presenta pérdida del reflejo corneal. También se ha encontrado en estadios tempranos asimetría de las respuestas reflejas oculomotoras, por lesión del nervio motor ocular externo. En términos electronistagmográficos, la afectación del tallo cerebral produce alteraciones de los sistemas sacádicos y de derivación; estos últimos se lesionan en forma temprana y causan alteración del sinusoide en las pruebas de rastreo pendular (rastreo sacádico). Las lesiones mayores producen desaparición del rastreo sacádico y sustitución por rastreo atáxico. La afectación de los pedúnculos y el flóculo cerebelosos provoca nistagmo postural de tipo central y hemiataxia ipsolateral. Desde el punto de vista clínico, se consideran tumores pequeños los menores de 1.5 cm, medianos de 1.6 a 2.9 cm y grandes los de 3 cm o más. El neurinoma del VIII par es el tumor más común de esta región, con una frecuencia de 70 a 80% y representa 5 a 8% de todos los tumores cerebrales. Los meningiomas ocupan el segundo lugar (10% del total), seguidos por los colesteatomas (6%); el resto de los casos está constituido por tumoraciones diversas, como hemangiomas, gliomas, lipomas, otros, del ángulo pontocerebeloso. 183 183 184 Oído, nariz, garganta y cirugía de cabeza y cuello Ménière. Es característico encontrar paresia o arreflexia vestibular del lado de la lesión durante las pruebas térmicas. Thomsen y Tos han señalado que la combinación de los siguientes datos sugiere un neurinoma del acústico, con un porcentaje de resultados falsos positivos muy pequeño: Capítulo 8 1. Hipoacusia neurosensorial con descenso de agudos. 2. Ausencia de reclutamiento. 3. Disminución de las respuestas calóricas. La afectación de trigémino (V par), facial (VII par), motor ocular externo (VI par) y motor ocular común (III par), así como el nistagmo optocinético, indican la extensión del tumor. El primer signo de afectación del V par es la pérdida del reflejo corneal, y en los tumores medianos y grandes se encuentra en más de 90% de los casos. La frecuencia de parálisis facial preoperatoria es baja (3.2%); en 5 a 6% de los casos se pueden reconocer fasciculaciones musculares. La parálisis facial se presenta más en meningiomas del ángulo pontocerebeloso. El VI y III pares craneales se afectan con menor frecuencia, sobre todo en tumoraciones mayores de 3 cm. Es común encontrar depresión del nistagmo optocinético hacia ambos lados, aunque también aparece depresión unilateral sin relación alguna con el lado de la lesión; de manera idéntica aparece depresión ipsolateral o contralateral respecto del tumor. Los individuos con estadios avanzados desarrollan síndrome craneohipertensivo con cefalea, visión borrosa y edema de la papila. La duración de los síntomas puede ser: 1. Corta (menos de dos años). 2. Intermedia (dos a cuatro años). 3. Tardía (más de cuatro años). Selesnick ha sugerido varios estadios de acuerdo con los síntomas encontrados en los neurinomas del acústico: 1. Estadio intracanalicular. Se caracteriza por la presencia de hipoacusia, acúfeno y vértigo. 2. Estadio cisternal. Existe empeoramiento de la hipoacusia, el vértigo disminuye y se torna más evidente el desequilibrio. 3. Estadio de compresión del tallo cerebral. Presenta hipoestesia corneal, cefalea de predominio occipital e inicio de ataxia. 4. Estadio de hidrocefalia y empeoramiento de la alteración del trigémino, afectación de la marcha, cefalea generalizada, pérdida visual, lesión de los pares craneales IX, X, XI y XII, aparición de espasticidad, debilidad muscular y muerte por herniación de las amígdalas cerebelosas. La incidencia de hemorragia intracraneal relacionada con tumores cerebrales es del 11% y en los schwannomas vestibulares del 1%. Yates notificó la muerte de un paciente con un schwannoma vestibuar grande (mayor de 2 cm) que presentó hemorragia y que en forma concomitante consumía warfarina por enfermedad coronaria. Estudios diagnósticos accesorios Prueba del reflejo estapedial. Es anormal en 85% de los casos; quizá el reflejo sea nulo, con umbrales altos, aumento de su latencia y presencia anormal de adaptación; además, la latencia del reflejo se considera la prueba más sensible para la detección de neurinomas del acústico. Respuestas auditivas del tallo cerebral. Consisten en el registro de una a siete ondas en los primeros 10 mseg de la aplicación de estímulos sonoros (capítulo 3). Los valores medios de tiempo entre las ondas I y III son de 2.07 mseg (con DE de 0.13), y entre las ondas I y V de 4.01 (con DE de 0.16). En esta prueba se estudian las siguientes constantes: a) Latencia interaural de la onda V; una diferencia de 0.4 mseg o más sugiere lesión retrococlear. b) Tiempos entre las ondas I y V; los valores de 4.33 mseg se consideran sospechosos y de 4.49 o mayores confirman la presencia de tumores del ángulo pontocerebeloso. En general, las respuestas auditivas del tallo cerebral tienen una sensibilidad de 92 a 98%, con un porcentaje de resultados falsos positivos de 5% y de falsos negativos de 2 a 4%. Valoración radiográfica. En 20% de los casos, las radiografías simples con proyecciones diferentes del vértice petroso (Stenvers, transorbitaria de Guillén) pueden mostrar en forma comparativa un ensanchamiento del conducto auditivo interno. En general, los siguientes criterios hacen pensar en una tumoración del conducto auditivo interno (CAI): a) Erosión del borde posterior de CAI. b) Adelgazamiento o erosión del techo de CAI. c) Ensanchamiento mayor de 2 mm en cualquier parte de CAI, en comparación con el contralateral. Las tomografías del vértice petroso son útiles en la fase preoperatoria cuando se planea la operación; sin embargo, en la actualidad se prefiere la tomografía axial computarizada de alta resolución con medio de contraste intravenoso, ya que en diferentes estudios Barrs y Brackman han mostrado una precisión hasta de 97% en tumores mayores de 1.5 cm, y de 48% en más pequeños. Cuando en un paciente con hipoacusia unilateral y alteración de las respuestas auditivas del tallo cerebral, la tomografía axial computarizada (TAC) con medio de contraste es negativa, el autor sugiere una nueva TAC con inyección previa de 4 a 5 cm de aire o CO2 mediante punción lumbar del espacio subaracnoideo (método de Liliequist, 1959). De esta manera se registra una cisternografía con gas, método que tiene una sensibilidad muy alta para la detección de pequeños neurinomas del acústico (menores de 1.5 cm). El diagnóstico se efectúa por la falta de entrada de aire en CAI o cuando el llenado es parcial. ERRNVPHGLFRVRUJ Lesiones otoneurológicas Tratamiento Estos tumores se tratan de manera quirúrgica. En tumoraciones intrameatales en sujetos con hipoacusia superficial a moderada, la fosa media es la vía indicada, a fin de tratar de preservar la audición. Se sugiere el empleo transoperatorio vigilado de respuestas auditivas del tallo cerebral, con lo que el cirujano puede detectar, durante la disección del tumor, cambios en los potenciales auditivos por isquemia transitoria o lesión directa del nervio. En ese sentido, en tumores de 0.5 a 1.0 cm se puede preservar la audición en 56% de los casos; en tumores de 1.1 a 1.4 cm, en 38% de los casos; en tumores de 1.5 a 2.0 cm, en 16%; y en tumores mayores de 2 cm el porcentaje es prácticamente nulo. El resto de las tumoraciones puede abordarse por vía translaberíntica, la cual puede combinarse con la suboccipital. En malformaciones adheridas al tallo cerebral, se logra preservar la continuidad anatómica del nervio facial en 90 a 95% y se consigue una función normal de este nervio en 88% de los individuos con tumores intrameatales medianos y 50 a 60% de tumoraciones grandes (mayores de 3 cm). De 9 a 10% de los enfermos requieren procedimientos quirúrgicos posteriores para rehabilitar la parálisis facial; en ellos, la técnica de la anastomosis hipogloso-facial ha mostrado ser satisfactoria. El tratamiento neurootoquirúrgico de los neurinomas del acústico tiene morbilidad y mortalidad bajas, gracias al desarrollo de la microcirugía. House encontró meningitis posoperatoria en 6% de los casos, fístulas de LCR en 1.7% y mortalidad perioperatoria de 0.86%, por lo que la resección también puede considerarse en personas mayores de 60 años en buen estado de salud. Las recurrencias posteriores a su extirpación total son raras, con una incidencia de 0.3% y un intervalo de tiempo de aparición de 10 años. En individuos con tumores unilaterales en oído único con audición, o en caso de tumores bilaterales, se ha sugerido una descompresión quirúrgica a través de la fosa media y seguimiento mediante resonancia magnética. Nissen ha empleado con éxito el láser KTP–532, el cual es preferible sobre el CO2 porque en los tejidos neurales produce una zona central de destrucción o vaporización, con un área periférica de necrosis envuelta por edema tisular. Su rayo se transmite en forma eficiente Figura 8–2. Tomografía axial computarizada que muestra un neurinoma del acústico. ERRNVPHGLFRVRUJ Capítulo 8 En los últimos 10 años, la resonancia magnética ha sobrepasado a la tomografía axial computarizada en el diagnóstico del neurinoma del acústico, dado que es más sensible a lesiones de 10 mm o menos de diámetro, además de que es un método no invasivo y, con el desarrollo de un eco de giro rápido en T2, muchas veces no es necesario el uso de material de contraste como el gadolino (figura 8-2). 185 185 186 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 8 a través del líquido cefalorraquídeo y las soluciones de irrigación. Redleaf y McCae informaron el caso de una mujer en el sexto decenio de la vida, a quien se le extrajo un neurinoma del acústico intrameatal de 0.5 cm y que al quinto año desarrolló una recurrencia tumoral de 18 mm localizada en el ángulo pontocerebeloso. Está indicada una conducta expectante. La tomografía axial computarizada, al cuarto año posterior, reveló ausencia de dicha tumoración. Se cree que los mecanismos que originaron la involución del neurinoma del acústico se relacionan con lo siguiente: 1. Una necrosis interna. 2. Afectación de la irrigación tumoral. 3. Cambio en el crecimiento tumoral vinculado con la edad. MENINGIOMAS DEL ÁNGULO PONTOCEREBELOSO En 1922, Cushing introdujo el término meningioma para describir en términos anatómicos un grupo de tumores benignos adheridos a las meninges. En éstos se ha identificado una anomalía genética característica que consiste en la monosomía del cromosoma 22. Comprenden 14% de las neoplasias intracraneales y el segundo lugar en frecuencia de las del ángulo pontocerebeloso. Son malformaciones de crecimiento lento y por tanto permanecen latentes y asintomáticas mucho tiempo. Surgen de acumulaciones celulares de las vellosidades aracnoideas. Hata ahora se han reconocido 13 subtipos histológicos. De éstos, el meningioma de células claras representa el 0.2% y se caracteriza por un comportamiento agresivo con tendencia a la recidiva. Las manifestaciones clínicas son muy parecidas a las del neurinoma del acústico y los síntomas más frecuentes son hipoacusia, vértigo o inestabilidad y acúfeno. En condiciones normales transcurre un gran lapso desde el inicio de los síntomas hasta que el paciente acude a consulta y se diagnostica. Los pares craneales más afectados en orden de frecuencia son VIII (80%), V (73%), VII (53%), IX (30%) y X (13%). En un estudio de 32 casos de meningiomas del ángulo pontocerebeloso confirmados de modo histológico, Granik encontró que 85% de los tumores medía 3 cm o más. En estudios tomográficos se registraron calcificaciones en 24% e hidrocefalia en 33%. Una característica radiográfica es que la densidad de estas neoplasias es mayor respecto de la masa cerebral que las rodea (figura 8–3). Para el diagnóstico también se usa la resonancia magnética con medio de contraste (gadolino) o con eco de giro rápido, lo que suministra mayor definición que la tomografía axial. El tratamiento es quirúrgico, por vías suboccipital o translaberíntica. Figura 8–3. Tomografía axial computarizada de cráneo que muestra un meningioma en la fosa media. Nótese que la densidad de la tumoración es mayor que la de la masa encefálica. ERRNVPHGLFRVRUJ Lesiones otoneurológicas COLESTEATOMA (QUISTE EPIDERMOIDE) GRANULOMAS DE COLESTEROL DEL VÉRTICE PETROSO Al parecer se deben a una reacción inflamatoria inespecífica de cuerpo extraño, con formación de cristales de colesterol. Por lo general se localizan en la región posterior al conducto carotídeo horizontal, tienen forma ovoide y miden, al momento de su diagnóstico, 2 a 4 cm de longitud. Se distinguen por ser masas homogéneas y sin calcificaciones, cuya densidad no aumenta después de la venoclisis de medio de contraste, ya que ésta es similar a la del tejido cerebral. Están compuestos de colesterol, grasa y hemosiderina. El estudio de resonancia magnética muestra señales de alta intensidad en T1 y T2, aunque en algunos casos se pueden encontrar intensidades bajas en T2. Su desarrollo se ha relacionado con una deficiente ventilación, interferencia con el drenaje y hemorragias en un espacio habitualmente neumatizado que producen una presión negativa, resorción de aire, edema de la mucosa y, en forma eventual, formación de granulomas de colesterol, generados por el catabolismo de la hemoglobina o la destrucción del tejido local. Su pared está integrada por tejido conectivo fibroso y carece de epitelio escamoso queratinizado, situación que lo diferencia de los quistes epidermoides. Las lesiones del ápex petroso producen síntomas clínicos por compresión de estructuras adyacentes, como los pares craneales V al VIII, trompa de Eustaquio, arteria carótida, tallo cerebral y erosión de la base del cráneo o la cápsula ótica. Entre los síntomas más frecuentes se encuentran la cefalea, casi siempre ipsolateral, otalgia, sensación de presión en el oído, diplopía, vértigo, hipoacusia de tipo neurosensorial o mixta, parálisis facial y parestesias en cara sobre la distribución de V2. Por lo regular, los granulomas de colesterol permanecen asintomáticos hasta alcanzar estadios avanzados en su desarrollo y el efecto de esta entidad sobre la porción vestibular del VIII par craneal es tan gradual que muchas veces los pacientes no reconocen el déficit. La adición de un componente conductivo a la hipoacusia se debe a obstrucción de la trompa de Eustaquio o la compresión de ésta, cuando la lesión se extiende en forma anterior e inferior en la fosa craneal media. La porción eferente del nervio facial es relativamente resistente a la compresión por estos granulomas; por lo tanto, no es frecuente observar parálisis faciales. Es más común encontrar movimientos faciales involuntarios. El crecimiento de los granulomas de colesterol puede tener las siguientes direcciones: 1. En forma anterior, con invasión del conducto carotídeo y deformación o compresión de la trompa de Eustaquio. 2. En forma medial, con erosión del clivus y desplazamiento hacia el seno cavernoso, con déficits sensoriales o motores de los pares craneales III, IV, V y VI. 3. En forma posterior, con compresión del tallo cerebral. 4. En forma inferior, al erosionar la fosa yugular o el conducto del hipogloso, lo que provoca una parálisis adjunta de los pares craneales IX, X, XI y XII. 5. En forma lateral, tras invadir la cavidad timpánica y semejar un colesteatoma congénito o adquirido del oído medio 6. En forma superior, al desplazar al lóbulo temporal y producir de manera intermitente o constante cefaleas parietales o temporales. Debe establecerse el diagnóstico diferencial con quistes epidermoides y mucoceles. Se considera que hay un granuloma de colesterol del vértice petroso por cada 30 ERRNVPHGLFRVRUJ Capítulo 8 Estas tumoraciones surgen de remanentes epiteliales aberrantes durante el cierre de la gruta neural, en la tercera y quinta semanas de vida fetal. Comprenden menos de 1% de las neoplasias intracraneales y la mayor parte se localiza en el ángulo pontocerebeloso (30 a 40%); representan 6% de los casos de tumores de esta área. Producen diferentes grados de destrucción ósea y erosión de la cóclea, el laberinto vestibular y el conducto auditivo interno. Causan hipoacusia neurosensorial, parálisis facial e hipostesia facial; en ocasiones también se relacionan con hemiespasmos faciales. En los estudios radiográficos (tomografía axial computarizada) aparecen como lesiones homogéneas hipodensas. En la resonancia magnética se reconocen señales de baja intensidad en T1 y de alta intensidad en T2. La discrepancia entre la extensión de la tumoración y los escasos síntomas referidos por el paciente constituyen una característica distintiva. Esta enfermedad se presenta con mayor frecuencia en la población adulta joven (30 a 50 años). Los quistes crecen en forma concéntrica por acumulación de queratina en su interior y a medida que ésta aumenta de volumen, aquéllos se delinean en los lugares de menor resistencia, de tal forma que pueden llenar todos los recesos de las cisternas prepóntica y pontocerebelosa, circundando así a nervios y vasos de la región. Sanna clasifica los colesteatomas de la porción petrosa del temporal en cinco clases: I, supralaberíntica, localizada en el ganglio geniculado del nervio facial; II, infralaberíntica, situada en la región hipotimpánica y celdillas infralaberínticas; III, infralaberíntica–apical, ubicada en el compartimiento infralaberíntico y que alcanza al conducto auditivo interno de la porción petrosa, afecta los segmentos vertical u horizontal de la arteria carótida interna, así como la fosa posterior a través de las celdillas retrofaciales; IV, masiva, que afecta por entero a la cápsula ótica, tanto a la dura de la fosa posterior como al conducto auditivo interno, ápex petroso, porción superior y media del clivus, seno esfenoidal y compartimiento infralaberíntico; y V, apical, con afectación del ápex petroso, fosa craneal posterior, V par craneal, clivus, seno esfenoidal y compartimiento infralaberíntico. El tratamiento es quirúrgico y depende de la extensión de la lesión, por lo que se puede emplear un abordaje translaberíntico combinado con la vía infratemporal y transtemporal. 187 187 188 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 8 neurinomas del acústico. El tratamiento es quirúrgico y consiste en drenaje de la lesión con aireación permanente para prevenir recurrencias. Se utiliza la vía translaberíntica cuando se han destruido la audición y función vestibular. Cuando la audición no se ha afectado en grado considerable, se puede recurrir a la vía retrolaberíntica o la de la fosa media. Si es posible, se recomienda exteriorizar estos quistes a través del oído medio y la mastoides. También se puede usar el abordaje infratemporal de Fisch. En esta vía se drena y oblitera el quiste, en tanto que el conducto auditivo externo se cierra a manera de saco ciego. Esta técnica posibilita una exposición amplia de la lesión y la toleran bien los pacientes (figura 8–4). GLIOMAS DEL NERVIO ACÚSTICO Son los tumores intracraneales más comunes. Por lo regular afectan al cerebro y rara vez aparecen en el ángulo pontocerebeloso, en donde se limitan al VIII par. En el plano histológico puede ser difícil diferenciar entre un glioma y un tumor de tipo Antoni B. Es útil la tinción de reticulina de Wilder, ya que los gliomas rara vez la contienen, a excepción de los que se presentan alrededor de los vasos sanguíneos. También ayuda al diagnóstico la presencia de la proteína ácida glial fibrilar, dado que es un antígeno específico para astrocitos. Los gliomas del tallo ocurren más en niños, producen anomalías de la motilidad ocular, signos cerebelosos y rara vez comprometen al nervio acústico; cuando lo hacen interviene más la degeneración de las fibras nerviosas y menos la infiltración por la neoplasia. El tratamiento de estos gliomas incluye resección y radioterapia. LIPOMAS DEL ÁNGULO PONTOCEREBELOSO Representan alrededor de 0.1% de los tumores cerebrales. Se considera que resultan de un proceso anormal del desarrollo. Su localización cerebral más frecuente es el cuerpo calloso y representan menos del 0.14% de todos los tumores del ángulo pontocerebeloso. Predominan en el sexo masculino en relación de 2.4:1. Estas malformaciones son radiotransparentes y por su consistencia rara vez producen efecto de masa (compresión) sobre el tallo cerebral, por lo que debe valorarse con cuidado una intervención quirúrgica, ya que por lo general no es necesaria. La mayor parte de estas neoplasias produce síntomas similares a los del neurinoma del acústico, puesto que envuelven al nervio cocleovestibular. La tomografía axial Figura 8–4. Angiografía que muestra un aneurisma de la arteria carótida interna en el foramen lacerum. ERRNVPHGLFRVRUJ Lesiones otoneurológicas HAMARTOMAS DEL ÁNGULO PONTOCEREBELOSO Los hamartomas consisten en el agrupamiento anormal de tejido que normalmente se encuentra en el órgano afectado. Existen pocos casos en las publicaciones médicas. En 1980, Babin notificó dos hamartomas, uno del conducto auditivo interno y otro del ángulo pontocerebeloso, sin síntomas neurootológicos. También se han descrito hamartomas mesenquimatosos en oído medio, con obstrucción de la trompa de Eustaquio y en el pabellón auricular. Hiperplasia papilar endotelial intravascular del conducto auditivo interno. Es una lesión vascular poco frecuente que describió por vez primera Pierre Mason en 1923 en el plexo hemorroidal. Aunque lo aparente, no es una neoplasia sino una proliferación excesiva de las células endoteliales en los vasos sanguíneos. Se relaciona con pérdida auditiva, acúfeno e inestabilidad. Se diagnostica a través de la resonancia magnética y su tratamiento es quirúrgico, con posible aplicación también de radioterapia. Osteomas del conducto auditivo interno. Consisten en tumoraciones óseas raras únicas, algunas veces bilobuladas, que producen estenosis del conducto auditivo interno con compresión del VIII par craneal. Predominan en el sexo femenino entre el tercero y quinto decenios de la vida y se distinguen por causar hipoacusia progresiva neurosensorial, acúfeno y episodios aislados o constantes de vértigo. Su diagnóstico se establece mediante tomografía axial computarizada. Su abordaje es a través de la fosa media o por la vía suboccipital y consiste en el fresado del osteoma; en caso de vértigo intenso preoperatorio, se sugiere la sección del nervio vestibular. También se ha informado la presencia de exostosis, es decir, malformaciones con una base de implantación ancha en número mayor de uno y que se vinculan con desequilibrio crónico; se recomienda una conducta expectante o bien la resección mediante un abordaje retrosigmoideo. Enfermedad de Camurati–Engelmann (displasia diafisal progresiva). Se trata de una enfermedad ósea esclerótica progresiva que afecta por lo regular a las diáfisis de los huesos largos y el cráneo. Puede afectar a pares craneales como el nervio óptico, el trigémino, el facial y el estatoacústico, estos dos últimos en relación con el desarrollo de estenosis del conducto auditivo interno. Es útil el tratamiento con esteroides, así como la descompresión del conducto por la vía suboccipital. Linfomas del ángulo pontocerebeloso. La incidencia de linfomas primarios del SNC se ha incrementado en años recientes y constituyen 3% de los tumores intracraneales. La mayor parte corresponde a las formas supratentoriales y la fosa posterior se afecta en menos de 20% de los casos. Se presentan lesiones intracraneales múltiples en 33%. Pueden aparecer en nexo con enfermedades del colágeno, como el lupus eritematoso sistémico o el síndrome de Sjögren, sarcoidosis, síndrome de inmunodeficiencia adquirida y enfermedad por virus de Epstein–Barr. Los pacientes presentan síntomas semejantes a los de la encefalitis, enfermedad cerebrovascular, enfermedades desmielinizantes, y pueden comprometer a pares craneales. Menos de 5% de los casos de linfoma cerebral se vincula con enfermedad sistémica en el momento de su presentación. En la resonancia magnética se observan señales de alta intensidad en T1 y T2. El tratamiento se basa en corticoesteroides, altas dosis de metotrexato y radioterapia. OTRAS TUMORACIONES TEMPORALES Y DE LA BASE DEL CRÁNEO DISPLASIA FIBROSA DEL HUESO TEMPORAL Esta enfermedad se caracteriza por la presencia de tejido fibroóseo en el interior de las partes afectadas del hueso. Comprende 25% de todas las neoplasias óseas y 7% de los tumores benignos óseos. Es más frecuente en mujeres que en varones, en proporción de 2:1. Hay tres formas clínicas: 1. Monostótica: afecta sólo un hueso (casi siempre fémur, tibia o costilla). 2. Poliostótica: incluye varios huesos, sobre todo las extremidades inferiores. 3. Síndrome de McCune–Albright: es una forma poliostótica con hiperpigmentación de la piel y alteraciones endocrinas. En el momento del diagnóstico, la mayoría de los pacientes tiene 10 a 20 años de edad. Con respecto al oído, lo más común es que se presenten grados variables de hipoacusia con aumento de volumen en la región temporal y se afecten más las porciones mastoidea y petrosa de este hueso. El diagnóstico radiográfico diferencial se establece con el granuloma eosinófilo, la osteítis fibrosa quística y la enfermedad de Paget. Se desconoce la causa de este padecimiento. Se puede presentar una transformación maligna con una incidencia del 0.5% de los pacientes. En el síndrome de McCune-Albright alcanza el 4%. Entre las alteraciones endocrinas vinculadas con este síndromes se encuentran anomalías de la glándula tiroides, aumento de la hormona de crecimiento de la corticotropina, con disminución de las concentraciones de fósforo. En el plano radiográfico hay una expansión ósea de tipo Paget, ERRNVPHGLFRVRUJ Capítulo 8 computarizada delinea lesiones hipodensas homogéneas que no captan el medio de contraste. En la resonancia magnética con técnica de supresión de grasa se reconoce una señal hiperintensa en T1 e hipointensa o isointensidad en T2. Se caracterizan por la dificultad de su resección quirúrgica, dado que infiltran en forma profunda a los nervios, por lo que a menudo su resección es incompleta y se sugiere abordarlos sólo en casos en que sea necesaria una descompresión. 189 189 190 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 8 con áreas alternadas radiolúcidas y radiopacas. También puede observarse un patrón de tipo esclerótico con expansión ósea y radiodensidad homogénea. Las lesiones asintomáticas se deben vigilar en forma regular sin intervención. Cuando la enfermedad se torna sintomática, se requiere tratamiento quirúrgico como la descompresión de parea craneales, tratamiento de la estenosis del conducto auditivo externo y la protrusión de la apófisis mastoides. La radioterapia tiene escasa utilidad y puede inducir transformación maligna. CORDOMA CONDROIDE Es una tumoración benigna, de crecimiento lento, que se deriva de restos ectópicos de la notocorda. Luschka lo describió por primera vez en 1856. El cordoma condroide es una variedad distinta, al parecer con mejor pronóstico que el cordoma ordinario o el condrosarcoma. Klebs publicó el primer caso clínico de esta tumoración que afectaba la base del cráneo. Ribbert logró inducir estas tumoraciones de manera experimental en conejos, al puncionar el ligamento espinoso anterior y romper el núcleo pulposo. También muestra una frecuencia de 2% de ectopia notocordal en la región del clivus en estudios de necropsia. El núcleo pulposo es la única estructura de la notocorda que normalmente permanece en el hombre. Desde el punto de vista histológico, es típica la presencia de células vacuoladas, con una matriz mucinosa intercelular. La matriz del condroide se tiñe con ácido fosfotúngstico y con hematoxilina–eosina, así como reticulina; la del cordoma no. Ambos se tiñen con Sudán III, PAS y azul de toluidina. Heffelsinger encontró esta variedad en 22 de 177 casos de cordomas y tumores cartilaginosos de la región basooccipital. Es fácil confundirlos con condrosarcomas y osteocondromas. El 45% de los condromas se localiza en la región sacrococcígea, 40% en el cráneo y 15% en las vértebras. Cerca de 30% de los cordomas de la región occipitobasal pertenece a la variedad condroide y tiene ligera predilección por el sexo femenino. Los síntomas que más se presentan son: diplopía (60 a 90%), cefalea (75%), parálisis del VI par (50%), afectación de campos visuales (25%), papiledema (12%) y afectación hipofisaria (12%). En 25 a 30% se reconoce una masa nasal visible. En 75% hay pruebas radiográficas de erosión occipitobasal, sobre todo en el clivus y la silla turca. La variedad condroide se relaciona más con calcificaciones. La arteriografía muestra, en forma típica, avascularidad. El tratamiento consiste en operación de la base del cráneo por vía lateral para eliminar lo más posible la tumoración, en combinación con radioterapia en dosis de 60 a 80 Gy. El pronóstico es más optimista para la formación condroide del cordoma. Son malformaciones poco radiosensibles y la quimioterapia no ha sido eficaz. Condroblastoma del hueso temporal. Consiste en una rara tumoración benigna que se origina en las células de la lámina endocondrial. Representa 1% de todos los tumores óseos primarios y 2% de los que surgen en los huesos del cráneo. Predomina entre el cuarto y quinto decenios de la vida y en el sexo masculino en relación de 2.3:1. Cuando se localiza en el hueso temporal, se vincula con hipoacusia, otalgia, acúfeno y sensación de presión en el oído. La exploración clínica revela una masa en el conducto auditivo externo o la región temporal. Su tratamiento es quirúrgico. CONDROSARCOMAS DE LA BASE DEL CRÁNEO Son tumores muy raros. La frecuencia de todos los sarcomas de cabeza y cuello no es mayor de 1% de todas las neoplasias malignas de esta zona. Se cree que 10% ocurre en cabeza y cuello. La localización temporal representa 0.16% de todos las malformaciones intracraneales. Se piensa que surgen de restos celulares cartilaginosos en la base del cráneo. Cuando afectan al esfenoides son casi siempre paraselares y pueden destruir el clivus o la silla turca. Son de crecimiento lento y emiten metástasis tardías en 15% de los casos. La información radiográfica muestra destrucción ósea sin calcificaciones, con bordes poco definidos y sin reacción en la periferia; la tomografía axial computarizada con medio de contraste es de gran utilidad, al igual que los estudios angiográficos en caso de afectación intratemporal. Los pares craneales que se lesionan de manera regular son, en orden de frecuencia, VI, VII, VIII, X, V, IX y XII. Tratamiento Es quirúrgico, pero si no es posible extirpar toda la tumoración se combina con radioterapia de protones, ya que es resistente a la convencional. SARCOMA OSTEÓGENO En una revisión de 1 200 casos de Huvos, en el Memorial Sloan–Kettering Cancer Center, se reconocieron 19 sarcomas de cráneo con una frecuencia de 1.6%; sin embargo, sólo 10 (menos de 1%) fueron primarios y los restantes secundarios, superpuestos a enfermedad de Paget, displasia fibrosa o como complicación posterior a la radioterapia. La edad media de los pacientes fue de 38 años y la duración de los síntomas de dos meses a cinco años. El aumento de la fosfatasa alcalina es un dato inespecífico. Por medio de los rayos X, las lesiones pueden ser de tipo lítico, esclerótico o mixto. El tratamiento recomendado es la quimioterapia preoperatoria (metotrexato, bleomicina, ciclofosfamida y dactinomicina, o adriamicina con cisplatino), seguida de cirugía ablativa. ADENOCARCINOMA PRIMARIO DEL HUESO TEMPORAL Hasta el momento se han publicado unos 60 casos de tumores adenomatosos primarios del hueso temporal. ERRNVPHGLFRVRUJ Lesiones otoneurológicas 1. Traqueotomía y colocación de sonda nasogástrica. 2. Ligadura de la vena yugular interna. 3. Parotidectomía superficial. 4. Mastoidectomía radical amplia. 5. Luxación anterior del cóndilo mandibular. 6. Obliteración del seno venoso lateral. 7. Extracción de la tumoración, que estaba muy adherida al tallo cerebral y cerebelo; se sacrificaron los pares craneales IX y XII. La evolución posoperatoria no mostró contratiempos y se aplicaron después 60 Gy de radioterapia; el paciente se mantuvo sin la enfermedad dos años después de la intervención. CARCINOMATOSIS MENÍNGEA Consiste en una infiltración difusa de las meninges por carcinoma metastático. Cerca de 5% de los individuos con cáncer puede desarrollar una carcinomatosis leptomeníngea durante el transcurso de su enfermedad. Al afectarse las meninges del conducto auditivo interno se presenta hipoacusia neurosensorial progresiva,/o súbita, además de parálisis facial. LESIONES DE ORIGEN VASCULAR CIRCULACIÓN DE LA FOSA POSTERIOR DEL CRÁNEO Se origina en el polígono de Willis, formado por la confluencia de las dos arterias vertebrales en el tronco basilar, el cual a su vez se bifurca al final para formar las dos arterias cerebrales posteriores. Las dos arterias carótidas emiten las ramas cerebrales anteriores y medias, así como las comunicantes posteriores que se anastomosan con las cerebrales posteriores. La porción terminal del tronco basilar contiene la arteria mesencefálica, que se conecta de manera embrionaria con la arteria cerebral posterior. Las colaterales de las arterias vertebrales, la arteria basilar y las arterias mesencefálicas forman tres grupos diferentes: a) Arterias paramedias, que se dirigen al parénquima nervioso, penetrando y ramificándose en su interior. b) Arterias circunferenciales cortas, que siguen un corto tramo a través de la superficie de la sustancia nerviosa, al cabo del cual penetran en el encéfalo. c) Arterias circunferenciales largas, que se desprenden de las arterias vertebrales y basilar siguiendo el tallo cerebral y el cerebelo, y proyectando ramas colaterales al interior; las ramas terminales llegan al parénquima encefálico. Estas arterias se encuentran representadas por cuatro troncos: 1. Arteria cerebelosa superior. Se origina detrás de la terminación rostral de la arteria basilar y da origen a pequeños vasos perforantes que se dirigen a la región externa del tegmento protuberancial; asimismo, emite una rama importante que termina en la cara dorsolateral del cerebelo. La rama terminal de la arteria cerebelosa superior se bifurca para dirigirse de forma caudal sobre la cara dorsal del hemisferio cerebeloso. 2. Arteria cerebelosa inferior. Es la colateral más caudal de la arteria basilar. Su curso es muy variable. Forma ramas perforantes para la zona parasagital de la protuberancia. Es común que siga paralela a los nervios facial y vestibulococlear, los rodea o pasa entre ellos, justo antes de que éstos penetren al conducto auditivo interno. Asimismo, se distribuye por la superficie inferior de los hemisferios cerebelosos. 3. Arteria cerebelosa posterior. Surge de la cara lateral de la arteria vertebral, en dirección rostrolateral por la superficie del bulbo raquídeo, para dar origen a numerosas ramas perforantes que penetran al bulbo y perfundir su zona dorsolateral, justo detrás de la oliva bulbar. Se divide en una rama externa y otra interna; la primera riega las dos terceras partes caudales de la base y las porciones externas de los hemisferios cerebelosos, en tanto que la interna irriga la porción interna de estos hemisferios y la parte más caudal del vermis 4. Arteria laberíntica. Puede originarse de forma independiente de la arteria basilar o como colateral de la arteria cerebelosa inferior. Acompaña el trayecto de los nervios facial y vestibulococlear, para penetrar en el conducto auditivo interno y llegar al laberinto. SÍNDROME BULBAR PARAMEDIANO La región paramedial del bulbo raquídeo recibe su aporte sanguíneo de arterias pequeñas que se originan en las vertebrales y la espinal anterior. La oclusión de dichas arterias o algunas de sus ramas puede ocasionar parálisis ipsolateral de la lengua, hemiplejía alterna, cuadriplejía, cuadriparesia y, en ocasiones, hipestesia contralateral transitoria. SÍNDROME LATERAL BULBAR La cara externa del bulbo raquídeo recibe irrigación en su porción más rostral por ramas del extremo proximal de la arteria basilar y en su porción más caudal por ramas ERRNVPHGLFRVRUJ Capítulo 8 Gulya y Glasscock señalaron el caso de un paciente de 55 años de edad con acúfeno en oído izquierdo, de 12 años de evolución, hipoacusia ipsolateral progresiva y otalgia intermitente. La tomografía axial computarizada mostró que la tumoración afectaba la porción petrosa del hueso temporal, con extensión hacia la fosa craneal posterior. Se resecó la tumoración a través de una vía infratemporal modificada, que consistió en lo siguiente: 191 191 192 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 8 de la arteria cerebelosa posterior. La obstrucción de esta arteria produce el síndrome de Wallenberg, caracterizado por la presencia de vértigo intenso de aparición brusca, con hipoestesia ipsolateral facial y contralateral en el resto del cuerpo. Estos síntomas pueden acompañarse de síndrome de Horner y descoordinación en el mismo sitio de la lesión. En ocasiones, la exploración neurootológica muestra nistagmo horizontal rotatorio ipsolateral del lado de la lesión, además de paresia vestibular unilateral en las pruebas térmicas, con o sin preponderancia direccional. SÍNDROME PARAMEDIANO PROTUBERANCIAL Las lesiones en la zona paramediana de la protuberancia son muy frecuentes y la mayor parte es efecto de enfermedad vascular. Es común que el único síntoma de lesión sea la aparición del signo de Babinski. Las anomalías de mayor tamaño pueden dar lugar a hemiparesia contralateral, al principio flácida y después espástica, pero lo más frecuente es que la paresia se limite a un miembro. Algunas veces las lesiones pónticas son bilaterales. SÍNDROME LATERAL PROTUBERANCIAL Este síndrome se debe a oclusión de las ramas circunferenciales cortas que nacen de la arteria basilar. Se reconoce por trastornos cerebelosos ipsolaterales a la lesión. Además, hay alteraciones sensoriales, consistentes en hemianestesia contralateral y déficit sensorial de la mitad ipsolateral de la cara. SÍNDROME DORSOLATERAL PROTUBERANCIAL Se produce por oclusión de la arteria cerebelosa inferior. Cuando el síndrome es completo, incluye hipoalgesia y termohipoestesia contralateral del tronco y las extremidades, e ipsolateral en el territorio del trigémino. Además, puede haber sordera del lado de la lesión, ya que la arteria auditiva interna nace con frecuencia de la cerebelosa inferior. El síndrome de Horner se presenta de forma constante, así como hemiataxia y otros signos de déficit cerebeloso en el lado de la arteria trombosada. SÍNDROME DEL TEGMENTO PROTUBERANCIAL Es consecuencia de oclusión de algunas ramas de la arteria cerebelosa superior. Éstas penetran por la superficie lateral del mesencéfalo y se dirigen a la porción más rostral del tegmento protuberancial. La afectación del haz central del tegmento puede producir mioclono velopalatino. SÍNDROME MESENCEFÁLICO PARAMEDIANO En este síndrome es frecuente observar parálisis de los pares craneales III y IV, ipsolaterales a la lesión, con hemianestesia contralateral. Cuando se afectan el núcleo rojo, el tubo rubrotalámico y la porción más inferior del tálamo, existe hemiasinergia con temblor de acción sin parálisis extraoculares ni déficit sensorial. En general, las lesiones del tegmento mesencefálico y del núcleo rojo producen temblor, movimientos atetósicos y coreiformes, ataxia y trastornos del equilibrio. SÍNDROME DORSOLATERAL MESENCEFÁLICO Se desarrolla por oclusión de las ramas circunferenciales largas de la arteria mesencefálica, en particular de las que se dirigen a la placa cuadrigémina. Las lesiones en esta zona ocasionan deficiencia cerebelosa ipsolateral, acompañada de síndrome de Horner, analgesia y termoestesia contralateral. Asimismo, quizás haya hipoacusia ipsolateral, contralateral o bilateral. TROMBOSIS DE LA ARTERIA AUDITIVA INTERNA Se relaciona con sordera súbita y pérdida de la función vestibular. Los síntomas dependen del grado de afectación de las ramas vestibulares, vestibulococlear y coclear. El vértigo puede ser incapacitante y las pruebas calóricas muestran paresia vestibular ipsolateral. VÉRTIGO POR COMPRESIÓN DEL NERVIO VESTIBULAR POR UN VASO ARTERIAL La pulsación de la arteria cerebelosa anteroinferior sobre las raíces del nervio trigémino es capaz de producir “tic doloroso”. Se ha descrito un mecanismo similar para explicar los casos de espasmo hemifacial. Jannetta propone que los acodamientos redundantes vasculares en el ángulo pontocerebeloso pueden interferir con el VIII par craneal y los estudios de Makin demuestran la existencia de éstos por fuera del conducto auditivo interno (CAI) en 78% de los casos, en la entrada del CAI en 12% y en la luz del CAI en 10%. Cuando aparece en las respuestas auditivas del tallo cerebral una latencia de intervalo mayor de 0.2 mseg entre las ondas I y III, cuando se comparan en forma bilateral, es probable la compresión del VIII par. Los acodamientos vasculares en el CAI pueden producir nistagmo espontáneo, hipoacusia sensorial con pruebas calóricas normales, y se relacionan con episodios recurrentes de vértigo, con desequilibrio e inestabilidad continuos e intolerancia al movimiento. En 1983, McCabe publicó un estudio en el cual ocho pacientes desarrollaron vértigo resistente por compresión vascular del nervio vestibular superior por la arteria cerebelosa anteroinferior. En todos los casos desapareció el vértigo después de seccionar el nervio vestibular por la fosa media o vía translaberíntica. En el preoperatorio ERRNVPHGLFRVRUJ Lesiones otoneurológicas es frecuente encontrar intolerancia al movimiento, que precipita los ataques vertiginosos. ANEURISMAS Aneurismas de la porción petrosa de la arteria carótida interna Estos aneurismas son raros y a menudo se acompañan de periodos de epistaxis espontánea atraumática, otorragia, acúfeno, grados variables de hipoacusia y vértigo. Otros síntomas referidos son parestesias y paresias faciales, diplopía, ptosis, disfonía, disfagia, cefalea, y en ocasiones se puede identificar con el otoscopio una masa azulada o rojiza en oído medio, o quizás aparecer como una masa pulsátil o no en la nasofaringe. Su diagnóstico se establece por tomografía axial computarizada, con medio de contraste, arteriografía con resonancia magnética y arteriografía carotídea. También se han informado casos de seudoaneurismas iatrogénicos de la arteria ca- rótida interna posteriores a toma de muestra para biopsia o aspiración de la región amigdalina. El tratamiento de estos aneurismas es quirúrgico, mediante la vía de la fosa infratemporal, con transposición del nervio facial y reparación directa de la arteria con anastomosis terminoterminal, posterior a la escisión del aneurisma. Sin embargo, cuando éste se extiende hasta el foramen lacerum, sólo se liga la arteria carótida, por falta de exposición del segmento arterial distal. En el hueso petroso hay cuatro ramas de la arteria carótida interna: 1. Arteria caroticotimpánica. 2. Arteria pterigoidea. 3. Arteria cavernosa. 4. Arteria hipofisaria. El vaso más afectado es el caroticotimpánico. También se han obtenido resultados exitosos con la embolización a través de balones de látex por vía de la arteria femoral. Las endoprótesis coronarias con la aplicación de rollos de platino desprendibles también han demostrado ser un tratamiento endovascular útil (figura 8-4). FÍSTULA POSTRAUMÁTICA ENTRE ARTERIA CAROTÍDEA Y SENO CAVERNOSO Esta fístula se desarrolla cuando una fractura de la base del cráneo tiene la suficiente fuerza para desgarrar la arteria carótida al atravesar el área del seno cavernoso, un plexo venoso que rodea a esta arteria, en el plano anterior mediante las venas oftálmicas superior e inferior y el plexo pterigoideo, y en el posterior por la vena petrosa superficial. Los signos y síntomas más comunes incluyen diplopía y visión borrosa, relacionados con la ingurgitación de las venas oftálmicas, de tal manera que se producen exoftalmos y compresión del VI par. A través del ojo dañado se ausculta la presencia de un soplo, aunque en ocasiones también se percibe sobre el cráneo. El diagnóstico se establece mediante una arteriografía carotídea bilateral. También son de utilidad la ultrasonografía con Doppler y la resonancia magnética con arteriografía y venografía. La ligadura intracraneal de esta fístula, método que sugirieron Hamby y Dohn, quizá no sea satisfactoria por el llenado retrógrado de la fístula a través de la arteria oftálmica. Por consiguiente, esta lesión debe tratarse por medios quirúrgicos, además de ligar dicho vaso; lo mismo se efectúa con la porción supraclinoidea de la arteria carótida interna. La oclusión por medio de balones intraarteriales parece ofrecer resultados más promisorios. Fístulas arteriovenosas durales Estas fístulas comprenden 10 a 15% de todas las malformaciones arteriovenosas y lo más frecuente es que comprometan la dura con el seno sigmoides o transverso y la arteria meníngea media o la occipital. Predominan en el sexo femenino y el síntoma más común es la presencia de acúfeno pulsátil. A medida que progresa la enfermedad, el acúfeno puede disminuir e incluso desaparecer por obstrucción del flujo venoso. ERRNVPHGLFRVRUJ Capítulo 8 Son dilataciones que pueden presentarse en las arterias intracraneales y que producen síntomas por presión sobre las estructuras contiguas, sobre todo pares craneales, o por su rotura, la cual ocasiona hemorragia subaracnoidea. Casi todos los aneurismas son resultado de deficiencia congénita de la capa media arterial en el sitio donde se unen dos de los componentes del polígono de Willis, o en donde se bifurca una de las arterias intracraneales. Se ha señalado una frecuencia de 0.5 al 1% de aneurismas congénitos en la población. Son múltiples en 15 a 20% de los casos. Los sitios en los cuales se presentan con mayor frecuencia son la arteria cerebral media y la unión de la arteria cerebral anterior con la comunicante anterior. Las ramas del sistema vertebrobasilar se afectan en 25% de los casos. Los aneurismas pequeños son difíciles de diagnosticar, dado que no producen síntomas de compresión de estructuras próximas. Cuando los de la arteria comunicante posterior provocan síntomas, éstos consisten en parálisis del III par y, con menor frecuencia, hemianopsia por compresión de la vía óptica. En los aneurismas de la arteria basilar puede haber hemiplejía cruzada con paresia de los pares craneales IX, X y XI. La rotura de un aneurisma intracraneal puede causar muerte súbita; cerca de 28% de los individuos fallece por la hemorragia inicial, 17 a 20% de una hemorragia subsecuente en las primeras ocho semanas y 12 a 15% en los seis a 12 meses siguientes, por lo que 40 a 45% de los sujetos sobreviven y, de ellos, sólo una tercera parte carece de síntomas residuales. Los síntomas de rotura de un aneurisma son hemorragia subaracnoidea con cefalea intensa, signos de irritación meníngea, vómito y pérdida rápida de la conciencia. Los aneurismas de la arteria vertebral pueden ocasionar síntomas antes de romperse (de forma equivalente al síndrome de Wallenberg, sin que éste sea completo); los aneurismas de la arteria basilar causar un síndrome paramediano protuberancial bajo o bulbar alto. 193 193 194 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 8 Para su diagnóstico se emplean la tomografía axial computarizada, la ultrasonografía con Doppler, la resonancia magnética con arteriografía y venografía, así como la angiografía carotídea cerebral. A menudo, esta última es la que establece el diagnóstico. Su tratamiento consiste en la embolización transarterial o transvenosa, empleando partículas de alcohol polivinílico, cianoacrilato o espirales de platino y metal a través de la arteria carotídea o la vena femoral. También se puede optar por el tratamiento quirúrgico combinado con la embolización en casos avanzados, por ejemplo en los que no hay drenaje venoso anterógrado, y consiste en la obliteración del seno transverso o sigmoideo. INSUFICIENCIA VERTEBROBASILAR (IVB) Se presenta en dos formas diferentes: 1. Insuficiencia intermitente por oclusión repentina y transitoria de un vaso grande, las más de las veces uno de las arterias vertebrales. 2. Disminución de la reserva vascular por engrosamiento de las paredes de las arterias pequeñas y medianas, lo que lleva alfinal a la aparición de infartos; esta forma es la más común. La IVB es una causa común de vértigo en personas mayores de 50 años de edad. En un estudio de Corvera y Benítez en 42 pacientes, con edad promedio de 63.3 años de edad, se encontraron los siguientes síntomas comunes: cefalea, vértigo e inestabilidad, que se pueden acompañar de trastornos visuales, como diplopía, ceguera transitoria y disartria. La electronistagmografía mostró: a) Nistagmo espontáneo (21%) b) Nistagmo posicional (29%); en 80% de los casos éste fue de tipo paroxístico benigno c) Pruebas calóricas anormales (33%), sobre todo depresión bilateral y preponderancia direccional d) Movimientos sacádicos anormales (33%), con dismetría hipométrica o hipermétrica e) Movimientos de seguimiento anormales (66%) f) Nistagmo optocinético asimétrico, deprimido o desorganizado (29%) g) Pruebas de integración optovestibular en la silla giratoria, con resultados anormales (80%) El nistagmo postural de tipo central puede indicar IVB, por lesión de las conexiones cerebelovestibulares. El nistagmo postural paroxístico benigno es consecuencia de enfermedad otológica o insuficiencia vascular de la arteria auditiva interna. Entre los métodos diagnósticos adicionales de esta entidad se encuentran los siguientes: 1. Pletismografía ocular y oftalmodinamometría: son métodos no invasivos que miden las presiones de la arteria central de la retina en posiciones erguida y supina, lo cual refleja de forma indirecta el estado de la arteria carótida interna. Al efectuar una compresión carotídea se puede valorar el flujo colateral y las vías comunicantes anteriores y posteriores. 2. Tomografía axial computarizada con medio de contraste: aquí se observa que la IVB produce depresión de fases de llenado y aplanamiento de la curva durante la fase lenta. 3. Arteriografía: se efectúa sobre todo en quienes se prevé la posibilidad de realizar un procedimiento quirúrgico, como derivación de la arteria subclavia a la vertebral, o de la temporal superficial a la cerebral media. 4. Ultrasonografía con Doppler transcraneal: las velocidades de flujo de 35 a 80 cm/seg representan los límites normales de las arterias intracraneales. Los diámetros de las arterias cerebelosa anteroinferior y posterosuperior se aproximan a 2 mm, el de la arteria vertebral es de 2 a 6 mm y el de la arteria oftálmica de 1 mm. Durante esta prueba se estudian la ventana del foramen magnum, la ventana temporal y la orbitaria. Constituye una prueba no invasiva y confiable. 5. Angiorresonancia: en la actualidad es el estudio de elección, en el cual se pueden observar con claridad las fases de la depresión del llenado. Migraña basilar Las primeras descripciones de la migraña se remontan a 4 000 años en Mesopotamia. Aretaus, un griego nacido en el años 81 a.C. fue el primero en relacionarla con trastornos del equilibrio y la audición. Rodella describe la fisiopatología de la migraña, la cual se caracteriza durante la fase prodrómica por vasoconstricción, seguida de vasodilatación, que origina la cefalea y durante la cual se detectan valores altos urinarios de metabolitos de la serotonina. La prevalencia de migraña entre la población estadounidense es de 17 a 29% en las mujeres adultas y de 6 a 20% en los varones. Brakerstaff acuñó el término migraña de la arteria basilar en su descripción original de 34 pacientes que iniciaban con síntomas visuales, seguidos de cefalea, vértigo, ataxia, disartria y debilidad motora que semejaba un estado hemiparético. Las manifestaciones clínicas de esta entidad son variables, desde el vértigo episódico intenso hasta la inestabilidad constante o el desequilibrio relacionado con los movimientos que se presentan antes, durante o después de la cefalea. También se ha informado la presencia de hipoacusia, acúfeno y sensación de presión en el oído y, en estos casos, se puede confundir con otras entidades como la enfermedad de Ménière. Los pacientes con vértigo entre las cefaleas tienen 86% de posibilidad de presentar nistagmo posicional y 67% de asimetría en las pruebas rotatorias. El tratamiento consiste en evitar alimentos que contengan tironina, así como alcohol y cafeína, además de evitar el estrés y la fatiga. Las crisis de migraña se pueden tratar con betabloqueadores, antidepresivos tricíclicos, bloqueadores del canal de calcio y antiserotonínicos, además de ansiolíticos del tipo de las benzodiacepinas. ERRNVPHGLFRVRUJ Lesiones otoneurológicas ALGUNAS ENFERMEDADES DESMIELINIZANTES Y DEGENERATIVAS Se caracteriza por la presencia de placas de desmielinización en SNC con proliferación de tejido glial. Por lo general afecta a los adultos jóvenes y, aunque su causa es idiopática, al parecer se relaciona con un virus. Es una enfermedad neurológica crónica, caracterizada por múltiples remisiones y exacerbaciones, con progreso lento de los síntomas, que son muy variables: a) Paresia o debilidad de los miembros (50% de los casos). b) Síntomas visuales consistentes con neuritis retrobulbar de inicio agudo unilateral y con tendencia a la recuperación, diplopía, defectos del campo o visión borrosa (30%). c) Síntomas cocleovestibulares, entre los que se encuentran sobre todo vértigo, en 20 a 75% de los casos, a menudo acompañado de nistagmo y pérdida del equilibrio por lesión vestibulooculomotora. Los síntomas cocleares, como hipoacusia y acúfeno, se observan con poca frecuencia, en especial en sujetos con muchos años de evolución. Se observa la triada sintomática de Charcot, que es típica de esta enfermedad: nistagmo, temblor y lenguaje disártrico. Los datos de la electronistagmografía muestran: a) Rastreo sacádico atáxico o abolido por afectación de los movimientos oculares sacádicos. b) Nistagmo optocinético disminuido. c) Nistagmo espontáneo, sobre todo de reojo. d) Alteración de las pruebas térmicas, en particular preponderancia direccional. En las respuestas auditivas del tallo cerebral se encuentran alteraciones en la latencia de las ondas con periodo I–V prolongado. Se trata con hormona adrenocorticotrópica (ACTH) y esteroides. ESCLEROSIS DIFUSA (ENFERMEDAD DE SCHILDER) Es la desmielinización difusa del cerebro, que se inicia durante la infancia y la adolescencia; se acompaña de demencia, espasticidad, vértigo y sordera. Se cree que es una enfermedad hereditaria de tipo autosómico recesivo y no existe un tratamiento específico. SIRINGOBULBIA Y SIRINGOMIELIA Se distinguen por la formación de cavidades y gliosis en bulbo raquídeo y médula espinal. Muchas veces estas le- siones producen signos y síntomas vestibulares acompañados de astenia, adinamia, pérdida de sustancia muscular y diferentes defectos sensoriales. Es común encontrar vértigo postural paroxístico. Cuando se afecta la médula espinal, hay pérdida de la sensación al dolor y la temperatura. El curso de esta enfermedad es de progresión lenta y a menudo sobreviene la muerte por infecciones intercurrentes. En ocasiones, la radioterapia retrasa la destrucción neural. ATROFIA OLIVOCEREBELOSA Se observan cambios anatomopatológicos en los núcleos de la protuberancia y los olivares, los hemisferios cerebelosos, la sustancia negra y los ganglios basales. Se caracteriza por el desarrollo de signos cerebelosos y extrapiramidales que aparecen entre los 40 y 50 años de edad; la presencia de vértigo no es muy frecuente. La mayoría de los pacientes termina incapacitada en cinco a 10 años. ATAXIA DE FRIEDRICH Es una rara degeneración neural que se localiza en la médula espinal, el tallo cerebral y los núcleos vestibulares. Se inicia en la infancia y es común que el sujeto fallezca durante el segundo o tercer decenios de la vida, muchas veces por infecciones intercurrentes. Se presentan grados variables de hipoacusia neurosensorial y 50% presenta nistagmo. De manera típica, el habla es de tipo explosivo, con pérdida de la sensación propioceptiva. VÉRTIGO DE ORIGEN PSICÓGENO El vértigo puede ser un síntoma común de neurosis, sobre todo en compañía de otros síntomas, como la sensación de que falta el aire, fatiga, insomnio, sudación profusa y trastornos gástricos. Este diagnóstico debe sospecharse en individuos que muestran tensión emocional y franca ansiedad. En ocasiones, los síntomas vertiginosos pueden ser útiles para obtener algún provecho y reconocer una reacción histérica conversiva. Los estudios electronistagmográficos son normales. El tratamiento comprende psicoterapia de apoyo y grupal, así como sedantes y antivertiginosos. EPILEPSIA La epilepsia, en especial la del lóbulo temporal, puede acompañarse de vértigo. A menudo hay un periodo aural prodrómico, pero en ocasiones los episodios vertiginosos ERRNVPHGLFRVRUJ Capítulo 8 ESCLEROSIS MÚLTIPLE 195 195 196 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 8 son la única manifestación, lo cual dificulta su diagnóstico temprano. La presencia de ataques transitorios de vértigo con pérdida de la conciencia sugieren epilepsia del lóbulo temporal, y un periodo vertiginoso aural seguido de convulsiones confirma el diagnóstico. En la electroencefalografía se detectan anomalías durante los ataques epilépticos, y algunas veces en procedimientos como hiperventilación, hipoglucemia, privación del sueño o consumo de barbitúricos. Debe tenerse presente que el vértigo y las convulsiones también pueden ser efecto de tumores cerebrales y hematomas subdurales; por lo tanto, la valoración de estos pacientes debe ser integral. En el tratamiento de personas con epilepsia temporal idiopática pueden emplearse primero anticonvulsivos mayores, del tipo de la carbamacepina. COMISUROTOMÍA Y FUNCIÓN AUDITIVA CENTRAL Pandya y Risse han sugerido que la mayor parte de las fibras auditivas se localiza en los dos tercios posteriores del cuerpo calloso, aunque algunas también se encuentren en la comisura anterior. Para ciertos pacientes con lesiones cerebrales se recomienda comisurotomía, con el fin de evitar que las convulsiones se propaguen de un hemisferio cerebral a otro; asimismo, está indicada en epilepsia resistente. Musiek publicó dos casos en los que se efectuó comisurotomía posterior y no mostraron alteraciones francas, debido quizá a que las fibras de la comisura anterior son suficientes para transmitir la información y procesarla de manera interhemisférica. Por otro lado, es razonable creer que la comisurotomía por etapas permite a cada hemisferio desarrollar los procesos necesarios para efectuar una función independiente. Gazzaniga ha comprobado que tanto el hemisferio derecho como el izquierdo tienen el potencial de realizar muchas acciones iguales, si bien en el cerebro normal el hemisferio derecho lleva a cabo algunas funciones complementarias del lado izquierdo (como la relación espacial e identificación de los ritmos musicales). superficial mayor, cuyo trayecto se sigue para exponer el ganglio geniculado y a partir de éste descubrir la primera porción del nervio facial y con ello el conducto auditivo interno. Sin embargo, aunque esta técnica es útil en descompresiones del nervio facial, el autor no considera que sea la más adecuada para la sección selectiva de los nervios vestibulares o la extirpación de tumores pequeños del acústico; en consecuencia, se ha propuesto una vía más directa, menos prolongada y con poco riesgo de lesionar el facial. Esta técnica se basa en trazar un triángulo imaginario entre el agujero espinoso (salida de la arteria meníngea media), la superficie interna de la escama del hueso temporal y la eminencia arqueada. La base del triángulo está constituida por la línea proyectada desde el agujero espinoso hasta la eminencia arqueada y 15 a 25 mm distales al citado agujero se encuentra un área de fresado seguro (que no lesiona estructuras del oído interno ni la facial) de 10 mm por debajo de la línea antes descrita (figura 8–5). Este método evita exponer otras estructuras anatómicas para llegar al conducto auditivo interno. Otras medidas de interés para el otoneurocirujano son las señaladas por Escajadillo, quien realizó un estudio anatómico en 50 cadáveres (figura 8–6); dichos parámetros son los siguientes. a) La distancia entre la superficie interna de la escama del hueso temporal y el conducto auditivo interno, que varía de 26 a 31 mm, con una media de 28.3 mm. b) En 85.5% de los casos, el ganglio geniculado está cubierto por hueso y su profundidad varía de 0.5 a 2.5 mm, con una medida de 0.9 mm; el 14.5% restante está expuesto en forma parcial o total. SIHT GG NF TÉCNICAS OTONEUROQUIRÚRGICAS EA AE AFS CAI VÍA DE LA FOSA MEDIA Esta vía la difundió House y desde entonces se ha usado para la extirpación de tumores pequeños del conducto auditivo interno, la descomposición del nervio facial y la sección selectiva del nervio vestibular. En cuanto a la técnica, existen diferentes referencias anatómicas para localizar el conducto auditivo interno en la fosa media. House sugirió reconocer el nervio petroso Figura 8–5. Acceso a través de la fosa media. Se muestra el área para fresado quirúrgico y llegar así al conducto auditivo interno, sin necesidad de exponer todo el trayecto del nervio facial. SIHT, superficie interna del hueso temporal; GG, ganglio geniculado; NF, nervio facial; AE, agujero espinoso; EA, eminencia arqueada; CAI, conducto auditivo interno; AFS, área segura de fresado. ERRNVPHGLFRVRUJ Lesiones otoneurológicas 197 197 quirúrgica se detalla en el capítulo 7, en la sección de vía translaberíntica. Abordaje transpetroso por la fosa media 10 8 9 3 2 6 4 7 11 Técnica Figura 8–6. Diferentes medidas entre estructuras anatómicas en la fosa media, efectuadas por el autor en un estudio de 50 cadáveres: 1. Distancia entre la superficie interna del hueso temporal y el conducto auditivo interno. 2. Profundidad del ganglio geniculado. 3. Ángulo entre el conducto auditivo interno y el conducto semicircular superior. 4. Distancia del nervio petroso superficial mayor cubierta por hueso. 5. Distancia entre el nervio petroso superficial mayor y la eminencia arqueada. 6. Profundidad del conducto auditivo interno. 7. Distancia entre el agujero espinoso y la pared anterior del conducto auditivo interno. 8. Distancia entre el conducto semicircular superior y el ganglio geniculado. 9. Conducto semicircular superior paralelo o no a la eminencia arqueada. 10. Distancia entre la superficie interna de la escama del hueso temporal y el agujero espinoso. 11. Distancia entre el agujero espinoso y la eminencia arqueada. c) El conducto auditivo interno se localiza entre 59 y 60° anteromediales al conducto semicircular superior. d) La distancia media entre el nervio petroso superficial mayor y la eminencia arqueada es de 15 mm. e) La distancia entre el conducto semicircular superior y el ganglio geniculado varía de 8 a 12 mm, con una media de 9.5 mm. f) La cantidad de hueso que es necesario fresar de la entrada del nervio petroso superficial mayor a su conducto, hasta alcanzar al ganglio geniculado, es de 2 a 6 mm, con una media de 4.4 mm. g) La profundidad del conducto auditivo interno varía de 4 a 10 mm, con una media de 6.9 mm. h) Al fresar sobre la eminencia arqueada se encontró, en 63% de los casos, desplazamiento mínimo o nulo del conducto semicircular superior con respecto a esta estructura; en el resto hubo un desplazamiento de 30° hacia atrás. i) La distancia entre el agujero espinoso y la pared anterior del conducto auditivo interno varía de 15 a 20 mm, con una media de 18.1 mm. j) El agujero espinoso se encontró a 25 mm de la superficie interna de la escama del hueso temporal, con límites de ± 1.5 mm y 31.5 mm de la eminencia arqueada, ± 2.5 mm. El resto de la técnica 1. Incisión en forma de U invertida sobre la región temporal, desde la raíz del cigoma hasta la región retroauricular. Se efectúa una retracción del colgajo de piel y las capas muscular y aponeurosis se inciden con asa diatérmica. 2. Elaboración de trépanos para delimitar el colgajo óseo y empleo de sierra de Gigli para levantarlo, con especial cuidado de no lesionar el seno lateral. 3. Incisión de la duramadre en forma de U. 4. Elevación del lóbulo temporal para identificar el tentorio cerebeloso y el borde posterior del hueso temporal. Se dividen las venas subtemporales, pero con cuidado de preservar la vena de Labbe que drena al seno lateral. 5. Retracción medial del lóbulo temporal. Se expone el tentorio cerebeloso hasta su borde libre y se incide la dura a lo largo de la cresta petrosa para que alcance la curvatura superior del seno lateral. 6. Se elabora un colgajo triangular sobre la dura que permite el acceso al cerebelo y ángulo pontocerebeloso. 7. En caso de que se requiera, se puede fresar el conducto auditivo interno. 8. Resección. En caso de tumores, primero se realiza una extirpación intracapsular, para continuar con una fina disección de la cápsula sobre los nervios adyacentes. 9. Los defectos del ápex petroso se cierran con cera de hueso y músculo temporal. 10. Cierre del colgajo dural tentorial, previa hemostasia. 11. La dura incidida sobre el lóbulo temporal se sutura y se fija a los bordes internos del colgajo óseo. 12. Se coloca el colgajo óseo y se fija con hilo de alambre. 13. Se cierra por planos hasta la piel. Casi nunca es necesario dejar drenaje lumbar y se administran ERRNVPHGLFRVRUJ Capítulo 8 En esta vía se aborda el ángulo pontocerebeloso por arriba y cuando se combina con una petrosectomía anterior ofrece una adecuada exposición del clivus, el ápex petroso y la arteria basilar. Sus principales indicaciones son el abordaje de neuromas de los pares craneales V a VIII, tumores petroclivales, meningiomas, colesteatomas, angiomas, quistes epidermoides y aneurismas de la arteria basilar. Una de sus desventajas es que se requiere una mayor retracción del lóbulo temporal, con el consiguiente riesgo de edema, así como de dificultades motoras y del lenguaje. La visualización del polo inferior y ramas de la arteria cerebelosa posteroinferior es inapropiada. 5 Oído, nariz, garganta y cirugía de cabeza y cuello 198 4 Capítulo 8 3 1 5 6 2 Figura 8–7. Abordaje del conducto auditivo interno. 1. Nervio facial. 2. Nervio vestibular superior. 3. Nervio vestibular inferior. 4. Nervio coclear. 5. Duramadre. 6. Rama de la arteria cerebelosa anteroinferior (arteria cerebelo-laberíntica). anticonvulsivos en forma profiláctica por espacio de una semana (figura 8-7). VÍA RETROLABERÍNTICA Ofrece la posibilidad de abordar el ángulo pontocerebeloso con preservación de la función auditiva. Hitselberg y Pulec utilizaron esta vía por primera vez para seccionar en forma parcial la raíz del V par craneal en casos de neuralgia, con preservación de la audición. Es una vía excelente al ángulo pontocerebeloso con visualización de los pares craneales V a XI y baja morbilidad. Algunas de sus indicaciones son las siguientes: a) Neurectomía vestibular selectiva en casos de vértigo. b) Resección de tumores del ángulo pontocerebeloso. c) Neurectomía de los pares craneales IX y X. d) Descompresión microvascular de la raíz del V par. Una de sus desventajas es que en 25% de los casos no existe un plano definido en el ángulo pontocerebeloso entre los nervios coclear y vestibular. Sin embargo, el uso de endoscopios a través de esta vía ayuda a identificar dicho plano, así como los nervios intermediario y facial. Técnica 1. Paciente en decúbito dorsal, con el oído por operar hacia arriba y rasurada la región retroauricular. 2. Limpieza y aislamiento quirúrgico del mesogastrio, de donde se toma un injerto de tejido graso subcutáneo. 3. Anestesia general; puede suministrarse manitol y también es posible producir hiperventilación para reducir el volumen de la masa encefálica. 4. Incisión semilunar unos 2 a 3 cm detrás del surco retroauricular, con injerto de fascia temporal. 5. Incisión de la aponeurosis y el epiostio en forma de T, o alrededor del conducto auditivo externo. 6. Exposición de la espina de Henle, área cribosa, punta mastoidea y sutura temporooccipital. 7. Mastoidectomía extensa con identificación de los conductos semicirculares lateral y posterior, nervio facial, saco endolinfático, así como disección de las celdillas infralaberínticas hasta el bulbo de la yugular. 8. Exposición de los senos venosos lateral y petroso superior, además del bulbo de la yugular, que se liberan por completo de sus soportes óseos para lograr su colapso y fácil movilización. Se recomienda remover el hueso con fresas de diamante, para disminuir la posibilidad de laceración de dichos vasos; la disección debe extenderse por detrás del seno venoso lateral, cuando menos 1 cm. 9. Identificación de la duramadre de la fosa posterior, por adelante y detrás del seno lateral, y enfrente de la región infralaberíntica hasta el bulbo de la yugular. 10. Incisión de la duramadre, anterior al seno lateral y posterior al saco endolinfático. 11. Acceso al ángulo pontocerebeloso; una vez que se ha cortado la duramadre, se secciona cuidadosamente la aracnoides, dejando intactos, hasta donde sea posible, sus elementos microvasculares, y se evacua el LCR de la cisterna cerebelopontina para favorecer el colapso del seno lateral. 12. Identificación de los elementos nerviosos: borde anterior del hemisferio cerebeloso, floculus, tallo cerebral, tentorio, pares craneales IV a XI y granulaciones de Paccioni. En este tiempo pueden usarse soluciones de manitol, para deshidratar el cerebelo y mejorar la exposición; la ventilación controlada también es satisfactoria. 13. Identificar los elementos vasculares: la vena de Dandy se encuentra en la región posterosuperior del campo quirúrgico, la arteria cerebelosa anteroinferior se identifica en relación con los pares craneales VII y VIII, por las colaterales que emite hacia el conducto auditivo interno. En ocasiones, una de éstas se introduce en el conducto pero la arteria cerebelosa posteroinferior se encuentra en relación con los pares craneales IX y X, y no proyecta colaterales hacia el conducto auditivo interno. 14. Al retraer de manera suave el cerebelo, aplicando un cotonoide, se expone el VIII par craneal; arriba y adelante se identifica el V par. El nervio facial cursa anterior al VIII par y puede reconocerse con facilidad al mover este último hacia arriba o abajo. ERRNVPHGLFRVRUJ Lesiones otoneurológicas Complicaciones de la vía retrolaberíntica 1. El 20% de los pacientes presenta diferentes grados de hipoacusia nuerosensorial, por daño a la microcirculación del VIII par. 2. La fístula de líquido cefalorraquídeo se observa en 5% de los casos. A menudo cede con tratamiento médico y rara vez requiere atención quirúrgica. 3. La parálisis facial periférica puede desarrollarse como complicación de la resección de tumores del ángulo pontocerebeloso y ser transitoria o permanente. 4. La meningitis, cuando se presenta, suele ser de tipo irritativo o químico; cede casi siempre con tratamiento conservador. 5. El hematoma del ángulo pontocerebeloso es por lo general secundario a hemostasia defectuosa. 6. Infección de la herida quirúrgica. Hipoacusia conductiva en graves, secundaria a osificación de la Figura 8–8. Acceso retrolaberíntico: se practicó una mastoidectomía con exposición del seno lateral y la duramadre de la fosa posterior, que se ha levantado. Con ayuda del retractor se rechazan hacia abajo el seno lateral y el cerebelo, y se exponen así los pares craneales V, VI, VII, VIII y X. CAE, conducto auditivo externo; D, duramadre; VD, vena de Dandy; C, cerebelo; SL, seno lateral; M, mastoides. cadena osicular por polvo de hueso durante el fresado quirúrgico. Esta complicación se evita con un lavado quirúrgico anterior al cierre de la herida. VÍA SUBOCCIPITAL O RETROSIGMOIDEA Esta vía, que muchas veces sigue el neurocirujano, se emplea para la resección de tumores extensos del ángulo pontocerebeloso y puede combinarse con la vía translaberíntica. Asimismo, se utiliza para la sección selectiva de los nervios vestibulares superior y ampular posterior después de identificar el conducto singular en el conducto auditivo interno. Este procedimiento, sugerido por Silverstein, disminuye la frecuencia de hipoacusias neurosensoriales después de una neurectomía vestibular. Se puede presentar cefalea posoperatoria en 25% de los casos y es posible sobre todo cuando se fresa el conducto auditivo interno. Técnica 1. Se afeita por completo la cabeza. 2. Posición de Riemens: paciente en decúbito supino con la cabeza ligeramente girada hacia el lado contralateral; el cirujano se sienta a la cabecera del individuo. 3. Incisión vertical que se extiende 5 cm por detrás de la porción escamosa del hueso temporal hasta la línea media de la nuca, a nivel de la primera vértebra cervical. 4. Incisión de los músculos de la nuca hasta el hueso, elevación del periostio hasta exponer la línea superior de la nuca, la porción aplanada del hueso temporal hacia el cuello y el área mastoidea en forma lateral. 5. Trépanos óseos, con extirpación de un segmento cuadrado de hueso de unos 5 por 5 cm, inmediatamente abajo de la línea superior de la nuca y por detrás de la región mastoidea, pasando por debajo y detrás del seno lateral. 6. Incisión de la duramadre en cruz, haciendo cuatro colgajos triangulares, que se refieren con un punto de seda, de tal modo que aparece el cerebelo. 7. Retracción cuidadosa del cerebelo, con maniobras previas para reducir el volumen de la masa encefálica; se exponen la pared posterior de la porción petrosa del hueso temporal, el conducto auditivo interno y el ángulo pontocerebeloso. 8. Exploración del ángulo pontocerebeloso. En la resección de tumoraciones muy grandes se abre la cisterna magna para obtener suficiente exposición; si esta medida resulta insuficiente, se puede resecar el polo lateral del cerebelo. 9. Colocación del retractor automático de Yasargil, con aplicación de un cotonoide entre la hoja de éste y el tejido cerebral que se retrae. Las tumoraciones deben resecarse de manera gradual, por lo cual se abre su cápsula y se remueve así el grueso del tumor mediante el bipolar y las pinzas ERRNVPHGLFRVRUJ Capítulo 8 15. En caso de cortarse el nervio vestibular, se recomienda hacerlo a casi 0.5 cm del tallo cerebral, desarrollando un plano de separación entre el nervio coclear y su división vestibular, que se encuentra en la porción superior del campo operatorio (figura 8–8). 16. Cierre quirúrgico. El defecto dural se oblitera con un injerto de fascia temporal y la cavidad mastoidea con tejido graso subcutáneo, cerrando tejidos blandos en dos planos, con aplicación de vendaje moderadamente compresivo. 199 199 Oído, nariz, garganta y cirugía de cabeza y cuello 200 10. Capítulo 8 11. 12. 13. pequeñas. El cirujano debe tener presente que, en muchas ocasiones, la cápsula se encuentra adherida al nervio facial. La abertura del conducto auditivo interno se realiza mediante riego continuo y fresas de diamante, para exponer así la porción externa del conducto. Hay que tener especial cuidado de no fresar muy abajo por el riesgo de lesionar los pares craneales IX, X y XI. Para preservar la audición, al disecar las tumoraciones pequeñas, son útiles las respuestas auditivas del tallo cerebral en forma transoperatoria. La extirpación del tumor y la disección de las estructuras vecinas deben efectuarse con microscopio. En caso de seccionar el nervio vestibular, se corta después de localizar el conducto singular en el conducto auditivo interno, el cual tiene una longitud aproximada de 3 mm; el hueso que lo separa del vestíbulo tiene 1 a 2 mm de grosor. Cierre quirúrgico; primero se deja expandir la masa encefálica, después se sutura la duramadre, reemplazando o no el hueso extraído a manera de injerto libre; se suturan las capas musculares profundas y superficiales. Se verifica si la hemostasia es adecuada y se cierra en capas el tejido celular subcutáneo hasta la piel. Puede dejarse drenaje tipo Penrose en la porción superficial de la herida, que se elimina en tres días. ACCESO A LA BASE DEL CRÁNEO POR VÍA LATERAL (INFRATEMPORAL) A pesar de las dificultades técnicas que ofrece operar sobre la base del cráneo, la intervención es el medio más efectivo para tratar los tumores en esta área. La vía lateral requiere un conocimiento anatómico preciso y detallado de la región, lo cual ayuda a eliminar con éxito la anomalía existente y conservar estructuras vitales. Fisch describió esta vía de modo originaly se aplica para tratar lesiones que afectan el bulbo de la yugular, la arteria carotídea, el vértice petroso, la región paraselar y el clivus, dado que posibilita una exposición amplia. Técnica 1. Posición en decúbito dorsal con la cabeza girada hacia el lado contralateral. 2. Afeitado total de la cabeza o cuando menos 12 a 15 cm alrededor del oído (región retroauricular). 3. Anestesia general equilibrada. 4. Incisión retroauricular en C, desde la región frontotemporal hasta la porción superior del cuello (5 a 7 cm detrás del pliegue retroauricular). 5. Exposición de la fascia y músculo temporales, así como del periostio y el músculo auricular posterior. 6. La extensión de la incisión en el cuello expone el músculo esternocleidomastoideo, el nervio auricular mayor, la arteria carotídea, la vena yugular interna y los pares craneales IX a XII. 7. Elaboración de un colgajo de base anterior que incluya fascia profunda, periostio y músculo auricular posterior, más largo arriba que abajo, y elevación de la región mastoidea en dirección anterior hasta seccionar la porción cartilaginosa del conducto auditivo externo, para exponer así la fascia y glándula parotídeas. 8. Mastoidectomía radical con exposición completa de los segmentos timpánico y mastoideo del nervio facial. 9. Eliminación de la membrana timpánica y remanente de piel de la porción ósea del conducto auditivo externo, con desarticulación incudoestapedial y extracción del martillo y el yunque. 10. Disección de toda la mucosa del oído medio, para prevenir la formación de mucoceles posoperatorios. 11. Si la lesión afecta al bulbo de la yugular, puede ligarse y cortarse este vaso en la porción superior del cuello, detrás del vientre posterior del digástrico. Asimismo, se aísla la arteria carótida interna, aplicando ligas vasculares de referencia. 12. Parotidectomía superficial para exponer las ramas extratemporales del nervio facial. 13. Liberación del facial con reubicación anterior de éste. La liberación del tejido fibroso alrededor de este nervio en el agujero estilomastoideo es laboriosa y difícil; puede seccionarse su rama cervical para facilitar la liberación del tronco principal. Se crea un nuevo conducto para el facial mediante fresado de las celdillas sobre el arco cigomático. 14. Elevación y luxación del cóndilo mandibular y la cápsula temporomandibular; en ocasiones es necesario resecar el cóndilo para mejorar la exposición del campo operatorio. 15. Mediante microfresado quirúrgico se exponen el bulbo de la yugular y la arteria carótida interna. 16. Cuando la enfermedad se extiende hacia la región “paraselar” o el clivus, se liga con pinzas vasculares la arteria meníngea media y se secciona, junto con la división mandibular del trigémino. 17. Cuando es necesario resecar el bulbo de la yugular, el seno lateral debe dividirse y ligarse abajo de la salida de la vena emisaria mastoidea, después de abrir la duramadre y exponer la aracnoides de la fosa posterior. Se emplea Surgicel® para ocluir los orificios del seno petroso inferior. 18. Se recomienda sellar la porción ósea de la trompa de Eustaquio con cera para hueso, polvo óseo y fascia temporal. 19. Esta vía puede extenderse hasta la nasofaringe; Fisch la utiliza para resecar tumoraciones recidivantes en esta área después de dosis curativas de radioterapia, para lo cual se fracturan las láminas pterigoideas externa e interna. 20. Cierre quirúrgico: a) El conducto auditivo externo se cierra a manera de saco ciego, con catgut crómico 3–0. b) El defecto mastoideo se oblitera con grasa abdominal. ERRNVPHGLFRVRUJ Lesiones otoneurológicas 201 201 c) El resto del campo se cubre con el colgajo de fascia y músculo previamente elaborado. d) Se deja drenaje en la porción posteroinferior de la herida, que se cierra en dos capas (figuras 8–9 a 8-11). 1. Acceso neuroquirúrgico por vía suboccipital, con aplicación de fascia lata para proveer una barrera interna resistente a la duramadre. 2. La segunda etapa es el acceso infratemporal entre la tercera y sexta semanas del posoperatorio inicial. Ello tiene por objeto llevar la tumoración de una posición intradural a una extradural Capítulo 8 En tumoraciones extensas con invasión intracraneal, se recomienda la extirpación en dos etapas: NF OT SL GP ACCESO TRANSTEMPOROESFENOIDAL DE LA BASE DEL CRÁNEO Con esta vía se evitan las hipoacusias neurosensoriales resultantes de las vías translaberíntica y transcoclear, así como la hipoacusia conductiva, con parálisis facial transitoria, además de posibles sincinesias por degeneración del nervio facial y secundarias a la vía infratemporal. ACI ACE XII VY XI Algunas veces no es necesario quitar la cadena osicular, sobre todo cuando no hay invasión del oído medio y la cápsula ótica; en estos casos se practica una hipotimpanotomía posterior amplia, con acceso extenso del receso facial. X Figura 8–10. Vía infratemporal: en este dibujo se exponen varios elementos de la base del cráneo. Se ha efectuado una mastoidectomía radical con preservación del nervio facial. Se han conservado la vena yugular y la arteria carótida interna, así como los pares craneales X, XI y XII. Nótese la ligadura de la arteria carótida externa. OT, orificio tubario; NF, nervio facial; SL, seno lateral; GP, glándula parótida; ACE, arteria carótida externa; ACI, arteria carótida interna; VY, vena yugular. Asimismo, ofrece la posibilidad de realizar una disección extradural e intradural. Algunas de sus indicaciones son: 1. Lesiones “paraselares”. 2. Lesiones de la porción superior del clivus y la nasofaringe. Figura 8–9. Abordaje infratemporal. Figura 8–11. Abordaje infratemporal. Nótese la identificación y exposición del nervio facial, así como los grandes vasos del cuello. ERRNVPHGLFRVRUJ 202 Oído, nariz, garganta y cirugía de cabeza y cuello 3. 4. 5. 6. Capítulo 8 Lesiones orbitarias posteriores y laterales. Lesiones pterigomaxilares. Afectación del vértice petroso. Lesiones anteromediales del lóbulo temporal y el puente esfenoidal. 7. Lesiones de las fosas temporal e infratemporal. 8. Lesiones posterosuperiores al seno maxilar. 9. Algunas lesiones del nervio trigémino. Técnica 1. Decúbito supino con la cabeza flexionada hacia el lado opuesto al sitio operatorio. 2. Afeitado de la región frontotemporal. 3. Anestesia general equilibrada. 4. Incisión en forma de S en la implantación del pelo, en la región temporal, posterior a la región externa del techo orbitario, que se continúa hacia arriba 2 o 3 cm por encima del arco cigomático; la curva inferior de la incisión se prolonga en el surco preauricular, hasta la región del implante del lóbulo de la oreja. 5. Exposición de la fascia del músculo temporal y la parótida, con colocación de retractores de garra automáticos. 6. Incisión curvilínea a través de la fascia temporal, paralela a la porción superior del arco cigomático (a 3 cm de éste), hasta 1 cm por detrás de la porción posterior de la pared orbitaria externa; se evita así cortar la rama frontocigomática del nervio facial. 7. Sección del músculo temporal por encima del arco cigomático, para exponer el ala mayor del esfenoides y la porción escamosa del hueso temporal. 8. Sección del arco cigomático en su región anterior y posterior; se rechaza hacia abajo con su porción unida al músculo masetero y el arco también se puede retirar completamente y fijarse con alambre al final de la operación. 9. Fresado del hueso sobre el ala mayor del esfenoides, hasta esqueletizarlo y dejarlo con el mínimo grosor, de tal modo que permita retraer de manera parcial el lóbulo temporal. El hueso también puede adelgazarse en la región periorbitaria y el ala menor del esfenoides, para exponer el repliegue de la duramadre sobre la fisura orbitaria superior y áreas adyacentes. Quizá no sea necesario disecar el ala mayor del esfenoides, si se trabaja en áreas como la nasofaringe, el vértice petroso y la porción inferior de la fosa infratemporal; es útil cuando las lesiones son extradurales y afectan la región posterior de la órbita, agujero óptico, región paraselar, divisiones principales del trigémino y área de la fisura pterigopalatina. 10. Si es necesario exponer la arteria carótida, la trompa de Eustaquio y la porción petrosa del hueso temporal, se luxarla articulación temporomandibular y se exponen la fisura escamotimpánica que representa una estructura clave para la identificación posterior de la arteria meníngea media y el orificio tubario, junto con la espina del esfenoides, la cual se elimina mediante fresado quirúrgico. 11. El fresado del hueso timpánico, sobre todo en su región posterior, expone la arteria carotídea en su curso intratemporal y las celdillas aéreas pericarotídeas, así como la porción superior del vértice petroso. 12. El fresado óseo entre los agujeros oval y redondo y la fisura orbitaria superior expone el doblez de la duramadre sobre el seno cavernoso. 13. Los defectos producidos en la nasofaringe o la órbita se cubren con colgajos miocutáneos locales, como el de músculo temporal o esternocleidomastoideo, quizá con colgajos distales, como los de miocutáneo, trapecio o fasciocutáneo de esta región. Este procedimiento lo describió el autor. Cuando se requiera disección intracraneal por crecimiento de la tumoración, se recomienda efectuar esta técnica en colaboración con el servicio de neurocirugía. ACCESO A LA BASE DEL CRÁNEO A TRAVÉS DE UNA MANDIBULOTOMÍA ANTERIOR La sección de la mandíbula en su línea media, junto con la división de los tejidos blandos del piso de la boca y la musculatura suprahioidea, permite girar la mandíbula en forma lateral y hace posible exponer así la fosa infratemporal, el techo del espacio parafaríngeo y la superficie inferior del hueso petroso. La sección de la trompa de Eustaquio de su unión ósea y cartilaginosa, junto con sus músculos, permite que la faringe se eleve del espacio prevertebral para que pueda retraerse hacia la región contralateral, de tal manera que se consigue una exposición adicional de la cavidad nasal posterior, nasofaringe, cuerpo del seno esfenoidal, clivus y vértebras cervicales superiores. Técnica 1. Traqueotomía preoperatoria. 2. Anestesia general equilibrada. 3. La incisión quirúrgica se inicia en la porción media del labio inferior, siguiendo el pliegue submentoniano, para continuar hacia abajo hasta la zona del hueso hioides y de ahí en forma horizontal y posterior, para pasar sobre el músculo esternocleidomastoideo hasta alcanzar la punta de la apófisis mastoides. 4. Se corta todo el grosor del labio inferior y se liga la arteria labial. 5. La incisión en el cuello abarca el cutáneo del cuello. 6. Identificación, corte y ligadura de la arteria, así como de la vena facial; se realiza la maniobra de Martin durante el levantamiento del colgajo ERRNVPHGLFRVRUJ Lesiones otoneurológicas 7. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. La mandíbula se reacomoda y se fija con alambre transóseo; el labio se cierra en capas, con especial cuidado de realinear el borde bermellón. 23. Por último, se coloca una sonda nasogástrica, de preferencia antes de aplicar el taponamiento posterior (figuras 8–12). Complicaciones 1. La sección del cartílago de la trompa de Eustaquio ocasiona otitis medias serosas crónicas, que pueden tratarse mediante aplicación de cánulas de ventilación. 2. En 10 a 20% de los casos se desarrollan fístulas salivales; su detección y drenaje tempranos disminuyen la posibilidad de erosión con rotura subsecuente de la arteria carótida interna. En pacientes con resecciones amplias de la faringe se recomienda, durante el cierre quirúrgico, girar un colgajo miocutáneo (trapecio, pectoral mayor o esternocleidomastoideo) para cubrir esta arteria; la aplicación de injertos de dermis también es útil. Figura 8–12. Acceso a la base del cráneo mediante mandibulotomía anterior. Se indica el cierre del colgajo mucoperióstico del paladar y el piso de la boca. Se ha reaproximado la osteotomía media mandibular en forma de escalón que se fija con alambre intraóseo. Una vez concluido lo anterior, se cierra el labio cortado en capas. ERRNVPHGLFRVRUJ Capítulo 8 8. de pie, para reducir la posibilidad de lesionar la rama mandibular del nervio facial. Se corta la inserción del tendón del músculo digástrico y el músculo milohioideo se divide y rechaza hacia arriba, junto con la glándula submandibular; se exponen así la vaina carotídea, la vena yugular interna y los nervios vago, espinal accesorio e hipogloso. Incisión del periostio en la sínfisis mandibular en la línea media; se eleva hacia ambos lados a una distancia de 2 a 3 cm. Osteotomía media mandibular en forma de escalón a partir de los dientes incisivos inferiores. División del ganglio submandibular y el conducto de Wharton, con lo que se facilita la rotación lateral de la mandíbula y se conservan los nervios lingual e hipogloso; el desplazamiento lateral de la mandíbula de esta manera da acceso directo a la fosa infratemporal y el espacio parafaríngeo. Después de identificar la arteria carótida externa, se secciona y liga. Sección del ligamento estilohioideo y de los músculos estilofaríngeo y estilogloso. La disección medial de la apófisis estiloides hace posible movilizar la arteria carótida interna de su conducto carotídeo. Se siguen hacia la base del cráneo la vena yugular interna y los pares craneales X, XI y XII. La incisión intrabucal se extiende sobre la tuberosidad del maxilar, pasando casi a 1 cm del borde gingival, hasta alcanzar la línea media en el paladar duro. Elevación del mucoperiostio del paladar duro, desde el área del agujero incisivo; adelante, hasta el agujero palatino mayor; atrás, cortando el pedículo neurovascular donde sale la rama mandibular del nervio trigémino. Remoción de la porción posterior del paladar óseo, con elevación de la mucosa nasal hacia un lado sobre la lámina pterigoidea interna. La disección superior sobre la lámina pterigoidea medial lleva al agujero oval por donde sale la rama mandibular del nervio trigémino. Se corta el músculo pterigoideo externo cerca de su origen en la porción interna de la lámina pterigoidea externa. Este tiempo quirúrgico permite exponer la fosa infratemporal y el espacio prevertebral. La retracción de la faringe y la mucosa nasal posterior expone la porción cartilaginosa de la trompa de Eustaquio, así como los músculos tensor y elevador del velo del paladar. Después de extirpar la lesión se sutura el músculo constrictor superior de la faringe a la base del cráneo y se coloca un taponamiento nasal posterior durante una semana. El colgajo mucoperióstico del paladar se sutura con Vicryl® 3–0 (también para cerrar el piso de la boca); los músculos suprahioideos se reaproximan con catgut crómico 3–0. 203 203 204 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 8 3. Las infecciones de la herida quirúrgica y las complicaciones del sistema nervioso central, como meningitis, son raras gracias a la administración de antibióticos de amplio espectro. Mann y Gilsbach propusieron una modificación de la técnica descrita, que consiste en la extracción del complejo malar a manera de injerto libre y la resección de la apófisis coronoides de la mandíbula para obtener una buena exposición de los tumores que afectan el espacio retromaxilar, la nasofaringe y la base de la fosa media. Después de extirpar la neoplasia, se fija de nueva cuenta el hueso cigomático en su sitio con hilo de alambre. Acceso a la base del cráneo a través de la vía transmandibular–transpterigoidea Ross y Sukis notificaron por primera vez el abordaje pterigoideo para la extirpación de un carcinoma adenoquístico de la nasofaringe. Nessel y Mundnich describieron una técnica similar a la denominada abordaje transpterigoideo o nasofaringostomía lateral, que en forma posterior difundió Yumoto, quien la llamó vía transmandibular transpterigoidea. Esta vía ofrece un gran campo operatorio y facilita el manejo de los grandes vasos y pares craneales que salen de la base del cráneo. Se obtiene una visualización medial de la lesión, y no lateral como en la vía infratemporal, además de que no supone una pérdida de la audición ni lesión del nervio facial y el tiempo quirúrgico es menor. Esta vía permite fresar el conducto carotídeo en el hueso petroso cuando existe la necesidad de exponer aún más la lesión. Los defectos de la mucosa de la nasofaringe secundarios a la manipulación quirúrgica no requieren ser cubiertos, siempre y cuando los grandes vasos del cuello se encuentren protegidos por los músculos pterigoideos o por colgajos locales musculares o musculocutáneos. El autor ha empleado esta vía con éxito para la resección de aneurismas carotídeos de la base del cráneo. Técnica 1. Traqueotomía preoperatoria. 2. Anestesia general equilibrada. 3. Incisión en la piel y división del labio inferior para continuar 2 a 3 cm por debajo del borde mandibular y extenderse en forma posterior hasta el cartílago tragal. 4. Incisión de la mucosa bucal desde el mentón y a lo largo del surco gingivolabial hasta la rama ascendente de la mandíbula y terminar cerca del hamulus pterigoideo. 5. Los tejidos blandos, incluidos piel, músculo masetero y glándula parótida, se elevan desde la mandíbula, con retracción hacia arriba. Con este tiempo se preserva la función del nervio facial. 6. La mandíbula se secciona en un punto posterior al tercer molar y su rama ascendente se retrae hacia arriba, previa sección del proceso coronoide, maniobra que facilita su movilidad y contribuye a prevenir la presencia de trismus en el posoperatorio. En caso de requerir mayor exposición, se desarticula la articulación temporomandibular y se libera el fragmento óseo seccionado. 7. Exposición de los músculos pterigoideos lateral y medial, los cuales se dividen para alcanzar las estructuras retropterigoideas e infratemporales. Figura 8–13. Tomografía axial computarizada que muestra una tumoración retropterigoidea derecha a expensas de un aneurisma carotídeo. ERRNVPHGLFRVRUJ Lesiones otoneurológicas 205 205 Capítulo 8 Figura 8–14. Incisión para acceso a la base del cráneo a través de la vía transmandibular-transpterigoidea. 8. Identificación de los grandes vasos en la porción superior del cuello, con seguimiento hasta la base del cráneo. 9. Resección del tumor, vascular, etc. 10. El espacio muerto posterior a la extirpación tumoral se llena con los músculos pterigoideos o con un colgajo pediculado de músculo esternocleidomastoideo. 11. Colocación de la rama ascendente de la mandíbula y fijación con miniplacas de compresión. 12. Cierre por planos hasta la piel, con cuidado especial de realinear el borde del bermellón labial. 13. Colocación de una sonda nasogástrica y remoción de la cánula de traqueotomía entre los días 5º y 7º del posoperatorio. La morbilidad por este procedimiento se relaciona con el desarrollo de procesos infecciosos, tanto en la cavidad bucal como en la mandíbula, que pueden tratarse en forma local con antibióticos. Siempre que se maneje la base de cráneo es preciso estar atento al desarrollo de lesiones de pares craneales, sobre todo IX, X, XI y XII, que pueden requerir rehabilitación para la deglución por trastornos de la motilidad hipofaringoesofágica y de rehabilitación por parálisis de la cuerda vocal, con la producción de disfonía, aspiración, tos ineficiente y neumonía, para lo cual es de utilidad la medialización de la cuerda vocal con implantes de silastico. Es común observar trismus posoperatorio, que es transitorio y desaparece entre la tercera y la sexta semanas (figuras 8–13 a 8-15). Linkov describió el síndrome de la primera mordedura como una complicación de esta operación, así como de la vía infratemporal, y se caracteriza por un espasmo o calambre en la región parotídea al dar la primera mordida durante la comida; el problema disminuye con las mordeduras subsecuentes y mejora con el empleo de inyecciones de Botox® y acupuntura. Figura 8–15. Abordaje transmandibular–transpterigoideo para la resección de un aneurisma de la arteria carótida interna en el foramen lacerum. ERRNVPHGLFRVRUJ 206 Oído, nariz, garganta y cirugía de cabeza y cuello BIBLIOGRAFÍA Capítulo 8 Adkins WY, Osgothorpe JD: Minicraniotomy for management of CSF otorrhea from tegmen defects. Laryngoscope 1983;93:1038–1039. Ahn M, Jackler R, Lustig L: The early history of the neurofibromatoses. Ar Otolaryng 1996;122:1240–1249. Anderson D, Olson J, Dowart R et al.: CT air–contrast scanning of the internal auditory. Ann Otol Rhinol Laryngol 1982;91:501–505. Angeli S, Brackmann D, Xenelles J et al.: Primary lymphoma of the internal auditory canal. Ann Otol Rhin Laryng 1998;107:17–21. Aristegui M, Folcioni M, Soleh E et al.: Meningoencephalic herniation into the middle ear. A report of 27 cases. Laryngosc 1995;105:513–518. Arriaga M, Chen D: Individualizing hearing preservation in acoustic neuroma surgery. Laryngosc 1997;107:1043– 1047. Babin RW, Fratkinb JD, Cancilla PA: Hamartomas of the cerebellopontine angle and internal auditory canal. Arch Otolaryngol 1980;106:500–502. Baik F, Nguyen L, Doherty J, Harris J: Comparative case series of exostoses and osteomas of the internal auditory canal. Ann Otol Rhinol Laryngol 2011;120:255–260. Barker D, Wright E, Nguyen L et al.: Gene for von Recklinghausen neurofibromatosis in the pericentromeric region of chromosome 17. Science 1987;236:1100–1102. Barrionuevo CE, Marcallo FA, Coelho A et al.: Fibrous dysplasia and the temporal bone. Arch Otolaryngol 1980;106:298–301. Barrs D, Lexford W, Becker T, Brackmann D: Computed tomography with gas cisternography for detection of small acoustic tumors. Arch Otolaryngol 1984;110:535–537. Barrs D, Brackmann D, Olson J, House WF: Changing concepts of acoustic neuroma diagnosis. Arch Otolaryngol 1985;111:17–21. Berenholz L, Eriksen C, Hirsh F: Recovery from repeated sudden hearing loss with corticosteroid use in the presence of an acoustic neuroma. Ann Otol Rhin Laryng 1992;101:827–831. Bikhazi N, Slattery W, Lalweni A et al.: Familial occurrence of unilateral vestibular schwannoma. Laryngosc 1997;107:1176–1180. Biller HF, Shugar JMA, Krespi YP: A new technique for wide– field exposure of the base of the skull. Arch Otolaryngol 1981;107:698–702. Brackmann DE, Hitselberger WE: Retrolabyrinthine approach: technique and newer indications. Laryngoscope 1978;88:286–297. Brand B, Caparosa R, Lubic T: Otorhinological brain abscess therapy, past and present. Laryngoscope 1984;94:483–487. Brenner M, Perrin R, Uppeluri R, Zipkel G: Atypical meningioma with claer cell features. Ar otolaryngol 2008;134:447-449. Brown NE, Jabre G, Grundfast F, Megerian CA: Diagnosis an management of spontaneous cerebrospinal fluid, middle ear effusion and otorrhea. Laryngoscope 2004;114:800-805. Cablemeyer K, Righi P, Mathews V: Iatrogenic pseudoaneurysm of the internal carotid artery. Ann Otol Rhinol Laryngol 1997;106:1093–1096. Cass S, Furman J, Ankerstjerne J et al.: Migraine–related vestibulopathy. Ann Otol Rhinol Laryngol 1997;106:182–189. Charabi S, Engel P, Jacobsen G et al.: Ann Otol Rhin Laryng 1993;102:805–809. Charabi S, Tos M, Thomsen J et al.: Vestibular schwannoma growth: the continuing controversy. Laryngosc 2000;110:1720–1725. Cheng P, Fason P, Atlas M, Roche J: Imaging destructive lesions of the petrous apex. Laryngosc 1998;108:599–604. Chole R: Petrous apicitis. Surgical anatomy. Ann Otol Rhinol Laryngol 1985;94:251–257. Clemis J, Ballard W, Basset P: Relative frequency of inferior vestibular schwannoma. Arch Otolaryngol 1986;112: 190–194. Clerico DM, Jahn A, Fontanella S: Osteoma of the internal auditory canal. Ann Otol Rhin Laryng 1994;103:619–623. Coltrera M, Goose P, Harrist T: Chondrosarcoma of the temporal bone. Cancer 1986;58:2689–2696. Corvera J, Benítez LD, López Ríos G, Rabiela MT: Vestibular and oculomotor abnormalities in vertebrobasilar insufficiency. Ann Otol Rhinol Laryngol 1980;89:370–376. Dichtel W, Miller R, Feliciano D: Lateral mandibulotomy: a technique of exposure for penetrating injuries of the internal carotid artery at the base of the skull. Laryngoscope 1984;94:1140–1144. Dornhoffer JL, Helms J, Hoehmann DH: Hearing preservation in acoustic tumor surgery. Laryngosc 1995;105:184–187. Effron MZ, Black FO, Shmrock D: Tension pneumocephalus complicating the treatment of postoperative CSF otorrhea. Arch Otolaryngol 1981;107:579–580. Eggermont JJ, Don M, Brackmann DE: Brain stem evoked responses and electrococleography. Ann Otol Rhinol Laryngol 1980;89(Sup. 75):1–19. Escajadillo JR: Surgical location of the internal auditory meatus in the cranial fossa. Escajadillo JR: Vía transmandibular–transpterigoidea para la resección de aneurisma carotídeo interno de la base del cráneo. Otorrin 2001;8(6):11–17. Escajadillo JR, Romero M: Quiste de colesterol de la base del cráneo. Boletín SMORL 1995;3(1):4–7. Elies W, Plester D: Basilar impression. Arch Otolaryngol 1980;106:232–233. Ferguson B, Wilkins R, Hudson W: Spontaneous CSF otorrhea from tegmen and posterior fossa defects. Laryngoscope 1986;96:635–644. Fisch U: Infratemporal fossa approach to tumors of the temporal bone and base of the skull. J Laryng Otol 1978;92:949–967. Franklin D, Jenkins H, Horowitz B et al.: Management of petrous apex lesions. Ar Otolaryng 1989;115:1121–1125. Gacek RR, Leipzig B: Congenital cerebrospinal otorrhea. Ann Otol Rhinol Laryngol 1979;88:358–365. Gadre A, Kwartler J, Brackmann D, House W: Middle fossa decompression of the internal auditory canal in acoustic neuroma surgery. Laryngosc 1990;100:948–952. ERRNVPHGLFRVRUJ Lesiones otoneurológicas Hanson W, Parnes L: Vestibular nerve compression in Camurati– Engelmann disease. Ann Otol Rhin Laryng 1995;104:823– 825. Hara A, Takahashi K, Ho Z et al.: Value of fat suppression magnetic resonance imaging in the diagnosis of lipomas of the internal auditory canal. Ann Otol Rhin Laryng 1997;106:343–347. Harmer SG, Laws ER: Posterior fossa approach for removal of acoustic neurinomas. Arch Otolaryngol 1981;107:590– 593. Harner S, Reese D: Roentgenographic diagnosis of acoustic neurinoma. Laryngoscope 1984;94:306–309. Harner S, Laws E, Onoprio B: Hearing preservation after removal of acoustic neurinoma. Laryngoscope 1984;94:1431– 1434. Harris A, McMenamin P: Carotid artery–cavernous sinus fistula. Arch Otolaryngol 1984;110:618–623. Hartnick CH, Mysero J, Myer CH: Endoscopic access to the infratemporal fossa and skull base. Ar Otolaryngol 2001;127:1325-1327. Hawke M, Jahn AF, Bailery D: Osteopetrosis of the temporal bone. Arch Otolaryngol 1981;107:278–282. Hecht C, Honrubia V, Wiet R, Sims S: Laryngosc 1997;107:1122– 1126. Hoffman R: Cerebrospinal fluid leak following acoustic neuroma removal. Laryngosc 1994;104:40–58. Holliday M, Nachlos N, Kennedy A: Uses and modifications of the infratemporal fossa approach to skull–base tumors. Ear Nose Throat 1986;65:9–16. Horowitz M, Levy E, Hathaway B, Jovin T, Hirsch B: Endovascular treatment of a petrous internal carotid artery aneurysm with hemotympanum and epistaxis using a coronary stent and detachable platinum coils. Ar Otolaryngol 2005;131:61-63. House WF: Surgical exposure of the internal auditory canal and its contents through the middle cranial fossa. Laryngoscope 1961;71:1363–1385. House JW, Hitselberger WE, McElveen J, Brackmann DE: Retrolabyrinthine section of the vestibular nerve. Otolaryngol Head Neck Surg 1984;92:212–215. House JW, Nissen R, Hitselberger WE: Acoustic tumor management in senior citizens. Laryngoscope 1987;97:129–130. Hsu R, Su C, Chien C, Liu C: Internal carotid artery aneurysm presenting as an unusual nasopharyngeal mass. Ann Otol Rhinol Laryngol 1998;107:536–539. Hughes G, Sismanis A, Glasscock ME III et al.: Management of bilateral acoustic tumors. Laryngoscope 1982;92:1351– 1358. Huvos A, Sundaresan N, Bretsky S, Butler A: Osteogenic sarcoma of the skull. Cancer 1985;56:1214–1221. Irjala K, Suonpää J, Laurent B: Identification of CSG leakage by immunofixation. Arch Otolaryngol 1979;105:447–448. Iwasaki S, Matsui Y, Ho K, Naito R: Hypertrophic cranial pachymeningitisd presenting as steroid responsive hearing loss. Ann Otol Rhinol Laryngol 2003;112:476-479. Jackson G, Netterville J, Glasscock M et al.: Defect reconstruction and cerebrospinal fluid management in neuro–otologic skull base tumors with intracranial extension. Laryngosc 1992;102:1205–1214. Jacob A, Robinson L, Bortman J, Yo L: Nerve of origin, tumor size, hearing preservation and facial nerve outocomes in ERRNVPHGLFRVRUJ Capítulo 8 Gantz B, Parnes L, Horfer L, McCabe BF: Middle cranial fossa acoustic neuroma excision. Ann Otol Rhinol Laryngol 1986;95:454–455. Gardner G, Cooke E, Robertson J: Skull base approach: infratemporal approach. Otol Head Neck Surg 1996;7:118–128. Gardner G, Robertson J, Clarck WC: 105 patients operated upon for cerebellopontine angle tumors. Experience using combined approach and CO2 laser. Laryngoscope 1983;92:1049–1055. Garthelose L, Mickey B, Shaefer S: Resection of upper aerodigestive tract tumors involving the middle cranial fossa. Laryngoscope 1985;95:908–914. Gay I, Elidan J, Kopolovic J: Chondrosarcoma at the skull base. Ann Otol Rhinol Laryngol 1981;90:53–55. Gazzanina M: Brain mechanisms and behavior. In: Gazzanina M, Blahesvore C (eds.): Handbook of psychobiology. New York: Academic Press Inc., 1975:565–588. Gherini S, Brackmann DE, Lo W et al.: Cholesterol granuloma of the petrous apex. Laryngoscope 1985;95:659–664. Glasscock M, Woods C, Jackson CG: Management of bilateral acoustic tumors. Laryngosc 1989;99:475–484. Glasscock ME III: Middle fossa approach to the temporal bone. Arch Otolaryngol 1969;90:41–53. Glasscock ME III, Hays JW, Jackson CG et al.: A one–stage combined approach for the management of large cerebellopontine angle tumors. Laryngoscope 1978;88:1563–1575. Glasscock ME III, Smith P, Band A: Management of aneurysms of the petrous portion of the internal carotid artery by resection and primary anastomosis. Laryngoscope 1983;93:1445–1453. Glasscock ME II, Kveton JF, Christiansen SG: Middle fossa vestibular neurectomy: an update. Otol Head Neck Surg 1984;92:216–219. Glasscock ME, Kveton J, Jackson G: A systematic approach to the surgical management of acoustic neuroma. Laryngoscope 1986;96:1088–1094. Goodhill V: Progress in otology. Ann Otol Rhinol Laryngol 1979;88:658–663. Graham M, Kemink J, Latack J, Kartush J: The giant cholesterol cyst of the petrous apex. Laryngoscope 1985;95:1401–1406. Granik M, Martuza R, Montgomery W et al.: Cerebellopontine angle meningiomas: clinical manifestations and diagnosis. Ann Otol Rhinol Laryngol 1985;94:34–38. Greenes RA, Weber AL: Intracranial chordoma. Ann Otol Rhinol Laryngol 1980;89:100–101. Greinwold J, Lassen L: Lipomas of the internal auditory canal. Laryngosc 1997;107:364–368. Gross M, Gomori J, Hamdan K, Elidaim J: Unusual bilateral lesions of the internal auditory canals. Ann Otol Rhinol Laryngol 2004;113:505-507. Gulya AJ, Glasscock ME III, Pensak M: Primary adenocarcinoma of the temporal bone with posterior fossa extension. Laryngoscope 1986;96:675–677. Gussen R, Canalis RF: Mucormycosis of the temporal bone. Ann Otol Rhinol Laryngol 1982;91:27–32. Haberkamp T, McFadden E, Khafagy Y, Harvey S: Gunshot injuries of the temporal bone. Laryng 1995;105:1053–1057. Hamby WB, Dohn DF: Carotid–cavernous fistulas: report of 36 cases and discussion of their management. Clin Neurosurg 1963;11:150–170. 207 207 208 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 8 359 vestibular schwannoma resections at a terciary care academic center. Laryngoscope 2007;117:2087-2092. Jahrsdoerfer RA, Richtsmeier WJ, Cantrell RW: Spontaneous CSF otorrhea. Arch Otolaryngol 1981;107:257–261. Jenkins H: Long–term adaptive changes of the vestibuloocular reflex in patients following acoustic neuroma surgery. Laryngoscope 1985;95:1224–1234. Jerger J, Neely G, Jerger S: Speech, impedance, and auditory brainstem response audiometry in brainstem tumors. Arch Otolaryngol 1980;106:218–223. Jerger S, Hayes D: Latency of the acoustic reflex in 8–nerve tumor. Arch Otolaryngol 1983;109:1–5. Kamerer D, Caparosa R: Temporal bone encephalocele diagnosis and treatment. Laryngoscope 1982;92:878–882. Kartush J, Telion S, Graham M: Anatomic basis for labyrinthine preservation during posterior fossa acoustic tumor surgery. Laryngoscope 1986;96:1024–1025. Kasantikul V, Netsky MG, Glasscock ME III, Hayes JW: Intracanalicular neurilemmomas: clinicopathologic study. Ann Otol Rhinol Laryngol 1980;89:29–32. Kasantikul V, Palmer JO, Netsky MG et al.: Glioma of the acoustic nerve. Arch Otolaryngol 1980;106:456–459. Kearns D, Pitcock J, Kenkins H: Tuberculous petrous apicitis. Arch Otolaryngol 1985;111:406–408. Kemink J, Graham M, Kartush J: Spontaneous encephalocele of the temporal bone. Arch Otolaryngol 1986;112:558-561. Kileny P, Wilson AF: Vestibulo–ocular and oculomotor responses following brainstem cerebrovascular accident. Ann Otol Rhinol Laryngol 1981;90:194–196. Kim H, Kim Y, Park IY et al.: Variability of the surgical anatomy of the neurovascular complex of the cerebellopontine angle. Ann Otol Rhinol Laryngol 1990;99:288–296. Kimmelman CP: Otolaryngologic aspects of neurofibromatosis. Arch Otolaryngol 1979;105:732–736. Kline OR: Spontaneous cerebrospinal otorrhea. Arch Otolaryngol 1933;18:34–39. Kraus E, McCabe BF: The giant apical air cell syndrome. Ann Otol Rhinol Laryngol 1982;91:237–239. Kumar A, Maudelonde C, Mafee M: Unilateral sensorineural hearing loss: analysis of 200 cases. Laryngoscope 1986;96:14–18. Kumar A, Valvassori G, Jafer J: Skull base lesions: classification and surgical approaches. Laryngoscope 1986;96:252–263. Kveton J, Goravalingappa R: Elimination of temporal bone cerebrospinal fluid otorrhea using hydroxyaporte cement. Laryng 2000;110:1655–1659. Lee S, Finn L, Sze R, Perkins J, Sie K: Gorham Stout syndrome. (Disappering bone disease.) Ar Otolaryngol 2003;129:1340. Levine R, Ojemann R, Montgomery W, McGaffigan P: Monitoring auditory evoked potentials during acoustic neuroma surgery. Ann Otol Rhinol Laryngol 1984;93:116–123. Linker S, Ruckenstein M, Acker J, Gardner G: An accurate cost effective approach for diagnosing retrocochlear lesions utilizing Thetz–weighted fast–spin echo magnetic resonance imaging scan. Laryngosc 1997;107:1525–1529. Linkov G, Morris L, Shah J, Kraus D: First bite syndrome: incidence, risk factors, treatment and outcomes. Laryngoscope 2012;122:1773–1778. Linthicum FH, Brackmann DE: Bilateral acoustic tumors. Arch Otolaryngol 1980;106:729–733. Lipkin A, Jenkins H: Role of air contrast computed tomography in diagnosis of small acoustic neuromas. Laryngoscope 1984;94:890–895. Liston SL, Waeckerle JF, Robinson W: Intracranial abscesses with behavioral changes. Arch Otolaryngol 1979;105:343–346. Luschka H: Die Altersveränderumgen der Zwischenwirbelknorpel Virc. Arch 1856;9:311. Lustig L, Holliday M, McCarthy E, Nager G: Fibrous dysplasia involving the skull base and temporal bone. Ar Otolaryngol 2001;127:1239-1247. Mafee M, Aimi K, Valvassori G: Computed tomography in the diagnosis of primary tumors of the petrous bone. Laryngoscope 1984;94:1423–1430. Makins A, Nikolopoulos T, Ludman C, O’Donohue G: Is there a correlation between vascular loops and unilateral auditory symptoms. Laryngoscope 1998;108:1739–1742. Mann W, Gilsbach J et al.: Use of a malar bone graft to augment skull base access. Arch Otolaryngol 1985;111:30–33. McCabe BF, Harker L: Vascular loop as a cause of vertigo. Ann Otol Rhinol Laryngol 1983;92:542–543. McGuirt W, Stool S: Cerebrospinal fluid fistula: the identification and management in pediatric temporal bone fractures. Laryngosc 1995;105:359–364. Miller S, Pulec J: A case of cysticercosis cerebri. Ann Otol Rhinol Laryngol 1982;91:122–125. Miyamoto RT, House WF, Brackmann DE: Neurotologic manifestations of the osteopetroses. Arch Otolaryngol 1980;106:210–214. Miyamoto R, Roos K, Campbell R, Worth R: Contemporary management of neurofibromatosis. Ann Otol Rhin Laryng 1991;100:38–43. Moffat DA, O’Connor AFF: Bilateral internal carotid aneurysms in the petrous temporal bones. Arch Otolaryngol 1980;106:172–175. Moller M: Results of microvascular decompression of the 8 nerve as treatment for disabling positional vertigo. Ann Otol Rhinol Laryngol 1990;99:724–729. Møller M, Møller A: Brainstem auditory evoked potentials in patients with cerebellopontine angle tumors. Ann Otol Rhinol Laryngol 1983;92:645–650. Mouwry S, Cannalis R : Gorham – stout disease of the temporal bone. Laryngoscope 2010;120:598-600. Musiek FE, Sachs E: Reversible neuroaudiologic findings in a case of right frontal lob abscess with recovery. Arch Otolaryngol 1980;106:280–283. Misiek FE, Wilson DH, Reeves AG: Staged commissurotomy and central auditory function. Arch Otolaryngol 1981;107:233–236. Myer C, Miller G, Ball J: Spontaneous cerebrospinal fluid otorrhea. Ann Otol Rhinol Laryngol 1985;94:96–97. Nageris B, Popovtzer A: Acoustic neuroma in patients with completely resolved hearing loss. Ann Otol Rinol Laryngol 2003;112:395-397. Nassif P, Shelton C, Arriaga M: Hearing preservation following surgical removal of meningiomas affecting the temporal bone. Laryngosc 1992;102:1357. Neely J, Neblett C: Differential facial nerve functions in tumors of the internal auditory meatus. Ann Otol Rhinol Laryngol 1983;92:39–41. Nessel E, Mundnich K: Chirurgie des epipharynx. En: Naumann HH (ed). Kopf– und Hals–Chirurgie. Part 2, Stuttgart, Alemania: Georg Thieme 1974;(vol. 2):667–670. ERRNVPHGLFRVRUJ Lesiones otoneurológicas Schweber M, Hall J: Cochleovestibular nerve compression syndrome. Clinical features and audiovestibular findings. Laryngoscope 1992;102:1020–1029. Schweber M, Urobec J: Suboccipital vestibular neuretomy: results and complications. Laryngosc 1993;103:936–938. Selesnick S, Jackler R, Pitts L: The changing clinical presentation of acoustic tumors in the magnetic resonance imaging era. Laryngosc 1993;103:431–436. Shah S, Lalwani A, Dowd C: Transverse sigmoid sinus dural arteriovenous fistules presenting as pulsatile tinnitus. Laryngoscope 1999;109:54–58. Shelton C: Unilateral acoustic tumors: how often do they recur after translabyrinthine removal. Laryngosc 1995;105:958–966. Shelton C, Brackmann D, House W, Hitselberger W: Middle fossa acoustic tumor surgery. Results in 106 cases. Laryngoscope 1989;99:405–408. Silverstein H, Norrell H: Retrolabyrinthine surgery: a direct approach to the cerebellopontine angle. Otolaryngol Head Neck Surg 1980;88:462–469. Silverstein H, Norrell H, Haberkamp T: A comparison of retrosigmoid internal auditory canal, retrolabyrinthine, and middle fossa vestibular neurectomy for treatment of vertigo. Laryngoscope 1987;97:165–173. Slater P, Welling B, Goodman J, Miner M: Middle fossa transpetrosal approach for petroclival and brainstem tumors. Laryngosc 1998;108:1408–1412. Slavit D, Harper S, Harper M, Beatis C: Auditory monitoring during acoustic neuroma removal. Ar Otolaryng 1991;117:1153–1157. Soliman A, Smouha E, Davis R: Cholesterol granuloma cyst of the petrous apex. Ar Otolaryng 1998;124:108–110. Spode JE, Bumsted RM, Warner ED: Chondroid chordoma. Ann Otol Rhinol Laryngol 1980;89:279–285. Sun G, Shoman N, Theodosopoulos P, Kendler A, Pensak M: Intravascular papillary endothelial hyperplasia of the internal auditory canal. Laryngoscope 2012;122:212–215. Swanson S, Chandler W, Kogan M, Bogdasarian R: Flow regulated continuous spinal drainage in the management of cerebrospinal fluid fistulas. Laryngoscope 1985;95:104–106. Teixido M, Wiet R: Hearing results in retrolabyrinthine vestibular neurectomy. Laryngosc 1992;102:33–38. Telian S, Kileny P, Niparko J: Normal auditory brainstem response in patients with acoustic neuroma. Laryngosc 1989;99:10–14. Thomsen J, Nyboe J, Borum P et al.: Acoustic neuromas. Arch Otolaryngol 1981;107:601–607. Tos M, Thomsen J: The price of preservation of hearing in acoustic neuroma surgery. Ann Otol Rhinol Laryngol 1983;91:240–245. Urken M, Biller H, Haimou M: Intratemporal carotid artery bypass in resection of a base of skull tumor. Laryngoscope 1985;95:1472–1476. Valvassori G, Dobben GD: Vertebrobasilar insufficiency. Ann Otol Rhinol Laryngol 1979:88:689–692. Van Leeuwen JP, Cremers CW, Thewissen PM et al.: Laryngoscope 1995;105:701–707. Varvares M, Cheney M, Goodman M, Montgomery W. Chondroblastoma of the temporal bone. Ann Otol Rhin Laryng 1992;101:763–769. ERRNVPHGLFRVRUJ Capítulo 8 Nissen A, Sikand A, Welsh J, Curto F: Use of the KTP–532 laser in acoustic neuroma surgery. Laryngosc 1997;107:118–121. Nom S, Linthicum F, Merchant J: Temporal bone histopathology in neurofibromatosis type 2. Laryngoscope 2011;121:1548– 1554. Olsson J: Neurotologic findings in basilar migraine. Laryngoscope 1991;101(52):1–41. Ortiz Armenta L: El abordaje retrolaberíntico del ángulo pontocerebeloso. Anales Soc Mex Otorrinolar 1986;31:25–29. Ozbek C, Aygen E, Fidon F, Unsal T: Fibrous dysplasia of the temporal bone. Ann Otol Rhinol Laryngol 2003;112:654656. Oson JE, Wolfe JW: Block nystagmus. Ann Otol Rhinol Laryngol 1980;89:286–287. Ozdamar O, Kraus N, Stein L: Auditory brainstem responses in infants recovering from bacterial meningitis. Arch Otolaryngol 1983;109:13–18. Pandya D, Karol E, Heilbronn D: The topographical distribution of interhemispheric projections in the corpus callosum of the rhesus monkey. Brain Res 1971;32:31–43. Pandya Y, Piccirillo E, Mancini F, Sanna M: Management of complex cases of petrous bone cholesteatoma. Ann Otol Rhinol Laryngol 2010;119:514–525. Pappas D Jr, Pappas D Sr: Vestibular nerve section. Long term follow–up. Laryngosc 1997;107:1203–1209. Parikh A, Brookes G: Conductive hearing loss following retro– labyrinthine surgery. Ar Otolaryng 1996;122:841–843. Pensak M, Glasscock ME III, Josey AF et al.: Sudden hearing loss and cerebellopontine angle tumors. Laryngoscope 1985;95:1188–1193. Pensak M, Glasscock ME III, Gulya A et al.: Cerebellopontine angle lipomas. Arch Otolaryngol 1986;112:99–101. Pons Y, Lombard B: Anatomic study of middle fossa approach landmarks using a image guidance system. Ann Otol Rhinol Laryngol 2009;118:728–734. Pulec JL, House WF: Vestibular involvement and testing in acoustic neuromas. Arch Otolaryngol 1964;80:677–679. Ramsay H, Brackmann D: Osteoma of the internal auditory canal. Ar Otolaryng 1994;120:207–208. Redleaf M, McCabe B: Disappearing recurrent acoustic neuroma in an elderly woman. Ann Otol Rhin Laryng 1993;102:518–520. Rinehart R, Harte R, Roski R, Dolan K: Aneurysm of the anterior inferior cerebellar artery producing hearing loss. Ann Otol Rhinol Laryngol 1992;101:705–706. Risse G, Ledoux J, Springer S et al.: The anterior commissure in man: functional variations in a multisensory system. Neuropsychologia 1978;16:23–31. Rock E: Vascular dizziness and transcranial Doppler ultrasonography. Ann Otol Rhinol Laryngol 1989;98(141):1–24. Rodrigo J, Llorente J, Genaro L et al.: Cerebellopontine angle lipoma. Ar Otolaryng 1995;121:935–937. Ross DE, Sukis AE: Nasopharyngeal tumors: a new surgical approach. Am J Surg 1966;111:524–530. Rouleau GA, Wertelecki W, Haines JL et al.: Genetic linkage of bilateral acoustic neurofibromatosis to a DNA marker on chromosome 22. Nature 1987;329:246–248. Sanna M, Zinni C, Gamoletti R: Petrous bone cholesteatoma. Skull Base Surg 1993;3:201- 213. Saunders J, Kwartler J, Wolf H et al.: Lipomas of the internal auditory canal. Laryngosc 1991;101:1031–1037. 209 209 210 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 8 Verdaguer J, Lobo D, García BJ, Ramírez CR: McCune-albright syndrome. Ar Otolaryngol 2005;131:181-185. Vazquez A, Ramchand T, Kupesan A, Liu J, Anderson E: Prepontine epidural abscess. JAMA Otolaryngol Head Neck Surg 2012;138:512–514. Wackyn P, King W, Borker F, Poe D: Endoscope–assisted vestibular neurectomy. Laryngosc 1998;108:1787–1793. Welling D: Clinical manifestations of mutations in the neurofibromatosis type 2 gene in vestibular schwannomas. Laryngosc 1998;108:178–189. Wiegand D, Ojemann R, Fickel V: Surgical treatment of acoustic neuroma (vestibular schwannoma) in the USA. Laryngosc 1996;106:58–66. Wier R, Schramm P, Keizan R: The retrolabyrinthine approach and vascular loop. Laryngoscope 1989;99:1035–1039. Wolfowitz B: Spontaneous CSF otorrhea simulating serous otitis. Arch Otolaryngol 1979;105:496–499. Yanagihara U, Agai M: Sudden hearing loss induced by acoustic neuroma: significance of small tumors. Laryngosc 1993;103:308–311. Yates Ch, Weinberg M, Packer M, Jacob A: Fatal case of tumor associated hemorraghe in a large vestibular scwannoma. Ann Otol Rhinol Laryngol 2010;119:402–405. Ylikoski J, Collan Y, Palva T: Vestibular findings in patients with acoustic neurinoma. Arch Otolaryngol 1980;106:723–726. Ylikoski J, Brackmann D, Salvolainen S: Facial nerve abnormalities after acoustic tumor removal. Arch Otolaryngol 1982;108:795–800. Yumoto E, Okamura H: Treatment of nasopharyngeal carcinoma: surgery combined with radiation therapy. Jibi Inkoka Tokeiby Geka 1988;60:189–194. Yumoto E, Okamura H, Yanagihara N: Transmandibular transpterigoid approach to the nasopharynx, parapharyngeal space, and skull base. Ann Otol Rhin Laryng 1992;101:383– 389. Zappia J, O’Connor C, Wiet R, Dinces E: Rethinking the use of auditory brainstem response in acoustic neuroma screening. Laryngosc 1997;107:1388–1392. Zeitouni A, Zagzag D, Cohen M: Meningioma of the internal auditory canal. Ann Otol Rhinol Laryngol 1997;106:657–661. ERRNVPHGLFRVRUJ Cirugía del oído medio infectado DISECCIONES PREVIAS El médico debe conocer las técnicas microquirúrgicas, para lo cual se recomiendan disecciones previas del hueso temporal en el laboratorio, con uso del microscopio y demás instrumentos de cirugía otológica, si bien Portmann ha señalado que deben disecarse 50 huesos temporales como mínimo antes de practicar operaciones otológicas en personas; el autor considera que es muy variable y que las disecciones del hueso debe efectuarlas con frecuencia el médico especialista a lo largo de su vida profesional, lo que siempre favorecerá un mejor conocimiento y dominio de las técnicas quirúrgicas. Radiografías simples del oído; el autor sugiere las placas de Schuller, Stenvers y Chausse III. En ocasiones, ciertos estudios, como la politomografía del oído y la tomografía axial computarizada de alta resolución, son importantes para determinar el tipo y extensión del proceso patológico. Afeitado de la región quirúrgica Se recomienda afeitar 4 a 5 cm alrededor de la incisión planeada. En las incisiones intrameatales, puede prescindirse de este paso y sólo se coloca un campo alrededor de la cabeza, fijado con tela adhesiva, para impedir la introducción de cabello y la contaminación del campo durante la operación. En seguida se aísla el campo quirúrgico para realizar la asepsia y antisepsia de la región, posterior a la intubación bucotraqueal, en caso de emplear anestesia general. VALORACIÓN PREOPERATORIA ANESTESIA Historia clínica completa Valorar el estado general del paciente y solicitar las interconsultas necesarias, según sean los problemas detectados durante el interrogatorio y la exploración, con el objeto de llevar al sujeto a la sala de operaciones en las mejores condiciones posibles. Fumar se considera un factor de riesgo para la cirugía del oído medio, ya que es capaz de producir aumento del número de células caliciformes, pérdida del epitelio ciliado, metaplasia escamosa y atipia nuclear. Estudios de laboratorio 1. Biometría hemática completa. 2. Grupo sanguíneo y factor Rh. 3. Tiempos de protrombina y parcial de tromboplastina. 4. Química sanguínea (glucosa, urea y creatinina). 5. Análisis general de orina. 6. Cultivo preoperatorio de la secreción ótica. Se sugiere suministrar anestesia local en procedimientos quirúrgicos menores, como miringoplastia, miringotomía, con o sin aplicación de cánulas de ventilación y estapedectomías. Esto es válido para adultos. En menores de 10 años no siempre tiene éxito y quizá se requiera neuroleptoanestesia concurrente o anestesia general, esta última ideal para procedimientos más prolongados en los que se utiliza fresa quirúrgica. Para la infiltración local del anestésico se usa una aguja 25 o 26 y xilocaína al 2% con adrenalina (1:200 000). Durante la aplicación del anestésico, el médico debe vigilar el desarrollo de arritmias cardiacas en pacientes susceptibles y por tanto siempre debe existir vigilancia cardiaca para registrar de modo temprano cualquier alteración y prevenir desastres mayores. Asimismo, se puede premedicar al paciente con un sedante como diacepam (10 mg para un adulto de 70 kg) y atropina (0.5 mg), 30 min antes de la opera- Capítulo 9 CONCEPTOS GENERALES Estudios de gabinete 211 ERRNVPHGLFRVRUJ 212 Oído, nariz, garganta y cirugía de cabeza y cuello ción. En la anestesia general resulta ideal la inducción con diacepam y fentanilo, ya que disminuye la vasodilatación capital producida por la mayor parte de los anestésicos y la sensibilización del sistema cardiaco de conducción a la adrenalina, situación que se observa a menudo con halotano. Capítulo 9 POSICIÓN DEL PACIENTE Decúbito dorsal con el mentón hacia el hombro contralateral. Se recomienda colocar al sujeto lo más cerca posible de la orilla de la mesa quirúrgica, con su cabeza en la porción distal de ésta y los pies en la cabecera, maniobra que facilita al circulante dar lateralidad u otros cambios de posición necesarios durante la intervención. 4. Microganchos con punta roma y fina, con diferentes grados de angulación. 5. Picos rectos con punta fina. Otros instrumentos necesarios son pinzas de cocodrilo rectas y anguladas, pinzas en copa, microtijeras rectas y anguladas, dos separadores de garra tipo Wullstein y desperiostizador curvo. El resto del instrumental se obtiene de cualquier equipo de cirugía menor y consiste en pinzas de Kelly, hojas de bisturí números 11 y 15, así como bisturí eléctrico. INCISIONES QUIRÚRGICAS Existen tres tipos de incisiones básicas en la cirugía del oído. INSTRUMENTOS NECESARIOS Vía intrameatal (transmeatal) Microscopio quirúrgico Consiste en crear un colgajo posterior de base medial, a unos 8 mm del surco timpánico, con otras incisiones en forma vertical a las 12 y 6 h. Esta vía es útil en exploraciones del oído medio y estapedectomías (figura 9–1). Microscopio quirúrgico, con distancia focal de 200 mm para procedimientos otológicos y 300 mm para otoneuroquirúrgicos, con aumentos de 6x, l0x y 16x. Equipo de aspiración Equipo de aspiración con diámetro variable de 0.6 a 3 mm. Para el trabajo en mastoides y la exposición de nervios se recomienda la aspiración continua, lo que produce un menor calentamiento y tiempo de fresado. Vía endoaural Se efectúa una incisión circunferencial entre las 6 y 12 h sobre la pared posterior de la unión ósea y cartilaginosa del conducto auditivo externo y una segunda incisión entre el trago y la incisura del hélix para extenderse 2 a 3 cm hacia arriba y conectarse con la primera en su porción inferior. Esta incisión es útil en procedimientos Fresa quirúrgica El clínico debe tener presente que cuanto mayor sea la velocidad, más sencillo será el fresado, con rapidez y seguridad. Aunque es adecuada la fresa eléctrica con el empleo de una cuerda (a manera de violín), se ha reemplazado de forma gradual por fresas de nitrógeno, las cuales alcanzan mayores revoluciones por minuto; las fresas de violín han quedado relegadas a estudios de laboratorio del hueso temporal. Se emplean piezas de mano, tanto rectas como anguladas. Las puntas de las fresas pueden ser de acero, tungsteno o diamante, estas últimas adecuadas para trabajar sobre estructuras nerviosas. En velocidades lentas (menores de 15 000 rpm) se recomienda emplear fresas con pocos dientes para evitar que se llenen rápidamente con detritos óseos. A velocidades mayores se pueden utilizar fresas con más dientes. Equipos otológicos Existen diferentes equipos en el mercado, pero por lo general es recomendable que contengan: 1. Bisturí horizontal. 2. Bisturí vertical. 3. Microcucharilla. Figura 9–1. Incisión intrameatal (transmeatal). ERRNVPHGLFRVRUJ Cirugía del oído medio infectado 213 213 Capítulo 9 IE Figura 9–2. Incisión endoaural (Sambaugh-Lempert). timpanoplásticos que no requieren fresado quirúrgico, en los que existe buena visualización del borde anterior de la membrana timpánica, en caso de perforaciones (figura 9–2). Vía retroauricular La incisión se traza detrás de la oreja, en la implantación del cabello (a unos 2 cm del surco retroauricular). Abajo se extiende hasta la punta de la mastoides y arriba en la parte más alta del pabellón auricular; en ocasiones, con el objeto de obtener mayor cantidad de fascia temporal, puede extenderse 1 a 2 cm más. Se realiza la incisión de la pared ósea posterior del conducto auditivo externo, junto con dos incisiones oblicuas, una superior y otra inferior. Después se aplican los retractores y se levanta la piel sobre la pared posterior del conducto; el autor facilita esta maniobra con un procedimiento intrameatal previo, con incisión horizontal a unos 6 mm del surco timpánico y otras dos verticales a las 12 y 6 h. Una vez que se localizan estas incisiones por vía retroauricular, se coloca una cinta umbilical por vía intrameatal, que se toma con una pinza de Kelly a través de la herida retroauricular y se lleva a la parte superior del campo operatorio, para sostener de esta manera la pared posterior del pabellón auricular y facilitar la exposición de la membrana timpánica y el oído medio (figura 9–3). Esta incisión es ideal para procedimientos timpanoplásticos en los que no se observa la porción anterior de la membrana timpánica cuando, además, la mucosa del oído medio presenta anomalías y en intervenciones que requieran fresado de la mastoides. Figura 9–3. Incisión retroauricular en la que además se muestra el levantamiento del colgajo aponeurótico (CA). Vendaje del oído Se aplica al finalizar la operación y consiste en colocar gasas alrededor de la herida quirúrgica (endoaural o retroauricular) y aplicar una torunda de algodón sobre la concha del pabellón auricular. A continuación se corta una porción de una venda elástica o gasa de 7 cm, que se aplica enfrente del pabellón auricular para fijar el vendaje colocado sobre el oído. Para evitar que se mueva se aplica tela adhesiva a su alrededor. El vendaje se deja cinco a seis días; después sólo se emplean gasas alrededor de la herida y algodón en la concha auricular (figura 9–4). MEATOPLASTIA PARA CORRECCIÓN DE ESTENOSIS ADQUIRIDAS Y CONGÉNITAS DEL CONDUCTO AUDITIVO EXTERNO Paparella y Kurkjian señalaron la importancia de remover toda la piel de las porciones ósea y cartilaginosa del conducto auditivo externo (CAE) y realizar una meatoplastia, con la colocación de injertos libres de piel, para el tratamiento de afectación que produzca estenosis del CAE. ERRNVPHGLFRVRUJ 214 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 9 Figura 9–4. Fotografía de un vendaje del oído. TÉCNICA 1. Anestesia general equilibrada. 2. Infiltración con anestesia local (xilocaína con adrenalina al 2:100 000) sobre la porción externa del CAE a las 12, 3, 6 y 9 h. 3. Obtención del injerto sin piel (regiones retroauricular contralateral o supraclavicular); se recomienda que el injerto tenga 0.12 pulgadas de grosor (3 mm). 4. Incisión retroauricular, con elaboración de un colgajo perióstico en forma de T invertida o M. 5. Identificación del área estenótica. 6. Remoción de toda la piel del CAE hasta la membrana timpánica. 7. Ensanchamiento de la porción ósea de CAE mediante fresado quirúrgico de su pared posterior. 8. Colocación del injerto sin piel; se recomienda que también cubra la membrana timpánica. 9. Aplicación de silástico en el conducto, así como material autoexpandible o gasa con antibiótico, para conservar los injertos en posición. 10. Cierre por capas de la herida quirúrgica. 11. Se coloca el vendaje compresivo de mastoides. Otros autores, como Moore, utilizan colgajos de piel retroauricular para la plastia del conducto, con resultados satisfactorios. TIMPANOPLASTIA Los objetivos de la timpanoplastia son: 1. Erradicación de la enfermedad. 2. Restauración de la aireación timpánica. 3. Reconstrucción del mecanismo transformador de sonido. 4. Creación de una cavidad autolimpiable. La era moderna de esta cirugía se inició a principios del decenio de 1950, con los trabajos de Wullstein y Zollner. Existen tres tipos de timpanoplastia: Timpanoplastia tipo I: consiste en restaurar la membrana timpánica (miringoplastia). Timpanoplastia tipo II: el paciente tiene un estribo completo y normal a través del cual se puede reconstruir la pérdida de la columnela, mediante la transposición de un huesecillo autólogo u homólogo, o emplear otros materiales aloplásticos. Timpanoplastia tipo III: el individuo sólo tiene la platina del estribo normal y es posible reconstruir el oído medio con materiales similares a los empleados en la timpanoplastia tipo II. Las timpanoplastias tipos II y III pueden realizarse en presencia o ausencia del martillo. ERRNVPHGLFRVRUJ Cirugía del oído medio infectado TIMPANOPLASTIA TIPO I (MIRINGOPLASTIA) 3. 4. 5. 6. 7. la piel de la pared posterior del conducto para reemplazarse como injerto libre al final de la intervención. En seguida, para ver mejor la pared anterior del conducto, se practica otra incisión vertical a las 2 h para levantar la piel y, en caso necesario, fresar la porción ósea del conducto. Vía endoaural. Vía retroauricular. Se retira el epitelio del remanente timpánico; se pueden reavivar los bordes de la perforación con unas pinzas en copa. Debe tenerse especial cuidado de no dejar remanentes de epitelio que puedan comprometer los resultados de la operación con la formación posterior de un colesteatoma, sobre todo si se utiliza la técnica de aplicar el injerto sobre el remanente timpánico. Con posterioridad se exploran las condiciones del oído medio y se verifica la integridad de la cadena osicular y el aspecto de la mucosa del oído medio y la trompa de Eustaquio. Colocación del injerto. Existen dos formas de hacerlo (figura 9–5): a) Debajo del remanente timpánico, para lo cual se levanta el anillo timpánico sobre su pared posterior, previo raspado de la capa mucosa del remanente timpánico, maniobra que se efectúa para producir una superficie cruenta que constituya un lecho ideal para la aplicación de la fascia temporal. Además, se colocan pequeños pedazos de Gelfoam® remojados antes en solución antibiótica con esteroides, que ayudan a conservar el injerto en su lugar. Se Técnica 1. Infiltración del anestésico local en la porción externa del conducto auditivo externo, apenas por debajo del trago. Se aplica 1 ml (xilocaína con adrenalina al 1:200 000) a las 12, 6, 3 y 9 h, así como a lo largo de la incisión endoaural o retroauricular, según sea el caso. 2. Vía intrameatal. Se levanta un colgajo timpanomeatal posterior a 6 u 8 mm del surco timpánico, con dos incisiones verticales a las 12 y 6 h. Durante este tiempo puede extraerse y conservarse Figura 9–5. Colocación de fascia temporal debajo del remanente timpánico. ERRNVPHGLFRVRUJ Capítulo 9 En general, no se recomienda este procedimiento en pacientes menores de siete años, dado que es una población de alto riesgo de sufrir otorrea posoperatoria. Sin embargo, en algunos casos seleccionados puede ofrecer resultados satisfactorios. El grado de hipoacusia que refieren los pacientes con perforaciones timpánicas guarda relación directa con su tamaño. En las de más de 75% puede haber hipoacusias de 20 dB o más; si son de 30 a 60% hay una pérdida aproximada de 15 a 17 dB; y en las menores de 20% las afecciones son de 10 dB o menores. Se han empleado diferentes tipos de injertos para reconstruir la membrana timpánica, desde que comenzaron a utilizarse los injertos sin piel. Los que han ofrecido mayor grado de éxito son los siguientes: Fascia temporal autóloga y homóloga: el autor considera que, por lo accesible de su obtención y sus características tanto de elasticidad como de grosor, es el material idóneo para reconstruir la membrana timpánica. El porcentaje de éxito es de 90% y es aún mayor en perforaciones pequeñas (menores de 25%). Esto se debe a que la fascia temporal tiene una nula o baja actividad metabólica, además de una baja viabilidad que facilita el crecimiento de la capa fibrosa media de la membrana timpánica y da lugar a la formación de neomembranas muy fuertes. Pericondrio: este material puede obtenerse del cartílago del trago o el costal y su obtención y preparación requieren mayor tiempo que el de fascia, aunque los resultados son igualmente satisfactorios. Homoinjertos de membrana timpánica: se obtienen de cadáveres de personas con menos de 24 horas de haber fallecido. Se preservan en alcohol al 95%. Si bien la remoción del injerto es un proceso lento y delicado, los resultados son satisfactorios en 85 a 90% de los casos. Se recomienda su empleo cuando existan bancos de hueso temporal. Fascia lata autóloga: es fácil su obtención mediante una incisión en la cara lateral externa del tercio superior del muslo. Ofrece una estabilidad dimensional mejor que la fascia temporal, se retrae en menor proporción y su cobertura es mayor. Tiene el inconveniente de que se obtiene de un sitio distal que debe prepararse de forma quirúrgica, pero constituye una excelente opción. 215 215 216 Capítulo 9 8. 9. 10. 11. Oído, nariz, garganta y cirugía de cabeza y cuello recomienda aplicar una porción de Gelfoam® alrededor de la articulación incudoestapedial, para evitar futuras adhesiones en ese sitio. Esta técnica se aconseja cuando exista un margen anterior en la perforación timpánica o al menos el anillo timpánico anterior. b) Encima del remanente timpánico. En esta técnica se coloca el injerto directo sobre el oído medio por debajo del mango del martillo, con lo cual se ayuda a conservar el injerto en su sitio, previa colocación de Gelfoam® en la caja timpánica. Se recomienda realizar algunas incisiones alrededor del injerto de fascia temporal para facilitar su aplicación adecuada (figura 9–6). Reposición de la piel del conducto auditivo externo, lo cual depende de la técnica empleada. Si se extrajo, se aplica a manera de injerto libre. Es importante señalar que la piel de las paredes posterior y anterior del conducto debe quedar encima de la fascia temporal. Aplicación de Gelfoam® sobre el injerto (fascia). Cierre por capas de las incisiones endoaural y retroauricular; se coloca un pequeño rollo de Gelfoam® en el conducto o una mecha de gasa para conservar permeable el conducto auditivo externo. También se pueden aplicar los nuevos materiales expandibles. Colocación del algodón en la concha del pabellón auricular y vendaje compresivo del oído (vendaje del oído). Complicaciones 1. Abombamiento del injerto sobre el ángulo timpanomeatal. Esta complicación se presenta más cuando se coloca el injerto sobre el remanente timpánico. 2. Desplazamiento lateral del injerto: aparece cuando la punta del mango del martillo no entra en contacto con la fascia. 3. Bolsa de retracción: se relaciona con una disfunción tubaria y en algunos casos puede prevenirse; se refuerza el cuadrante posterosuperior de la membrana timpánica con la colocación de cartílago septal y la introducción de una hoja de silástico en el oído medio. 4. Perforación: puede presentarse cuando el injerto se aplica por debajo del remanente timpánico en ausencia de un anillo fibroso timpánico anterior. También se observa en sujetos con disfunción tubaria que desarrollan cuadros infecciosos de vías respiratorias superiores. En estos casos es de utilidad el empleo de injertos de cartílago, como el de la fosa triangular del pabellón auricular. 5. Inclusión de colesteatoma: se debe a desepitelización inadecuada del remanente timpánico cuando se aplica la fascia. TIMPANOPLASTIA TIPOS I Y III (RECONSTRUCCIÓN DE LA CADENA OSICULAR) Existen diferentes materiales que pueden usarse para reconstruir la cadena osicular. El tiempo ha demostrado que los más eficaces son: 1. Huesecillos autólogos (interposición de yunque) 2. Huesecillos homólogos 3. Cartílago septal y tragal preservados 4. Materiales biocompatibles Técnica de interposición del yunque Con presencia de martillo: la técnica que es válida tanto para yunques autólogos como homólogos consiste en: Figura 9–6. Colocación de fascia temporal encima del remanente timpánico. a) Extirpar la apófisis larga del yunque. b) Fresado de la porción residual de la apófisis larga para formar una cavidad que se articule con la cabeza del estribo (timpanoplastia tipo II). Si sólo existe la platina del estribo, no se corta la apófisis larga del yunque y se aplica directamente sobre la platina (timpanoplastia tipo III). c) En ocasiones, y de acuerdo con la relación entre el estribo y el martillo, también puede emplearse la apófisis corta de yunque para articularla con la cabeza del estribo. d) Fresado de la superficie articular del yunque, a manera de silla de montar, para aceptar al mango del martillo. ERRNVPHGLFRVRUJ Cirugía del oído medio infectado 217 217 Capítulo 9 A B Figura 9–7. Técnica de interposición del yunque. A. Fresado en la apófisis corta y del cuerpo del yunque, así como de su apófisis larga, en la cual se articula la cabeza del estribo. B. Yunque interpuesto entre el estribo y el martillo. e) La interposición y fijación del yunque se facilitan con el uso de un adhesivo tisular autólogo de fibrina; otros adhesivos como el Histoacryl® producen reacciones tisulares notorias. f) Otro elemento útil para estabilizar el yunque es el nervio de la cuerda del tímpano (figura 9–7). Las estadísticas muestran que en 60 a 65% de los casos se logra un cierre de la brecha (gap) óseo–aéreo de 0 a 15 dB. Ausencia de martillo: en esta situación se emplea la apófisis larga del yunque, se crea una superficie articular para la cabeza del estribo o, si no existe, se coloca de forma directa sobre la platina. Estos casos representan mayor riesgo de desplazamiento transoperatorio y posoperatorio del implante. El autor ha encontrado que el uso del adhesivo tisular autólogo de fibrina es muy útil (figura 9–8). Con esta técnica se obtiene un cierre de la brecha (gap) óseo–aéreo de 0 a 20 dB en 20% de los casos. Pueden esperarse aberturas o diferencias mayores de 30 dB en más de 50% de los casos. Causas de fracaso. Por lo general se deben a lateralización del huesecillo (yunque) interpuesto (50% de los casos). Otras menos frecuentes son fijación (20%), atrofia (13%) y formación de fístula (3.3%), que casi siempre se acompañan de mala función tubaria. Con el empleo de cartílago se logra cerrar la brecha (gap) óseo–aérea de 0 a 20 dB en 60 a 65% de los casos. Cuando se pierde la mucosa del oído medio, se recomienda aplicar una hoja delgada de silástico para evitar la posibilidad de adhesiones y fijación subsecuente del implante. Mikaelian utiliza cartílago tragal para la reconstrucción osicular, cuyo pericondrio se levanta a manera de isla para cubrir tanto al injerto como a la perforación timpánica existente. Compuestos porosos de polietileno Se han empleado compuestos porosos de polietileno de alta densidad (PORP, partial ossicular reconstruction pros- Reconstrucción osicular con cartílago Se pueden utilizar implantes de cartílago del trago, el tabique o la región condrocostal, tanto autólogos como homólogos. Cuando se obtienen de cadáveres, se sugiere extraerlos de personas jóvenes (tres a 20 años), sobre todo el costal. Aunque el tamaño y la longitud de los implantes varían según sean las necesidades de cada paciente, las dimensiones promedio recomendadas son 8 mm de alto por 4 mm de ancho. Figura 9–8. Interposición del yunque cuando no existen el martillo ni la superestructura del estribo. Las líneas interrumpidas representan el Gelfoam® que se ha aplicado en la caja timpánica con el fin de conservar el yunque en su lugar. A continuación se coloca sobre éste fascia temporal para formar la nueva membrana timpánica. ERRNVPHGLFRVRUJ 218 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 9 thesis; y TORP, total ossicular reconstruction prosthesis). El uso de este material se generalizó en la segunda mitad del decenio de 1970 y pronto la experiencia clínica mostró una frecuencia alta de rechazo con salida de los implantes; por lo tanto, se decidió reducir el tamaño de su plataforma de contacto con la membrana timpánica e interponer entre estas dos estructuras un cartílago con pericondrio. Estas medidas han disminuido la frecuencia de rechazo y salida que fluctúa entre 5 y 10%, y se relaciona con el desarrollo de atelectasias, fibrosis y otitis medias, sobre todo en sujetos con mala función tubaria. Es importante señalar que si el cirujano detecta en clínica el inicio de rechazo de estos implantes, debe adoptar una actitud expectante, ya que a menudo las parciales permanecen así por tiempo prolongado sin alterar sobremanera la capacidad auditiva del individuo. Si la audición baja, está indicada una revisión quirúrgica. PORP se emplea cuando el estribo está completo (timpanoplastia tipo II) y TORP en casos en los cuales sólo existe la platina (timpanoplastia tipo III). Aunque las estadísticas varían en grado considerable con respecto al cierre de la brecha (gap) ósea–aérea que se obtiene con estas prótesis, debido sobre todo al tiempo de seguimiento de los pacientes, con el uso de PORP se consigue 0 y 20 dB en 55 a 65% de los casos, y con TORP 40 a 55%. Otra prótesis tipo TORP es la Spandrel II desarrollada por Xomed, formada por una estructura de acero inoxidable moldeado de 0.12 mm de diámetro con un revestimiento de policel (polietileno de alto refinamiento). Consta de dos partes: a) Una cabeza adherida a una columnela. b) Una base inferior o zapata. Este dispositivo permite que después de determinar el tamaño adecuado de la prótesis, la estructura de acero de la columnela se pueda introducir a la zapata para fijar de esta forma la prótesis y posibilitar la adecuada transmisión del sonido. Fisch ha obtenido con su empleo resultados muy alentadores, ya que consigue un mejor comportamiento vibratorio y permite que al cortar el alambre 0.5 mm más largo que la base de la zapata ésta se pueda fijar a la platina del estribo para que la cabeza de la prótesis tenga una mejor adaptabilidad en respuesta a los movimientos de la membrana timpánica, lo que elimina la necesidad de cubrir con cartílago la cabeza de la prótesis y produce menor extrusión. Materiales biocompatibles Desde la invención de los materiales activos de superficie, acreditada a Hench en 1969, se han efectuado extensos estudios en diferentes modelos experimentales de animales. Con respecto a la reconstrucción osicular en el oído, se han desarrollado implantes con materiales bioactivos de vidrio y cerámica, que se denominan biovidrio y ceravital, respectivamente. También se han diseñado prótesis híbridas de hidroxiapatita con compuestos porosos de polietileno de alta densidad (Plasti-pore®, policel) y otros como el cemento de hueso, resultante de la combinación de una base compuesta de calcio, aluminio y silicato de flúor, con el ácido polialquenoico. Al mezclarlos se inicia un proceso exotérmico que permite durante un periodo de 5 a 10 min moldear el cemento antes de que se endurezca y se pegue al huesecillo. Todos ellos han demostrado tener una excelente biocompatibilidad. El implante de biovidrio en el oído del ratón ha mostrado su unión con el hueso de la cadena osicular, así como con cartílago y tejidos blandos, como la membrana timpánica. Estos implantes tienden a cubrirse con una cápsula muy delgada de fibras de colágena que es revestida por la mucosa del oído medio de aspecto normal. Al parecer, el rechazo y la formación de atelectasias en el oído son mínimos y por tanto se compara de manera favorable con los compuestos porosos de polietileno. Este material puede moldearse durante la operación con el empleo de fresas de diamante. El biovidrio difiere del ceravital porque este último contiene óxido de magnesio y potasio, además de menos óxido de sodio. La estructura del ceravital le confiere menor reactividad que el biovidrio. Estudios clínicos y experimentales de Reck han demostrado una buena tolerancia tisular con restauración funcional de la audición comparable a la de los homoinjertos osiculares. Cuando el biovidrio entra en contacto con el tejido, se desencadena una serie de reacciones de superficie controladas en las que los iones de hidrógeno se intercambian por iones alcalinos, de tal manera que se forma una capa biológica activa alcalina de fosfato de calcio, lo cual favorece el depósito de mineral de hueso y fibras de colágena. Otros tipos de implantes bioactivos de cerámica tratados con óxido de aluminio, que son física, química y fisiológicamente inertes, han mostrado resultados alentadores. A los implantes de cerámica se los denomina CORP (ceramic ossicular reconstruction prosthesis) y pueden ser parciales (P) o totales (T). Las dimensiones de algunas de estas prótesis son las siguientes: a) La porción cefálica, de forma convexa y elíptica, mide 4 x 2 mm. b) Diámetro de la porción vertical (columnela) del implante: CORP–P: 1.2 mm; CORP–T: 0.8 mm. c) Porción caudal (base): CORP–P: 2.5 mm; CORP–T: 1.0 mm. d) El largo de la prótesis es variable: CORP–P: 3, 4 o 5 mm; CORP–T: 5, 6 o 7 mm. e) Peso: CORP–P: 31 a 41 mg; CORP–T: 23 a 30 mg. En opinión del autor, en un futuro cercano los materiales biocompatibles (como el biovidrio y el ceravital) reemplazarán a los compuestos porosos de polietileno, debido a su mejor integración con el tejido y un rechazo mínimo. Los implantes de metal a base de titanio para las reconstrucciones osiculares ofrecen una excelente biocompatibilidad, bioestabilidad y bajo ferromagnetismo, además de ser muy ligeros y rígidos, por lo que son una ERRNVPHGLFRVRUJ Cirugía del oído medio infectado opción adecuada para casos en los que se requiere el uso de implantes parciales (Porp) y totales (Torp.). MASTOIDECTOMÍA 1. Eliminar la enfermedad, que da lugar a la formación de un oído seco y autolimpiable. 2. Alteración de la anatomía de la mastoides y el oído medio que prevenga el desarrollo de recurrencias. 3. Reconstrucción de la membrana timpánica y la cadena osicular. CONSIDERACIONES SOBRE LA CIRUGÍA DE MASTOIDES a) Debe evitarse el empleo de antisépticos tipo Isodine®, sin diluir, ya que son sustancias ototóxicas que pueden comprometer los resultados funcionales de la intervención. El autor recomienda el Benzal®, con secado previo del conducto con alcohol. Cuando se utilice Isodine®, se recomienda diluirlo con solución isotónica. b) Si se deja mucosa durante una mastoidectomía tiende a formar quistes y trayectos fistulosos abiertos a la cavidad, con el desarrollo subsecuente de tejido de granulación que causa otorrea continua. De manera semejante, al remover un colesteatoma del oído, en el que se han encontrado pruebas histológicas, la rotura de la pared de un quiste colesteatomatoso puede llevar al aislamiento de células epiteliales viables entre el tejido de granulación, el cual origina la formación subsecuente de perlas epiteliales si no se remueve. La experiencia clínica indica que deben exenterarse con cuidado las celdillas de la región del tegmen y el ángulo sinodural, así como las de las regiones cigomática, es- camosa, retrosinusal y de las puntas mastoideas, lo que reduce la frecuencia de enfermedad residual. c) Riesgo térmico durante la mastoidectomía. Las fresas que remueven pedazos pequeños de hueso producen más calor que las que eliminan pedazos grandes. Asimismo, la irrigación continua disminuye la posibilidad de lesionar el facial por calentamiento. La pérdida de excitabilidad del nervio se inicia con temperaturas mayores de 11 a 14 °C. d) Ruido generado por fresado y aspiración en la operación mastoidea. Estudios experimentales han demostrado cómo la aspiración sola con irrigación expone al oído ipsolateral a un ruido mayor de 107 dB (el fresado quirúrgico produce 65 a 96 dB). Asimismo, las fresas de acero generan más ruido que las de diamante. La aspiración e irrigación aunadas al fresado son muy dañinas para la audición, dado que producen ruido que puede exceder los 110 dB. Las pausas del fresado en el transoperatorio y la manipulación delicada de la cadena osicular ayudan a evitar el traumatismo acústico. e) Desde el punto de vista clinicorradiológico, la mastoides se divide en tres grupos, de acuerdo con el tamaño: 1. Mastoides pequeña (esclerosa), con una superficie de 0 a 5 cm2. 2. Mastoides mediana (esclerodiploica), que tiene una superficie de 5 a 10 cm2. 3. Mastoides grande (diploica), con superficie mayor de 10 cm2. Las mastoides pequeñas se relacionan con procesos infecciosos crónicos del oído desde la infancia y además es mayor la frecuencia de colesteatomas. TIPOS DE MASTOIDECTOMÍA En términos prácticos, existen dos grandes grupos: a) Mastoidectomía con conservación de la pared posterior ósea del conducto auditivo externo (técnica cerrada). b) Mastoidectomía sin conservación de la pared posterior ósea–puente (técnica abierta). En ambos grupos pueden efectuarse procedimientos timpanoplásticos simultáneos o en distintos tiempos. En general, aunque la mastoidectomía con conservación del puente es el tipo más funcional, se acompaña con mayor frecuencia de recurrencia de colesteatoma y oídos húmedos (infección) durante el posoperatorio. El autor considera que la infección crónica del oído con colesteatoma y el tejido de granulación en mastoides esclerosas es indicación para mastoidectomías sin conservación de la pared posterior ósea del conducto. De los grupos ya mencionados se desprende la siguiente terminología para definir los tipos de mastoidectomía: ERRNVPHGLFRVRUJ Capítulo 9 El inicio de la cirugía de mastoides en la era cristiana data del siglo XVII cuando Riolanus, en 1649, describió una operación mastoidea para mejorar una obstrucción tubaria y acúfeno en un paciente. Petit, en el siglo XVIII, realizó con éxito una exenteración de las celdillas mastoideas periantrales, como tratamiento de una mastoiditis aguda. Schwartze, en 1873, describió las indicaciones y técnica de la mastoidectomía simple y a finales del siglo XIX von Troltsch agregó algunas modificaciones a la técnica de Schwartze, que derivaron en el inicio de las mastoidectomías radicales. Bondy, en 1910, propuso una modificación consistente en extirpar la pared posterior del conducto y dejar la membrana timpánica y los huesecillos intactos (lo que, con algunas variantes, constituye la base de la mastoidectomía radical modificada). Los objetivos de la cirugía de mastoides son: 219 219 220 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 9 1. Timpanoplastia con mastoidectomía. Es una operación que consiste en la erradicación de la afectación tanto en la mastoides como en la cavidad del oído medio y además reconstruye el mecanismo conductivo de la audición. Tiene tres variedades: a) Técnica de cavidad abierta, que consiste en la creación de una cavidad de mastoides que se exterioriza en forma permanente. b) Técnica obliterativa, en la cual la cavidad de mastoides se oblitera en forma parcial. c) Técnica de conservación de la pared posterior del conducto auditivo externo, en la cual la cavidad de mastoides no se exterioriza al conducto auditivo externo. 2. Mastoidectomía radical. Es una intervención que se efectúa para erradicar la anomalía del oído medio y la mastoides; en esta operación, el ático, el oído medio, la cavidad mastoidea y el conducto auditivo externo se convierten en una cavidad común, sin efectuar procedimientos reconstructivos en el oído medio. La cadena de huesecillos, con excepción del estribo, se remueve. 3. Mastoidectomía radical modificada. Es una intervención practicada para erradicar trastornos de la mastoides en la cual el ático, la mastoides y el conducto auditivo externo se convierten en una cavidad común y se exteriorizan a través del conducto auditivo externo. En esta técnica se trata de conservar la cadena osicular. Cabe señalar que toda cavidad de mastoides puede obliterarse, en particular cavidades amplias con o sin enfermedad recidivante. externo. Dicha incisión se prolonga de manera oblicua en sus porciones inferior y superior, de tal forma que se produce una M (figura 9–9). Otra incisión recomendada adopta la forma de T, con límite superior en la línea temporal superior. 4. Elevación del colgajo aponeurótico y el periostio. Esta maniobra se dificulta un poco en la porción inferior, por la inserción del músculo esternocleidomastoideo. 5. Colocación de los retractores de garra, tipos Wullstein o Beckmann; en general, se recomienda aplicar dos. 6. Inicio del fresado, delimitando un área triangular formada en su porción superior por la línea temporal superior, enfrente por la pared ósea posterior del conducto auditivo externo y la espina de Henle, y atrás por una línea oblicua que junta la punta de la mastoides con el extremo posterior de la línea temporal. El fresado óseo se inicia en el área de las celdillas superficiales antrales situadas debajo de la línea temporal y detrás de la espina de Henle hasta un área de casi 1 cm (figura 9–10). El fresado más profundo expone el área de las celdillas superficiales subantrales y de la punta de la mastoides. En el área posteroinferior del campo, por encima de la punta de las mastoides, se delimita el seno lateral, sin exponerlo. A continuación se abre la cavidad hacia el área de las celdillas antrales profundas y se expone el antro mastoideo. La extensión de la ca- MASTOIDECTOMÍA CON PRESERVACIÓN DE LA PARED POSTERIOR ÓSEA DEL CONDUCTO Mastoidectomía simple Técnica 1. Incisión retroauricular. Se inicia en la línea temporal superior para continuar hacia abajo en la punta de la mastoides, en donde se efectúa una ligera convexidad en forma de S. 2. Liberación de la aurícula y los tejidos blandos. Se deben liberar la piel y el cartílago del pabellón auricular de las capas musculares y la aponeurosis, desde un área que comprenda por delante el conducto auditivo externo, hasta 2 a 3 cm detrás de la incisión. En la actualidad es muy útil usar el bisturí eléctrico por la hemostasia concomitante que produce. 3. Incisión del periostio. Se recomienda hacerla tras introducir antes el dedo índice de la mano contralateral en el conducto auditivo externo, con el objeto de evitar desgarros en la piel posterior al conducto. La incisión del periostio se inicia alrededor de la porción ósea del conducto auditivo Figura 9–9. Mastoidectomía simple: incisión sobre el periostio de la mastoides, con el objeto de elaborar un colgajo musculoperióstico en forma de M. ERRNVPHGLFRVRUJ Cirugía del oído medio infectado 221 221 b) Otitis medias secretorias complicadas con mastoiditis. Antrotomía en lactantes Timpanoplastia con mastoidectomía Figura 9–10. Mastoidectomía simple: incisión sobre el periostio de la mastoides, con el objeto de elaborar un colgajo musculoperióstico en forma de M. 7. 8. 9. 10. 11. vidad hacia arriba y delante, a través del piso de la porción escamosa del hueso temporal, facilita la abertura amplia del aditus ad antrum, viendo la pared ósea del conducto semicircular lateral. Por último, se exponen las celdillas subantrales profundas que se encuentran entre la superficie convexa del hueso cortical que cubre el seno lateral y el área del conducto del facial por delante, con especial cuidado de remover las celdillas del ángulo sinodural. Empleo del microscopio quirúrgico. El autor recomienda usarlo una vez que se ha expuesto el antro mastoideo; el aumento 10x es el más útil. Las maniobras especiales pueden requerir mayor aumento. Una vez expuesta la cavidad de la mastoides, se pule cualquier espícula ósea o superficie irregular que haya quedado. Se aplica Gelfoam® en la cavidad. Cierre de la herida quirúrgica. El autor deja drenaje de Penrose en procesos infecciosos agudos del oído, acompañado de abundante material necrótico y purulento; no es necesario en otros casos, siempre que se haga una hemostasia adecuada. La capa muscular y de la aponeurosis se sutura con catgut crómico 3–0 y la piel con nailon o seda 4–0. Colocación de gasas en la herida y torunda de algodón en la concha del pabellón auricular y al final vendaje compresivo de la mastoides. Indicaciones de la mastoidectomía simple a) Tratamiento de otomastoiditis agudas, en las que a menudo se deja una cánula de ventilación. Se conserva la pared posterior del conducto auditivo externo en técnica “cerrada”. 1. El acceso se consigue a través de la vía retroauricular. 2. El fresado de las celdillas mastoideas es similar al de la mastoidectomía simple, salvo en algunas modificaciones que consisten en mayor exposición del piso de la porción escamosa del hueso temporal hasta exponer el ático (aticotomía), el aditus ad antrum y la pared ósea del conducto semicircular posterior. Esta maniobra se facilita al adelgazar la pared posterosuperior del conducto y el hueso cortical, el cual se encuentra inmediatamente por debajo de la duramadre de la fosa media, sobre el tegmen timpánico y mastoideo. Una vez terminada la aticotomía aparecen la apófisis corta del yunque y la cabeza del martillo. 3. Timpanotomía posterior. Ofrece un amplio acceso a los elementos del oído medio. Las estructuras anatómicas de referencia que el cirujano debe tener presente durante este procedimiento son las siguientes: a) La apófisis corta y el cuerpo del yunque. b) La fosa incudis. c) El borde interno del conducto auditivo externo. d) El conducto semicircular lateral, situado medial y detrás del campo quirúrgico. e) El conducto de Falopio. En seguida, con una fresa de diamante se agranda la fosa incudis, para después exponer y abrir el receso facial, exponiendo el estribo y la segunda porción del nervio facial. La timpanotomía se continúa abajo, con cuidado de no lesionar el nervio facial, la porción profunda de la pared posterior del conducto auditivo externo y el surco timpánico (figura 9–11). 4. Si el yunque se encuentra desarticulado de la cadena osicular, se remueve y conserva para una in- ERRNVPHGLFRVRUJ Capítulo 9 Debido a la falta de desarrollo de la mastoides en lactantes, el antro representa el sistema de celdillas mastoideas y por tanto en estos casos la mastoidectomía se limita a abrir esta cavidad. Este procedimiento se indica en el tratamiento de otitis medias agudas complicadas. Durante el fresado óseo, debe tenerse presente que el antro se encuentra más superficial que en el adulto y lo mismo ocurre con la tercera porción (vertical) del nervio facial. Una vez expuesto el antro, se recomienda continuar el fresado a su alrededor con fresas de diamante, con lo cual es posible exponer también el aditus ad antrum y el ático, preservando la pared posterior del conducto auditivo externo. EH 222 Oído, nariz, garganta y cirugía de cabeza y cuello 8. En los casos en los cuales se ha eliminado extensamente la mucosa del oído medio por su afectación, la colocación de una hoja delgada de silástico (1 mm de grosor) ayuda a evitar la formación de adherencias (atelectasias) subsecuentes. 9. Cierre del campo operatorio. Primero se aplica la piel de las paredes posterior y anterior del conducto auditivo externo, con el cuidado de que yazga sobre el injerto de fascia temporal aplicado. A continuación se coloca Gelfoam® en el conducto con un material autoexpandible o una mecha de gasa impregnada con antibiótico. En la cavidad de la mastoides también se aplica Gelfoam® humedecido en una solución previamente preparada con antibiótico y corticosteroide (hidrocortisona o dexametasona). El colgajo muscular y aponeurótico se sutura con catgut 3–0 y la piel con puntos separados de nailon o seda 4–0. No se deja drenaje y se aplica una torunda de algodón en la concha del pabellón auricular, seguido de vendaje compresivo de la mastoides. Capítulo 9 MT A M Y E CSL TP NF CM Figura 9–11. Timpanotomía posterior durante la mastoidectomía. Nótense las estructuras anatómicas de referencia: la apófisis corta y el cuerpo del yunque, la pared posterior interna del conducto auditivo externo, el conducto semicircular lateral y el conducto de Falopio. MT, membrana timpánica; A, ático; M, martillo; Y, yunque; E, estribo; CSL, conducto semicircular lateral; TP, timpanotomía posterior; NF, nervio facial; CM, cavidad de la mastoidectomía. terposición posterior; por otro lado, si el martillo se muestra osteítico o cubriendo en forma parcial un colesteatoma, se considera su extracción. 5. Limpieza del oído medio. Se recomienda efectuarla de arriba abajo (del ático al hipotímpano) y de atrás hacia delante (de la apófisis piramidal y el estribo a la trompa de Eustaquio). Si la mucosa no se halla hiperplásica, con tejido de granulación o colesteatoma, es buena medida no retirarla, ya que esto reduce la frecuencia de fibrosis y atelectasias secundarias que pueden comprometer la función de la cadena osicular. Durante la limpieza del oído medio debe insistirse en eliminar la afectación por debajo del borde anterior del conducto del facial, en lo profundo del seno timpánico. 6. Procedimiento timpanoplástico. Depende del grado de destrucción de la cadena osicular, por lo que se lleva a cabo la reconstrucción o timpanoplastias tipos I, II o III. 7. Antes de colocar el injerto para la formación de la nueva membrana timpánica, se recomienda reconstruir la pared posterosuperior del conducto auditivo, que se eliminó en forma parcial durante la timpanotomía posterior. Esta reconstrucción se realiza con cartílago septal preservado en Merthiolate® o cartílago auricular autólogo, mediante la incisión retroauricular; lo anterior también es útil en oídos con extensa destrucción de la cadena osicular, en los que la pared medial del ático suele estar atrófica. Indicaciones de la timpanoplastia con mastoidectomía Técnica cerrada: está indicada en todos los tipos de otitis media y otomastoiditis crónicas. Aunque la existencia de colesteatoma no la contraindica, el cirujano debe recordar que el riesgo de recurrencias es mayor con esta técnica respecto de la abierta, pese a que también existen autores que favorecen el empleo de esta última en algunos casos. El reforzamiento de la membrana timpánica en la técnica cerrada mediante el empleo de injertos de cartílago tragal o de la concha auricular puede reducir en forma significativa la incidencia de colesteatoma recurrente, sobre todo cuando se ha removido el martillo, puesto que confiere una mejor estabilidad y tolerancia al incremento en las presiones negativas de oído medio. En la experiencia del autor, si el colesteatoma se localiza entre el nervio facial y la crura posterior del estribo o medial al tendón del músculo estapedial, no puede removerse con seguridad a través de una timpanotomía posterior. MASTOIDECTOMÍA SIN CONSERVACIÓN DE LA PARED POSTERIOR ÓSEA DEL CONDUCTO AUDITIVO EXTERNO (TÉCNICA ABIERTA) Mastoidectomía radical Técnica 1. Acceso por vía retroauricular. 2. Mastoidectomía simple. 3. Aticotomía extensa con exposición adecuada de la apófisis corta del yunque y la cabeza del martillo y el aditus ad antrum. El autor prefiere la técnica de abertura de las cavidades del antro y el ático de atrás hacia delante, aunque el fresado también se puede practicar de adelante hacia atrás. ERRNVPHGLFRVRUJ Cirugía del oído medio infectado 9. La meatoplastia se considera un tiempo quirúrgico importante en todas las operaciones de mastoides con técnica abierta, dado que favorece la ventilación y la limpieza de la cavidad. Aunque existen diversas técnicas quirúrgicas, todas siguen el mismo criterio, es decir, retirar una porción del cartílago de la concha auricular y disminuir con ello la tendencia a las estenosis posoperatorias del conducto. El autor prefiere la técnica de Fisch, por su fácil ejecución y buenos resultados clínicos: consiste en una incisión posterior a través de la piel y el cartílago de la concha y su longitud depende del tamaño de la cavidad de la mastoidectomía; después se separa la piel del cartílago, resecando a su alrededor una porción de éste y los colgajos de la piel que se obtienen se giran hacia atrás, fijados a los bordes de la herida retroauricular con catgut 3–0 (figura 9–13). 10. Cierre del campo operatorio. Se coloca Gelfoam® en el conducto y una mecha de gasa impregnada en antibiótico o un material autoexpandible. El resto de la herida se sutura en la forma descrita en otros tipos de mastoidectomía. Indicaciones de la mastoidectomía radical a) Otomastoiditis crónica con colesteatoma, que se acompaña de sordera intensa de tipo mixto y con mayor predominio sensorineural. b) Pacientes con complicaciones, sobre todo intracraneales, secundarias a otomastoiditis aguda o crónica. PA VO VR I CS CF SL I Figura 9–12. Mastoidectomía radical: se ha rebajado el muro del facial, lo que facilita el aseo adecuado de la cavidad en el futuro. En este caso, se ha dejado la cavidad del oído medio sin cadena osicular; sólo la ventana oval se encuentra sellada por la platina del estribo. VO, ventana oval; VR, ventana redonda; CS, conductos semicirculares; CF, conducto de Falopio; SL, seno lateral. CM Figura 9–13. Técnica de la meatoplastia posterior a una mastoidectomía, sin conservación de la pared posterior del conducto auditivo externo. Se realiza una incisión vertical extirpando una porción de cartílago auricular en sus bordes. PA, pabellón auricular; I, incisión; CM, cavidad de la mastoides. ERRNVPHGLFRVRUJ Capítulo 9 4. En el fresado sobre la pared posterior del conducto se emplea como guía la apófisis corta del yunque, lo cual permite al cirujano rebajar el muro del facial de manera segura hasta llegar al conducto de Falopio, pero sin exponer el nervio; debe intentarse dejar una cavidad más o menos plana que permita su limpieza adecuada y la menor acumulación posible de desechos epiteliales que puedan comprometer una epitelización adecuada de la cavidad. Se recomienda exponer el conducto de Falopio con fresa de diamante (figura 9–12). 5. Fresado de la pared anterior del conducto auditivo externo, en el plano del surco timpánico, para agrandar el meato óseo. 6. Limpieza del oído medio, con extracción de la afectación (saco de colesteatoma, tejido de granulación, etc.). No debe olvidarse que a menudo se encuentran dehiscencias del conducto de Falopio, en las que el nervio facial puede estar envuelto en el tejido del colesteatoma; en otras ocasiones éste sella fístulas perilinfáticas y en tal caso se recomienda dejarlas así, procurando no remover el tejido que se encuentre sobre ellas. 7. Eliminación de la cadena osicular, excepto el estribo. 8. Una vez limpia la cavidad, se aplican trozos de Gelfoam® humedecidos en solución antibiótica y se deja que epitelice por sí sola. 223 223 224 Oído, nariz, garganta y cirugía de cabeza y cuello c) Extirpación de algunas tumoraciones, benignas o malignas, del oído medio y la base de cráneo. Mastoidectomía radical modificada Capítulo 9 Técnica 1. Acceso por vía retroauricular. 2. Mastoidectomía simple. 3. Aticotomía extensa. 4. Fresado de la pared posterior del conducto, tratando de rebajar el muro del facial todo lo posible. 5. Fresado de la pared anterior del conducto auditivo externo. 6. Limpieza del oído medio. En esta fase resulta a menudo necesario remover al remanente timpánico y, en caso de existir un colesteatoma en el ático o el antro, se extrae, con el cuidado de no luxar la cadena osicular si se encuentra íntegra. Cuando está erosionada la apófisis larga del yunque, se recomienda retirarla para efectuar una interposición de ella en un segundo tiempo quirúrgico. El objetivo de esta técnica es tratar de conservar la cadena osicular mediante la colocación de una membrana timpánica adicional, para lo cual se utiliza fascia temporal. 7. Una vez eliminado el problema, tanto del oído medio como de la mastoides, se coloca Gelfoam® seguido o no de la aplicación de silástico en el oído medio, sobre el que puede acomodarse la fascia temporal autóloga u homóloga. 8. Obliteración de la cavidad de la mastoidectomía mediante un colgajo de músculo y la aponeurosis de base anterior, tipo Palva. Aunque originalmente descrita con el objeto de evitar la posibilidad de abscesos mastoideos posteriores a la infección de vías respiratorias superiores en pacientes mastoidectomizados, la experiencia clínica ha demostrado su utilidad para reducir de tamaño las cavidades amplias de mastoidectomías en las que también se aplica polvo de hueso y pequeños fragmentos óseos obtenidos de la punta de la mastoides. Las cavidades pequeñas mejoran la transmisión de frecuencias medias y agudas, sobre todo entre 1 500 y 4 000 Hz, en tanto que las grandes lo hacen con frecuencias graves. Sin embargo, este efecto al parecer no es de largo plazo, debido a la resorción con atrofia parcial de estos colgajos. Por otro lado, es baja la frecuencia de colesteatoma posterior a la obliteración (Sheehy, 5.4%; Turner, 6%; Palva, 3%), lo cual no la contraindica en oídos cuando se ha extraído un colesteatoma. La ejecución de este procedimiento depende de la experiencia del cirujano y las condiciones del oído operado. 9. Meatoplastia. 10. Cierre del campo operatorio. Indicaciones de la mastoidectomía radical modificada a) Otomastoiditis crónicas con colesteatoma o abundante tejido de granulación. b) Pacientes con cavidades mastoideas poco neumatizadas que impidan una observación y extracción adecuadas de la afectación, al conservar la pared posterior del conducto auditivo externo. c) Algunas complicaciones no intracraneales de otomastoiditis agudas y crónicas. RECONSTRUCCIÓN DE LA PARED POSTERIOR DEL CONDUCTO AUDITIVO EXTERNO SECUNDARIA A MASTOIDECTOMÍAS CON TÉCNICA “ABIERTA” La experiencia clínica ha mostrado resultados funcionales a largo plazo poco alentadores, ya sea que se utilice hueso autólogo u homoinjerto osicular o fascia temporal. Gersdorf ha publicado resultados favorables con el empleo de polvo de hueso (paté) y adhesivos tisulares biológicos (a base de fibrinógeno y trombina) en la reconstrucción de defectos del ático, el llenado de los espacios resultantes de una timpanotomía y las reconstrucciones del tegmen timpani. Otro método descrito consiste en tomar cartílago de la concha auricular, que se sostiene a través de la obliteración de la cavidad de la mastoidectomía con polvo de hueso y un colgajo muscular y de aponeurosis. También se ha empleado la hidroxiapatita, que es un material de cerámica bioactiva, que es similar a la matriz mineral del hueso natural. Ésta se manufactura en forma densa y porosa. La primera es ideal para la reconstrucción de la cadena osicular y la porosa para reconstruir la pared posterior del conducto auditivo externo. Las mallas de titanio con polvo de hueso también pueden utilizarse para la reconstrucción de la pared posterior. MANEJO POSOPERATORIO DEL PACIENTE a) Se recomienda emplear antibióticos de amplio espectro durante la primera semana de la operación. b) El paciente puede darse de alta a las 24 h tras efectuar una timpanoplastia y de 48 a 72 h después en una mastoidectomía. c) El movimiento de la cadena osicular en el transoperatorio puede desencadenar náusea y vómito, acompañados de un estado vertiginoso (laberintitis serosa). Su atención con sedantes laberínticos es suficiente. Por otro lado, el suministro de dexametazona reduce en forma significativa la náusea y el vómito posoperatorios en la cirugía timpanomastoidea; se cree que su acción antiemética la ejerce a través del núcleo del tracto solitario y el núcleo del rafe en el área postrema a través de una potente acción antiinflamatoria. d) Entre el sexto y octavo días del posoperatorio se elimina el vendaje compresivo de la mastoides, se retiran los puntos alternados de la piel y se coloca sólo una gasa en la herida, así como algodón en la concha del pabellón auricular. ERRNVPHGLFRVRUJ Cirugía del oído medio infectado COMPLICACIONES DE LA CIRUGÍA DE LA MASTOIDES a) Pericondritis. Se observa más en relación con las incisiones por vías endoaural, en las que el cartílago auricular se traumatiza con mayor facilidad, sobre todo si se realizan mastoidectomías por esta vía. La meatoplastia, durante la operación de mastoides con la técnica abierta, puede acompañarse de la formación de pericondritis, en especial si los cortes en el cartílago fueron muy irregulares y no se controló en el preoperatorio la infección de oído. El tratamiento consiste en esteroides y antibióticos contra Pseudomonas y compresión local; si persiste se efectúan varias incisiones en la piel anterior y posterior del pabellón auricular, a fin de introducir catéteres para irrigación local con antibiótico. b) Lesión del nervio facial. Se presenta en 1 a 3% de los casos y con mayor frecuencia se lesiona la segunda porción del facial, por dehiscencia congénita del nervio en el conducto de Falopio o afección del oído medio (colesteatoma). A menudo se vincula con una técnica quirúrgica defectuosa, en particular de cirujanos otólogos con poca experiencia. c) Exposición de la duramadre en el tegmen mastoideo o el timpánico y el seno lateral. Es un acontecimiento menor que no produce alteraciones, a menos que se hayan lacerado la duramadre o el seno lateral. d) Laceración de la duramadre. Cuando la fresa escapa al control del cirujano, puede lacerar la duramadre, incluida una porción de la masa encefálica. En este caso se retira el tejido cerebral afectado, cubriendo el defecto de la dura con músculo y fascia temporales. En el posoperatorio se agrega el tratamiento del edema cerebral y, de manera profiláctica, fármacos como la carbamazepina para evitar crisis epileptiformes. e) Hemorragia. Puede provenir de la vena emisaria mastoidea que entra en el tercio superior del seno sigmoideo sobre su cara posterolateral; a menudo se controla mediante cauterización con el bipolar y esto mismo se aplica para desgarros pequeños del seno sigmoideo. Si son grandes, se recomienda emplear Surgicel®, que se coloca debajo de la isla de hueso que se deja con frecuencia sobre el seno sigmoideo. También puede obliterarse de manera intraluminal la porción distal del seno con taponamiento a base de Surgicel® y, si no es eficaz, se liga con seda 4–0 y un punto de Connell. Cuando la hemorragia no se controla con cauterio o taponamiento, se considera el ligado en forma profiláctica de la vena yugular interna para evitar la embolización del material utilizado con anterioridad (Surgicel®). Aunque la hemorragia venosa puede ser masiva y muy angustiante para el cirujano, las más de las veces es de baja presión y susceptible de controlarse, al menos de forma temporal, mediante compresión extraluminal. f) Lesión laberíntica. Por lo regular se presenta en la pared externa del conducto semicircular lateral, que quizá se erosionó por colesteatoma o tejido de granulación y es obvia cuando se levanta dicho tejido. En otras ocasiones, durante la exposición de las celdillas subantrales profundas, se lesiona de manera inadvertida el conducto semicircular posterior; se recomienda que el cirujano cierre las fístulas laberínticas con fascia y músculo temporales. En el posoperatorio, el paciente desarrolla nistagmo tipo irritativo hacia el lado de la lesión, que luego pasa al lado contralateral a la lesión. Además de los síntomas agudos vestibulares, puede desarrollarse sordera profunda, que por fortuna no se presenta en todos los casos. g) Hipoacusia sensorineural. Se limita sobre todo a frecuencias agudas; puede presentarse hasta en 4.5% de los casos, casi siempre en relación con las mastoidectomías sin preservación de la pared posterior del conducto auditivo externo. Se han señalado anacusias en 0.5% de los casos. h) Necrosis del injerto para reconstrucción de la membrana timpánica. Se recomienda emplear gotas óticas con antibiótico y esteroides. Esta complicación termina por producir pérdida o perforación del injerto. i) Mastoiditis aguda. Sadé señaló que puede ser una complicación a largo plazo de las mastoidectomías en niños con conservación de la pared posterior. j) En las mastoidectomías con conservación del puente, algunos individuos experimentan retracciones de la membrana timpánica con la formación subsecuente de colesteatoma, que hace necesaria una revisión en una segunda intervención. k) Estenosis meatal. Es muy común como complicación de las mastoidectomías con técnica abierta. Sin embargo, en la colocación de materiales autoexpandibles con aplicación local de este proceso, la mejor prevención es una técnica de meatoplastia cuidadosa. l) Desarrollo de quistes epidermoides de inclusión. Aunque son raros y por lo general relacionados más con traumatismos, su implantación durante la operación de mastoides puede deberse a desplazamiento inferior de un fragmento de epidermis que se enquista con posterioridad. m) La herniación secundaria de las meninges (meningocele), con o sin masa encefálica, se presenta en el tegmen mastoideo y timpánico, en ocasiones ERRNVPHGLFRVRUJ Capítulo 9 e) Unos 10 a 15 días después se inicia el retiro del Gelfoam® del tercio externo del conducto, aspirando el resto en las semanas siguientes. Durante este lapso se agregan al tratamiento gotas óticas con antiinflamatorio y antibiótico por 10 días. f) El tejido de granulación que se presente en el conducto se cauteriza con nitrato de plata al 5 o 10%, o bien con polvo de sulfato de cinc. 225 225 226 Oído, nariz, garganta y cirugía de cabeza y cuello después de una mastoidectomía. Estos defectos pueden repararse por vía transmastoidea (en defectos pequeños) o a través de la fosa media (en defectos mayores) y consiste en interponer cartí- Capítulo 9 lago (septal, auricular o condrocostal) entre la duramadre y el defecto óseo existente. El empleo de hueso cortical de mastoides también ofrece buenos resultados. BIBLIOGRAFÍA Adkins W, White B: Type I tympanoplasty: influencing factors. Laryngoscope 1984;94:916–918. Applebaum E: An hydroxylapatite prosthesis for defects of the incus long process. Laryngosc 1993;103:330–332. Austin D: Reconstructive techniques for tympanosclerosis. Ann Otol Rhin Laryng 1988;97:670–674. Becvarouski Z, Kartosh J: Smoking and tympanoplasty implications for prognosis and the middle ear risk index. Laryngoscope 2001;111:1806–1811. Brackmann D: Mastoid cavity management. Op Tech Head Neck Surg 1992;3:8–14. Brackmann DE: Porous polyethylene prosthesis. Ann Otol Rhinol Laryngol 1986;95:76–77. Brask T: Reconstruction of the ossicular chain in the middle ear with glass ionomer cement. Laryngosc 1999;109:573–576. Chole R: Ménière: ossicular replacement with self–stabilizing presculptured homologous cartilage. Arch Otolaryngol 1982;108:560–562. Chole R: Use of presculpted, banked cartilage transplants in ossicular reconstruction. Arch Otolaryngol 1987;113:145–148. Chüden HG: Management of the totally disabled ear. Laryngoscope 1986;96:446–447. Cole J, Reams O: Tympanomastoidectomy. Ann Otol Rhinol Laryngol 1983;92:577–581. Dodson E, Hashisaki G, Holsgood T, Lambert P: Impact canal wall mastoidectomy with tympanoplasty for cholesteatoma in children. Laryngosc 1998;108:977–983. Erdreich J, Keim RJ, Love TJ: Thermal hazard during mastoid surgery. Ann Otol Rhinol Laryngol 1979;88:387–391. Feenstra L, Blom R: The mastoid approach for brain herniation into the middle ear. Clin Otolaryngol 1983;8:187–190. Feghali J, Boris D, Beety C et al.: Bone cement reconstruction of the ossicular chain. Laryngosc 1998;108:829–836. Fisch U: Timpanoplastia, mastoidectomía y cirugía del estribo. New York: Thieme Med Publ Inc., 1994. Friedman C, Wiet R: Meatoplasty in chronic ear disease when using an open technique. Laryngoscope 1987;97:110–111. Gersdorff M, Robillard T: Bone reconstruction in otomicrosurgery: a mixture of bone dust and fibrinogen adhesive. Laryngoscope 1985;95:1278–1280. Goldberg R: Reconstruction of the middle ear using hydroxylapatite hybrid prostheses. Otol Head Neck Surg 1992;3:225–231. Haddad N: Tip in ossiculoplasty. Laryngoscope 1983;93:1226– 1227. Hench LL, Splinter RJ, Greenlee TK, Allen WC: Bonding mechanisms at the interface of ceramic prosthetic materials. J Biomed Mater Res 1971;2:117–141. Hernández G, Escajadillo JR: Pericondritis aural. An Soc Mex Otorrinolar 1981;26:24–27. Heumann H, Steinbach E: The effects of an adhesive in the middle ear. Arch Otolaryngol 1980;106:734–736. Indorewala SH, Pagare R, Aboojimola S: Dimensional stability of the free fascia grafts: human study. Laryngoscope 2004;114:543–547. Indorewala SH: Dimensional stability of the free fascia grafts: an animal experiment. Laryngoscope 2002;112:727–730. Jackler R, Schindler R: Role of the mastoid in tympanic membrane reconstruction. Laryngoscope 1984;94:495–500. Jackson C, Glasscock ME, Nissen A et al.: Open mastoid procedures: contemporary indications and surgical technique. Laryngoscope 1985;95:1037–1043. Jackson G, Glasscock ME, Schwaber M et al.: Open mastoid procedures: contemporary indications and surgical technique. Laryngoscope 1985;95:1037–1043. Jones R, Fry T: A new complication of prosthetic ossicular reconstruction. Arch Otolaryngol 1984;110:757–758. Kaneko Y, Yuasa R, Ise I et al.: Bone destruction due to rupture of a cholesteatoma sac. Laryngoscope 1980;90:1865–1871. Kinney S: Five years’ experience using the intact cord wall tympanoplasty with mastoidectomy for cholesteatoma. Laryngoscope 1982;92:1395–1400. Kylén P, Arlinger S, Jerlvall L, Harder H: Ossicular manipulation in chronic ear surgery. Arch Otolaryngol 1980;106:598–601. Lesinski SG: Reconstruction of hearing when malleus is absent: TORP vs. homograft TMMI. Laryngoscope 1984;94:1443–1446. Liu Y, LI M, Wang P, TaiIto J: Use of dexamethasone on the prophylaxis of nausea and vomiting after tympanomastoid surgery. Laryngoscope 2001;111:1271–1274. Luetje C: Utility of autograft tragal cartilage in tympanoplasty and ossicular reconstruction. Op Tech Head Neck Surg 1995;6:54–59. Martín A, Harner S: Ossicular reconstruction with titanium prosthesis. Laryngoscope 2004;114:61–64. Martin CH, Timoshenko A, Martin C, Bertholon P: Malleus removal and total cartilage reinforcement in intact canal wall tympanoplasty for cholesteatoma. Ann Otol Rhinol Laringol 2004;113:421–425. Mattew N, Linthicum F: Long term effects of silastic sheeting in the middle ear. Laryngosc 1992;102:1097–1102. McDonald T, Facer G, Clark J: Surgical treatment of stenosis of the external auditory canal. Laryngoscope 1986;96:830–833. McElveen J, Goode R, Miller C, Falk ST: Effect of mastoid cavity modification on middle ear sound transmission. Ann Otol Rhinol Laryngol 1982;91:526–532. Merwin GE: Bioglass middle ear prosthesis: preliminary report. Ann Otol Rhinol Laryngol 1986;95:78–81. Mikaelian D: Perichondrial–cartilage islands graft in on stage tympano– ossiculoplasty. Laryngoscope 1986;96:237–239. Moloy P, Brackmann DE: Control of venous bleeding in otologic surgery. Laryngoscope 1986;96:580–582. Moore G: Revision tympanoplasty utilizing fossa traingularis cartilage. Laryngoscope 2002;112:1543–1554. ERRNVPHGLFRVRUJ Cirugía del oído medio infectado Sheehy J: Cholesteatoma surgery: canal wall down procedure. Ann Otol Rhin Laryng 1988;97:30–35. Sheehy JL, Anderson RG: Myringoplasty. A review of 472 cases. Ann Otol Rhinol Laryngol 1980;89:331–334. Siedentop K, Harris D, Ham K, Sánchez B: Autologous fibrin tissue adhesive from patients’ own blood. Laryngoscope 1986;86:1062–1064. Silverstein H, McDaniel A, Lichtenstein R: A comparison of PORP, TORP and incus homograft for ossicular reconstruction in chronic ear surgery. Laryngoscope 1986;96:159–165. Silverstein H, Wanamaker H, Flanzer J: Composite torp and porps for ossicular reconstruction. Laryngosc 1993;103:94–95. Slater P, Rizer F, Schuring A, Tippy W: Practical use of total and partial ossicular replacement prostheses in ossiculoplasty. Laryngosc 1997;107:1193–1198. Smyth G: Cholesteatoma surgery: the influence of the canal wall. Laryngoscope 1985;95:92–96. Staindl O: Tissue adhesion with highly concentrated human fibrinogen in otolaryngology. Ann Otol Rhinol Laryngol 1979;88:413–418. Tos M: Modification of combined approach tympanoplasty in attic cholesteatoma. Arch Otolaryngol 1982;108:772–778. Tos M, Lau T, Plate S: Sensorineural hearing loss following chronic ear surgery. Ann Otol Rhinol Laryngol 1983;93:403–409. Tos M, Orzntoft S, Stangerup S: Results of tympanoplasty in children after 15 to 27 years. Ann Otol Rhin Laryng 2000;109:17–23. Tovi F, Bartal N, Zarkin C: Epidermal cysts of temporal fossa: an unusual complication of ear surgery. Ann Otol Rhinol Laryngol 1985;94:162–164. Troms O, Mair IW, Laufli E: Air conduction thresholds after myringoplasty and stapes surgery: a conventional and high frequency audimetric comparison. Ann Otol Rhinol Laryngol 1986;95:327–330. Vartiainen E, Karjalainen S: Surgery in elderly patients with chronic otitis media. Arch Otolaryngol 1985;111:509–510. Wehrs R: The homograft tympanic membrane after 12 years. Ann Otol Rhinol Laryngol 1982;91:533–537. Wiet R, Harvey S, Pyle M: Canal wall reconstruction: a newer implantation technique. Laryngosc 1993;103:594–599. Wormold P, Nilssen E: The facial ridge and the discharging mastoid cavity. Laryngosc 1998;108:92–96. Yamamoto E: Aluminum oxide ceramic ossicular replacement prosthesis. Ann Otol Rhinol Laryngol 1985;94:149–152. Zini C, Quaranta N, Piazza F: Posterior canal wall reconstruction with titanium–micromesh and bone pate. Laryngoscope 2002;112:753–756. ERRNVPHGLFRVRUJ Capítulo 9 Moore G, Moore I, Yonkers A, Nissen A: Use of full thickness skin grafts in canalplasty. Laryngoscope 1984;94:1117– 1118. Moretz WH Jr: Malleus strut, peg–top, and hydroxylapatite cap prostheses. Op Tech Otol Head Neck Surg 1992;3:266–273. Morizono T, Sikora M: The ototoxicity of topically applied povidore–iodine preparations. Arch Otolaryngol 1982;108:210– 213. Nadol J: Causes of failure of mastoidectomy for chronic otitis media. Laryngoscope 1985;95:410–413. Neely G, Kuhn J: Diagnosis and treatment of iatrogenic cerebrospinal fluid leak and brain herniation during or following mastoidectomy. Laryngoscope 1985;95:1299–1300. Ojala K, Palva T: Late results of obliterative cholesteatoma surgery. Arch Otolaryngol 1982;108:1–3. Ojala K, Sorri M, Sibila P: Late changes in ear canal volumes after mastoid obliteration. Arch Otolaryngol 1982;108:208–209. Palva T, Mäkinen J: The meatally based musculoperiosteal flap in cavity obliteration. Arch Otolaryngol 1979;105:377–380. Palva T, Virtanen H: Ear surgery and mastoid air cell system. Arch Otolaryngol 1981;107:71–73. Paparella MM, Kurkjian JM: Surgical treatment for chronic stenosign external otitis. Laryngoscope 1966;76:232–234. Parkin JL, Wood GS, Wood RD, McCandles GA: Drill and suction–generated noise in mastoid surgery. Arch Otolaryngol 1980;106:92–96. Pennington C: Incus interposition. Ann Otol Rhinol Laryngol 1983;92:568–570. Rambo JHT: Mastoid surgery: effect of retained mucosa on healing. Ann Otol Rhinol Laryngol 1979;88:701–707. Ramirez–Camacho RA: Tympanoplasty. Arch Otolaryngol 1981;107:608–609. Reck R: Bioactive glass ceramic: a new material in tympanoplasty. Laryngoscope 1983;93:196–199. Reck R: Bioactive glass–ceramics in ear surgery: animal studies and clinical results. Laryngoscope 1984;94(Suppl 33). Rediano H, Englender M: Myringoplasty with fascial stakes. Ann Otol Rhinol Laryngol 1981;90:172–173. Rizer F: Tympanoplasty: a historical review and a comparison of techniques. Laryngosc 1997;107:1–36. Sade J, Halevy A, Berco E: Acute mastoiditis after a combined approach tympanoplasty operation. Arch Otolaryngol 1980;106:727–728. Schuknecht H, Chandler JR: Surgical obliteration of the tympanomastoid compartment and external auditory canal. Ann Otol Rhinol Laryngol 1984;93:641–645. Schuknecht H, Shi SR: Surgical pathology of middle ear implants. Laryngoscope 1985;95:249–258. 227 227 228 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 9 ERRNVPHGLFRVRUJ EMBRIOLOGÍA DE LA NARIZ Y SENOS PARANASALES La nariz es uno de los primeros órganos que se desarrollan en el embrión humano. Durante la tercera semana de la gestación surgen del prosencéfalo (forebrain) dos engrosamientos epiteliales llamados placodas olfatorias, separadas por la masa de tejido del proceso frontal. Durante la cuarta semana, la periferia de las placodas olfatorias toma forma de herradura y su centro se hunde para formar los mamelones olfatorios, cuyo crecimiento progresivo dorsocaudal hace que se aproximen en la línea media sobre el techo de la cavidad bucal, hasta que un epitelio muy delgado los mantenga separados. Los mamelones olfatorios dividen la porción caudal terminal del proceso frontonasal en una parte medial y otra lateral. El proceso medial nasal crece más rápido que el lateral y se unen en la línea media para formar la columella y el proceso premaxilar (figura 10–1). En la tercera semana de la gestación se acercan los procesos maxilar y mandibular del primer arco branquial a la pared lateral del proceso frontonasal, y su crecimiento lleva a la fusión del proceso maxilar con el nasal medial para completar los límites inferiores del vestíbulo y las alas nasales. La unión y constante compresión en la línea de los mamelones olfatorios tiene como resultado la formación del tabique nasal primario. Durante este estadio, la nariz se abre de manera directa en la cavidad bucal y la lengua yace sobre la coana. Entre los 45 y 48 días de la gestación aparecen dos crestas palatinas verticales sobre los procesos maxilares dentro de la cavidad bucal, que crecen en sentidos caudal y medial en ambos lados de la lengua, hasta que la expansión de la mandíbula y el piso de la boca permitan su descenso. Las crestas palatinas giran en sentido medial para fusionarse entre sí y con el paladar primitivo; este fenómeno se completa hacia la novena semana y se inicia en el agujero nasopalatino para continuar en dirección caudal en forma de Y. Durante la sexta y séptima semanas de la gestación, el tabique nasal primario crece de forma cefálica y caudal, y el alargamiento concomitante de la cavidad nasal transforma las coanas primitivas y las sitúa en la porción posterior de ésta. El tabique nasal se fusiona con el paladar alrededor de la décima semana de gestación. A los 35 días de vida embrionaria, la pared lateral nasal es lisa e inicia su diferenciación hacia los 45 días. Los centros de crecimiento mesenquimatoso de los procesos nasal lateral y maxilar forman la hendidura nasoóptica. Las estructuras que derivan del proceso nasal medial son: a) b) c) d) e) f) g) h) Columella. Porción medial del labio superior. Premaxilar. Lámina cuadrangular o cartílago septal. Lámina perpendicular del etmoides. Vómer. Procesos nasales del maxilar. Hueso palatino. El premaxilar sirve como punto de apoyo de la porción caudal del vómer y el cartílago septal; asimismo, actúa como saco óseo que contiene los folículos dentales de los cuatro incisivos superiores. Cuando se inicia el cierre del proceso palatino, queda una pequeña dehiscencia posterior al premaxilar, que dará lugar al agujero palatino anterior, por el cual se encontrarán los vasos y nervios palatinos anteriores. Es en esta área donde se localiza la coana primitiva. Ambas estructuras se mueven hacia atrás alrededor del tercer mes de gestación, según sea su posición final del desarrollo del paladar. Los cartílagos paraseptales aparecen en el embrión desde la quinta semana, como repliegues de la mucosa sobre la pared septal, aunque algunos autores han relacionado esta estructura con el órgano vomeronasal de Jacobson. El vómer es de origen membranoso y se desarrolla a manera de una lámina bilateral sobre la porción posteroinferior del tabique. La resorción de este cartílago puede persistir hasta la edad de seis a Capítulo 10 Embriología, anatomía y anomalías congénitas de nariz y senos paranasales 229 ERRNVPHGLFRVRUJ Oído, nariz, garganta y cirugía de cabeza y cuello 230 A Capítulo 10 m g B c Figura 10–1. Embriología nasal. A. Feto durante la cuarta a quinta semanas de gestación. Se han desarrollado a partir de la placoda olfatoria los procesos medial (m), lateral (l) y globular (g). B. Feto en la quinta a sexta semanas, en el que se destaca el crecimiento del proceso medial, con su unión en la línea media para formar la columella (c). ocho años. El desarrollo activo de los cartílagos paraseptales durante la época embrionaria puede producir crestas en la unión del vómer con la lámina perpendicular del etmoides y el borde cefálico del cartílago septal, que a menudo se encuentran en adultos. Durante la séptima semana de la gestación, cada proceso maxilar avanza desde su posición lateral para fusionarse primero con el proceso nasal lateral y luego con el proceso nasal medial, hasta terminar con el proceso maxilar en el lado contralateral, lo cual da origen a la configuración externa de la nariz y la formación de las narinas. Una falla en este proceso puede propiciar el desarrollo unilateral de la nariz, con la presencia de mamelones nasales adyacentes (figura 10–2). La cápsula de cartílago del órgano del olfato se desarrolla a partir del mesodermo de los procesos nasales medial y lateral fusionados, así como del maxilar. Dicha cápsula se encuentra bien desarrollada hacia el cuarto mes de vida fetal y se localiza en la porción superior del tabique nasal. El proceso lateral nasal forma los cornetes superior, medio e inferior, que proveen a la nariz una mayor superficie mucosa para la entrada y calentamiento del aire. Aparecen hacia la octava semana de gestación y desarrollan un cartílago de soporte en la novena y décima semanas. El primordio del infundíbulo etmoidal se torna visible entre la 11ª y 12ª semanas y, hacia la 15ª y 16ª semanas, los cornetes se encuentran bien desarrollados y la osificación del cornete medio se identifica alrededor de las semanas 20ª a 22ª. Los senos paranasales aparecen como crecimientos hacia fuera de las cavidades de la pared lateral nasal. El seno maxilar surge a manera de primordio de la mucosa nasal hacia el tercer mes de vida embrionaria. El seno frontal se desarrolla a partir de un crecimiento hacia arriba de las celdillas etmoidales anteriores y, en general, no penetra en el hueso frontal sino hasta después del nacimiento, durante los dos primeros años de vida, para comenzar a crecer hacia los nueve y alcanzar su máximo desarrollo a los 20. El grupo de celdillas etmoidales crece a partir de los meatos superior y medio; se encuentra presente desde el nacimiento y alcanza su máximo desarrollo en la adolescencia, tras experimentar un rápido crecimiento entre los tres y ocho años de edad. Aunque los senos esfenoidales se originan desde el nacimiento, su desarrollo y neumatización se aceleran durante el tercer año de vida, con un crecimiento adicional durante la pubertad. En cuanto a los senos maxilares, aparecen desde el nacimiento como pequeñas cavidades localizadas en el maxilar, que se extienden en sentido lateral hasta la altura del nervio infraorbitario hacia el final del primer año de la vida, y continúan su neumatización hasta los nueve o diez años, con un crecimiento subsecuente relacionado con la erupción de la dentadura permanente. Figura 10–2. Anomalía congénita de la nariz (desarrollo unilateral) secundaria a una falla en la fusión entre los procesos nasales lateral y medial, que se efectúa durante la séptima semana de la gestación. ERRNVPHGLFRVRUJ Embriología, anatomía y anomalías congénitas de nariz y senos paranasales Estadio de Carnegie 13 (cuatro semanas de gestación). La placoda nasal consiste en cuatro a cinco capas de células epiteliales, con mitosis de las células epiteliales cercanas a la membrana basilar. Estadio de Carnegie 14 (cuatro a cinco semanas de gestación). Se observa con claridad la placoda nasal en la porción ventrolateral del procencéfalo. Asimismo, se reconoce el proceso maxilar que se origina del arco mandibular. Estadio de Carnegie 15 (cinco semanas de gestación). La placoda nasal se observa más cóncava. Se torna evidente el proceso nasal lateral, que surge a partir de una hipertrofia del mesodermo y se desarrolla más el proceso maxilar. Estadio de Carnegie 16 (cinco a seis semanas de gestación). Se desarrolla la prominencia medial nasal. La prominencia frontonasal yace entre los dos sacos nasales. El saco nasal se separa del estoma por una aleta nasal producto de la fusión del proceso maxilar y el proceso nasal medial. Estadio de Carnegie 17 (seis semanas de gestación). Existe un notable desarrollo de los procesos nasales medial y lateral, así como del proceso globular de His que corresponde a la porción inferior del segmento intermaxilar. Los procesos maxilares se unen para formar los límites del saco nasal. El proceso nasal medial en ambos lados forma el tabique nasal. Estadio de Carnegie 18 (seis a siete semanas de gestación). La fusión del proceso maxilar y el proceso globular de His se completa casi por completo. Se identifica el borde inferior de ambas narinas. La membrana buconasal se rompe y se forma la coana primitiva. Se desarrolla el órgano vomeronasal y los cornetes en sus porciones maxilar y etmoidal, además de que se hace evidente el cartílago del tabique nasal primario. Estadio de Carnegie 19 (siete semanas de gestación). Existe profusión anterior del área nasal. La cavidad nasal primaria y el estomodeo persisten conectados y se forma una cavidad común. El proceso palatino lateral que surge del proceso maxilar protruye hacia los lados de la lengua y luego por debajo de ésta. Existe un adecuado desarrollo del epitelio olfatorio sobre la porción superior de la pared lateral nasal, así como del tabique nasal y el órgano vomeronasal. Estadio de Carnegie 20 (siete a ocho semanas de gestación). Se advierte ya epitelio sobre la porción anterior de las narinas y formación de cartílago en el tabique nasal y la pared lateral de la cavidad nasal. La porción inferior del segmento intermaxilar, el proceso globular, se encuentra fusionado con el proceso maxilar. Estadio de Carnegie 21 (siete a ocho semanas de gestación). El proceso palatino lateral yace vertical por debajo de la lengua y los cornetes etmoidales se desplazan de la porción superior del tabique nasal a la porción superior de la pared lateral nasal. Se forma el área olfatoria, ya que el epitelio olfatorio se localiza en el área etmodial y de los cornetes, así como en la región superior del tabique nasal. Estadio de Carnegie 22 (ocho semanas de gestación). Histológicamente se identifica el cartílago de Meckel, así como el alargado y vertical proceso lateral palatino. El meato medio se forma entre los cornetes, maxilares y etmoidales. Estadio de Carnegie 23 (ocho a nueve semanas de gestación). Desde la posición frontal se identifica una nariz normal. La porción anterior de la cavidad nasal se encuentra separada por la premaxila y la fusión entre el proceso maxilar y el globular da lugar a la cavidad bucal. La coana primitiva se encuentra permeable y las prominencias nasales laterales en ambos lados se fusionan para formar el paladar definitivo, desde la porción ventral hasta la dorsal. Se identifica la premaxila formada por el proceso globular del segmento intermaxilar y el proceso maxilar. ANOMALÍAS CONGÉNITAS DE NARIZ Y SENOS PARANASALES INFECCIONES El desarrollo de procesos infecciosos durante la gestación, como rubeola, varicela y sífilis, son causas conocidas de defectos nasales, como la nariz aplanada o en silla de montar, relacionada con microcefalia. ERRNVPHGLFRVRUJ Capítulo 10 El conducto lagrimal se desarrolla a lo largo de la hendidura nasolagrimal, entre el ala de la pared lateral de la nariz y el proceso maxilar, a través de una invaginación del ectodermo sobre esta hendidura. El conducto tiene una abertura secundaria en el meato inferior de la cavidad nasal y, en su porción superior, se bifurca y establece conexiones con el saco conjuntival en el canto interno del ojo, para formar los canalículos lagrimales. Por otro lado, la glándula lagrimal se desarrolla a partir de una proliferación ectodérmica del saco conjuntival del ángulo superoexterno del ojo. Su inervación secretomotora proviene del ganglio esfenopalatino y el nervio facial, por la vía de su rama cigomaticotemporal. La mucosa nasosinusal se inicia con células indiferenciadas planas para transformarse en una membrana mucosa con epitelio y lámina propia entre la novena y 12ª semanas de gestación. El epitelio olfatorio aparece en la octava semana y cubre toda la cavidad nasal por arriba del meato superior, para sufrir atrofia y degeneración parcial después del nacimiento. Se reconoce epitelio seudoestratificado ciliado cuboidal o columnar en la cavidad nasal en la novena semana de la gestación y en las celdillas etmoidales y seno maxilar entre las semanas 14ª y 16ª. Aparecen las células caliciformes y acinos glandulares entre las semanas 12ª y 14ª. Al principio predominan en la cavidad nasal anterior para distribuirse de modo más amplio hacia la 24ª semana. Por lo general, el desarrollo del epitelio del tabique nasal precede al de la pared lateral de la nariz. Esta última desarrolla epitelio respiratorio ciliado entre las semanas 10ª y 14ª. De acuerdo con los estadios de Carnegie, la nariz se desarrolla de la siguiente manera: 231 231 232 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 10 FÁRMACOS ACONDROPLASIA Todo medicamento teratógeno puede causar alteraciones en el desarrollo craneofacial del feto como la hipoplasia de las estructuras nasales. Se acompaña de puente nasal bajo y macrocefalia. Los miembros, manos y pies son cortos y hay la extensión del codo es limitada. En ocasiones, el conducto espinal es estrecho. La estatura es baja y se transmite en forma autosómica dominante. TRISOMÍA 13 Puede producir alteraciones en los ojos, como fisuras palpebrales oblicuas, nariz aplanada y alteraciones del cerebro anterior, tipo prosencefalia, junto con polidactilia, uñas hiperconvexas, déficit mental y estatura baja. DELECIÓN DEL BRAZO LARGO DEL CROMOSOMA 18 Se acompaña de hipoplasia de la mitad de la cara (con un conducto auditivo estrecho o atrésico), frecuencia elevada de huella digital en remolino, déficit mental y estatura baja. SÍNDROME DE RUBINSTEIN–TAYBI Existe microcefalia, hipoplasia maxilar y fisuras palpebrales antimongoloides. La nariz es prominente y el tabique cartilaginoso se extiende por debajo de la altura de las narinas. Existen también déficit mental moderado y estatura baja. SÍNDROME DE SECKEL Los pacientes presentan hipoplasia facial con nariz prominente, microcefalia e hipotricosis. Es probablemente de origen autosómico dominante. Estos sujetos constituyen un grupo de alto riesgo para el desarrollo de procesos infecciosos del oído medio, como otitis serosas. SÍNDROME DE FREEMAN–SHELDON (FACIES DE SILBADOR) Se acompaña de alas nasales hipoplásicas y el aspecto de la cara es parecido al de una máscara con la acción de silbar. Se transmite en forma autosómica dominante. SÍNDROME DE MIETENS Nariz estrecha, opacidad corneal y contractura en flexión del codo. Se transmite en forma autosómica recesiva. SÍNDROME DE PYLE (DISPLASIA CRANEOMETAFISARIA) Consiste en nariz aplanada y ancha, con engrosamiento del cráneo y compresión de nervios craneales. También existe clono rotuliano y se transmite en forma autosómica recesiva. SÍNDROME DE APERT (ACROCEFALOSINDACTILIA) Hay craneosinostosis, hipertelorismo e hipoplasia facial superior. La sindactilia es del pulgar y primer ortejo ancho y grueso. Se acompaña de déficit mental y se transmite en forma autosómica dominante. ENFERMEDAD DE CROUZON (DISOSTOSIS CRANEOFACIAL) Se caracteriza por craneosinostosis, órbita poco profunda e hipoplasia maxilar. Se transmite en forma autosómica dominante. SÍNDROME DE HALLERMANN–STREIFF Se caracteriza por microftalmía y catarata, micrognatia y nariz pequeña y picuda. Se transmite en forma autosómica recesiva. ANOSMIA CONGÉNITA Este padecimiento se relaciona con agenesia de los lóbulos olfatorios. Cuando se acompaña de hipogonadismo, constituye el síndrome de Kallman o displasia olfatogenital, en la que existe además deficiencia de la secreción de gonadotropina. NARIZ BÍFIDA SÍNDROME OCULODENTODIGITAL Los pacientes presentan nariz estrecha, microoftalmos, glaucoma, hipoplasia del esmalte y campodactilia del quinto dedo. Se transmite en forma autosómica recesiva. Es una anomalía congénita consistente en falta de fusión adecuada de los procesos laterales nasales en la línea media. Puede ocurrir en forma aislada o acompañarse de labio y paladar hendidos (figura 10–3). ERRNVPHGLFRVRUJ Embriología, anatomía y anomalías congénitas de nariz y senos paranasales 233 233 Capítulo 10 Figura 10–3. Nariz bífida por fusión inadecuada de los procesos laterales nasales en la línea media. AUSENCIA CONGÉNITA DE HUESOS PROPIOS DE LA NARIZ Se debe a que la porción cefálica de la cápsula cartilaginosa no se reemplaza con tejido óseo; su efecto es una pirámide ósea aplanada y ancha, sin pruebas de hueso en los estudios radiológicos. faciales, se recomienda efectuar una resonancia magnética y estudios metabólicos y genéticos. El tratamiento es quirúrgico y consiste en agrandar la apertura piriforme con fresas de diamante mediante un abordaje sublabial, dejando un soporte nasal posoperatorio con cánulas endotraqueales por espacio de cinco a siete días. APLASIA DE SENOS PARANASALES ESTENOSIS CONGÉNITA DE LA ABERTURA PIRIFORME La estenosis congénita de la abertura piriforme se ha descrito como una nueva y rara entidad que origina obstrucción de las vías aéreas en recién nacidos y lactantes. Brown informó los primeros casos. Se puede presentar en relación con otras anomalías centrofaciales y cerebrales medias y su relación con la holoprosencefalia se ha visto reforzada por el hallazgo ocasional de anomalías cromosómicas. En el 60% de los casos se puede encontrar un diente incisivo superior único. También se ha descrito la presencia de hipotelorismo y puente nasal bajo, estas últimas como manifestaciones clínicas de disgenesia premaxilar. Su diagnóstico se establece en forma clínica con episodios de insuficiencia respiratoria por obstrucción nasal, que mejoran con el llanto y al aplicar una cánula bucal. Es frecuente que los nasofaringoscopios flexibles de 3.5 mm no puedan pasar a través de la abertura piriforme. La tomografía axial computarizada confirma el diagnóstico y, cuando se vincula con otras anomalías cerebrales y La aplasia del seno frontal es la más frecuente. Lo más común es que sea unilateral, con una incidencia entre la población del 12%; le sigue la del seno esfenoidal, con 1 a 1.5%. La más rara es la aplasia completa de los senos maxilares, que se relaciona con hipoplasia o ausencia del proceso unciforme, lo cual debe tomarse en cuenta, sobre todo durante la realización de operaciones endoscópicas funcionales de la nariz y es secundaria a un trastorno del desarrollo entre el tercero y quinto meses de vida embrionarios. QUISTES DERMOIDES NASALES Son áreas de epitelio embrionario a lo largo de la línea de fusión de la fisura intranasal. En ocasiones presentan un trayecto fistuloso que comunica los quistes con la superficie de la piel. Se caracterizan por presentarse en la línea media en relación con el cartílago alar, septal o los huesos propios de la nariz. Por lo regular se diagnostica durante el primer o segundo años de vida (figura 10–4). ERRNVPHGLFRVRUJ 234 Oído, nariz, garganta y cirugía de cabeza y cuello Capítulo 10 Figura 10–4. Quiste dermoide que surgió de la línea media nasal y se extendía hacia el ángulo superointerno de la órbita. Cuando los quistes presentan una vía fistulosa hacia piel, la inyección de material radiopaco es la prueba más útil para determinar la extensión de dicha vía y descartar una posible participación intracraneal. Los quistes dermoides son capaces de ensanchar el tabique nasal y extenderse en forma superior hacia el área de la lámina cribiforme, para llegar así la fosa craneal anterior y penetrar entre los repliegues anteriores o posteriores de la duramadre hasta alcanzar la hipófisis. Cefaloceles que afectan la porción convexa de la cavidad craneal 1. Cefalocele occipital inferior. 2. Cefalocele occipital superior; estos dos tipos representan las formas más frecuentes (hasta 74%). 3. Cefalocele parietal (12%). 4. Cefalocele lateral. 5. Cefalocele interfrontal. Cefaloceles que afectan la base del cráneo CEFALOCELES Consisten en la extensión o protrusión de cualquier elemento intracraneal a través de un defecto congénito en el cráneo y la duramadre. Si el cefalocele contiene aracnoides y espacio subaracnoideo con líquido cefalorraquídeo se denomina meningocele. Si, además, contiene tejido cerebral o cerebeloso se conoce como encefalocele. Los cefaloceles son una anomalía primaria de la formación y separación del tubo neural de su superficie relacionada con un defecto en el desarrollo de la estructura ósea que lo cubre. Existen diferentes tipos de cefaloceles. 1. Cefaloceles frontoetmoidales; el más frecuente es el nasofrontal, seguido del nasoetmoidal y el nasoorbitario. 2. Cefaloceles esfenoorbitarios. Se comunican con la fosa media a través del agujero óptico, por la fisura orbitaria superior o un defecto congénito en la pared orbitaria. En clínica pueden manifestarse con una proptosis pulsátil. 3. Cefaloceles esfenomaxilares. Representan una extensión del espacio subaracnoideo de la fosa media craneal a través de la fisura orbitaria superior. ERRNVPHGLFRVRUJ Embriología, anatomía y anomalías congénitas de nariz y senos paranasales Se considera que la frecuencia de cefaloceles es de 1 a 3 por cada 10 000 nacidos vivos. ces forman sacos con fondo ciego que descienden a través del músculo orbicular de los labios hasta una profundidad de 0.5 a 2.5 cm, y se comunican con las glándulas salivales menores adyacentes a través de sus conductos excretorios. Estas fístulas transportan con frecuencia saliva espesa hacia la superficie, en forma espontánea o por presión mecánica sobre ellas. Se cree que se desarrollan a partir de la persistencia de conductos embrionarios que por lo regular se encuentran en el arco mandibular del embrión de 5 a 6 mm y desaparecen en el de 10 a 16 mm. Las fístulas del labio inferior se presentan también en el síndrome bucofaciodigital, en el que, además, hay hipoplasia del ala de la nariz y asimetría digital y se transmite ligado al cromosoma X. Otro síndrome que se acompaña de fístulas del labio inferior es el del pterigión poplíteo. Gliomas nasales ATRESIA DE COANAS Son tumoraciones que pueden estar presentes en el momento del nacimiento. Un 60% es extranasal, 30% intranasal y