Puente de Kohlrausch: Conductimetría y Conductividad Electrolítica
Anuncio

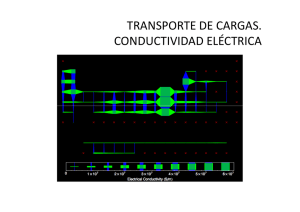
UNIVERSIDAD NACIONAL DEL CALLAO PUENTE KOHLRAUSCH PUENTE DE KOHLRAUSCH INTRODUCCION En los primeros intentos para medir la conductividad de una disolución electrolítica se usó la corriente continua procedente de una batería, pero esta corriente producía la descomposición electrolítica en los electrodos de platino de la célula de conductividades, originando la polarización de los mismos. El primero que midió satisfactoriamente las conductividades de disoluciones de electrolitos fue Kohlrausch, entre los años 1860-1870, 1860-1870, usando para ello corriente alterna. Puesto que un galvanómetro galvanómetro convencional no respondía a la corriente alterna, usaba como receptor un teléfono, que le permitía oír cuando se equilibraba el puente de Wheatstone. Los instrumentos que se usan hoy día para medir la conductividad de las disoluciones lo que hacen, normalmente, es medir la resistencia de la disolución, R, al paso de la corriente, por comparación con una resistencia estándar I.- OBJETIVOS: OBJETIVOS: Estudiar la importancia del puente Kohlrausch en la conductimetria. Describir la manera de determinar la conductividad electrolítica mediante un puente Kohlrausch. Conocer conceptos tales como: resistividad, conductividad, conductividad molar, conductividad equivalente, movilidad iónica y número de transporte, resaltando las relaciones entre ellos, así como las unidades de medida. II.- FUNDAMENTO TEORICO: Conductimetría: Es una técnica instrumental que tiene como objeto determinar la conductividad de las disoluciones de las sustancias llamadas electrolitos, las cuales se caracterizan por ser conductoras de la electricidad y por presentarse en las mismas el fenómeno de la ionización. Resistenci Resistencia, a, conductanci conductancia a y conducti conductividad En ausencia de un campo eléctrico, los iones se encuentran en un constante movimiento debido a la agitación por energía térmica. La distancia efectiva recorrida por lo iones en su conjunto es nula. Cuando se somete a dichos iones a la acción de un campo eléctrico, los mismos se moverán, en un UNIVERSIDAD NACIONAL DEL CALLAO PUENTE KOHLRAUSCH sentido u otro, de acuerdo con la intensidad del campo eléctrico aplicado, su carga y sus posibilidades físicas de “moverse” en la solución. Éste fenómeno se conoce como migración iónica. Supongamos que una porción de una determinada solución se aloja entre dos placas metálicas de área A, separadas por una distancia l, y a las que se aplica una diferencia de potencial E, tal como se muestra Figura 1. 1 En estas condiciones, se puede considerar a la disolución como un conductor, que obedece a la Ley de Ohm. Consideremos la representación de una porción disolución (Fig. 1) en la que la resistencia R correspondiente vendrá dada por: La inversa de la resistencia es la conductancia (L) cuya unidad es el Siemens (S), también llamado ohm-1 o mho. Combinando las ecuaciones anteriores se obtiene: Donde k es la conductividad de la disolución (en S.cm-1), definida como la inversa de la resistividad. Conductancia molar y equivalente La conductividad es una medida de la habilidad con que los portadores de carga migran bajo la acción de un campo eléctrico. Para el caso de un conductor iónico el valor de la conductividad dependerá del número de iones presentes en el volumen entre las placas, es decir su concentración. A fin de obtener una medida normalizada, independiente de la concentración se define la conductancia molar definida como: , UNIVERSIDAD NACIONAL DEL CALLAO PUENTE KOHLRAUSCH Donde C es la concentración molar (mol.L-1) del electrolito ionizado. Un análisis dimensional revela que si [C] = mol.L-1 y [k]= S.cm-1 entonces se deben hacer compatibles las unidades de longitud de k y C. Para ello tendremos en cuenta que 1 L equivale a 1000 cm3, por lo que las unidades para C se pueden expresar como [C]= .mol.. De esta manera, las unidades para serán: = S. mol-1 y si para C se utilizan las unidades de mol.L-1 y para k las de S.cm-1 entonces la ecuación que se deberá usar para es en realidad: Donde el factor 1000 da cuenta del cambio de unidades de litro Debido a que algunos iones poseen carga mutiple, la cantidad de corriente que pueden transportar (para determinado tamaño iónico) es mayor. Por esta razón y, nuevamente, con el fin de normalizar la medida se introduce la magnitud conductancia equivalente que considera a todos los iones como monovalentes, es decir, de una sola carga. Ésto permite la comparación de sus valores por unidad de carga o, mejor dicho, por mol de cargas. Definimos como electrolito en un volumen de 1 L. La relación entre y a la conductancia de 1 equivalente de es: Donde z representa la carga de la especie considerada. Variación de la concentración: Ley de Kohlrausch La variación de la conductividad equivalente de un electrolito fue caracterizada experimentalmente por Kohlrausch, a una temperatura determinada, frente a la raíz cuadrada de la concentración, y, para algunos electrolitos, las gráficas obtenidas en el dominio de bajas concentraciones correspondían con bastante precisión a una línea recta. Éstas gráficas, para varios electrolitos se representan en la figura 1. Aquí se observa que aparecen dos tipos diferentes de comportamiento: aquellos electrolitos que presentan esencialmente variación lineal, se les agrupa entre los electrolitos fuertes; mientras que, los que se aproximan a la conductividad límite de forma casi tangencial, están agrupados como electrolitos débiles. De la figura 1 se puede observar una interesante relación al extrapolar los valores de las conductividades de los electrolitos hasta la dilución infinita, para obtener la llamada conductividad UNIVERSIDAD NACIONAL DEL CALLAO PUENTE KOHLRAUSCH equivalente límite. Estas conductividades, que se representan por Λo, son la base de la Ley de Kohlrausch o de la migración independiente de los iones. FIGURA 1. Variación de la Conductividad equivalente en función de para algunas disoluciones acuosas de electrolitos, a 25°C La conductividad del electrolito a dilución infinita se considera como resultado de las contribuciones de las dos clases de iones individuales que forman al electrolito. De esta forma, se introducen los conceptos de conductividades iónicas equivalentes, que para dilución infinita permiten establecer que: + Λo = λo + λo- (Idealidad) La ley de Kohlrausch sugiere ahora, que la conductividad a dilución infinita de un electrolito depende de las contribuciones independientes de los iones que lo conforman. La independencia de éstas contribuciones se pone de manifiesto al comparar electrolitos que tienen algún ión común; pero la ley de Kohlrausch no suministra, y así debe destacarse, la forma de calcular las contribuciones individuales de los diferentes iones, solo permite evaluar variaciones (∆). La aplicación práctica e inmediata de la idea de una contribución independiente de los iones a dilución infinita, es el camino para deducir el valor de la conductividad límite de los electrolitos débiles. Por ejemplo, para el ácido acético se puede establecer que: Λo (HAc) = Λo (Na Ac) + Λo (HCl) - Λo (NaCl) UNIVERSIDAD NACIONAL DEL CALLAO PUENTE KOHLRAUSCH Porque el miembro derecho de la ecuación cabe interpretarlo como: λo Na+ + Ac- λo + H+ λo Puente de kohlrausch: + Cl- λo - λo Na+ - Cl- λo = H+ λo + Ac- λo = Λo (HAc) Es un aparato que se utiliza para medir las resistencias eléctricas de los líquidos. Basado su funcionamiento en el puente de Wheatstone, pero empleando la corriente alterna producida por una pequeña bobina de inducción, es posible determinar con este tipo de instrumentos la resistencia de los electrólitos, ya que una corriente de este tipo no produce descomposición alguna en los mismos. En este caso, el galvanómetro del puente de Wheatstone es sustituido por un teléfono que produce un menor o mayor sonido según se alcance o no el equilibrio en el puente. Cuando éste se consigue, el teléfono no emite sonido alguno o resulta prácticamente imperceptible. III.-MATERIALES o Conductimetro o Célula de conductividad o Disolución a medir o Aparato de control de temperatura UNIVERSIDAD NACIONAL DEL CALLAO PUENTE KOHLRAUSCH IV.- PROCEDIMIENTO EXPERIMENTAL Medición de la conductividad: Los conductímetros modernos consisten de un celda de vidrio con dos electrodos de negro de Platino de área (A) y distancia definida (l). La resistencia de la solución se mide mediante un circuito de resistencias en paralelo, denominado Puente de Wheatstone: La resistencia R3 se varía hasta balancear la corriente (lectura cero en A) que pasa por las dos ramas en paralelo. Se utiliza CA para evitar electrólisis de la solución. La constante de la celda (l / A) se determina con una solución de referencia (KCl 0.1 mM – 10 mM) Ahora como sabemos que el puente Kohlrausch es una variante del puente wheatstone observamos en la fig 1, que el puente consta de 4 resistencias, en las cuales una de ellas es la resistencia de la disolución (Rx). La ecuación que rige el comportamiento de cada una de las resistencias se expresa como: Fig 1. Puente de kohlrausch para la medición de la resistencia UNIVERSIDAD NACIONAL DEL CALLAO PUENTE KOHLRAUSCH Como se observa en la figura 1, se encuentra conectado un galvanómetro, el cual indicará un valor nulo (0V), en el momento que todas las resistencias del puente sean iguales. Al variar Rx, el puente estará en desequilibrio y se originará una pequeña diferencia de potencial entre las terminales del galvanómetro. Los conductímetros operan con corriente alterna de baja amplitud (hasta 10V AC, dependiendo del modelo) para alimentar al puente, y la frecuencia suele ser menor a 1KHz ya que con frecuencias mayores la capacitancia de la celda provoca errores de medición debido a los cambios de fase en la corriente, que son difíciles de compensar. Una celda tradicional para la medición de conductividad se puede apreciar en la siguiente figura 11 Celda medidora de conductividad de disoluciones. Todo diseño de una celda de medición de conductividad debe de cumplir con una buena aproximación, y generalmente trabajar en un rango específico 44 de resistencias medidas. Un valor efectivo de este rango de resistencias se encuentra de 100 a 200K Ω (la resistencia del agua es aproximadamente 200K Ω). En un puente de Kohlrausch se esperaría que la impedancia medida de la disolución fuera puramente resistiva. Sin embargo, dado que la celda de conductividad consiste en dos electrodos (dos placas) separados a una distancia, la estructura se asemeja a la de un capacitor. Es por eso que cada celda de medición de conductividad posee un capacitor en paralelo con la resistencia de la disolución, con el fin de eliminar la reactancia capacitiva y que la impedancia medida sea puramente resistiva. En un puente de conductividad bien diseñado, todos los brazos deben funcionar prácticamente como puras resistencias.