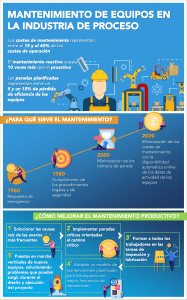
Directriz sobre buenas prácticas de farmacovigilancia (GVP) Módulo XVI - Medidas de minimización de riesgos: selección de herramientas e indicadores de efectividad XVI.B. Estructuras y procesos XVI.B.1. Principios generales Las medidas de minimización de riesgos tienen como objetivo optimizar el uso seguro y eficaz de un medicamento a lo largo de su ciclo de vida. El equilibrio riesgo-beneficio de un medicamento puede mejorarse reduciendo la carga de reacciones adversas o optimizando el beneficio, mediante la selección y / o exclusión específicas de pacientes y mediante la gestión del tratamiento (p. Ej., Régimen de dosificación específico, pruebas relevantes, seguimiento del paciente). . Por lo tanto, las medidas de minimización de riesgos deben orientar el uso óptimo de un medicamento en la práctica clínica con el objetivo de respaldar la provisión del medicamento adecuado, en la dosis adecuada, en el momento adecuado, al paciente adecuado y con la información y el seguimiento adecuados. La mayoría de los problemas de seguridad se abordan mediante medidas rutinarias de minimización de riesgos (consulte el Módulo V de GVP). Excepcionalmente, para riesgos importantes seleccionados, la minimización de riesgos de rutina puede considerarse insuficiente y pueden considerarse necesarias medidas adicionales de minimización de riesgos. Para determinar si se necesitan actividades adicionales de minimización de riesgos, las preocupaciones de seguridad deben priorizarse en términos de frecuencia, gravedad, gravedad, impacto en la salud pública y prevención. Luego, se debe considerar cuidadosamente si el objetivo puede alcanzarse con actividades de minimización de rutina y, si no se considera suficiente, qué medidas de minimización adicionales son las más apropiadas. Las medidas adicionales de minimización de riesgos deben centrarse en los riesgos prevenibles más importantes y la carga de imponer una minimización adicional de riesgos debe equilibrarse con el beneficio para los pacientes. Actualmente hay una variedad de herramientas disponibles para minimizar los riesgos adicionales. Este campo se está desarrollando continuamente y es probable que se desarrollen nuevas herramientas en el futuro. Los avances tecnológicos, como las herramientas interactivas basadas en la web, pueden ganar prominencia además de los materiales educativos en papel. La implementación exitosa de medidas adicionales de minimización de riesgos requiere la contribución de todas las partes interesadas, incluidos los solicitantes / titulares de autorización de comercialización, pacientes y profesionales de la salud. El desempeño de estas medidas en los sistemas sanitarios requiere una evaluación para asegurar que se cumplan sus objetivos y que las medidas implantadas sean proporcionadas teniendo en cuenta la relación riesgo-beneficio del producto y los esfuerzos necesarios de los profesionales sanitarios y los pacientes para implementar las medidas. Por tanto, es importante asegurarse de que las medidas adicionales de minimización de riesgos, incluida la evaluación de su eficacia, no supongan una carga indebida para el sistema de prestación de asistencia sanitaria, los titulares de autorizaciones de comercialización, los reguladores y, lo que es más importante, sobre los pacientes. Para ello, deben tener un objetivo claramente definido relevante para la minimización de riesgos específicos y / o la optimización del balance riesgo-beneficio. Los objetivos claros y las medidas de éxito definidas con hitos deben guiar el desarrollo de medidas adicionales de minimización de riesgos, y es necesario un seguimiento cercano tanto de su implementación como de su efectividad final. La naturaleza de la preocupación por la seguridad en el contexto de la relación riesgo-beneficio del producto, la necesidad terapéutica del producto, la población objetivo y las acciones clínicas necesarias para minimizar el riesgo son factores que deben tenerse en cuenta al seleccionar las herramientas de minimización del riesgo y desarrollar una estrategia de implementación para lograr el resultado de salud pública deseado. La evaluación de la eficacia debe facilitar las acciones correctivas tempranas si es necesario y puede requerir modificaciones con el tiempo. Se reconoce que esta es un área en evolución de las ciencias médicas sin estándares y enfoques universalmente acordados. Por lo tanto, es importante aprovechar cualquier elemento relevante de los métodos de la farmacoepidemiología y otras disciplinas, como las ciencias sociales / del comportamiento y los métodos de investigación cualitativa. La introducción de una minimización de riesgos adicional debe considerarse como un “programa” en el que se desarrollan herramientas específicas, junto con un esquema de implementación y una estrategia de evaluación. Por lo tanto, la descripción de las medidas de minimización de riesgos, una parte integral del PGR (ver Módulo V de GVP), debe considerar adecuadamente los siguientes puntos: os, se debe proporcionar una justificación para esas medidas adicionales; definidos y una descripción clara de cómo y qué problemas de seguridad se abordan con las medidas adicionales de minimización de riesgos propuestas; minimización de riesgos adicionales seleccionadas, incluidas las herramientas que se utilizarán y los elementos clave del contenido; propuesta detallada para la implementación de medidas adicionales de minimización de riesgos (por ejemplo, establecimiento y momento o frecuencia de la intervención, detalles de la audiencia objetivo, plan para la distribución de herramientas educativas; cómo se llevará a cabo la acción). coordinado cuando esté involucrado más de un titular de autorización de comercialización); ación: Esta sección del plan de gestión de refrigerantes debe proporcionar un plan detallado con hitos para evaluar la eficacia de las medidas adicionales de minimización de riesgos en términos de proceso y en términos de medidas de resultados generales de salud (por ejemplo, reducción del riesgo). XVI.B.2. Medidas de minimización de riesgos Las medidas de minimización de riesgos tienen como objetivo facilitar la toma de decisiones informadas para respaldar la minimización de riesgos al prescribir, dispensar y / o utilizar un medicamento. Si bien se aplican medidas de rutina a todos los medicamentos (ver Módulo V de GVP), las actividades adicionales de minimización de riesgos solo deben introducirse cuando se consideren esenciales para el uso seguro y eficaz del medicamento (ver también XVI.C.) y debe ser desarrollado y proporcionado por personas debidamente calificadas. Las medidas adicionales de minimización de riesgos pueden diferir ampliamente en el propósito, el diseño, el público objetivo y la complejidad. Estas medidas pueden utilizarse para orientar la selección adecuada de pacientes con la exclusión de los pacientes cuyo uso está contraindicado, para respaldar la monitorización durante el tratamiento relevante para los riesgos importantes y / o el tratamiento de una reacción adversa. Además, se pueden desarrollar medidas específicas para minimizar el riesgo de error de medicación (consulte la Guía de buenas prácticas de PRAC sobre minimización de riesgos y prevención de errores de medicación1) y / o para garantizar la administración adecuada del producto cuando no sea posible lograrlo a través del producto. información y etiquetado únicamente. XVI.B.2. describe medidas adicionales de minimización de riesgos que pueden considerarse además de las medidas de rutina, que incluyen: XVI.B.2.1. Programa educativo Los programas educativos se basan en una comunicación dirigida con el objetivo de complementar la información del RCP y del PL. Todo material educativo debe centrarse en objetivos viables y debe proporcionar mensajes claros y concisos que describan las acciones que se deben tomar para prevenir y minimizar los riesgos seleccionados. El objetivo de un programa educativo es mejorar el uso de un medicamento influyendo positivamente en las acciones de los profesionales sanitarios y los pacientes para minimizar el riesgo. Por lo tanto, los materiales educativos deben basarse en la premisa de que existe una recomendación procesable para la educación dirigida y que la aplicación de esta medida se considera esencial para minimizar un riesgo importante y / o para optimizar la relación riesgobeneficio. En el contexto de un programa educativo, las herramientas pueden tener varios destinatarios diferentes, pueden abordar más de un problema de seguridad y pueden entregarse utilizando una combinación de herramientas y medios (por ejemplo, papel, audio, video, web, capacitación en persona) . Idealmente, los materiales educativos deberían estar disponibles en una variedad de formatos para garantizar que el acceso no esté limitado por una discapacidad o el acceso a Internet. Cuando sea factible, la idoneidad de la herramienta y los medios para el público objetivo (por ejemplo, lenguaje adecuado, imágenes, diagramas u otro soporte gráfico) debe ser probado por el usuario con anticipación, a fin de optimizar el éxito de la fase de implementación. El contenido de cualquier material educativo debe estar completamente alineado con la información de producto actualmente aprobada para un medicamento, como el RCP y PL, y debe agregar en lugar de duplicar información de RCP y PL. Los elementos promocionales, ya sean directos o velados (por ejemplo, logotipos, colores de la marca del producto, imágenes e imágenes sugerentes), no deben incluirse y el material educativo debe centrarse en los riesgos relacionados con el producto y la gestión de esos riesgos. (s) que requieran una minimización adicional del riesgo. Cualquier programa educativo debe estar completamente separado de las actividades promocionales y la información de contacto de médicos o pacientes recopilada a través de programas educativos no debe usarse para actividades promocionales. Las herramientas educativas que se describen a continuación se pueden considerar individualmente o en combinaciones al desarrollar un programa educativo con el propósito de minimizar el riesgo adicional. XVI.B.2.1.1.1. Herramientas educativas dirigidas a los profesionales sanitarios El objetivo de cualquier herramienta educativa dirigida a un profesional de la salud debe ser ofrecer recomendaciones específicas sobre el uso (qué hacer) y / o contraindicaciones (qué no hacer) y / o advertencias (por ejemplo, cómo manejar una reacción adversa) asociados con el medicamento y los riesgos importantes específicos que requieren medidas adicionales de minimización de riesgos, que incluyen: administración o dispensación de un medicamento; El formato de una herramienta en particular debe depender del mensaje que se va a transmitir. Por ejemplo, cuando se necesitan varias acciones antes de escribir una receta para un paciente, una lista de verificación puede ser el formato más adecuado. Un folleto puede ser más apropiado para aumentar la conciencia de riesgos importantes específicos con un enfoque en el reconocimiento temprano y el manejo de reacciones adversas, mientras que los carteles para exhibir en ciertos entornos clínicos pueden incluir guías de referencia de tratamiento o dosis útiles. Pueden ser preferibles otros formatos, dependiendo del objetivo de la herramienta. XVI.B.2.1.1.2. Herramientas educativas dirigidas a pacientes y / o cuidadores El objetivo de las herramientas dirigidas a pacientes y / o cuidadores debe ser mejorar su conocimiento de los primeros signos y síntomas de reacciones adversas específicas que provocan la necesidad de medidas adicionales de minimización de riesgos y sobre el mejor curso de acción a tomar en caso de que alguno de ellos firme o aparecen los síntomas. Si es apropiado, se podría utilizar una herramienta educativa para el paciente para proporcionar información sobre la correcta administración del producto y recordarle al paciente sobre una actividad importante, por ejemplo, un diario de dosificación o procedimientos de diagnóstico que deben ser llevados a cabo y registrados por paciente y eventualmente discutido con los profesionales de la salud, para garantizar que se cumplan todos los pasos necesarios para el uso seguro y eficaz del producto. Tarjeta de alerta para el paciente El objetivo de esta herramienta debe ser garantizar que el paciente tenga en todo momento información especial sobre la terapia actual del paciente y sus riesgos importantes (por ejemplo, interacciones potencialmente mortales con otras terapias) y que llegue al profesional sanitario correspondiente cuando sea necesario. La información debe mantenerse al mínimo necesario para transmitir el mensaje o mensajes clave de minimización y la acción requerida, en cualquier circunstancia, incluida la emergencia. La capacidad de llevar la tarjeta de alerta para el paciente con facilidad (por ejemplo, se puede guardar en una billetera) debería ser una característica clave del diseño de esta herramienta. XVI.B.2.2. Programa de acceso controlado Un programa de acceso controlado consiste en intervenciones que buscan controlar el acceso a un medicamento más allá del nivel de control garantizado por las medidas rutinarias de minimización de riesgos, es decir, el estatus legal. Dado que un programa de acceso controlado tiene grandes implicaciones para todas las partes interesadas, el uso de dicho programa debe ser limitado y debe estar guiado por una clara necesidad terapéutica del producto basada en su beneficio demostrado (por ejemplo, trata una enfermedad grave sin terapias alternativas; trata a pacientes que han fracasado con las terapias existentes), la naturaleza del riesgo asociado (por ejemplo, el riesgo es potencialmente mortal) y la probabilidad de que este riesgo pueda ser manejado por dicho programa. Por lo tanto, el acceso controlado solo debe considerarse como una herramienta para minimizar un riesgo importante con un impacto significativo en la salud pública o en el paciente individual para un producto con beneficios claramente demostrados, pero que de otro modo no estaría disponible sin un programa en el que el acceso del paciente dependa del cumplimiento de uno o más requisitos antes de prescribir o dispensar un producto para garantizar su uso seguro. A continuación se enumeran ejemplos de requisitos que deben cumplirse antes de prescribir y / o dispensar y / o utilizar el producto en un programa de acceso controlado (pueden incluirse individualmente o en combinación): clínicos estrictamente definidos; r y / o paciente que documente su recepción y comprensión de la información sobre el riesgo grave del producto; inscripción en un sistema de recopilación de datos específico, p. registro de pacientes; registradas y aprobadas para dispensar el producto. En ocasiones, el requisito de probar o monitorear a un paciente de una manera específica también se puede utilizar como una herramienta de acceso controlado. Por ejemplo, el seguimiento del estado de salud del paciente, los valores de laboratorio u otras características antes y / o durante el tratamiento, p. Ej. electrocardiograma, pruebas de función hepática, análisis de sangre periódicos, pruebas de embarazo (que pueden ser parte de un programa de prevención del embarazo). Deben adoptarse medidas para garantizar que el seguimiento se lleve a cabo de acuerdo con el RCP cuando sea fundamental para el equilibrio riesgo-beneficio del producto. XVI.B.2.3. Otras medidas de minimización de riesgos XVI.B.2.3.1. Sistema de distribución controlado Un sistema de distribución controlada se refiere al conjunto de medidas implementadas para asegurar que las etapas de la cadena de distribución de un medicamento sean seguidas hasta la prescripción y / o farmacia que dispensa el producto. Los pedidos y envíos de producto desde uno o varios puntos de distribución identificados facilitan la trazabilidad del producto. Por ejemplo, este tipo de medidas podrían ser consideradas para aquellos productos controlados en cada país bajo las respectivas legislaciones nacionales para prevenir el uso indebido y abuso de medicamentos. XVI.B.2.3.2 Programa de prevención del embarazo Un programa de prevención del embarazo (PPP) es un conjunto de intervenciones destinadas a minimizar la exposición del embarazo durante el tratamiento con un medicamento con efectos teratogénicos conocidos o potenciales. El alcance de dicho programa es garantizar que las pacientes no queden embarazadas al iniciar la terapia y que no queden embarazadas durante el transcurso de la terapia o poco después de finalizarla. También podría dirigirse a pacientes varones cuando el uso de un medicamento por parte del padre biológico pueda tener un efecto negativo en el resultado del embarazo. Un PPP combina el uso de herramientas educativas con intervenciones para controlar adecuadamente el acceso al medicamento. Por lo tanto, los siguientes elementos deben considerarse individualmente y / o en combinación en el desarrollo de una APP: sobre el riesgo teratogénico y las acciones necesarias para minimizar este riesgo (p. Ej., Orientación sobre la necesidad de utilizar más de un método anticonceptivo y orientación sobre los diferentes tipos de anticoncepción, información incluida para el paciente sobre cuánto tiempo para evitar el embarazo después de interrumpir el tratamiento, información sobre cuándo se trata a la pareja masculina); prueba de embarazo y que el profesional sanitario verifique los resultados negativos antes de prescribir o dispensar el medicamento; embarazo accidental. El diseño y la implementación de un registro de embarazos (como una actividad independiente o como parte de un programa de prevención de embarazos) también deben considerarse para la inscripción universal de pacientes que quedan embarazadas durante el tratamiento o dentro de un tiempo apropiado después del final del tratamiento (p. Ej. 3 meses). El uso de esta herramienta sistemática para recopilar información sobre el resultado del embarazo puede ser útil para evaluar la eficacia del programa de prevención del embarazo y / o para facilitar una caracterización adicional del riesgo, particularmente en el período posterior a la autorización, cuando los datos sobre el embarazo humano pueden ser muy limitados y / o o cuando la posible preocupación puede basarse únicamente en datos no clínicos. XVI.B.2.3.3. Comunicación directa con profesionales de la salud (DHPC) Una comunicación directa al profesional de la salud (DHPC) es una intervención de comunicación mediante la cual un titular de una autorización de comercialización o una autoridad competente entrega información importante directamente a los profesionales de la salud individuales, para informarles de la necesidad de tomar ciertas acciones o adaptar sus prácticas en relación con a un medicamento (ver Anexo I de GVP). Por ejemplo, un DHPC puede tener como objetivo adaptar el comportamiento de prescripción para minimizar riesgos particulares y / o reducir la carga de reacciones adversas con un medicamento. Las situaciones en las que se debe considerar la diseminación de un DHPC se detallan en el Módulo XV de GVP. XVI.B.4. Efectividad de las medidas de minimización de riesgos Es necesario evaluar la efectividad de las medidas adicionales de minimización de riesgos para establecer si una intervención ha sido efectiva o no, y si no, por qué y qué acciones correctivas son necesarias. La evaluación debe realizarse para las herramientas adicionales de minimización de riesgos individualmente y para el programa de minimización de riesgos en su conjunto. La evaluación de la eficacia debe realizarse en el momento más adecuado, teniendo en cuenta el tiempo necesario para el lanzamiento de las medidas de minimización de riesgos, el uso estimado del producto por parte del sistema sanitario y otras circunstancias relevantes. Se debe planificar una revisión periódica de la eficacia de una o más herramientas específicas o del programa general, según corresponda. Los momentos de especial relevancia son los siguientes: dentro de los 12-18 meses), para permitir la posibilidad de modificaciones, si fueran necesarias; Siempre que se evalúe la eficacia, se debe considerar cuidadosamente la necesidad de continuar con la medida adicional de minimización de riesgos. La evaluación de la eficacia debe abordar diferentes aspectos de la minimización de riesgos, es decir, el proceso en sí (es decir, en qué medida el programa se ha implementado según lo planeado), su impacto en el conocimiento y los cambios de comportamiento en la audiencia objetivo (es decir, las medidas que afectan el comportamiento cambio), y el resultado (es decir, en qué medida se cumplieron los objetivos predefinidos de minimización de riesgos, a corto y largo plazo). Al diseñar una estrategia de evaluación, se debe tener en cuenta qué aspectos del proceso y los resultados se pueden medir de manera realista para evitar la generación de datos inexactos o engañosos o colocar una carga indebida en el sistema de salud u otras partes interesadas. El momento para evaluar cada aspecto de la intervención, así como el establecimiento de métricas realistas sobre las cuales se juzga la efectividad de la herramienta, también deben ser cuidadosamente consideradas y planificadas antes del inicio. Para evaluar la efectividad de las medidas adicionales de minimización de riesgos, se deben considerar dos categorías de indicadores: Los indicadores de proceso son necesarios para recopilar evidencia de que los pasos de implementación de medidas adicionales de minimización de riesgos han tenido éxito. Estos indicadores de proceso deben proporcionar información sobre en qué medida se ha ejecutado el programa según lo planeado y si se han observado los impactos previstos en el comportamiento. Las métricas de implementación deben identificarse con anticipación y monitorearse a lo largo del tiempo. La evaluación del proceso de implementación también puede mejorar la comprensión de los procesos y los mecanismos causales mediante los cuales las medidas adicionales de minimización de riesgos condujeron o no al control deseado de los riesgos importantes especificados. Los indicadores de resultados proporcionan una medida general del nivel de control de riesgos que se ha logrado con cualquier medida de minimización de riesgos implementada. Por ejemplo, cuando el objetivo de una intervención es reducir la frecuencia y / o la gravedad de una reacción adversa, la medida final de éxito estará vinculada a este objetivo. En raras circunstancias, cuando se justifique que la evaluación de los indicadores de resultados no sea factible (por ejemplo, número inadecuado de pacientes expuestos, eventos adversos muy raros), la evaluación de la eficacia puede basarse exclusivamente en la interpretación cuidadosa de los datos sobre los indicadores de proceso. La conclusión de la evaluación puede ser que la minimización de riesgos debe permanecer sin cambios o que se deben realizar modificaciones a las actividades existentes. Alternativamente, la evaluación podría indicar que la minimización de riesgos es insuficiente y debería fortalecerse (por ejemplo, mediante la modificación de las advertencias o recomendaciones en el RCP o prospecto, mejorando la claridad de los consejos de minimización de riesgos y / o agregando herramientas adicionales o mejorando las herramientas existentes) . Otra decisión puede ser que la minimización del riesgo sea desproporcionada o carezca de un enfoque claro y podría reducirse o simplificarse (por ejemplo, disminuyendo el número de herramientas o la frecuencia de la intervención, o eliminando las intervenciones que se demostró que no contribuyen a la minimización del riesgo). En todas las circunstancias, la carga para el paciente y el sistema sanitario debe considerarse cuidadosamente. Además de evaluar la efectividad de las medidas de minimización de riesgos en la gestión de preocupaciones de seguridad, también es importante monitorear si la intervención de minimización de riesgos puede haber tenido consecuencias no deseadas (negativas) relevantes para la cuestión de salud pública en consideración, ya sea a corto y / o a largo plazo. Algunos ejemplos de consecuencias no deseadas pueden incluir una carga indebida para el sistema sanitario o la interrupción de un producto en los pacientes, incluso si la relación riesgo-beneficio fue positiva para ellos. La legislación define “Cualquier estudio ... que mida la eficacia de las medidas de gestión de riesgos” como un estudio de seguridad posterior a la autorización [DIR Art 1 (15)]. Por lo tanto, si se realiza un estudio para evaluar los indicadores de resultados de comportamiento o seguridad, se deben seguir las pautas detalladas para realizar un estudio de seguridad posterior a la autorización, que se proporciona en el Módulo VIII de GVP. Esta guía no se aplica a la medición de marcadores de procesos simples (por ejemplo, distribución de las herramientas que llegan a la población objetivo). La Guía ENCePP sobre normas metodológicas en farmacoepidemiología2 debe aplicarse según corresponda.