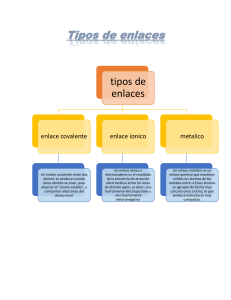
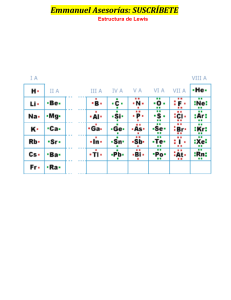
Colegio San Juan Masías QUIMICA TIPOS DE ENLACES QUIMICOS CTA – 3er. Bim - 2021 • ENLACE COVALENTE: Los enlaces covalentes son las fuerzas que mantienen unidos entre sí los átomos no metálicos • Estos dos átomos comparten sus electrones de último nivel para así alcanzar el octeto estable adquiriendo estabilidad. • Ejemplo: El enlace covalente de la molécula de agua (H2O) CARACTERÍSTICAS DEL ENLACE COVALENTE Las principales características son: •Los enlaces se caracterizan por la unión entre dos pares de electrones que no sean metales. •Los átomos que se unen al enlace deben de poder ganar electrones. •Se encuentran formados por no metales más no se da en los metales. •Tienen la capacidad de formar moléculas •Los enlaces covalentes son blandos cuando se encuentran en estado sólido. •Son solubles en agua. •Los electrones que se comparten se representan por medio de una única línea. 1.- CLASES DE ENLACES COVALENTES Dependiendo de la diferencia en la electronegatividad, los enlaces covalentes pueden ser clasificados en dos diferentes tipos, covalente apolar y covalente polar: A) .- COVALENTE APOLAR o NO POLAR: Es también conocido con el nombre de enlace covalente puro o no polar. Se produce debido al comportamiento de los electrones que se da entre dos o más átomos que tienen la misma electronegatividad, por lo que su resultado es de 0. Pueden distribuir su carga electrónica entre los núcleos de forma simétrica y el par electrónico es atraído por los dos núcleos. Cuando la electronegatividad es menor a 0,4 es covalente apolar. Ejemplo el enlace que forma la molécula de oxígeno. B). COVALENTE POLAR: Este tipo de enlace es una transición que se da entre un enlace iónico puro y un enlace covalente que es apolar. Se produce cuando se da el compartimiento de electrones entre dos o más átomos que tienen diferente electronegatividad, produciéndose una separación de las cargas o la distribución de estas entre los núcleos de forma asimétrica. En este tipo de enlace se pueden dar diferentes grados de polaridad en los enlaces. Su característica más importante es el grado de simetría que se encuentra determinado por la diferencia que hay entre la electronegatividad de los átomos. Ejemplo: El enlace que se da para formar una molécula de agua. TIPOS DE ENLACE COVALENTE Dependiendo del número de pares de electrones que comparten, existen varios tipos de enlaces, como: • Enlace simple • Enlace doble y • Enlace triple A.- ENLACE SIMPLE: se da cuando se comparte un par de electrones, donde cada átomo aporta un electrón. • El enlace simple se puede representar con un guion entre los átomos que lo forman. • Ejemplo, el enlace para formar la molécula de cloro (Cl2) B.- ENLACE DOBLE: se da cuando un átomo comparte con otro cuatro electrones, dos de cada átomo. • El enlace simple se puede representar con dos guiones entre los átomos que lo forman. • Ejemplo, el enlace para formar la molécula de oxigeno (O2) C.- ENLACE TRIPLE: se da cuando un átomo comparte con otro seis electrones, tres de cada átomo. • El enlace simple se puede representar con tres guiones entre los átomos que lo forman. • Ejemplo, el enlace de la molécula del nitrógeno (N2) PROPIEDADES DE LOS ENLACES COVALENTES Los enlaces covalentes pueden formarse cuando se encuentran en estado líquido, aunque también pueden presentarse en estado gaseoso o sólido. Tienen por esta razón la propiedad de mantener sus puntos de fusión y de ebullición a temperaturas normales. Tienen la capacidad de ser solubles en solventes que sean apolares. Son muy malos conductores de electricidad y de calor. Tienen dos diferentes fuerzas de atracción entre las moléculas, lo que es conocido como fuerza intermolecular, y esta es la razón por la cual sus uniones no son tan fuertes. Son ejemplos de enlaces covalentes: TAREA DOMICILIARIA En tu cuaderno: 1.- Busca dos ejemplos mas de enlaces covalentes apolar y covalente polar, grafica. 2.- Busca 2 ejemplos mas de enlaces covalentes: simples, dobles y triples, grafica.