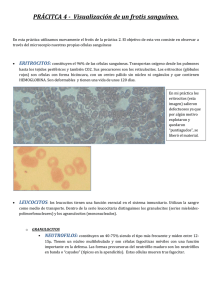
"Año del bicentenario del Perú: 200 años de independencia" UNIVERSIDAD NACIONAL DE TRUJILLO FACULTAD DE MEDICINA ESCUELA ACADÉMICO PROFESIONAL DE MEDICINA INFORME GRUPAL N°01 ALUMNOS: - Avila Rodriguez Diego Pio - Berrios Valera Jefferson AÑO: 4° año CURSO: Laboratorio DOCENTE: Dr. Vilela Desposorio, Carlos David PROMOCIÓN LVII TRUJILLO – PERÚ 2019 Tinción de Romanowsky La tinción de Romanowsky , también conocida como tinción de Romanowsky-Giemsa , es una técnica de tinción prototípica que fue la precursora de varias tinciones distintas pero similares ampliamente utilizadas en hematología (el estudio de la sangre) y citopatología (el estudio de células enfermas). Las tinciones de tipo Romanowsky se utilizan para diferenciar células para el examen microscópico en muestras patológicas , [1] especialmente las extensiones de sangre y médula ósea , y para detectar parásitos como la malaria en la sangre. Las tinciones que se relacionan o derivan de las tinciones de tipo Romanowsky incluyen las tinciones de Giemsa , Jenner , Wright , Field , MayGrünwald y Leishman . La técnica de tinción lleva el nombre del médico ruso Dmitri Leonidovich Romanowsky (1861-1921), quien fue uno de los primeros en reconocer su potencial de uso como tinción de sangre. Frotis de sangre con tinción de Giemsa . Glóbulos blancos (centro) rodeados de glóbulos rojos . Mecanismo El valor de la tinción de Romanowsky radica en su capacidad para producir una amplia gama de tonos, lo que permite diferenciar fácilmente los componentes celulares. Este fenómeno se conoce como efecto Romanowsky , o más generalmente como metacromasia . Efecto Romanowsky Frotis de sangre teñido con Giemsa que muestra Plasmodium (centro de la imagen), el parásito que causa las infecciones por malaria . En 1891 Romanowsky desarrolló una tinción usando una mezcla de eosina (típicamente eosina Y ) y soluciones envejecidas de azul de metileno que formaban tonos no atribuibles a los componentes de la tinción solo: tonos distintivos de púrpura en la cromatina del núcleo celular y dentro de los gránulos en el citoplasma de algunos glóbulos blancos. Esto se conoció como el efecto Romanowsky o RomanowskyGiemsa. eosina y el azul de metileno puro solos (o en combinación) no producen el efecto Romanowsky, y ahora se consideran las manchas activas que producen el efecto ser azul B y eosina. Azul de metileno policromado Las tinciones tipo Romanowsky se pueden hacer a partir de una combinación de tintes puros o de azul de metileno que ha sido sometido a desmetilación oxidativa , lo que da como resultado la descomposición del azul de metileno en muchas otras tinciones, algunas de las cuales son necesarias para producir el efecto Romanowsky. . El azul de metileno que ha sufrido este proceso oxidativo se conoce como "azul de metileno policromado". El azul de metileno policromado puede contener hasta 11 tintes, incluidos azul de metileno , azul A , azul B, azul C, tionina , violeta de metileno Bernthesen, metil tionolina y tionolina. La composición exacta del azul de metileno policromado depende del método utilizado, e incluso los lotes del tinte del mismo fabricante pueden variar en composición. Aunque se ha demostrado que el azul B y la eosina son los componentes necesarios para producir el efecto Romanowsky, estos tintes en sus formas puras no siempre se han utilizado en la formulación de las soluciones de tinción.Las fuentes originales de azur B (uno de los productos de oxidación del azul de metileno) procedían de soluciones de azul de metileno policromado, que se trataron con agentes oxidantes o se dejaron envejecer naturalmente en el caso de Romanowsky. Ernst Malachowsky en 1891 fue el primero en policromar azul de metileno a propósito para usarlo en una tinción tipo Romanowsky. Tipos May-Grünwald-Giemsa La tinción de May-Grünwald-Giemsa es un procedimiento de dos pasos que incluye la primera tinción con la tinción de May-Grünwald, que no produce el efecto Romanowsky, seguida de la tinción con la tinción de Giemsa que sí produce el efecto Romanowsky. Tinciones de Wright y Wright-Giemsa La tinción de Wright se puede utilizar sola o en combinación con la tinción de Giemsa, que se conoce como tinción de Wright-Giemsa. La tinción de Wright lleva el nombre de James Homer Wright, quien en 1902 publicó un método que usaba calor para producir azul de metileno policromado, que se combina con eosina Y. El metileno policromado el azul se combina con eosina y se deja precipitar, formando un eosinato que se redisuelve en metanol . La adición de Giemsa al tinte de Wright aumenta el brillo del color "púrpura rojizo" de los gránulos citoplasmáticos. Las tinciones de Wright y Wright-Giemsa son dos de las tinciones de tipo Romanowsky de uso común en los Estados Unidos y se utilizan principalmente para la tinción de frotis de sangre y médula ósea. Tinción de Leishman En 1901 William Leishman desarrolló una mancha similar a la de Louis Jenner pero con la sustitución del azul de metileno puro por azul de metileno policromado. La tinción de Leishman se prepara a partir del eosinato de azul de metileno policromado y eosina Y utilizando metanol como disolvente. Tinción de Giemsa La tinción de Giemsa se compone de "Azure II" y eosina Y con metanol y glicerol como disolvente. Se cree que "Azure II" es una mezcla de azul B (que Giemsa llamó "azul I") y azul de metileno, aunque la composición exacta de "azul I" se considera un secreto comercial. Se han publicado formulaciones comparables que utilizan tintes conocidos y están disponibles comercialmente. La tinción de Giemsa se considera la tinción estándar para la detección e identificación del parásito de la malaria. COLORACIÓN ESPERADA CON LA TINCIÓN MAY GRÜNWALD – GIEMSA HEMATOPOYESIS La hematopoyesis es el proceso de formación, desarrollo y maduración de los elementos formes de la sangre (eritrocitos, leucocitos y plaquetas) a partir de un precursor celularcomún e indiferenciado conocido como célula madre hematopoyética pluripotencial, unidad formadora de clones,hemocitoblasto o stem cell. Las células madre que en el adulto se encuentran en la médula ósea son las responsables de formar todas las células y derivados celulares que circulan por la sangre. Las células sanguíneas son degradadas por el bazo y los macrófagos del hígado. Este último, también elimina las proteínas y otras sustancias de la sangre. Hematopoyesis prenatal. Durante la fase mesoblástica, que se inicia en la segunda semana de desarrollo embrionario, el mesodermo del saco vitelineo, en donde se agregan las células mesenquimatosas se les llama islotes sanguíneos, sus paredes forman la pared vascular, y las células que quedan se convierten eneritroblastos, que se diferenciarán en eritrocitos con núcleo. La fase mesoblástica comienza a reemplazarse por la fase hepática, en la sexta semana de gestación. En esta etapa los eritrocitos aún poseen núcleo; los leucocitos aparecen aproximadamente en la octava semana dedesarrollo embrionario. La hematopoyesis se inicia en la médula ósea hacia el final del segundo trimestre. Esta se encuentra dividida en cuatro fases. 1. Fase mesoblastica. La formación de células sanguíneas se inicia dos semanas después de la concepción en el mesodermo del saco vitelino, donde se agregan células mesenquimatosas en racimos conocidos como islotes sanguíneos. Las células periféricas de estos islotes forma la pared del vaso y los restantes se transforman en eritroblastos que se diferencian en eritrocitos nucleados. 2. Fase hepática. Inicia alrededor de la sexta semana de gestación. Los eritrocitos aun tienen núcleo y aparecen los leucocitos en la octava semana de embarazo. 3. Fase esplénica. Inicia durante el segundo trimestre y continúa hasta el finalde la gestación. 4. Fase mieloide. Comienza en la médula ósea roja al final del segundo trimestre. A medida que continúa el desarrollo del sistema esquelético. ERITROPOYESIS: La eritropoyesis es el proceso que corresponde a la generación de los glóbulos rojos (también conocidos como eritrocitos o hematíes). Este proceso en los seres humanos ocurre en diferentes lugares dependiendo de la edad de la persona. Durante las primeras semanas de la vida intrauterina la eritropoyesis se da en el saco vitelino. Posteriormente, en el segundo trimestre de gestación la eritropoyesis se traslada alhígado y en la vida extrauterina, este proceso ocurre en la médula ósea, principalmente de los huesos largos. Hacia los 20años los huesos largos se llenan de grasa y la eritropoyesis se llevará a caboen huesos membranosos como las vértebras, el esternón, las costillas y los ilíacos. La falta de cualquiera de estas causas el fracaso de maduración en el proceso de la eritropoyesis, que se manifiesta clínicamente como reticulocitopenia, una cantidad anormalmente baja de reticulocitos. TROMBOPOYESIS Trombopoyesis es el proceso mediante el cual se generan las plaquetas que promueven la coagulación para impedir la pérdidade sangre en caso de una lesión vascular. Este proceso tiene lugar en la médula ósea. El proceso comienza a partir de los megacarioblastos, que se transforman en protomegacariocitos y más tarde estos en megacariocitos; de estos últimos se escinden fragmentos citoplasmáticos: las protoplaquetas. A partir de un megacariocito se originan 6 protoplaquetas que dan lugar a su vez a 6 - 12 x 103 plaquetas. Causa Puede deberse a múltiples causas (disminución de la producción plaquetaria o trombopoyesis; aumento de la captación de plaquetas en el bazo, en el caso de esplenomegalia; disminución de la "vida útil" de las plaquetas, ya sea por autoanticuerpos o por patologías hipercoagulativas). LEUCOPOYESIS La leucopoyesis es el proceso de formación y desarrollo de los leucocitos. Forma parte de la hematopoyesis, proceso mediante el cual se forman, diferencian, desarrollan y maduran las células sanguíneas, incluyendo la composición de eritrocitos, plaquetas y leucocitos. La leucopoyesis incluye la diferenciación, formación, desarrollo y maduración de varias líneas celulares que dan origen a cinco tipos de células: – Los granulocitos o leucocitos polimorfonucleares neutrófilos – Los polimorfonucleares eosinófilos – Los polimorfonucleares basófilos – Los monocitos – Algunos linfocitos. Los neutrófilos son los leucocitos o células blancas más abundantes en el torrente circulatorio. A pesar de que en circulación existen 500 veces más eritrocitos que leucocitos, el 75% de las células de la médula ósea son de la serie mieloide que producen leucocitos. Factores que estimulan la leucopoyesis La proliferación y diferenciación de las células progenitoras y de las diferentes células madre comprometidas hasta la formación de los leucocitos obedece a una serie de factores hormonales, los cuales actúan específicamente en las diferentes etapas de diferenciación de la leucopoyesis. Las interleucinas (IL) y los factores estimuladores de colonias (CSF) son los principales estimuladores de la diferenciación de las células madre y de la posterior proliferación y maduración de las diferentes líneas celulares de leucocitos. En presencia de interleucina 3 y 5 (IL3 Y 5) y del factor estimulador de colonia de agranulocitos (aG-CSF), las células pluripotenciales se diferencian en monoblastos. La formación de mieloblastos depende de la presencia de IL3, IL5 y del factor estimulador de colonia de granulocitos (G-CSF). La interleucina 4 (IL4) participa en la diferenciación de los mieloblastos en la línea de los basófilos. Otros factores han sido descritos como el factor estimulador de colonia de granulocitos y macrófagos (GM-CSF) y el factor estimulador de colonia de macrófagos (MCSF). Algunos estudios muestran que la ausencia de algunos factores, en ciertos casos, puede ser reemplazada por los restantes, esto implica la participación conjunta de varios factores. LEUCOCITOS Los leucocitos se dividen en dos grupos diferenciados por la presencia de gránulos prominentes en el citoplasma, los granulocitos (neutrófilos, eosinófilos y basófilos) y agranulocitos (linfocitos y monocitos) . NEUTROFILOS: CARACTERISTICAS • Los mas abundantes y mas comunes de los granulocitos • Se llaman así, debido a la ausencia de tinción citoplasmática. • se caracterizan por las múltiples lobulaciones de su núcleo; por esta razón, también reciben el nombre de neutrófilos polimorfonucleares o polimorfos. • N. Maduros o segmentados poseen 2 a 4 lóbulos unidos por finas hebras de material nuclear • miden de 10 a 12 mm de diámetro • N. joven o abastonados presentan el núcleo en banda. 0-4 % • Heterocromatina se encuentra en la periferia del núcleo en contacto envol. nuclear • Eucromatina se encuentra en el centro del núcleo FUNCIONES: • Poseen 3 tipos distintos de gránulos que reflejan sus funciones fagocíticas • Gránulos azurófilos o primarios: Actúan como lisosomas (contiene MPO, defensinas, catelicidina) • Gránulos específicos o secundarios: Forma elipsoidal (contiene enzimas, activ. complemento y péptidos antimicro.) • Gránulos terciarios: Posee fosfatasas y metaloproteinasa que facilitan su migracion • 1era línea que llega sitio de lesión tisular • Participan inflamación y la curación de la heridas EOSINÓFILOS CARACTERISTICAS • Casi del tamaño de un Neutrófilo , su núcleo es bilobulado • Reciben su nombre a causa de los grandes gránulos refringentes de su citoplasma • Heterocromatina se encuentra junto a la envolura nuclear • Eucromatina se encuentra en el centro del núcleo FUNCIONES • Poseen 2 tipos distintos de gránulos que reflejan sus funciones • Gránulos azurófilos o primarios: Actúan como lisosomas (contienen hidrolasas ácidas) • Destrucción de parásitos e hidrolisis de complejos Ag-Ac • Gránulos específicos: Contiene MPB (da la acidófila) , ECP, EPO y EDN. • MPB, ECP y EPO -> Efecto citotóxico sobre protozoarios y helmintos parásitos • Encontramos histaminasa, arilsulfatasa, colagenasa y catepsinas BASOFILOS: Células con granulaciones azuladas o violetas oscuro ricas en: histamina, heparina, sustancia quimio táctica del eosinófilo, kalicreina, factor activador de plaquetas. El contorno del núcleo no se observa con facilidad porque se encuentra oculto parcialmente por la presencia de los gránulos específicos. La intensidad de la basofilia de los gránulos específicos se debe a la concentración de abundantes moléculas de sulfato ligados a los G.A.Gs heparina y heparán sulfato Constituyen sólo un 0,5 % de leucocitos. La membrana plasmática de los basófilos posee receptores de Fc con alta afinidad por los anticuerpos IgE, y una proteína específica CD40L. Esta última interactúa con el receptor CD40 de los linfocitos B, causando una retroalimentación positiva en la síntesis de IgE. A su vez, los gránulos de los basófilos son de dos tipos, según su contenido, a saber: Azurófilos (primarios): Son sus lisosomas, contienen hidrolasas ácidas. Específicos (secundarios): Contienen heparina, histamina, heparán sulfato, leucotrienos, IL-4 e IL-13. Tamaño: 10-14um FUNCIONES: Capacidad fagocítica en reacciones alérgicas Gracias a la heparina participa en la anticoagulación. Una reacción de exceso de basófilos y células cebada produce un choque anafiláctico las interleucinas 4 y 13 promueven la síntesis de anticuerpos IgE por los linfocitos B. MONOCITOS: Células grandes con núcleo arriñonado. Presentan abundante citoplasma que se tiñe de un color ligeramente gris azulado. Se suelen observar gránulos escasos azurófilos. Formadas en médula ósea, están poco tiempo en circulación (2-3 h) y luego pasan a los tejidos convirtiéndose en macrófagos donde duran meses. El macrófago aumenta de tamaño celular de 5 a 10 veces, aumenta su actividad enzimática, de adherencia y fagocitosis. Y presentar epitopos a linfocitos T Constituyen sólo un 3-7 % de leucocito. LINFOCITOS: CÉLULAS B Y CÉLULAS T Los linfocitos son los agranulocitos más comunes, representando aproximadamente un 25-35% del total de leucocitos, o sea de 1500-4000/uL. En la microscopía óptica, se pueden diferenciar a los linfocitos según su tamaño en pequeños, medianos y grandes, con diámetros de 6-20 um. En general, el citoplasma suele estar representado por un reborde muy fino y pálido alrededor del núcleo basófilo, aunque estas dimensiones pueden variar de acuerdo al tamaño linfocitario. Los pequeños son la mayoría de linfocitos (>90%) en el torrente sanguíneo y suelen tener un tamaño de 7-9 um, semejante al de un eritrocito; mientras que, el grupo de linfocitos grandes está constituido, en su mayoría, por linfocitos activados (o sea, que poseen receptores de superficie para algún antígeno específico) o linfocitos destructores naturales (NK) y su diámetro no suele pasar de los 18 um. Desde el punto de vista funcional, se caracterizan 3 tipos de linfocitos: LINFOCITOS T: Poseen proteínas de superficie llamadas “receptores del linfocito T” o TCR, a su vez, proteínas marcadoras CD2, CD3, CD5 y CD7; sin embargo, su subclasificación principal está dada por la presencia o ausencia de las proteínas marcadoras CD4 y CD8. Los linfocitos T CD4+ (o sea, los que poseen el marcador CD4) reconocen antígenos unidos a moléculas del complejo mayor de histocompatibilidad tipo II, o MHC II, que suele ser expresado por macrófagos; de tal manera que los linfocitos T CD4+ cooperadores activados producen y liberan interleucinas (IL-12) para estimular la proliferación y diferenciación de más linfocitos T CD4+ cooperadores, a su vez, la diferenciación y función de los linfocitos B (hacia plasmocitos, con la consecuente síntesis de anticuerpos), T y NK, de ahí su nombre de “cooperadores”. Por otro lado, los CD8+ reconocen antígenos unidos a MHC I que expresan antígenos de células infectadas por virus o que han sufrido transformaciones neoplásicas, mediante sus proteínas TCR. Su función es esencialmente citotóxica, pues secretan linfocinas y perforinas para lisar a las células infectadas o neoplásicas. LINFOCITOS B: Los linfocitos B maduros participan en la producción de anticuerpos circulantes y poseen en su superficie a los anticuerpos IgM e IgD; a su vez moléculas de MHC II; así como marcadores específicos CD9, CD19, CD20 y CD24. No son distinguibles de los linfocitos T en los frotis de sangre ni cortes histológicos, pues, para diferenciarlos se requiere de técnicas inmunocitoquímicas para sus marcadores y proteínas específicas de superficie celular. LINFOCITOS NK: Son distinguibles de los linfocitos T y B en la microscopía óptica debido a su gran tamaño (15 um), y poseen gránulos azurófilos visibles en este mismo tipo de estudios; a su vez, sus marcadores específicos son CD16, CD56 y CD94. Son programados durante su desarrollo para la destrucción de células infectadas por virus (secretan el interferóngamma) y células neoplásicas. Leucograma: Alteraciones Cuantitativas Es importante conocer el leucograma que nos ayudará a conocer la cifra total de leucocitos, así como el porcentaje de cada tipo celular (fórmula leucocitaria). Estas células son las encargadas de la defensa frente a agresiones externas, mediante mecanismos de fagocitosis (neutrófilos, monocitos) o en la respuesta inmune celular o humoral (linfocitos, celulas plasmáticas, monocitos y eosinófilos). El siguiente cuadro se muestran los valores normales de los leucocitos: Así como los valores pueden encontrarse normales, existen alteraciones en las cantidades de los leucocitos. Esto se conoce como alteraciones cuantitativas. Estas alteraciones pueden ser por exceso o por defecto. Alteraciones cuantitativas por defecto: Las leucopenias son consideradas como la existencia de una cifra de leucocitos inferior a 4000/uL. La mayoría de los casos se deben a neutropenia absoluta (<2500 células / mm3); los casos raros son secundarios a linfopenia absoluta (<1000 células / mm3). Por lo que se considera que la etiología principal de la leucopenia sea la neutropenia.1 Las diferencias entre leucopenias y neutropenias se encuentran registradas en el siguiente cuadro: LEUCOPENIA Es la reducción de las células blancas en sangre a menos de 4000/uL Da lugar a infecciones bacterianas recorrentes Los pacientes no responden a antibióticos NEUTROPENIA Es solo la reducción de neutrófilos en sangre Da lugar a infecciones virales recurrentes Los pacientes responden a antibióticos Con respecto a las neutropenias, clasificadas por su origen, se denominan: Congénitas: Que pueden deberse a neutropenia cíclica, agranulocitosis infantil (síndrome de Kostmann) o neutropenia familiar benigna. Adquiridas, que a su vez pueden ser idiopáticas o secundarias. o Secundarias o Idiopáticas: Que se deben a neutropenia crónica idiopática o neutropenia autoinmune. Por último, la linfopenia sin neutropenia asociada es poco común. La mayoría de los casos son secundarios a fármacos (p. Ej., Esteroides), lesión por radiación o insuficiencia renal. Algunas infecciones virales, particularmente el VIH, también pueden causar linfopenia absoluta.1 Alteraciones cuantitativas por exceso: Las leucocitosis son el aumento de la cifra total de leucocitos por encima de 10 000/uL. La mayoría de veces se debe a una neutrofilia, pero también puede deberse a causas no infecciosas como dolor agudo, procesos inflamatorios, colagenosis, situaciones posthemorrágicas, hipertermia no infecciosa, quemaduras extensas, crisis gotosas o determinados fármacos.1 Las reacciones leucemoides son aumento de leucocitos por encima de 30 000/uL en los que no existen blastos ni una parada en la maduración de los leucocitos. Puede deberse a diversas causas, como neutrofilia; causas linfocíticas como mononucleosis infecciosa u otras infecciones virales; o eosinofilia debida a síndromes. Las neutrofilias son el aumento de los neutrófilos por encima de los 7 500/uL. Puede deberse a sepsis u otras infecciones bacterianas, intoxicaciones, colagenosis, quemaduras extensas, cetoacidosis diabética, metástasis ósea o tratamiento con G-CSF o GM-CSF.1 La linfocitosis se define como el aumento de los linfocitos por encima de 4 000/uL. No incluye a la linfocitosis relativa, secundaria a una neutropenia; como es mostrada en el cuadro de abajo. Es común entre niños, especialmente en recién nacidos; otras causas son infecciones bacterianas crónicas, tuberculosis, mononucleosis; hemopatías como leucemia linfática crónica, leucemia aguda; enfermedades inflamatorias y endocrinopatías. La monocitosis se refiere a la presencia de más de 1 000/uL. Suele aparecer en procesos subagudos o crónicos. La eosinofilia se refiere a cuando la cifra total de eosinófilos supera los 500/uL, las principales causas se resumen en la siguiente tabla: Por último, la basofilia que es poco frecuente, es cuando los basófilos superan los 150/uL. Es muy infrecuente y aparece en casos de hipersensibilidad a algunos medicamentos o alimentos. LEUCOGRAMA: ALTERACIONES FUNCIONALES Desde el punto de vista fisiopatológico las alteraciones funcionales de los neutrófilos pueden clasificarse en: defectos de adherencia y quimiotaxis, anomalías de la ingestión o endocitosis, y deficiencias de la actividad microbicida y la desgranulación. Déficit de adhesión leucocitaria Es una enfermedad de transmisión autosómica recesiva. Los neutrófilos son incapaces de adherirse a la superficie del endotelio, por una alteración de las integrinas y/o de las selectinas. A nivel molecular se ha demostrado la ausencia o la expresión reducida de determinadas glicoproteínas en la superficie celular como CD18 (déficit de adhesión tipo 1) o un defecto en la fucosilación de los hidratos de carbono (déficit de adhesión tipo 2). Los polimorfonucleares son incapaces de emigrar hasta el foco infeccioso, y en consecuencia aumentan los niveles de neutrófilos circulantes, mientras la formación de pus y la cicatrización de heridas están limitadas. Síndrome de Chédiak-Higashi: Esta enfermedad autosómica recesiva se caracteriza por la presencia de grandes inclusiones intracelulares de origen lisosomial en el interior de granulocitos, monocitos y linfocitos. A nivel molecular se ha detectado una mutación en el gen LYST, que codifica una proteína citoplasmática involucrada en la formación de vacuolas y en el transporte de proteínas. Los neutrófilos tiene alterada la quimiotaxis y la capacidad bactericida. Las manifestaciones clínicas más frecuentes son: infecciones bacterianas por Streptococcus spp y Staphylococcus aureus, neuropatía periférica, retraso mental moderado, albinismo oculocutáneo, disfunción plaquetaria y enfermedad periodontal severa. Deficiencia de gránulos específicos En el interior de los neutrófilos no se detectan gránulos específicos, fundamentales en los procesos inflamatorios, y en cambio se observan gránulos pequeños y elongados, que carecen de constituyentes esenciales como lactoferrina, citocromo b y vitamina B12. En los gránulos basófilos también se han descrito irregularidades, como la reducción de tamaño y la ausencia de defensinas. Entre las anomalías funcionales de los neutrófilos de estos pacientes destacan el deterioro de la quimiotaxis y de la capacidad bactericida. Déficit de mieloperoxidasa: La deficiencia hereditaria de mieloperoxidasa se considera la alteración congénita más frecuente de los neutrófilos, con una prevalencia de 1 caso cada 2.000 nacimientos (36). Esta enzima constituye el principal componente de los gránulos basófilos y cataliza la formación de hipoclorito. Los neutrófilos presentan una actividad metabólica oxidativa exagerada y conservan ralentizada su capacidad germicida. El déficit de mieloperoxidasa generalmente es asintomático, salvo en pacientes con otras enfermedades condicionantes de la respuesta inmunológica como la diabetes. Enfermedad granulomatosa crónica: Los neutrófilos de estos enfermos tienen un defecto en el sistema de la NADPH-oxidasa, una enzima imprescindible para producir especies reactivas del oxígeno y en consecuencia para la destrucción intracelular de microorganismos. Los pacientes presentan infecciones por gérmenes catalasa-positivos como Staphylococcus aureus, Serratia marcescens o Aspergillus spp, que suelen debutar en los primeros años de vida y afectan a piel, pulmones, ganglios linfáticos y vísceras. Las manifestaciones clínicas más frecuentes son acné severo, inflamación persistente y dolorosa de las narinas, úlceras orales y formación de granulomas que pueden originar obstrucciones del tracto genitourinario y digestivo. Alteraciones funcionales de origen extrínseco Entre las alteraciones de la funcionalidad de los neutrófilos de origen extrínseco, destacan las secundarias a la exposición a determinados virus, como: citomegalovirus, rubeola, influenza, herpes virus, hepatitis B, parvovirus, que explicarían la elevada prevalencia de procesos bacterianos consecutivos a ciertas infecciones virales. INDICE DE LOBULARIDAD DE ARNETH El índice de Arneth es una herramienta que permite la descripción del núcleo de los neutrófilos en 5 grandes grupos. Se da a partir de la transformación de los mielocitos en la médula ósea, estos se segmentan gradualmente y se dividen, de acuerdo a la edad, en un número mayor de lobulaciones o segmentos. Es importante saber su clasificación por el núcleo: un núcleo, bilobulado, trilobulado, tetralobulado, pentalobulado. (17) NEUTRÓFIL OS TIPO I TIPO II SEGMENTACIÓN Y NUMERO DE LOBULOS 0 Segmentos y 1 lóbulo 1 Segmentos y 2 lóbulos TIPO III 2 Segmentos y 3 lóbulos TIPO IV 3 Segmentos y 4 lóbulos TIPO V 4 Segmentos y 5 PRINCIPIOS: lóbulos ESTADIFICACIÓN DE NEUTRÓFILOS SE BASA EN EL GRADO DE MADUREZ: ESTADIFICACIÓN DE NEUTRÓFILOS SE BASA EN EL GRADO DE MADUREZ: (1) El número de gránulos: las células más jóvenes contienen más gránulos (2) El tamaño de la celda: El tamaño de la celda disminuye a medida que a celda avanza con la edad. PROCEDIMIENTO: (1) Seleccionar un buen frotis sanguíneo cuya tinción sea de buena calidad para la visualización al microscopio. (2) Utilizar el objetivo de 40X (400X de resolución) para buscar buenas zonas de la extensión sanguínea. De este modo facilitaremos la tarea de identificación de neutrófilos y su segmentación si la hubiese. (3) Cambiar al objetivo de inmersión (1000X de resolución) utilizando aceite de inmersión en la preparación. (4) Recorrer las zonas elegidas de la extensión, identificando los neutrófilos y anotando los lóbulos de cada uno. (5) Identificar y contar hasta 100 neutrófilos, teniendo cuidado de no repetir los campos ya visualizados. (6) Calcular el índice de lobularidad de Arneth. IMPORTANCIA CLÍNICA: El recuento de Arneth se utiliza para determinar la cantidad de neutrófilos más jóvenes o más viejos en la circulación. Revela la producción de neutrófilos → refleja indirectamente la actividad de la médula ósea. DESVIACIÓN A LA IZQUIERDA DESVIACIÓN A LA DERECHA Desplazamient o Regenerativo Desplazamient o Degenerativo - Infeccione s piógenas agudas - Tuberculosis - Hemorragia - Irradiación - Anemia megaloblástica - Anemi a aplásic a - Septicemia - Uremia ANOMALÍAS E INCLUSIONES CITOPLASMÁTICAS ANOMALÍA DE PELGER -HUET: DEFINICIÓN: La anomalía de Pelger-Huët (PHA) es un trastorno hematológico congénito, caracterizado por una alteración de la lobulación de los neutrófilos con una cromatina nuclear gruesa. Es una laminopatía hematológica asociada con el receptor de la proteína B de la lámina nuclear (LBR), esencial para el ensamblaje nuclear. Podemos decir también que es un defecto benigno heredado de manera autosómica dominante. Está caracterizado por un tipo de leucocito conocido como neutrófilo que se encuentra alterado, pues su núcleo es hiposegmentado y no presenta su granulación primaria característica. FISIOPATOLOGÍA: o La lobulación de los núcleos de neutrófilos puede explicarse parcialmente por una respuesta dependiente de la dosis de LBR de tipo salvaje. o A diferencia de los granulocitos multisegmentados de sujetos sanos, las células de heterocigotos PHA presentan hiposegmentación de los núcleos en asociación con la mitad de la cantidad normal de LBR. o Los granulocitos de los homocigotos PHA tienen núcleos redondos no segmentados y se caracterizan por una cantidad menor de LBR. o La organización de la envoltura nuclear puede ser modulada por mutaciones de la proteína emerina de la membrana nuclear interna o por mutaciones de láminas A type (láminas A y C). o Las mutaciones clonales adquiridas de LBR o una reducida expresión de LBR pueden ser la base genética subyacente de la pseudo PHA. ASPECTOS CLÍNICOS: * HOMOCIGOTOS: presentación clínica variable (retraso psicomotor, estatura corporal desproporcionada, macrocefalia con frente prominente, comunicación interventricular, polidactilia y metacarpianos cortos). * HETEROCIGOTOS: PHA benigna, único fenotipo aparente es el núcleo de neutrófilos alterado MORFOLOGÍA: * Los núcleos de todos los leucocitos se ven afectados en la PHA. Tienen menor relación núcleo / citoplasma. * Los lóbulos presentan una apariencia simétrica, en "mancuerna", conectados por una hebra o filamento delgado. * El tamaño celular, el citoplasma y el patrón granular son comparables a los de los neutrófilos normales. * Una pequeña población de neutrófilos posee un núcleo no lobulado o con forma de maní (células de Stodtmeister). * Las bandas de un lóbulo parecen ser más cortas y más gruesas que las punzadas habituales. FUNCIONALIDAD: Las actividades bioquímicas, metabólicas, fagocíticas y bactericidas de los granulocitos PHA no son diferentes de las de los sujetos sanos. Las células de Pelger-Huët muestran un tiempo de supervivencia normal en circulación. CUERPOS DE DÖHLE: Son estructuras pequeñas, redondeadas u ovales y de color grisazulado. Son estructuras pequeñas, redondeadas u ovales y de color grisazulado. DEFINICIÓN: Están formados por ribosomas y retículo endoplásmico. CONSTITUCIÓN: Están formados por ribosomas y retículo endoplásmico. APARICIÓN: (1) Infecciones bacterianas (2) Agresiones tisulares como quemaduras (3) Inflamación (4) Tras la administración de G-CSF (5) Reacciones leucemoides neutrofílicas (6) Embarazo. (7) Anomalía de May-Hegglin presenta una estructura morfológica similar, aunque no idéntica; en este trastorno, las inclusiones tienden a ser mayores y angulares y se presentan en todos los tipos de leucocitos, a excepción de los linfocitos. ANOMALÍA DE ADLER REILLY: DEFINICIÓN: La anomalía de Alder - Reily, alteración hereditaria en forma autosómica recesiva, caracterizada por presencia de gránulos muy grandes y azurófilos agrupados en racimo en citoplasma de los granulocitos, monocitos y linfocitos. MORFOLOGÍA: * Los cuerpos de Alder-Reilly son gránulos azurófilos muy grandes y bien diferenciados que pueden dificultar la visión de núcleo, contienen esfingomielina y otros mucopolisácaridos. * Los gránulos muestran una zona clara a su alrededor. * Faltan las enzimas lisosomales que degradan los mucopolisacáridos, lo que conduce a la acumulación de estos gránulos densos en los leucocitos. ASPECTOS CLÍNICOS: La anomalía de Alder-Reily no interfiere en funciones propias de células, a diferencia de síndrome de Chediak-Higashi, en el cual hay un defecto funcional asociado a susceptibilidad a las infecciones graves. Sin embargo, la presentación clínica puede variar con la cual está asociada como el síndrome de Hunter, el cual tiene una presentación sindrómica amplia que involucra anomalías esqueléticas dismorfismo facial, hepatoesplenomegalia, anomalías del desarrollo neurológico y reducción de la esperanza de vida. REFERENCIAS BIBLIOGRAFICAS: 1. Rodak CJ. Atlas de Hematología Clínica. 3ra ed. Editorial Panamericana, Trad. España: Elsevier. 2009 2. Morales V. Extendidos de sangre periférica. Revista Médica de Costa Rica. 1982 3. Brown AB. Hematology: Principles and Procedures (Lea & Febiger. ed.). Philadelphia. 1993). 4. Fortoul van der Goes T. Histología y biología celular, 3 Ed. McGrawHill Interamericana Editores. 2017 5. Pawlina W, Ross M. Histologia: Texto y Atlas color con Biología Celular y Molecular. Barcelona: Wolters Kluwer; 2020. 6. Hall J, Guyton A. Guyton & Hall. Madrid. Tratado de Fisiología Médica: Elsevier; 2016.