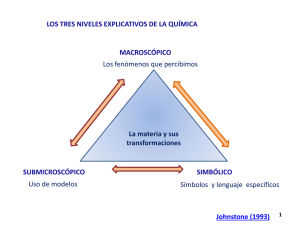
DEPUAGUAS SAS - SOLUBILIDAD O DISOLUCIONES QUIMICAS SOLUBILIDAD O DISOLUCIONES QUIMICAS 1 Las disoluciones son las mezclas más importantes que se realizan en química Contiene las unidades individuales de sus componentes (átomos, moléculas). Mezcla Homogéneas Heterogéneas 2 DEPUAGUAS SAS - SOLUBILIDAD O DISOLUCIONES QUIMICAS Tipos de mezclas: A) Homogéneas o disoluciones B) Heterogéneas 2 o más fases Sal disuelta en agua: se observa luego de un tiempo una sola fase, donde la sal se disolvió en agua debido a las fuerzas intermoleculares presentes. Agua y aceite: se observan dos fases ya que las fuerzas de interacción son nulas. Los componentes no se llegan a mezclar. 3 DEPUAGUAS SAS - SOLUBILIDAD O DISOLUCIONES QUIMICAS Disoluciones • Las disoluciones son sistemas homogéneos (iguales propiedades físicas y químicas en toda su masa) 4 DEPUAGUAS SAS - SOLUBILIDAD O DISOLUCIONES QUIMICAS • Por lo tanto, una mezcla heterogénea NUNCA puede ser una disolución. • Toda disolución esta constituida por dos compuestos: soluto y disolvente. El soluto se disuelve en el disolvente y se encuentra, generalmente, en menor proporción que éste. De ser una solución al 50% se tomará como disolvente el que se indique según el caso. 5 DEPUAGUAS SAS - SOLUBILIDAD O DISOLUCIONES QUIMICAS Proceso de solubilidad Solubilidad: capacidad de disolverse una determinada sustancia (sal) en un determinado medio (agua) Soluto: Sal Solvente: Agua 6 DEPUAGUAS SAS - SOLUBILIDAD O DISOLUCIONES QUIMICAS Expresión de solubilidad • Cantidad máxima que se puede disolver. Lo que se agregue extra por densidad se depositará en el fondo del recipiente, dado que se agotaron las interacciones entre soluto y solvente. 7 DEPUAGUAS SAS - SOLUBILIDAD O DISOLUCIONES QUIMICAS • La solubilidad se expresa como: “X” gramos de soluto/100 g de solvente. • La solubilidad depende de la temperatura, a mayor temperatura mayor interacción entre los componentes, por lo tanto mayor solubilidad. 8 DEPUAGUAS SAS - SOLUBILIDAD O DISOLUCIONES QUIMICAS Tipos de disoluciones: • Insaturadas: cuando se coloca menos gramos del soluto respecto a lo máximo que se puede disolver. • Saturadas: Sobresatmáxima cantidad de soluto por disolver (equilibrio entre la cantidad de soluto y solvente) • uradas: cuando se coloca más de los gramos máximos del soluto que se pueden disolver (disolución inestable) 9 DEPUAGUAS SAS - SOLUBILIDAD O DISOLUCIONES QUIMICAS Unidades de concentración de soluciones • Porcentaje peso en peso g. de soluto en 100 g. de solución • Porcentaje peso en volumen g. de soluto en 100 ml. de solución • Porcentaje volumen en volumen mL de soluto en 100 ml. de solución % m/m % m/v % v/v 10 DEPUAGUAS SAS - SOLUBILIDAD O DISOLUCIONES QUIMICAS Propiedades físicas. Soluto, punto de ebullición, punto de solidificación. • Si se deja la solución en reposo durante un tiempo las partículas no se depositan en el fondo del recipiente. • Sus componentes no se pueden separar por filtración. • 11 DEPUAGUAS SAS - SOLUBILIDAD O DISOLUCIONES QUIMICAS 12 DEPUAGUAS SAS - SOLUBILIDAD O DISOLUCIONES QUIMICAS 13 DEPUAGUAS SAS - SOLUBILIDAD O DISOLUCIONES QUIMICAS 14 DEPUAGUAS SAS - SOLUBILIDAD O DISOLUCIONES QUIMICAS BALANCE CATION- ANION ∑cationes(meq/L)=∑aniones(meq/L) 15 DEPUAGUAS SAS - SOLUBILIDAD O DISOLUCIONES QUIMICAS BALANCE CATION- ANION ∑cationes(meq/L)=∑aniones(meq/L) Cationes Na+ K+ Ca+2 Mg+2 Concentración (mg/L) 13,700 1,180 42,500 3,210 pm , g/mol 23,000 39,000 40,000 24,300 Valencia 1,000 1,000 2,000 2,000 SUMA DE CATIONES Aniones CLSO4-2 HCO3-1 NO3-1 3,015 Concentración (mg/L) 31,200 39,500 79,900 1,300 SUMA DE ANIONES % BE = Concentración (meq/L) 0,596 0,030 2,125 0,264 pm , g/mol 35,500 96,000 61,000 62,000 Valencia 1,000 2,000 1,000 1,000 Concentración (meq/L) 0,879 0,823 1,310 0,021 3,033 0,29% < 5% Balance ACEPTABLE > 5% deben revisarse los métodos de muestreo y los procedimientos analiticos 16 DEPUAGUAS SAS - SOLUBILIDAD O DISOLUCIONES QUIMICAS PRECIPITACION QUIMICA – SOBRESATURACION (TDS) La aparición de una fase sólida en el seno de un líquido, bien por adición de un reactivo que forma un producto insoluble con algunos de los iones de la disolución, o bien por concentración del mismo líquido hasta sobrepasar la saturación, se llama precipitación y se denomina precipitado al producto sólido que se origina 17 DEPUAGUAS SAS - SOLUBILIDAD O DISOLUCIONES QUIMICAS REMOCION QUIMICA DE ELEMENTOS SOLUBLES SULFATOS Para la precipitación química de sulfatos se pueden utilizar dos procedimientos: Precipitación en forma de yeso: Se realiza mediante la adición de calcio (Ca2+) a las aguas con alto contenido en sulfatos (SO4 2-), formándose yeso (CaSO4.2H2O). Si las aguas son ácidas se suele adicionar el calcio en forma de cal, mientras que en aguas con fuerte contenido salino se suele adicionar en forma de cloruro cálcico: (CaCl2). SO4 = + Ca 2+ + 2H2O ⇒ CaSO4.2H2O ↓ Precipitación con cloruro de bario: Al adicionar cloruro de bario (BaCl2) se forma sulfato de bario (BaSO4) insoluble, de acuerdo con las siguientes reacciones, que sirven de ejemplo: CaSO4 + BaCl2 ⇒ BaSO4 ↓ + CaCl2 Na2SO4 + BaCl2 ⇒ BaSO4 ↓ + 2 NaCl Este procedimiento es más caro, además de que no tiene aplicación en las aguas de consumo, por la toxicidad del bario soluble. 18 DEPUAGUAS SAS - SOLUBILIDAD O DISOLUCIONES QUIMICAS REMOCION QUIMICA DE ELEMENTOS SOLUBLES OTROS ELEMENTOS QUE PUEDEN ELIMINARSE MEDIANTE REMOCION QUIMICA - FLUORUROS (Cal, Mg(OH)2,CaCl2) FOSFATOS (Cal) CALCIO (Cal, NaOH,Na2CO3) MAGNESIO (Cal, NaOH,Na2CO3) SILICE (Cal, Mg(OH)2 ) 19 DEPUAGUAS SAS - SOLUBILIDAD O DISOLUCIONES QUIMICAS PRECIPITACION QUIMICA – COAGULACION (SST) COAGULACION Es la desestabilización de los coloides por la acción de reactivos químicos. El estado coloidal se caracteriza por su alta superficie específica, de forma que las moléculas del coloide se unen con moléculas del disolvente y se impide su separación. El procedimiento más empleado para desestabilizar los coloides es la utilización de reactivos químicos Los factores que afectan al proceso de coagulación son el pH, el contenido en sales y su tipo, la alcalinidad, la naturaleza del coloide, la temperatura y el grado de agitación. Los coagulantes que suelen emplearse en el tratamiento de agua son: 1) los basados en el aluminio, como el sulfato de aluminio, los policloruros de aluminio y el aluminato sódico 2) Los basados en el hierro, como los sulfatos férrico y ferroso y el cloruro férrico. 3) Los coagulantes orgánicos de tipo polielectrolito. 4) Mezclas y formulaciones de los anteriores, específicas para cada caso. 20