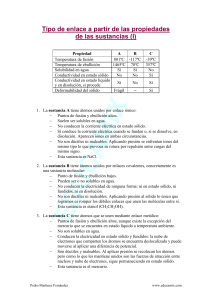
QUÍMICA GENERAL CLASE TEÓRICA N° 1 ESTRUCTURA DE LA MATERIA I.INTRODUCCIÓN: QUÍMICA: Es la ciencia que trata de la composición y propiedades de la materia. La química es parte de nuestras vidas, en nuestro entorno estudia desde el aire que respiramos, los alimentos que consumimos, vivienda, transporte, combustible, en salud: Medicamentos. RAMAS DE LA QUÍMICA: 1. Química General 2. Química Orgánica 3. Química Analítica 4. Química Aplicada II.MATERIA: CONCEPTO: La materia es todo lo que ocupa espacio, tiene una propiedad llamada masa y posee inercia. Cada ser humano es un objeto material. Todos ocupamos espacio y describimos nuestra masa por medio de una propiedad relacionada con ella, nuestro peso. MASA: es la magnitud que mide la materia de un objeto. (Masa no es un valor absoluto) PESO: es la fuerza con que la gravedad actúa sobre un objeto. III.ESTADOS: La materia suele encontrarse en uno de los tres estados, sólido, líquido o gas, los que se denomina estados de agregación o estados físicos. En un sólido, los átomos o moléculas están en contacto próximo, a veces en disposiciones muy organizadas que se llaman cristales. Un sólido tiene una forma definida. En un líquido, los átomos o moléculas están generalmente separados por distancias mayores que en un sólido. El movimiento de estos átomos o moléculas proporciona al líquido una de sus propiedades más características: la capacidad de fluir cubriendo el fondo y adoptando la forma del recipiente que lo contiene. En un gas, las distancias entre átomos o moléculas son mucho mayores que en un líquido. Un gas siempre se expande hasta llenar el recipiente que lo contiene. Dependiendo de las condiciones, una sustancia puede existir solo en uno de los estados de la materia, o puede estar en dos o tres estados. Así, cuando el hielo de una charca empieza a fundir en primavera, el agua está en dos estados, el sólido y d líquido (realmente en tres estados, si tenemos en cuenta el vapor del agua del aire en contacto con la charca). Cada estado particular resulta de la acción de 2 tipos de fuerzas que se presentan cuando interactúan entre las partículas fundamentales que conforman un cuerpo: Fuerzas de atracción y Fuerzas repulsión. Estas fuerzas actúan simultáneamente y con sentido contrario sobre las partículas del cuerpo, la que se encuentran en constante movimiento. Solido: Fuerzas atracción > Fuerza de repulsión Líquido: Fuerzas atracción = Fuerzas de repulsión Gaseoso: Fuerzas atracción > Fuerzas de repulsión Los cuerpos en Estado Sólido: poseen forma propia y volumen propio, en Estado Líquido: No posee forma propia, si volumen propio y en Estado Gaseoso: No posee ni forma, ni volumen propio. Estado Plasmático: es el cuarto estado de la materia y es energético. Es como un gas cargado eléctricamente (ionizado) conformado por: moléculas, átomos, electrones y núcleos; estos últimos provenientes de átomos desintegrados. Se encuentran a elevadísimas temperaturas ejem: núcleo del Sol, de las estrellas, energía atómica. En la superficie de la tierra a una distancia de 200 km, se encuentra plasma de hidrógeno conformando el cinturón de Van Allen. CAMBIOS DE ESTADO: Los cuerpos pueden pasar de un estado a otro variando especialmente su presión y/o temperatura. Cada uno de estos cambios a presión constantemente recibe el nombre: IV.PROPIEDADES DE LA MATERIA: 1. Propiedades Generales: Son las propiedades que presenta toda materia independientemente de su estado físico ejemplo: Extensión o volumen (un cuerpo ocupa un lugar en el espacio), Impenetrabilidad (2 cuerpos no pueden ocupar el mismo espacio), Inercia (resistencia al cambio de estado de reposo o movimiento). Ejemplo: el hierro tiene las mismas propiedades que el agua, ambos tienen volumen, masa y peso, son divisibles, tiene resistencia al movimiento. 2. Propiedades Específicas: Son propiedades características de cada sustancia y permiten diferenciar un cuerpo de otro como: La Elasticidad, punto de ebullición, de presión, densidad, dureza, tenacidad, solubilidad y reactividad. Ejemplo: Alcohol y gasolina son líquidos que poseen masa y volumen, pero el alcohol es soluble en agua y la gasolina no es soluble. 2.1 Propiedades físicas: describen la respuesta de la sustancia a cualquier influencia externa tal como: luz, calor, fuerza, electricidad sin necesidad que la sustancia sea destruida o transformada. Las propiedades físicas pueden ser: Extensivas o Intensivas. 2.1.1 Propiedades Extensivas: El valor medido depende de la cantidad de materia que se considere. Ejem: masa, volumen, capacidad calorífica, longitud, etc. 2.1.2 Propiedades Intensivas: El valor medido no depende de cuánta materia se considere. Ejem: punto de ebullición, punto de fusión, gravedad específica, etc. Los valores numéricos de estas propiedades se denomina constancias físicas. 2.2 Propiedades Químicas: Son aquellas que se presentan al alterar su estructura interna o molecular, cuando interactúan con otras sustancias Ejem.: combustibilidad, comburencia y la reactividad (el agua no se quema) (mientras que el alcohol lo hace fácilmente) (el aire es comburente para cualquier combustible) V.CLASIFICACIÓN DE LA MATERIA: 1. Sustancia: todo aquello que posee masa y volumen. Tiene composición y propiedades definidas constante e invariable. Todas las muestras de una sustancia tienen las mismas propiedades. Se clasifican en: 1.1. Elementos: son aquellos que no se pueden descomponer en otras más sencillas por procesos químicos. Ejem. C, Ag, S, N. 1.2. Compuestos: Sustancia constituida por dos o más tipos de elementos diferentes en una relación deprimida. Puede descomponerse por medios químicos en elementos. Se le representa por una fórmula. Las combinaciones entres sustancias se denominan: reacciones químicas. Ejem: H2O, HCl, etc. 2. Mezcla: Materia conformada por 2 o más sustancias en proporciones variables (aunque puede determinarse su composición) no se le puede representar por una formula química. Los componentes de una mezcla se pueden separar por medios físicos. Los componentes al formar mezcla no pierdan su identidad, es decir no se transforman en nuevas sustancias. Se clasifican en: homogéneas y heterogéneas. 2.1. Mezcla Homogénea: mezclas que presentar una sola fase. Se denominan soluciones. Ejem: azúcar disuelto en agua, también se le denomina: solución. 2.2. Mezcla Heterogénea: mezclas que no presenta uniformidad de las propiedades en toda su extensión, es decir presenta 2 o más fases Ejem: granito, limaduras de hierro y otro, etc. SEPARACIÓN DE SUS COMPONENTES DE UNA MEZCLA 1. SEPARACIÓN DE SOLIDOS: ✓ Tamizado: separación de polvo fino y grueso ✓ Levigación: separación de un mineral de la ganga. 2. SEPARACIÓN DE LÍQUIDO-SOLIDO: ✓ Decantación: separación de arena y agua. ✓ Sifón: proceso que sigue a la decantación, o sea extracción del líquido dejando el sólido. ✓ Filtración: separación de las semillas del extracto de una fruta. ✓ Centrifugación: separación de los precipitados de una mezcla. 3. SEPARACIÓN DE LÍQUIDOS: ✓ Líquidos no miscibles: agua y éter de petróleo (sifón, pipeta, embudo de decantación) ✓ Líquidos miscibles: agua y etanol (destilación fraccionada) 4. SEPARACIÓN DE GASES: ✓ LICUEFACIÓN: por medio de elevadas presiones y temperaturas bajas. VI.CAMBIOS DE LA MATERIA: 1. CAMBIOS FÍSICOS: son aquellos que ocurren sin que se produzca alteración en la composición química de la materia. Se cambia la forma, el tamaño, Ejem. los líquidos se evaporan, la fusión de un sólido, etc. En ninguno de estos casos la materia ha perdido su identidad. 2. CAMBIOS QUÍMICOS: son aquellos que siempre alteran la composición de la materia. El proceso se denomina Reacción Química y se forman sustancias diferentes con nuevas propiedades Ejem: cuando quemamos papel (combustión). VII.BIBLIOGRAFIA: 1. https://drive.google.com/open?id=1vOyeM7kfE8fIwxH7DgdJwX838WyFKMo_ 2. https://drive.google.com/open?id=15VPywWjy3NSEGeKJwRaPVAAh8loUVGDX 3. https://drive.google.com/open?id=1etoH2Qhtf4Vb81byDVd-JTd-beSCt9yV