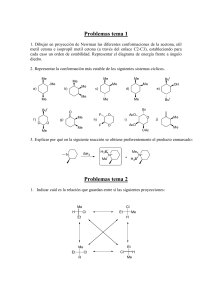
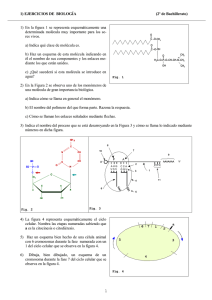
SINTESIS QUIMICA La síntesis de moléculas orgánicas ha sido un campo de trabajo científico por más de un siglo. A pesar de ello, solo una pequeña cantidad de las infinitas variantes de compuestos orgánicos ha sido preparada y estudiada. Durante el último siglo nuestra capacidad de construir moléculas complejas ha aumentado considerablemente y sigue creciendo a medida que se descubren o inventan nuevas reacciones, se mejoran otras conocidas y se comprenden mejor los mecanismos involucrados. Debido a la complejidad de las moléculas orgánicas, su construcción eficiente requiere (salvo en casos muy simples) de varias etapas, cada una de las cuales usa reacciones químicas que llevan especificamente a una estructura. Existe un número muy grande de reacciones conocidas y una gran diversidad de compuestos orgánicos posibles (conocidos o no); ésto da lugar a la metodología química actual. Hoy la síntesis de compuestos orgánicos usa reacciones y reactivos que involucran a más de 60 elementos aunque solo 1 docena de ellos están presentes comunmente en las moléculas orgánicas de interés comercial o biológico. Desde el punto de vista de la síntesis química, los factores que hacen difícil la planificación y ejecución de un esquema de síntesis particular son los mismos que dan lugar a la complejidad estructural. Esos elementos de complejidad pueden resumirse en: tamaño molecular contenido de elementos y grupos funcionales conectividad cíclica contenido de estereocentros reactividad química inestabilidad estructural La síntesis de una molécula compleja requiere desarrollar un esquema de síntesis factible que en general consistirá en una serie de intermediarios sintéticos conectados por reacciones posibles para realizar las interconversiones. Para ello se deberán examinar muchos esquemas posibles y luego analizar las reacciones involucradas, los posibles reactivos y condiciones de reacción, etc. antes de comenzar la fase experimental. Allí surgirán nuevos problemas a resolver, ya que muchas reacciones standard y reactivos conocidos pueden fallar en estructuras complejas y así deberán desarrollarse nuevos procesos o modificaciones de los conocidos. También se requiere ajustar las condiciones de cada paso de reacción, una tarea que insume mucho tiempo. A pesar que la implementación práctica de un esquema de síntesis suele llevar mucho más tiempo que su planeamiento, el invertir más tiempo en esa primer etapa puede resultar en un gran ahorro de tiempo y esfuerzo en la etapa práctica evitando seguir líneas que puedan llevarnos a puntos sin salida. Cuales son los motivos que nos llevan a sintetizar compuestos orgánicos? 1) Por el desafío que implica 2) Confirmar la estructura y/o estereoquímica propuesta para un producto natural 3) Obtener cantidades importantes de un producto natural que se aisla en pequeñas cantidades o cuya fuente natural es de difícil renovación (caso del taxol) por ejemplo para realizar estudios detallados de actividad biológica, o en el caso de un producto natural de interés comercial simplemente porque su obtención de fuentes naturales resulte un proceso que no es práctico desde el punto de vista comercial. 4) Para obtener nuevos análogos de un compuesto natural que presenta alguna propiedad de interés en busca de mejorar esa propiedad (muy usado en la industria farmacéutica). 5) Para obtener una nueva estructura a la que teoricamente se le predicen determinadas propiedades/actividades (muy usado en el diseño de nuevos fármacos, polímeros, etc.) El objetivo en cualquier síntesis es obtener el producto deseado (la molécula blanco) en forma pura por el procedimiento más eficiente y conveniente posible. Si el proceso de síntesis será utilizado comercialmente también deberemos considerar el costo de los reactivos y los residuos y efluentes que deberán descartarse. El esquema de síntesis debe tener el menor número de pasos posibles, ya que el rendimiento total cae rapidamente a medida que aumenta el número de pasos. La secuencia de reacciones que se use en una síntesis puede ser lineal o convergente A 90% B 90% C 90% D 90% E 7 R = 0,90 x 100 90% F 90% G 90% H producto (47,8%) 90% A 90% B 90% C 90% D producto 90% E 90% (72,9%) F G 90% R = 0,903 x 100 H Evidentemente la estrategia convergente es más eficiente porque la distancia en pasos entre los materiales de partida y el producto final se reduce. Pensemos además que en el caso lineal si no hacemos ninguna purificación intermedia, nuestro producto final estará mezclado con una gran cantidad de impurezas (intermediarios sin reaccionar, productos secundarios, etc.) Si sintetizamos un polipéptido de 64 aa uniendo los aminoácidos secuencialmente uno a uno, en el caso ideal de rendimientos del 90% por etapa, tendremos un rendimiento final de 0,13% (y 99,87% de impurezas!) mientras que la síntesis convergente daría 53%. Si el rendimiento fuera 85% por etapa tendremos 0,004% para la lineal y 37% para la convergente. Sin embargo en el caso de polipéptidos el acoplamiento de las unidades más grandes suele ser cada vez menos eficiente y por otra parte la síntesis lineal puede hacerse muy eficiente trabajando en fase sólida. En la práctica el esquema convergente “puro” no siempre es aplicable y es común usar una combinación de ambas estrategias. La síntesis total de un compuesto orgánico requeriría partir de los elementos. A partir de ellos podemos obtener compuestos orgánicos simples como urea, metano, metanol, acetileno y así siguiendo podemos ir construyendo estructuras cada vez más complejas. Sin embargo esto no es práctico ni necesario ya que existen una gran cantidad de compuestos orgánicos que están disponibles comercialmente y podemos usar como materiales de partida. Estrictamente todos ellos derivan de los elementos o pueden derivarse de ellos asi que cualquier síntesis que hagamos a partir de esas materias primas es “formalmente” una síntesis total. El concepto de síntesis total formal se ha extendido bastante y se acepta como tal cualquier proceso sintético que me permite unir un precursor de la molécula blanco (que ya fue convertido en ella por alguien) con algún compuesto cuya síntesis total se conoce. En la síntesis total de la quinina de Woodward y Doering, alcanzó con llegar al homomeroquineno, ya que su reconversión a quinina era conocida (Ver “Making Quinine from Scratch”, G. Stork et al. JACS, 123, 3239 (2001)) SINTESIS “TOTAL” DE LA QUININA H H N O N H H HO MeO N Rabe O 1918 H OMe MeO N N N quinina H quinotoxina Prelog 1943 CO2H O OH O H Woodward Doering H + H N Woodward Doering H N N H H 1944 N H homomeroquineno Ver: Stork et al., J. Am. Chem. Soc. 123, 3239 (2001) En muchos casos no es práctico ni necesario realizar una síntesis total ya que puede existir algún producto natural facilmente obtenible que puede utilizarse como material de partida. En este caso se habla de hemisíntesis o síntesis parcial. (TAXOL). Síntesis parcial de Taxol HO O O OH Ph AcO O NH O OH Potier HO H OH 1988 O AcO HO O Ph H HO AcO O OCOPh OCOPh 10-deacetil bacatin III (hojas de Taxus baccata) Taxol (corteza de Taxus brevifolia) aislamiento 1963-1971 0,014% de la corteza de Taxus brevifolia O t-BuO AcO O NH O estudios preclínicos 1977 informes de actividad antitumoral 1989-1991. OH Ventas USD 1000.000.000 en 1998 O Ph H OH AcO HO OCOPh Taxotere (análogo de síntesis) Rhone Poulenc 1996 O Un factor clave a tener en cuenta es la selectividad de las reacciones usadas y que control podemos tener sobre ella. La selectividad abarca diversos aspectos: Quimioselectividad: diferenciar entre grupos funcionales con reactividad química idéntica o similar CO2Et CO2Et NaBH4 HO O En general debemos planear la síntesis de modo de evitar que se generen grupos de idéntica reactividad que deban reaccionar en forma diferente en las etapas subsiguientes. Regioselectividad: diferenciar entre posiciones o regiones de una molécula con reactividad similar que darían lugar a isómeros estructurales. En general es un factor que puede controlarse por una elección cuidadosa de reactivos y condiciones. Hemos visto varios casos como adición 1,4 vs 1,2 en cetonas α,β-insaturadas, Calquilación vs O alquilación de compuestos carbonílicos, orientación en la SEAr, etc. Si un isómero predomina sobre el otro la reacción es regioselectiva, si solo se obtiene uno de los posibles es regioespecífica. Estereoselectividad: se refiere a la obtención preponderante de un estereoisómero frente a otro. Si además, cual es el estereoisómero que se obtiene depende de la estereoisomería del material de partida la reacción es estereoespecífica. Todas las reacciones estereoespecíficas son estereoselectivas pero la inversa no es cierta. Una reacción realizada sobre un compuesto que no tiene estereoisómeros puede ser estereoselectiva pero NO estereoespecífica H3C CH3 H2 H H3C H estereoselectiva pero NO estereoespecífica CH3 Podemos hacer la siguiente subdivisión: diasteroselectividad: se refiere a la obtención predominante de un diasterómero (o un par de enanteómeros) frente a otro. Si el diasterómero formado depende de la estereoisomería del material de partida la reacción es diasteroespecífica. HO2C HO2C Br2 Br CO2H CO2H CO2H H Br H Br CO2H H Br2 H Br CO2H Br CO2H H CO2H CO2H H Br diasteroselectiva y diasteroespecífica enanteoselectividad: se refiere al control de la estereoquímica absoluta, es decir la obtención preferencial de un enanteómero frente a otro. Este tipo de reacciones requiere que el material de partida o alguno de las reactivos sea quiral. Si un enanteómero da una estereoquímica y el otro la opuesta la reacción es enanteoespecífica. H OTs CN NC - R H OTs H CN- NC S S H R enanteoselectiva y enanteoespecífica En sistemas cíclicos el control de la estereoselectividad y estereoespecificidad es más fácil, porque la rigidez de la molécula mantiene a los sustituyentes en disposiciones espaciales fijas: H3C H O H H3C Me2CuLi H O H H3C mayoritario H Hay moléculas que sin ser quirales presentan caras que son una la imagen especular de la otra (llamadas enanteotópicas) y que en consecuencia según de que lado ataque un reactivo podrán dar uno u otro enanteómero. Por ejemplo: O H MeMgBr CH2CH3 H3C OH + CH2CH3 H HO CH3 H CH2CH3 El Grignard no es capaz de distinguir entre ambas caras y obtenemos el racemato. Sin embargo un reactivo quiral puede “ver” la diferencia y en vez de dar los dos diasterómeros dar predominantemente uno. También puede lograrse evidenciar la diferencia usando un catalizador quiral o un auxiliar quiral que se coordine con una cara de la molécula en forma preferencial a la otra. Como hace un químico para encontrar la ruta para la síntesis de una molécula estructuralmente compleja? La metodología ha cambiado con el tiempo y eso ha permitido acceder a moléculas cada vez más complejas. En estructuras simples, un pensamiento asociativo o por analogía suele ser suficiente y esto se observa en las síntesis realizadas entre fines del siglo XIX y principios del siglo XX que se basaban principalmente en la disponibilidad de materiales de partida que contuvieran una porción significativa de la molécula final. CH3 N O OH α-terpineol (Perkin 1904) alcanfor (Komppa 1903 Perkin 1904) O tropinona (Robinson 1917) Entre 1920 y 1945 se lograron síntesis de moléculas más complejas que se basaron en el conocimiento de reacciones para formar moléculas policíclicas y en un planeamiento detallado que permitiera aplicar esos métodos. 1920-1950 N O N Fe N OH OH HO N H N HCl HO equilenina (Bachman 1939) CO2H HO2C clorhidrato de piridoxina (Folkers 1939) Hemina (Fischer 1929) H H N OH H HO MeO vitamina A (Isler 1949) N quinina (Woodward y Doering 1944) Después de la 2da Guerra Mundial y hasta 1960 se pasó a otro nivel de sofisticación gracias a la formulación de los mecanismos electrónicos de las reacciones orgánicas, la introducción del análisis conformacional, el desarrollo de métodos espectroscópicos, el uso de métodos cromatográficos de análisis y separación y el descubrimiento y aplicación de nuevos reactivos selectivos. 1950-1960 OH H O O N OH OH H H O H O H H cortisona (Woodward y Robinson 1951) MeO H morfina (Gates 1956) N N H H MeO cedrol (Stork 1955) OH H H O H OMe O N H OMe OMe reserpina (Woodward 1956) H OMe O O N O H estricnina Woodward 1954 Muchas de estas síntesis que tenían 20 o más pasos fueron posibles gracias a la evaluación previa de cada paso basada en el conocimiento de mecanismos de reacción, intermediarios reactivos, efectos estéricos y electrónicos en la reactividad, efectos conformacionales y estereoelectrónicos. A pesar de ello en esa época cada problema sintético se encaraba como un caso especial y con un análisis individualizado. Se hacía mucho uso de la intuición y no se aplicaban técnicas generales de solución de problemas. En la actualidad las síntesis se planean cuidadosamente siguiendo una metodología más racional y basada en estrategias generales. Así se han logrado las síntesis de moléculas extremadamente complejas. Síntesis recientes OH Holton 1994 (-) borneol O Ph OTBS AcO O NH O OH Nicolau Ph 1994 O H OH HO NNHSO2Ar AcO OCOPh Taxol (corteza de Taxus brevifolia) O Danishefsky 1996 O cetona de Wieland-Miescher http://www.bris.ac.uk/Depts/Chemistry/MOTM/taxol/taxol.htm O ESTRATEGIAS DE SINTESIS En el planeamiento de la síntesis de un producto debemos tener en cuenta: -la formación de las uniones C-C y C-heteroátomo que llevan al esqueleto de la molécula -la introducción, interconversión y/o eliminación de grupos funcionales -los problemas estereoquímicos Si bien tomamos inicialmente estos aspectos como independientes en las etapas iniciales del planeamiento, en algún punto más avanzado del análisis deberemos considerar su interacción. Podemos formular una regla de máxima simplicidad que dice que debe existir la máxima correlación entre las diferentes operaciones sintéticas individuales de manera que cada una permita, facilite o simplifique a las demás. Antes de comenzar a elaborar un plan, debemos: -conocer los detalles estructurales de la molécula a sintetizar (modelado molecular) -conocer los antecedentes químicos de la molécula (si es conocida) o de compuestos relacionados, especialmente su reactividad, estabilidad y comportamiento en distintas condiciones de reacción Durante la preparación de un plan de síntesis debemos tener en cuenta: -La posibilidad de realizar un paso de síntesis debe ser alta (minimizar reacciones competitivas) -Existencia de caminos/procedimientos alternativos para cada paso -Cumplir la regla de máxima simplicidad Una forma de aproximación al diseño de una síntesis es elegir un material de partida que tenga alguna relación estructural con nuestro objetivo (o con una parte de él) y usando la experiencia y el conocimiento de reacciones orgánicas armar una secuencia de pasos que permita la conversión. Esta aproximación hacia delante solo es aplicable a casos sencillos y aún asi puede dar lugar a secuencias poco eficientes. Por ejemplo si queremos sintetizar ácido 3-fenilpropanoico, podemos pensar en salir de un derivado del benceno con una cadena lateral funcionalizada como benzaldehido, y hacerla “crecer” en 2 C: CHO CH (CO Et) 2 2 2 H CO2Et C CO2Et H + H CO2H C C H H2 cat CO2H Sin embargo cuando la molécula es más compleja, encontrar el material de partida apropiado puede no ser tan obvio. En ese caso la estrategia que se sigue es una de análisis hacia atrás, es decir de productos a reactivos que se denomina análisis retrosintético. La metodología consiste en “desarmar” gradualmente el producto rompiendo uniones (uniones estratégicas) para dar fragmentos más simples que llamamos bloques de construcción o sintones. La operación de romper uniones se denomina desconexión y se efectúa siguiendo ciertas reglas lo que permite una aproximación más racional y sistematizada a resolver el problema. Luego de una desconexión, nos encontraremos con fragmentos o estructuras más simples que nuestro objetivo, cada uno de los cuales se somete a un nuevo análisis y a una nueva desconexión que dará lugar a fragmentos o estructuras aún más simples y así sucesivamente hasta llegar a estructuras que coinciden con algún compuesto accesible comercialmente (o cuya síntesis está descripta a partir de precursores comerciales) que será entonces nuestro material de partida. Esta sucesión de desconexiones da lugar a un árbol sintético que recorrido en sentido inverso nos llevará del material de partida al objetivo sintético. En general no hay un único camino retrosintético posible y esto es especialmente cierto en moléculas complejas. La conversión de una molécula en sus precursores sintéticos se consigue por medio de una transformación que es la inversa de una reacción sintética y se indica con una flecha de doble trazo: OH CHO CHO + + CHO transformación aldólica transformación Diels Alder Además de las transformaciones de desconexión que simplifican la estructura usaremos otras transformaciones que si bien no cambian la complejidad estructural dan las características de reactividad a los distintos fragmentos para poder realizar las desconexiones. Estas son las interconversiones de grupo funcionales (IGF): CHO transformación hidrogenación CH2OH transformación oxidación Tampoco modifican la complejidad estructural las transformaciones que conectan o reordenan el esqueleto de la molécula y las que invierten o transfieren estereocentros. Por último hay transformaciones que aumentan la complejidad, por ejemplo agregando grupos funcionales (AGF). Estas generalmente involucran en el sentido sintético la eliminación de algún grupo que se usó para proveer estereo- o regio- control: NH2 Br Br Br Br AGF NH2 NO2 Br Br IGF Desconexiones Cuando realizamos una desconexión, los fragmentos ideales que se forman se denominan sintones. Esos sintones deben reemplazarse por reactivos reales cuando el proceso se lleve a cabo en el sentido sintético. En la desconexión, la ruptura del enlace puede hacerse en forma heterolítica lo cual da lugar a fragmentos cargados o bien homolítica si la reacción sintética corresponde a una reacción radicalaria o pericíclica OH CH3CH2CH CH2CO2H OH CH3CH2CH+ OH CH3CH2CH CH2CO2H OH CH3CH2CH- - CH2 + CH2 CO2H factible CO2H no factible La desconexión debe llevar a cationes/aniones estabilizados por efecto inductivo o resonancia, la estabilidad del sintón da preferencia a una desconexión sobre otra. La desconexión debe basarse en un mecanismo razonable de formación de enlaces La desconexión que conduce a dos fragmentos grandes es preferible a la que conduce a uno grande y uno pequeño (principio de máxima simplificación) La desconexión que conduce a dos fragmentos iguales (simetría) es preferible sobre las demás. Es conveniente realizar desconexiones en los puntos de ramificación y en las proximidades de un grupo funcional (este también puede agregarse previo a la desconexión) OH OH Una vez establecidos los sintones debemos buscar su equivalente sintético y el reactivo que los genera: - CH2 CO2H sintón OH CH3CH2CH+ sintón CH2 O-+Li COEt equivalente sintético OH CH3CH2CH equivalente sintético BrMg sintón CH2CO2Et + LDA equivalente sintético reactivos CH3CH2CHO reactivos Br + Mg reactivos Retrones y sintones En la terminología de la retrosíntesis, del mismo modo que el sintón identifica a las porciones que darán lugar a una reacción determinada, el retrón identifica en la molécula blanco la posible transformación: Desconexiones: Blanco Retrón precursores O HO C C C CO2tBu PhCHO CO2tBu OH Ph O O C C C C C Ph O Ph Ph O O O CO2Me CO2Me O O O O O O N C C C Me2N O Me2NH O H2CO O R C C Et O C Et2CuLi Remoción de grupos funcionales (desconexiones C-X) OMe OMe Br OH OH Br OH OH GRUPOS PROTECTORES En el diseño de una síntesis de una molécula con varios grupos funcionales, es común que un reactivo que produce una transformación sobre un grupo funcional afecte también a otro en otra parte de la molécula. En esos casos en que no podemos lograr un quimioselectividad adecuada, el grupo que debe permanecer inalterado se protege convirtiéndolo temporalmente en una funcionalidad inerte a las condiciones de la reacción. Esa protección debe satisfacer tres requisitos básicos: La reacción debe tener buen rendimiento y ser quimioselectiva El nuevo grupo funcional debe ser estable en las condiciones de reacción El grupo funcional original debe poder regenerarse con buen rendimiento y sin afectar al resto de la molécula La funcionalidad introducida no debe agregar centros quirales a la molécula que puedan generar diasterómeros. No existe en la práctica un grupo protector ideal para cada funcionalidad, si existe una gran batería de protectores posibles cada uno de los cuales cumple las condiciones anteriores en determinadas circunstancias. Grupo Aldehido/cetona Protector acetal ácidos éster alcohol alquil éter silil éter éster dioles acetal aminas amidas tioles tioésteres Resistente a bases, nucleófilos, oxidantes, reductores ac y bases débiles, electrófilos ác y bases, oxidantes reductores, nucleófilos, electrófilos débiles bases, oxidantes reductores, nucleófilos ac y bases débiles, electrófilos bases, nucleófilos, oxidantes, reductores ac y bases débiles, electrófilos electrófilos El uso de protectores debe reducirse al mínimo y su elección debe ser tal que no se requiera reemplazarlos a lo largo de la síntesis ya que los pasos de introducción y remoción suman costo y trabajo a la síntesis y disminuyen el rendimiento.
Anuncio
Documentos relacionados
Descargar
Anuncio
Añadir este documento a la recogida (s)
Puede agregar este documento a su colección de estudio (s)
Iniciar sesión Disponible sólo para usuarios autorizadosAñadir a este documento guardado
Puede agregar este documento a su lista guardada
Iniciar sesión Disponible sólo para usuarios autorizados