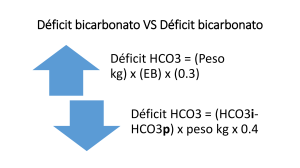
Equilibrio ácido base Se denomina al balance que mantiene al organismo entre ácidos y bases con el objetivo de mantener un pH constante (pH 7 aprox.). Con el fin de mantener las reacciones químicas (ya que producen y consumen H+) Es el log negativo de la concentración de H+, el pH sanguíneo va de 7.35 a 7.45 ↑ 𝐻 + = 𝑝𝐻 ↓ ↓ 𝐻 + = 𝑝𝐻 ↑ Se sugiere que la regulación ácido-base se refiere a la homeostasis del ion H+, a partir de esto se da a conocer los conceptos sig: Base: Es un aceptor de iones Ácido: Es un donador de iones Debido a que los ácidos tienen una mayor [H+] el pH de un ácido será menor a 7, si las bases tienen una menor [H+] su pH será mayor que 7. El metabolismo completo de los alimentos produce CO2 y H2O que se ioniza en H+ y HCO3-, su combustión incompleta genera ácidos pirúvicos, láctico y acético. Las grasas producen ácidos grasos, y los aminoácidos en cetoácidos. Mecanismos reguladores del pH 1.- Amortiguadores químicos de los líquidos corporales: la neutralización extracelular ocurre inmediatamente, la intracelular ocurre en un periodo de varias horas por la difusión de H+. 2.- Mecanismo regulador respiratorio: ayuda a eliminar y regula el CO2 y HCO3, de acción rápida. 3.- Mecanismo de regulación renal: eliminan exceso de ácidos o bases. - Regulación sanguínea El buffer consiste en una mezcla de ácido o base débil llamado par amortiguador al disociarse produce el ion común, en conjunto de que puede aceptar protones, así mismo la disminución de ácido conjugado es igual a la cantidad de base conjugada formada y viceversa. El pH de una solución amortiguadora puede calcularse mediante la ecuación de Henderson Haselbach que es una forma de expresara la ley de acción de masas: Esta ley indica que la reacción directa de V1 (a la derecha) es mayor si aumenta A o B; o disminuye C o D; la reacción inversa de V2 (a la izquierda) es mayor si aumenta C o D; o disminuye A o B. En el equilibrio la velocidad de la reaccion directa e inversason iguales y dependen de la constante de equilibrio [Keq]. - Amortiguadores químicos del cuerpo Un amortiguador solo es útil en un intervalo de pH que no varié más allá de una unidad de su pKa, por ello existen 4 sistemas amortiguadores que son: 1) Sistema CO2/HCO3 que actúa principalmente en el espacio extracelular; resalta su importancia por que la producción de CO2 en los tejidos es constante, su transporte por la circulación en forma de HCO3 y la concentración de HCO3 se mantiene constante por la eliminación alveolar de las hemoglobinas. Lo que se considera como ácido es el CO2 que realmente es el anhídrido del ácido que reacciona con el agua para formar HCO3. En los eritrocitos el CO2 con el agua reacciona por la acción de la anhidrasa carbónica, en cambio la ionización del acido carbónico es una reacción rápida y espontánea. 2) Sistema de fosfatos, importante en el espacio intracelular, sobre todo en eritrocitos y células tubulares del riñón. 3) El sistema de las proteínas que actúa a nivel tisular y plasma 4) Sistema amortiguador de las hemoglobinas. Este debe su efecto a la capacidad de disociación del grupo imidazólico de la histidina al Fe +; donde la hemoglobina reducida (HHb) se comporta como un ácido débil, a este punto el 20% de la HHb esta disociada y el 80% sin disociar. El transporte de CO2 producido a nivel celular viaja de diferentes formas: - Como CO2 disuelto en el plasma y en el interior del eritrocito - Combinada con agua por medio de la anhidrasa carbónica para formar ácido carbónico que luego se ioniza en iones H y HCO3 - En forma de compuestos carbamino al unirse con los residuos -NH2 terminales de las proteínas, principalmente con la hemoglobina, una molécula de CO2 por cada monómero. La hemoglobina oxigenada, es un ácido más fuerte que la Hb no oxigenada, de ahí que en la sangre venosa la HHb acepta iones H+ y el ácido carbónico viaja como bicarbonato. En la sangre arterial la HbO2 libera H+ que se combinan con HCO3- para dar H2CO3 que con acción de la anhidrasa carbónica pulmonar libera fácilmente CO2 y agua. 5) Mecanismos anfóteros: es la primer línea de acción amortiguadora los cuales cambian su carga y amortigua el cambio de pH realizando el principio isohídrico - Mecanismos de compensación pulmonar Es rápido ya que la eliminación de CO2 proveniente del H2CO3 se lleva a cabo eficazmente merced a la anhidrasa carbónica (enzima intereritrocitaria). 𝐶𝑂2 + 𝐻2 𝑂 ↔ 𝐻2 𝐶𝑂3 Como la reacción que forma carbaaminohemoglobina es libremente reversible el valor de la PCO2 es el factor que determina la cantidad de carbaaminohemoglobina. Cuando el pH de los líquidos cerebrales alcanza niveles cercanos a 7.2 los quimiorreceptores centrales del bulbo raquídeo estimulan la ventilación pulmonar, que produce una marcada hiperventilación pulmonar que es máxima cuado alcanza el valor de 7.0 Sí la [H2CO3] en la sangre aumenta, se produce un aumento en la [PCO2] del aire alveolar con la consecuente estimulación del centro respiratorio, condicionando una disminución de la PCO2 del aire alveolar. Llevando de nuevo a su relación HCO3/CO2 a su valor normal. - Regulación renal Estos van a regular el HCO3-, estos suelen ser más lentos pero eficaces y completos, son varios los mecanismos por los cuales se excreta H+ y retiene HCO3: 1) Reabsorción de bicarbonato: en el túbulo proximal se absorben aprox. 4500 mmoles de HCO3, la anhidrasa carbónica que cataliza la hidratación del CO2 en ácido carbónico se encuentra en las células epiteliales del túbulo proximal. El H2CO3 formado se disocia en HCO3- e H+. La secreción de H+ y la reabsorción de bicarbonato serán incrementados por cualquier proceso que aumente la concentración intracelular de H+. La deficiencia de K+ y la hipercapnia ocasionan una reabsorción de HCO3 El estado de volumen extraceluar (VEC) afecta la reabsorción de HCO3 si esta expandido la reabsorción se inhibe, si esta contraído la reabsorción de Na+ con HBO3- (efecto mediado por la aldosterona) 2) Acidificación de la orina: los ácidos débiles se eliminan bajo la forma de fosfato monosódico. En el LEC a pH 7.4 la relación HPO4/ H2PO4 , pero en la orina a pH bajo (5.4)se eliminan grandes cantidades de NAH2PO4 invirtiendo la relación HPO4/ H2PO4, este proceso se le llama acides titulable. La acides titulable se refiere a la cantidad de H+ que se pierden en forma de aniones de ácidos débiles. Ya que el H2PO4- no se reabsorbe. 3) Producción de amonio: se debe a la hidrolisis de glutamina que es la fuente principal de amoniaco (-NH3. El amoniaco es una base débil que difunde libremente a través de las membranas celulares y capta iones amonio 𝑁𝐻3 + 𝐻 ↔ 𝑁𝐻4+ El amonio (NH4) no difunde a través de las membranas celulares y su concentración depende del pH de los compartimientos; dos factores determinan su excreción: 1° Lo constituye el pH urinario; conforme el pH urinaro disminuye mas amoniaco (NH3-) es producido en el lumen tubular para formar amonio y eliminarlo en la orina. 2° Lo constituye la acidosis metabólica crónica que estimula la utilización renal de glutamina que favorece la producción de amoniaco y aumenta la excreción de amonio. HCO3 que es bicarbonato producido por los riñones y el PCO2 producido por el pulmón. Trastorno en el HCO3 se le llama: trastorno metabólico Trastorno en el PCO2 se le llama: trastorno respiratorio La relación que tiene el HCO3, PCO2 con los H+ es el siguiente: ↑ 𝐻𝐶𝑂3 = 𝐻+ ↓ ↓ 𝐻𝐶𝑂3 = 𝐻+ ↑ ↑ 𝑃𝐶𝑂2 = 𝐻 +↑ ↓ 𝑃𝐶𝑂2 = 𝐻+↓ Es el deceso del pH sanguíneo, que de acuerdo con la ecuación de Henderson Hasellbach los cambios del PH plasmático se deben a las diferentes concentraciones plasmáticas de bicarbonato (alteraciones metabólicas) o de PCO2 (alteraciones respiratorias). Son cuatro las alteraciones del equilibrio ácido base: 1) Acidosis metabólica 2) Alcalosis metabólica Alcalosis respiratoria Los trastornos del desequilibrio acido-base pueden ser primarios o simples cuando existe una sola alteración precipitante; uno mixto es aquel con dos o más alteraciones diferentes. Se empieza a hacer uso de mecanismos compensatorios, su principio de ellos es si una condición anormal a alterado alguno de los términos de relación HCO 3/PCO2 el pH del plasma se puede reajustar a un valor normal, pero este no implica el reajuste de los ya mencionados. Así el px muestra señales de compensación y mantenerla (acidosis o alcalosis compensada) o mostrar señales de descompensación (alcalosis o acidosis descompensada. Acidosis Se le llama acidosis a cualquier trastorno acido base donde se observe disminución del pH plasmático y disminución en la relación HCO3/CO2. Se pueden clasificar de acuerdo con su causa en: - Acidosis metabólica: Se caracteriza por una disminución en la concentración plasmática de HCO3- , esto puede suceder por el aumento de H+ que consume HCO3- por el proceso de neutralización. El aumento de H+ ocurre por la producción elevada de acetoacético y el Bhidroxibutírico (cetonas) producidos en la cetoacidosis diabética y cetosis del ayuno prolongado, producción de ácido láctico (acidosis láctica del ejercicio muscular anaeróbico), choque, hipoxia, infecciones agudas, intoxicación por fenformín, colapso circulatorio. También ocurre por aumento exógeno de ácidos como en la ingesta de sustancias acidas como el cloruro de amonio. Por la perdida de sustancias alcalinas como HCO3 (diarrea, pancreatitis, inhibidores de la anhidrasa carbónica. En la acidosis metabólica la orina se acidifica excepto en la provocada por la IR en el cual los mecanismos de compensación no son posibles reteniendo aniones como Cl- generando la acidosis metabólica hiperclorémica. Al elevarse la concentración de H+, a nivel de bicarbonato se producen los siguientes cambios: 1) Al desplazarse la reacción a la derecha por aumento de H+, se consume HCO3 provoca su desplazamiento hacia la izquierda con la disminución de HCO3. Altera la relación HCO3-/CO2. ↑ 𝐻+= 𝐻𝐶𝑂3 ↓ Al elevarse el acido carbónico, produce un incremento en la PCO2 que estimula el centro respiratorio, donde la respuesta compensatoria pulmonar es una hiperventilación (signo inicial de la acidosis metabólica). ↑ 𝐻2𝐶𝑂3 ↔ 𝐻20 + 𝐶𝑂2 ↑ La respuesta renal, que es de desarrollo lento se presenta por fatiga muscular a los 4 días. 2) Perdida de bicarbonato u otras enfermedades causa acidosis metabólica con ácido carbónico normal, pero disminución de bicarbonato. - Brecha aniónica Es la diferencia que existe entre la concentración plasmática donde compara la concentración de Na y K en individuos normales es mayor que la del Cl y el HCO3. 𝑁𝑎+ − 𝐶𝑙 − + 𝐻𝐶𝑂3 La acidosis metabólica sin cambio en la brecha anionica se debe a la acumulación de H+ de Cl- o a una disminución de HCO3 - Acidosis respiratoria Se presenta cuando existe una falla en la eliminación de CO2, se presenta bajo dos formas: 1) Aguda: cuando el tiempo de instalación es breve y no permite la compensación renal. 2) Crónica: cuando el tiempo de evolución es mayor y permite el mecanismo de compensación renal. Por la ley de acción de masas se desplaza la reacción de formación de HCO3, elevando sus valores. La alteración de H2CO3 altera la reacción HCO3/CO2 A continuación, se muestran las causas de acidosis respiratoria: Alcalosis Se considera alcalosis a cualquier cambio en la relación HCO3/CO2 que tienda a elevar su valor normal y que modifique el pH > 7.4. - Alcalosis metabólica Aumento de HCO3 ya sea por administración excesiva de álcalis (exógenos), por su producción excesiva (endógena) o por la pérdida de H+. El HCO3 por hidrolisis produce una base fuerte y un ácido débil: 𝑁𝑎𝐻𝐶𝑂3 + 𝐻2 𝑂 → 𝑁𝑎𝑂𝐻 + 𝐻2 𝐶𝑂3 La perdida de H+ por diarreas y vómitos también condiciona la perdida de K+ causa alcalosis metabólica con hipopotasemia. Para compensar la alcalosis la FR disminuye y aumenta la PCO2, con lo que el pH tiende a disminuir, la compensación renal disminuye la reabsorción de bicarbonato formando orina alcalina -Alcalosis respiratoria Se presenta cuando la difusión respiratoria provoca un aumento del pH plasmático, se presenta de dos formas: 1) Aguda: por ansiedad o ingesta de salicilatos, de duración breve sin tiempos de mecanismos compensatorios renales. 2) Crónica: hiperventilación debida a hipoxia o al estímulo de la respiración como en el embarazo y el coma hepático. Gasometría Estudio que sirve para identificar una alteración acido-base o de propiedad respiratoria. Valores de la gasometría Sangre arterial pH 7.35 – 7.45 HCO3 19-26 mmol/L PCO2 35-45 mmHg PO2 70-100 mmol/L CO2 23-28 mmol/L SO2 88-100% (periférica) Lactato < 2mmol/L (<16mg/L) Excesos de base +/- 2 Hb 12-16 g/dL Hto 37-47% Glucosa 70-100 mg/dL Sangre venosa 7.32 – 7.42 19-26 mmol/L 38-52 mmHg 24-48 mmol/L ------------------40-70% < 2mmol/L +/- 2 ------------------------------------------------------ Electrolitos Na+ K+ ClCa+ LIC 14.5 mM 5 +/- mEq/L 100 +/- 5 mEq/L 4mEq/L LEC 145 +/- 10 mM 120 mEq/L 25 mEq/L 0.0005 mEq/L Para la evaluación ácido-base: 1.- pH: valores mayores a 7.4 es alcalosis (> 7.45 es alcalemia); valores menores a 7.4 es acidosis (< 7.35 es acidemia). Puede existir una acidosis con el pH normal. 2.- PCO2/mmHg: valores > 45 mmHg se considera una acidosis respiratoria; < 35 mmHg es una alcalosis respiratoria (como trastorno primario o situación compensadora). 3.- HCO3: > 26 mmHg se tiene una alcalosis metabólica; < 22 mmHg es una acidosis metabólica (como trastorno primario o situación compensadora). 𝑃𝑥 𝑐𝑜𝑛 𝐴𝑐. 𝑚𝑒𝑡𝑎𝑏ó𝑙𝑖𝑐𝑎 ↔ 𝐴𝑙𝑐𝑎𝑙𝑜𝑠𝑖𝑠 𝑟𝑒𝑠𝑝𝑖𝑟𝑎𝑡𝑜𝑟𝑖𝑎 𝑃𝑥 𝑐𝑜𝑛 𝐴𝑙𝑐. 𝑚𝑒𝑡𝑎𝑏ó𝑙𝑖𝑐𝑎 ↔ 𝐴𝑐𝑖𝑑𝑜𝑠𝑖𝑠 𝑟𝑒𝑠𝑝𝑖𝑟𝑎𝑡𝑜𝑟𝑖𝑎 *Recordar: que el pH manda y que si el CO2 o el HCO3 están normales no se excluye una alteración ácido-base Anión Gap o brecha aniónica Diferencia entre aniones y cationes que es: 𝑁𝑎+ − 𝐶𝑙 − + 𝐻𝐶𝑂3 Su valor normal oscila entre 8-12 mEq Como resultado se tiene anión GAP elevado o normocloremico y anión GAP normal o hiperclorémica. - Si se piensa en alcalosis metabólica: hipocalemia, vómitos, diuréticos. Si piensa en acidosis respiratoria: broncoespasmo, enfermedades neuromusculares, sedantes. Si se piensa em alcalosis respiratoria: dolor, fiebre, sepsis etc. Fórmula de PCO2 esperado o formula de Winter: Para calcular cuanto a disminuido la PCO2 con respecto a la acidosis metabólica que presenta el paciente. 𝑃𝐶𝑂2 = 𝐻𝐶𝑂3 1.5 + 8 Al resultado se le da un rango +- 2 Acidosis metabólica compensada, resultado igual a la formula. Acidosis respiratoria el PCO2 medido, es mayor que la formula. Alcalosis respiratoria el PCO2 medido, es menor que la formula. PAFi Es la relación que hay entre la PAO2 y la FiO2 con la cual se tomó la gasometría 𝑃𝑂2 𝑥100 𝐹𝑖𝑂2 Sirve para ver si esta oxigenando correctamente la sangre y la función pulmonar, se clasifica en insuficiencia respiratoria, leve, moderada y severa Leve 300-200mmHg Moderada 200-100 mmHg Servera < 100 mmHg Moderada 14-11mEq Servera 10 mEq o menos Con respecto al bicarbonato Leve 15-18mEq Para ventilación mecánica se necesita saber si está < 150 mmHg