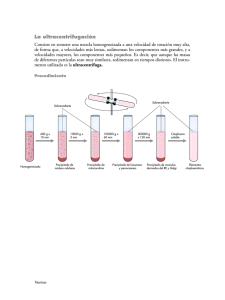
REPORTE N°1 IDENTIFICACIÓN DE LOS ELEMENTOS DEL GRUPO 3 1. OBJETIVOS - Identificar a los cationes pertenecientes al grupo 3. Separar los elementos del grupo 4. Conocer la importancia que tienes en su uso estos cationes. 2. FUNDAMENTO TEÓRICO En la solución guardada, luego de separar los elementos del grupo 2 del análisis sistemático, se hallan presentes: ácido nítrico y los cationes que no han precipitado hasta el momento y que están presentes en la muestra. La separación de elementos del grupo 3 se basa en la formación de compuestos “insolubles” que se forman entre los iones del grupo 3, en medio nítrico, por la adición de ácido clorhídrico, formando cloruros insolubles. Están comprendidos los cationes: Ag+, Hg22+, Pb+2 que precipitan como AgCl, HgCl y PbCl2, con ácido clorhídrico diluido (este último precipita parcialmente). 3. MATERIALES Y REACTIVOS 3.1. Materiales - Vaso precipitado de 50 ml - Centrifuga de 2000 a 3000 rpm - Tubos de ensayos - Gradilla para tubos - Cocina eléctrica 3.2.Reactivos - Solución de HCl 2 M - Solución de K2CrO4 0.5 M - Solución de KI 0.5 M - Solución de H2SO4 2 M - Solución de NH4OH 2 M 4. PROCEDIMIENTO Paso 1: A la disolución nítrica guardada, luego de separar los elementos del grupo 2, se traslada en un tubo de ensayo de 13 por 100 mm y se le añade suficientes gotas de solución de HCl 2M, hasta obtener la precipitación completa. Pb2+ + 2Cl- PbCl2 ↓ (blanco) Ag+ + Cl- AgCl ↓ (blanco) Hg+ + Cl- HgCl ↓ (blanco) Se agita constantemente el contenido del tubo mientras se agrupa la solución de HCl. Se deja reposar ligeramente y se agrega 1 gota más de HCl para observar si continúa precipitando. Colocar el tubo en la centrifuga y someter a centrifugación por 2 min a 2000 rpm y decantar la solución sobrenadante, la que se guarda para analizar en ella los elementos de los grupos 4,5 y 6. El precipitado que se produce puede ser blanco cuajoso, de AgCl, que tomo un color violáceo y después negro por exposición prolongada a la luz, o blanco cristalino, de PbCl2 o HgCl. Se lava dos veces con agua fría a ala que se añade una gota de HCl 2 M. En este precipitado se analizan los elementos del grupo 3. SEPARACION DEL PLOMO DE PLATA Y MERCURIO Paso 2: Tratar el precipitado con 2 ml de agua hirviendo, mantener a ebullición de 1 min y centrifugar, cuando el líquido aun esta caliente. Decantamos y luego pasar el líquido caliente a 3 tubo de ensayo para reconocer Pb+2 y dejar residuo para reconocer los iones Ag+ y Hg22+. ANALISIS DE IONES PLOMO (II) Paso 3: En un tubo de ensayo se coloca 0.5 ml de la solución caliente separada del paso 2. Al enfriar se obtiene un precipitado blanco, en forma de agujas, de cloruro de plomo, cuando la solución no es muy diluida. Paso 4: En un tubo de ensayo se coloca 0.5 ml de la solución caliente separada del paso 2. Se añaden 3 gotas de solución de cromato de potasio 0.5 M. la dormición de un precipitado amarillo indica la presencia de plomo. Pb2+ + CrO42- PbCrO4 ↓ (amarillo) Paso 5: En un tubo de ensayo se coloca 0.5 ml de la solución caliente separada del paso 2. Añadir 4 gotas de solución de yoduro de plomo, moderadamente soluble en agua caliente, obteniéndose una solución incolora de la que se separa por enfriamiento, en forma de laminillas de color amarillo. También es soluble en exceso de solución de yoduro de potasio formándose una sal compleja que se descompone por dilución, depositándose yoduro de plomo. Pb2+ + 2I- PbI2 ↓ (amarillo) Paso 6: En un tubo de ensayo se coloca 0.5 ml de solución caliente separada del paso 2. Añadir ácido sulfúrico diluido. Se produce un precipitado blanco de sulfato de plomo. Pb2+ + SO42- PbSO4 ↓ (blanco) ANALISIS DE IONES MERCURIO (I) Paso 7: Colocar en un tubo de ensayo la mitad del precipitado, luego de la centrifugación realiza en el paso 2. Añadirle amoniaco 2M, poniendo en contacto el precipitado con el reactivo. La formación de un precipitado negro inmediato indica la presencia de mercurio; reacción suficientemente sensible y especifica. Hg2Cl2 + 2NH4OH Hg(NH4)Cl + Hg ↓ (negro) + NH4Cl + H2O Se somete a centrifugación el precipitado formado y se descarta. La solución obtenida se decanta y se guarda par la identificación de plata. AgCl ↓ + 2NH4OH Ag(NH3)2Cl + 2H2 ANALISIS DE IONES DE PLATA (I) Paso 8: En un tubo de ensayo se coloca 0.5 ml de la disolución amoniacal se añade gotas de solución de ácido nítrico 3M hasta que se encuentre en medio acido (observar el papel indicador de tornasol). Si de la solución incolora cambia a formarse un precipitado blanco cuajoso, nos indica la presencia de plata, por la formación de un precipitado de cloruro de plata. [Ag(NH3)2]Cl + HNO3 AgCl ↓ (blanco) + 2NH4NO3 5. RESULTADOS 5.1. De las experiencias anteriores reporte la presencia o no, de los elementos del grupo 3 fundamentalmente las razones de sus resultados. Tabla N° 1 Reporte de los resultados del Análisis del grupo 3 ELEMENTO RESULTADO Pb Presencia Hg Presencia Ag Presencia RAZONES Tubo 1: Se formó precipitado amarillo con el KI, que significa presencia de Pb. Tubo 2: Se formó precipitado amarillo con el cromato, significado de presencia de Pb. Tubo 3: Se formó precipitado blanco pero en pequeña cantidad, por lo que hay poca presencia de Pb. Porque al añadirle amoniaco se forma un precipitado negro, que significa la presencia de Hg. Porque a la solución amoniacal al añadir el ácido nítrico rápidamente se forma un precipitado blanco lechoso, que significa presencia de Ag. 5.2. Cuestionario 1. En la precipitación de los elementos del grupo 3, ¿Influye o no la presencia del ácido nítrico para precipitarlos respectivos cloruros? Si influye ya que la presencia del grupo tres en medio nítrico por la adición conjunta con el ácido clorhídrico forman cloruros insolubles que están comprendidos en cationes y que precipitan como cloruros. 2. ¿Por qué se dice que no todo plomo no precipita en el grupo 3, junto a la plata y el ion mercurioso? Por qué el plomo se disuelve completamente en caliente (liquido), mientras que la plata y mercurio precipitan, esto significa que si o si precipitan para que haya presencia de cloruros de plata y mercurio. 3. ¿Qué semejanzas y diferencias encuentra en cuanto a las caracterizaciones de los compuestos formados, en la identificación de plomo, usando iones cromato y yoduro? - Cromato: que el precipitado es más abundante y la solución liquida es de color amarillo intenso. Yoduro: que el precipitado es poco y la solución liquida es amarillo no intenso. 4. ¿Cómo podemos diferenciar que en una muestra se halla iones mercurio sin la posibilidad de confundirnos que se encuentre iones plata? Se puede diferencia ya que el precipitado cuando hay iones mercurio es negro intenso, y el de la plata en similar pero un poco más plomo brillante. 5. ¿Cuál considera Ud. que es la reacción más adecuada para identificar iones plata en una muestra? [Ag(NH3)2]Cl + HNO3 AgCl ↓ (blanco) + 2NH4NO3 Ya que al agregar a la solución amoniacal ácido nítrico se forma el precipitado blanco, clara indicación de presencia de plata. 6. ¿Cuál considera Ud. que es la reacción menos adecuada para identificar la presencia de iones Hg? Hg2Cl2 + 2NH4OH Hg(NH4)Cl + Hg ↓ (negro) + NH4Cl + H2O Ya que al agregar amoniaco y llevarlo a la centrifuga se observa el precipitado negro, clara indicación de mercurio. 6. CONCLUSIONES - Se logró satisfactoriamente identificar los cationes pertenecientes al grupo tres en la práctica. Se separó los elementos 4, 5 y 6 y guardo la muestra que se utilizara para la siguiente práctica. Se logró reconocer la importancia de estos cationes y su uso mediante la práctica realizada, conjuntamente con las aportaciones del docente de laboratorio.