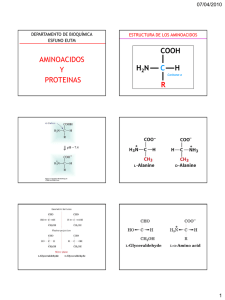
Berg • Tymoczko • Stryer Biochemistry Sixth Edition Cap 2 Composicion de Proteina y estructura Copyright © 2007 by W. H. Freeman and Company Cristales de insulina. Las cadenas de aminoacidos se pliegan en estructuras bien definidas (E terciaria) Hay varias propiedades que permiten a las proteínas tener una variedad de funciones. 1. Las proteinas estan formadas por la aminoacidos empalmados uno tras otro. La estructura dicta la función. Una proteína componente de la maquinaria de replicación del DNA rodea una sección de la doble hélice del DNA (cilindro). 2. Las proteinas pueden interaccionar ente si y con otras macromoleculas biologicas pra formar asociaciones complejas. Una asociación compleja de proteínas. Micrografia electronica de un corte de tejido de vuelo de un insecto constituido por una malla hexagonal con 2 tipos de filamentos proteicos. 3. Las proteínas tienen un amplio surtido de grupos funcionales. 4. Algunas proteínas son muy rígidas, mientras que otras presentan una considerable flexibilidad. Al unirse al hierro la proteína lactoferrina experimenta cambios conformacionales que permiten que otras moléculas distingan entre la forma libre y la forma unida al hierro. Los isomeros L y D de los aminoacidos. R = cadena lateral Los isomeros L y D son imágenes especulares entre si. En las proteinas solo se encuentran L-aminoácidos. Casi todos los L-aa tienen una configuracion absoluta S (latin sinister, izquierda). La direccion antihoraria de los sustituyentes de mayor a menor prioridad indica que el centro quiral es de la configuración S. El estado de ionización como función del pH. El estado de ionización de los aa se altera por un cambio en el pH. Cerca del pH biologico predomina la forma switterionica. Estructura de la Gly y Ala. Modelo de esferas y varillas. Fórmulas esteroquímicas. Las proyecciones de Fischer muestran todos los enlaces como perpendiculars para una repreesntacion simplificada. Aminoácidos con cadena lateral alifáticas. * = centro quiral adicional de la isoleucina Estructura cíclica de la Pro. Aminoácidos con cadenas laterales aromáticas. La Tyr y el Trp también tienen propiedades hidrofílicas debido a sus grupos –OH y –NH- respectivamente. Aminoácidos con grupos hidroxilo alifáticos. La Ser y la Thr tienen grupos OH que les dan carácter hidrofílico. Estructura de la Asn y la Gln, 2 aminoácidos polares con grupo carboxamida. La Cys tiene un sulfhidrilo. Grupos de la Arg y la His Los aminoácidos básicos Ionización de la His. La His puede captar o liberar protons alrededor del pH fisiologico. Reactividad indeseable en aa. Algunos aa son inapropiados para las proteínas debido a su ciclación indeseada. La HomoSer se puede ciclar en un anillo estable de 5 átomos, lo que puede romper el enlace peptídico. La ciclación de la Ser formaría un anillo tenso de 4 átomos desfavorecido. X puede ser un grupo amino de un aa vecino u otro grupo químico potencial. Estructura primaria: Los aa están unidos por enlaces peptídicos para formar cadenas polipeptidicas Las secuencias de aa tienen dirección. El pentapeptido, Leu-encefalina, es un péptido opiáceo que modula la percepcion del dolor. El péptido inverso, Leu-Phe-Gly-Gly-Tyr, es una molécula diferente que no muestra tales efectos. Componentes de una cadena polipetidica: Una cadena polipeptídica consta de una parte repetida regularmente, llamada la cadena principal o esqueleto (en negro), y una parte variable constituida por las cadenas laterales características (R en verde). Enlaces cruzados. La formación de un enlace disulfuro a partir de 2 residuos de Cys es una reacción de oxidación. Las proteinase tienen secuencias de aa especificas determinadas por los genes. Secuencia de aa de la Insulina bovina El enlace peptídico tiene un carácter parcial de doble enlace. Que Evita la rotacion a su alrededor y restringe la conformacion del esqueleto peptidico Los enlaces peptídicos son planos. En 2 aminoácidos unidos hay 6 átomos en un plano Longitudes de enlace en una unidad peptídica. La unidad en configuración trans. Enlaces peptídicos cis y trans. La forma trans esta favorecida debida a que los choques estéricos se dan mas en la forma cis. Los enlaces cis mas comunes se dan en las uniones X-Pro. Las energías de estas 2 formas son semejantes porque los choques estéricos se producen en las 2 conformaciones. Rotación alrededor de los enlaces de un polipéptido. La estructura de cada aa de un polipéptido se puede ajustar mediante la rotación alrededor de 2 enlaces sencillos. Fi ( ) es el angulo de rotación alrededor del enlace entre el átomo de N y el átomo de C alfa mientras que psi ( ) es el angulo de rotación alrededor del enlace entre el átomo de C alfa y el C carbonílico (C=O). Vista inferior del enlace entre el N yel C alfa, que muestra como se mide fi Vista superior del enlace entre el C alfa y el carbonilo, que muestracomo se mide psi. Diagrama de Ramachandran indica los valores de fi y psi. Las regiones mas favorables se muestran en verde oscuro; las regiones frontera se muestran en verde claro. La estructura de la derecha es desfavorable a causa de los choques estéricos. Estructura secundaria: Estructura de la a-hélice. Diagrama de Cintas que muestra los C alfa y las cadenas laterales (verde). Alfa hélice, vista lateral, en versión esferas y varillas, representa los puentes de H (líneas discontinuas) entre los grupos NH y CO Alfa hélice. Vista apical muestr el esqueleto enrollado como el interior de la hélice y las cadenas laterales (verde) proyectándose hacia afuera. Alfa hélice. Vista de esferas compactas muestra el núcleo interior de la hélice estrechamente empaquetada. Esquema de puentes de H para una hélice a. Diagrama de Ramachandran para las hélices. Las hélices dextrogiras y levógiras se encuentran en regiones de conformaciones permitidas en el diagrama de Ramachandran. Casi todas las hélices de las proteínas son dextrógiras. Vistas esquemáticas de alfa hélices. (A) Modelo de esferas y varillas. (B) Modelo de cintas. (C) Representación cilíndrica. Una proteína formada principalmente por alfahélices. La ferritina, una proteína de almacenamiento de hierro, esta formada por un haz de hélices alfa. Las hojas beta se estabilizan por puentes de H. Diagrama de Ramachandran para las hojas beta. El área roja muestra las conformaciones estéricas permitidas para las estructuras extendidas, tipo hebra beta. Estructura de una hebra beta. Las cadenas laterales (verde) alternan por encima y por debajo del plano de la hebra. Una hoja beta antiparalela. Las hebras b adyacentes transcurren en sentido opuesto. Los puentes de H entre los grupos NH y CO conectan cada aa con un único aa en la hebra opuesta, lo que estabiliza la estructura. Una hoja b paralela. Las hebras badyacentes transcurren en el mismo sentido. Los puentes de H conectan cada aa de una hebra con 2 aa diferentes de la hebra opuesta. Estructura de una hoja beta mixta. Una hoja b retorcida. (A) Modelo de esferas y varillas. (B) Modelo esquematico. (C) Vista esquemática virada 90 grados para apreciar el giro. Las proteínas que se unen a ácidos grasos son ricas en hojas-b Las cadenas polipeptídicas pueden cambiar de dirección por giros inversos y bucles. Estructura de un giro inverso. El grupo CO del residuo i de la cadena polipeptídica se une por puente de H al grupo NH del residuo i+3 para estabilizar el giro. Bucles en una superficie de proteína. Una molécula de anticuerpo que tiene bucles en la superficie (en rojo) que median las interacciones con otras moléculas. Una superhélice. (A) Modelo especial compacto. (B) Diagrama de cintas. En queratina Heptada repetida en una proteína con superenrollamientos. Cada séptimo residuo en cada hélice es Leu. Las 2 hélices se mantienen juntas por las interacciones de van der Waals entre los residuos de Leu. Secuencia de aa de una parte de la cadena del colágeno. Cada tercer residuo es Gly. Conformación de una sola hebra de la triple hélice del colágeno, Estructura de la proteína colageno. Modelo espacial compacto del colágeno. Cada hebra se ve de un color diferente. Sección transversal de un modelo de colágeno. Cada hebra se une a las otras mediante puentes de H. El C alfa de la Gly (G) es frecuente. Cada 3 residuos hay una G La estructura terciaria: las proteinas solubles en agua se pliegan en estructuras compactas con un nucelo no polar. Estructura de la mioglobina. Estructura 3D de la mioglobina. El diagrama de cintas muestra que la proteína esta formada por alfa-hélices. La mioglobina es una molecula compacta. Modelo espacial compacto de la mioglobina. El grupo hemo esta cobijado en una hendidura dentro de la proteína compacta con un unico extremo expuesto al exterior. Una hélice se muestra en azul. Distribución de los aa en la mioglobina. (A) Modelo espacial compacto con los aa hidrofóbicos (amarillo), los aa cargados (azul) y el resto en blanco. La superficie de la molécula tiene muchos aa cargados. (B) Un corte en sección muestra que la mayoría de los aa hidrofóbicos están en el interior de la estructura, mientras que los aa cargados se encuentran en la superficie de la proteína. Distribución de aa invertida en la porina. El exterior de la porina ( en contacto con los grupos hidrofóbicos de la membrana) esta cubierto principalmente por residuos hidrofóbicos, mientras que el centro contiene un conducto acuoso lineal con aa polares y cargado. El motivo hélice-vuelta-hélice, un elemento de estructura supersecundaria. Estos motivos se encuentran en muchas proteínas que se unen al DNA. Dominios proteicos. La proteína CD4 de la superficie celular consta de 4 dominios similares. Estructura cuaternaria: las cadenas polipeptídicas pueden ensamblarse en estructuras de múltiples subunidades. La proteína cro del bacteriófago lambda es un dimero de subunidades idénticas. El tetrámero α2β2 de la hemoglobina humana. La estructura de 2 subunidades α idénticas (rojo) es similar pero no idéntica a la de las 2 subunidades β (amarillo). La molécula contiene 4 grupos hemo (en gris con el átomo de Hierro purpura). El diagrama de cintas resalta la similitud de las subunidades y muestra que están compuestas de hélices α El modelo espacial compacto de la hemoglobina resalta como los grupos hemo (gris) ocupan oquedades de la proteína. Estructura cuaternaria compleja. La envoltura del rinovirus humano contiene 60 copias de sus 4 subunidades proteicas (colores diferentes). Los agentes como la urea o el cloruro de guanidinio rompen los enlaces no covalentes. El β mercaptoetanol rompe los puentes disulfuro. Secuencia de aa de la ribonucleasa bovina. La proteína tiene 4 puentes disulfuro (color). Papel del β-mercaptoetanol en la reducción de los puentes disulfuro. Cuando se reducen los disulfuro, el βmercaptoetanol se oxida y forma dimeros. Reducción y desnaturalización de la ribonucleasa. Restablecimiento del emparejamiento correcto de los pares disulfuro. La ribonucleasa nativa se puede regenerar desde la ribonucleasa revuelta en presencia de trazas de βmercaptoetanol. Conformaciones alternativas de una secuencia peptídica. En diferentes proteínas, muchas secuencias pueden adoptar conformaciones alternativas. La secuencia VDLLKN (rojo) , adopta una conformación en hélice en un contexto proteico (izquierda) y una hebra β, en otro (derecha). Modelo proteico de la transmisión de la enfermedad priónica. Un núcleo formado por proteínas con una configuración anómala crece por la adición de proteínas del conjunto normal. Estructura de las fibras amiloideas. Un modelo detallado para las fibrillas Aβ, deducido de estudios de RMN en fase solida muestra que la agregación proteica se debe a la formación de grandes laminas β, paralelas. Transición desde el estado plegado al desplegado. La mayor parte de las proteínas experimentan una transición brusca desde la forma plegada hasta la desplegada cuando se las trata con agentes desnaturalizantes. Componentes de una disolución proteica desnaturalizada parcialmente. En una disolución de proteína medio desplegada, la mitad de las moléculas están completamente plegadas y la otra mitad completamente desplegadas. Vía de plegado propuesto para el inhibidor de la quimotripsina. Inicialmente regiones locales con suficiente preferencia estructural tienden a adoptar sus estructuras favorables (1). Estas estructuras se juntan para formar un núcleo con una estructura tipo nativo, pero todavía móvil (4). Esta estructura entonces se condensa plenamente para formar la estructura nativa mas rígida (5). La modificación y escisión de las proteínas les confieren nuevas capacidades. Toques finales. Se muestran algunas modificaciones covalentes de las cadenas laterales. Reorganizaciones químicas en la GFP (Green Fluorescent Protein). Estructura de la proteína verde fluorescente. La reorganización y oxidación de la secuencia Ser-Tyr-Gly es la fuente de la fluorescencia. Micrografía fluorescente de un embrión de 4 células del gusano Caenorhabditis elegans que contiene la proteína PIE-1 marcada con GFP. La proteína solo se expresa en la célula superior que dará lugar a la línea germinal. Modelo espacial compacto de la lisozima. Tomos empquetados con poco espacio sin rellenar. Se representan todos los átomos excepto los H. Modelo de esferas y varillas de la lisozima. Se omiten los H. Modelo de esqueleto de la lisozima. Diagrama de cintas de la lisozima. Las hélices α se muestrancomo cintas enrolladas; las hebras β se describen con flechas. Las estructuras mas irregulares se ven como tubos delgados. Diagrama de cintas de la lisozima con zonas resaltadas. Los 4 puentes disulfuro y un residuo de Asp se muestran en forma de esferas y varillas.