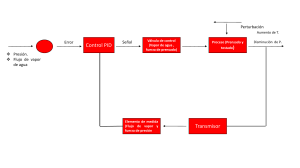
Laboratorio de Termodinamica Análisis Termodinámico del equilibrio líquido-vapor Luis Daniel Salazar Hoyos a a Facultad de Minas, Universidad Nacional de Colombia, Medellín, Colombia. [email protected] Recibido: Abril 4th, 2015. Abstract In this report we make a study of the thermodynamic vapor-liquid equilibrium (VLE). In first instance we develop a thermodynamic analysis of distilled water as pure liquid, and then of two binary systems; the first, miscible, composed of acetone/chloroform. And the second, immiscible composed of water/toluene. For the vapor pressure of a pure liquid system, we draw the pressure curve at different pressure points below the atmosphere pressure. From the procedure performed on the miscible liquid binary system, the vapor-liquid phase diagram is built by means of the correlation of the mid values of the temperature variation in respect with the variation of the fraction of the species in the solution at a constant pressure. We found that the system presented an azeotrope at a temperature of 57.6°C. In the immiscible binary system composed of water/toluene, we found that the eutectic point was met at 80.3°C, for the molar fractions of 0.201 water and 0.799 toluene. Keywords: thermodynamic equilibrium; eutectic point; liquid-vapor equilibrium; miscible system; immiscible system; azeotrope. 1 Introducción Muchas aplicaciones prácticas se realizan ya sea a temperatura constante o a presión constante, pueden describirse adecuadamente por diagramas. No obstante no es práctico pretender mostrar todos los datos de equilibrio (aun para una mezcla binaria) en una sola carta, porque al hacerlo así exigiría un gráfico multidimensional y aumentaría bastante su complejidad y construcción [1]. Para sistemas multicomponentes, se puede clasificar de acuerdo al número de componentes aplicando la regla de las fases que se expresa de la siguiente manera: 𝐹+𝐿 =𝐶+2 (1) Siendo F el número de fases, L el número de grados de libertad y C el número de componentes. La regla es aplicable a todo sistema macroscópico que se encuentre en un estado de equilibrio heterogéneo y que solamente sea influido por variaciones de presión, temperatura y concentración [2]. Para un sistema de dos componentes L = 4 – F así si son solo dos fases, al fijar la presión o la temperatura se tiene el sistema totalmente definido, y se puede empezar a trabajar en él, Para una fase L=3 y las tres variables intensivas independientes son P, T y una de las fracciones molares, se suele mantener P o T constantes y se representa gráficamente un diagrama de fases bidimensional, que es un corte transversal de la representación tridimensional [3]. El equilibrio termodinámico se da cuando todas las propiedades macroscópicas de este no varían con el tiempo; equilibrio mecánico, térmico y másico, es decir, el sistema se encuentra en estado estacionario, por lo tanto este posee propiedades fisicoquímicas determinadas, que definen completamente el estado termodinámico del sistema a partir del equilibrio de fases.[4] Los sistemas en equilibrio termodinámico, presentan equilibrios entre las fases, es decir, debido a fenómenos fisicoquímicos que involucran procesos de transferencia de materia, calor y movimiento entre las fases, el sistema tiende al equilibrio. Se evaluara la presión de vapor de agua destilada como líquido puro, con el fin de hacer un análisis a la variación del punto de ebullición y la presión de vapor de agua destilada cuando se altera la presión interna del sistema. Por otra parte se evaluará el comportamiento del equilibrio líquido-vapor del sistema binario cloroformo/acetona, determinando la fracción de líquido y vapor condensado se bosquejara la curva correspondiente a la temperatura del sistema en equilibrio con respecto a fracción de vapor y fracción en estado líquido de los compuestos que conforman el sistema a presión constante. Para estudiar el sistema binario inmiscible agua-tolueno se realizará el diagrama temperatura con respecto a composición con el fin de analizar el punto eutéctico del sistema, el cual corresponde a la máxima temperatura a la que puede producirse la mayor cantidad de especies en la mezcla y la temperatura más baja a la cual puede evaporarse la solución con una composición fija de los compuestos presentes. El uso de instrumento de medición produce una propagación de errores que varía la precisión de la medida, por lo que se le debe dar un tratamiento especial a las mediciones tomadas en el laboratorio con el fin de tener en cuenta la propagación de error. A partir de la varianza, la cual mide la propagación de los errores de las medidas correspondientes a los procesos matemáticos que se realizan desde las varianzas individuales ligadas a cada medición ejecutada. Las ecuaciones (2) y (3) serán de utilidad para calcular la varianza relacionada a varianzas relativas en el proceso de adición y multiplicación respectivamente: 𝑠 = √(𝑆𝑎 )2 + (𝑆𝑏 )2 + (𝑆𝑐 )2 + ⋯ + (𝑆𝑛 )2 𝑆 2 𝑆 2 𝑆 2 𝑆 𝑠 = √( 𝑎𝑎 ) + ( 𝑏𝑏 ) + ( 𝑐𝑐 ) + ⋯ + ( 𝑛𝑛 ) Encender la plancha de calefacción que se dispuso debajo del matraz de destilación, cuando el agua dentro de este se encuentre en ebullición, y cuando el sistema se encuentre en equilibrio, es decir, cuando el manómetro y el termómetro hayan alcanzado la máxima estabilidad, y el vapor haya condensado y gotee por el bulbo del termómetro, lo que indica que se ha alcanzado la temperatura de equilibrio, se toma el valor de la temperatura, y se realizar la lectura del manómetro registrando la diferencia h entre la posición de cada menisco, hay que tener presente que durante la lectura se debe mantener la visual al nivel del menisco para evitar errores de paralaje. El procedimiento anterior se realiza varias veces, disminuyendo gradualmente el vacío, esto hasta llegar a la presión atmosférica. (2) 2 (3) 2.2 Análisis termodinámico del equilibrio liquido-vapor en sistemas binarios de líquidos miscibles. Donde a, b y c hasta n son los valores numéricos de las mediciones realizadas y 𝑆𝑎 ,𝑆𝑏 , hasta 𝑆𝑛 , son las incertidumbres asociadas a cada medición. Antes de empezar la práctica de ELV en sistemas binarios de líquidos miscibles se debe verificar que el refractómetro se encuentre bien conectado y calibrado, para esto se debe conectar el enchufe de este a un tomacorriente de 120VAC, y ensamblar las mangueras de agua de enfriamiento a las conexiones de entrada y salida de agua para el control de temperatura y fijar el flujo de agua de enfriamiento de este sistema 2 Metodología 2.1 Presión de vapor de un líquido puro Inicialmente se registran las condiciones ambientales, presión y temperatura en las que se encuentra el laboratorio, para determinar la presión de vapor de agua destilada como líquido puro a distintas presiones por debajo de la presión atmosférica, se dispone a realizar el montaje ilustrado en la Figura 1, cerciorándose de que las conexiones de las mangueras que conectan el manómetro y la bomba de vacío con el matraz de destilación estén completamente sellados, con el objetivo de evitar inclusiones de aire. Adicionar en el centro de la superficie del prisma aproximadamente 3 gotas de agua destilada, y cerrar cuidadosamente el prisma secundario, enfocar el ensamble de iluminación y observar por el ocular, mover la perilla de compensación de color hasta obtener una zona clara y otra oscura perfectamente definidas y divididas por una línea hasta obtener una zona clara, girar la perilla de manejo de escala hasta hacer que la línea divisoria atraviese el centro de la cruz, posteriormente leer en la escala inferior el índice de refracción, se sabe que el índice de refracción del agua destilada, tiene un valor de 1,3333, si este no coincide, ajustar la escala, colocando el destornillador del refractómetro en el tornillo de ajuste de escala hasta obtener este valor y ahora si se ha verificado que el refractómetro se encuentra calibrado, se dispone a iniciar la determinación del índice de refracción de las muestras. 2.2.1 Curva de calibración para determinar la fracción molar de uno de los componentes Con el fin de realizar una curva compuesta por la fracción de la especie con respecto al índice de refracción, la cual es utilizada posteriormente para definir la fracción de cloroformo y acetona en el equilibrio liquido-vapor, a partir del índice de refracción leído en las muestras de líquido y vapor condensado. Figura 1. Montaje de la determinación de la presión de vapor de un líquido puro. [5] Se adicionan al matraz de destilación aproximadamente 100ml de agua destilada, se enciende la bomba de vacío, y mediante la perilla que dispone la bomba se ajusta un valor fijo de vacío esperando hasta que la columna de mercurio que se encuentra en el tubo en U se estabilice. Se preparan cinco soluciones en relación ml[acetona]:ml[cloroformo] 5:0, 4:1, 3:2, 2:3, 1:4, 0:5 en tubos de ensayo, posteriormente se lee el índice de refracción y se registra el valor obtenido, se repite el procedimiento para todas 2 las muestras y se apuntan los datos, para luego construir la curva de calibración. Cada vez que se cambie de solución debe limpiarse con un algodón el prisma secundario y la zona del prisma principal donde se adicionan las gotas de la solución, para que el valor del índice de refracción corresponda a la solución y no a la mezcla de las soluciones residuales. Luego se quita la fuente de calor, se limpia el montaje, y se repite todo el procedimiento indicado con anterioridad pero esta vez en el destilador se agregan 50ml de acetona, medir el índice de refracción tanto de líquido como de vapor condensado, y agregar sucesivamente 5 ml de cloroformo, hasta que como en el caso anterior el índice de refracción tanto del líquido como del vapor condensado se acercan a un mismo valor, y al agregar más cloroformo la temperatura permanece constante, esto indica nuevamente que se ha alcanzado por el otro extremo el azéotropo el cual debe encontrarse a la misma temperatura e índice de refracción del experimento inicial con 50ml de cloroformo. 2.2.2 Índice de refracción de las mezclas en equilibrio líquida y del vapor condensado del sistema (cloroformo-acetona) Para la determinación del índice de refracción de las mezclas en equilibrio líquido vapor del sistema cloroformo, acetona, se realiza el montaje expuesto en la figura 2 2.3 Análisis termodinámico del equilibrio liquido-vapor en sistemas binarios de líquidos inmiscibles. Para la determinación del equilibrio líquido vapor del sistema binario de líquidos inmiscibles, se realiza el montaje expuesto en la Figura 3. Figura 2. Montaje para el análisis termodinámico del ELV en sistemas binarios de líquidos miscibles [6]. Se adicionan 50ml de cloroformo en el destilador, y se calienta hasta ebullición y cuando la temperatura en el termómetro no varíe, se toma el dato de temperatura, es este momento se toma una muestra aproximada de 2 a 3ml del líquido en el destilador, y del vapor en la llave de muestra de vapor condensado, se adiciona cada muestra por separado en el prisma del refractómetro, y se registra el índice de refracción tanto del líquido en el destilador, como de la muestra tomada del condensador. Figura 3. Montaje para el análisis termodinámico del equilibrio líquido-vapor en sistemas binarios de líquidos inmiscibles [7]. Adicionar 200ml de agua y tolueno en cada uno de los balones volumétricos, y disponer los balones como se indican en la Figura 3, encender la estufa en la cual está el balón con el agua en fuego alto, y l estufa en la que se encuentre el tolueno en fuego bajo. Posteriormente se agregan 5ml de acetona al destilador, y se calienta nuevamente hasta que la temperatura alcance un valor estable, se registra la temperatura, y como en el procedimiento anterior se toma una muestra tanto del liquido en el destilador, como del vapor condensado en el condensador, se lee el idice de refracción de cada una de las muestras, y se repite el procedimiento agregando cada vez 5ml de acetona, esto se repite hasta ver que el índice de refracción del tanto del líquido como del vapor condensado se acercan a un mismo valor, y en este momento también se debe ver que al agregar más acetona la temperatura se mantiene constante en el mismo valor, esto quiere decir que se ha llegado al azéotropo en el cual es muy difícil de romper ese equilibrio. Se recolecta en un Beaker el condensado inicial, hasta que se llegue a una temperatura constante, para garantizar que las muestras que se van a analizar estén en equilibrio. Luego recolectar el condensado de tres muestras compuestas por tolueno y agua destilada, cada una de 50 ml en tres probetas graduadas. Se vierten cada una de las muestras tomadas en tres embudos de separación, y se dejan reposar durante 24 horas, hasta que los sistemas se hayan separado en dos fases completamente definidas. 3 Luego se efectúa la separación del agua y del tolueno, depositando cada una de las fases en diferentes probetas previamente pesadas, y finalmente se pesa en una balanza analítica la masa de cada una de las fases de las muestras recolectadas. Presión (mmHg) Temperatura vs Presión 3 Resultados 3.1 Presión de vapor de un líquido puro 800 600 400 200 0 60 70 80 90 100 Temperatura (°C) Para determinar la presión de vapor de agua destilada como liquido puro, con el propósito de analizar la variación del punto de ebullición y la presión de vapor de agua destilada cuando la presión interna del sistema cambia, por debajo de la presión atmosférica. Para esto se utiliza una bomba de vacío marca GAST modelo DOA-P704AA, esto con el fin de generar un vacío parcial, evidenciado en la columna de mercurio ya que los meniscos se desplazan, la presión de gas del sistema que empuja el líquido de la columna es menor que la presión atmosférica. A partir de esta generación del vacío, se lleva el líquido que se encuentra en el matraz de destilación, hasta la temperatura de ebullición, para determinar la presión de vapor del agua a diferentes presiones. Figura 4. Curva de temperatura vs Presión A partir de la relación de Clausius - Clapeyron que expone que el logaritmo natural de la presión de vapor del líquido puro es proporcional al inverso de la temperatura, teniendo un comportamiento lineal. Tabla 3. Datos de ln(Pvap) y de 1/T Ln(Pvap) mmHg ± 0.2 mmHg 5.322 5.424 5.648 5.771 5.877 5.988 6.093 6.188 6.295 6.386 Fuente: Datos tomados del laboratorio Para la toma de temperatura en el matraz de destilación, se utiliza un termómetro digital marca BRIXCO con un rango de temperatura de -50°C – 150°C con una incertidumbre asociada a la medida de 0,1 ˚C, para determinar de la presión interna del sistema, se emplea una columna de mercurio en U, la cual posee una incertidumbre de 0.1cm. Antes de empezar la toma de los datos se tomaron la temperatura ambiente y la presión ambiente, los cuales se muestran en la Tabla1, posteriormente se tomaron un total de 10 muestras a diferentes presiones las cueles se indican en la Tabla 2. 1/T °C ± 0.1 °C 0.0157233 0.0150602 0.0138696 0.0134771 0.0129702 0.0125628 0.0121507 0.0117509 0.0112359 0.0109051 Ln(Pvap) (mmHg) 1/T vs Ln(Pvap) Tabla 1. Condiciones ambiente en el momento de realizar el procedimiento de presión de vapor de un líquido puro. Datos Valor Temperatura 29,0 ± 0.1 °C Presión 635.8 ± 0.1 mmHg Fuente: Datos tomados en el laboratorio 0,02 0,015 0,01 0,005 0 5,2 5,4 5,6 5,8 1/T Tabla 2. Temperatura del agua destilada a distintas presiones Presión en mmHg ± 0.2 mmHg Temperatura en °C ± 0.1 °C 204.8 63.6 226.8 66.4 283.8 72.1 320.8 74.2 356.8 77.1 398.8 79.6 442.8 82.3 486.8 85.1 541.8 89.0 593.8 91.7 Fuente: Datos tomados del laboratorio 6 6,2 6,4 6,6 (°C-1) Figura 5. Relación entre la presión de vapor con respecto a la temperatura, a partir de la relación de la ecuación de Clausius Clapeyron. 3.2 Equilibrio líquido vapor de sistemas miscibles Para estudiar el comportamiento del termodinámico del equilibrio líquido vapor, del sistema cloroformo-acetona, se realiza el montaje mostrado en la Figura 2, y cuando se alcanza el punto de ebullición se toma una muestra de la mezcla en equilibrio tanto del líquido, como del vapor condensado, con el objetivo de bosquejar la curva correspondiente a la temperatura del sistema en equilibrio con respecto a fracción de vapor y fracción en estado líquido de los compuestos que conforman el sistema a presión constante. El comportamiento termodinámico mostrado en la Figura 4, demuestra que la temperatura aumenta cuando la presión de vapor de saturación del sistema aumenta y viceversa 4 Previamente se debe de realiza una curva de calibración, tomando los índices de refracción de distintas concentraciones conocidas de acetona y cloroformo, con el fin de realizar una curva compuesta por la fracción de la especie con respecto al índice de refracción, la cual es utilizada posteriormente para definir la fracción de cloroformo y acetona en el equilibrio liquido-vapor, a partir del índice de refracción leído en las muestras de líquido y vapor condensado. Indice de refracción Fracción de acetona vs. Indice de refracción A continuación se muestran los resultados de los procedimientos realizados, para poder hacer el análisis termodinámico del sistema binario acetona-cloroformo. 1,46 1,44 1,42 1,4 1,38 1,36 1,34 y = -0,0849x + 1,4435 0 0,2 0,4 0,6 0,8 1 1,2 Fracción de acetona 3.2.1 Determinación de la curva de calibración del sistema binario de líquidos miscibles. Figura 6. Fracción de acetona vs índice de refracción para la determinación de la curva de calibración del sistema binario de líquidos miscibles. El día que se realizó el laboratorio de equilibrio líquidovapor en sistemas binarios de líquidos miscibles se tenían las siguientes condiciones ambientales dentro del laboratorio. 3.2.2 Índice de refracción de las mezclas en equilibrio líquido y del vapor condensado del sistema cloroformo-acetona Tabla 4. Condiciones ambiente en el momento de realizar el procedimiento del sistema binario de líquidos miscibles Datos Valor Temperatura 25.0 ± 0.1 °C Presión 634.7 ± 0.1 mmHg Fuente: Datos tomados en el laboratorio Para la toma de volúmenes del cloroformo y la acetona inicial, como compuesto puro se utilizó una pipeta graduada de 50ml marca PHYSIS ex 20°C, con una incertidumbre de ± 1, y para la adición de los 5ml al destilador para cambiar la fracción de la especie, se utilizó una probeta de 5ml ex 20°C marca Brixco, con una incertidumbre asociada a la medida de ± 0.05ml, y se utilizó un refractómetro previamente calibrado para medir el índice de refracción de las soluciones binarias, el cual tiene una incertidumbre de ± 0.0005. Para tomar los volúmenes de cloroformo y acetona se dispuso de dos pipetas graduadas marca BlauBrand, de 5ml con una incertidumbre de 0.03ml, y se utilizó un refractómetro previamente calibrado para medir el índice de refracción de las soluciones binarias, el cual tiene una incertidumbre de ± 0.0005 Tabla 5. Temperatura del agua destilada a distintas presiones Volumen de Volumen de acetona Fracción de cloroformo (ml ± 0.3 ml) cloroformo (ml ± 0.3 ml) 5,00 0 1 4,00 1,00 0,8 3,00 2,00 0,6 2,00 3,00 0,4 1,00 4,00 0,2 0 5,00 0 Fuente: Volúmenes tomados en el laboratorio Para la determinación de los puntos de líquido y de vapor condensado del sistema binario en equilibrio liquido-vapor, variando la concentración de los componentes, se realiza un calentamiento directo del sistema con el propósito de estipular la temperatura a la que el sistema está en equilibrio, manteniendo la presión constante. Las tablas 7 y 8 corresponden al índice de refracción variando la fracción de la especie iniciando con cloroformo y puro y acetona pura respectivamente. Fracción de acetona 0 0,2 0,4 0,6 0,8 1 Tabla 7. Índice de refracción de la mezcla binaria miscible y fracción molar, iniciando con cloroformo puro. Temperat Volumen Índice de Indice de Fracció Fracció ura (°C de refracción refracción n de n de ± 0.1 °C) acetona del liquido del vapor acetona acetona (ml ± en el en el 0.05 ml) liquido vapor 54,0 0 1,4435 1,4435 0 0 55,6 5,00 1,4370 1,4345 0,07656 0,10601 56,2 10,00 1,4340 1,4275 0,11190 0,18845 57,3 15,00 1,4200 1,4160 0,27680 0,32391 57,6 20,00 1,4105 1,4120 0,38869 0,37102 57,6 25,00 1,4135 1,4135 0,35336 0,35336 Fuente: Datos tomados en el laboratorio Tabla 6. Temperatura del agua destilada a distintas presiones Fracción de cloroformo Fracción de acetona n (± 0.0005) 1 0 1,4435 0,8 0,2 1,4265 0,6 0,4 1,4100 0,4 0,6 1,3925 0,2 0,8 1,3750 0 1 1,3590 Fuente: Datos medidos en el laboratorio 5 Tabla 8. Índice de refracción de la mezcla iniciando con acetona pura. Temperat Volumen Índice de ura (°C de refracción ± 0.1 °C) cloroformo del (ml ± 0.05 liquido ml) (n ± 0.0005 n) 49,9 0 1,3590 51,3 5,00 1,3685 52,5 10,00 1,3770 53,5 15,00 1,3840 54,4 20,00 1,3900 55,5 25,00 1,3960 56,1 30,00 1,4005 56,8 35,00 1,4050 57,3 40,00 1,4085 57,6 45,00 1,4110 57,6 50,00 1,4135 Fuente: Datos tomados en el laboratorio binaria miscible y fracción molar, Índice de refracció n del vapor (n ± 0.0005 n) 1,3590 1,3615 1,3640 1,3690 1,3745 1,3795 1,3885 1,3955 1,4040 1,4090 1,4135 Fracció n de acetona en el liquido Fracció n de acetona en el vapor 1 0,88339 0,78327 0,70082 0,63015 0,55948 0,50648 0,45347 0,41225 0,38280 0,35336 1 0,96584 0,93640 0,87750 0,81272 0,75383 0,64782 0,56537 0,46525 0,40636 0,35336 la mayor cantidad de especies en la mezcla y la temperatura más baja a la cual puede evaporarse la solución con una composición fija de los compuestos presentes Para la definición de la temperatura de ebullición de agua destilada y tolueno como componentes puros y del sistema en el punto eutéctico, se usaron dos probetas para la recolección de tres muestras, la primera probeta marca LMS Germany de 25ml con una incertidumbre de 0.5ml, una segunda probeta de 50ml SILVER BRAND con una incertidumbre asociada de ± 0.8ml se emplea un termómetro digital con una incertidumbre asociada a la medida de ± 0,1 ℃, posteriormente se halla la masa en gramos de los componentes del sistema binario inmiscible en el punto eutéctico, para esto se utiliza una balanza analítica marca Precisa 180ª con precisión de ±0.0001g. En las Tablas 9, 10 y 11 se detalla la información determinada a partir del desarrollo experimental realizado. Se define gráficamente el equilibrio liquido-vapor de un sistema binario compuesto por cloroformo/acetona, desde el bosquejo del diagrama de temperatura con respecto a composición a presión constante, con el fin de conocer íntegramente el comportamiento de la mezcla, se determinaran puntos estacionarios del sistema, empezando desde cloroformo puro y análogamente desde acetona pura agregándole cada vez 5ml del otro compuesto hasta llegar por cada extremo al azéotropo. Tabla 9. Temperatura de ebullición del sistema binario y los componentes puros en equilibrio termodinámico. Propiedad Temperatura (°C ± 0,1°C) Agua destilada 98,5 Tolueno 110.2 Punto eutéctico 80,3 Fuente: Datos tomados en el laboratorio Tabla 10. Masa de los componentes en el punto eutéctico Embudo de separación Masa del agua Masa del tolueno (g ± 0.0001g) (g ± 0.0001g) 1 8,6616 33,8199 2 8,2042 34,6547 3 8,8217 33,7081 La figura 7 pertenece a la gráfica del equilibrio liquidovapor del sistema binario compuesto por cloroformo y acetona respectivamente, donde hay variación de temperatura con respecto a la composición de las especies en solución a presión constante de 635,8 mm Hg. Promedio 8,5625 Fuente: Datos medidos en el laboratorio Tabla 11. Fracción de los componentes en el punto eutéctico. Embudo de separación Fracción de agua Fracción de tolueno ( ± 0.001) ( ± 0.001) 1 0,204 0,796 2 0,191 0,809 3 0,207 0,793 Diagrama de fases líquido-vapor. Temperatura vs. composición Temperatura (°C) 34,0609 59 58 57 56 55 54 53 52 51 50 49 Promedio 0,201 0,799 Fuente: Calculados a partir de datos medidos en el laboratorio 0 0,2 0,4 0,6 0,8 1 Fracción molar de acetona Figura 7. Diagrama de temperatura vs. Composición del sistema binario compuesto por acetona y cloroformo. 3.2 Equilibrio líquido vapor de sistemas miscibles Con el fin de analizar el punto eutéctico del sistema, el cual corresponde a la máxima temperatura a la que puede producirse Figura 8. Diagrama de temperatura vs. Composición del sistema binario compuesto por agua/tolueno. 6 4. Discusiones puede calcular la otra fracción de la otra especie, con la relación y = 1-x, donde la “x” indica la fracción conocida y “y” la fracción de la otra especie. El punto azeotrópico teórico tiene la misma tendencia en comparación con el experimental, porque la fracción de cloroformo es mayor con respecto a la fracción de acetona. Se exponen a continuación el análisis termodinámico de los datos obtenidos, a partir del procedimiento experimental realizado para la determinación cuantitativa del equilibrio líquido-vapor miscible e inmiscible de los sistemas binarios anteriormente planteados, y del sistema de presión de vapor de un líquido puro. Un sistema se encuentra en equilibrio termodinámico si no experimenta un cambio espontaneo de una propiedad macroscópica, el fenómeno fisicoquímico enunciado es posible ser visualizado experimentalmente porque no hay transferencia de calor en el sistema en equilibrio, lo cual sugiere que el cambio de la temperatura con respecto a la posición y el tiempo es cero, porque no hay efectos convectivos y conductivos; por lo tanto la temperatura permanece constante [7]. Así las posibles fases que se forman en un sistema multicomponente o puro a una temperatura y presión dadas, se encuentran en equilibrio termodinámico, por tanto la temperatura del sistema no cambia con el tiempo. En el análisis del sistema de presión de vapor de agua como líquido puro, la temperatura de ebullición del líquido en el sistema, corresponde al punto donde la presión de vapor es igual a la presión del sistema. La información experimental encontrada en este sistema de presión de vapor de líquido puro, el efecto de vacío que se generó en el sistema con la bomba, se demostró que mientras menor sea la presión a la que está sometido el sistema en estado líquido, la temperatura de ebullición también será menor. Figura 9. Diagrama de temperatura vs. Composición del sistema binario compuesto por acetona y cloroformo [9]. Con la ayuda del software ASPEN PLUS 8.6 se determinó el azéotropo teórico del sistema binario cloroformo/acetona, el cual arrojó un valor de 55,74 ˚C, el azéotropo encontrado experimentalmente se observó a una temperatura de 57.6°C. Por tanto el error respecto al valor experimental es de 3.3%, este error podría ser causa de la pureza de los compuestos, por tanto esto puede inducir en una causa de error importante. El proceso de determinación del azéotropo mediante software se analiza como un sistema cerrado, donde se supone que no existen pérdidas de materia y de calor hacia afuera del sistema; no obstante las conexiones entre el material volumétrico empleado no se encuentran completamente herméticas, ya que con el paso del tiempo, se ha desgastado y se presentan algunas pequeñas fugas, que pueden hacer que el equilibrio liquido-vapor del sistema tenga lugar a una temperatura mayor. A partir de la relación de Clausius- Clapeyron que expone que el logaritmo natural de la presión de vapor del líquido puro es proporcional al inverso de la temperatura, teniendo un comportamiento lineal, se encontró que los valores experimentales obtenidos se correlacionan con la tendencia teórica. Para el análisis del sistema binario de líquidos miscibles cloroformo/acetona, el punto de equilibrio o azéotropo corresponde a una proporción determinada de las especies que componen la solución en la cual las interacciones moleculares son máximas, por lo tanto la temperatura del sistema en este punto es la máxima a la que el sistema binario puede llegar, antes de evaporarse completamente. En el análisis del equilibrio líquido-vapor del sistema binario inmiscible, el punto eutéctico es encontrado con facilidad debido a que la solución inmiscible en estado líquido, es completamente estable en estado de vapor, de acuerdo a esto el sistema tiende a estar en equilibrio en el estado que se encuentra, porque el punto eutéctico corresponde a la zona que menor energía libre de Gibbs tiene, es decir el punto eutéctico corresponde a la región donde el sistema inmiscible en estado líquido compuesto por agua/tolueno tiene un punto de vaporización mínimo, inferior al correspondiente a cada uno de los compuestos en estado puro. El comportamiento termodinámico del diagrama temperatura con respecto a composición mostrados en la Figura 7, es similar al diagrama teórico expuesto en la Figura 9 del sistema cloroformo/acetona, donde las condiciones de temperatura varían con respecto a los datos experimentales obtenidos, debido a que la presión del sistema teórico es al nivel del mar 760mmHg y es inverso porque la fracción molar de la especie del diagrama teórico es cloroformo, mientras que en el experimental esta fracción indicada es de acetona, se sabe que a partir de la concentración molar de una de las especies, se 7 El punto eutéctico no sólo corresponde a la zona donde la temperatura es menor, sino que existen fracciones específicas de las especies del sistema, experimentalmente se encontró un valor de 0.201 para el agua y 0.799 para el tolueno, que corresponden al punto eutéctico. Referencias [1] Richard E. Balzhiser, Michael r. Samuels, John D. Eliassen. (1974). Termodinámica Química para Ingenieros. Estados unidos de América: Pretince-Hall International. [2] La regla de las fases. Ferguson, Jones. Capítulo 2. Ed. Alhambra S. A. 5. Conclusiones [3] I. N. Levine, Fisicoquimica, Madrid: McGraw_Hill, 1990. La presión de vapor, corresponde a la propiedad que mide la volatilidad de la sustancia en estado líquido, es decir, la capacidad de pasar de estado líquido a vapor; por tanto mientras mayor sea la presión de vapor la volatilidad de la sustancia es mayor. [4] Martin Blas, Teresa. Serrano Fernández, Ana. Sistema termodinámico: primer principio. Universidad Politécnica de Madrid. España. [5] Manual de prácticas de laboratorio de termodinámica. Universidad Nacional de Colombia, Sede Medellín. Figura 8. Montaje presión de vapor de líquidos puros. Pág. 12. Se evidencio que cuando se acerca a un azéotropo en sistemas binarios por cualquiera de los dos extremos, las fracciones de las especies en solución de los dos compuestos se acercan a un mismo valor, el cual también se evidencio que este azéotropo es muy difícil de romper. [6] Manual de prácticas de laboratorio de termodinámica. Universidad Nacional de Colombia, Sede Medellín. Figura 12. Montaje Análisis termodinámico del ELV en sistemas binarios de líquidos miscibles. Pág 16. [7] Se determinó que para el sistema binario miscible cloroformo/acetona el azéotropo, se encuentra a una temperatura de 57.6°C y una fracción de 0.35 moles de acetona, y 0.65 moles de cloroformo. Manual de prácticas de laboratorio de termodinámica. Universidad Nacional de Colombia, Sede Medellín. Figura 13. Montaje Análisis termodinámico del ELV en sistemas binarios de líquidos inmiscibles. Pág 18. [8] J. M. Smith, V. N. H. C. y A. M. M., (1998) «Capitulo 10» Introducción a la termodinámica en ingeniería química, Zaragoza, McGRAW-HILL. El equilibrio líquido vapor del sistema binario inmiscible tolueno/agua, el punto eutéctico experimental del sistema agua/tolueno para una fracción determinada de 0,201 de agua y 0.799 de tolueno a una temperatura de 80,3 °C, el cual corresponde a la región de temperatura mínima de evaporación. [9] Barrow M. Gordon. Química Física. Volumen 1. 1988. Figura 10.26. Diagrama de puntos de ebullición del sistema cloroformo acetona a 1 atm de presión. (Datos tomados de las International Critical Tables, vol III, Mc-Graw Hill Book Company, New York, 1930). Se recomienda cambiar las mangueras y conexiones del montaje para el equilibrio líquido vapor de sistemas miscibles, ya que estos evidenciaron fugas, los cuales son fuentes de causa de error, ya que la suposición de sistema cerrado no se estaría dando, por perdidas de temperatura y masa. 8