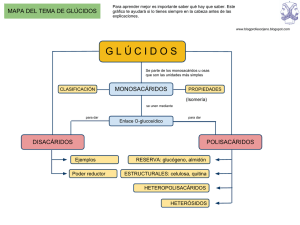
4. Glúcidos Las funciones orgánicas de interés biológico. Características generales y clasificación de los glúcidos. Monosacáridos. Enlace O-glucosídico. Disacáridos. Polisacáridos. Métodos de identificación de glúcidos. Funciones orgánicas de interés biológico. Peculiaridad del átomo de carbono. La gran variabilidad estructural de los compuestos orgánicos se debe a las peculiaridades del átomo de carbono. Tiene cuatro eˉ en su última capa y debido a su electronegatividad media puede enlazar con otros átomos de carbono formando cadenas abiertas o cerradas, de longitud variable , mediante enlaces sencillos dobles o triples. Esa electronegatividad intermedia le permite enlazar con otros átomos, tanto electropositivos (H), como electronegativos (O,N,S). Funciones orgánicas de interés biológico. Grado de oxidación del carbono. El grado de oxidación del carbono se define como el número de valencias que utiliza para enlazar con el oxígeno o con otros átomos electronegativos. Así, los hidrocarburos saturados son funciones en grado de oxidación cero, los alcoholes en gado de oxidación uno; los aldehídos , en grado dos y los ácidos carboxílicos en grado tres. La urea tiene grado cuatro. Ejercicio 4.19 Justifica el grado cuatro de la urea. Hidrocarburos Los hidrocarburos son compuestos binarios de carbono e hidrógeno. Según la estructura de la cadena carbonada pueden ser abiertos, alicíclicos o aromáticos, los aromáticos tiene al menos un anillo bencénico . Entre los abiertos la cadena puede ser lineal o ramificada. Los hidrocarburos son sustancia muy apolares y, por lo tanto, inmiscibles con el agua y miscibles con disolventes orgánicos. Los hidrocarburos se hallan en la naturaleza principalmente formando parte del petróleo. Algunos microorganismos Candida lipolytica pueden utilizar hidrocarburos como fuente de carbono y de energía. Alcoholes Son compuestos ternarios de C,H y O. Por contener en su molécula un radical alquilo y un grupo hidroxilo, tienen propiedades intermedias entre los hidrocarburos y el agua. Su carácter apolar aumenta con la longitud de la cadena carbonada, mientras que su carácter polar o hidrofílico aumenta con el número de hidroxilos de la molécula. Muchas biomoléculas poseen funciones alcohol, todos los azúcares, algunos aminoácidos (serina, treonina) Cuando un grupo hidroxilo está unido a un carbono perteneciente a un anillo aromático, la función recibe el nombre de fenol, la hormona estradiol y el aminoácido tirosina son fenoles. La condensación de dos funciones alcohol con pérdida de una molécula de agua da la función éter. Aldehídos y cetonas Son funciones en segundo grado de oxidación. Derivan de los hidrocarburos por sustitución de dos átomos de hidrógeno en un mismo carbono por uno de oxígeno, dando lugar a un grupo oxo (=O). Si la sustitución tiene lugar en un carbono primario el compuesto resultante es un aldehído, si la sustitución tiene lugar en un carbono secundario se trata de una cetona. Los azúcares son polihidroxialdehídos y polihidroxicetonas. Ácidos carboxílicos. Son funciones en tercer grado de oxidación. En un mismo átomo de carbono (forzosamente primario) se inserta un grupo (=O) y un grupo hidroxilo (-OH). La presencia de los átomos de oxígeno electronegativos confieren polaridad a estas moléculas y las dotan de la posibilidad de establecer enlaces de puentes de hidrógeno. El compuesto mayoritario de los lípidos son los ácidos monocarboxílicos de cadena larga (más de doce átomos de carbono) se le llama ácidos grasos. Aminas Se originan cuando uno o más hidrógenos del amoniaco (NH3) se sustituyen por radicales alkilo. El grupo amino confiere a la molécula un carácter polar algo más atenuado que el grupo hidroxilo. La función amino es muy frecuente en las biomoléculas, los ejemplos más importantes son los aminoácidos. Características generales de los glúcidos. Moléculas formadas por C,H y O, a veces también N. El nombre hidratos de carbono no es el más apropiado. Son polihidroxialdehídos o polihidroxicetonas. So moléculas que se utilizan para proporcionar energía, pero también desempeñan otras funciones. Clasificación de glúcidos Monosacáridos u osas. No pueden ser hidrolizados. Aldosas, su grupo carbonilo es un aldehído. Cetosas, su grupo carbonilo es una cetona. Ósidos. Se forman por la unión de monosacáridos, se pueden hidrolizar liberando monosacáridos. Oligosacáridos: Formados por la unión de 2 a 9 monosacáridos. Polisacáridos: Más de diez monosacáridos. Ejercicios 4.1 y 4.2 de la página 57 Monosacáridos. Propiedades Son sólidos cristalinos solubles en agua y con sabor dulce. Todos tienen poder reductor. Isomería Isómeros: Son compuestos que tienen la misma fórmula molecular pero que tienen distintas propiedades. Estereoisomería Existen moléculas que coinciden en todas sus propiedades menos en la capacidad de desviar la luz polarizada, se trata de los llamados isómero ópticos. Uno desvía la luz a la derecha (+) o dextrógiro, mientras que el otro la desvía en la misma magnitud pero a la izquierda, (-) o levógiro. Su comportamiento frente a la luz polarizada se debe a que la molécula carece de plano de simetría y por lo tanto se pueden distinguir dos isómeros que son cada uno imagen especular del otro. El caso más frecuente de carencia de plano de simetría se debe a que algún carbono tetraédrico está unido a cuatro radicales distintos (carbono asimétrico) Proyección de Fischer La representación en un plano de los carbonos asimétricos ofrece dificultades, la proyección de Fischer se ideó para obviar esas dificultades. Se proyecta la molécula en el plano del papel, con las siguientes condiciones: 1. La cadena carbonada se sitúa en vertical, con la valencias que la integran en dirección a la parte posterior del plano. 2. La cadena se orienta con la parte más oxidada hacia arriba y la más reducida hacia abajo. 3. Las valencias que no integran la cadena carbonada resultan así horizontales y dirigidas hacia delante del plano. Ejemplo de proyección de Fischer. Estereoisómeros D o L Cuando se aplica la convención de Fischer a alcoholes o aminas asimétricos, como es el caso de azúcares o aminoácidos, se denomina isómero D al que presenta el grupo funcional a la derecha del espectador e isómero L, al que lo tiene a la izquierda. Cuando una molécula tiene más de un carbono asimétrico, la denominación D o L se establece por la posición del grupo funcional (-OH), (NH2) del último carbono asimétrico. (Se empiezan a numerar partiendo del carbono más oxidado.) Las moléculas con r carbonos asimétricos poseen 2ʳ estereoisómeros. Enantiomorfos o enantiómeros, diastereoisómeros y epímeros En las moléculas con varios carbonos asimétricos, como en la mayoría de los azúcares, se pueden distinguir los isómeros especulares, enantiomorfos, de los que no lo son diastereoisómeros. Los azúcares que solo difieren en la configuración de un carbono asimétrico se llaman epímeros. D-glucosa D-manosa Ejercicios: 4.3 y 4.4 de la página 58 4.5 de la página 60 4.6 y 4.7 de la página 61 Clasificación de los monosacáridos Triosas: Tres átomos de carbono. Dihidroxiacetona y D-gliceraldehído. Aparecen en algunos procesos metabólicos. Tetrosas: Cuatro C.Menos frecuentes en los seres vivos. Pentosas: Cinco C. D-Ribosa presente en el ARN. Ddesoxirribosa, en el ADN, D-ribulosa, molécula sobre la que se fija el CO2 en la fotosíntesis. Hesoxas: Glucosa, muy abundante, forma polisacáridos. Galactosa, presente en la leche, la fructosa que forma parte de la sacarosa. Derivados de los monosacáridos. Por oxidación: ácidos urónicos. Por reducción: polialcoholes, como manitol y glicerina. Por sustitución: 1. Desoximonosacáridos: Desoxiribosa. 2. Aminoazúcares: Glucosamina. Estructura de los monosacáridos en disolución. En disolución los monosacáridos no suelen presentar estructura lineal, generalmente se ciclan. La ciclación se produce al reaccionar el grupo carbonilo (=O) con uno de los hidroxilos(-OH). Se forman así hemiacetales y hemicetales. Los anillos que se forman poseen un átomo de O en el anillo, son estables y si son pentagonales se denominan furanosas y piranosas si son hexagonales. Carbono anomérico La ciclación genera un nuevo carbono asimétrico en la molécula, este carbono se denomina anómérico y se crean dos estereoisómeros que se llaman anómeros. Los dos anómeros se llaman α o β según la posición que ocupa el OH (hidroxilo) unido al carbono anomérico. Nomenclatura de pentosas y hexosas. E 4.20 Nombra estos monosacáridos: Ejercicio4.8 de la página 63 Ejercicio 4.9, 4.10 y 4.11 de la página 64 Enlace O-Glucosídico Los monosacáridos pueden unirse al reaccionar dos de los grupos –OH liberándose una molécula de agua. Si en el enlace intervienen dos hidroxilos unidos a los carbonos anoméricos de los dos monosacáridos, entonces el disacárido resultante no tiene poder reductor, sucede así en la sacarosa. Si en la formación del enlace interviene un grupo amino, el enlace resultante se llama N-glucosídico. El enlace puede romperse por hidrólisis liberando una molécula de agua. Propiedades y nomenclatura de los disacáridos. Tienen la mismas propiedades que los monosacáridos, pero su poder reductor depende de la presencia de un grupo anomérico libre. Nomenclatura: Se escribe en nombre del monosacárido que emplea el –OH del grupo carbonilo en la unión, cambiando la terminación -osa por -osil. 2. Se expresan entre paréntesis los carbonos participantes en el enlace separados por una flecha. 3. Se escribe el nombre del segundo monosacárido con la terminación -osa, si el enlace es monocarbonílico, o con la terminación –osido, si es dicarbonílico. 1. Disacáridos más importantes. Sacarosa: β-D-fructofuranosil (2 1)α-D- glucopinanósido. Lactosa: β- D galactopiranosil (1 4) -D glucopiranosa. Presente en la leche y en algunos glucolípidos. Maltosa: α-D glucopiranosil (14) α-D glucopiranosa. Por hidrólisis de almidón y glucógeno. Isomaltosa: α-D glucopiranosil (16) α-D glucopiranosa. Celobiosa: β-D glucopiranosil (14) β-D glucopiranosa. Ejercicio 12 de la página 66. Ejercicio 13, 14 y 15 de la página 67 Polisacáridos Son largas cadenas de monosacáridos unidos por enlaces O-glucosídicos. Pueden ser cadenas lineales o ramificadas. Propiedades, muy diferentes de los monosacáridos. No se disuelven bien en agua, sin sabor dulce, nos son cristalinos y no tienen poder reductor. Clasificación de los polisacáridos. Homopolisacáridos: Un solo tipo de monosacárido. De reserva. (Anómeros α) Almidón, es una mezcla de amilosa y amilopectina. En vegetales. Glucógeno, mas ramificado que la amiolopectina. Cada 8 a 12 glucosas. Dextranos. Presentes en levaduras. Estructurales: (Anómeros ) Celulosa. En las paredes celulares de los vegetales. Pectina. Formado por la unión de monómeros de metilgalacturónico. Quitina. Hongos y artrópodos. Unión de unidades de N-acetilglucosamina. Muy similar a la celulosa. Clasificación de los polisacáridos. Heterololisacáridos: Intervienen dos o más monosacáridos distintos o derivados de éstos. Presentes en vegetales: Hemicelulosa: Presente en paredes de células vegetales. Gomas: Con papel defensivo en vegetales. Mucílagos: en vegetales, bacterias y algas, como el agar-agar, que se utiliza para fabricar cultivos de bacterias y en la industria alimentaria. Presentes en animales: Ácido hialurónico. Condroitina. Heparina.