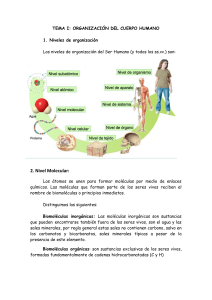
BUFFERS O SOLUCIONES AMORTIGUADORAS. I
Anuncio

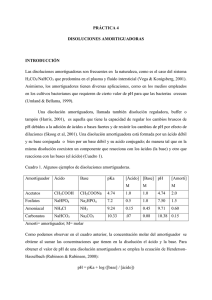
BUFFERS O SOLUCIONES AMORTIGUADORAS. I.-INTRODUCCION. Mantener el pH constante es vital para el correcto desarrollo de las reacciones químicas y bioquímicas que tienen lugar tanto en los seres vivos como, a nivel experimental, en el laboratorio. Los amortiguadores (también llamados disoluciones amortiguadoras, sistemas tampón o buffers) son aquellas disoluciones cuya concentración de protones apenas varía al añadir ácidos o bases fuertes (Figura inferior). Cambio de pH tras añadir ácido/base al Cambio de pH tras añadir ácido/base a agua una disolución amortiguadora Los organismos vivos soportan muy mal las variaciones del pH, aunque tan solo se trate de unas décimas de unidad, y por ello han desarrollado en la historia de la evolución sistemas tampón o buffer que mantienen el pH constante, mediante mecanismos homeostáticos. Las variaciones de pH, afectan a la estabilidad de las proteínas y, en concreto, en la actividad catalítica de los enzimas, pues en función del pH, pueden generar cargas eléctricas que modifiquen su actividad biológica. Los sistemas tampón que tienden a impedir la variación del pH cuando se añaden pequeñas cantidades de iones H+ u OH- consisten en un par ácido-base conjugada que actúan como dador y aceptor de protones, respectivamente. Podemos citar otros tampones biológicos, como son el par carbonato-bicarbonato y el par monofosfato-bifosfáto. El pH normal de los fluidos corporales suele y debe oscilar alrededor de 7,0 Plasma sanguíneo7, 4; Saliva: 6,356,95; Orina 5,8; jugo gástrico: 2,1 etc. II.- OBETIVOS: 1. Adquirir conocimientos de cómo preparar una solución amortiguadora. 2. Preparar soluciones amortiguadoras y determinar su pH. 3. Observar el efecto amortiguador de las soluciones buffers al agregarles ácidos o bases. III.-Materiales NaOH. HCl KH2PO4 Na2HPO4 02 tubo de ensayo Probeta 02 matraz Agua destilada 02 caso de precipitación 02 pipetas Balanza Pera pH metro IV Procedimiento. 1. Preparar 25 mL de una solución amortiguadora a 0.2 M a partir de Na2HPO4 0,2 M en 50 mL en HCL 0.2 M en 2 mL que se encuentra al 37 % en peso y densidad: 1,19 mL; medir el pH. 2. Preparar una solución amortiguadora con 50 mL de KH2PO4 al 0.2 M con 2 mL de NaOH al O,2 M V.- RESULTADOS. VI.- DISCUSION.