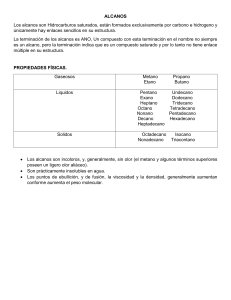
a. ALCANOS: Los alcanos son compuestos formados exclusivamente por carbono e hidrógeno (hidrocarburos), que solo contienen enlaces simples carbono-carbono. b. CLASIFICACIÓN DE LOS ALCANOS: lineales, ramificados, cíclicos y policíclicos. c. CARACTERÍSTICAS DE LOS ALCANOS: 1. HIDROCARBUROS SATURADOS Las uniones entre los átomos de carbono son simples y estables. Se dice que son saturados porque en los alcanos, las uniones entre los átomos de carbono son simples y estables. Esto los diferencia de los alquenos y los alquinos, que se caracterizan por tener uniones dobles y triples, respectivamente, entre sus átomos de carbono. 2. PUEDEN PRESENTAR SUSTITUYENTES: Los átomos de hidrógeno que acompañan a cada átomo de carbono pueden sustituirse por otros átomos, como halógenos (flúor, bromo, cloro) o diversos grupos o “radicales”, son muy frecuentes los grupos hidroxilo y metilo. En este último caso, la estructura se va complejizando dando lugar a alcanos ramificados. 3. PUEDEN FORMAR ESTRUCTURAS CERRADAS: Los átomos de carbono se van uniendo entre sí dando lugar a la formación de cadenas, pero los extremos de dichas cadenas pueden combinarse y formar entonces los denominados alcanos cíclicos, como en el caso del ciclohexano. 4. PROPIEDADES FÍSICAS Los alcanos que tienen entre 5 y 17 átomos de carbono son líquidos. Las propiedades físicas de los alcanos están en gran medida determinadas por el número de átomos de carbono. Así por ejemplo, los alcanos que tienen entre 1 y 4 átomos de carbono son gases a temperatura ambiente; aquellos que tienen entre 5 y 17 átomos de carbono son líquidos a esa misma temperatura, y los que tienen 18 carbonos o más son sólidos a temperatura ambiente. 5. ESCASA SOLUBILIDAD: En general, los alcanos son poco solubles en agua y a medida que aumenta el peso molecular la solubilidad se torna incluso menor. Por esta razón, el más soluble en agua es el metano (que tiene un solo átomo de carbono): 0,00002 g/ml (a 25 °C). En solventes orgánicos, sin embargo, la solubilidad es alta. 6. BAJA DENSIDAD: Su densidad es menor que la del agua, por eso tienden a flotar; esto se ve muy bien cuando se producen derrames de hidrocarburos en el mar. 7. PUNTO DE FUSIÓN VARIABLE: El punto de fusión depende del número de átomos de carbono (a mayor número, más elevado es el punto de fusión), pero también de la estructura: aquellas que son simétricas tienen un punto de fusión más alto que las asimétricas. 8. PUEDEN SUFRIR DIVERSAS REACCIONES QUÍMICAS: Las más comunes son: Oxidación. Al combinarse con el oxígeno pueden formar dióxido de carbono y agua y liberar energía bajo la forma de calor. Esta es la típica reacción de combustión. Halogenación. Tanto el cloro como el bromo, el flúor y el yodo pueden sustituir a átomos de hidrógeno del alcano. El bien conocido cloroformo es un hidrocarburo halogenado (el triclorometano). Nitración. A altas temperaturas y en presencia de vapores de ácido nítrico, se puede producir la sustitución de un hidrógeno por el grupo -NO2, generándose un nitroalcano. Isomerización. Es la reestructuración de la molécula sin pérdida ni ganancia de átomos. Pirólisis. Es la descomposición por exposición a muy elevada temperatura. 9. SU MANIPULACIÓN PUEDE SER PELIGROSA: Los alcanos pueden ser inflamables, explosivos o tóxicos. Es importante saber que algunos alcanos pueden ser inflamables, explosivos o tóxicos, de modo que se deben manejar con extrema precaución siempre, a fin de evitar accidentes. d. MASA ATOMICA DEL CARBONO: Es un elemento químico con símbolo C, número atómico 6 y masa atómica 12,01. Es un no metal y tetravalente disponiendo de cuatro electrones para formar enlaces químicos covalentes. Es la masa de un átomo, más frecuentemente expresada en unidades de masa atómica unificada. La masa atómica algunas veces es usada incorrectamente como un sinónimo de masa atómica relativa, masa atómica media y peso atómico; estos últimos difieren sutilmente de la masa atómica. La masa atómica está definida como la masa de un átomo, que sólo puede ser de un isótopo a la vez, y no es un promedio ponderado en las abundancias de los isótopos. e. MASA ATÓMICA DE HIDROGENO: Primer elemento de la tabla periódica. En condiciones normales es un gas incoloro, inodoro e insípido, compuesto de moléculas diatómicas, H2. El átomo de hidrógeno, símbolo H, consta de un núcleo de unidad de carga positiva y un solo electrón. Tiene número atómico 1 y peso atómico de 1.00797. Es uno de los constituyentes principales del agua y de toda la materia orgánica.