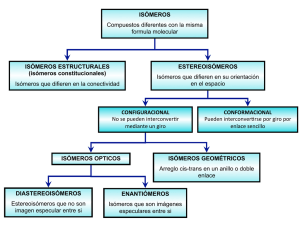
MOLÉCULAS ORGÁNICAS Funciones y formas CONCEPTOS BÁSICOS La materia viva se compone principalmente de elementos livianos. Los elementos más livianos forman enlaces más fuertes. Las biomoléculas más comunes son COMPUESTOS DE CARBONO. Los esqueletos carbonados con grupos funcionales son COMPUESTOS ORGÁNICOS Los grupos funcionales determinan las PROPIEDADES QUÍMICAS de un compuesto. PROPIEDADES SINGULARES DEL CARBONO Predominio de compuestos del C es resultado de su versatilidad química, comparada con otros elementos: • forma 4 enlaces covalentes muy estables • forma enlaces dobles y triples • forma cadenas de enlaces C-C de extensión ilimitada Se conocen más de 7 millones de compuestos químicos, de los cuales el 90% son compuestos de C! Solo B, C, N, Si y P pueden formar más de 3 enlaces covalentes Por qué no hay abundancia de compuestos de B, N, Si y P??? ESTRUCTURA TRIDIMENSIONAL DEL CARBONO Hibridación del carbono ¿CH2 ? ! CH4 ¡ Átomo Z 1s 2s 2p 3s 3p H 1 1 C 6 2 2 2 N 7 2 2 3 O 8 2 2 4 P 15 2 2 6 2 3 S 16 2 2 6 2 4 4 sp3 3 sp2 2 sp FUNCIONES ORGÁNICAS SIN CARBONILO R–H R–R R – OH R–O–R R – NH2 R – SH R – SR CON CARBONILO R – CO - H R – CO - R R – CO – OH R – CO – OR R – CO – NH2 R – CO – SH R – CO – SR ESTEREOISOMERÍA La forma de las moléculas ISÓMEROS CONSTITUCIONALES Diferente conectividad CONFIGURACIONALES Interconversión: ruptura de enlaces ESTEREOISÓMEROS Diferente disposición de átomos CONFORMACIONALES: Interconversión: rotación en enlaces s ÓPTICOS Relación tridimensional de sustituyentes en torno a un átomo GEOMÉTRICOS Rotación restringida sobre enlace múltiple ISÓMEROS CONFORMACIONALES CONFORMACIONES DEL ETANO CAMBIOS DE ENERGÍA PRODUCTO DE LA ROTACIÓN EN TORNO AL ENLACE C-C EN EL ETANO ISÓMEROS CONFIGURACIONALES Primer caso: GEOMÉTRICOS ISÓMEROS GEOMÉTRICOS 11-CIS RETINAL RETINAL TODO TRANS ISÓMEROS CONFIGURACIONALES Segundo caso: ÓPTICOS MOLÉCULA QUIRAL ISÓMEROS CONFIGURACIONALES Segundo caso: ÓPTICOS MOLÉCULA AQUIRAL ISÓMEROS CONFIGURACIONALES Segundo caso: ÓPTICOS FORMA DE OBTENER LA CONFIGURACIÓN R o S DE UN CENTRO QUIRAL ÁCIDO TARTÁRICO DEXTRO Y LEVOROTATORIO INTERPRETACIÓN Y MECANISMO DE LAS REACCIONES ORGÁNICAS Se dará respuesta a las siguientes preguntas: • Por qué ciertas reacciones se llevan a cabo y otras no? • Qué factores controlan la velocidad de las reacciones? • Cuál es la relación entre la estructura de una molécula y su actividad? TERMODINÁMICA: Cambio de contenido de Energía de los reactivos respecto de los productos. CINÉTICA: Camino que siguen las moléculas para transformarse de reactivos en productos y la velocidad a la que ésto ocurre. PERFIL DE REACCIÓN O DIAGRAMA DE ENERGíA Gráfica del cambio de energía potencial que se produce a medida que la reacción avanza. ENERGÍA LIBRE Medida de la energía potencial de una molécula o grupo de moléculas. DG0 = DH0 - TDS0 TERMODINÁMICA Energías relativas de reactivos y productos. Para que una reacción sea práctica, la termodinámica debe favorecer el producto deseado y la velocidad de reacción debe ser suficiente para que ocurra en un tiempo razonable y para que la reacción predomine sobre las otras reacciones en competencia. REACCIONES ENDO Y EXOTÉRMICAS Una reacción es endotérmica cuando la entalpía de los productos es mayor que la de los reactivos. Una reacción es exotérmica cuando la entalpía de los productos es menor que la de los reactivos. Una reacción termoneutra tiene igual entalpía para reactivos y productos. CINÉTICA La velocidad de reacción depende de la temperatura y de la concentración de las especies en reacción. Una reacción se puede verificar en una etapa (concertada) o en varias etapas que involucran la participación de uno o varios intermediarios. ESTADO DE TRANSICIÓN Es la especie de mayor energía a lo largo de toda la coordenada de reacción. Es inestable y su existencia es transitoria. La energía que se requiere para alcanzar el estado de transición es la ENERGÍA DE ACTIVACIÓN. Cómo es la energía de activación de la reacción directa e inversa en una reacción endotérmica? En una exotérmica? En una termoneutra? MECANISMOS DE REACCIÓN Descripción detallada de cómo ocurre una reacción. Para que una reacción tenga lugar se requieren condiciones de energía, orientación, concentración, forma de las moléculas. TIPOS DE REACCIONES MÁS COMUNES: Sustitución: Intercambio de átomos o grupo Eliminación: Pérdida de dos o más átomos Adición: Proceso contrario al anterior y supone magnificación molecular Transposición: Procesos en los que se producen cambios de posición de átomos o grupos en una molécula. Redox: Implica cambios en los numeros de oxidación. INTERMEDIARIOS REACTIVOS MECANISMOS DE REACCIÓN Sustitución nucleofílica bimolecular SN2 Sustitución nucleofílica unimolecular SN1 Eliminación unimolecular E1 Eliminación bimolecular E2 NUCLEÓFILO: Reactivo básico, rico en electrones REACCIÓN UNIMOLECULAR: En el estado de transición está involucrado una sola especie (una sola clase de molécula) REACCIÓN BIMOLECULAR: En el estado de transición están involucradas dos especies (dos clases de moléculas) Energía libre Energía libre Coordenada de reacción Coordenada de reacción GRUPO SALIENTE GRUPO SALIENTE NUCLEÓFILO ALGUNOS GRUPOS FUNCIONALES QUE ACTÚAN COMO GRUPOS SALIENTES EN LAS CÉLULAS