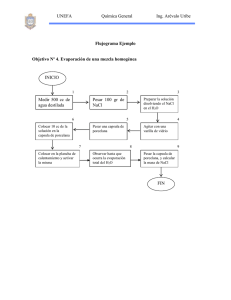
UNIVERSIDAD TÉCNICA DE MACHALA FACULTAD DE CIENCIAS QUÍMICAS Y DE LA SALUD LABORATORIO DE QUÍMICA ANALÍTICA CUANTITATIVA GUÍA DE PRÁCTICA DE ASIGNATURA NÚMERO DE PRÁCTICA: BF.4.02-01 NOMBRE DE LA PRÁCTICA: DETERMINACION DE AGUA EN EL CLORURO DE BARIO DIHIDRATADO (BaCl2.2H2O) 1. DATOS INFORMATIVOS: CARRERA: INGENIERIA QUIMICA ASIGNATURA: QUÍMICA ANALÍTICA II CICLO/NIVEL: CUARTO SEMESTRE 2. FUNDAMENTACIÓN El cloruro de Bario di hidratado pierde humedad si se lo calienta a temperatura mayores de 100 °C. Se la puede someter a temperaturas bastantes más altas porque el BaCl2 anhidro no es volátil y es estable. Para ciertas sales no debe pasarse de temperaturas determinadas 101°C, para evitar que se descompongan el producto de la deshidratación. Reacción: 𝐵𝑎𝐶𝑙2. 2𝐻2 𝑂 → 𝐵𝑎𝐶𝑙2 + 2𝐻2𝑂 3. RESULTADO DE APRENDIZAJE Identifica y cuantifica los componentes de una muestra inorgánica Maneja correctamente los materiales y equipos de laboratorio. 4. OBJETIVOS ESPECÍFICOS Determinar el porcentaje de agua en una muestra sólida mediante el método gravimétrico para conocer su pureza, y tomando como ejemplo el cloruro de bario di hidratado (BaCl2.2H2O) Adquirir habilidades y destrezas en el desarrollo del análisis, para el mejor manejo de materiales y equipos del laboratorio. 5. EQUIPOS, MATERIALES E INSUMOS Materiales e insumos Equipos Reactivos Pinzas metálicas Franela Capsulas de porcelanas Desecado r Estufa Balanza analítica Cl2Ba.2H2O H2O potable H2O destilada 6. PROCEDIMIENTO N° Actividad Observación Colocar en un tubo de ensayo 1 Verificar la muestra a tratar 2 Determinar el peso de capsula vacía (debe estar tarada a 800 °C) 3 4 5 6 7 Llevar a peso constante Pesar exactamente por borda alrededor de 1 – 1.5 Se peso 1.4873 gramos gramos de muestra. Llevar la muestra a 130°C durante 4 horas en la Únicamente se colocó la muestra por 2 horas estufa Enfriar la muestra en el desecador se la coloca a secar por 10 minutos Pesar la capsula con muestra desecada No se debe tocar la capsula con la mano antes de pesar Obtener peso práctico para realizar los cálculos. Se lo obtiene restando el peso de la capsula. 7. RESULTADOS ESPERADOS Datos obtenidos en la pesada por borda de la muestra antes de secarla. + 43,4776 41,9903 1,4873 g de Cl2Ba.2H2O Peso de la capsula tarada más la muestra pesada en la balanza analítica + 42,5090 1,48730 43, 99630 g Peso de la muestra seca después de exponerla por 2 horas a 130°C − 43, 99630 43,79914 0, 1972 g de H2O evaporada 1,4873g de Cl2Ba.2H2O − 0, 19716 g de H2O evaporada= 1, 2901g de Cl2Ba Cálculos estequiometricos aplicados para encontrar el porcentaje de humedad en la muestra. 1,4873 g de Cl2Ba.2H2O 0,1972 g de H2O 𝐗 = 𝟏𝟑, 𝟐𝟔% de H2O están al 100% X Porcentaje máximo de humedad que tiene la muestra antes de ser secada. Peso Molecular de la muestra (Cl2Ba. 2H2O) Cl= 35,45 × 2 = 70,90 Ba= 137,32 = 137,32 + H= 1 × 4 = 4,0 O= 16 × 2 = 32,0 244,22 g Peso molecular del agua extraída de la muestra H= 1 × 4 = O= 16 × 2 = 4,0 + 32,0 36,0 g 244,22 g de Cl2Ba.2H2O 36 g de H2O X = 14,72% están al 100% X Análisis Se obtuvo un buen secado ya que se logró extraer casi toda el agua. Agua extraída 13,26% Agua máxima que se puede extraer 14,72% 8. BIBLIOGRAFÍA Zummer, Roberto (1978). Primeros pasos en química analítica cuantitativa. Argentina: Eudeba. (BCQS00493) Gary Christian. Química Analítica. Mcgraw-hill/Interamericana Editores. Sexta edición. México. 2009 ANEXOS