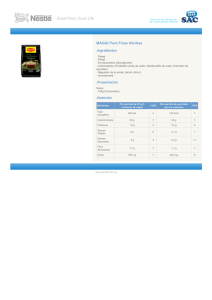
EL SODIO El sodio es un elemento químico de aspecto blanco plateado con número atómico 11. Su símbolo es Na y pertenece al grupo de los metales alcalinos y su estado habitual en la naturaleza es sólido. El sodio está situado en la posición 11 de la tabla periódica. En esta clase descubriremos las propiedades químicas del sodio e información sobre el sodio y otros elementos de la tabla periódica como litio, potasio, magnesio o hidrógeno. 1. Propiedades del sodio El sodio pertenece al grupo de los metales alcalinos. Este grupo de elementos se caracterizan por tener un solo electrón en su nivel energético más externo y tienen tendencia a perderlo formando así un ion monopositivo. Esta tendencia que tienen los metales alcalinos como el sodio es debida a su baja energía de ionización y su poca afinidad electrónica. El estado del sodio en su forma natural es sólido (no magnético). El sodio es un elemento químico de aspecto blanco plateado y pertenece al grupo de los metales alcalinos. El número atómico del sodio es 11. El símbolo químico del sodio es Na. El punto de fusión del sodio es de 370,87 grados Kelvin o de 98,72 grados celsius o grados centígrados. El punto de ebullición del sodio es de 1156 grados Kelvin o de 883,85 grados celsius o grados centígrados. El sodio es un mineral que nuestro organismo necesita para su correcto funcionamiento y se puede encontrar en los alimentos. 2. Usos del sodio El sodio es un elemento esencial para la vida. Está presente en grandes cantidades en los océanos y los ríos. Si alguna vez te has preguntado para qué sirve el sodio, a continuación tienes una lista de sus posibles usos: El sodio se utiliza para descalcificación de metales. Esto da el metal una superficie lisa. El metal de sodio se utiliza también para refinar metales, tales como zirconio y potasio, a partir de sus compuestos. El sodio fundido (líquido) se utiliza como refrigerante en muchos reactores nucleares. Se puede utilizar individualmente o puede combinarse con potasio. El sodio se añade a los ácidos grasos para hacer sales de sodio. Estas sales son mucho más duras (con puntos de fusión más altos) que los jabones de potasio. La prueba de fusión de sodio se utiliza la alta reactividad, alta solubilidad y bajo punto de fusión para determinar la presencia de halógenos, nitrógeno y azufre en una muestra. El sodio se puede utilizar como un agente reductor para transformar algunas moléculas orgánicas en nuevas formas. Las lámparas de vapor de sodio (de uso frecuente en las luces de la calle) son una forma muy eficiente de producir luz de la electricidad. Estas lámparas emiten una luz característica de color amarillo-naranja. El cloruro de sodio es un material que tiene una alta transferencia de calor. El sodio puede ser utilizado solo o con potasio para crear disolventes secos (denominados desecantes). 3. Propiedades atómicas del sodio La masa atómica de un elemento está determinado por la masa total de neutrones y protones que se puede encontrar en un solo átomo perteneciente a este elemento. En cuanto a la posición donde encontrar el sodio dentro de la tabla periódica de los elementos, el sodio se encuentra en el grupo 1 y periodo 3. El sodio tiene una masa atómica de 22,98976928(2) u u. La configuración electrónica del sodio es [Ne]3s1. La configuración electrónica de los elementos, determina la forma el cual los electrones están estructurados en los átomos de un elemento. El radio medio del sodio es de 180 pm, su radio atómico o radio de Bohr es de 190 pm, su radio covalente es de 154 pm y su radio de Van der Waals es de 227 pm. El sodio tiene un total de 11 electrones cuya distribución es la siguiente: En la primera capa tiene 2 electrones, en la segunda tiene 8 electrones y en su tercera capa tiene 1 electrón. 4. EL SODIO EN LA AGRICULTURA El sodio es un elemento presente siempre para las plantas, simplemente porque cualquier agua tiene pequeñas cantidades de sodio. El sodio no es uno de los nutrientes esenciales para las plantas, pero se usa en pequeñas cantidades, al igual que los micronutrientes, como auxiliar para el metabolismo y la síntesis de clorofila. En dosis alta, el sodio en las plantas presenta toxicidad. De forma similar a lo que ocurre con los micronutrientes, el sodio en niveles alto se ve en forma de necrosis o quemaduras en puntas y orillas de las plantas. Otro problema de las dosis demasiado altas del sodio es que el sodio compite con el potasio, el calcio, el magnesio y el amonio. Si los niveles de sodio son demasiado elevados y las dosis de los demás elementos son bajos o normales, la planta no podrá diferenciar a unos de otros, absorberá lo que se encuentre en el sustrato. Por eso, la planta podría no recibir niveles suficientes de algún nutriente esencial, lo cual sería causa de deficiencia (en el tejido). Por ello en cuanto a compuestos para agricultura se refiere se utilizan normalmente compuestos de potasio, no de sodio. El potasio y sodio tienen la misma valencia química con lo que pueden combinarse con los mismos elementos. En el caso del potasio, es un nutriente esencial para las plantas y su exceso no provoca toxicidad. 5. ¿CUÁLES SON LOS EFECTOS EN LA SALUD DEL SODIO EN EL AGUA? El sodio está presente en el cuerpo humano en cantidades en torno a los 100 g. Es un mineral de alimentación parcialmente responsable de funciones del sistema nervioso. El suero sanguíneo contiene 3.3 g/L de sodio. Regula fluidos extracelulares, regula el equilibrio ácido-base y el potencial de membranas, parcialmente junto con el potasio. Un consumo excesivo de sodio de sal de cocina, causa aumento de la presión sanguínea, arteriosclerosis, edemas e hiperosmolaridad. La falta de sodio puede causar convulsiones, deshidratación, parálisis muscular, disminución del crecimiento y entumecimiento general. Generalmente, los seres humanos requieren alrededor de 300 mg de cloruro de sodio al día para garantizar un nivel de sodio adecuado. La gente que padece de diarrea u otras molestias que implican un aumento de las necesidades de sal, requieren una dieta rica en sodio, con cantidades superiores a las habituales. El consumo de sal de cocina en los adultos es de 9 g al día de media, esto se traduce en aproximadamente 4 g de sodio. Para las personas con enfermedades del corazón, se recomienda una dieta pobre en sodio. La solución de sal de cocina se aplicó como provocante de vómitos en épocas anteriores. La sosa cáustica puede afectar profundamente a los tejidos. INVESTIGAR: Acudir a una tienda o supermercado hacer una lista y fotografiar productos con este símbolo. Presenta tus hallazgos en la siguiente clase usando diapositivas.