Gestión de Riesgos en Productos Sanitarios: Análisis y Aplicación
Anuncio

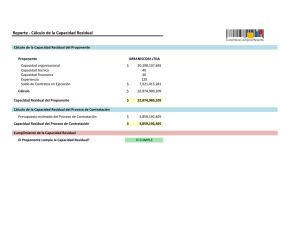
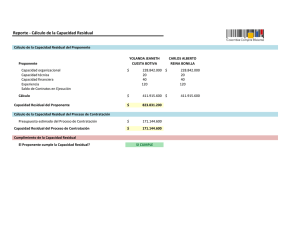
APLICACIÓN DE LA GESTIÓN DE RIESGOS A LOS PRODUCTOS SANITARIOS María Aláez DIRECTORA TÉCNICA ¿QUÉ ES EL ANÁLISIS DE RIESGOS? Es un ejercicio metodológico que consiste en prever todos los posibles riesgos que puedan surgir durante las fases de diseño, fabricación, transporte almacenamiento y utilización del producto para proporcionar soluciones que permitan garantizar el mayor nivel de seguridad posible. REQUERIMIENTO DE LAS DIRECTIVAS Exigencia de la gestión de riesgos: Anexos correspondientes requisitos esenciales a los Procedimientos de evaluación de la conformidad APLICACIÓN NORMATIVA UNE EN ISO 14971:2007 Productos Sanitarios. Aplicación de la gestión de riesgos a los productos sanitarios Esta norma se puede utilizar para apoyar algunas partes de los procedimientos de evaluación de la conformidad descritos en los anexos de las directivas europeas de productos sanitarios: una descripción adecuada de: resultados de análisis de riesgos. un compromiso del fabricante para establecer y mantener hasta la fecha un procedimiento sistemático para revisar la experiencia conseguida desde los productos en fase posproducción e implementar los medios apropiados para aplicar cualquier acción preventiva necesaria. DEFINICIONES Daño: lesión o daño físico a la salud de las personas o daños a la propiedad o al ambiente. Peligro: Fuente potencial de daño. Fallo: El producto no cumple la prestación que de él se espera. Riesgo: Combinación de la probabilidad de ocurrencia de un daño y del grado de severidad de tal daño. Riesgo residual: Riesgo que permanece después de haber tomado medidas protectoras. DEFINICIONES Detección: Probabilidad de identificar un modo de fallo una vez que ha ocurrido. Ocurrencia: Probabilidad de que el efecto de un fallo suceda. Severidad: Valoración de las consecuencias posibles de un modo potencial de fallo. PRINCIPIOS DE SEGURIDAD ¾ Eliminar o reducir los riesgos tanto como sea posible (de forma inherente el diseño y la construcción seguros) ¾ Cuando sea apropiado, tomar los medios de protección adecuados incluyendo las alarmas si fuera necesario, en relación a los riesgos que no se pueden eliminar. ¾Informar a los usuarios de los riesgos residuales debido a cualquier defecto de las medidas de protección adoptadas. REQUISITOS GENERALES PARA LA GESTIÓN DE LOS RIESGOS INTEGRAR LA GESTIÓN DE RIESGOS EN EL SISTEMA DE CALIDAD UNE EN ISO 13485:2004. Productos sanitarios Sistemas de gestión de la calidad. Requisitos para fines reglamentarios Implementación de procesos de análisis, evaluación, control de riesgos e información posterior a la producción. Asignación de responsabilidades Dotación de recursos Inclusión en la política de calidad Revisión por la Dirección Mantenimiento de registros PROCESO DE GESTIÓN DE LOS RIESGOS Proceso de gestión de los riesgos general: Análisis del riesgo Evaluación del riesgo Control del riesgo Evaluación del riesgo residual global Informe de la gestión de riesgos Información de producción y posproducción RESPONSABILIDADES DE LA DIRECCIÓN Compromiso con el proceso de gestión de los riesgos: Asegurar la provisión de los recursos adecuados Asegurar la asignación de personal cualificado Definir y documentar la política para determinar los criterios para la aceptabilidad del riesgo. Revisar la idoneidad del proceso de gestión de los riesgos. CUALIFICACIÓN DEL PERSONAL Conocimiento y experiencia del producto sanitarios particular y su utilización Conocimiento implicadas de las tecnologías Conocimiento de las técnicas de gestión de los riesgos PLAN DE GESTIÓN DE LOS RIESGOS Establecer y documentar un plan de gestión de los riesgos de conformidad con el proceso de gestión de los riesgos: Campo de aplicación de las actividades de gestión de los riesgos: descripción del producto y fases del ciclo de vida afectadas por el plan Asignación de responsabilidades Revisión de las actividades de gestión de los riesgos Criterios de aceptabilidad del riesgo Verificación Recogida y revisión posproducción de la información de producción y ARCHIVO DE GESTIÓN DE LOS RIESGOS Proporciona la trazabilidad para cada peligro identificado respecto a: Análisis del riesgo Evaluación del riesgo Implementación y verificación de las medidas de control del riesgo Apreciación de la aceptabilidad de cualquier riesgo residual ANÁLISIS DEL RIESGO PROCESO DEL ANÁLISIS DEL RIESGO Descripción e identificación del producto sanitario Identificación de las personas de la organización implicadas en el análisis del riesgo Objeto y campo de aplicación y fecha del análisis del riesgo UTILIZACIÓN PREVISTA Y CARACTERÍSTICAS RELATIVAS A LA SEGURIDAD Utilización prevista Mala utilización razonablemente previsible Características cualitativas y cuantitativas Tipos de usuarios Situaciones de utilización IDENTIFICACIÓN DE LOS PELIGROS Documentación sobre los peligros conocidos y previsibles asociados con el producto sanitario: En condiciones normales En condiciones de fallo ESTIMACIÓN DE LOS RIESGOS Para cada mediante: situación peligrosa estimar los riesgos asociados Normas publicadas Datos técnicos científicos Datos de campo de productos sanitarios similares ya en uso Ensayo de facilidad de uso Evidencia clínica Resultados de investigaciones apropiadas Opinión de expertos Instituciones de evaluación de la calidad externas EVALUACIÓN DEL RIESGO Valoración de los riesgos Decisiones de aceptabilidad de los riesgos CONTROL DEL RIESGO Reducción del riesgo Análisis de la opción de control de riesgo Implementación de las medidas de control de riesgo Evaluación del riesgo residual Análisis del riesgo beneficio Riesgos que resultan de las medidas de control de riesgo Exhaustividad del control del riesgo EVALUACIÓN DE LA ACEPTABILIDAD DEL RIESGO RESIDUAL GLOBAL Decidir si el riesgo residual global es aceptable Si es inaceptable revisar si los beneficios médicos de la utilización prevista compensan el riesgo residual global Si se compensan: riesgo residual global aceptable Si no se compensan: riesgo residual global inaceptable Decidir información a incluir en los documentos que acompañan al producto para revelar el riesgo residual global. Resultados de la evaluación del riesgo residual global se registran en el archivo de gestión de los riesgos INFORME DE GESTIÓN DE LOS RIESGOS Revisión del proceso de gestión de los riesgos para asegurar: Plan de gestión de los riesgos implementado de forma apropiada Riesgo residual global aceptable Métodos apropiado para obtener la información de producción y posproducción. Registrar los resultados de esta revisión como informe de gestión de los riesgos en el registro de gestión de los riesgos. INFORMACIÓN DE PRODUCCIÓN Y POSPRODUCCIÓN Sistema para recoger y revisar la información sobre el producto sanitario en las fases de producción y posproducción considerando: Mecanismos por los que se recoge y procesa la información generada por el operador, el usuario o responsables de la instalación, utilización y mantenimiento. Normas nuevas revisadas Recoger y revisar información de productos similares en el mercado INFORMACIÓN DE PRODUCCIÓN Y POSPRODUCCIÓN Evaluar especialmente: Si existen peligros no reconocidos previamente Si el riesgo estimado derivado de una situación peligrosa ya no es aceptable Si ocurre alguna de estas condiciones: evaluar su impacto en la gestión de riesgos y reintroducirlo como una entrada en el proceso revisión del archivo de gestión de riesgos evaluando el impacto de estos riesgos sobre las medidas de control del riesgo implementadas AUDITORIA DE PRODUCTO • Para poder mantener al día el archivo de gestión de riesgos un método habitual es la realización de “auditorias” o “revisiones” de producto. • Contenido Auditoria de producto: – No conformidades acaecidas relativas al producto – Reclamaciones / quejas acaecidas relativas al producto – Prestaciones / ensayos funcionales ( rutina en lotes) – Servicio posventa / reparaciones en garantía – Actualización evidencias clínicas (PMS / PMCFU) – Vigilance System: Incidentes en el mercado productos propios y/o similares – Cambios: componentes / proveedores / manuales – Nueva normativa ¡MUCHAS GRACIAS!