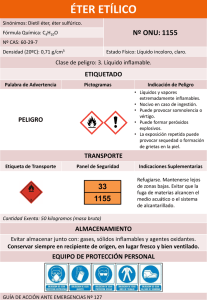
INFORME DE LABORATORIO HIDROCARBUROS ALIFATICOS ALCOHOLES Y DERIVADOS FC UNVERSIDAD NACIONAL DE INGENIERÍA FACULTAD DE CIENCIAS ELEMENTOS QUÍMICOS, PROPIEDADES Y APLICACIONES INFORME DE LABORATORIO N° 01 EXTRACCIÓN DE LA TRIMIRISTINA DE LA NUEZ MOSCADA ALUMNO: - Zeus Braulio Chavez Chavez Revata Adrianzen, Christopher ESPECIALIDAD: - Química PROFESOR DEL ÁREA: Acha de la Cruz, Otilia FECHA DE ENTREGA: - 12/04/19 Código: 20182181K Código: 20180621C INFORME DE LABORATORIO HIDROCARBUROS ALIFATICOS ALCOHOLES Y DERIVADOS FC INTRODUCCION La nuez moscada (Myristica) es un género de árboles perennifolios de la familia de las Myristicaceae procedente de las Islas de las Especias (en la actualidad las Islas Molucas en Indonesia). Estos árboles son la fuente de dos especias derivadas del fruto: la nuez moscada y la macis (Mehelenbacher, 1977). El aceite esencial se obtiene de la destilación de la nuez molida y es ampliamente utilizado en la industria farmacéutica y perfumería. El aceite es incoloro o ligeramente amarillento, sabe y huele a nuez. Contiene numerosos componentes de interés para la industria oleo química y se utiliza como saborizante alimentario en productos horneados, jarabes, bebidas, dulces, etc. (Domínguez, 1973). Su mantequilla es semisólida y de color marrón rojizo, con sabor y olor a nuez moscada. Aproximadamente el 75 % (por peso) de ella es trimiristina, que puede convertirse en ácido mirístico, un ácido graso de 14 carbonos que se puede utilizar como sustituto de la manteca de cacao, se puede mezclar con otras grasas como el aceite de semilla de algodón o el aceite de palma y tiene aplicaciones como lubricante industrial (Mehelenbacher,1977). INFORME DE LABORATORIO HIDROCARBUROS ALIFATICOS ALCOHOLES Y DERIVADOS FC Índice 1. Resumen .................................................................................................................................... 3 2. Objetivo General ....................................................................................................................... 4 3. Objetivos Específicos..................................................... Ошибка! Закладка не определена. 4. Marco teórico o Fundamento Teórico ................................................................................... 4 5. Material y Reactivos ................................................................................................................. 5 5. PROCEDIMIENTO EXPERIMENTAL ................................................................................... 8 6. Datos y observaciones ............................................................................................................ 9 7. Cálculos y resultados ............................................................................................................. 10 8. Conclusiones ........................................................................................................................... 11 9. Bibliografía ............................................................................................................................... 11 10. Cuestionario ........................................................................................................................ 12 1. Resumen El presente trabajo de laboratorio consistió en determinar la cantidad de trimiristina extraída de la nuez moscada. Para ello, se hizo uso de tres métodos INFORME DE LABORATORIO HIDROCARBUROS ALIFATICOS ALCOHOLES Y DERIVADOS FC 2. Objetivos Comprender y realizar el proceso de purificación de un sólido (la trimiristina) por medio de la recristalización de esta. Entender el proceso de saponificación (esterificación) de la trimiristina, como también la síntesis del ácido mirístico por hidrólisis. Implementar un equipo de reflujo y entender su funcionamiento. 3. Marco teórico o Fundamento Teórico TRIMIRISTINA Recibió su nombre por la nuez moscada (Myristica fragans) cuya manteca tiene 75 % de este triglicérido compuesto por tres moléculas de ´acido mirístico. Este ´acido también se encuentra en el aceite de palma, manteca y espermaceti, la fracción cristalizada del aceite de grasa de ballena y pescado. Figura 1. Molécula de trimiristina Figura 1. Molécula de trimiristina EXTRACCIÓN Es un procedimiento de separación de una sustancia que puede disolverse en dos partes no miscibles entre sí, con distinto grado de solubilidad y que están en INFORME DE LABORATORIO HIDROCARBUROS ALIFATICOS ALCOHOLES Y DERIVADOS FC contacto a través de una interfase. La disolución es una competencia entre las clases diferentes de interacciones intermoleculares. Figura 2. Extracción de la trimiristina DESTILACIÓN Proceso que consiste en calentar un líquido hasta que sus componentes más volátiles pasan a la fase de vapor y, a continuación, enfriar el vapor para recuperar dichos componentes en forma líquida por medio de la condensación. La destilación simple es aplicable en los sistemas que contengas líquidos orgánicos de puntos de ebullición bastante diferenciados. PRECIPITACIÓN Como resultado de este proceso, se obtiene un sólido en una disolución por efecto de una reacción bioquímica. La precipitación puede ocurrir cuando la sustancia insoluble se forma en la disolución debido a una reacción química en la que alguno de los reactantes está sobresaturado. DESECANTE Sustancia que se utiliza para eliminar la humedad del aire o de alguna otra sustancia, como combustibles orgánicos. 4. Material y Reactivos REACTIVOS PROPIEDADES FÍSICAS PROPIEDADES QUÍMICAS INFORME DE LABORATORIO HIDROCARBUROS ALIFATICOS ALCOHOLES Y DERIVADOS FC - Soluble - Estado de agregación: solido. en compuestos orgánicos: hexano, metano, etc. Trimiristina - Punto de fusión: 54 °C - Grasa neutra. - Es hidrolizable, saponificación con sales alcalinas formando jabones. - Líquido incoloro, volátil, de olor característico. n – Hexano Ciclo hexano - Es inmiscible en agua. - Reacciona con oxidantes - Punto de ebullición: 69 °C. fuertes, originando peligro de - Punto de fusión: –95 °C. incendio - Densidad relativa: 0.66 y explosión. - Liquido incoloro. - Es inmiscible en agua. - Punto de ebullición: 81 °C. - Es altamente inflamable y tiene - Punto de fusión: 7 °C. olor penetrante similar al del petróleo. - Liquido dulce de leve aroma - No dulce. inflamable en condiciones normales. - El Cloruro de metilo es compuesto se descompone al contacto con - Altamente estable. - Completamente miscible con llamas abiertas y superficies una amplia radiantes con la formación de disolventes. gama de gases dañinos. - Punto de fusión: -96 °C. - Punto de ebullición: 40 °C. - A temperatura ambiente, es un Cloroformo líquido volátil, - No es inflamable. no - Se descompone lentamente por inflamable, incoloro, de olor acción combinada del ´oxígeno y la dulzón. luz - Punto de fusión: -63,65 °C. solar, transformándose en fosgeno (COCl2) y cloruro de INFORME DE LABORATORIO HIDROCARBUROS ALIFATICOS ALCOHOLES Y DERIVADOS - Punto de ebullición: -61,05 °C. Éter etílico FC hidrógeno. - Es un ´éter líquido, incoloro. - Es un buen disolvente de - Punto de fusión: -116,3°C. grasas, azufre, fósforo, etc. - Punto de ebullición: 34,6 °C. - Tiene aplicaciones industriales como y en la fabricación de explosivos. - Es una mezcla liquida de - Inflamable. Éter de petróleo diversos compuestos volátiles. - Incompatible con oxidantes fuertes. - Ataca a algunas plásticos, formas caucho recubrimientos. Acetona - Punto de fusión: -94,9 °C. - Soluble en agua. - Punto de ebullición: 56,3 °C. - Puede disolverse en etanol, isopropanol y tolueno. - Liquido Etanol inodoro, incoloro, - Inflamable, miscible en agua. altamente volátil - Carácter básico - Punto de fusión: -114,3 °C. - Punto de ebullición: 78.4 °C. Metanol - Estado de agregación: liquido. - Acidez (pKa = 15,5) - Incoloro, incoloro. - Solubilidad en agua - Densidad: 0,7918 g/cm3. - Momento dipolar: 1,69 D - Punto de fusión: -97,16 °C. - Punto de ebullición: 64,7 °C. Sulfato de sodio anhidro - Estado de agregación: sólido. - Densidad: 2,68 g/cm3 - Punto de fusión: 884 °C. - Estable bajo condiciones normales - Se produce óxidos de azufre. de y INFORME DE LABORATORIO HIDROCARBUROS ALIFATICOS ALCOHOLES Y DERIVADOS FC 5. PROCEDIMIENTO EXPERIMENTAL Extracción solida – liquido - Rayar 7.5 gr de nuez moscada y introducirlas en un frasco Erlenmeyer de 125 ml. - En seguida se vierte 20 ml de n-hexano se tapa el frasco y durante 30 min removemos el contenido de vez en cuando. - Pasado esto, se filtra la solución, recibiendo el filtrado en un frasco Erlenmeyer de 50 ml. - Se lava los residuos de la nuez retenidos en el frasco con 10 ml de n-hexano, se agita el frasco por 5 min y se filtra. - Se le agrega unos miligramos de sulfato de sodio al frasco con el filtrado orgánico, se tapa y se deja en reposo. Destilación simple - En un balón de destilación simple filtrar la solución orgánica, luego proceder a armar el equipo de destilación en baño maría. - Destilar hasta recuperar el n-hexano en unos 5 - 10 𝑚𝐿. Precipitación - Vertimos la solución en un vaso de precipitados de 50 ml y agregamos 20 ml de metanol. - Cubrimos el vaso con una de reloj y se deja en reposo durante 1 h y media aprox. En lo que la trimiristina precipitara. - Luego lo filtramos al vacío todo el producto. INFORME DE LABORATORIO HIDROCARBUROS ALIFATICOS ALCOHOLES Y DERIVADOS - FC Terminado esto se saca el papel filtro y se coloca en una luna de reloj para llevarlo al horno a secar a 45°C durante unos 10 min. - Finalmente se pesa el producto y se halla el rendimiento. Pruebas de solubilidad - En 7 tubos de ensayo agregar un poco de trimiristina y estos solventes en cada uno respectivamente, éter de petróleo, éter etílico, acetona, etanol, metanol y agua. - Asimismo, ensayar la solubilidad entre diferentes solventes: n-hexano / éter de petróleo n-hexano / éter etílico n-hexano / acetona n-hexano / etanol n-hexano / agua metanol/ etanol metanol/ agua. 6. Datos y observaciones Extracción solido-liquido - Al momento de disolver la nuez rayada con el n-hexano, la sustancia presento un color marrón semi-oscuro. Destilación simple - En el balón de destilación, el color de la muestra era de carácter amarillo cuasi transparente. - En el matraz de Erlenmeyer, la sustancia presento un color transparente. Por otro lado, al momento de introducir la cubeta de hielo en el respectivo matraz, esta seguía en condición de alta temperatura por un bien tiempo. - INFORME DE LABORATORIO HIDROCARBUROS ALIFATICOS ALCOHOLES Y DERIVADOS FC 7. Cálculos y resultados Pruebas de solubilidad Trimiristina Tabla 1: Determinación del carácter de solubilidad de la trimiristina en diferentes solventes Solvente Solubilidad trimiristina Agua Insoluble trimiristina Etanol Insoluble trimiristina Metanol Parcialmente soluble trimiristina Acetona Insoluble trimiristina Éter de petróleo Soluble trimiristina Éter etílico soluble Soluto Solvente – solvente Tabla2: Determinación del carácter de solubilidad de cada compuesto para la disolución de la trimiristina Soluto Solvente Solubilidad n-hexano Éter de petróleo ++ n-hexano Éter etílico ++ n-hexano Acetona +++ n-hexano Etanol +++ INFORME DE LABORATORIO HIDROCARBUROS ALIFATICOS ALCOHOLES Y DERIVADOS FC Metanol Etanol ++ Metanol Agua +++ n-hexano Agua + Rendimiento de la trimiristina obtenida Masa de la materia prima = 7.5 gr Masa del producto extraído = 0.24 gr 𝑅𝑛 (𝑅𝑒𝑛𝑑𝑖𝑚𝑖𝑒𝑛𝑡𝑜, 𝑒𝑛 %) = 𝑃𝑒𝑠𝑜 𝑑𝑒𝑙 𝑝𝑟𝑜𝑑𝑢𝑐𝑡𝑜 𝑒𝑥𝑡𝑟𝑎í𝑑𝑜 ∗ 100% 𝑃𝑒𝑠𝑜 𝑡𝑜𝑡𝑎𝑙 𝑑𝑒 𝑚𝑎𝑡𝑒𝑟𝑖𝑎 𝑝𝑟𝑖𝑚𝑎 𝑟𝑒𝑛𝑑𝑖𝑚𝑖𝑒𝑛𝑡𝑜 = 0.24 𝑔𝑟 ∗ 100% 7.5 𝑔𝑟 𝑟𝑒𝑛𝑑𝑖𝑚𝑖𝑒𝑛𝑡𝑜 = 3.2% 8. Conclusiones - Se determinó que el peso del producto extraído (trimiristina) fue de 0,24gr - Se determinó que el rendimiento respecto a la cantidad de trimiristina obtenida de la nuez mosca fue de 3.2% 9. Bibliografía Katz. M. (2016). La química fácil y caritativa en beneficio de las damas. Asociación química argentina. Revisado el 12 de abril de 2019. Recuperado de: file:///C:/Users/Alumno/Downloads/ComentariosobreellibrodeMeurdrac.pdf Accame. M. (2009). Nuez moscada, especia y planta medicina. Revisado el 12 de abril de 2019. Recuperado de: https://botplusweb.portalfarma.com/documentos/2009/11/25/41204.pdf INFORME DE LABORATORIO HIDROCARBUROS ALIFATICOS ALCOHOLES Y DERIVADOS 10. FC Cuestionario 1. ¿Qué tipo de fuerzas intermoleculares existe entre las moléculas de trimiristina que hacen que su punto de fusión sea de 56°C? Se debe a que en la longitud de la cadena de la trimiristina predomina no solo fuerzas de Van Der Waals como en el n-eicosano, sino que la parte oxigenada presenta fuerzas o interacciones puente de hidrógeno. Obviamente están en mayor cantidad las fuerzas de Van Der Waals por su gran estructura. Este tamaño permite la existencia de muchas interacciones de Van Der Waals que implican la cohesión de las moléculas y los altos puntos de fusión y de ebullición. 2. Para la etapa de extracción: Si no se dispusiera en el laboratorio de nhexano ¿Qué solvente utilizaría para sustituirlo: n-heptano, ¿éter de petróleo, etanol o agua? Se utilizaría el éter de petróleo que es una mezcla de n-heptanos, hexanos, heptanos, pero no es un éter como erróneamente señala su nombre. La explicación es que necesitamos una cadena muy grande de hidrocarburos y que su interacción sea de Van Der Waals. 3. Para el proceso de destilación simple: a. ¿Por qué no se usa un baño de aceite en lugar del baño María? El baño de aceite no se utiliza por su alta capacidad calorífica y no es muy controlable, mientras que el baño María es más controlable para una destilación. b. ¿Por qué no se calienta directamente el balón de destilación con la llama del mechero Bunsen? INFORME DE LABORATORIO HIDROCARBUROS ALIFATICOS ALCOHOLES Y DERIVADOS FC Porque la llama no permite un calentamiento uniforme, mientras que el baño María lo hace uniformemente. Además, la temperatura de la llama maneja intervalos de temperaturas mayores. c. ¿Por qué es preferible agregar dentro del balón de destilación pequeños trozos de vidrio, o de porcelana, antes de comenzar el proceso de destilación? Para prevenir proyecciones violentas de líquidos y sobrecalentamiento de las sustancias. En nuestro caso no se usó trozos de vidrio por que no hubo una cantidad significativa de la mezcla para que reaccione violentamente. d. ¿Por qué es necesario recibir el n-hexano que destila en un frasco de Erlenmeyer enfriado exteriormente con hielo? Como destila en caliente, es decir sus condensados son calientes, entonces es preciso que no regrese a la evaporación del n-hexano. 4. De una posible explicación de la acción que cumple el metanol en la precipitación de la trimiristina que se encuentra disuelta en el n-hexano. El metanol dispersa el volumen del n-hexano y hace que el cambio de polaridad precipite la trimiristina. Es decir, hay una competencia entre la repulsión y la atracción: el metanol se interpone entre la interacción de la trimiristina y el n-hexano. 5. Para la etapa de precipitación: Si no dispusiera en el laboratorio de metanol ¿Qué solvente utilizaría para sustituirlo: n-pentano, ¿éter de petróleo, etanol o agua? Necesitaríamos un solvente polar de la naturaleza covalente del metanol (alcohol), como lo es el etanol. INFORME DE LABORATORIO HIDROCARBUROS ALIFATICOS ALCOHOLES Y DERIVADOS FC